4.2元素周期律课件(共46张PPT)2023-2024学年高一上学期化学人教版(2019)必修第一册
文档属性
| 名称 | 4.2元素周期律课件(共46张PPT)2023-2024学年高一上学期化学人教版(2019)必修第一册 |

|
|
| 格式 | pptx | ||
| 文件大小 | 7.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-15 00:00:00 | ||
图片预览







文档简介
(共46张PPT)
第四章 物质结构 元素周期律
第1课时 元素性质的周期性变化规律
人教版化学必修第1册
第二节 元素周期律
学习目标
一、知道同周期元素的核外电子排布、原子半径、化合价等随元素原子序数递增而呈周期性变化的规律。
二、能够以第三周期元素为例,说明同周期元素的金属性、非金属性等随元素原子序数递增而呈周期性变化的规律。
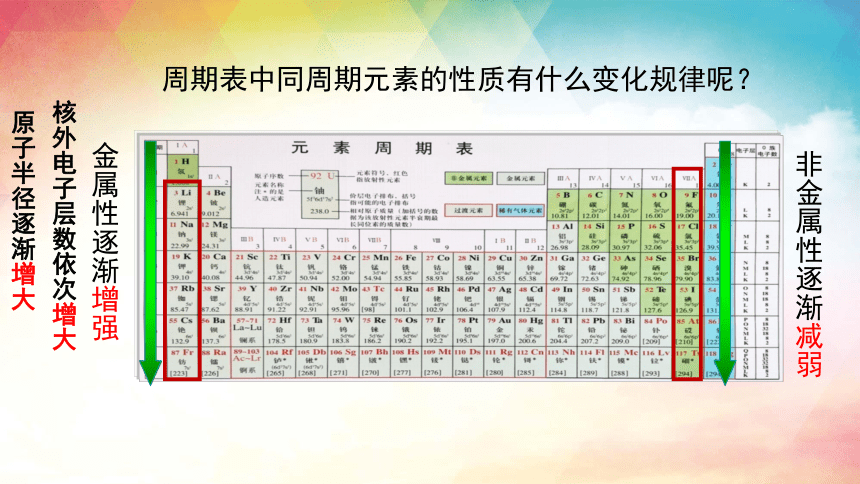
周期表中同周期元素的性质有什么变化规律呢?
非金属性逐渐减弱
金属性逐渐增强
原子半径逐渐增大
核外电子层数依次增大
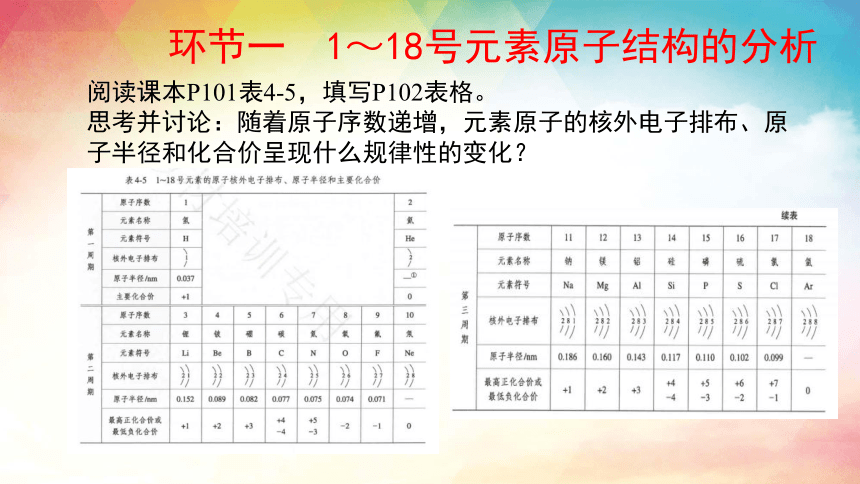
环节一 1~18号元素原子结构的分析
阅读课本P101表4-5,填写P102表格。
思考并讨论:随着原子序数递增,元素原子的核外电子排布、原子半径和化合价呈现什么规律性的变化?
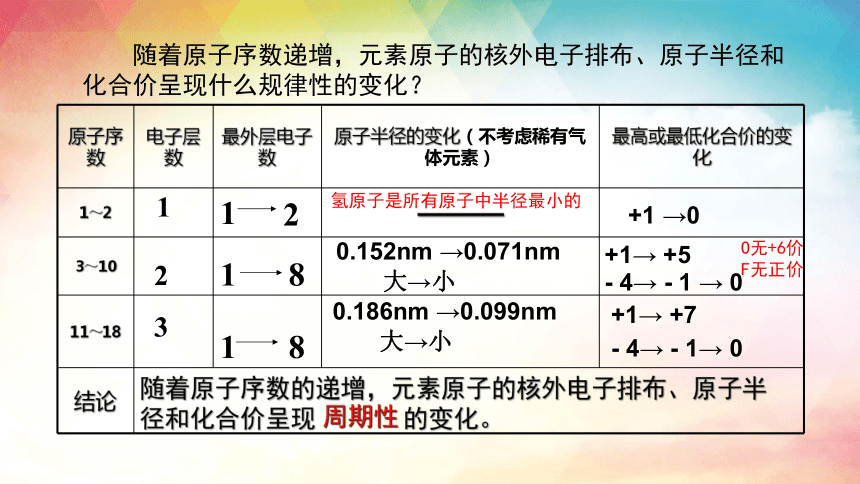
原子序数 电子层数 最外层电子数 原子半径的变化(不考虑稀有气体元素) 最高或最低化合价的变化
1~2 1 ———
3~10
11~18
结论
2
3
1
2
1
8
1
8
0.152nm →0.071nm
大→小
+1→ +5
- 4→ - 1 → 0
+1 →0
+1→ +7
- 4→ - 1→ 0
随着原子序数的递增,元素原子的核外电子排布、原子半径和化合价呈现 的变化。
0.186nm →0.099nm
大→小
随着原子序数递增,元素原子的核外电子排布、原子半径和化合价呈现什么规律性的变化?
O无+6价
F无正价
周期性
氢原子是所有原子中半径最小的
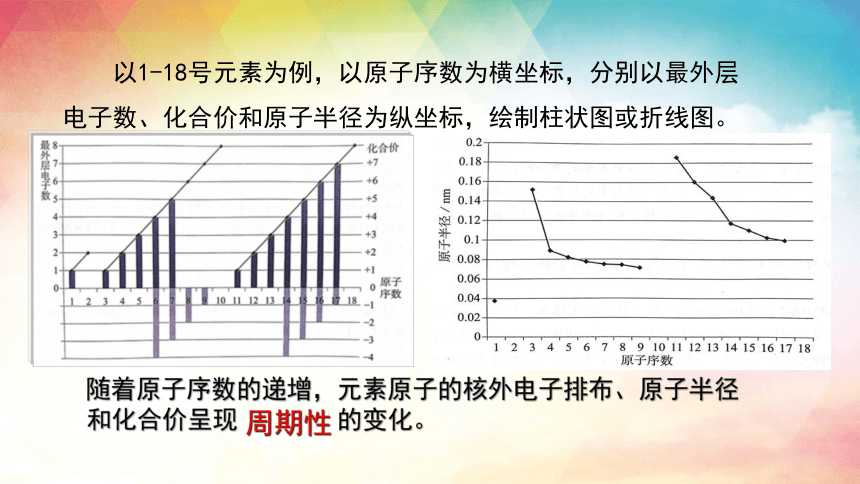
以1-18号元素为例,以原子序数为横坐标,分别以最外层电子数、化合价和原子半径为纵坐标,绘制柱状图或折线图。
随着原子序数的递增,元素原子的核外电子排布、原子半径和化合价呈现 的变化。
周期性
为什么同周期元素的原子半径会随着原子序数的增加而逐渐变小呢?
在电子层数相同的情况下,随着原子序数的增加,原子核对核外电子的电性作用 ,使得最外层电子与原子核之间的距离 ,从而使得原子半径减小。
思考与讨论
增强
缩小
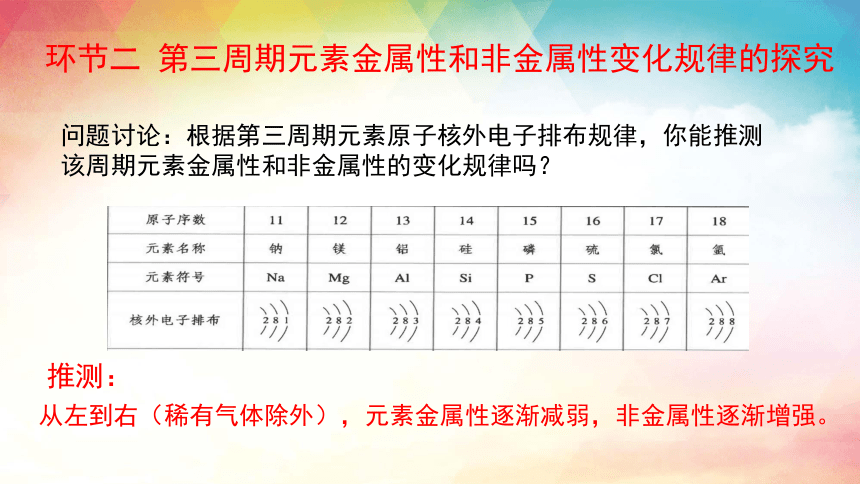
问题讨论:根据第三周期元素原子核外电子排布规律,你能推测该周期元素金属性和非金属性的变化规律吗?
环节二 第三周期元素金属性和非金属性变化规律的探究
推测:
从左到右(稀有气体除外),元素金属性逐渐减弱,非金属性逐渐增强。
实验探究
设计实验方案:探究钠、镁、铝的金属性强弱
单质与水(或酸)反应的难易程度
最高价氧化物对应的水化物——氢氧化物的碱性强弱
【实验比较1】
观察镁与水的反应,分析比较现象,得出结论。
【实验比较1】
观察镁与水的反应,分析比较现象,得出结论。
实验内容 实验现象 反应方程式 实验
结论
Na 与冷水 (酚酞)
Mg 与冷水 (酚酞)
与热水 (酚酞)
常温下钠与水反应剧烈,放出氢气,溶液变红。
2Na+2H2O=2NaOH+H2↑
常温下镁与水的反应较缓慢,镁条表面有微量气泡产生,溶液微微变红。
Mg+2H2O = Mg(OH)2+H2↑
加热后反应剧烈,镁条表面有大量气泡产生,镁条附近溶液变为红色。
Mg+2H2O Mg(OH)2 + H2↑
钠的金属性强于镁
向氯化铝溶液中加入氨水,将生成的沉淀分装在两个试管中,分别加入盐酸和氢氧化钠溶液,观察现象,得出结论。
【实验比较2】
AlCl3溶液
氨水
HCl溶液
NaOH溶液
Al3+ + 3NH3·H2O = Al(OH)3↓+ 3NH4+
白色沉淀溶解
白色沉淀溶解
白色絮状沉淀
Al(OH)3白色沉淀在酸或强碱中都能够溶解
Al(OH)3+ 3H+ = Al3+ + 3H2O
Al(OH)3+ OH- = AlO2-+ 2H2O
两性氢氧化物:既能与酸反应生成盐和水,又能与碱反应生成盐和水的氢氧化物。
向氯化铝溶液中加入氨水,将生成的沉淀分装在两个试管中,分别加入盐酸和氢氧化钠溶液,观察现象,得出结论。
【实验比较2】
【实验比较3】
向氯化镁溶液中加入氨水,将生成的沉淀分装在两个试管中,分别加入盐酸和氢氧化钠溶液,观察现象,得出结论。
【实验比较3】
向氯化镁溶液中加入氨水,将生成的沉淀分装在两个试管中,分别加入盐酸和氢氧化钠溶液,观察现象,得出结论。
MgCl2
溶液
氨水
HCl溶液
NaOH溶液
白色沉淀不溶解
Mg(OH)2白色沉淀只溶解于酸
白色沉淀溶解
Na Mg Al
最高价氧化物对应的水化物碱性强弱
根据实验结论以及课本信息,得出结论。
NaOH
强碱
Mg(OH)2
中强碱
Al(OH)3
两性氢氧化物
金属性:钠>镁>铝
问题讨论
我们可以通过哪些方法验证元素的非金属性强弱?
单质与氢气生成气态氢化物的难易程度以及氢化物的稳定性
最高价氧化物对应的水化物(含氧酸)的酸性强弱
结论:硅、磷、硫、氯所对应的最高价氧化物的水化物的酸性逐渐 ,所以硅、磷、硫、氯的非金属性逐渐 。
增强
增强
分析科学事实:探究Si、P、S、Cl非金属性的强弱。
阅读课本103页提供的最高价氧化物对应的水化物(含氧酸)的
酸性强弱信息表。
通过实验比较和信息获取,你得出的结论是什么?与最初的预测一致吗?
从左到右(稀有气体除外),元素金属性逐渐减弱,非金属性逐渐增强。
环节三 同周期元素金属性和非金属性变化规律分析
元素的金属性和非金属性随着原子序数的递增而呈周期性的变化
同周期主族元素性质变化规律的原因是什么?
原子核外电子层数相同核电荷数逐渐增多
失电子能力逐渐减弱
得电子能力逐渐增强
同一周期 从左到右
原子核对核外电子的电性作用增强
金属性逐渐减弱
非金属性逐渐增强
原子半径逐渐减小
元素周期律
元素的性质随着原子序数的递增而呈现周期性的变化规律。
元素性质的周期性变化是元素原子的核外电子排布周期性变化的必然结果。
元素的性质随着原子序数的递增而呈现周期性的变化规律。
元素周期律——
环节四 课堂小结
随着原子序数的递增:
1.元素原子的核外电子排布、原子半径、化合价呈现周期性变化。
结构决定性质 性质反映结构
2.同周期主族元素,从左到右,原子半径逐渐减小,金属性逐渐减弱,非金属性逐渐增强。
元素性质的周期性变化是元素原子的核外电子排布周期性变化的必然结果。
第四章 物质结构 元素周期律
第2课时 元素周期表和元素周期律的应用
人教版化学必修第1册
第二节 元素周期律
1.会利用元素在元素周期表中的位置和原子结构,分析、预测、比较元素及其对应物质的性质。
3.了解元素周期律(表)在学习元素及其化合物知识和科学研究中的重要作用。
2.可以结合相关资料,来说明元素周期律(表)对合成新物质、寻找新材料的指导作用。
学习目标:
碱金属元素金属性:
卤族元素非金属性:
【温故知新】
Li<Na < K < Rb < Cs
F>Cl > Br > I
第三周期金属元素金属性:
第三周期非金属元素非金属性:
Na > Mg > Al
Si < P < S < Cl
元素周期律
一、金属元素与非金属元素的分区及性质的递变规律
族 周期 ⅠA ⅡA ⅢA ⅣA ⅤA ⅥA ⅦA 0
1 2 3 4 5 6 7
增强
增
强
增
强
增强
Al Si
既表现金属元素的性质,又表现非金属元素的性质。
(一)元素金属性、非金属性的递变(阅读P104)
铝
硅
硼
除去放射性元
素,哪种元素
的金属性最强
?哪种元素的
非金属性最强
?它们分别位
于元素周期表
的什么区域?
想一想
金属性最强的元素:Cs (左下方)
非金属性最强的元素:F(右上方)
1.主族元素的最高正化合价 主族序数 最外层电子(价电子)数
提示:元素原子的最外电子层中的电子也叫价电子,有些元素的化合价
与原子的次外层或倒数第三层的部分电子有关,这部分电子也叫价电子。
(二)元素化合价与元素在元素周期表中的位置关系
IA IIA IIIA IVA VA VIA VIIA 0
1 2 3 4 5 6
1 2 3
4 5 6 7
=
=
7
2.非金属元素:
(二)元素化合价与元素在元素周期表中的位置关系
+ + + +
=
=
=
=
8 8 8 8
最高正化合价+|最低负化合价|=8
2.非金属元素:
注意:氟元素,无正价;氧元素无+6价, 一般显一2价, 在H2O2 、Na2O2等过氧化物中显一1价;氢一般显+1价,但在金属氢化物中显一1价。最高正化合价+|最低负化合价|=2
(二)元素化合价与元素在元素周期表中的位置关系
+ + + +
=
=
=
最高正化合价+|最低负化合价|=8
代数和 0 2 4 6
IVA~VIIA非金属元素:最高正化合价与最低负化合价代数和分别为0、2、4、6
=
【练习1】X元素最高价氧化物对应水化物的化学式为
H2XO4,该元素的气态氢化物的化学式是( )
A.HX B.H2X C.XH3 D.XH4
B
解析:
X的最高正化合价为+6,最低负化合价=最高正化合价-8 = -2
+6
【练习2】某元素X的最高正化合价与最低负化合价的代数和为2,下列说法正确的是( )
A.元素X为第六主族的元素
B.元素X最高价含氧酸的化学式为H2XO4
C.元素X最高价氧化物为XO2
D.元素X的氢化物的化学式为XH3
D
HXO3 /H3XO4
X2O5
VA
代数和 0 2 4 6
二、元素周期表和元素周期律的应用
指导其他与化学相关的科学技术
1.在周期表_____________________,可以找半导体材料,如硅、锗、镓等。
金属与非金属分界处
(一)元素周期表和元素周期律的生产应用(阅读P105)
锗晶体
镓器件
硅芯片
耐高温、耐腐蚀,
发动机火花塞
2.在___________中寻找催化剂和耐高温、耐腐蚀的合金材料。
过渡元素
镍
钴
合
金
铂铑合金
铱合金
钛合金
指导其他与化学相关的科学技术
(一)元素周期表和元素周期律的生产应用(阅读P105)
三氧化二砷
3.在元素周期表的__________,寻找制取农药的元素。
右上方
指导其他与化学相关的科学技术
(一)元素周期表和元素周期律的生产应用(阅读P105)
稀土的英文是Rare Earths,
“稀”原指稀贵,“土”是
指其氧化物难溶于水的“土”
性。根据国际纯粹与应用化
学联合会1UPAC推荐,把57
至71的15种元素称为镧系元
素,用Ln表示,它们再加上
钪、钇称为稀土元素,
用RE表示。
在合金中加入适量稀土金属,能大大改善合金的性能。稀土元素又被称为冶金工业的维生素。如,在钢中加入稀土元素,可以增加钢的塑性、韧性、耐磨性、耐热性、抗氧化性和抗腐蚀性等。因此,稀土全属广泛应用在冶金、石油化工、材料工业(电子材料、荧光材朴、发光材料永磁材料超导材料、染色材料、纳米材料、引火合金和催化剂等) 、医药及农业等领域。
4.在元素周期表的__________,寻找“稀土元素”。
第三列
指导其他与化学相关的科学技术
(一)元素周期表和元素周期律的生产应用(阅读P105)
(一)元素周期表和元素周期律的应用(阅读P105)
门捷列夫在研究元素周期表时,科学地预言了11种尚未发现的元素,为它们在周期表中留下了空位。例如,他认为在铝的下方有一个与铝类似的元素“类铝”,并预测了它的性质。1875年,法国化学家布瓦博德朗发现了这种元素,将它命名为镓。门捷列夫相信镓和“类铝”是同一种物质,并认为镓的密度应该是5.9 - 6.0 g/cm3, 而不是布瓦博德朗发表的4.7 g/cm3。当时布瓦博德朗认为只有他本人才拥有镓,门捷列夫怎么会知道这种金属的密度呢 他没有固执己见,重新提纯了镓,最后测得的密度果然是5.94 g/cm3。门捷列夫还预测了锗的存在和性质,多年后也得到了证实。
电子层数
结构
(1)核电荷数、原子序数
(2)核外电子
最外层电子数
位置
(周期、族)
决
定
反
映
性质
元素的性质
决
定
反
映
单质的性质
化合物的性质
决定
反映
同一元素的“位、构、性”关系可表示如下:
(二)元素周期表和元素周期律的理论应用
(二)元素周期表和元素周期律的理论应用
1.预测元素的性质
【例】镭是第7周期第ⅡA族元素,下列关于镭的性质的描述中
不正确的是( )
A.镭比钙金属性更强
B.氢氧化物呈两性
C.在化合物中呈+2价
D.碳酸盐难溶于水
B
碱性:Ra(OH)2> Ba(OH)2
BaCO3 CaCO3均难溶于水
元素金属性越强:
①与水(或酸)放出氢气越容易
②最高价氢氧化物碱性越强
2.比较元素的性质
(二)元素周期表和元素周期律的理论应用
【例】下列说法正确的是( )
A.C、N、O、F的单质与氢气化合依次变困难
B.NH3、H2O(g)、HF 稳定性依次增强
C.酸性:HClO>H2SO4
D.非金属性:P>S
B
酸性:HClO4>H2SO4
元素非金属性越强:
①气态氢化物的稳定性越强
②单质与氢气生成气态氢化物越容易
③最高价氧化物对应水化物酸性越强
【练习3】我国著名化学家张青莲精确地测定了锗(Ge)、锌等
九种元素的相对原子质量,得到的新值被作为国际新标准。已知锗
的原子序数为32。
(1)它位于元素周期表中第____周期第_____ 族。
(2)二氧化锗能溶于氢氧化钠溶液,二氧化锗与足量氢氧化钠溶液
反应的化学方程式为______________________________________
4
ⅣA
GeO2+2NaOH=Na2GeO3+H2O
CO2+2NaOH=Na2CO3+H2O
增多
增大
增强
减少
减小
增强
增多
减小
增强
减少
增大
增强
小结
THANKS
第四章 物质结构 元素周期律
第1课时 元素性质的周期性变化规律
人教版化学必修第1册
第二节 元素周期律
学习目标
一、知道同周期元素的核外电子排布、原子半径、化合价等随元素原子序数递增而呈周期性变化的规律。
二、能够以第三周期元素为例,说明同周期元素的金属性、非金属性等随元素原子序数递增而呈周期性变化的规律。
周期表中同周期元素的性质有什么变化规律呢?
非金属性逐渐减弱
金属性逐渐增强
原子半径逐渐增大
核外电子层数依次增大
环节一 1~18号元素原子结构的分析
阅读课本P101表4-5,填写P102表格。
思考并讨论:随着原子序数递增,元素原子的核外电子排布、原子半径和化合价呈现什么规律性的变化?
原子序数 电子层数 最外层电子数 原子半径的变化(不考虑稀有气体元素) 最高或最低化合价的变化
1~2 1 ———
3~10
11~18
结论
2
3
1
2
1
8
1
8
0.152nm →0.071nm
大→小
+1→ +5
- 4→ - 1 → 0
+1 →0
+1→ +7
- 4→ - 1→ 0
随着原子序数的递增,元素原子的核外电子排布、原子半径和化合价呈现 的变化。
0.186nm →0.099nm
大→小
随着原子序数递增,元素原子的核外电子排布、原子半径和化合价呈现什么规律性的变化?
O无+6价
F无正价
周期性
氢原子是所有原子中半径最小的
以1-18号元素为例,以原子序数为横坐标,分别以最外层电子数、化合价和原子半径为纵坐标,绘制柱状图或折线图。
随着原子序数的递增,元素原子的核外电子排布、原子半径和化合价呈现 的变化。
周期性
为什么同周期元素的原子半径会随着原子序数的增加而逐渐变小呢?
在电子层数相同的情况下,随着原子序数的增加,原子核对核外电子的电性作用 ,使得最外层电子与原子核之间的距离 ,从而使得原子半径减小。
思考与讨论
增强
缩小
问题讨论:根据第三周期元素原子核外电子排布规律,你能推测该周期元素金属性和非金属性的变化规律吗?
环节二 第三周期元素金属性和非金属性变化规律的探究
推测:
从左到右(稀有气体除外),元素金属性逐渐减弱,非金属性逐渐增强。
实验探究
设计实验方案:探究钠、镁、铝的金属性强弱
单质与水(或酸)反应的难易程度
最高价氧化物对应的水化物——氢氧化物的碱性强弱
【实验比较1】
观察镁与水的反应,分析比较现象,得出结论。
【实验比较1】
观察镁与水的反应,分析比较现象,得出结论。
实验内容 实验现象 反应方程式 实验
结论
Na 与冷水 (酚酞)
Mg 与冷水 (酚酞)
与热水 (酚酞)
常温下钠与水反应剧烈,放出氢气,溶液变红。
2Na+2H2O=2NaOH+H2↑
常温下镁与水的反应较缓慢,镁条表面有微量气泡产生,溶液微微变红。
Mg+2H2O = Mg(OH)2+H2↑
加热后反应剧烈,镁条表面有大量气泡产生,镁条附近溶液变为红色。
Mg+2H2O Mg(OH)2 + H2↑
钠的金属性强于镁
向氯化铝溶液中加入氨水,将生成的沉淀分装在两个试管中,分别加入盐酸和氢氧化钠溶液,观察现象,得出结论。
【实验比较2】
AlCl3溶液
氨水
HCl溶液
NaOH溶液
Al3+ + 3NH3·H2O = Al(OH)3↓+ 3NH4+
白色沉淀溶解
白色沉淀溶解
白色絮状沉淀
Al(OH)3白色沉淀在酸或强碱中都能够溶解
Al(OH)3+ 3H+ = Al3+ + 3H2O
Al(OH)3+ OH- = AlO2-+ 2H2O
两性氢氧化物:既能与酸反应生成盐和水,又能与碱反应生成盐和水的氢氧化物。
向氯化铝溶液中加入氨水,将生成的沉淀分装在两个试管中,分别加入盐酸和氢氧化钠溶液,观察现象,得出结论。
【实验比较2】
【实验比较3】
向氯化镁溶液中加入氨水,将生成的沉淀分装在两个试管中,分别加入盐酸和氢氧化钠溶液,观察现象,得出结论。
【实验比较3】
向氯化镁溶液中加入氨水,将生成的沉淀分装在两个试管中,分别加入盐酸和氢氧化钠溶液,观察现象,得出结论。
MgCl2
溶液
氨水
HCl溶液
NaOH溶液
白色沉淀不溶解
Mg(OH)2白色沉淀只溶解于酸
白色沉淀溶解
Na Mg Al
最高价氧化物对应的水化物碱性强弱
根据实验结论以及课本信息,得出结论。
NaOH
强碱
Mg(OH)2
中强碱
Al(OH)3
两性氢氧化物
金属性:钠>镁>铝
问题讨论
我们可以通过哪些方法验证元素的非金属性强弱?
单质与氢气生成气态氢化物的难易程度以及氢化物的稳定性
最高价氧化物对应的水化物(含氧酸)的酸性强弱
结论:硅、磷、硫、氯所对应的最高价氧化物的水化物的酸性逐渐 ,所以硅、磷、硫、氯的非金属性逐渐 。
增强
增强
分析科学事实:探究Si、P、S、Cl非金属性的强弱。
阅读课本103页提供的最高价氧化物对应的水化物(含氧酸)的
酸性强弱信息表。
通过实验比较和信息获取,你得出的结论是什么?与最初的预测一致吗?
从左到右(稀有气体除外),元素金属性逐渐减弱,非金属性逐渐增强。
环节三 同周期元素金属性和非金属性变化规律分析
元素的金属性和非金属性随着原子序数的递增而呈周期性的变化
同周期主族元素性质变化规律的原因是什么?
原子核外电子层数相同核电荷数逐渐增多
失电子能力逐渐减弱
得电子能力逐渐增强
同一周期 从左到右
原子核对核外电子的电性作用增强
金属性逐渐减弱
非金属性逐渐增强
原子半径逐渐减小
元素周期律
元素的性质随着原子序数的递增而呈现周期性的变化规律。
元素性质的周期性变化是元素原子的核外电子排布周期性变化的必然结果。
元素的性质随着原子序数的递增而呈现周期性的变化规律。
元素周期律——
环节四 课堂小结
随着原子序数的递增:
1.元素原子的核外电子排布、原子半径、化合价呈现周期性变化。
结构决定性质 性质反映结构
2.同周期主族元素,从左到右,原子半径逐渐减小,金属性逐渐减弱,非金属性逐渐增强。
元素性质的周期性变化是元素原子的核外电子排布周期性变化的必然结果。
第四章 物质结构 元素周期律
第2课时 元素周期表和元素周期律的应用
人教版化学必修第1册
第二节 元素周期律
1.会利用元素在元素周期表中的位置和原子结构,分析、预测、比较元素及其对应物质的性质。
3.了解元素周期律(表)在学习元素及其化合物知识和科学研究中的重要作用。
2.可以结合相关资料,来说明元素周期律(表)对合成新物质、寻找新材料的指导作用。
学习目标:
碱金属元素金属性:
卤族元素非金属性:
【温故知新】
Li<Na < K < Rb < Cs
F>Cl > Br > I
第三周期金属元素金属性:
第三周期非金属元素非金属性:
Na > Mg > Al
Si < P < S < Cl
元素周期律
一、金属元素与非金属元素的分区及性质的递变规律
族 周期 ⅠA ⅡA ⅢA ⅣA ⅤA ⅥA ⅦA 0
1 2 3 4 5 6 7
增强
增
强
增
强
增强
Al Si
既表现金属元素的性质,又表现非金属元素的性质。
(一)元素金属性、非金属性的递变(阅读P104)
铝
硅
硼
除去放射性元
素,哪种元素
的金属性最强
?哪种元素的
非金属性最强
?它们分别位
于元素周期表
的什么区域?
想一想
金属性最强的元素:Cs (左下方)
非金属性最强的元素:F(右上方)
1.主族元素的最高正化合价 主族序数 最外层电子(价电子)数
提示:元素原子的最外电子层中的电子也叫价电子,有些元素的化合价
与原子的次外层或倒数第三层的部分电子有关,这部分电子也叫价电子。
(二)元素化合价与元素在元素周期表中的位置关系
IA IIA IIIA IVA VA VIA VIIA 0
1 2 3 4 5 6
1 2 3
4 5 6 7
=
=
7
2.非金属元素:
(二)元素化合价与元素在元素周期表中的位置关系
+ + + +
=
=
=
=
8 8 8 8
最高正化合价+|最低负化合价|=8
2.非金属元素:
注意:氟元素,无正价;氧元素无+6价, 一般显一2价, 在H2O2 、Na2O2等过氧化物中显一1价;氢一般显+1价,但在金属氢化物中显一1价。最高正化合价+|最低负化合价|=2
(二)元素化合价与元素在元素周期表中的位置关系
+ + + +
=
=
=
最高正化合价+|最低负化合价|=8
代数和 0 2 4 6
IVA~VIIA非金属元素:最高正化合价与最低负化合价代数和分别为0、2、4、6
=
【练习1】X元素最高价氧化物对应水化物的化学式为
H2XO4,该元素的气态氢化物的化学式是( )
A.HX B.H2X C.XH3 D.XH4
B
解析:
X的最高正化合价为+6,最低负化合价=最高正化合价-8 = -2
+6
【练习2】某元素X的最高正化合价与最低负化合价的代数和为2,下列说法正确的是( )
A.元素X为第六主族的元素
B.元素X最高价含氧酸的化学式为H2XO4
C.元素X最高价氧化物为XO2
D.元素X的氢化物的化学式为XH3
D
HXO3 /H3XO4
X2O5
VA
代数和 0 2 4 6
二、元素周期表和元素周期律的应用
指导其他与化学相关的科学技术
1.在周期表_____________________,可以找半导体材料,如硅、锗、镓等。
金属与非金属分界处
(一)元素周期表和元素周期律的生产应用(阅读P105)
锗晶体
镓器件
硅芯片
耐高温、耐腐蚀,
发动机火花塞
2.在___________中寻找催化剂和耐高温、耐腐蚀的合金材料。
过渡元素
镍
钴
合
金
铂铑合金
铱合金
钛合金
指导其他与化学相关的科学技术
(一)元素周期表和元素周期律的生产应用(阅读P105)
三氧化二砷
3.在元素周期表的__________,寻找制取农药的元素。
右上方
指导其他与化学相关的科学技术
(一)元素周期表和元素周期律的生产应用(阅读P105)
稀土的英文是Rare Earths,
“稀”原指稀贵,“土”是
指其氧化物难溶于水的“土”
性。根据国际纯粹与应用化
学联合会1UPAC推荐,把57
至71的15种元素称为镧系元
素,用Ln表示,它们再加上
钪、钇称为稀土元素,
用RE表示。
在合金中加入适量稀土金属,能大大改善合金的性能。稀土元素又被称为冶金工业的维生素。如,在钢中加入稀土元素,可以增加钢的塑性、韧性、耐磨性、耐热性、抗氧化性和抗腐蚀性等。因此,稀土全属广泛应用在冶金、石油化工、材料工业(电子材料、荧光材朴、发光材料永磁材料超导材料、染色材料、纳米材料、引火合金和催化剂等) 、医药及农业等领域。
4.在元素周期表的__________,寻找“稀土元素”。
第三列
指导其他与化学相关的科学技术
(一)元素周期表和元素周期律的生产应用(阅读P105)
(一)元素周期表和元素周期律的应用(阅读P105)
门捷列夫在研究元素周期表时,科学地预言了11种尚未发现的元素,为它们在周期表中留下了空位。例如,他认为在铝的下方有一个与铝类似的元素“类铝”,并预测了它的性质。1875年,法国化学家布瓦博德朗发现了这种元素,将它命名为镓。门捷列夫相信镓和“类铝”是同一种物质,并认为镓的密度应该是5.9 - 6.0 g/cm3, 而不是布瓦博德朗发表的4.7 g/cm3。当时布瓦博德朗认为只有他本人才拥有镓,门捷列夫怎么会知道这种金属的密度呢 他没有固执己见,重新提纯了镓,最后测得的密度果然是5.94 g/cm3。门捷列夫还预测了锗的存在和性质,多年后也得到了证实。
电子层数
结构
(1)核电荷数、原子序数
(2)核外电子
最外层电子数
位置
(周期、族)
决
定
反
映
性质
元素的性质
决
定
反
映
单质的性质
化合物的性质
决定
反映
同一元素的“位、构、性”关系可表示如下:
(二)元素周期表和元素周期律的理论应用
(二)元素周期表和元素周期律的理论应用
1.预测元素的性质
【例】镭是第7周期第ⅡA族元素,下列关于镭的性质的描述中
不正确的是( )
A.镭比钙金属性更强
B.氢氧化物呈两性
C.在化合物中呈+2价
D.碳酸盐难溶于水
B
碱性:Ra(OH)2> Ba(OH)2
BaCO3 CaCO3均难溶于水
元素金属性越强:
①与水(或酸)放出氢气越容易
②最高价氢氧化物碱性越强
2.比较元素的性质
(二)元素周期表和元素周期律的理论应用
【例】下列说法正确的是( )
A.C、N、O、F的单质与氢气化合依次变困难
B.NH3、H2O(g)、HF 稳定性依次增强
C.酸性:HClO>H2SO4
D.非金属性:P>S
B
酸性:HClO4>H2SO4
元素非金属性越强:
①气态氢化物的稳定性越强
②单质与氢气生成气态氢化物越容易
③最高价氧化物对应水化物酸性越强
【练习3】我国著名化学家张青莲精确地测定了锗(Ge)、锌等
九种元素的相对原子质量,得到的新值被作为国际新标准。已知锗
的原子序数为32。
(1)它位于元素周期表中第____周期第_____ 族。
(2)二氧化锗能溶于氢氧化钠溶液,二氧化锗与足量氢氧化钠溶液
反应的化学方程式为______________________________________
4
ⅣA
GeO2+2NaOH=Na2GeO3+H2O
CO2+2NaOH=Na2CO3+H2O
增多
增大
增强
减少
减小
增强
增多
减小
增强
减少
增大
增强
小结
THANKS
