第三章 铁 金属材料 测试题 (含解析)2023-2024学年高一上学期化学人教版(2019)必修第一册
文档属性
| 名称 | 第三章 铁 金属材料 测试题 (含解析)2023-2024学年高一上学期化学人教版(2019)必修第一册 |  | |
| 格式 | docx | ||
| 文件大小 | 687.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-15 19:48:36 | ||
图片预览



文档简介
第三章 铁金属材料 测试题
一、选择题
1.下列实验现象描述错误的是
编号 实验 现象
A 加热放在坩埚中的小块钠 钠先熔化成光亮的小球,燃烧时,火焰为黄色,燃烧后,生成淡黄色固体
B 在酒精灯上加热用砂纸打磨过的铝箔 铝箔变软,失去光泽,熔化的铝并不滴落
C 在氯气中点燃氢气 安静燃烧,产生苍白色火焰
D 将水蒸气通过灼热的铁粉 黑色粉末变为红褐色
A.A B.B C.C D.D
2.下列物质中,在一定条件下与铁反应,且铁元素的化合价能变成+3价的是
A.氯化铁溶液 B.氯气 C.稀盐酸 D.氯化钠溶液
3.下列离子方程式书写错误的是
A.三氯化铁溶液与铁粉反应:
B.溶于水:
C.向烧碱溶液中加入一小段铝片:
D.将稀盐酸滴在石灰石上:
4.化学与生活、社会发展息息相关,下列说法错误的是
A.“熬胆矾铁釜,久之亦化为铜”,该过程发生了置换反应
B.先秦文献《考工记》记录了六类青铜器物的合金成分配比,说明古人已经认识到合金的熔点比纯金属的高
C.《齐民要术》对我国传统的酿造方法有较详细的叙述,酒、醋、酱油等通常是用粮食发酵酿制而成的
D.Cu(OH)2 CuCO3中铜的质量分数高于Cu(OH)2 2CuCO3
5.除去铜粉中混有的少量氧化铜,下列方法正确的是
A.将混合物放在空气中加热
B.在混合物中加入足量的水,充分搅拌后过滤
C.在混合物中加入足量的铁粉,反应后过滤
D.在混合物中加入足量的盐酸,充分反应后过滤
6.下列反应的离子方程式书写正确的是
A.钠与水反应:
B.氢氧化钡溶液与稀硫酸反应:
C.氨水与氯化铜溶液反应:
D.氯气与氯化亚铁溶液反应:
7.下列操作中,不会影响溶液中等离子大量共存的是
A.通入 B.加入粉 C.加入 D.加入
8.工业上曾经通过反应“3Fe+4NaOHFe3O4+2H2↑+4Na↑”生产金属钠。下列说法正确的是
A.用磁铁可以将Fe与Fe3O4分离 B.该反应条件下铁的氧化性比钠强
C.每生成1molH2,转移的电子为4mol D.将生成的气体在空气中冷却可获得钠
9.常温下,下列各组离子在指定溶液中一定能大量共存的是
A.pH=1(酸性)的溶液中:Na+、、Cl-、K+
B.无色酸性溶液中:Fe2+、K+、 、
C.含有I- 的溶液中:H +、Na+、Cl-、
D.pH=14(碱性)的溶液中:K+、、ClO-、Cl-
10.为了检验某FeSO4溶液是否变质,可向溶液中加入
A.铁片 B.铜片 C.KSCN溶液 D.3%的过氧化氢溶液
11.铁及其化合物在生产、生活中应用广泛。下列有关它们的性质与用途具有对应关系的是
A.有氧化性,可用作净水剂 B.有磁性,可用作高炉炼铁的原料
C.是红棕色,可用于制红色油漆 D.Fe有还原性,可用于铝热反应焊接钢轨
12.下列有关实验安全以及药品保存等说法正确的是
A.金属钠着火燃烧时用水灭火
B.新制氯水保存在棕色试剂瓶中并放置在阴凉处
C.检验铁和水蒸气反应的气体产物时直接点燃
D.直接向容量瓶中加水稀释浓硫酸
13.下列物质对应的组成不正确的是
A.小苏打:NaHCO3 B.铁红:Fe3O4
C.软锰矿的主要成分:MnO2 D.漂粉精的有效成分:Ca(ClO)2
14.“神八”与“天宫一号”的成功对接,标志着中国的航空铝材处于世界领先的行列。下列关于铝合金的说法中错误的是
A.铝合金是一种混合物,它比纯铝的硬度大
B.高温铝液易被氧化,铝合金应在熔剂层覆盖下熔炼
C.镁铝合金耐腐蚀,但能被烧碱(NaOH)腐蚀
D.镁铝合金在盐酸中无法溶解
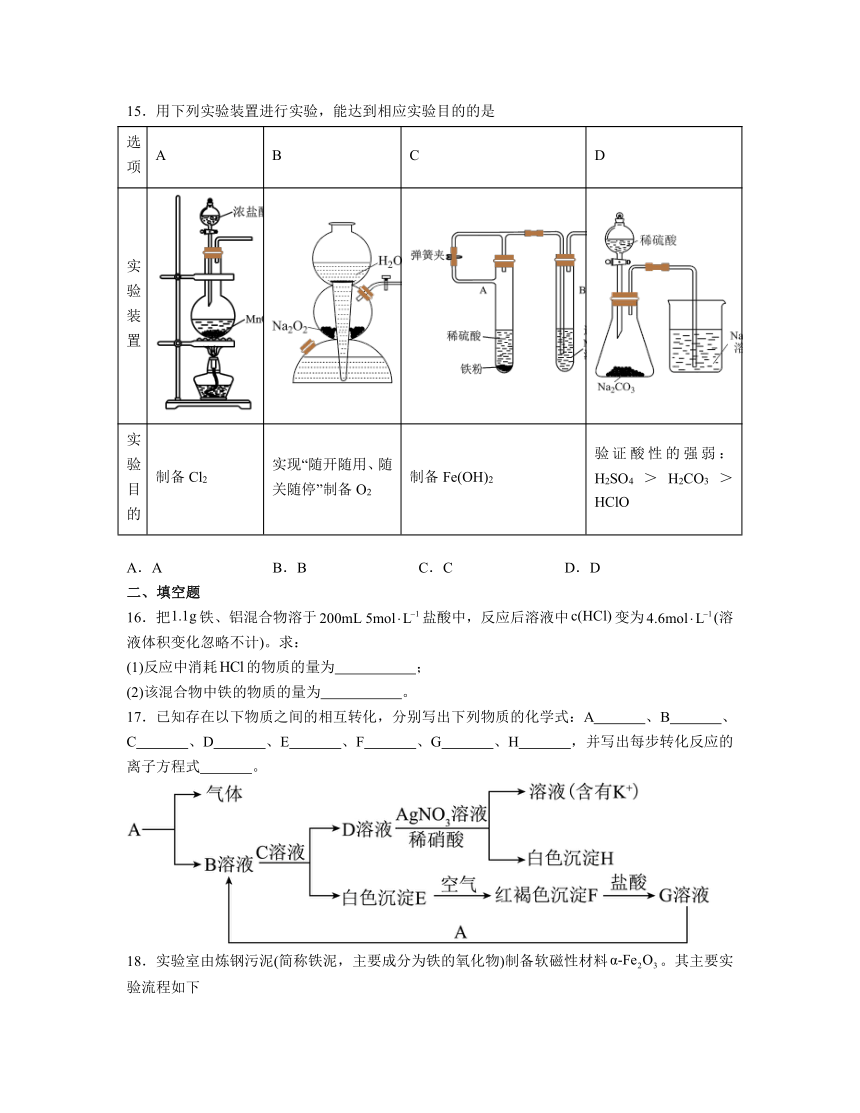
15.用下列实验装置进行实验,能达到相应实验目的的是
选项 A B C D
实验装置
实验目的 制备Cl2 实现“随开随用、随关随停”制备O2 制备Fe(OH)2 验证酸性的强弱:H2SO4>H2CO3>HClO
A.A B.B C.C D.D
二、填空题
16.把铁、铝混合物溶于盐酸中,反应后溶液中变为(溶液体积变化忽略不计)。求:
(1)反应中消耗的物质的量为 ;
(2)该混合物中铁的物质的量为 。
17.已知存在以下物质之间的相互转化,分别写出下列物质的化学式:A 、B 、C 、D 、E 、F 、G 、H ,并写出每步转化反应的离子方程式 。
18.实验室由炼钢污泥(简称铁泥,主要成分为铁的氧化物)制备软磁性材料。其主要实验流程如下
还原。向“酸浸”后的滤液中加入过量铁粉,使完全转化为。“还原”过程中除生成外,还会生成 (填化学式):检验是否还原完全的实验操作是 。
19.请找出常见物质与其用途的对应关系 。
(1)氯气 A、呼吸面具中氧气来源
(2)碳酸氢钠 B、漂白粉的有效成分
(3)氧化铁 C、用于自来水杀菌消毒
(4)过氧化钠 D、制作红色油漆的颜料
(5)次氯酸钙 E、发酵粉的成分或治疗胃酸过多
20.液体化合物,常用做火箭燃料。在一定量的中恰好完全燃烧,反应方程式为,则:
(1)反应前需要标准状况下的体积为多少? 。
(2)生成的质量为多少? 。
21.Ⅰ.2.7gAl与的稀盐酸充分反应,试计算:
(1)在标准状况下生成氢气的体积为 L。
(2)用6.0mol/L盐酸配制盐酸,需要量取6.0mol/L盐酸的体积 mL。
Ⅱ.现有和的混合溶液,将其分为两等份,向其中一份中加入溶液,至恰好不再产生沉淀,消耗50mL,将沉淀过滤、洗涤、干燥,称其质量为mg;向另一份溶液加入铁片,充分反应后,取出铁片,洗涤、烘干,称其质量比原来减轻了0.56g。试计算:
(1)m= 。
(2)则原溶液中K+的物质的量浓度为 mol/L(写出计算过程)。
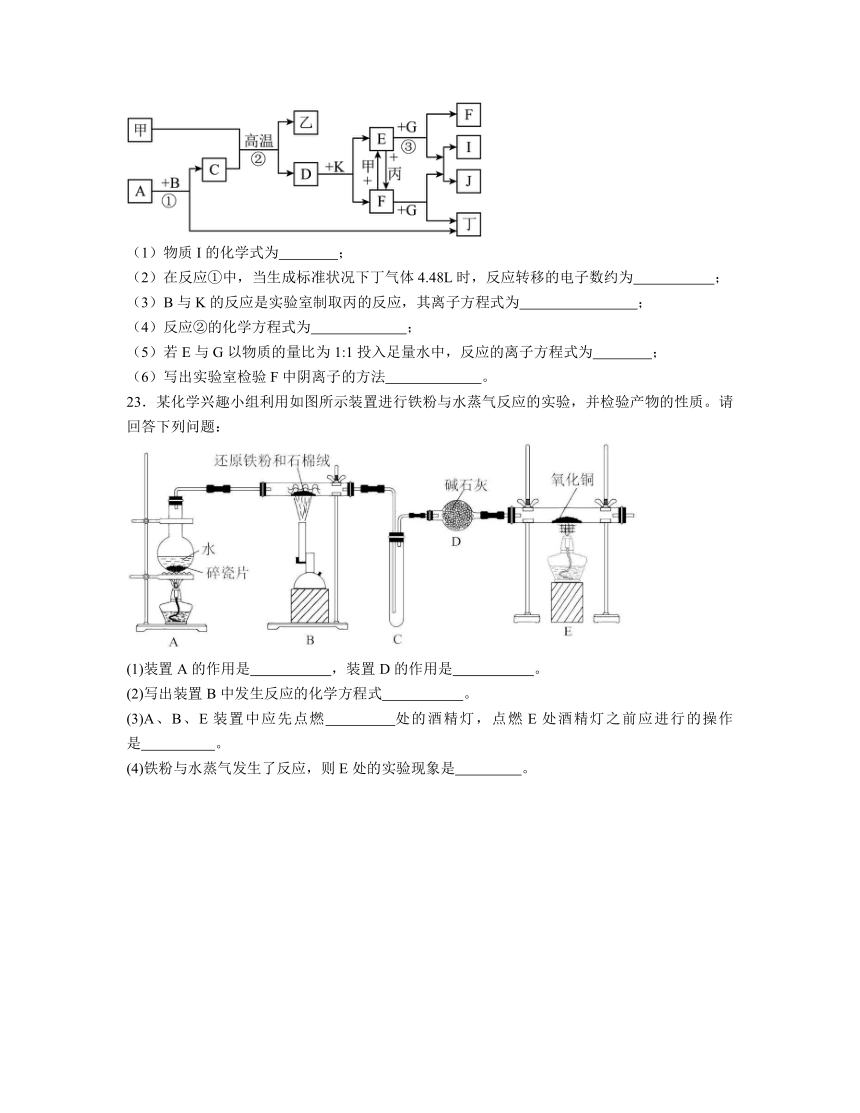
22.下列各物质是中学化学中常见的物质,甲为常见金属单质,丙为黄绿色的单质气体,乙、丁是常见无色气态非金属单质,其它均为化合物,C常温下为一种液体,B、D分别为黑色粉末和黑色晶体,G为淡黄色固体,J为生活中常见的调味品,I为红褐色固体,F为棕黄色溶液。①是实验室制取丁的反应之一。各物质间的转化如下图所示,回答下列问题(部分生成物未列出):
(1)物质I的化学式为 ;
(2)在反应①中,当生成标准状况下丁气体4.48L时,反应转移的电子数约为 ;
(3)B与K的反应是实验室制取丙的反应,其离子方程式为 ;
(4)反应②的化学方程式为 ;
(5)若E与G以物质的量比为1:1投入足量水中,反应的离子方程式为 ;
(6)写出实验室检验F中阴离子的方法 。
23.某化学兴趣小组利用如图所示装置进行铁粉与水蒸气反应的实验,并检验产物的性质。请回答下列问题:
(1)装置A的作用是 ,装置D的作用是 。
(2)写出装置B中发生反应的化学方程式 。
(3)A、B、E装置中应先点燃 处的酒精灯,点燃E处酒精灯之前应进行的操作是 。
(4)铁粉与水蒸气发生了反应,则E处的实验现象是 。
【参考答案】
一、选择题
1.D
解析:A.金属钠熔点较低,将金属钠放在坩埚中加热,我们看到钠先熔化成光亮的小球,然后与空气中的氧气发生燃烧反应,火焰为黄色,燃烧后,生成淡黄色过氧化钠固体,A正确;
B.在酒精灯上加热用砂纸打磨过的铝箔,铝箔表面的Al与空气中的氧气反应产生熔点高的Al2O3,内部的Al受热熔化,但被熔点高的氧化铝包裹,因此铝箔变软,失去光泽,熔化的铝并不滴落,B正确;
C.在氯气中点燃氢气,我们看到H2能够在氯气中安静燃烧,火焰呈苍白色,C正确;
D.将水蒸气通过灼热的铁粉,二者发生反应产生黑色Fe3O4晶体,同时产生无色气体,D错误;
故合理选项是D。
2.B
解析:A.氯化铁溶液与铁反应生成氯化亚铁,铁元素由+3价变为+2价,故A错误;
B.铁在氯气中燃烧生成氯化铁,铁元素由0价变为+3价,故B正确;
C.铁与稀盐酸反应生成氯化亚铁和氢气,铁元素由0价变为+2价,故C错误;
D.铁与氯化钠溶液不反应,铁元素的化合价不可能变成+3价,故D错误;
故选B。
3.B
解析:A.三氯化铁溶液与铁粉反应生成氯化亚铁,离子方程式为,故A正确;
B.溶于水生成盐酸和次氯酸,次氯酸为弱酸,书写离子方程式不能拆开写,故离子方程式为,故B错误;
C.铝和烧碱氢氧化钠溶液反应生成偏铝酸钠和氢气,离子方程式为,故C正确;
D.石灰石和盐酸反应生成氯化钙、水和二氧化碳气体,离子方程式为,故D正确;
故选B。
4.B
解析:A.胆矾是硫酸铜,该过程中发生的反应是:,置换反应,故A不选;
B.合金的熔点低于任一组分的熔点,故B选;
C.古代酒、醋、酱油等通常是用粮食发酵酿制而成的,故C不选;
D.Cu(OH)2中铜的质量分数高于CuCO3中铜的质量分数,所以Cu(OH)2 CuCO3中铜的质量分数高于Cu(OH)2 2CuCO3,故D不选;
故选B。
5.D
解析:A.铜在空气中加热,铜被氧化为氧化铜,原物质被除去,故A错误;
B.铜和氧化铜都不溶于水,故B错误;
C.铜和氧化铜都不能与铁粉反应,故C错误;
D.铜与盐酸不反应,氧化铜与盐酸反应生成氯化铜和水,则加入足量的盐酸,充分反应后过滤即可除去铜粉中的氧化铜,故D正确;
故答案选D。
6.A
解析:A.钠与水反应生成氢氧化钠和氢气,反应的离子方程式是,故A正确;
B.氢氧化钡溶液与稀硫酸反应生成硫酸钡沉淀和水,反应的离子方程式是,故B错误;
C.氨水与氯化铜溶液反应生成氢氧化铜沉淀和氯化铵,反应的离子方程式是,故C错误;
D.氯气与氯化亚铁溶液反应生成氯化铁,反应的离子方程式是,故D错误;
选A。
7.A
解析:A.通入CO2,CO2不与以上几种离子反应,能大量共存,A正确;
B.Fe能与Fe3+反应,加入铁粉铁离子不能大量共存,B错误;
C.NaOH能与铁离子反应,加入NaOH铁离子不能大量共存,C错误;
D,硫酸根离子和钡离子能反应生成硫酸钡沉淀,加入ZnSO4,钡离子不能大量共存,D错误;
故答案选A。
8.C
解析:A.Fe与Fe3O4都能被磁铁吸引,不能用磁铁分离Fe与Fe3O4,故A错误;
B.该反应条件下生成钠气体,从反应体系中挥发出来,与还原性强弱无关,故B错误;
C.根据反应的方程式可知,每生成1molH2,同时生成2molNa,转移的电子为4mol,故C正确;
D.钠在空气中易被氧化为氧化钠,因此将生成的气体在空气中冷却不能获得钠,故D错误;
故答案选C。
9.A
解析:A.pH=1(酸性)的溶液中存在大量的氢离子,氢离子和Na+、、Cl-、K+,不反应,且其相互之间不反应,可共存,A正确;
B.二价铁是浅绿色的,另外,酸性条件下硝酸根离子可以将二价铁氧化为三价铁,不能共存,B错误;
C.酸性调价下,硝酸根离子可以将碘离子氧化为单质碘,不能共存,C错误;
D.碱性条件下,氢氧根离子可以和铵根离子反应生成一水合氨,不能共存,D错误;
故选A。
10.C
解析:FeSO4溶液具有强还原性,变质后变为硫酸铁,因此检验某FeSO4溶液是否变质,可向溶液中加入KSCN溶液,若溶液变为红色,则证明FeSO4溶液已变质,反之未变质;
故选C。
11.C
解析:A.溶液中铁离子水解生成氢氧化铁胶体,氢氧化铁胶体有吸附性,能吸附杂质,可用作净水剂,与其氧化性无关,A错误;
B.中含铁元素,可用作高炉炼铁的原料,与其磁性无关,B错误;
C.是红棕色固体,难溶于水,可用于制红色油漆,C正确;
D.铝热反应为铝和氧化铁在高温下反应生成铁和氧化铝,与铁的还原性无关,D错误;
答案选C。
12.B
解析:A.钠和水反应生成可燃性氢气,金属钠着火燃烧时不能用水灭火,A错误;
B.新制氯水中次氯酸见光受热易分解,故保存在棕色试剂瓶中并放置在阴凉处,B正确;
C.铁和水蒸气反应生成氢气,氢气具有可燃性,和空气混合点燃容易发生爆炸,故检验铁和水蒸气反应的气体产物时应先检验纯度再点燃,C错误;
D.稀释浓硫酸要把浓硫酸沿器壁慢慢注入水中并不断搅拌,D错误;
故选B。
13.B
解析:A.小苏打是碳酸氢钠的俗称,碳酸氢钠的化学式为NaHCO3,故A正确;
B.铁红是氧化铁的俗称,氧化铁的化学式为Fe2O3,故B错误;
C.软锰矿的主要成分为二氧化锰,二氧化锰的化学式为MnO2,故C正确;
D.漂粉精的有效成分为次氯酸钙,次氯酸钙的化学式为Ca(ClO)2,故D正确;
故选B。
14.D
解析:A.合金是混合物,合金要比组成其纯金属的熔点低、硬度大,铝合金是一种混合物,它比纯铝的硬度大,A正确;
B.铝易被氧化,铝合金应在溶剂层覆盖下熔炼,可隔绝空气,防止高温铝液被氧化,B正确;
C.镁铝合金中的铝能与氢氧化钠溶液反应,C正确;
D.镁、铝都能与盐酸反应,镁铝合金在盐酸中能溶解,D错误;
答案选D。
15.A
解析:A.浓盐酸与MnO2混合加热发生氧化还原反应产生Cl2,图示符合Cl2的制备装置,A正确;
B.Na2O2与H2O反应产生NaOH、O2快速溶解,不能实现“随开随用、随关随停”制备O2,B错误;
C.Fe与稀硫酸反应产生H2能够将装置中空气排出,但反应产生的FeSO4溶液不能进入到装置B中,因此不能制取得到Fe(OH)2,C错误;
D.H2SO4与Na2CO3反应产生CO2气体,将制取得到的CO2通入到盛有NaClO的溶液中会发生反应:CO2+H2O+NaClO=NaHCO3+HClO,但反应后溶液中我颜色变化,无沉淀生成,因此不能观察到明显的实验现象,因此不能证明酸性:H2CO3>HClO,D错误;
故合理选项是A。
二、填空题
16.(1)0.08 mol
(2)0.01 mol
解析:(1)反应中消耗的物质的量为;故答案为:0.08mol。
(2)根据题意建立方程式56n(Fe)+27n(Al)=1.1g,2n(Fe)+3n(Al)=0.08mol,解得n(Fe)=0.01mol,n(Al)=0.02mol,则该混合物中铁的物质的量为0.01mol;故答案为:0.01。
17. Fe FeCl2 KOH KCl Fe(OH)2 Fe(OH)3 FeCl3 AgCl Fe+2H+=Fe2++H2↑,Fe2++2OH-=Fe(OH)2↓,Ag++Cl-=AgCl↓,4Fe(OH)2+O2+2H2O=4Fe(OH)3,Fe(OH)3+3H+=Fe3++3H2O,2Fe3++Fe=3Fe2+
【分析】通过白色沉淀E在空气中转化为红褐色沉淀F,可以推知E为Fe(OH)2,F为Fe(OH)3,以此作为突破口进而推出其他物质。
解析:由白色沉淀E在空气中转化为红褐色沉淀F,可以推知E为Fe(OH)2,F为Fe(OH)3,则G为FeCl3;由D溶液中加入硝酸酸化的AgNO3溶液,产生白色沉淀H和溶液中含有K+可知,H为AgCl,则D为KCl;由B+CKCl+Fe(OH)2,可推知B、C为KOH和FeCl2,而G(FeCl3)+AB,可知B为FeCl2,C为KOH,并推知A为Fe,Fe与盐酸反应生成FeCl2和H2。故A为Fe,B为FeCl2,C为KOH,D为KCl,E为Fe(OH)2,F为Fe(OH)3,G为FeCl3,H为AgCl;涉及的离子方程式为Fe+2H+=Fe2++H2↑,Fe2++2OH-=Fe(OH)2↓,Ag++Cl-=AgCl↓,4Fe(OH)2+O2+2H2O=4Fe(OH)3,Fe(OH)3+3H+=Fe3++3H2O,2Fe3++Fe=3Fe2+。
【点睛】离子方程式书写的分为四步,第一步:正确写出反应的化学方程式,第二步:把易溶于水、易电离的物质拆写成离子形式,第三步:删去方程式两边不参加反应的离子,第四步:检查方程式两边的元素和电荷是否守恒。
18. 取少量清液,向其中滴加几滴溶液,观察溶液颜色是否呈血红色
解析:“酸浸”时酸过量,“酸浸”后的滤液中还含有大量,与铁粉反应生成;一般用溶液检验,操作为取少量清液,向其中滴加几滴溶液,观察溶液颜色是否呈血红色。
19.(1)C(2)E(3)D(4)A(5)B
解析:(1)氯气具有强氧化性,可用于自来水杀菌消毒,对应C;
(2)碳酸氢钠的水溶液呈弱碱性,能与酸反应,可用于治疗胃酸过多,且碳酸氢钠受热易分解,可作为发酵粉的成分,对应E;
(3)氧化铁为红棕色粉末,俗称铁红,可用于制作红色油漆的颜料,对应D;
(4)过氧化钠能与水或二氧化碳反应放出氧气,供人体呼吸,可用于呼吸面具中氧气来源,对应A;
(5)次氯酸钙是漂白粉精的有效成分,对应B;
故填(1)C(2)E(3)D(4)A(5)B;
20.2 L 14 g
解析:(1)的物质的量为=0.5mol,根据反应可知,消耗氧气的物质的量为0.5mol,则反应前需要标准状况下的体积为0.5mol×22.4L/mol=11.2L;
(2)根据(1)中计算分析,参与反应的的物质的量为0.5mol,根据反应可知,生成的的物质的量为0.5mol,则氮气的质量为0.5mol×28g/mol=14g。
21.36 100 11.65 0.2
【分析】Ⅰ.2.7gAl与的稀盐酸充分反应的计算,要根据化学方程式分析反应是否是恰好反应,然后才可以把相关数据代入计算。
Ⅱ根据溶液的均一性,分成两等份的溶液和原溶液成分是一样的,然后根据加入的BaCl2溶液的量可以求出生成沉淀BaSO4的量,进而求出其质量;第二份溶液中加入铁片,能和铁片反应的是Fe2(SO4)3,则可根据消耗的铁片的质量求出Fe2(SO4)3的量,从而求出其含有的的量,然后根据总共的物质的量则可求出K2SO4含有的物质的量,进而求出K+的浓度,据此解答。
解析:Ⅰ.2.7gAl与的稀盐酸充分反应,2.7g Al的物质的量为0.1mol,的稀盐酸含溶质HCl的物质的量为0.6mol,根据反应的关系式2Al~6HCl~3H2,可知盐酸是足量的,2 molAl和足量盐酸反应生成3 molH2,则0.1molAl和足量盐酸反应生成氢气n(H2)=0.15mol ,其在标准状况下生成氢气的体积为22.40.15mol=3.36L。
(2)用6.0mol/L盐酸配制盐酸,根据稀释规律,c(浓溶液),,可得6mol/L=3mol/LmL ,则=100mL,则需要量取6.0mol/L盐酸的体积为100 mL。
Ⅱ. (1)将和混合液分为两等份,则其中一份体积是200mL,与50mL 溶液恰好反应生成沉淀mg,则沉淀是BaSO4,根据关系式BaCl2~ BaSO4,可知n(BaSO4)=n(BaCl2)=0.05L1mol/L=0.05 mol,则其质量为m(BaSO4)= 0.05 mol233g/mol=11.65g。
(2) 向另一份溶液加入铁片,则发生的离子反应是Fe+2Fe3+=3 Fe2+,充分反应后,取出铁片,洗涤、烘干,称其质量比原来减轻了0.56g,也就是减少了0.01molFe ,根据离子方程式,可求出参加反应的Fe3+是0.02mol,根据关系式2Fe3+~3Fe2(SO4)3,可知一份溶液中Fe2(SO4)3含有的为0.03mol,经过(1)的计算,可知一份溶液中总共含有为0.05mol,则可知一份溶液中含有K2SO4的物质的量为0.02 mol,则n (K+)=0.04 mol,则c(K+)==0.2mol/L,每份溶液和原混合液浓度是一样的,因此原溶液中K+的物质的量浓度为0.2mol/L。
22. Fe(OH)3 2.408×1023 MnO2+4H++2Cl- Mn2++Cl2↑+2H2O 3Fe + 4H2O(g) Fe3O4 +4H2 4Fe2++4Na2O2 + 6H2O = 4Fe(OH)3↓+8Na+ + O2↑ 取少量F溶液于试管中,加入少量AgNO3溶液,若产生白色沉淀且加稀HNO3不溶解,则有Cl-
【分析】甲为常见金属单质,丙为黄绿色的单质气体,再根据E、F的转化关系得出甲为Fe,丙为Cl2,乙是无色气态非金属单质,C常温下为一种液体,B、D分别为黑色粉末和黑色晶体,说明C为水,D为四氧化三铁,乙为氢气,K为盐酸,E为氯化亚铁,F为氯化铁,G为淡黄色固体,I为红褐色固体,G为过氧化钠,I为氢氧化铁,J为生活中常见的调味品即为氯化钠,丁为氧气,①是实验室制取丁的反应之一,说明A为过氧化氢,B为二氧化锰。
解析:⑴根据上面分析得到物质I的化学式为Fe(OH)3;故答案为:Fe(OH)3。
⑵在反应①中,2H2O22H2O + O2↑,2mol转移2mol电子生成1mol氧气,当生成标准状况下丁气体4.48L即0.2mol,反应转移的电子物质的量为0.2mol,数目约为2.408×1023;故答案为:2.408×1023。
⑶二氧化锰与浓盐酸的反应是实验室制取丙的反应,其离子方程式为MnO2+4H++2Cl- Mn2++Cl2↑+2H2O;故答案为:MnO2+4H++2Cl- Mn2++Cl2↑+2H2O。
⑷反应②的化学方程式为3Fe + 4H2O(g) Fe3O4 +4H2;故答案为:3Fe + 4H2O(g) Fe3O4 +4H2。
⑸若E与G以物质的量比为1:1投入足量水中,反应的离子方程式为4Fe2++4Na2O2 + 6H2O = 4Fe(OH)3↓+8Na+ + O2↑;故答案为:4Fe2++4Na2O2 + 6H2O = 4Fe(OH)3↓+8Na+ + O2↑。
⑹实验室检验F中阴离子的方法取少量氯化铁溶液于试管中,加入少量AgNO3溶液,若产生白色沉淀且加稀HNO3不溶解,则有Cl-;故答案为:少量氯化铁溶液于试管中,加入少量AgNO3溶液,若产生白色沉淀且加稀HNO3不溶解,则有Cl-。
23.(1) 提供水蒸气 除去未反应的水蒸气(或干燥生成的气体)
(2)
(3) A 收集氢气验纯或检验氢气纯度
(4)黑色氧化铜枌末变红色
【分析】A处提供水蒸气,B处铁与水蒸气发生反应,C处冷凝水蒸气,D处干燥氢气,E处氢气还原氧化铜,注意要检验氢气的纯度防止发生爆炸。
解析:(1)铁与水蒸气反应的条件是高温,水的状态是气体,所以A装置的作用是提供水蒸气;E是氢气还原氧化铜的实验,气体进入E装置前要干燥,否则会有危险,硬质玻璃管可能炸裂,因此D的作用是除去未反应的水蒸气(或干燥生成的气体);
(2)装置B中是铁与水蒸气反应生成氢气和四氧化三铁,反应的方程式为;
(3)若先点燃B处,铁会与氧气发生反应,所以须先点燃A处;氢气是可燃性气体混有空气会发生爆炸,任何可燃性气体都有爆炸极限,所以点燃E处酒精灯之前应进行的操作是收集H2并检验其纯度,具体操作为:收集一试管气体,将试管口靠近酒精灯火焰,若发出噗的声音,说明气体纯净;若发生尖锐爆鸣声,说明气体不纯;
(4)氢气还原氧化铜得到铜和水,即H2+CuOCu+H2O,所以E中的实验现象是硬质玻璃管中黑色氧化铜枌末变红色
一、选择题
1.下列实验现象描述错误的是
编号 实验 现象
A 加热放在坩埚中的小块钠 钠先熔化成光亮的小球,燃烧时,火焰为黄色,燃烧后,生成淡黄色固体
B 在酒精灯上加热用砂纸打磨过的铝箔 铝箔变软,失去光泽,熔化的铝并不滴落
C 在氯气中点燃氢气 安静燃烧,产生苍白色火焰
D 将水蒸气通过灼热的铁粉 黑色粉末变为红褐色
A.A B.B C.C D.D
2.下列物质中,在一定条件下与铁反应,且铁元素的化合价能变成+3价的是
A.氯化铁溶液 B.氯气 C.稀盐酸 D.氯化钠溶液
3.下列离子方程式书写错误的是
A.三氯化铁溶液与铁粉反应:
B.溶于水:
C.向烧碱溶液中加入一小段铝片:
D.将稀盐酸滴在石灰石上:
4.化学与生活、社会发展息息相关,下列说法错误的是
A.“熬胆矾铁釜,久之亦化为铜”,该过程发生了置换反应
B.先秦文献《考工记》记录了六类青铜器物的合金成分配比,说明古人已经认识到合金的熔点比纯金属的高
C.《齐民要术》对我国传统的酿造方法有较详细的叙述,酒、醋、酱油等通常是用粮食发酵酿制而成的
D.Cu(OH)2 CuCO3中铜的质量分数高于Cu(OH)2 2CuCO3
5.除去铜粉中混有的少量氧化铜,下列方法正确的是
A.将混合物放在空气中加热
B.在混合物中加入足量的水,充分搅拌后过滤
C.在混合物中加入足量的铁粉,反应后过滤
D.在混合物中加入足量的盐酸,充分反应后过滤
6.下列反应的离子方程式书写正确的是
A.钠与水反应:
B.氢氧化钡溶液与稀硫酸反应:
C.氨水与氯化铜溶液反应:
D.氯气与氯化亚铁溶液反应:
7.下列操作中,不会影响溶液中等离子大量共存的是
A.通入 B.加入粉 C.加入 D.加入
8.工业上曾经通过反应“3Fe+4NaOHFe3O4+2H2↑+4Na↑”生产金属钠。下列说法正确的是
A.用磁铁可以将Fe与Fe3O4分离 B.该反应条件下铁的氧化性比钠强
C.每生成1molH2,转移的电子为4mol D.将生成的气体在空气中冷却可获得钠
9.常温下,下列各组离子在指定溶液中一定能大量共存的是
A.pH=1(酸性)的溶液中:Na+、、Cl-、K+
B.无色酸性溶液中:Fe2+、K+、 、
C.含有I- 的溶液中:H +、Na+、Cl-、
D.pH=14(碱性)的溶液中:K+、、ClO-、Cl-
10.为了检验某FeSO4溶液是否变质,可向溶液中加入
A.铁片 B.铜片 C.KSCN溶液 D.3%的过氧化氢溶液
11.铁及其化合物在生产、生活中应用广泛。下列有关它们的性质与用途具有对应关系的是
A.有氧化性,可用作净水剂 B.有磁性,可用作高炉炼铁的原料
C.是红棕色,可用于制红色油漆 D.Fe有还原性,可用于铝热反应焊接钢轨
12.下列有关实验安全以及药品保存等说法正确的是
A.金属钠着火燃烧时用水灭火
B.新制氯水保存在棕色试剂瓶中并放置在阴凉处
C.检验铁和水蒸气反应的气体产物时直接点燃
D.直接向容量瓶中加水稀释浓硫酸
13.下列物质对应的组成不正确的是
A.小苏打:NaHCO3 B.铁红:Fe3O4
C.软锰矿的主要成分:MnO2 D.漂粉精的有效成分:Ca(ClO)2
14.“神八”与“天宫一号”的成功对接,标志着中国的航空铝材处于世界领先的行列。下列关于铝合金的说法中错误的是
A.铝合金是一种混合物,它比纯铝的硬度大
B.高温铝液易被氧化,铝合金应在熔剂层覆盖下熔炼
C.镁铝合金耐腐蚀,但能被烧碱(NaOH)腐蚀
D.镁铝合金在盐酸中无法溶解
15.用下列实验装置进行实验,能达到相应实验目的的是
选项 A B C D
实验装置
实验目的 制备Cl2 实现“随开随用、随关随停”制备O2 制备Fe(OH)2 验证酸性的强弱:H2SO4>H2CO3>HClO
A.A B.B C.C D.D
二、填空题
16.把铁、铝混合物溶于盐酸中,反应后溶液中变为(溶液体积变化忽略不计)。求:
(1)反应中消耗的物质的量为 ;
(2)该混合物中铁的物质的量为 。
17.已知存在以下物质之间的相互转化,分别写出下列物质的化学式:A 、B 、C 、D 、E 、F 、G 、H ,并写出每步转化反应的离子方程式 。
18.实验室由炼钢污泥(简称铁泥,主要成分为铁的氧化物)制备软磁性材料。其主要实验流程如下
还原。向“酸浸”后的滤液中加入过量铁粉,使完全转化为。“还原”过程中除生成外,还会生成 (填化学式):检验是否还原完全的实验操作是 。
19.请找出常见物质与其用途的对应关系 。
(1)氯气 A、呼吸面具中氧气来源
(2)碳酸氢钠 B、漂白粉的有效成分
(3)氧化铁 C、用于自来水杀菌消毒
(4)过氧化钠 D、制作红色油漆的颜料
(5)次氯酸钙 E、发酵粉的成分或治疗胃酸过多
20.液体化合物,常用做火箭燃料。在一定量的中恰好完全燃烧,反应方程式为,则:
(1)反应前需要标准状况下的体积为多少? 。
(2)生成的质量为多少? 。
21.Ⅰ.2.7gAl与的稀盐酸充分反应,试计算:
(1)在标准状况下生成氢气的体积为 L。
(2)用6.0mol/L盐酸配制盐酸,需要量取6.0mol/L盐酸的体积 mL。
Ⅱ.现有和的混合溶液,将其分为两等份,向其中一份中加入溶液,至恰好不再产生沉淀,消耗50mL,将沉淀过滤、洗涤、干燥,称其质量为mg;向另一份溶液加入铁片,充分反应后,取出铁片,洗涤、烘干,称其质量比原来减轻了0.56g。试计算:
(1)m= 。
(2)则原溶液中K+的物质的量浓度为 mol/L(写出计算过程)。
22.下列各物质是中学化学中常见的物质,甲为常见金属单质,丙为黄绿色的单质气体,乙、丁是常见无色气态非金属单质,其它均为化合物,C常温下为一种液体,B、D分别为黑色粉末和黑色晶体,G为淡黄色固体,J为生活中常见的调味品,I为红褐色固体,F为棕黄色溶液。①是实验室制取丁的反应之一。各物质间的转化如下图所示,回答下列问题(部分生成物未列出):
(1)物质I的化学式为 ;
(2)在反应①中,当生成标准状况下丁气体4.48L时,反应转移的电子数约为 ;
(3)B与K的反应是实验室制取丙的反应,其离子方程式为 ;
(4)反应②的化学方程式为 ;
(5)若E与G以物质的量比为1:1投入足量水中,反应的离子方程式为 ;
(6)写出实验室检验F中阴离子的方法 。
23.某化学兴趣小组利用如图所示装置进行铁粉与水蒸气反应的实验,并检验产物的性质。请回答下列问题:
(1)装置A的作用是 ,装置D的作用是 。
(2)写出装置B中发生反应的化学方程式 。
(3)A、B、E装置中应先点燃 处的酒精灯,点燃E处酒精灯之前应进行的操作是 。
(4)铁粉与水蒸气发生了反应,则E处的实验现象是 。
【参考答案】
一、选择题
1.D
解析:A.金属钠熔点较低,将金属钠放在坩埚中加热,我们看到钠先熔化成光亮的小球,然后与空气中的氧气发生燃烧反应,火焰为黄色,燃烧后,生成淡黄色过氧化钠固体,A正确;
B.在酒精灯上加热用砂纸打磨过的铝箔,铝箔表面的Al与空气中的氧气反应产生熔点高的Al2O3,内部的Al受热熔化,但被熔点高的氧化铝包裹,因此铝箔变软,失去光泽,熔化的铝并不滴落,B正确;
C.在氯气中点燃氢气,我们看到H2能够在氯气中安静燃烧,火焰呈苍白色,C正确;
D.将水蒸气通过灼热的铁粉,二者发生反应产生黑色Fe3O4晶体,同时产生无色气体,D错误;
故合理选项是D。
2.B
解析:A.氯化铁溶液与铁反应生成氯化亚铁,铁元素由+3价变为+2价,故A错误;
B.铁在氯气中燃烧生成氯化铁,铁元素由0价变为+3价,故B正确;
C.铁与稀盐酸反应生成氯化亚铁和氢气,铁元素由0价变为+2价,故C错误;
D.铁与氯化钠溶液不反应,铁元素的化合价不可能变成+3价,故D错误;
故选B。
3.B
解析:A.三氯化铁溶液与铁粉反应生成氯化亚铁,离子方程式为,故A正确;
B.溶于水生成盐酸和次氯酸,次氯酸为弱酸,书写离子方程式不能拆开写,故离子方程式为,故B错误;
C.铝和烧碱氢氧化钠溶液反应生成偏铝酸钠和氢气,离子方程式为,故C正确;
D.石灰石和盐酸反应生成氯化钙、水和二氧化碳气体,离子方程式为,故D正确;
故选B。
4.B
解析:A.胆矾是硫酸铜,该过程中发生的反应是:,置换反应,故A不选;
B.合金的熔点低于任一组分的熔点,故B选;
C.古代酒、醋、酱油等通常是用粮食发酵酿制而成的,故C不选;
D.Cu(OH)2中铜的质量分数高于CuCO3中铜的质量分数,所以Cu(OH)2 CuCO3中铜的质量分数高于Cu(OH)2 2CuCO3,故D不选;
故选B。
5.D
解析:A.铜在空气中加热,铜被氧化为氧化铜,原物质被除去,故A错误;
B.铜和氧化铜都不溶于水,故B错误;
C.铜和氧化铜都不能与铁粉反应,故C错误;
D.铜与盐酸不反应,氧化铜与盐酸反应生成氯化铜和水,则加入足量的盐酸,充分反应后过滤即可除去铜粉中的氧化铜,故D正确;
故答案选D。
6.A
解析:A.钠与水反应生成氢氧化钠和氢气,反应的离子方程式是,故A正确;
B.氢氧化钡溶液与稀硫酸反应生成硫酸钡沉淀和水,反应的离子方程式是,故B错误;
C.氨水与氯化铜溶液反应生成氢氧化铜沉淀和氯化铵,反应的离子方程式是,故C错误;
D.氯气与氯化亚铁溶液反应生成氯化铁,反应的离子方程式是,故D错误;
选A。
7.A
解析:A.通入CO2,CO2不与以上几种离子反应,能大量共存,A正确;
B.Fe能与Fe3+反应,加入铁粉铁离子不能大量共存,B错误;
C.NaOH能与铁离子反应,加入NaOH铁离子不能大量共存,C错误;
D,硫酸根离子和钡离子能反应生成硫酸钡沉淀,加入ZnSO4,钡离子不能大量共存,D错误;
故答案选A。
8.C
解析:A.Fe与Fe3O4都能被磁铁吸引,不能用磁铁分离Fe与Fe3O4,故A错误;
B.该反应条件下生成钠气体,从反应体系中挥发出来,与还原性强弱无关,故B错误;
C.根据反应的方程式可知,每生成1molH2,同时生成2molNa,转移的电子为4mol,故C正确;
D.钠在空气中易被氧化为氧化钠,因此将生成的气体在空气中冷却不能获得钠,故D错误;
故答案选C。
9.A
解析:A.pH=1(酸性)的溶液中存在大量的氢离子,氢离子和Na+、、Cl-、K+,不反应,且其相互之间不反应,可共存,A正确;
B.二价铁是浅绿色的,另外,酸性条件下硝酸根离子可以将二价铁氧化为三价铁,不能共存,B错误;
C.酸性调价下,硝酸根离子可以将碘离子氧化为单质碘,不能共存,C错误;
D.碱性条件下,氢氧根离子可以和铵根离子反应生成一水合氨,不能共存,D错误;
故选A。
10.C
解析:FeSO4溶液具有强还原性,变质后变为硫酸铁,因此检验某FeSO4溶液是否变质,可向溶液中加入KSCN溶液,若溶液变为红色,则证明FeSO4溶液已变质,反之未变质;
故选C。
11.C
解析:A.溶液中铁离子水解生成氢氧化铁胶体,氢氧化铁胶体有吸附性,能吸附杂质,可用作净水剂,与其氧化性无关,A错误;
B.中含铁元素,可用作高炉炼铁的原料,与其磁性无关,B错误;
C.是红棕色固体,难溶于水,可用于制红色油漆,C正确;
D.铝热反应为铝和氧化铁在高温下反应生成铁和氧化铝,与铁的还原性无关,D错误;
答案选C。
12.B
解析:A.钠和水反应生成可燃性氢气,金属钠着火燃烧时不能用水灭火,A错误;
B.新制氯水中次氯酸见光受热易分解,故保存在棕色试剂瓶中并放置在阴凉处,B正确;
C.铁和水蒸气反应生成氢气,氢气具有可燃性,和空气混合点燃容易发生爆炸,故检验铁和水蒸气反应的气体产物时应先检验纯度再点燃,C错误;
D.稀释浓硫酸要把浓硫酸沿器壁慢慢注入水中并不断搅拌,D错误;
故选B。
13.B
解析:A.小苏打是碳酸氢钠的俗称,碳酸氢钠的化学式为NaHCO3,故A正确;
B.铁红是氧化铁的俗称,氧化铁的化学式为Fe2O3,故B错误;
C.软锰矿的主要成分为二氧化锰,二氧化锰的化学式为MnO2,故C正确;
D.漂粉精的有效成分为次氯酸钙,次氯酸钙的化学式为Ca(ClO)2,故D正确;
故选B。
14.D
解析:A.合金是混合物,合金要比组成其纯金属的熔点低、硬度大,铝合金是一种混合物,它比纯铝的硬度大,A正确;
B.铝易被氧化,铝合金应在溶剂层覆盖下熔炼,可隔绝空气,防止高温铝液被氧化,B正确;
C.镁铝合金中的铝能与氢氧化钠溶液反应,C正确;
D.镁、铝都能与盐酸反应,镁铝合金在盐酸中能溶解,D错误;
答案选D。
15.A
解析:A.浓盐酸与MnO2混合加热发生氧化还原反应产生Cl2,图示符合Cl2的制备装置,A正确;
B.Na2O2与H2O反应产生NaOH、O2快速溶解,不能实现“随开随用、随关随停”制备O2,B错误;
C.Fe与稀硫酸反应产生H2能够将装置中空气排出,但反应产生的FeSO4溶液不能进入到装置B中,因此不能制取得到Fe(OH)2,C错误;
D.H2SO4与Na2CO3反应产生CO2气体,将制取得到的CO2通入到盛有NaClO的溶液中会发生反应:CO2+H2O+NaClO=NaHCO3+HClO,但反应后溶液中我颜色变化,无沉淀生成,因此不能观察到明显的实验现象,因此不能证明酸性:H2CO3>HClO,D错误;
故合理选项是A。
二、填空题
16.(1)0.08 mol
(2)0.01 mol
解析:(1)反应中消耗的物质的量为;故答案为:0.08mol。
(2)根据题意建立方程式56n(Fe)+27n(Al)=1.1g,2n(Fe)+3n(Al)=0.08mol,解得n(Fe)=0.01mol,n(Al)=0.02mol,则该混合物中铁的物质的量为0.01mol;故答案为:0.01。
17. Fe FeCl2 KOH KCl Fe(OH)2 Fe(OH)3 FeCl3 AgCl Fe+2H+=Fe2++H2↑,Fe2++2OH-=Fe(OH)2↓,Ag++Cl-=AgCl↓,4Fe(OH)2+O2+2H2O=4Fe(OH)3,Fe(OH)3+3H+=Fe3++3H2O,2Fe3++Fe=3Fe2+
【分析】通过白色沉淀E在空气中转化为红褐色沉淀F,可以推知E为Fe(OH)2,F为Fe(OH)3,以此作为突破口进而推出其他物质。
解析:由白色沉淀E在空气中转化为红褐色沉淀F,可以推知E为Fe(OH)2,F为Fe(OH)3,则G为FeCl3;由D溶液中加入硝酸酸化的AgNO3溶液,产生白色沉淀H和溶液中含有K+可知,H为AgCl,则D为KCl;由B+CKCl+Fe(OH)2,可推知B、C为KOH和FeCl2,而G(FeCl3)+AB,可知B为FeCl2,C为KOH,并推知A为Fe,Fe与盐酸反应生成FeCl2和H2。故A为Fe,B为FeCl2,C为KOH,D为KCl,E为Fe(OH)2,F为Fe(OH)3,G为FeCl3,H为AgCl;涉及的离子方程式为Fe+2H+=Fe2++H2↑,Fe2++2OH-=Fe(OH)2↓,Ag++Cl-=AgCl↓,4Fe(OH)2+O2+2H2O=4Fe(OH)3,Fe(OH)3+3H+=Fe3++3H2O,2Fe3++Fe=3Fe2+。
【点睛】离子方程式书写的分为四步,第一步:正确写出反应的化学方程式,第二步:把易溶于水、易电离的物质拆写成离子形式,第三步:删去方程式两边不参加反应的离子,第四步:检查方程式两边的元素和电荷是否守恒。
18. 取少量清液,向其中滴加几滴溶液,观察溶液颜色是否呈血红色
解析:“酸浸”时酸过量,“酸浸”后的滤液中还含有大量,与铁粉反应生成;一般用溶液检验,操作为取少量清液,向其中滴加几滴溶液,观察溶液颜色是否呈血红色。
19.(1)C(2)E(3)D(4)A(5)B
解析:(1)氯气具有强氧化性,可用于自来水杀菌消毒,对应C;
(2)碳酸氢钠的水溶液呈弱碱性,能与酸反应,可用于治疗胃酸过多,且碳酸氢钠受热易分解,可作为发酵粉的成分,对应E;
(3)氧化铁为红棕色粉末,俗称铁红,可用于制作红色油漆的颜料,对应D;
(4)过氧化钠能与水或二氧化碳反应放出氧气,供人体呼吸,可用于呼吸面具中氧气来源,对应A;
(5)次氯酸钙是漂白粉精的有效成分,对应B;
故填(1)C(2)E(3)D(4)A(5)B;
20.2 L 14 g
解析:(1)的物质的量为=0.5mol,根据反应可知,消耗氧气的物质的量为0.5mol,则反应前需要标准状况下的体积为0.5mol×22.4L/mol=11.2L;
(2)根据(1)中计算分析,参与反应的的物质的量为0.5mol,根据反应可知,生成的的物质的量为0.5mol,则氮气的质量为0.5mol×28g/mol=14g。
21.36 100 11.65 0.2
【分析】Ⅰ.2.7gAl与的稀盐酸充分反应的计算,要根据化学方程式分析反应是否是恰好反应,然后才可以把相关数据代入计算。
Ⅱ根据溶液的均一性,分成两等份的溶液和原溶液成分是一样的,然后根据加入的BaCl2溶液的量可以求出生成沉淀BaSO4的量,进而求出其质量;第二份溶液中加入铁片,能和铁片反应的是Fe2(SO4)3,则可根据消耗的铁片的质量求出Fe2(SO4)3的量,从而求出其含有的的量,然后根据总共的物质的量则可求出K2SO4含有的物质的量,进而求出K+的浓度,据此解答。
解析:Ⅰ.2.7gAl与的稀盐酸充分反应,2.7g Al的物质的量为0.1mol,的稀盐酸含溶质HCl的物质的量为0.6mol,根据反应的关系式2Al~6HCl~3H2,可知盐酸是足量的,2 molAl和足量盐酸反应生成3 molH2,则0.1molAl和足量盐酸反应生成氢气n(H2)=0.15mol ,其在标准状况下生成氢气的体积为22.40.15mol=3.36L。
(2)用6.0mol/L盐酸配制盐酸,根据稀释规律,c(浓溶液),,可得6mol/L=3mol/LmL ,则=100mL,则需要量取6.0mol/L盐酸的体积为100 mL。
Ⅱ. (1)将和混合液分为两等份,则其中一份体积是200mL,与50mL 溶液恰好反应生成沉淀mg,则沉淀是BaSO4,根据关系式BaCl2~ BaSO4,可知n(BaSO4)=n(BaCl2)=0.05L1mol/L=0.05 mol,则其质量为m(BaSO4)= 0.05 mol233g/mol=11.65g。
(2) 向另一份溶液加入铁片,则发生的离子反应是Fe+2Fe3+=3 Fe2+,充分反应后,取出铁片,洗涤、烘干,称其质量比原来减轻了0.56g,也就是减少了0.01molFe ,根据离子方程式,可求出参加反应的Fe3+是0.02mol,根据关系式2Fe3+~3Fe2(SO4)3,可知一份溶液中Fe2(SO4)3含有的为0.03mol,经过(1)的计算,可知一份溶液中总共含有为0.05mol,则可知一份溶液中含有K2SO4的物质的量为0.02 mol,则n (K+)=0.04 mol,则c(K+)==0.2mol/L,每份溶液和原混合液浓度是一样的,因此原溶液中K+的物质的量浓度为0.2mol/L。
22. Fe(OH)3 2.408×1023 MnO2+4H++2Cl- Mn2++Cl2↑+2H2O 3Fe + 4H2O(g) Fe3O4 +4H2 4Fe2++4Na2O2 + 6H2O = 4Fe(OH)3↓+8Na+ + O2↑ 取少量F溶液于试管中,加入少量AgNO3溶液,若产生白色沉淀且加稀HNO3不溶解,则有Cl-
【分析】甲为常见金属单质,丙为黄绿色的单质气体,再根据E、F的转化关系得出甲为Fe,丙为Cl2,乙是无色气态非金属单质,C常温下为一种液体,B、D分别为黑色粉末和黑色晶体,说明C为水,D为四氧化三铁,乙为氢气,K为盐酸,E为氯化亚铁,F为氯化铁,G为淡黄色固体,I为红褐色固体,G为过氧化钠,I为氢氧化铁,J为生活中常见的调味品即为氯化钠,丁为氧气,①是实验室制取丁的反应之一,说明A为过氧化氢,B为二氧化锰。
解析:⑴根据上面分析得到物质I的化学式为Fe(OH)3;故答案为:Fe(OH)3。
⑵在反应①中,2H2O22H2O + O2↑,2mol转移2mol电子生成1mol氧气,当生成标准状况下丁气体4.48L即0.2mol,反应转移的电子物质的量为0.2mol,数目约为2.408×1023;故答案为:2.408×1023。
⑶二氧化锰与浓盐酸的反应是实验室制取丙的反应,其离子方程式为MnO2+4H++2Cl- Mn2++Cl2↑+2H2O;故答案为:MnO2+4H++2Cl- Mn2++Cl2↑+2H2O。
⑷反应②的化学方程式为3Fe + 4H2O(g) Fe3O4 +4H2;故答案为:3Fe + 4H2O(g) Fe3O4 +4H2。
⑸若E与G以物质的量比为1:1投入足量水中,反应的离子方程式为4Fe2++4Na2O2 + 6H2O = 4Fe(OH)3↓+8Na+ + O2↑;故答案为:4Fe2++4Na2O2 + 6H2O = 4Fe(OH)3↓+8Na+ + O2↑。
⑹实验室检验F中阴离子的方法取少量氯化铁溶液于试管中,加入少量AgNO3溶液,若产生白色沉淀且加稀HNO3不溶解,则有Cl-;故答案为:少量氯化铁溶液于试管中,加入少量AgNO3溶液,若产生白色沉淀且加稀HNO3不溶解,则有Cl-。
23.(1) 提供水蒸气 除去未反应的水蒸气(或干燥生成的气体)
(2)
(3) A 收集氢气验纯或检验氢气纯度
(4)黑色氧化铜枌末变红色
【分析】A处提供水蒸气,B处铁与水蒸气发生反应,C处冷凝水蒸气,D处干燥氢气,E处氢气还原氧化铜,注意要检验氢气的纯度防止发生爆炸。
解析:(1)铁与水蒸气反应的条件是高温,水的状态是气体,所以A装置的作用是提供水蒸气;E是氢气还原氧化铜的实验,气体进入E装置前要干燥,否则会有危险,硬质玻璃管可能炸裂,因此D的作用是除去未反应的水蒸气(或干燥生成的气体);
(2)装置B中是铁与水蒸气反应生成氢气和四氧化三铁,反应的方程式为;
(3)若先点燃B处,铁会与氧气发生反应,所以须先点燃A处;氢气是可燃性气体混有空气会发生爆炸,任何可燃性气体都有爆炸极限,所以点燃E处酒精灯之前应进行的操作是收集H2并检验其纯度,具体操作为:收集一试管气体,将试管口靠近酒精灯火焰,若发出噗的声音,说明气体纯净;若发生尖锐爆鸣声,说明气体不纯;
(4)氢气还原氧化铜得到铜和水,即H2+CuOCu+H2O,所以E中的实验现象是硬质玻璃管中黑色氧化铜枌末变红色
