3.2 金属材料 同步练习题 (含解析)2023-2024学年高一上学期化学人教版(2019)必修第一册
文档属性
| 名称 | 3.2 金属材料 同步练习题 (含解析)2023-2024学年高一上学期化学人教版(2019)必修第一册 |  | |
| 格式 | docx | ||
| 文件大小 | 298.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-15 19:57:53 | ||
图片预览


文档简介
3.2 金属材料 同步练习题
一、选择题
1.联合国卫生组织认为我国的铁锅是一种理想的炊具而向世界推广。其主要原因是
A.升热慢,退热也慢,保温效果好
B.烹饪的食物中含有丰富的“铁质”
C.生产过程简单,价格便宜
D.生铁中含有碳元素,因而含有对人体有益的有机物
2.两份铝片,一份与足量盐酸反应,另一份与足量烧碱溶液反应,同温、同压下,放出的气体体积比为1:2,则两份铝片的质量之比为
A.1:2 B.2:3 C.3:2 D.1:6
3.将1.76g铜镁合金完全溶解于50mL物质的量浓度为12mol/L的浓硝酸中,得到NO2和N2O4的混合气体1120mL (标准状况),向反应后的溶液中加入1.0mol/LNaOH溶液,当金属离子全部沉淀时,得到3.12g沉淀。下列说法不正确的是
A.反应过程中转移电子物质的量为0.08mol
B.NO2和N2O4的混合气体中,NO2的体积分数是40%
C.该合金中铜与镁的物质的量之比是1:1
D.得到3.12g沉淀时,加入NaOH溶液的体积是550mL
4.下列反应的离子方程式书写正确的是
A.铁粉加入盐酸:
B.浓烧碱溶液中加入铝片:
C.碳酸钙粉末加入稀盐酸:
D.过氧化钠加入水中:
5.化学在生产和日常生活中有重要的应用。下列说法不正确的是
A.目前我国流通的硬币是由合金材料制造的
B.合金的熔点一般比其成分金属的熔点高
C.青铜是我国使用最早的合金材料,目前世界上使用量最大的合金材料是钢铁
D.铝比铁活泼,但在空气中铝制品比铁制品耐腐蚀
6.日常生活中使用的钥匙是由铝合金制成的,而不是由纯铝所制,这主要是因为铝合金的( )
A.熔点低 B.耐腐蚀性强 C.硬度大 D.密度小
7.下列关于合金的说法中,不正确的是
A.合金的熔点一般比各成分金属的低
B.钢的含碳量为0.03%~2%
C.铝合金是目前用量最大、用途最广的合金
D.在合金中加入适量的稀土金属,能大大改善合金的性能
8.下列有关物质的性质与用途具有对应关系的是
A.是两性氧化物,可用作耐高温材料
B.受热易分解,可用作氮肥
C.明矾易溶于水,可用作净水剂
D.有强氧化性,可用于漂白
二、非选择题
9.含有氧化钠的钠块与足量水充分反应,产生的气体在标准状况下体积为。回答下列问题:
(1)钠与水反应的离子方程式为 。
(2)产生的气体的物质的量为 。
(3)列式计算钠块中氧化钠和钠单质的物质的量之比 。
10.根据图像中的信息先确定反应物和生成物,然后根据图像中各物质量的关系确定反应物和生成物的计量关系。如向密闭容器中加入0.2molH2S,反应在不同温度(900~1500℃)下达到平衡时,混合气体中各组分的体积分数如图所示,则在此温度区间内,H2S热分解反应的化学方程式为 。
11.在加热的条件下,用MnO2与100 mL物质的量浓度为12 mol/L的浓盐酸反应,制得氯气2.24 L(标准状况)。(已知MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O)
(1)需要消耗MnO2的质量是多少?
(2)被氧化的HCl的物质的量是多少?
(3)反应中氧化产物与还原产物的物质的量之比是多少?
(4)若反应后溶液的体积不变,则反应后溶液中Cl-的物质的量浓度是多少?
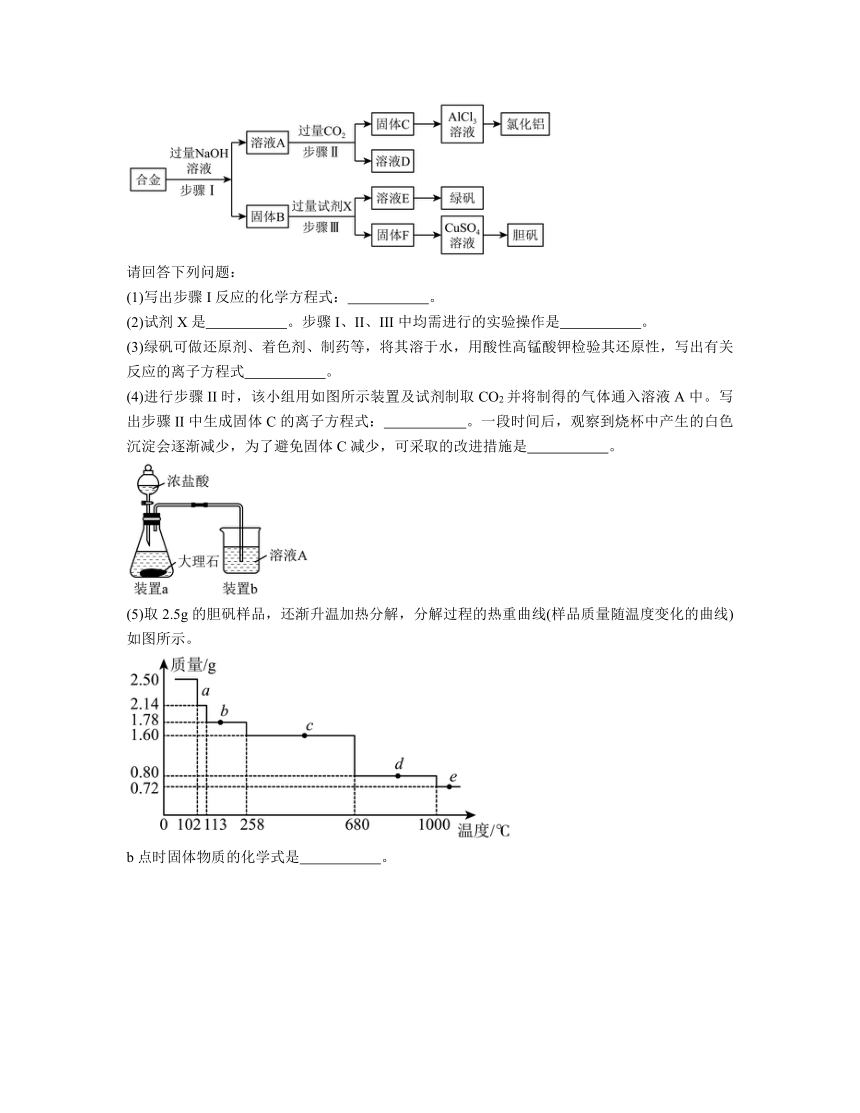
12.为探索工业废料的再利用,某化学兴趣小组设计了如图所示实验流程,用含有铝、铁和铜的合金废料制取氯化铝。绿矾晶体(FeSO4·7H2O)和胆矾晶体。(已知固体C为氢氧化铝)
请回答下列问题:
(1)写出步骤I反应的化学方程式: 。
(2)试剂X是 。步骤I、II、III中均需进行的实验操作是 。
(3)绿矾可做还原剂、着色剂、制药等,将其溶于水,用酸性高锰酸钾检验其还原性,写出有关反应的离子方程式 。
(4)进行步骤II时,该小组用如图所示装置及试剂制取CO2并将制得的气体通入溶液A中。写出步骤II中生成固体C的离子方程式: 。一段时间后,观察到烧杯中产生的白色沉淀会逐渐减少,为了避免固体C减少,可采取的改进措施是 。
(5)取2.5g的胆矾样品,还渐升温加热分解,分解过程的热重曲线(样品质量随温度变化的曲线)如图所示。
b点时固体物质的化学式是 。
【参考答案】
一、选择题
1.B
解析:A.铁锅吸热快、散热快,保温效果不好,A错误;
B.使用铁锅烹饪的食物中有人体需要的铁元素,可以预防缺铁性贫血,B正确;
C.铁锅是一种理想的炊具而向世界推广,结合B分析可知生产过程和价格不是主要原因,C错误;
D.生铁中含有碳元素,但是不含对人体有益的有机物,D错误;
答案选B。
2.A
解析:铝不管和盐酸或氢氧化钠反应,都生成氢气,根据电子守恒关系分析,等量的铝产生等量的氢气,故放出的气体体积比为1:2,则铝的质量比为1:2。
故选A。
3.D
【分析】n(NO2)+n(N2O4)==0.05mol,m(OH-)=3.12g-1.76g=1.36g,n(OH-)==0.08mol。设Cu的物质的量为x,则Mg的物质的量为(0.04-x),从而得出64x+24(0.04-x)=1.76,x=0.02mol,0.04-x=0.02mol;设NO2的物质的量为y,则N2O4的物质的量为(0.05-y),依据得失电子守恒可得y+2(0.05-y)=0.08,y=0.02mol。
解析:A.由关系式Cu——2e-——2OH-、Mg——2e-——2OH-可知,反应过程中转移电子物质的量与生成沉淀中OH-的物质的量相等,即为0.08mol,A正确;
B.由分析可知,NO2和N2O4的混合气体中,NO2的物质的量为0.02mol,而混合气的总物质的量为0.05mol,则NO2的体积分数是=40%,B正确;
C.由分析可知,该合金中,铜与镁的物质的量都为0.02mol,则二者的物质的量之比是1:1,C正确;
D.反应最终所得溶液中,溶质为NaNO3,则n(NaOH)=n(HNO3)-n(NO2)-2n(N2O4)= 0.050L× 12mol/L-0.02mol-2×0.03mol=0.52mol,所以加入NaOH溶液的体积是=520mL,D不正确;
故选D。
4.D
解析:A.铁粉加入盐酸反应生成氯化亚铁和氢气,离子方程式为:,故A错误;
B.浓烧碱溶液中加入铝片,反应生成偏铝酸钠和氢气,离子方程式必须满足电荷守恒,正确的离子方程式为:2Al+2OH-+2H2O═2+3H2↑,故B错误;
C.碳酸钙是难溶物,应保留化学式,离子方程式为:,故C错误;
D.过氧化钠和水反应生成NaOH和氧气,离子方程式为:,故D正确;
故选:D。
5.B
解析:A.硬币是由不锈钢、铁芯镀铜、铁芯镀镍等合金材料制造的,A正确;
B.合金的熔点一般比其成分金属的熔点低,硬度大,B错误;
C.青铜是我国使用最早的合金材料,商朝的司马鼎等,目前世界上使用量最大的合金材料是钢铁,C正确;
D.虽然铝的金属活动性大于铁的,但铝表面容易被空气氧化为致密的氧化物薄膜,从而使其更耐腐蚀,D正确;
故选B。
6.C
解析:单质铝的硬度较小,而作为钥匙的材料,需要硬度较大,所以铝合金代替纯铝制作钥匙主要是因为铝合金的硬度大,故答案为C。
7.C
解析:A.合金的熔点一般比各成分金属的低,如钠钾合金常温下呈液态,A正确;
B.钢是铁和碳的合金,含碳量为0.03%~2%,B正确;
C.钢是用量最大、用途最广的合金,不是铝合金,C错误;
D.在合金中加入适量的稀土金属,能大大改善合金的性能,因此稀土元素被 称为冶金工业的维生素,D正确;
故选C。
8.D
解析:A.熔点高,受热不易熔化,可用作耐高温材料,不具有对应关系,A不符合题意;
B.含有N元素可用作氮肥, B不符合题意;
C.明矾易溶于水,生成氢氧化铝胶体具有吸附性,可用作净水剂, C不符合题意;
D.有强氧化性,可用于漂白,具有对应关系,D符合题意;
故选D。
二、非选择题
9.(1)
(2)0.01
(3)1:1
解析:(1)钠与水反应生成氢氧化钠和氢气,离子方程式为。
(2)产生的气体为氢气,物质的量为。
(3)根据可知,钠的物质的量为0.01mol,质量为,则,故钠块中氧化钠和钠单质的物质的量之比1:1。
10.2H2S2H2+S2
解析:图中纵轴表示各组分的体积分数,的分解反应为吸热反应,随着温度升高,体积分数减小的是反应物,体积分数增大的是生成物单质硫和氢气;选择时的数据进行分析,的体积分数为,此时生成的两种单质的体积分数分别为、,若将单质硫写为“”,则与氢气的体积分数应该相等,若将单质硫写为双原子分子“”,则氢气的体积分数为“”的两倍,故热分解反应的化学方程式为。
11.(1)8.7 g (2)0.2 mol (3)1∶1 (4)10 mol·L-1
解析:(1)根据n=,可得 n(Cl2)= = 0.1mol,根据MnO2+4HCl (浓) MnCl2+Cl2↑+2H2O,可得MnO2~Cl2,n(MnO2)=n(Cl2)=0.1mol,m(MnO2)=nM=0.1mol×87g/mol=8.7g;
(2)因Cl元素的化合价升高时被氧化,氧化产物为氯气,则被氧化的HCl的物质的量n=2n (Cl2) =2×0.1mol=0.2mol;
(3)反应中若有4mol浓HCl被消耗,其中2molHCl被氧化,得到1mol氯气,为氧化产物;1mol二氧化锰被还原,得到1mol氯化锰,作还原产物,则氧化产物与还原产物的物质的量之比1:1;
(4)反应后溶液中的Cl减少了2×n (Cl2) =0.2mol,反应后溶液中n (Cl-) =12mol/L×0.1L-0.2mol= 1.0mol,则c(Cl-)== = 10 mol·L-1。
12.(1)
(2) 稀硫酸 过滤
(3)5Fe2++MnO+8H+=5Fe3++ Mn2++4H2O
(4) 将生成二氧化碳气体通过饱和碳酸氢钠溶液
(5)CuSO4 H2O
【分析】含有铝、铁和铜的合金加入过量氢氧化钠,铜、铁不反应进入固体B,B加入过量稀硫酸,铜不反应进入固体F,最终生成胆矾,铁和稀硫酸反应生成硫酸亚铁,最终生成绿矾;铝和氢氧化铝生成偏铝酸钠进入A,通入过量二氧化碳生成氢氧化铝沉淀C,氢氧化铝和盐酸反应生成氯化铝。
解析:(1)步骤I反应为铝和氢氧化钠生成偏铝酸钠和氢气,
(2)由分析可知,试剂X是稀硫酸。步骤I、II、III中均为分离固液的操作,操作是过滤。
(3)用酸性高锰酸钾检验其还原性,反应为高锰酸根离子和亚铁离子生成铁离子和锰离子,5Fe2++MnO+8H+=5Fe3++ Mn2++4H2O。
(4)溶液A中含有过量的氢氧化钠和生成的偏铝酸钠,制取二氧化碳使用浓盐酸,导致生成二氧化碳气体中含有挥发出的氯化氢气体;过量CO2气体通入溶液A中,生成固体C氢氧化铝沉淀的反应为二氧化碳和偏铝酸根离子生成氢氧化铝沉淀和碳酸氢根离子,;一段时间后,观察到烧杯中产生的白色沉淀会逐渐减少,是因为氯化氢和氢氧化铝沉淀生成氯化铝和水,为了避免固体C减少,可采取的改进措施是将生成二氧化碳气体通过饱和碳酸氢钠溶液除去氯化氢气体。
(5)胆矾为CuSO4 5H2O,2.5g的胆矾样品的物质的量为,结晶水的物质的量为0.05mol,加热首先失去结晶水,b点时减少质量为2.50-1.78=0.72g,失去结晶H2O的物质的量为,则b点时固体物质的化学式是CuSO4 H2O
一、选择题
1.联合国卫生组织认为我国的铁锅是一种理想的炊具而向世界推广。其主要原因是
A.升热慢,退热也慢,保温效果好
B.烹饪的食物中含有丰富的“铁质”
C.生产过程简单,价格便宜
D.生铁中含有碳元素,因而含有对人体有益的有机物
2.两份铝片,一份与足量盐酸反应,另一份与足量烧碱溶液反应,同温、同压下,放出的气体体积比为1:2,则两份铝片的质量之比为
A.1:2 B.2:3 C.3:2 D.1:6
3.将1.76g铜镁合金完全溶解于50mL物质的量浓度为12mol/L的浓硝酸中,得到NO2和N2O4的混合气体1120mL (标准状况),向反应后的溶液中加入1.0mol/LNaOH溶液,当金属离子全部沉淀时,得到3.12g沉淀。下列说法不正确的是
A.反应过程中转移电子物质的量为0.08mol
B.NO2和N2O4的混合气体中,NO2的体积分数是40%
C.该合金中铜与镁的物质的量之比是1:1
D.得到3.12g沉淀时,加入NaOH溶液的体积是550mL
4.下列反应的离子方程式书写正确的是
A.铁粉加入盐酸:
B.浓烧碱溶液中加入铝片:
C.碳酸钙粉末加入稀盐酸:
D.过氧化钠加入水中:
5.化学在生产和日常生活中有重要的应用。下列说法不正确的是
A.目前我国流通的硬币是由合金材料制造的
B.合金的熔点一般比其成分金属的熔点高
C.青铜是我国使用最早的合金材料,目前世界上使用量最大的合金材料是钢铁
D.铝比铁活泼,但在空气中铝制品比铁制品耐腐蚀
6.日常生活中使用的钥匙是由铝合金制成的,而不是由纯铝所制,这主要是因为铝合金的( )
A.熔点低 B.耐腐蚀性强 C.硬度大 D.密度小
7.下列关于合金的说法中,不正确的是
A.合金的熔点一般比各成分金属的低
B.钢的含碳量为0.03%~2%
C.铝合金是目前用量最大、用途最广的合金
D.在合金中加入适量的稀土金属,能大大改善合金的性能
8.下列有关物质的性质与用途具有对应关系的是
A.是两性氧化物,可用作耐高温材料
B.受热易分解,可用作氮肥
C.明矾易溶于水,可用作净水剂
D.有强氧化性,可用于漂白
二、非选择题
9.含有氧化钠的钠块与足量水充分反应,产生的气体在标准状况下体积为。回答下列问题:
(1)钠与水反应的离子方程式为 。
(2)产生的气体的物质的量为 。
(3)列式计算钠块中氧化钠和钠单质的物质的量之比 。
10.根据图像中的信息先确定反应物和生成物,然后根据图像中各物质量的关系确定反应物和生成物的计量关系。如向密闭容器中加入0.2molH2S,反应在不同温度(900~1500℃)下达到平衡时,混合气体中各组分的体积分数如图所示,则在此温度区间内,H2S热分解反应的化学方程式为 。
11.在加热的条件下,用MnO2与100 mL物质的量浓度为12 mol/L的浓盐酸反应,制得氯气2.24 L(标准状况)。(已知MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O)
(1)需要消耗MnO2的质量是多少?
(2)被氧化的HCl的物质的量是多少?
(3)反应中氧化产物与还原产物的物质的量之比是多少?
(4)若反应后溶液的体积不变,则反应后溶液中Cl-的物质的量浓度是多少?
12.为探索工业废料的再利用,某化学兴趣小组设计了如图所示实验流程,用含有铝、铁和铜的合金废料制取氯化铝。绿矾晶体(FeSO4·7H2O)和胆矾晶体。(已知固体C为氢氧化铝)
请回答下列问题:
(1)写出步骤I反应的化学方程式: 。
(2)试剂X是 。步骤I、II、III中均需进行的实验操作是 。
(3)绿矾可做还原剂、着色剂、制药等,将其溶于水,用酸性高锰酸钾检验其还原性,写出有关反应的离子方程式 。
(4)进行步骤II时,该小组用如图所示装置及试剂制取CO2并将制得的气体通入溶液A中。写出步骤II中生成固体C的离子方程式: 。一段时间后,观察到烧杯中产生的白色沉淀会逐渐减少,为了避免固体C减少,可采取的改进措施是 。
(5)取2.5g的胆矾样品,还渐升温加热分解,分解过程的热重曲线(样品质量随温度变化的曲线)如图所示。
b点时固体物质的化学式是 。
【参考答案】
一、选择题
1.B
解析:A.铁锅吸热快、散热快,保温效果不好,A错误;
B.使用铁锅烹饪的食物中有人体需要的铁元素,可以预防缺铁性贫血,B正确;
C.铁锅是一种理想的炊具而向世界推广,结合B分析可知生产过程和价格不是主要原因,C错误;
D.生铁中含有碳元素,但是不含对人体有益的有机物,D错误;
答案选B。
2.A
解析:铝不管和盐酸或氢氧化钠反应,都生成氢气,根据电子守恒关系分析,等量的铝产生等量的氢气,故放出的气体体积比为1:2,则铝的质量比为1:2。
故选A。
3.D
【分析】n(NO2)+n(N2O4)==0.05mol,m(OH-)=3.12g-1.76g=1.36g,n(OH-)==0.08mol。设Cu的物质的量为x,则Mg的物质的量为(0.04-x),从而得出64x+24(0.04-x)=1.76,x=0.02mol,0.04-x=0.02mol;设NO2的物质的量为y,则N2O4的物质的量为(0.05-y),依据得失电子守恒可得y+2(0.05-y)=0.08,y=0.02mol。
解析:A.由关系式Cu——2e-——2OH-、Mg——2e-——2OH-可知,反应过程中转移电子物质的量与生成沉淀中OH-的物质的量相等,即为0.08mol,A正确;
B.由分析可知,NO2和N2O4的混合气体中,NO2的物质的量为0.02mol,而混合气的总物质的量为0.05mol,则NO2的体积分数是=40%,B正确;
C.由分析可知,该合金中,铜与镁的物质的量都为0.02mol,则二者的物质的量之比是1:1,C正确;
D.反应最终所得溶液中,溶质为NaNO3,则n(NaOH)=n(HNO3)-n(NO2)-2n(N2O4)= 0.050L× 12mol/L-0.02mol-2×0.03mol=0.52mol,所以加入NaOH溶液的体积是=520mL,D不正确;
故选D。
4.D
解析:A.铁粉加入盐酸反应生成氯化亚铁和氢气,离子方程式为:,故A错误;
B.浓烧碱溶液中加入铝片,反应生成偏铝酸钠和氢气,离子方程式必须满足电荷守恒,正确的离子方程式为:2Al+2OH-+2H2O═2+3H2↑,故B错误;
C.碳酸钙是难溶物,应保留化学式,离子方程式为:,故C错误;
D.过氧化钠和水反应生成NaOH和氧气,离子方程式为:,故D正确;
故选:D。
5.B
解析:A.硬币是由不锈钢、铁芯镀铜、铁芯镀镍等合金材料制造的,A正确;
B.合金的熔点一般比其成分金属的熔点低,硬度大,B错误;
C.青铜是我国使用最早的合金材料,商朝的司马鼎等,目前世界上使用量最大的合金材料是钢铁,C正确;
D.虽然铝的金属活动性大于铁的,但铝表面容易被空气氧化为致密的氧化物薄膜,从而使其更耐腐蚀,D正确;
故选B。
6.C
解析:单质铝的硬度较小,而作为钥匙的材料,需要硬度较大,所以铝合金代替纯铝制作钥匙主要是因为铝合金的硬度大,故答案为C。
7.C
解析:A.合金的熔点一般比各成分金属的低,如钠钾合金常温下呈液态,A正确;
B.钢是铁和碳的合金,含碳量为0.03%~2%,B正确;
C.钢是用量最大、用途最广的合金,不是铝合金,C错误;
D.在合金中加入适量的稀土金属,能大大改善合金的性能,因此稀土元素被 称为冶金工业的维生素,D正确;
故选C。
8.D
解析:A.熔点高,受热不易熔化,可用作耐高温材料,不具有对应关系,A不符合题意;
B.含有N元素可用作氮肥, B不符合题意;
C.明矾易溶于水,生成氢氧化铝胶体具有吸附性,可用作净水剂, C不符合题意;
D.有强氧化性,可用于漂白,具有对应关系,D符合题意;
故选D。
二、非选择题
9.(1)
(2)0.01
(3)1:1
解析:(1)钠与水反应生成氢氧化钠和氢气,离子方程式为。
(2)产生的气体为氢气,物质的量为。
(3)根据可知,钠的物质的量为0.01mol,质量为,则,故钠块中氧化钠和钠单质的物质的量之比1:1。
10.2H2S2H2+S2
解析:图中纵轴表示各组分的体积分数,的分解反应为吸热反应,随着温度升高,体积分数减小的是反应物,体积分数增大的是生成物单质硫和氢气;选择时的数据进行分析,的体积分数为,此时生成的两种单质的体积分数分别为、,若将单质硫写为“”,则与氢气的体积分数应该相等,若将单质硫写为双原子分子“”,则氢气的体积分数为“”的两倍,故热分解反应的化学方程式为。
11.(1)8.7 g (2)0.2 mol (3)1∶1 (4)10 mol·L-1
解析:(1)根据n=,可得 n(Cl2)= = 0.1mol,根据MnO2+4HCl (浓) MnCl2+Cl2↑+2H2O,可得MnO2~Cl2,n(MnO2)=n(Cl2)=0.1mol,m(MnO2)=nM=0.1mol×87g/mol=8.7g;
(2)因Cl元素的化合价升高时被氧化,氧化产物为氯气,则被氧化的HCl的物质的量n=2n (Cl2) =2×0.1mol=0.2mol;
(3)反应中若有4mol浓HCl被消耗,其中2molHCl被氧化,得到1mol氯气,为氧化产物;1mol二氧化锰被还原,得到1mol氯化锰,作还原产物,则氧化产物与还原产物的物质的量之比1:1;
(4)反应后溶液中的Cl减少了2×n (Cl2) =0.2mol,反应后溶液中n (Cl-) =12mol/L×0.1L-0.2mol= 1.0mol,则c(Cl-)== = 10 mol·L-1。
12.(1)
(2) 稀硫酸 过滤
(3)5Fe2++MnO+8H+=5Fe3++ Mn2++4H2O
(4) 将生成二氧化碳气体通过饱和碳酸氢钠溶液
(5)CuSO4 H2O
【分析】含有铝、铁和铜的合金加入过量氢氧化钠,铜、铁不反应进入固体B,B加入过量稀硫酸,铜不反应进入固体F,最终生成胆矾,铁和稀硫酸反应生成硫酸亚铁,最终生成绿矾;铝和氢氧化铝生成偏铝酸钠进入A,通入过量二氧化碳生成氢氧化铝沉淀C,氢氧化铝和盐酸反应生成氯化铝。
解析:(1)步骤I反应为铝和氢氧化钠生成偏铝酸钠和氢气,
(2)由分析可知,试剂X是稀硫酸。步骤I、II、III中均为分离固液的操作,操作是过滤。
(3)用酸性高锰酸钾检验其还原性,反应为高锰酸根离子和亚铁离子生成铁离子和锰离子,5Fe2++MnO+8H+=5Fe3++ Mn2++4H2O。
(4)溶液A中含有过量的氢氧化钠和生成的偏铝酸钠,制取二氧化碳使用浓盐酸,导致生成二氧化碳气体中含有挥发出的氯化氢气体;过量CO2气体通入溶液A中,生成固体C氢氧化铝沉淀的反应为二氧化碳和偏铝酸根离子生成氢氧化铝沉淀和碳酸氢根离子,;一段时间后,观察到烧杯中产生的白色沉淀会逐渐减少,是因为氯化氢和氢氧化铝沉淀生成氯化铝和水,为了避免固体C减少,可采取的改进措施是将生成二氧化碳气体通过饱和碳酸氢钠溶液除去氯化氢气体。
(5)胆矾为CuSO4 5H2O,2.5g的胆矾样品的物质的量为,结晶水的物质的量为0.05mol,加热首先失去结晶水,b点时减少质量为2.50-1.78=0.72g,失去结晶H2O的物质的量为,则b点时固体物质的化学式是CuSO4 H2O
