3.2铁合金铝和铝合金 新型合金课件(共25张PPT)2023-2024学年高一上学期化学人教版(2019)必修第一册
文档属性
| 名称 | 3.2铁合金铝和铝合金 新型合金课件(共25张PPT)2023-2024学年高一上学期化学人教版(2019)必修第一册 |

|
|
| 格式 | pptx | ||
| 文件大小 | 2.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-15 00:00:00 | ||
图片预览






文档简介
(共25张PPT)
第三章 铁 金属材料a
第1课时 铁合金 铝和铝合金 新型合金
人教版化学必修第1册
第二节 金属材料
金属材料:包括纯金属和合金
1、大多数金属为银白色(铜:紫红色,金:黄色)固体(汞:液体)
2、有金属光泽
3、具有导电性、导热性和延展性
金属特性:
合金:两种或两种以上的金属(或金属跟非金属)熔
合而成的具有金属特性的物质。
合金具有许多优良的物理、化学或机械性能。
硬度大于各成分金属
熔点低于各成分金属
一般来说,
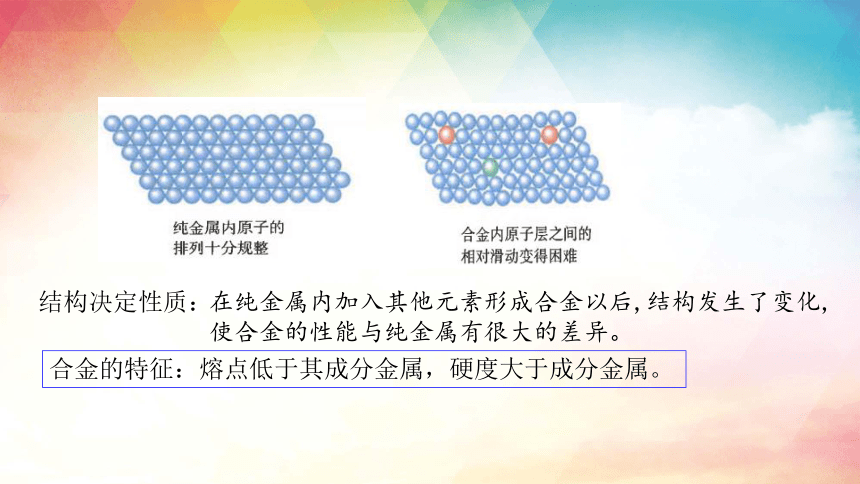
结构决定性质:
在纯金属内加入其他元素形成合金以后,结构发生了变化,使合金的性能与纯金属有很大的差异。
合金的特征:熔点低于其成分金属,硬度大于成分金属。
生铁
钢
(含碳量在2%~4.3%之间,还含硅、锰及少量硫、磷 )
碳素钢
{
低碳钢
(含碳0.3%~0.6%)
高碳钢
(含碳0.03%~0.3%)
中碳钢
(含碳0.6%~2% )
合金钢: 也叫特种钢在碳素钢中加入铬、锰、钨、
镍、钼、钴等一种或几种元素,组织结构发生
变化,从而使钢具有各种特殊性能
0.03%~2%
铁合金
铁合金的分类:
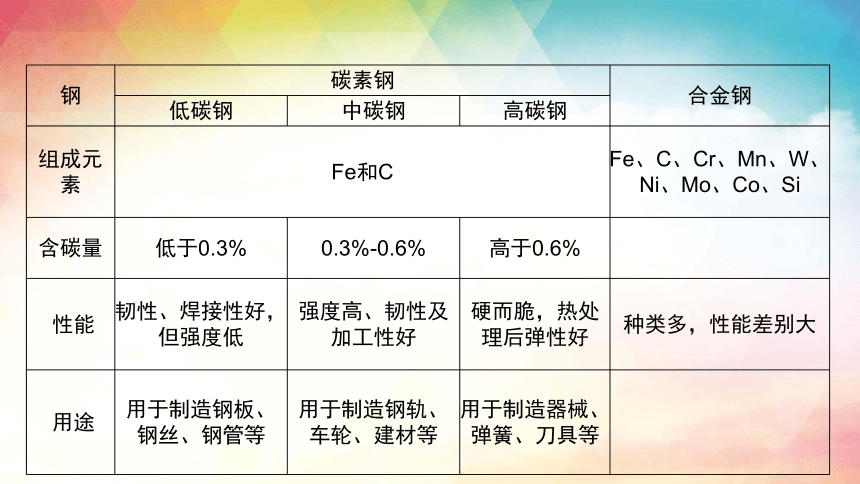
钢 碳素钢 合金钢
低碳钢 中碳钢 高碳钢
组成元素 Fe和C Fe、C、Cr、Mn、W、Ni、Mo、Co、Si
含碳量 低于0.3% 0.3%-0.6% 高于0.6%
性能 韧性、焊接性好,但强度低 强度高、韧性及加工性好 硬而脆,热处理后弹性好 种类多,性能差别大
用途 用于制造钢板、钢丝、钢管等 用于制造钢轨、车轮、建材等 用于制造器械、弹簧、刀具等
性能:在大气中比较稳定,不容易生锈,具有很强的抗腐蚀能力。
用途:生活中常见的医疗器材、厨房用具和餐具等,很多都是用
不锈钢制造的;有些地铁列车的车体材质也是不锈钢。
合金元素:主要是 铬 (Cr)和镍 (Ni )
不锈钢
铝和铝合金
4Al+3O2 ===2Al2O3
1、铝的物理性质
银白色金属、密度小、质软,熔点低、良好的导电导热性和延展性。
2、铝在地壳中的含量
地壳中含量最高的金属元素
3、铝的化学性质
铝是一种活泼金属,易失去电子,常温下被空气中的氧气氧化
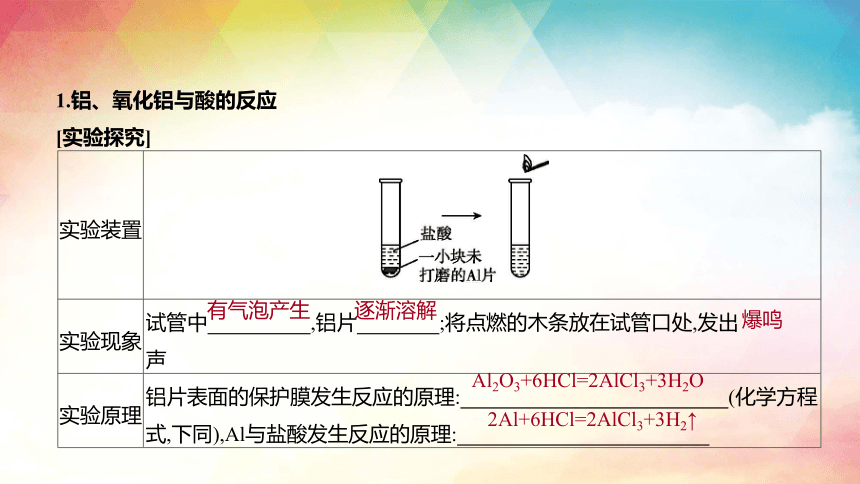
实验装置
实验现象 试管中 ,铝片 ;将点燃的木条放在试管口处,发出 声
实验原理 铝片表面的保护膜发生反应的原理: (化学方程式,下同),Al与盐酸发生反应的原理:
1.铝、氧化铝与酸的反应
[实验探究]
Al2O3+6HCl=2AlCl3+3H2O
有气泡产生
逐渐溶解
爆鸣
2Al+6HCl=2AlCl3+3H2↑
2.铝、氧化铝与碱的反应
[实验探究]
实验装置 实验1 实验2
实验现象 试管中 气泡,一段时间后 气泡,铝片 ;将点燃的木 条放在试管口处,发出 声 试管中 气泡,铝片 ;将点燃的木条放在试管口处,发出 声
开始没有
产生
溶解
爆鸣
立即产生
溶解
爆鸣
实验装置 实验1 实验2
实验 原理 反应的化学方程式: 、 化学方程式:
Al2O3+2NaOH=2NaAlO2+H2O
2Al+2NaOH+2H2O=2NaAlO2+3H2↑
2Al+2NaOH+2H2O=2NaAlO2+3H2↑
实验装置 实验1 实验2
实验 原理 离子方程式: 、 离子方程式:
既能与酸反应生成盐和水,又能与碱反应生成盐和水的氧化物,例如Al2O3。
【应用】由于Al和 A12O3均能与酸、碱反应,因此铝制餐具不宜用来蒸煮或长时间存放酸性或碱性食物。
两性氧化物:
新型合金
储氢合金
思考:
(1)氢能的利用关键要解决什么问题?
(2)储氢合金的储氢原理是什么
储氢合金是一类能够大量吸收H2,并与H2结合成金属氢化物的材料。
安全储存和运输问题
要求:储氢量大, 金属氢化物既容易形成,稍稍加热又容易分解,室温下吸、 放氢的速率快。
钛合金
镍钴合金
第三章 铁 金属材料a
第2课时 物质的量应用于化学方程式的计算
人教版化学必修第1册
第二节 金属材料
化学方程式中化学计量数与各物质之间量的关系
·化学方程式是表示物质间发生化学反应的式子,它必须遵循质量守恒定律,即在反应前后质量守恒、原子种类和数目守恒。在化学方程式中,可反映出物质的质量关系、粒子数目关系、物质的量关系等。例如:
2Na + ═ ↑
质量之比: 46 g∶ 36 g ∶ 80 g ∶ 2 g
化学计量数之比 2 ∶ 2 ∶ 2 ∶ 1
扩大倍: ∶ ∶ ∶
物质的量之比: 2 mol∶ 2 mol ∶ 2 mol ∶ 1 mol
·归纳总结
化学方程式中化学计量数之比等于粒子数之比,也等于物质的量之比。物质的量又可将物质的质量、物质的量浓度、气体体积联系起来融入计算之中。
一 物质的量在化学方程式计算中的应用
例题解析
[例1] 把6.5 g Zn放入足量盐酸中,锌完全反应。计算:
(1)6.5 g Zn的物质的量;
(2)参加反应的HCl的物质的量;
(3)生成的体积(标准状况)。
[分析]根据物质的量、质量和摩尔质量的关系,先计算出6.5 g Zn的物质的量,然后根据化学反应中各物质之间的化学计量数之比,计算出参加反应的HCl的物质的量和生成的体积(标准状况)。
(1)Zn的摩尔质量是65 g·。
n(Zn)===0.1 mol
(2)Zn + 2HCl═↑
1 2
0.1 mol n(HCl)
=
n(HCl)==0.2 mol
(3)Zn + 2HCl═↑
1 mol 22.4 L
0.1 mol
=
==2.24 L
答:(1)6.5 g Zn的物质的量是0.1 mol;
(2)有0.2 mol HCl参加了反应;
(3)生成的体积在标准状况下是2.24 L。
归纳总结
·物质的量用于化学方程式的计算题,一般应遵循下列步骤:
1.写出化学方程式或离子方程式(要确保正确)。
2.在物质化学式的下面列出四个相关量。
某物质A的未知量,可用m(A)、n(A)、V(A)这样的物理量符号表示,也可用x、y这样的字母表示。
在列出的四个相关量中,必须符合“左右量值相当,上下单位相同”原则,否则就是错的。“左右量值相当”,如在上述例题中,1 mol Zn与标准状况下22.4 L (也是1 mol )相当,65 g Zn(也是1 mol Zn)与标准状况下22.4 L 相当。
3.用列出的四个相关量组成比例式或比例式的变式,求出未知量。
4.写出答案。
例1
关系式法
当已知物和未知物之间是靠多个反应来联系时只需直接确定已知量和未知量之间的比例关系,即“关系式”。
·根据化学方程式确定关系式。写出发生反应的化学方程式,根据量的关系写出关系式。例如,把CO还原生成的通入澄清石灰水中,求生成沉淀的量。发生反应的化学方程式如下:
═↓
则关系式为3CO~~,即CO~。
·根据原子守恒确定关系式。上述例子中也可直接根据碳原子守恒得出CO~。
二 化学计算常用的方法
例2
守恒法
·质量守恒:反应前后元素质量、原子个数不变。
·电子守恒:在氧化还原反应中,还原剂失电子总数=氧化剂得电子总数。
·电荷守恒:在电解质溶液中,所有阳离子所带正电荷总数=所有阴离子所带负电荷总数。
例4
Mg、Al组成的混合物与足量盐酸反应,产生标准状况下的氢气4.48 L。下列推断中错误的是( )
A.参加反应的Mg、Al共0.2 mol
B.参加反应的HCl为0.4 mol
C.Mg、Al在反应中共失去0.4 mol电子
D.若与足量的稀硫酸反应能产生0.2 mol
【解析】反应的实质为═↑,═↑,==0.2 mol,则参加反应的= 0.4 mol。若换成稀硫酸,同样产生0.2 mol 。依据得失电子守恒,由→得电子总数为0.2 mol×2=0.4 mol,则Mg、Al在反应中共失去0.4 mol 。0.2 mol Mg提供0.4 mol电子,0.2 mol Al则提供0.6 mol电子,0.2 mol Mg、Al混合物提供的电子数大于0.4 mol小于0.6 mol。
【答案】A
THANKS
第三章 铁 金属材料a
第1课时 铁合金 铝和铝合金 新型合金
人教版化学必修第1册
第二节 金属材料
金属材料:包括纯金属和合金
1、大多数金属为银白色(铜:紫红色,金:黄色)固体(汞:液体)
2、有金属光泽
3、具有导电性、导热性和延展性
金属特性:
合金:两种或两种以上的金属(或金属跟非金属)熔
合而成的具有金属特性的物质。
合金具有许多优良的物理、化学或机械性能。
硬度大于各成分金属
熔点低于各成分金属
一般来说,
结构决定性质:
在纯金属内加入其他元素形成合金以后,结构发生了变化,使合金的性能与纯金属有很大的差异。
合金的特征:熔点低于其成分金属,硬度大于成分金属。
生铁
钢
(含碳量在2%~4.3%之间,还含硅、锰及少量硫、磷 )
碳素钢
{
低碳钢
(含碳0.3%~0.6%)
高碳钢
(含碳0.03%~0.3%)
中碳钢
(含碳0.6%~2% )
合金钢: 也叫特种钢在碳素钢中加入铬、锰、钨、
镍、钼、钴等一种或几种元素,组织结构发生
变化,从而使钢具有各种特殊性能
0.03%~2%
铁合金
铁合金的分类:
钢 碳素钢 合金钢
低碳钢 中碳钢 高碳钢
组成元素 Fe和C Fe、C、Cr、Mn、W、Ni、Mo、Co、Si
含碳量 低于0.3% 0.3%-0.6% 高于0.6%
性能 韧性、焊接性好,但强度低 强度高、韧性及加工性好 硬而脆,热处理后弹性好 种类多,性能差别大
用途 用于制造钢板、钢丝、钢管等 用于制造钢轨、车轮、建材等 用于制造器械、弹簧、刀具等
性能:在大气中比较稳定,不容易生锈,具有很强的抗腐蚀能力。
用途:生活中常见的医疗器材、厨房用具和餐具等,很多都是用
不锈钢制造的;有些地铁列车的车体材质也是不锈钢。
合金元素:主要是 铬 (Cr)和镍 (Ni )
不锈钢
铝和铝合金
4Al+3O2 ===2Al2O3
1、铝的物理性质
银白色金属、密度小、质软,熔点低、良好的导电导热性和延展性。
2、铝在地壳中的含量
地壳中含量最高的金属元素
3、铝的化学性质
铝是一种活泼金属,易失去电子,常温下被空气中的氧气氧化
实验装置
实验现象 试管中 ,铝片 ;将点燃的木条放在试管口处,发出 声
实验原理 铝片表面的保护膜发生反应的原理: (化学方程式,下同),Al与盐酸发生反应的原理:
1.铝、氧化铝与酸的反应
[实验探究]
Al2O3+6HCl=2AlCl3+3H2O
有气泡产生
逐渐溶解
爆鸣
2Al+6HCl=2AlCl3+3H2↑
2.铝、氧化铝与碱的反应
[实验探究]
实验装置 实验1 实验2
实验现象 试管中 气泡,一段时间后 气泡,铝片 ;将点燃的木 条放在试管口处,发出 声 试管中 气泡,铝片 ;将点燃的木条放在试管口处,发出 声
开始没有
产生
溶解
爆鸣
立即产生
溶解
爆鸣
实验装置 实验1 实验2
实验 原理 反应的化学方程式: 、 化学方程式:
Al2O3+2NaOH=2NaAlO2+H2O
2Al+2NaOH+2H2O=2NaAlO2+3H2↑
2Al+2NaOH+2H2O=2NaAlO2+3H2↑
实验装置 实验1 实验2
实验 原理 离子方程式: 、 离子方程式:
既能与酸反应生成盐和水,又能与碱反应生成盐和水的氧化物,例如Al2O3。
【应用】由于Al和 A12O3均能与酸、碱反应,因此铝制餐具不宜用来蒸煮或长时间存放酸性或碱性食物。
两性氧化物:
新型合金
储氢合金
思考:
(1)氢能的利用关键要解决什么问题?
(2)储氢合金的储氢原理是什么
储氢合金是一类能够大量吸收H2,并与H2结合成金属氢化物的材料。
安全储存和运输问题
要求:储氢量大, 金属氢化物既容易形成,稍稍加热又容易分解,室温下吸、 放氢的速率快。
钛合金
镍钴合金
第三章 铁 金属材料a
第2课时 物质的量应用于化学方程式的计算
人教版化学必修第1册
第二节 金属材料
化学方程式中化学计量数与各物质之间量的关系
·化学方程式是表示物质间发生化学反应的式子,它必须遵循质量守恒定律,即在反应前后质量守恒、原子种类和数目守恒。在化学方程式中,可反映出物质的质量关系、粒子数目关系、物质的量关系等。例如:
2Na + ═ ↑
质量之比: 46 g∶ 36 g ∶ 80 g ∶ 2 g
化学计量数之比 2 ∶ 2 ∶ 2 ∶ 1
扩大倍: ∶ ∶ ∶
物质的量之比: 2 mol∶ 2 mol ∶ 2 mol ∶ 1 mol
·归纳总结
化学方程式中化学计量数之比等于粒子数之比,也等于物质的量之比。物质的量又可将物质的质量、物质的量浓度、气体体积联系起来融入计算之中。
一 物质的量在化学方程式计算中的应用
例题解析
[例1] 把6.5 g Zn放入足量盐酸中,锌完全反应。计算:
(1)6.5 g Zn的物质的量;
(2)参加反应的HCl的物质的量;
(3)生成的体积(标准状况)。
[分析]根据物质的量、质量和摩尔质量的关系,先计算出6.5 g Zn的物质的量,然后根据化学反应中各物质之间的化学计量数之比,计算出参加反应的HCl的物质的量和生成的体积(标准状况)。
(1)Zn的摩尔质量是65 g·。
n(Zn)===0.1 mol
(2)Zn + 2HCl═↑
1 2
0.1 mol n(HCl)
=
n(HCl)==0.2 mol
(3)Zn + 2HCl═↑
1 mol 22.4 L
0.1 mol
=
==2.24 L
答:(1)6.5 g Zn的物质的量是0.1 mol;
(2)有0.2 mol HCl参加了反应;
(3)生成的体积在标准状况下是2.24 L。
归纳总结
·物质的量用于化学方程式的计算题,一般应遵循下列步骤:
1.写出化学方程式或离子方程式(要确保正确)。
2.在物质化学式的下面列出四个相关量。
某物质A的未知量,可用m(A)、n(A)、V(A)这样的物理量符号表示,也可用x、y这样的字母表示。
在列出的四个相关量中,必须符合“左右量值相当,上下单位相同”原则,否则就是错的。“左右量值相当”,如在上述例题中,1 mol Zn与标准状况下22.4 L (也是1 mol )相当,65 g Zn(也是1 mol Zn)与标准状况下22.4 L 相当。
3.用列出的四个相关量组成比例式或比例式的变式,求出未知量。
4.写出答案。
例1
关系式法
当已知物和未知物之间是靠多个反应来联系时只需直接确定已知量和未知量之间的比例关系,即“关系式”。
·根据化学方程式确定关系式。写出发生反应的化学方程式,根据量的关系写出关系式。例如,把CO还原生成的通入澄清石灰水中,求生成沉淀的量。发生反应的化学方程式如下:
═↓
则关系式为3CO~~,即CO~。
·根据原子守恒确定关系式。上述例子中也可直接根据碳原子守恒得出CO~。
二 化学计算常用的方法
例2
守恒法
·质量守恒:反应前后元素质量、原子个数不变。
·电子守恒:在氧化还原反应中,还原剂失电子总数=氧化剂得电子总数。
·电荷守恒:在电解质溶液中,所有阳离子所带正电荷总数=所有阴离子所带负电荷总数。
例4
Mg、Al组成的混合物与足量盐酸反应,产生标准状况下的氢气4.48 L。下列推断中错误的是( )
A.参加反应的Mg、Al共0.2 mol
B.参加反应的HCl为0.4 mol
C.Mg、Al在反应中共失去0.4 mol电子
D.若与足量的稀硫酸反应能产生0.2 mol
【解析】反应的实质为═↑,═↑,==0.2 mol,则参加反应的= 0.4 mol。若换成稀硫酸,同样产生0.2 mol 。依据得失电子守恒,由→得电子总数为0.2 mol×2=0.4 mol,则Mg、Al在反应中共失去0.4 mol 。0.2 mol Mg提供0.4 mol电子,0.2 mol Al则提供0.6 mol电子,0.2 mol Mg、Al混合物提供的电子数大于0.4 mol小于0.6 mol。
【答案】A
THANKS
