第2章 化学反应的方向、限度与速率 测试题(含解析) 2023-2024学年高二上学期鲁科版(2019)化学选择性必修1
文档属性
| 名称 | 第2章 化学反应的方向、限度与速率 测试题(含解析) 2023-2024学年高二上学期鲁科版(2019)化学选择性必修1 |  | |
| 格式 | docx | ||
| 文件大小 | 611.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-15 23:09:03 | ||
图片预览



文档简介
第2章 化学反应的方向、限度与速率 测试题
一、选择题
1.在一恒容密闭容器中放入一定量的,发生反应 ,下列说法正确的是
A.当质量不变时,该反应达到平衡状态
B.若,则反应达到平衡状态
C.反应达到平衡时,升高温度,正反应速率大于逆反应速率
D.反应物的总能量小于生成物的总能量
2.工业上以NH3和CO2为原料合成尿素,其能量转化关系如图所示。总反应为2NH3(l)+CO2(g)=H2O(l)+H2NCONH2(l) △H=-103.7kJ mol-1。
下列有关说法正确的是
A.△S1>0,△H4>0
B.H2NCOONH4(l)的能量比H2NCONH2(l)的低,H2NCOONH4(l)更稳定
C.其他条件不变,增大压强,总反应速率和平衡转化率均增大
D.过程③的反应速率慢,使用合适的催化剂可减小△H3从而加快反应速率
3.在锌与某浓度的盐酸反应的实验中,得到如表结果:
序号 锌的质量/g 锌的形状 温度/℃ 锌完全溶解于酸的时间/s
I 2 薄片 15 200
II 2 粉末 15
III 2 粉末 35
下列说法正确的是
①t1>t2
②t1<200
③实验II和实验III比较,单位时间内消耗的锌的质量:m(II)>m(III)
A.只有① B.只有② C.②③ D.①②
4.反应达到平衡后,保持温度不变,再通入NO2,重新达到平衡,则新平衡与旧平衡相比的值
A.变小 B.变大 C.不变 D.无法确定
5.反应的反应机理为:①②……③(快反应),改变反应物浓度时,反应的瞬时速率如表所示:
0.038 0.060
0.076 0.060
0.076 0.030
下列说法正确的是
A.该反应的速率方程为
B.该反应的速率常数k的值为6.58×10-3
C.第②步的反应方程式为
D.3步反应中反应③的活化能最大
6.下列说法正确的是
A.等量的硫蒸气和硫固体分别完全燃烧,前者放出热量多
B.甲烷的燃烧热为,则甲烷燃烧的热化学方程式可表示为:
C.在一个确定的化学反应关系中,反应物的总能量与生成物的总能量可能相同
D.已知热化学方程式:,在容器中充入和充分反应,最终放出的热量为
7.对于反应,下列表示不同条件下的反应速率,反应进行得最快的是
A. B.
C. D.
8.在密闭恒容容器中,对于N2+3H22NH3反应来说,能说明反应达到平衡状态的是
A.3v(H2)正=2v(NH3)逆
B.v(N2):v(H2):v(NH3)=1:3:2
C.混合气体的平均摩尔质量不变
D.断裂3molH-H键的同时形成6molN-H键
9.将的溶液和溶液等体积混合,取混合液分别完成下列实验:
实验编号 实验操作 实验现象
① 滴入KSCN溶液 溶液变红色
② 滴入AgNO3溶液 有黄色沉淀生成
③ 滴入溶液 有蓝色沉淀生成
④ 滴入淀粉溶液 溶液变蓝色
下列说法不正确的是
A.由实验①和②不能说明与没有发生反应
B.由实验③和④说明与发生反应
C.由实验①和③说明与发生的是可逆反应
D.由实验②和④说明与发生的是可逆反应
10.羰基硫(COS)可作为一种粮食熏蒸剂,能防止某些昆虫的危害。在恒容密闭容器中,CO 和 H2S 混合加热生成羰基硫的反应为 CO(g)+H2S(g)COS(g)+H2(g)。下列说法能充分说明该反应已经达到化学平衡状态的是
A.正、逆反应速率都等于零
B.CO、H2S、COS、H2 的浓度相等
C.CO、H2S、COS、H2 在容器中共存
D.CO、H2S、COS、H2 的浓度均不再变化
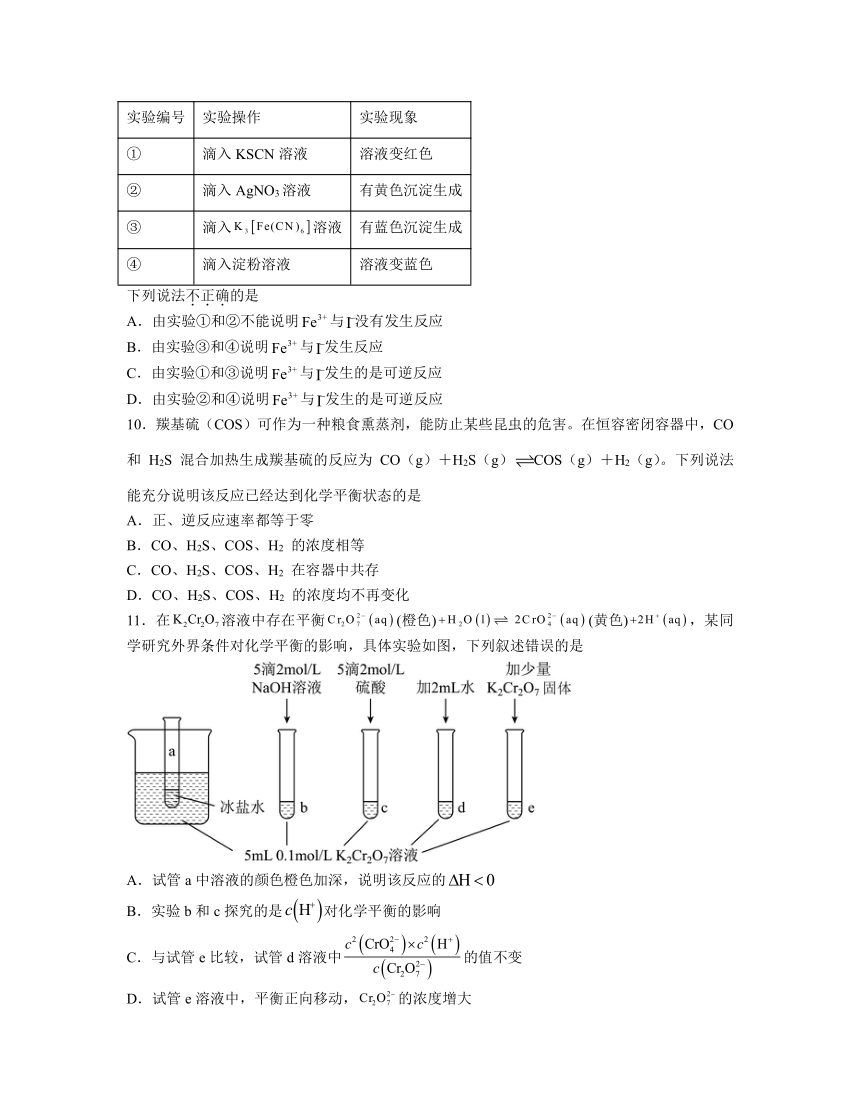
11.在溶液中存在平衡(橙色)(黄色),某同学研究外界条件对化学平衡的影响,具体实验如图,下列叙述错误的是
A.试管a中溶液的颜色橙色加深,说明该反应的
B.实验b和c探究的是对化学平衡的影响
C.与试管e比较,试管d溶液中的值不变
D.试管e溶液中,平衡正向移动,的浓度增大
12.一定温度下,在容积恒定的密闭容器中进行反应,下列叙述能表明该反应已达到平衡状态的是
①混合气体的密度不变
②容器内气体的压强不变
③混合气体的总物质的量不变
④B的物质的量浓度不变
⑤
A.①②③④ B.②③ C.①③④ D.只有⑤
13.下列说法中正确的是
A.2CaCO3(s)+2SO2(g)+O2(g)=2CaSO4(s)+2CO2(g)在低温下能自发进行,则该反应的ΔH<0
B.NH4Cl(s)= NH3(g)+HCl(g)在室温下不能自发进行,则该反应的ΔH<0
C.若ΔH>0,ΔS<0,化学反应在任何温度下都能自发进行
D.加入合适的催化剂能降低反应的活化能,从而改变反应的焓变
14.将与晶体混合后搅拌,会闻到刺激性气味且体系温度降低。下列对该反应的说法不正确的是
A.该反应的熵变明显增大 B.该反应的
C.该反应在理论上可以设计成原电池 D.该反应在常温下能自发进行
15.恒容密闭容器中发生反应CO(g)+2H2(g)CH3OH(g) △H= Q kJ mol﹣1
在其他条件不变的情况下,研究温度对反应的影响,实验结果如图所示,下列说法正确的是
A.反应的平衡常数
B.Q>0
C.高温有利于该反应的自发进行
D.A点混合气体的平均摩尔质量大于B点
二、填空题
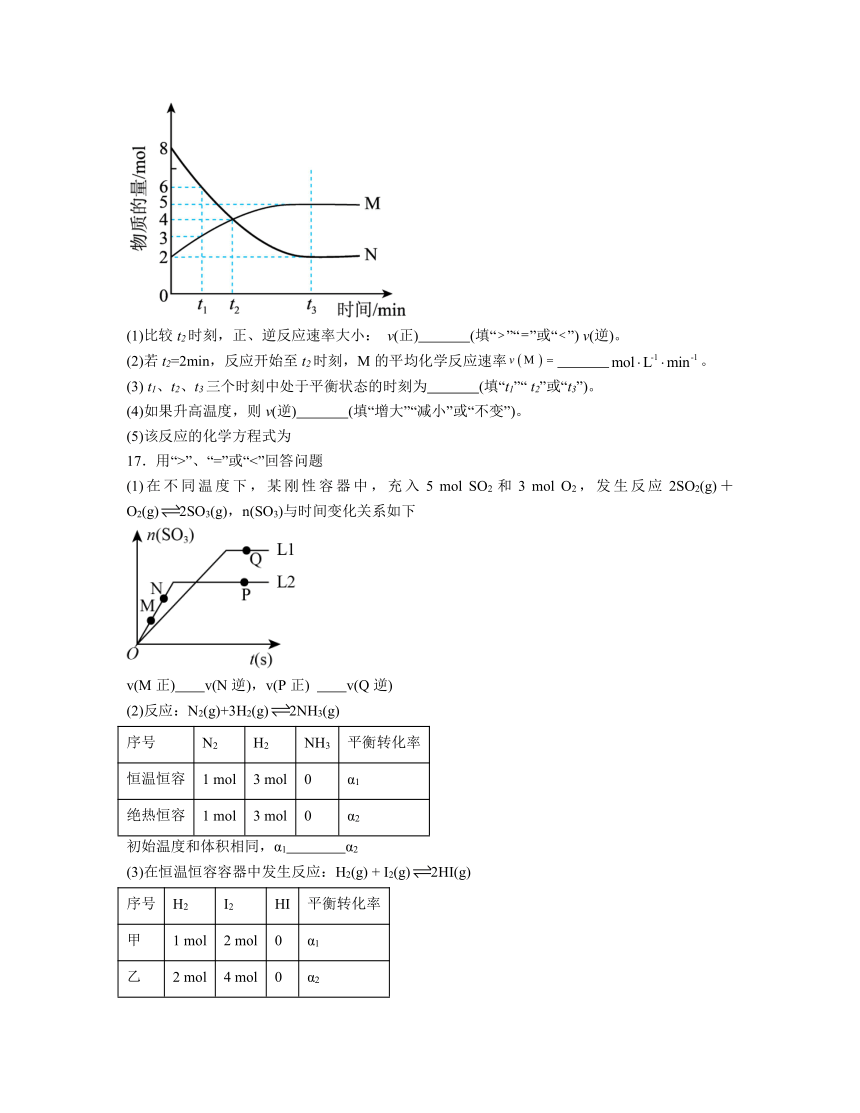
16.在一定温度下,4L密闭容器内发生气体M和气体N的转化反应。它们的物质的量随时间变化的曲线如图所示。
(1)比较t2时刻,正、逆反应速率大小: v(正) (填“”“”或“”) v(逆)。
(2)若t2=2min,反应开始至t2时刻,M的平均化学反应速率 。
(3) t1、t2、t3三个时刻中处于平衡状态的时刻为 (填“t1”“ t2”或“t3”)。
(4)如果升高温度,则v(逆) (填“增大”“减小”或“不变”)。
(5)该反应的化学方程式为
17.用“>”、“=”或“<”回答问题
(1)在不同温度下,某刚性容器中,充入5 mol SO2和3 mol O2,发生反应2SO2(g)+O2(g)2SO3(g),n(SO3)与时间变化关系如下
v(M正) v(N逆),v(P正) v(Q逆)
(2)反应:N2(g)+3H2(g)2NH3(g)
序号 N2 H2 NH3 平衡转化率
恒温恒容 1 mol 3 mol 0 α1
绝热恒容 1 mol 3 mol 0 α2
初始温度和体积相同,α1 α2
(3)在恒温恒容容器中发生反应:H2(g) + I2(g)2HI(g)
序号 H2 I2 HI 平衡转化率
甲 1 mol 2 mol 0 α1
乙 2 mol 4 mol 0 α2
α1 α2
(4)在恒温恒容容器中发生反应:2SO2(g)+O2(g) 2SO3(g),
序号 SO2 O2 SO3 平衡转化率
甲 2 mol 1 mol 0 α甲(SO2)
乙 0 0 4 mol α乙(SO3)
α甲(SO2)+α乙(SO3) 1
(5)恒温恒压容器中发生反应:2NO2(g) N2O4(g)
序号 NO2 N2O4 He 平衡转化率
甲 2 mol 0 mol 0 α甲
乙 4 mol 0 mol 2 mol α乙
α甲 α乙
18.硫酸是重要的化工材料,二氧化硫与氧气反应生成三氧化硫是工业制硫酸的重要反应之一。
(1)将0.050molSO2(g)和0.030molO2(g)放入容积为1L的密闭容器中,反应2SO2(g)+O2(g)2SO3(g)在一定条件下经20分钟达到平衡,测得c(SO3)=0.040mol/L。
①从反应开始到达到平衡,用SO2表示的平均反应速率为
②从平衡角度分析采用过量O2的目的是 ;
③该反应的平衡常数表达式为K= 。
④已知:K(300℃)>K(350℃),该反应是 (选填“吸”或“放”)热反应。若反应温度升高,SO2的转化率将 (填“增大”、“减小”或“不变”)。
(2)某温度下,SO2的平衡转化率(α)与体系总压强(P)的关系如图所示。平衡状态由A变到B时,平衡常数K(A) K(B)(填“>”、“<”或“=”,下同)。
19.恒容容器中发生可逆反应:M(g)+N(g)P(g)+Q(g)+R(s),回答下列问题(写出计算过程)
(1)在某温度下,起始时c(M)=1mol/L、c(N)=2.4mol/L,达到平衡后,M的转化率为60%,求该温度下反应的化学平衡常数 。
(2)若保持温度不变,起始时c(M)=4mol/L、c(N)=a mol/L,达到平衡后c(P)=2mol/L,求a的值是多少 ?
(3)若保持温度不变,起始时c(M)=c(N)=b mol/L,达到平衡后,N的转化率为多少 ?
20.将1molCO和2molH2充入恒容密闭容器中,在催化剂作用下发生如下反应:CO(g)+2H2(g)CH3OH(g),不同压强下CH3OH在平衡混合气体中的体积分数随温度的变化如图所示,A、B、C三点的化学平衡常数KA、KB、KC的相对大小为 ,计算C点的压强平衡常数Kp= (用平衡分压代替平衡浓度计算,分压=总压×体积分数)。
21.研发二氧化碳和有机物的利用技术对治理生态环境具有重要意义。
(1)已知:
则催重整反应的 。
(2)催化重整反应中,测得的平衡转化率与温度及压强的关系如图所示:
①判断该反应的 0(填“>”、“<”或“=”),比较压强的大小: (填“>”、“<”或“=”) 。
② 在恒容容器中进行该催化重整反应(不考虑其他反应),下列能说明该反应处于化学平衡状态的是 (填字母)。
A.的质量分数保持不变 B.容器中与H2的百分含量之比保持不变
C. D.容器中混合气体的平均相对分子质量保持不变
③X点对应的初始投料比,平衡压强为,温度为950℃,则X点平衡常数 。
(3)反应 的正、逆反应速率可分别表示为、,其中k正、k逆分别为正、逆反应速率常数,仅受温度影响。则如图所示的四条斜线中,有两条分别为和pk逆 随T变化斜线,能表示pk正 随T变化关系的是 (填字母)。
(4)一种以甲醇为原料,利用和CuO纳米片(CuONS/CF)作催化电极,制备甲酸(甲酸盐)的电化学装置的工作原理如图所示。
电解过程中阳极电极反应式为 。
22.I.为探究H+对MnO2与H2O2反应速率的影响。现取等量MnO2和表中有关物质,在相同温度下进行4组实验,分别记录收集20.0mLO2所需时间。
实验编号 1 2 3 4
10%H2O2的体积/mL 5.0 5.0 V1 V2
20%硫酸的体积/mL 0 0.5 1.0 V3
水的体积/mL 15.0 14.5 V4 13.5
所需时间t/s t1 t2 t3 t4
已知酸性条件下时:MnO2+H2O2+2H+=Mn2++O2↑+2H2O
(1)表中V2= mL,V4= mL。
(2)实验测得t2>t3>t4,则可得出的实验结论是 。
II.已知反应2NO(g)+2H2(g)=N2(g)+2H2O(g)生成N2的初始速率与NO、H2的初始浓度的关系为v=kcx(NO)cy(H2),k为速率常数。在800℃时测得的相关数据如表所示。
实验数据 初始浓度 生成N2的初始速率/mol·L-1·s-1
c(NO)/mol·L-1 c(H2)/mol·L-1
1 2.00×10-3 6.00×10-3 1.92×10-3
2 1.00×10-3 6.00×10-3 4.80×10-4
3 2.00×10-3 3.00×10-3 9.60×10-4
(3)由表中的数据可算出x、k的值:x= ,k= 。
(4)若800℃时,初始浓度c(NO)=c(H2)=4.00×10-3mol·L-1,则生成N2的初始速率为 mol·L-1·s-1。
【参考答案】
一、选择题
1.A
解析:A.当质量不变时,该反应不再移动,说明达到平衡状态,A正确;
B.反应速率比等于系数比,时,正逆反应速率不相等,反应没有达到平衡状态,B错误;
C.反应为放热反应,达到平衡时,升高温度,平衡逆向移动,则正反应速率小于逆反应速率,C错误;
D.反应为放热反应,则反应物的总能量大于生成物的总能量,D错误;
故选A。
2.C
解析:A.二氧化碳气体转化为液态二氧化碳是一个熵减的过程,A项错误;
B.反应③为吸热反应,说明的能量比液态水和的总能量低,无法比较和的能量高低,所以无法判断两者的稳定性强弱,B项错误;
C.压强增大,反应速率增大,该反应为反应前后气体体积减小的反应,其他条件不变,增大压强,平衡向正反应方向移动,平衡转化率增大,C项正确;
D.过程③使用合适的催化剂可降低反应的活化能,但不改变反应热的大小,D项错误;
故选C。
3.D
解析:粉末状比薄片状,表面积大,反应快,温度越高,反应速率越快,且II、III实验中只有温度不同,则III中温度高,III中反应速率快,可知t1>t2、t1<200,实验II和实验III比较,且Zn均完全溶于酸,III中反应速率快,则反应结束前单位时间内消耗的锌的质量为m(II)4.C
解析:根据题意,,K只与温度有关,温度不变,则K不变,故选C。
5.B
解析:A.由1、2两组数据可知:c()增大一倍,速率增大一倍;由2、3两组数据可知:c(I-)增大一倍,速率增大1倍,该反应的速率方程为,A错误;
B.将1组的数据代入速率方程式可得:v=k×0.038×0.06=1.5×10-5,解得k=6.58×10-3,B正确;
C.根据盖斯定律,用总反应-①-③,整理可得第②步的反应方程式为,C错误;
D.3步中反应③为快反应,其活化能最小,D错误;
故合理选项是B。
6.A
解析:A.由于等量的S(g)能量高于S(s),故完全燃烧后,S(g)放热更多,故A正确;
B.甲烷的燃烧热ΔH=-890.3 kJ mol-1,则1mol甲烷完全燃烧生成二氧化碳和液态水,放出890.3kJ热量,则CH4(g)+2O2(g)═CO2(g)+2H2O(l)ΔH=-890.3 kJ mol-1,故B错误;
C.化学反应必然伴随着能量变化,则反应物的总能量与生成物的总能量一定不相等,故C错误;
D.热化学方程式中为完全转化时的能量变化,可逆反应不能完全转化,且物质的量与热量成正比,则容器中充入2molSO2和1molO2充分反应,最终放出的热量小于196.64kJ,故D错误;
故选:A。
7.A
【分析】根据速率之比等于化学计量数之比,换算成相同单位、同一物质表示的反应速率然后比较。
解析:都转化成B物质表示的化学反应速率;
A.v(B)=3v(A)=3×0.02mol/(L s)=0.06mol/(L s)=3.6mol/(L min);
B.v(B)=0.05mol/(L s)=3mol/(L min);
C.v(B)=2.00mol/(L min);
D.v(B)=v(C)=×1mol/(L min)=1.5mol/(L min);
则反应进行得最快的是v(A)=0.02mol/(L s);答案选A。
8.C
解析:A.反应达到平衡状态时,正反应速率等于逆反应速率,根据化学反应速率之比等于各物质的化学计量数之比可知2v(H2)正=3v(NH3)逆,可说明反应达到平衡状态,A错误;
B.根据化学反应速率之比等于各物质的化学计量数之比可知v(N2):v(H2):v(NH3)始终等于1:3:2,则v(N2):v(H2):v(NH3)=1:3:2不能说明反应达到平衡状态,B错误;
C.混合气体的平均摩尔质量等于气体的总质量与气体总物质的量之比,由于气体的总质量保持不变,气体总的物质的量随着反应的进行不断减小,所以气体的摩尔质量为变量,当气体摩尔质量不变时,可说明反应达到平衡状态,C正确;
D.断裂3molH-H键的同时形成6molN-H键只能代表正反应,不能代表正反应速率等于逆反应速率,所以不能说明反应达到平衡状态,D错误;
故选C。
9.D
【分析】由实验的实验现象可知,过量的碘化钾溶液与硫酸铁溶液混合时,铁离子与碘离子反应生成亚铁离子和碘离子的反应为可逆反应,反应的方程式为2Fe3++2I—2Fe2++I2,反应后的溶液中含有钾离子、硫酸根离子、铁离子、亚铁离子、碘离子和单质碘。
解析:A.由分析可知,铁离子与碘离子反应生成亚铁离子和碘离子的反应为可逆反应,,反应后的溶液中含有铁离子和碘离子,所以由实验①和②不能说明铁离子与碘离子没有发生反应,故A正确;
B.由分析可知,铁离子与碘离子反应生成亚铁离子和碘离子的反应为可逆反应,所以由实验③和④说明铁离子与碘离子发生反应,故B正确;
C.由分析可知,溶液混合时,碘化钾溶液过量,溶液中存在铁离子说明该反应为可逆反应,所以由实验①和③说明铁离子与碘离子发生的是可逆反应,故C正确;
D.由分析可知,溶液混合时,碘化钾溶液过量,溶液中存在碘离子不能说明该反应为可逆反应,所以由实验②和④不能说明铁离子与碘离子发生的是可逆反应,故D错误;
故选D。
10.D
解析:A.化学平衡是动态平衡,当反应达到平衡状态时,正逆反应速率相等但不为0,故A错误;
B.当体系达平衡状态时CO、H2S、COS,H2的浓度可能相等也可能不等,故B错误;
C.只要反应发生就有CO、H2S、COS,H2在容器中共存,故C错误;
D.CO、H2S、COS,H2的浓度均不再变化,说明正逆反应速率相等,达到平衡状态,故D正确;
故选D。
11.A
解析:A.试管a中溶液的颜色橙色加深,说明降温该反应逆向移动,该反应的,A错误;
B.实验b加入2mol/LNaOH溶液,使减小,实验c加入2mol/L硫酸,使增大,所以实验b、c探究的是溶液中对化学平衡的影响,B正确;
C.平衡常数,K的值只受温度影响,温度不变,K值不变,C正确;
D.试管e溶液中加入K2Cr2O7固体,使的浓度增大,平衡正向移动, D正确;
故选A。
12.A
解析:①反应前后,气体的质量增大,恒容容器内气体的体积不变,故反应前后,气体的密度增大,当混合气体的密度不变时,说明该反应已达到平衡状态,①符合题意;
②反应前后,气体的分子数增加,恒容容器内气体的压强增大,当容器内气体的压强不变时,说明该反应已达到平衡状态,②符合题意;
③反应前后,气体的质量增大,当混合气体的总物质的量不变时,说明该反应已达到平衡状态,③符合题意;
④反应前后,B的物质的量浓度减小,当B的物质的量浓度不变时,说明该反应已达到平衡状态,④符合题意;
⑤该反应达到平衡状态时,,即3v正(B)=2v逆(C),故2v正(B)=3v逆 (C)时,不能说明该反应已达到平衡状态,⑤不符合题意;
综上所述,能表明该反应已达到平衡状态的是①②③④,故选A。
13.A
【分析】自由能变△G的的判断方法 △G=△H-T△S,△G<0,反应正向自发进行;△G=0,反应处在平衡状态;△G>0,反应逆向自发进行;以此解答。
解析:A. 对于反应2CaCO3(s)+2SO2(g)+O2(g)=2CaSO4(s)+2CO2(g),气体物质的量减小,ΔS<0,在低温下能自发进行,所以该反应的ΔH<0,故A正确;
B. 反应NH4Cl(s)=NH3(g)+HCl(g)的气体物质的量增加,所以ΔS>0,该反应在室温下不能自发进行,说明ΔH>0,故B错误;
C. 若ΔH>0,ΔS<0,ΔH-TΔS任何温度下都大于0,所以化学反应在任何温度下都不能自发进行,故C错误;
D. 加入合适的催化剂能降低反应活化能,不能改变反应的焓变,故D错误;
故选A。
14.C
解析:A.会闻到刺激性气味说明反应固体反应生成气体,反应熵变增大,A正确;
B.体系温度降低,说明温度降低,反应为吸热反应,焓变大于零,B正确;
C.自发的氧化还原反应可以设计成原电池,该反应不是氧化还原反应,在理论上不可以设计成原电池,C错误;
D.由题干可知,该反应在常温下能自发进行,D正确;
故选C。
15.D
解析:A.该反应的平衡常数, A不符合题意;
B.由分析可知,该反应为放热反应,因此Q<0,B不符合题意;
C.若反应自发进行,则ΔH-TΔS<0,由于该反应ΔH<0,ΔS<0,若为高温条件,则ΔH-TΔS可能大于0,不利于反应自发进行,C不符合题意;
D.该反应中反应物和生成物都是气体,因此反应前后混合气体的质量不变,A点时反应正向进行的程度较大,则混合气体的物质的量较小,根据公式可知,混合气体的平均摩尔质量较大,D符合题意;
故答案为:D
二、填空题
16.(1)>
(2)0.25
(3)t3
(4)增大
(5)2N(g) M(g)
解析:(1)t2时刻,N的物质的量继续减小中,M的物质的量继续增大中,故处于建立平衡的过程中,则t2时刻正、逆反应速率大小:v(正)>v(逆)。
(2)若t2=2min,反应开始至t2时刻,M的平均化学反应速率。
(3)达到平衡时,各成分M、N的物质的量不再改变。则处于平衡状态的时刻为t3。
(4)温度升高反应速率加快,正逆反应速率都增大,则升高温度,v(逆)增大。
(5)从反应开始至平衡时刻,,,物质的量的变化量之比等于化学计量数之比,故该反应的化学方程式为2N(g) M(g)。
17.(1) > >
(2)>
(3)=
(4)<
(5)>
【分析】(1)未达到平衡时,正反应速率大于逆反应速率;L2平衡时SO3浓度低,消耗的SO2和O2少,压强大;
(2)N2(g)+3H2(g)2NH3(g)为放热反应,恒温恒容温度不变,绝热恒容温度升高,反应平衡向左移动,转化率低;
(3)H2(g)+I2(g)2HI(g)为气体体积分数不变的反应,恒温恒容容器中等比例增加反应物,转化率不变;
(4)2SO2(g)+O2(g)2SO3(g)为气体体积分数减小的反应,乙反应中气体体积大,压强大,平衡右移;
(5)恒温恒压下,通入惰性气体,会使容器中气体体积增大,参与反应的气体分压变小,所以要向着体积增大的方向移动。
解析:(1)未达到平衡时,正反应速率大于逆反应速率;所以v(M正)>v(N逆);L2平衡时SO3浓度低,消耗的SO2和O2少,压强大;所以v(P正)>v(Q逆);故答案为>;>;
(2)N2(g)+3H2(g)2NH3(g)为放热反应,恒温恒容温度不变,绝热恒容温度升高,反应平衡向左移动,转化率低;所以α1>α2;故答案为>;
(3)H2(g)+I2(g)2HI(g)为气体体积分数不变的反应,恒温恒容容器中等比例增加反应物,转化率不变;所以α1=α2;故答案为=;
(4)2SO2(g)+O2(g)2SO3(g)为气体体积分数减小的反应,如果乙反应冲入2molSO3(g),α甲(SO2)+α乙(SO3)=1;题中乙反应中气体体积大,压强大,平衡右移,SO3转化率降低;所以α甲(SO2)+α乙(SO3)<1;故答案为<;
(5)恒温恒压下,如果不通入惰性气体,通入2mol和4molNO2,转化率相等;通入惰性气体后,会使容器中气体体积增大,参与反应的气体分压变小,反应逆向移动,转化率降低,所以α甲>α乙;故答案为>。
18.002mol/(L min) 提高二氧化硫的转化率 放 减小 =
解析: 2SO2(g)+O2(g)2SO3(g)
开始(mol/L) 0.050 0.030 0
改变(mol/L) 0.040 0.020 0.040
平衡(mol/L) 0.010 0.010 0.040
①从反应开始到达到平衡,用SO2表示的平均反应速率:
②加入过量O2,使另一反应物二氧化硫的转化率增大,目的是提高二氧化硫的转化率;
③反应2SO2(g)+O2(g)2SO3(g)的平衡常数表达式为;
④已知:K(300℃)>K(350℃),则升高温度平衡常数减小,平衡向逆反应方向移动,而升高温度平衡向吸热反应的方向移动,则该反应是放热反应。若反应温度升高,平衡逆向移动,则SO2的转化率将减小;
故为:0.002mol/(L min);提高二氧化硫的转化率;;放;减小。
(2)平衡常数只与温度有关,与压强无关,在温度不变的条件下,无论压强怎样变化,平衡常数都不变。故为:=。
19.(1)0.5
(2)6
(3)41%
解析:(1)起始时c(M)=1mol/L、c(N)=2.4mol/L,达到平衡后,M的转化率为60%,则平衡时c(M)=0.4mol/L、c(N)=1.8mol/L、c(P)=0.6mol/L、c(Q)=0.6mol/L,;
(2)若保持温度不变,则平衡常数不变,因此有,解得a=6;
(3)若保持温度不变,则平衡常数不变,设N的转化率为x,则,解得。
20.KA>KB=KC
解析:平衡常数是温度函数,温度不变,平衡常数不变,由图可知,温度升高,甲醇的体积分数减小,说明平衡向逆反应方向移动,该反应为放热反应,平衡常数减小,B、C的温度相同,高于A,则A、B、C三点的化学平衡常数相对大小为KA>KB=KC;设C点平衡时甲醇的物质的量为amol,由题意可建立如下三段式:
由甲醇的百分含量为50%可得:×100%=50%,解得a=0.5,则平衡时一氧化碳、氢气和甲醇的分压分别为×p2=0.25p2、×p2=0.5p2、×p2=0.25p2,反应的平衡常数Kp===,故答案为:KA>KB=KC;。
21.(1)(a-2b-2c)
(2)> < AD
(3)d
(4)CH3OH-4e-+H2O=HCOOH+4H+
解析:(1)①
②
③
根据盖斯定律①-②×2-③×2得的 (a-2b-2c)。
(2)①由图可知,温度升高CH4的平衡转化率增大,升温平衡向正反应方向移动,该反应的>0;而由催化重整反应可知,相同温度下,增大压强平衡逆向移动,CH4的平衡转化率减小,则<。
② A.的质量分数保持不变,说明浓度不变,反应达到平衡状态,故选A;
B.与H2都是生成物,物质的量比始终为1:1,容器中与H2的百分含量之比保持不变,反应不一定平衡,故不选B;
C.,正逆反应速率比不等于系数比,反应不平衡,故不选C;
D.混合气体总质量不变、混合气体的物质的量是变量,容器中混合气体的平均相对分子质量是变量,混合气体的平均相对分子质量保持不变,反应一定达到平衡状态,故选D;
选AD。
③压强为p4、投料比=1、950℃的条件下,,X点平衡常数Kp═==。
(3)升高温度,反应速率加快,k正、k逆都增大,pk都减小,反应 ,正反应吸热,升高温度平衡正向移动,说明k正增大的幅度大于k逆。能表示pk正(pk=-lgk)随T变化关系的是d。
(4)从图分析,右侧由甲醇变成甲酸,失去电子,故右侧为阳极,即b为电源正极,电解过程中阳极电极反应式为CH3OH-4e-+H2O=HCOOH+4H+。
22.(1) 5.0 14.0
(2)其他条件相同的情况下,H+的浓度越大,反应速率越快
(3)2 8×104
(4)5.12×10-3
【分析】探究H+浓度对MnO2与H2O2反应速率的影响,需要控制变量,只改变H+浓度,其他量都必须相同。
解析:(1)为了探究H+浓度对MnO2与H2O2反应速率的影响,只改变H+浓度,其他量都必须相同,所以V1=5.0mL;水和硫酸的体积之和为15.0mL,所以表中V4=14.0mL。
(2)实验测得t2>t3>t4,则实验2、3、4的反应速率依次加快,则可得出的实验结论是:其他条件相同的情况下,H+的浓度越大,反应速率越快。
(3)将3组实验数据代入v=k cx(NO) cy(H2),中有:
,
,
,解得:x=2,y=1,k=8×104。
(4)若800℃时,初始浓度c(NO)=c(H2)=4.00×10-3mol·L-1,则生成N2的初始速率v=8×104×c2(NO)·c( H2) =8×104×(4.00×10-3)2×(4.00×10-3)=5.12×10-3mol·L-1·s-1
一、选择题
1.在一恒容密闭容器中放入一定量的,发生反应 ,下列说法正确的是
A.当质量不变时,该反应达到平衡状态
B.若,则反应达到平衡状态
C.反应达到平衡时,升高温度,正反应速率大于逆反应速率
D.反应物的总能量小于生成物的总能量
2.工业上以NH3和CO2为原料合成尿素,其能量转化关系如图所示。总反应为2NH3(l)+CO2(g)=H2O(l)+H2NCONH2(l) △H=-103.7kJ mol-1。
下列有关说法正确的是
A.△S1>0,△H4>0
B.H2NCOONH4(l)的能量比H2NCONH2(l)的低,H2NCOONH4(l)更稳定
C.其他条件不变,增大压强,总反应速率和平衡转化率均增大
D.过程③的反应速率慢,使用合适的催化剂可减小△H3从而加快反应速率
3.在锌与某浓度的盐酸反应的实验中,得到如表结果:
序号 锌的质量/g 锌的形状 温度/℃ 锌完全溶解于酸的时间/s
I 2 薄片 15 200
II 2 粉末 15
III 2 粉末 35
下列说法正确的是
①t1>t2
②t1<200
③实验II和实验III比较,单位时间内消耗的锌的质量:m(II)>m(III)
A.只有① B.只有② C.②③ D.①②
4.反应达到平衡后,保持温度不变,再通入NO2,重新达到平衡,则新平衡与旧平衡相比的值
A.变小 B.变大 C.不变 D.无法确定
5.反应的反应机理为:①②……③(快反应),改变反应物浓度时,反应的瞬时速率如表所示:
0.038 0.060
0.076 0.060
0.076 0.030
下列说法正确的是
A.该反应的速率方程为
B.该反应的速率常数k的值为6.58×10-3
C.第②步的反应方程式为
D.3步反应中反应③的活化能最大
6.下列说法正确的是
A.等量的硫蒸气和硫固体分别完全燃烧,前者放出热量多
B.甲烷的燃烧热为,则甲烷燃烧的热化学方程式可表示为:
C.在一个确定的化学反应关系中,反应物的总能量与生成物的总能量可能相同
D.已知热化学方程式:,在容器中充入和充分反应,最终放出的热量为
7.对于反应,下列表示不同条件下的反应速率,反应进行得最快的是
A. B.
C. D.
8.在密闭恒容容器中,对于N2+3H22NH3反应来说,能说明反应达到平衡状态的是
A.3v(H2)正=2v(NH3)逆
B.v(N2):v(H2):v(NH3)=1:3:2
C.混合气体的平均摩尔质量不变
D.断裂3molH-H键的同时形成6molN-H键
9.将的溶液和溶液等体积混合,取混合液分别完成下列实验:
实验编号 实验操作 实验现象
① 滴入KSCN溶液 溶液变红色
② 滴入AgNO3溶液 有黄色沉淀生成
③ 滴入溶液 有蓝色沉淀生成
④ 滴入淀粉溶液 溶液变蓝色
下列说法不正确的是
A.由实验①和②不能说明与没有发生反应
B.由实验③和④说明与发生反应
C.由实验①和③说明与发生的是可逆反应
D.由实验②和④说明与发生的是可逆反应
10.羰基硫(COS)可作为一种粮食熏蒸剂,能防止某些昆虫的危害。在恒容密闭容器中,CO 和 H2S 混合加热生成羰基硫的反应为 CO(g)+H2S(g)COS(g)+H2(g)。下列说法能充分说明该反应已经达到化学平衡状态的是
A.正、逆反应速率都等于零
B.CO、H2S、COS、H2 的浓度相等
C.CO、H2S、COS、H2 在容器中共存
D.CO、H2S、COS、H2 的浓度均不再变化
11.在溶液中存在平衡(橙色)(黄色),某同学研究外界条件对化学平衡的影响,具体实验如图,下列叙述错误的是
A.试管a中溶液的颜色橙色加深,说明该反应的
B.实验b和c探究的是对化学平衡的影响
C.与试管e比较,试管d溶液中的值不变
D.试管e溶液中,平衡正向移动,的浓度增大
12.一定温度下,在容积恒定的密闭容器中进行反应,下列叙述能表明该反应已达到平衡状态的是
①混合气体的密度不变
②容器内气体的压强不变
③混合气体的总物质的量不变
④B的物质的量浓度不变
⑤
A.①②③④ B.②③ C.①③④ D.只有⑤
13.下列说法中正确的是
A.2CaCO3(s)+2SO2(g)+O2(g)=2CaSO4(s)+2CO2(g)在低温下能自发进行,则该反应的ΔH<0
B.NH4Cl(s)= NH3(g)+HCl(g)在室温下不能自发进行,则该反应的ΔH<0
C.若ΔH>0,ΔS<0,化学反应在任何温度下都能自发进行
D.加入合适的催化剂能降低反应的活化能,从而改变反应的焓变
14.将与晶体混合后搅拌,会闻到刺激性气味且体系温度降低。下列对该反应的说法不正确的是
A.该反应的熵变明显增大 B.该反应的
C.该反应在理论上可以设计成原电池 D.该反应在常温下能自发进行
15.恒容密闭容器中发生反应CO(g)+2H2(g)CH3OH(g) △H= Q kJ mol﹣1
在其他条件不变的情况下,研究温度对反应的影响,实验结果如图所示,下列说法正确的是
A.反应的平衡常数
B.Q>0
C.高温有利于该反应的自发进行
D.A点混合气体的平均摩尔质量大于B点
二、填空题
16.在一定温度下,4L密闭容器内发生气体M和气体N的转化反应。它们的物质的量随时间变化的曲线如图所示。
(1)比较t2时刻,正、逆反应速率大小: v(正) (填“”“”或“”) v(逆)。
(2)若t2=2min,反应开始至t2时刻,M的平均化学反应速率 。
(3) t1、t2、t3三个时刻中处于平衡状态的时刻为 (填“t1”“ t2”或“t3”)。
(4)如果升高温度,则v(逆) (填“增大”“减小”或“不变”)。
(5)该反应的化学方程式为
17.用“>”、“=”或“<”回答问题
(1)在不同温度下,某刚性容器中,充入5 mol SO2和3 mol O2,发生反应2SO2(g)+O2(g)2SO3(g),n(SO3)与时间变化关系如下
v(M正) v(N逆),v(P正) v(Q逆)
(2)反应:N2(g)+3H2(g)2NH3(g)
序号 N2 H2 NH3 平衡转化率
恒温恒容 1 mol 3 mol 0 α1
绝热恒容 1 mol 3 mol 0 α2
初始温度和体积相同,α1 α2
(3)在恒温恒容容器中发生反应:H2(g) + I2(g)2HI(g)
序号 H2 I2 HI 平衡转化率
甲 1 mol 2 mol 0 α1
乙 2 mol 4 mol 0 α2
α1 α2
(4)在恒温恒容容器中发生反应:2SO2(g)+O2(g) 2SO3(g),
序号 SO2 O2 SO3 平衡转化率
甲 2 mol 1 mol 0 α甲(SO2)
乙 0 0 4 mol α乙(SO3)
α甲(SO2)+α乙(SO3) 1
(5)恒温恒压容器中发生反应:2NO2(g) N2O4(g)
序号 NO2 N2O4 He 平衡转化率
甲 2 mol 0 mol 0 α甲
乙 4 mol 0 mol 2 mol α乙
α甲 α乙
18.硫酸是重要的化工材料,二氧化硫与氧气反应生成三氧化硫是工业制硫酸的重要反应之一。
(1)将0.050molSO2(g)和0.030molO2(g)放入容积为1L的密闭容器中,反应2SO2(g)+O2(g)2SO3(g)在一定条件下经20分钟达到平衡,测得c(SO3)=0.040mol/L。
①从反应开始到达到平衡,用SO2表示的平均反应速率为
②从平衡角度分析采用过量O2的目的是 ;
③该反应的平衡常数表达式为K= 。
④已知:K(300℃)>K(350℃),该反应是 (选填“吸”或“放”)热反应。若反应温度升高,SO2的转化率将 (填“增大”、“减小”或“不变”)。
(2)某温度下,SO2的平衡转化率(α)与体系总压强(P)的关系如图所示。平衡状态由A变到B时,平衡常数K(A) K(B)(填“>”、“<”或“=”,下同)。
19.恒容容器中发生可逆反应:M(g)+N(g)P(g)+Q(g)+R(s),回答下列问题(写出计算过程)
(1)在某温度下,起始时c(M)=1mol/L、c(N)=2.4mol/L,达到平衡后,M的转化率为60%,求该温度下反应的化学平衡常数 。
(2)若保持温度不变,起始时c(M)=4mol/L、c(N)=a mol/L,达到平衡后c(P)=2mol/L,求a的值是多少 ?
(3)若保持温度不变,起始时c(M)=c(N)=b mol/L,达到平衡后,N的转化率为多少 ?
20.将1molCO和2molH2充入恒容密闭容器中,在催化剂作用下发生如下反应:CO(g)+2H2(g)CH3OH(g),不同压强下CH3OH在平衡混合气体中的体积分数随温度的变化如图所示,A、B、C三点的化学平衡常数KA、KB、KC的相对大小为 ,计算C点的压强平衡常数Kp= (用平衡分压代替平衡浓度计算,分压=总压×体积分数)。
21.研发二氧化碳和有机物的利用技术对治理生态环境具有重要意义。
(1)已知:
则催重整反应的 。
(2)催化重整反应中,测得的平衡转化率与温度及压强的关系如图所示:
①判断该反应的 0(填“>”、“<”或“=”),比较压强的大小: (填“>”、“<”或“=”) 。
② 在恒容容器中进行该催化重整反应(不考虑其他反应),下列能说明该反应处于化学平衡状态的是 (填字母)。
A.的质量分数保持不变 B.容器中与H2的百分含量之比保持不变
C. D.容器中混合气体的平均相对分子质量保持不变
③X点对应的初始投料比,平衡压强为,温度为950℃,则X点平衡常数 。
(3)反应 的正、逆反应速率可分别表示为、,其中k正、k逆分别为正、逆反应速率常数,仅受温度影响。则如图所示的四条斜线中,有两条分别为和pk逆 随T变化斜线,能表示pk正 随T变化关系的是 (填字母)。
(4)一种以甲醇为原料,利用和CuO纳米片(CuONS/CF)作催化电极,制备甲酸(甲酸盐)的电化学装置的工作原理如图所示。
电解过程中阳极电极反应式为 。
22.I.为探究H+对MnO2与H2O2反应速率的影响。现取等量MnO2和表中有关物质,在相同温度下进行4组实验,分别记录收集20.0mLO2所需时间。
实验编号 1 2 3 4
10%H2O2的体积/mL 5.0 5.0 V1 V2
20%硫酸的体积/mL 0 0.5 1.0 V3
水的体积/mL 15.0 14.5 V4 13.5
所需时间t/s t1 t2 t3 t4
已知酸性条件下时:MnO2+H2O2+2H+=Mn2++O2↑+2H2O
(1)表中V2= mL,V4= mL。
(2)实验测得t2>t3>t4,则可得出的实验结论是 。
II.已知反应2NO(g)+2H2(g)=N2(g)+2H2O(g)生成N2的初始速率与NO、H2的初始浓度的关系为v=kcx(NO)cy(H2),k为速率常数。在800℃时测得的相关数据如表所示。
实验数据 初始浓度 生成N2的初始速率/mol·L-1·s-1
c(NO)/mol·L-1 c(H2)/mol·L-1
1 2.00×10-3 6.00×10-3 1.92×10-3
2 1.00×10-3 6.00×10-3 4.80×10-4
3 2.00×10-3 3.00×10-3 9.60×10-4
(3)由表中的数据可算出x、k的值:x= ,k= 。
(4)若800℃时,初始浓度c(NO)=c(H2)=4.00×10-3mol·L-1,则生成N2的初始速率为 mol·L-1·s-1。
【参考答案】
一、选择题
1.A
解析:A.当质量不变时,该反应不再移动,说明达到平衡状态,A正确;
B.反应速率比等于系数比,时,正逆反应速率不相等,反应没有达到平衡状态,B错误;
C.反应为放热反应,达到平衡时,升高温度,平衡逆向移动,则正反应速率小于逆反应速率,C错误;
D.反应为放热反应,则反应物的总能量大于生成物的总能量,D错误;
故选A。
2.C
解析:A.二氧化碳气体转化为液态二氧化碳是一个熵减的过程,A项错误;
B.反应③为吸热反应,说明的能量比液态水和的总能量低,无法比较和的能量高低,所以无法判断两者的稳定性强弱,B项错误;
C.压强增大,反应速率增大,该反应为反应前后气体体积减小的反应,其他条件不变,增大压强,平衡向正反应方向移动,平衡转化率增大,C项正确;
D.过程③使用合适的催化剂可降低反应的活化能,但不改变反应热的大小,D项错误;
故选C。
3.D
解析:粉末状比薄片状,表面积大,反应快,温度越高,反应速率越快,且II、III实验中只有温度不同,则III中温度高,III中反应速率快,可知t1>t2、t1<200,实验II和实验III比较,且Zn均完全溶于酸,III中反应速率快,则反应结束前单位时间内消耗的锌的质量为m(II)
解析:根据题意,,K只与温度有关,温度不变,则K不变,故选C。
5.B
解析:A.由1、2两组数据可知:c()增大一倍,速率增大一倍;由2、3两组数据可知:c(I-)增大一倍,速率增大1倍,该反应的速率方程为,A错误;
B.将1组的数据代入速率方程式可得:v=k×0.038×0.06=1.5×10-5,解得k=6.58×10-3,B正确;
C.根据盖斯定律,用总反应-①-③,整理可得第②步的反应方程式为,C错误;
D.3步中反应③为快反应,其活化能最小,D错误;
故合理选项是B。
6.A
解析:A.由于等量的S(g)能量高于S(s),故完全燃烧后,S(g)放热更多,故A正确;
B.甲烷的燃烧热ΔH=-890.3 kJ mol-1,则1mol甲烷完全燃烧生成二氧化碳和液态水,放出890.3kJ热量,则CH4(g)+2O2(g)═CO2(g)+2H2O(l)ΔH=-890.3 kJ mol-1,故B错误;
C.化学反应必然伴随着能量变化,则反应物的总能量与生成物的总能量一定不相等,故C错误;
D.热化学方程式中为完全转化时的能量变化,可逆反应不能完全转化,且物质的量与热量成正比,则容器中充入2molSO2和1molO2充分反应,最终放出的热量小于196.64kJ,故D错误;
故选:A。
7.A
【分析】根据速率之比等于化学计量数之比,换算成相同单位、同一物质表示的反应速率然后比较。
解析:都转化成B物质表示的化学反应速率;
A.v(B)=3v(A)=3×0.02mol/(L s)=0.06mol/(L s)=3.6mol/(L min);
B.v(B)=0.05mol/(L s)=3mol/(L min);
C.v(B)=2.00mol/(L min);
D.v(B)=v(C)=×1mol/(L min)=1.5mol/(L min);
则反应进行得最快的是v(A)=0.02mol/(L s);答案选A。
8.C
解析:A.反应达到平衡状态时,正反应速率等于逆反应速率,根据化学反应速率之比等于各物质的化学计量数之比可知2v(H2)正=3v(NH3)逆,可说明反应达到平衡状态,A错误;
B.根据化学反应速率之比等于各物质的化学计量数之比可知v(N2):v(H2):v(NH3)始终等于1:3:2,则v(N2):v(H2):v(NH3)=1:3:2不能说明反应达到平衡状态,B错误;
C.混合气体的平均摩尔质量等于气体的总质量与气体总物质的量之比,由于气体的总质量保持不变,气体总的物质的量随着反应的进行不断减小,所以气体的摩尔质量为变量,当气体摩尔质量不变时,可说明反应达到平衡状态,C正确;
D.断裂3molH-H键的同时形成6molN-H键只能代表正反应,不能代表正反应速率等于逆反应速率,所以不能说明反应达到平衡状态,D错误;
故选C。
9.D
【分析】由实验的实验现象可知,过量的碘化钾溶液与硫酸铁溶液混合时,铁离子与碘离子反应生成亚铁离子和碘离子的反应为可逆反应,反应的方程式为2Fe3++2I—2Fe2++I2,反应后的溶液中含有钾离子、硫酸根离子、铁离子、亚铁离子、碘离子和单质碘。
解析:A.由分析可知,铁离子与碘离子反应生成亚铁离子和碘离子的反应为可逆反应,,反应后的溶液中含有铁离子和碘离子,所以由实验①和②不能说明铁离子与碘离子没有发生反应,故A正确;
B.由分析可知,铁离子与碘离子反应生成亚铁离子和碘离子的反应为可逆反应,所以由实验③和④说明铁离子与碘离子发生反应,故B正确;
C.由分析可知,溶液混合时,碘化钾溶液过量,溶液中存在铁离子说明该反应为可逆反应,所以由实验①和③说明铁离子与碘离子发生的是可逆反应,故C正确;
D.由分析可知,溶液混合时,碘化钾溶液过量,溶液中存在碘离子不能说明该反应为可逆反应,所以由实验②和④不能说明铁离子与碘离子发生的是可逆反应,故D错误;
故选D。
10.D
解析:A.化学平衡是动态平衡,当反应达到平衡状态时,正逆反应速率相等但不为0,故A错误;
B.当体系达平衡状态时CO、H2S、COS,H2的浓度可能相等也可能不等,故B错误;
C.只要反应发生就有CO、H2S、COS,H2在容器中共存,故C错误;
D.CO、H2S、COS,H2的浓度均不再变化,说明正逆反应速率相等,达到平衡状态,故D正确;
故选D。
11.A
解析:A.试管a中溶液的颜色橙色加深,说明降温该反应逆向移动,该反应的,A错误;
B.实验b加入2mol/LNaOH溶液,使减小,实验c加入2mol/L硫酸,使增大,所以实验b、c探究的是溶液中对化学平衡的影响,B正确;
C.平衡常数,K的值只受温度影响,温度不变,K值不变,C正确;
D.试管e溶液中加入K2Cr2O7固体,使的浓度增大,平衡正向移动, D正确;
故选A。
12.A
解析:①反应前后,气体的质量增大,恒容容器内气体的体积不变,故反应前后,气体的密度增大,当混合气体的密度不变时,说明该反应已达到平衡状态,①符合题意;
②反应前后,气体的分子数增加,恒容容器内气体的压强增大,当容器内气体的压强不变时,说明该反应已达到平衡状态,②符合题意;
③反应前后,气体的质量增大,当混合气体的总物质的量不变时,说明该反应已达到平衡状态,③符合题意;
④反应前后,B的物质的量浓度减小,当B的物质的量浓度不变时,说明该反应已达到平衡状态,④符合题意;
⑤该反应达到平衡状态时,,即3v正(B)=2v逆(C),故2v正(B)=3v逆 (C)时,不能说明该反应已达到平衡状态,⑤不符合题意;
综上所述,能表明该反应已达到平衡状态的是①②③④,故选A。
13.A
【分析】自由能变△G的的判断方法 △G=△H-T△S,△G<0,反应正向自发进行;△G=0,反应处在平衡状态;△G>0,反应逆向自发进行;以此解答。
解析:A. 对于反应2CaCO3(s)+2SO2(g)+O2(g)=2CaSO4(s)+2CO2(g),气体物质的量减小,ΔS<0,在低温下能自发进行,所以该反应的ΔH<0,故A正确;
B. 反应NH4Cl(s)=NH3(g)+HCl(g)的气体物质的量增加,所以ΔS>0,该反应在室温下不能自发进行,说明ΔH>0,故B错误;
C. 若ΔH>0,ΔS<0,ΔH-TΔS任何温度下都大于0,所以化学反应在任何温度下都不能自发进行,故C错误;
D. 加入合适的催化剂能降低反应活化能,不能改变反应的焓变,故D错误;
故选A。
14.C
解析:A.会闻到刺激性气味说明反应固体反应生成气体,反应熵变增大,A正确;
B.体系温度降低,说明温度降低,反应为吸热反应,焓变大于零,B正确;
C.自发的氧化还原反应可以设计成原电池,该反应不是氧化还原反应,在理论上不可以设计成原电池,C错误;
D.由题干可知,该反应在常温下能自发进行,D正确;
故选C。
15.D
解析:A.该反应的平衡常数, A不符合题意;
B.由分析可知,该反应为放热反应,因此Q<0,B不符合题意;
C.若反应自发进行,则ΔH-TΔS<0,由于该反应ΔH<0,ΔS<0,若为高温条件,则ΔH-TΔS可能大于0,不利于反应自发进行,C不符合题意;
D.该反应中反应物和生成物都是气体,因此反应前后混合气体的质量不变,A点时反应正向进行的程度较大,则混合气体的物质的量较小,根据公式可知,混合气体的平均摩尔质量较大,D符合题意;
故答案为:D
二、填空题
16.(1)>
(2)0.25
(3)t3
(4)增大
(5)2N(g) M(g)
解析:(1)t2时刻,N的物质的量继续减小中,M的物质的量继续增大中,故处于建立平衡的过程中,则t2时刻正、逆反应速率大小:v(正)>v(逆)。
(2)若t2=2min,反应开始至t2时刻,M的平均化学反应速率。
(3)达到平衡时,各成分M、N的物质的量不再改变。则处于平衡状态的时刻为t3。
(4)温度升高反应速率加快,正逆反应速率都增大,则升高温度,v(逆)增大。
(5)从反应开始至平衡时刻,,,物质的量的变化量之比等于化学计量数之比,故该反应的化学方程式为2N(g) M(g)。
17.(1) > >
(2)>
(3)=
(4)<
(5)>
【分析】(1)未达到平衡时,正反应速率大于逆反应速率;L2平衡时SO3浓度低,消耗的SO2和O2少,压强大;
(2)N2(g)+3H2(g)2NH3(g)为放热反应,恒温恒容温度不变,绝热恒容温度升高,反应平衡向左移动,转化率低;
(3)H2(g)+I2(g)2HI(g)为气体体积分数不变的反应,恒温恒容容器中等比例增加反应物,转化率不变;
(4)2SO2(g)+O2(g)2SO3(g)为气体体积分数减小的反应,乙反应中气体体积大,压强大,平衡右移;
(5)恒温恒压下,通入惰性气体,会使容器中气体体积增大,参与反应的气体分压变小,所以要向着体积增大的方向移动。
解析:(1)未达到平衡时,正反应速率大于逆反应速率;所以v(M正)>v(N逆);L2平衡时SO3浓度低,消耗的SO2和O2少,压强大;所以v(P正)>v(Q逆);故答案为>;>;
(2)N2(g)+3H2(g)2NH3(g)为放热反应,恒温恒容温度不变,绝热恒容温度升高,反应平衡向左移动,转化率低;所以α1>α2;故答案为>;
(3)H2(g)+I2(g)2HI(g)为气体体积分数不变的反应,恒温恒容容器中等比例增加反应物,转化率不变;所以α1=α2;故答案为=;
(4)2SO2(g)+O2(g)2SO3(g)为气体体积分数减小的反应,如果乙反应冲入2molSO3(g),α甲(SO2)+α乙(SO3)=1;题中乙反应中气体体积大,压强大,平衡右移,SO3转化率降低;所以α甲(SO2)+α乙(SO3)<1;故答案为<;
(5)恒温恒压下,如果不通入惰性气体,通入2mol和4molNO2,转化率相等;通入惰性气体后,会使容器中气体体积增大,参与反应的气体分压变小,反应逆向移动,转化率降低,所以α甲>α乙;故答案为>。
18.002mol/(L min) 提高二氧化硫的转化率 放 减小 =
解析: 2SO2(g)+O2(g)2SO3(g)
开始(mol/L) 0.050 0.030 0
改变(mol/L) 0.040 0.020 0.040
平衡(mol/L) 0.010 0.010 0.040
①从反应开始到达到平衡,用SO2表示的平均反应速率:
②加入过量O2,使另一反应物二氧化硫的转化率增大,目的是提高二氧化硫的转化率;
③反应2SO2(g)+O2(g)2SO3(g)的平衡常数表达式为;
④已知:K(300℃)>K(350℃),则升高温度平衡常数减小,平衡向逆反应方向移动,而升高温度平衡向吸热反应的方向移动,则该反应是放热反应。若反应温度升高,平衡逆向移动,则SO2的转化率将减小;
故为:0.002mol/(L min);提高二氧化硫的转化率;;放;减小。
(2)平衡常数只与温度有关,与压强无关,在温度不变的条件下,无论压强怎样变化,平衡常数都不变。故为:=。
19.(1)0.5
(2)6
(3)41%
解析:(1)起始时c(M)=1mol/L、c(N)=2.4mol/L,达到平衡后,M的转化率为60%,则平衡时c(M)=0.4mol/L、c(N)=1.8mol/L、c(P)=0.6mol/L、c(Q)=0.6mol/L,;
(2)若保持温度不变,则平衡常数不变,因此有,解得a=6;
(3)若保持温度不变,则平衡常数不变,设N的转化率为x,则,解得。
20.KA>KB=KC
解析:平衡常数是温度函数,温度不变,平衡常数不变,由图可知,温度升高,甲醇的体积分数减小,说明平衡向逆反应方向移动,该反应为放热反应,平衡常数减小,B、C的温度相同,高于A,则A、B、C三点的化学平衡常数相对大小为KA>KB=KC;设C点平衡时甲醇的物质的量为amol,由题意可建立如下三段式:
由甲醇的百分含量为50%可得:×100%=50%,解得a=0.5,则平衡时一氧化碳、氢气和甲醇的分压分别为×p2=0.25p2、×p2=0.5p2、×p2=0.25p2,反应的平衡常数Kp===,故答案为:KA>KB=KC;。
21.(1)(a-2b-2c)
(2)> < AD
(3)d
(4)CH3OH-4e-+H2O=HCOOH+4H+
解析:(1)①
②
③
根据盖斯定律①-②×2-③×2得的 (a-2b-2c)。
(2)①由图可知,温度升高CH4的平衡转化率增大,升温平衡向正反应方向移动,该反应的>0;而由催化重整反应可知,相同温度下,增大压强平衡逆向移动,CH4的平衡转化率减小,则<。
② A.的质量分数保持不变,说明浓度不变,反应达到平衡状态,故选A;
B.与H2都是生成物,物质的量比始终为1:1,容器中与H2的百分含量之比保持不变,反应不一定平衡,故不选B;
C.,正逆反应速率比不等于系数比,反应不平衡,故不选C;
D.混合气体总质量不变、混合气体的物质的量是变量,容器中混合气体的平均相对分子质量是变量,混合气体的平均相对分子质量保持不变,反应一定达到平衡状态,故选D;
选AD。
③压强为p4、投料比=1、950℃的条件下,,X点平衡常数Kp═==。
(3)升高温度,反应速率加快,k正、k逆都增大,pk都减小,反应 ,正反应吸热,升高温度平衡正向移动,说明k正增大的幅度大于k逆。能表示pk正(pk=-lgk)随T变化关系的是d。
(4)从图分析,右侧由甲醇变成甲酸,失去电子,故右侧为阳极,即b为电源正极,电解过程中阳极电极反应式为CH3OH-4e-+H2O=HCOOH+4H+。
22.(1) 5.0 14.0
(2)其他条件相同的情况下,H+的浓度越大,反应速率越快
(3)2 8×104
(4)5.12×10-3
【分析】探究H+浓度对MnO2与H2O2反应速率的影响,需要控制变量,只改变H+浓度,其他量都必须相同。
解析:(1)为了探究H+浓度对MnO2与H2O2反应速率的影响,只改变H+浓度,其他量都必须相同,所以V1=5.0mL;水和硫酸的体积之和为15.0mL,所以表中V4=14.0mL。
(2)实验测得t2>t3>t4,则实验2、3、4的反应速率依次加快,则可得出的实验结论是:其他条件相同的情况下,H+的浓度越大,反应速率越快。
(3)将3组实验数据代入v=k cx(NO) cy(H2),中有:
,
,
,解得:x=2,y=1,k=8×104。
(4)若800℃时,初始浓度c(NO)=c(H2)=4.00×10-3mol·L-1,则生成N2的初始速率v=8×104×c2(NO)·c( H2) =8×104×(4.00×10-3)2×(4.00×10-3)=5.12×10-3mol·L-1·s-1
同课章节目录
- 第1章 化学反应与能量转化
- 第1节 化学反应的热效应
- 第2节 化学能转化为电能——电池
- 第3节 电能转化为化学能——电解
- 第4节 金属的腐蚀与防护
- 微项目 设计载人航天器用化学电池与氧气再生方案——化学反应中能量及物质的转化利用
- 第2章 化学反应的方向、 限度与速率
- 第1节 化学反应的方向
- 第2节 化学反应的限度
- 第3节 化学反应的速率
- 第4节 化学反应条件的优化——工业合成氨
- 微项目 探讨如何利用工业废气中的二氧化碳合成甲醇——化学反应选择与反应条件优化
- 第3章 物质在水溶液中的行为
- 第1节 水与水溶液
- 第2节 弱电解质的电离 盐类的水解
- 第3节 沉淀溶解平衡
- 第4节 离子反应
- 微项目 揭秘索尔维制碱法和侯氏制碱法——化学平衡思想的创造性应用
