第2章 化学反应的方向、限度与速率(含解析) 测试题 2023-2024学年高二上学期鲁科版(2019)化学选择性必修1
文档属性
| 名称 | 第2章 化学反应的方向、限度与速率(含解析) 测试题 2023-2024学年高二上学期鲁科版(2019)化学选择性必修1 | 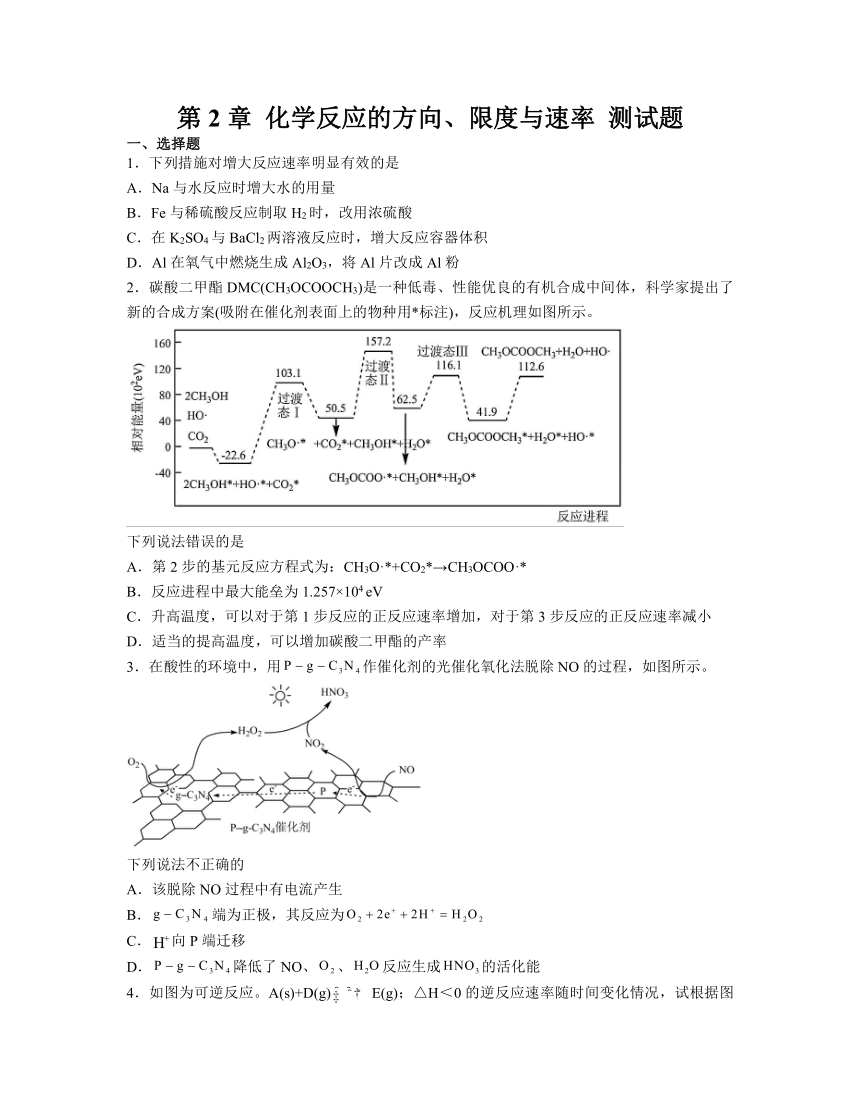 | |
| 格式 | docx | ||
| 文件大小 | 792.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-16 12:19:52 | ||
图片预览




文档简介
第2章 化学反应的方向、限度与速率 测试题
一、选择题
1.下列措施对增大反应速率明显有效的是
A.Na与水反应时增大水的用量
B.Fe与稀硫酸反应制取H2时,改用浓硫酸
C.在K2SO4与BaCl2两溶液反应时,增大反应容器体积
D.Al在氧气中燃烧生成Al2O3,将Al片改成Al粉
2.碳酸二甲酯DMC(CH3OCOOCH3)是一种低毒、性能优良的有机合成中间体,科学家提出了新的合成方案(吸附在催化剂表面上的物种用*标注),反应机理如图所示。
下列说法错误的是
A.第2步的基元反应方程式为:CH3O·*+CO2*→CH3OCOO·*
B.反应进程中最大能垒为1.257×104 eV
C.升高温度,可以对于第1步反应的正反应速率增加,对于第3步反应的正反应速率减小
D.适当的提高温度,可以增加碳酸二甲酯的产率
3.在酸性的环境中,用作催化剂的光催化氧化法脱除NO的过程,如图所示。
下列说法不正确的
A.该脱除NO过程中有电流产生
B.端为正极,其反应为
C.向P端迁移
D.降低了NO、、反应生成的活化能
4.如图为可逆反应。A(s)+D(g)E(g);△H<0的逆反应速率随时间变化情况,试根据图中曲线判断下列说法中不正确的是
A.t3时刻可能采取的措施是减小c(D) B.t5时刻可能采取的措施是降温
C.t7时刻可能采取的措施是减小压强 D.t5~t6时间段平衡向逆反应方向移动
5.把0.6mol X气体和0.4mol Y气体混合于2L容器中,使它们发生如下反应:3X(g)+Y(g)=nZ(g)+2W(g)。5min末生成0.2mol W,若测得以Z浓度变化来表示的化学反应速率为0.01mol/(L·min),则上述反应中Z气体的化学计量数n的值是
A.1 B.2 C.3 D.4
6.对于反应4NH3(g)+5O2(g)4NO(g)+6H2O(g),下列有关说法不正确的是
A.上述反应的平衡常数表达式K=
B.适当提高NH3的浓度,可以加快反应速率,提高NH3的转化率
C.1molN—H断裂同时有1molO—H断裂,说明达该条件下的平衡状态
D.其它条件不变,加入高效的催化剂能提高单位体积内的活化分子百分数
7.下列说法正确的是
A.化学反应速率通常用单位时间内反应物或生成物的质量变化来表示
B.用不同物质的浓度变化表示同一时间内同一反应的速率时,其数值之比等于反应方程式中对应物质的化学计量数之比
C.由v=计算所得化学反应速率为某时刻的瞬时速率
D.在反应过程中,反应物的浓度逐渐变小,所以用反应物表示的化学反应速率为负值
8.对于反应,下列表示中反应速率最快的是。
A. B.
C. D.
9.工业上合成CH3OH的原理为2H2(g)+CO(g)CH3OH(g),一定温度下,向1L恒容密闭容器中充入H2和CO,反应达平衡时CH3OH的体积分数与反应物投料之比[n(H2)/n(CO)]的关系如图所示[假设投料时n(CO)不变],下列说法错误的是
A.相同条件下,达到平衡时混合气体的密度与反应前相同
B.a、b、c、d四点中,c点CO的转化率最大
C.a、b、c、d四点中d处CH3OH的物质的量最大
D.图像中c点到d点,平衡向正反应方向移动
10.反应C(s)+H2O(g)CO(g)+H2(g)在一可变容积的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是
①增加C的量 ②保持体积不变,充入N2使体系压强增大
③将容器的体积缩小一半 ④保持压强不变,充入N2使容器体积变大
A.①④ B.②③ C.①② D.③④
11.已知反应的,,下列正确的是
A.低温下能自发进行 B.高温下能自发进行
C.任何温度下都不能自发进行 D.任何温度下都能自发进行
12.在一定温度下,某恒容密闭容器内的某一反应中,气体X、气体Y的物质的量随反应时间的变化曲线如图所示,下列表述正确的是
A.t1时,Y的浓度是X的浓度的2倍
B.反应的化学方程式为2X3Y
C.t2时,反应的正、逆反应速率相等,达到平衡状态
D.t3时,X、Y的量不再变化,化学反应停止了,正、逆反应速率为零
13.下列说法正确的是
A.甲烷的燃烧热ΔH=﹣890.4 kJ/mol,则甲烷燃烧的热化学方程式可表示为:CH4(g)+O2(g)=CO2(g)+H2O(l) △H=-445.2 kJ/mol
B.一定条件下,将 0.5 mol N2和 1.5 mol H2置于密闭容器中充分反应生成 NH3放热 19.3 kJ,其热化学方程式为 N2(g)+3H2(g)2NH3(g)ΔH=﹣38.6 kJ/mol
C.由水电离出的 c(H+)=1×10-12mol·L-1的溶液中可能大量存在:K+、I-、Mg2+、
D.已知C(s)+CO2(g)=2CO(g) ΔH>0,则该反应在低温条件下容易自发进行
14.已知在等温等压条件下,化学反应方向的判据为:ΔH-TΔS<0 反应能正向自发进行,ΔH-TΔS=0 反应达到平衡状态, ΔH-TΔS>0 反应不能自发进行。设反应A=D+E ΔH-TΔS=(-4 500+11T) J·mol-1,要防止反应发生,温度必须( )
A.高于409 K B.低于136 K
C.高于136 K而低于409 K D.低于409 K
15.钒的配合物催化某可逆反应的一种反应机理如下图所示。下列说法错误的是
A.该反应的离子方程式为:
B.产物可用于杀菌消毒
C.该催化循环中V的成键数目发生变化
D.钒的配合物通过参与反应,降低反应的活化能,提高的平衡转化率
二、填空题
16.氢气用于工业合成氨N2(g)+3H2(g)2NH3(g);ΔH=-92.2kJ·mol-1。一定温度下,在容积恒定的密闭容器中,一定量的N2和H2反应达到平衡后,改变某一外界条件,反应速率与时间的关系如下图所示,其中t4 ﹑t5﹑t7时刻所对应的实验条件改变分别是
t4 。t5 。t7 。
17.如图表示800℃时A、B、C三种气体物质的浓度随时间变化的情况,t是到达平衡状态的时间。试回答:
(1)该反应的反应物是 。
(2)该反应的化学反应方程式为 。
(3)若达到平衡状态的时间是2min,A物质的平均反应速率为 。
(4)假设该反应在体积固定的密闭容器中进行,下列能做为判断该反应达到化学平衡状态的标志的是 。
A.每有3molA消耗,就会有3molC消耗 B.B的体积分数保持不变
C.气体的密度保持不变 D.B和C的浓度之比1:3
(5)达到平衡时,A的体积分数是 。
18.合成氨工业对国民经济和社会发展具有重要的意义。其原理为:;据此回答以下问题:
(1)根据温度对化学平衡的影响规律可知,对于该反应温度越高,其化学平衡常数的值 。(填“越大”、“越小”或“不变”)
(2)某温度下,若把与置于体积为的密闭容器内,反应达到平衡状态时,测得混合气体的压强变为开始时的,则平衡时氢气的转化率= (用百分数表示。能说明该反应达到化学平衡状态的是 填字母。
a.容器内的密度保持不变b.容器内压强保持不变
c.v正(N2)=2v逆(NH3) d.混合气体中c(NH3)不变
(3)某2L恒容密闭容器中充入2mol X(g)和1mol Y(g)发生反应:2X(g)+Y(g) 3Z(g)△H,反应过程中持续升高温度,测得混合体系中X的体积分数与温度的关系如图所示,△H 0
19.一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如下图所示,
请回答下列问题:
(1)反应开始到10s,用Z表示的反应速率为 mol/(L·s)。
(2)反应开始到10s,X的物质的量浓度减少了 mol/L。
(3)反应开始到10s,Y的转化率为 。
(4)反应的化学方程式为 。
(5)10s之后,该反应达到 状态。
20.2SO2(g)+O2(g)2SO3(g)ΔH<0是制备硫酸的重要反应。将4molSO2与2molO2放入2L的密闭容器中,在一定条件下反应5min达到平衡,测得平衡时SO3的浓度为1.5mol/L。
(1)用O2表示的平均速率为 ,平衡时SO2的转化率为 。
(2)写出该反应的化学平衡常数表达式K= ;如温度升高时,K值将 (选填“增大”“减小”或“不变”)。
(3)若不改变反应温度和反应物中SO2的起始浓度,使SO2的平衡转化率达到90%,则O2的起始物质的量浓度为 mol/L。
21.在一定体积的密闭容器中,进行如下化学反应:CO2+H2CO+H2O,其化学平衡常数K 和温度t 的关系如下表:
t℃ 700 800 830 1000 1200
K 0.6 0.9 1.0 1.7 2.6
回答下列问题:
(1)此反应化学平衡常数表达式:K= 。该化学反应的正反应为 反应(填“吸热”、“放热”),原因是 。
(2)能说明该反应达到化学平衡状态的是 。
a.混合气体平均相对分子质量不变 b.混合气体中 c(CO)不变
c.该反应化学平衡常数的值不再变化 d.CO2 和H2 的消耗速率相等
(3)某温度下,平衡浓度符合下式 13c(CO2)·c(H2)=5c(CO)·c(H2O),则此时的温度为 ℃。若此时生成物与反应物能量差的绝对值为 a,写出此反应的热化学方程式 。
(4)830℃时,在 1L 密闭容器中分别投入 lmolH2 和 lmolCO 2 反应达到化学平衡时,CO2 的转化率为 ;保持温度不变,在平衡体系中再充入 1molH2 和 lmolCO2 重新达到化学平衡时,CO2 的平衡转化率 (填“增大”、“减小”或“不变”)。
(5)假设反应 xA+yBzC 在某温度下达到平衡。若A、B、C 都是气体,减压后正反应速率小于逆反应速率,则 x、y、z的关系是 。若 C 为气体,且 x+y=z,在加压时化学平衡发生移动,则平衡必定向 方向移动。如果在体系中增加或减少B 的量,平衡均不发生移动,则B 肯定不能为 态。
22.为验证化学反应“2Fe3++2I-=2Fe2++I2”是可逆反应,并探究平衡移动与物质的浓度、性质的关系,甲、乙两同学进行如下实验。
已知:a.含I2的溶液呈黄色或棕黄色。
b.利用色度计可测定溶液的透光率,通常溶液颜色越深,透光率数值越小。
I.甲同学设计下列实验进行相关探究,实验如图1所示。
回答下列问题:
(1)甲同学利用实验②中ⅰ和ⅱ证明Fe2(SO4)3溶液与KI溶液的反应为可逆反应,实验ⅰ中的现象是 ,实验ⅱ中a是 (填化学式)溶液。
(2)用离子方程式表示实验②ⅲ中产生黄色沉淀的原因 。
II.乙同学:利用色度计对Fe2(SO4)3溶液与KI溶液的反应进行再次探究。
【实验过程】
序号 实验步骤1 实验步骤2
实验③ 将盛有2mL蒸馏水的比色皿放入色度计的槽孔中 向比色皿中逐滴滴入5滴(每滴约0.025mL)0.05mol L-1Fe2(SO4)3溶液,同时采集溶液的透光率数据
实验④ 将盛有2mL0.1mol L-1KI溶液的比色皿放入色度计的槽孔中 同上
实验⑤ 将盛有2mL0.2mol L-1KI溶液的比色皿放入色度计的槽孔中 同上
实验中溶液的透光率数据变化如图2所示。
回答下列问题:
(3)乙同学实验③的目的是 。
(4)乙同学通过透光率变化推断:FeCl3溶液与KI溶液的反应为可逆反应.理由是 。
(5)乙同学根据氧化还原反应的规律,用图3装置(a、b均为石墨电极),探究化学平衡移动与I-、Fe2+的浓度及还原性强弱关系,操作过程如图:
①K闭合时,电流计指针向右偏转,乙同学得出结论:2Fe3++2I-2Fe2++I2向正反应方向进行,b作 (填“正”或“负”)极,还原性I->Fe2+。
②当指针归零(反应达到平衡)后,向U型管右管滴加0.1mol L-1FeSO4溶液,电流计指针向左偏转,由此得出还原性为Fe2+ I-(填“>”或“<”)。
(6)综合甲、乙两位同学的实验探究过程,可得出结论:2Fe3++2I-=2Fe2++I2为可逆反应,改变条件可使平衡移动;Fe3+和I2的氧化性强弱受 影响。
【参考答案】
一、选择题
1.D
解析:A.水为纯液体,增加水的用量不能增大反应速率,A错误;
B.常温下Fe在浓硫酸中会发生钝化,加热时反应生成二氧化硫,B错误;
C.压强不能影响液体之间的反应速率,C错误;
D.将Al片改成Al粉,增大接触面积,加快反应速率,D正确;
综上所述答案为D。
2.C
解析:A.第2步的基元反应方程式为:CH3OH·*+CO2* → CH3OCOO·*,A正确;
B.最大能垒为第1步基元反应:CH3OH*+HO·* → CH3O·*+H2O*,其差值为1.257×104 eV,B正确;
C.升高温度,对于反应速率均增加,C错误;
D.总反应为2CH3OH+CO2 CH3OCOOCH3+H2O ΔH>0,为吸热反应;因此适当的提高温度,可以增加碳酸二甲酯的产率,D正确;
故选C。
3.C
解析:A.该脱除NO过程中存在元素化合价的改变,则存在电子的转移,故有电流产生,A正确;
B.端的氧气得到电子发生还原生成过氧化氢,故为正极,其反应为,B正确;
C.P极NO失去电子为负极,原电池中阳离子向正极移动,C错误;
D.用作催化剂的光催化氧化法脱除NO,催化剂改变反应历程,降低了反应的活化能,D正确;
故选C。
4.D
解析:A.由图可知,t3时刻v逆减小,且是在原来的基础上减小,是改变物质的浓度引起的,可能是减少c(D),故A正确;
B.t5时刻,逆反应速率突然减小,可能是降低温度所致,故B正确;
C.t7时刻,逆反应速率减小,t7之后,逆反应速率不再改变,反应达平衡,反应为气体体积分数不变的反应,所以可能是减小压强所致,故C正确;
D.t5时刻,逆反应速率突然减小,之后在t5~t6时间段内,逆反应速率逐渐增大,说明平衡正向移动,故D错误;
故答案选D。
5.A
解析:5min末已生成0.2molW,则v (w)== =0.02mol·(L·min)-1,根据速率之比等于化学计量数之比,v (Z):v (W) =n:2=0.01mol·(L·min)-1:0.02mol·(L·min)-1,解得n=1;
答案选A。
6.B
解析:A.由方程式可知,反应的平衡常数表达式K=,故A正确;
B.适当提高氨气的浓度,反应速率加快,平衡向正反应方向移动,但氨气的转化率减小,故B错误;
C.由方程式可知,1molN—H断裂同时有1molO—H断裂说明正逆反应速率相等,反应已达到平衡,故C正确;
D.其它条件不变,加入高效的催化剂能提高单位体积内的活化分子百分数,加快反应速率,故D正确;
故选B。
7.B
解析:A.化学反应速率通常用单位时间内反应物或生成物的浓度变化来表示,A错误;
B.用不同物质的浓度变化表示同一时间内、同一反应的速率时,其数值之比等于反应方程式中对应物质的化学计量数之比,B正确;
C.化学反应速率表示化学反应在某一时间段内的平均速率,而不是瞬时速率,C错误;
D.在计算化学反应速率时,取浓度变化的绝对值,故化学反应速率恒为正值,D错误;
故答案为:B。
8.C
【分析】根据速率之比等于化学计量数之比,先都转化为用B表示的反应速率且要统一单位,再进行比较。
解析:A.A为固体,不能用浓度变化量表示其反应速率;
B.;
C. ;
D.;
则反应速率v(C)>v(B)>v(D);
故答案选C。
9.B
解析:A.由质量守恒定律可知,反应前后气体的质量相等,在恒容密闭容器中混合气体的密度始终不变,所以相同条件下,达到平衡时混合气体的密度与反应前相同,故A正确;
B.反应物投料之比增大相当于增大氢气的浓度,平衡向正反应方向移动,一氧化碳的转化率增大,则d点一氧化碳的转化率最大,故B错误;
C.反应物投料之比增大相当于增大氢气的浓度,平衡向正反应方向移动,一氧化碳的转化率增大,则a、b、c、d四点中d点一氧化碳的转化率最大,甲醇的物质的量最大,故C正确;
D.由图可知,c点到d点相当于增大氢气的浓度,平衡向正反应方向移动,故D正确;
故选B。
10.C
解析:①C在该反应中是固体,增加固体的量不会影响反应物浓度等,不会改变化学反应速率;
②N2不参加化学反应,保持体积不变,充入N2不会改变反应物分压,化学反应速率不变;
③压缩体积将使参加反应的物质浓度增大,化学反应速率将增大;
④N2不参加化学反应,保持压强不变,充入N2使容器体积变大,参加反应的各物质的分压将减小,化学反应速率将减小;
综上所述,条件的改变对其反应速率几乎无影响的是①②,故答案为C。
11.C
【分析】根据吉布斯自由能可判断反应是否自发进行,当时,反应能自发进行,据此分析解答。
解析:反应的,,因为T,则一定大于0,即反应在任何温度下都不能自发进行,C项符合题意。
故选C。
12.A
解析:A.t1时,Y的物质的量为6mol,X的物质的量为3mol,容器体积恒定不变,则Y的浓度是X浓度的2倍,故A正确;
B.t2时,X和Y的物质的量均为4mol,X的物质的量增加2mol,Y的物质的量减少4mol,X是生成物,Y是反应物,物质的量变化量之比=反应计量系数之比,反应的方程式为2Y X,故B错误;
C.平衡时反应体系各组分的含量不变,t2时之后,X、Y的量还在变化,反应未达到平衡状态,故C错误;
D.t3时,X、Y的量不再变化,反应达到平衡状态,平衡状态为动态平衡,正逆反应速率相等,但不为零,故D错误;
答案选A。
13.A
解析:A.甲烷的燃烧热ΔH=﹣890.4 kJ/mol,指1mol甲烷完全燃烧生成CO2气体和液态水时放出890.4kJ热量,则甲烷燃烧的热化学方程式可表示为:CH4(g)+O2(g)=CO2(g)+H2O(l) △H=-445.2 kJ/mol,故A正确;
B.合成氨是可逆反应,反应物转化率始终小于100%,则一定条件下,将 0.5 mol N2和 1.5 mol H2置于密闭容器中充分反应生成 NH3放热 19.3 kJ,实际参加反应的N2小于0.5mol,说明1molN2完全转化时释放的能量大于38.6 kJ,则热化学方程式 N2(g)+3H2(g)2NH3(g)中ΔH<﹣38.6 kJ/mol,故B错误;
C.由水电离出的 c(H+)=1×10-12mol·L-1的溶液pH=2或pH=12,Mg2+在碱性溶液中不能大量共存,而酸性溶液中I-能被氧化,不能大量共存,则此溶液中不可能大量存在K+、I-、Mg2+、,故C错误;
D.已知C(s)+CO2(g)=2CO(g) ΔH>0,该反应的Δs>0,则根据ΔG=ΔH-TΔS可知,只有高温下ΔG才可能小于0,反应能自发进行,故D错误;
故答案为A。
14.A
解析:已知反应A═D+E △H-T△S=(-4 500+11T )J·mol-1,(温度单位为K)。要防止A分解反应发生,需要△H-T△S=(-4 500+11T )J·mol-1≥0,计算得到:T≥409K,故选A。
15.D
解析:A.由图示知,整个过程输入H2O2、Cl-、H+、H2O物质的量之比为1:1:1:1,生成H2O、HOCl物质的量之比为2:1,故该反应离子方程式为:H2O2+Cl-+H+= H2O+HOCl,A正确;
B.产物HOCl,即次氯酸,具有强氧化性,可以杀菌消毒,B正确;
C.该催化循环过程中,有V元素形成6根键,也有V元素形成5根键的情况,C正确;
D.钒的配合物在过程中起到催化作用,即作催化剂,而催化剂对平衡移动没有影响,故不会影响H2O2平衡转化率,D错误;
故答案选D。
二、填空题
16.加入催化剂 减小NH3浓度 降温
解析:t4时刻正逆反应速率均变大且相等,所对应的实验条件改变是使用催化剂;t5时刻正反应速率不变,而逆反应速率减小,则说明生成物浓度减小,所对应的实验条件改变是减小NH3浓度;t7时刻正逆反应速率均小,且逆反应速率更小,平衡正向移动,所对应的实验条件改变是降温;
17.(1)A
(2)3A(g)B(g)+3C(g)
(3)0.6mol/(L·min)
(4)AB
(5)42.9%
解析:(1)由A的物质的量浓度不断减小,可以判断A为反应物;
(2)A为反应物,B、C为生成物,又根据反应的系数之比等于反应的物质的量之比,可得反应的方程式为3A(g)B(g)+3C(g);
(3)A的反应速率==0.6mol/(L·min);
(4)A.每有3molA消耗是正反应方向,3molC消耗是逆反应方向,正逆反应速率相等,达到了平衡,正确;
B.B的体积分数保持不变,即B的量不再变化,达到了平衡,正确;
C.气体的容积和质量恒定,即密度恒定,故密度保持不变,不一定平衡,错误;
D.B和C的浓度之比1:3,不一定平衡,错误;
故选AB。
(5)达平衡时,A的体积分数=×100%≈42.9%.
18.(1)越小
(2)20% bd
(3)<
解析:(1)合成氨为放热反应,升高温度,平衡逆移,平衡常数减小,故温度越高,其化学平衡常数的值越小。
(2)把与置于体积为的密闭容器内,设反应达平衡时N2转化的物质的量为x,
根据理想气体状态方程,可知恒温恒容条件下,反应前后的压强之比等于气体的总物质的量之比,则
,解x=2,平衡时氢气的转化率=;
反应体系中全部为气体,气体的总质量为定值,恒容条件下,气体的密度不变,不能作为达平衡的标志,a项错误;
该反应为气体分子数减小的反应,恒容装置中,随着反应的进行,体系的压强减小,容器内压强不变说明反应已经达到平衡状态,b项正确;
根据反应的方程式为,可知达平衡时2v正(N2)= v逆(NH3),c项错误;
c(NH3)会随着反应的进行而变化,混合气体中c(NH3)不变,说明反应已经达到平衡状态,d项正确;
故选bd。
(3)结合图象可知,Q点之前反应未达到平衡,随着反应正向进行,混合体系中X的体积分数逐渐减小,Q点之后反应已经达到平衡状态,升高温度,混合体系中X的体积分数增大,说明升温平衡逆移,则正反应为放热反应,故。
19.079 0.395 79% X+Y 2Z 化学平衡
【分析】(1)根据化学反应速率计算公式计算Z表示的反应速率;
(2)根据图像判断X的物质的量浓度减少量;
(3)根据转化率计算公式计算Y的转化率;
(4)根据各物质曲线的走向和变化的量分析化学反应方程式;
(5)当各物质的物质的量不再变化时,反应达到平衡状态。
解析:(1)根据图像可知,反应开始到10s,Z的物质的量增加了1.58mol,则用Z表示的反应速率为:v(Z)= =0.079 mol/(L·s);
(2)根据图像可知,反应开始到10s,X的物质的量浓度减少量为 =0.395 mol/L ;
(3)反应开始到10s时,Y的转化率=×100%=×100%=79%;
(4)由图像可以看出,X、Y的物质的量减少,Z的物质的量增多,则X、Y为反应物,Z为生成物,到10s后各物质的物质的量均不再变化且不为0,说明该反应为可逆反应,化学反应中各物质的物质的量的变化量之比等于化学计量数之比,则有X∶Y∶Z=(1.20mol-0.41mol)∶(1.0mol-0.21mol)∶1.58mol=1∶1∶2,所以该反应的化学方程式为X+Y 2Z;
(5)根据图像可知,10s后各物质的物质的量不再变化,说明该可逆反应达到了化学平衡状态。
20.15mol/(L·min) 75% 减小 3.15
解析:(1)由题意有物质的量浓度的变化量之比等于化学计量数之比,则,所以平衡时;则氧气的反应速率,二氧化硫的转化率,故答案为:0.15mol/(L·min);75%;
(2)由2SO2(g)+O2(g)2SO3(g) ΔH<0可知,该反应的平衡常数K=,化学平衡常数只与温度有关,由于该反应ΔH<0为放热反应,升高温度平衡逆向移动,平衡常数减小,故答案为:;减小;
(3)由可知该反应的平衡常数;若不改变反应温度和反应物中SO2的起始浓度,使SO2的平衡转化率达到90%,则设O2的起始物质的量浓度为amol/L,则由可得,由于温度不变,所以,则,解得a=3.15mol/L,故答案为:3.15。
21.(1) 吸热 温度升高,化学平衡常数增大,说明平衡向正反应方向移动,该反应为吸热反应
(2)b
(3)1200 CO2(g)+H2(g)CO(g)+H2O(g) △H=+akJ/mol
(4)50% 不变
(5)x+y>z 逆反应 气
解析:(1)
由方程式可知,反应的化学平衡常数K=;由表格数据可知,温度升高,化学平衡常数增大,说明平衡向正反应方向移动,该反应为吸热反应,故答案为:;吸热;温度升高,化学平衡常数增大,说明平衡向正反应方向移动,该反应为吸热反应
(2)
a.由质量守恒定律可知,反应中气体的质量相等,在恒容密闭容器中混合气体的密度始终不变,则混合气体的密度保持不变不能说明正逆反应速率相等,无法判断反应是否达到平衡,故错误;
b.混合气体中一氧化碳浓度不变不变说明正逆反应速率相等,反应已达到平衡,故正确;
c.化学平衡常数为温度函数,温度不变,平衡常数不变,则该反应化学平衡常数的值不再变化不能说明正逆反应速率相等,无法判断反应是否达到平衡,故错误;
d.二氧化碳和氢气的消耗速率都代表正反应速率,则二氧化碳和氢气的消耗速率相等不能说明正逆反应速率相等,无法判断反应是否达到平衡,故错误;
故选b;
(3)
由平衡浓度符合下式13c(CO2)·c(H2)=5c(CO)·c(H2O)可知,该温度下反应的平衡常数K===2.6,由表格数据可知,此时的温度为1200℃;由此时生成物与反应物能量差的绝对值为 a可知,反应的热化学方程式为CO2(g)+H2(g)CO(g)+H2O(g) △H=+akJ/mol,故答案为:1200;CO2(g)+H2(g)CO(g)+H2O(g) △H=+akJ/mol;
(4)
设830℃反应达到平衡时二氧化碳的转化率为a,由题给数据可建立如下三段式:
由平衡常数为1.0可得:=1.0,解得a=0.5,既50%;保持温度不变,在平衡体系中再充入 1mol氢气和 lmol二氧化碳相当于增大压强,该反应是气体体积不变的反应,增大压强,化学平衡不移动,则重新达到化学平衡时,二氧化碳 的平衡转化率不变,故答案为:50%;不变;
(5)
若A、B、C 都是气体,减压后正反应速率小于逆反应速率说明平衡向逆反应方向移动,该反应为是气体体积减小的反应,则x、y、z的关系是x+y>z;若 C 为气体,且 x+y=z,在加压时化学平衡发生移动说明A、B中必定有1个是非气态,该反应为气体体积增大的反应,平衡向逆反应方向移动;如果在体系中增加或减少B 的量,平衡均不发生移动说明B 肯定不能为气态,故答案为:x+y>z;逆反应;气。
22.(1) 溶液变蓝 KSCN
(2)Ag++I-=AgI↓
(3)排除实验④和实验⑤中Fe3+对溶液透光率的干扰
(4)溶液的透光率不再随时间改变后,实验⑤的溶液透光率低于实验④,说明实验④中虽然KI过量但仍有未反应的Fe3+
(5)正 >
(6)浓度
解析:(1)该反应的化学方程式:2Fe3++2I- 2Fe2++I2,产物有碘单质,加入到淀粉溶液,可观察到溶液变蓝,若该反应存在限度,则应剩余Fe3+,实验ii中a是KSCN溶液,Fe3+与SCN 形成配合物,溶液呈红色;
(2)反应2Fe3++2I- 2Fe2++I2,存在反应限度,则还剩余I ,加入AgNO3溶液,形成黄色沉淀,用离子方程式表示为:Ag++I =AgI↓,
(3)该探究实验是探究I 浓度对反应的影响,而透光率与溶液的颜色有关,故用实验③加蒸馏水,把Fe3+的浓度影响控制一致,与实验④、⑤对照,排除实验④和实验⑤中Fe3+对溶液透光率的干扰;
(4)分析实验④和⑤,溶液透光率不再随时间改变后,实验⑤的溶液透光率低于实验④的溶液透光率,说明实验④中虽然KI过量,但仍有未反应的Fe3+,可以说明该反应存在限度;
(5)①电流计指针向右偏转,说明b极Fe3+得到电子,作正极;
②电流计指针向左偏转,说明a极的I2得电子生成I ,由此得出还原性Fe2+>I ;
(6)甲同学实验是为了证明该反应存在限度,乙同学是探究浓度对物质的氧化性和还原性的影响,综合甲、乙两位同学的实验探究过程,得出的结论有:2Fe3++2I- 2Fe2++I2存在限度;改变条件可使平衡移动;物质的氧化性与还原性强弱受浓度影响
一、选择题
1.下列措施对增大反应速率明显有效的是
A.Na与水反应时增大水的用量
B.Fe与稀硫酸反应制取H2时,改用浓硫酸
C.在K2SO4与BaCl2两溶液反应时,增大反应容器体积
D.Al在氧气中燃烧生成Al2O3,将Al片改成Al粉
2.碳酸二甲酯DMC(CH3OCOOCH3)是一种低毒、性能优良的有机合成中间体,科学家提出了新的合成方案(吸附在催化剂表面上的物种用*标注),反应机理如图所示。
下列说法错误的是
A.第2步的基元反应方程式为:CH3O·*+CO2*→CH3OCOO·*
B.反应进程中最大能垒为1.257×104 eV
C.升高温度,可以对于第1步反应的正反应速率增加,对于第3步反应的正反应速率减小
D.适当的提高温度,可以增加碳酸二甲酯的产率
3.在酸性的环境中,用作催化剂的光催化氧化法脱除NO的过程,如图所示。
下列说法不正确的
A.该脱除NO过程中有电流产生
B.端为正极,其反应为
C.向P端迁移
D.降低了NO、、反应生成的活化能
4.如图为可逆反应。A(s)+D(g)E(g);△H<0的逆反应速率随时间变化情况,试根据图中曲线判断下列说法中不正确的是
A.t3时刻可能采取的措施是减小c(D) B.t5时刻可能采取的措施是降温
C.t7时刻可能采取的措施是减小压强 D.t5~t6时间段平衡向逆反应方向移动
5.把0.6mol X气体和0.4mol Y气体混合于2L容器中,使它们发生如下反应:3X(g)+Y(g)=nZ(g)+2W(g)。5min末生成0.2mol W,若测得以Z浓度变化来表示的化学反应速率为0.01mol/(L·min),则上述反应中Z气体的化学计量数n的值是
A.1 B.2 C.3 D.4
6.对于反应4NH3(g)+5O2(g)4NO(g)+6H2O(g),下列有关说法不正确的是
A.上述反应的平衡常数表达式K=
B.适当提高NH3的浓度,可以加快反应速率,提高NH3的转化率
C.1molN—H断裂同时有1molO—H断裂,说明达该条件下的平衡状态
D.其它条件不变,加入高效的催化剂能提高单位体积内的活化分子百分数
7.下列说法正确的是
A.化学反应速率通常用单位时间内反应物或生成物的质量变化来表示
B.用不同物质的浓度变化表示同一时间内同一反应的速率时,其数值之比等于反应方程式中对应物质的化学计量数之比
C.由v=计算所得化学反应速率为某时刻的瞬时速率
D.在反应过程中,反应物的浓度逐渐变小,所以用反应物表示的化学反应速率为负值
8.对于反应,下列表示中反应速率最快的是。
A. B.
C. D.
9.工业上合成CH3OH的原理为2H2(g)+CO(g)CH3OH(g),一定温度下,向1L恒容密闭容器中充入H2和CO,反应达平衡时CH3OH的体积分数与反应物投料之比[n(H2)/n(CO)]的关系如图所示[假设投料时n(CO)不变],下列说法错误的是
A.相同条件下,达到平衡时混合气体的密度与反应前相同
B.a、b、c、d四点中,c点CO的转化率最大
C.a、b、c、d四点中d处CH3OH的物质的量最大
D.图像中c点到d点,平衡向正反应方向移动
10.反应C(s)+H2O(g)CO(g)+H2(g)在一可变容积的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是
①增加C的量 ②保持体积不变,充入N2使体系压强增大
③将容器的体积缩小一半 ④保持压强不变,充入N2使容器体积变大
A.①④ B.②③ C.①② D.③④
11.已知反应的,,下列正确的是
A.低温下能自发进行 B.高温下能自发进行
C.任何温度下都不能自发进行 D.任何温度下都能自发进行
12.在一定温度下,某恒容密闭容器内的某一反应中,气体X、气体Y的物质的量随反应时间的变化曲线如图所示,下列表述正确的是
A.t1时,Y的浓度是X的浓度的2倍
B.反应的化学方程式为2X3Y
C.t2时,反应的正、逆反应速率相等,达到平衡状态
D.t3时,X、Y的量不再变化,化学反应停止了,正、逆反应速率为零
13.下列说法正确的是
A.甲烷的燃烧热ΔH=﹣890.4 kJ/mol,则甲烷燃烧的热化学方程式可表示为:CH4(g)+O2(g)=CO2(g)+H2O(l) △H=-445.2 kJ/mol
B.一定条件下,将 0.5 mol N2和 1.5 mol H2置于密闭容器中充分反应生成 NH3放热 19.3 kJ,其热化学方程式为 N2(g)+3H2(g)2NH3(g)ΔH=﹣38.6 kJ/mol
C.由水电离出的 c(H+)=1×10-12mol·L-1的溶液中可能大量存在:K+、I-、Mg2+、
D.已知C(s)+CO2(g)=2CO(g) ΔH>0,则该反应在低温条件下容易自发进行
14.已知在等温等压条件下,化学反应方向的判据为:ΔH-TΔS<0 反应能正向自发进行,ΔH-TΔS=0 反应达到平衡状态, ΔH-TΔS>0 反应不能自发进行。设反应A=D+E ΔH-TΔS=(-4 500+11T) J·mol-1,要防止反应发生,温度必须( )
A.高于409 K B.低于136 K
C.高于136 K而低于409 K D.低于409 K
15.钒的配合物催化某可逆反应的一种反应机理如下图所示。下列说法错误的是
A.该反应的离子方程式为:
B.产物可用于杀菌消毒
C.该催化循环中V的成键数目发生变化
D.钒的配合物通过参与反应,降低反应的活化能,提高的平衡转化率
二、填空题
16.氢气用于工业合成氨N2(g)+3H2(g)2NH3(g);ΔH=-92.2kJ·mol-1。一定温度下,在容积恒定的密闭容器中,一定量的N2和H2反应达到平衡后,改变某一外界条件,反应速率与时间的关系如下图所示,其中t4 ﹑t5﹑t7时刻所对应的实验条件改变分别是
t4 。t5 。t7 。
17.如图表示800℃时A、B、C三种气体物质的浓度随时间变化的情况,t是到达平衡状态的时间。试回答:
(1)该反应的反应物是 。
(2)该反应的化学反应方程式为 。
(3)若达到平衡状态的时间是2min,A物质的平均反应速率为 。
(4)假设该反应在体积固定的密闭容器中进行,下列能做为判断该反应达到化学平衡状态的标志的是 。
A.每有3molA消耗,就会有3molC消耗 B.B的体积分数保持不变
C.气体的密度保持不变 D.B和C的浓度之比1:3
(5)达到平衡时,A的体积分数是 。
18.合成氨工业对国民经济和社会发展具有重要的意义。其原理为:;据此回答以下问题:
(1)根据温度对化学平衡的影响规律可知,对于该反应温度越高,其化学平衡常数的值 。(填“越大”、“越小”或“不变”)
(2)某温度下,若把与置于体积为的密闭容器内,反应达到平衡状态时,测得混合气体的压强变为开始时的,则平衡时氢气的转化率= (用百分数表示。能说明该反应达到化学平衡状态的是 填字母。
a.容器内的密度保持不变b.容器内压强保持不变
c.v正(N2)=2v逆(NH3) d.混合气体中c(NH3)不变
(3)某2L恒容密闭容器中充入2mol X(g)和1mol Y(g)发生反应:2X(g)+Y(g) 3Z(g)△H,反应过程中持续升高温度,测得混合体系中X的体积分数与温度的关系如图所示,△H 0
19.一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如下图所示,
请回答下列问题:
(1)反应开始到10s,用Z表示的反应速率为 mol/(L·s)。
(2)反应开始到10s,X的物质的量浓度减少了 mol/L。
(3)反应开始到10s,Y的转化率为 。
(4)反应的化学方程式为 。
(5)10s之后,该反应达到 状态。
20.2SO2(g)+O2(g)2SO3(g)ΔH<0是制备硫酸的重要反应。将4molSO2与2molO2放入2L的密闭容器中,在一定条件下反应5min达到平衡,测得平衡时SO3的浓度为1.5mol/L。
(1)用O2表示的平均速率为 ,平衡时SO2的转化率为 。
(2)写出该反应的化学平衡常数表达式K= ;如温度升高时,K值将 (选填“增大”“减小”或“不变”)。
(3)若不改变反应温度和反应物中SO2的起始浓度,使SO2的平衡转化率达到90%,则O2的起始物质的量浓度为 mol/L。
21.在一定体积的密闭容器中,进行如下化学反应:CO2+H2CO+H2O,其化学平衡常数K 和温度t 的关系如下表:
t℃ 700 800 830 1000 1200
K 0.6 0.9 1.0 1.7 2.6
回答下列问题:
(1)此反应化学平衡常数表达式:K= 。该化学反应的正反应为 反应(填“吸热”、“放热”),原因是 。
(2)能说明该反应达到化学平衡状态的是 。
a.混合气体平均相对分子质量不变 b.混合气体中 c(CO)不变
c.该反应化学平衡常数的值不再变化 d.CO2 和H2 的消耗速率相等
(3)某温度下,平衡浓度符合下式 13c(CO2)·c(H2)=5c(CO)·c(H2O),则此时的温度为 ℃。若此时生成物与反应物能量差的绝对值为 a,写出此反应的热化学方程式 。
(4)830℃时,在 1L 密闭容器中分别投入 lmolH2 和 lmolCO 2 反应达到化学平衡时,CO2 的转化率为 ;保持温度不变,在平衡体系中再充入 1molH2 和 lmolCO2 重新达到化学平衡时,CO2 的平衡转化率 (填“增大”、“减小”或“不变”)。
(5)假设反应 xA+yBzC 在某温度下达到平衡。若A、B、C 都是气体,减压后正反应速率小于逆反应速率,则 x、y、z的关系是 。若 C 为气体,且 x+y=z,在加压时化学平衡发生移动,则平衡必定向 方向移动。如果在体系中增加或减少B 的量,平衡均不发生移动,则B 肯定不能为 态。
22.为验证化学反应“2Fe3++2I-=2Fe2++I2”是可逆反应,并探究平衡移动与物质的浓度、性质的关系,甲、乙两同学进行如下实验。
已知:a.含I2的溶液呈黄色或棕黄色。
b.利用色度计可测定溶液的透光率,通常溶液颜色越深,透光率数值越小。
I.甲同学设计下列实验进行相关探究,实验如图1所示。
回答下列问题:
(1)甲同学利用实验②中ⅰ和ⅱ证明Fe2(SO4)3溶液与KI溶液的反应为可逆反应,实验ⅰ中的现象是 ,实验ⅱ中a是 (填化学式)溶液。
(2)用离子方程式表示实验②ⅲ中产生黄色沉淀的原因 。
II.乙同学:利用色度计对Fe2(SO4)3溶液与KI溶液的反应进行再次探究。
【实验过程】
序号 实验步骤1 实验步骤2
实验③ 将盛有2mL蒸馏水的比色皿放入色度计的槽孔中 向比色皿中逐滴滴入5滴(每滴约0.025mL)0.05mol L-1Fe2(SO4)3溶液,同时采集溶液的透光率数据
实验④ 将盛有2mL0.1mol L-1KI溶液的比色皿放入色度计的槽孔中 同上
实验⑤ 将盛有2mL0.2mol L-1KI溶液的比色皿放入色度计的槽孔中 同上
实验中溶液的透光率数据变化如图2所示。
回答下列问题:
(3)乙同学实验③的目的是 。
(4)乙同学通过透光率变化推断:FeCl3溶液与KI溶液的反应为可逆反应.理由是 。
(5)乙同学根据氧化还原反应的规律,用图3装置(a、b均为石墨电极),探究化学平衡移动与I-、Fe2+的浓度及还原性强弱关系,操作过程如图:
①K闭合时,电流计指针向右偏转,乙同学得出结论:2Fe3++2I-2Fe2++I2向正反应方向进行,b作 (填“正”或“负”)极,还原性I->Fe2+。
②当指针归零(反应达到平衡)后,向U型管右管滴加0.1mol L-1FeSO4溶液,电流计指针向左偏转,由此得出还原性为Fe2+ I-(填“>”或“<”)。
(6)综合甲、乙两位同学的实验探究过程,可得出结论:2Fe3++2I-=2Fe2++I2为可逆反应,改变条件可使平衡移动;Fe3+和I2的氧化性强弱受 影响。
【参考答案】
一、选择题
1.D
解析:A.水为纯液体,增加水的用量不能增大反应速率,A错误;
B.常温下Fe在浓硫酸中会发生钝化,加热时反应生成二氧化硫,B错误;
C.压强不能影响液体之间的反应速率,C错误;
D.将Al片改成Al粉,增大接触面积,加快反应速率,D正确;
综上所述答案为D。
2.C
解析:A.第2步的基元反应方程式为:CH3OH·*+CO2* → CH3OCOO·*,A正确;
B.最大能垒为第1步基元反应:CH3OH*+HO·* → CH3O·*+H2O*,其差值为1.257×104 eV,B正确;
C.升高温度,对于反应速率均增加,C错误;
D.总反应为2CH3OH+CO2 CH3OCOOCH3+H2O ΔH>0,为吸热反应;因此适当的提高温度,可以增加碳酸二甲酯的产率,D正确;
故选C。
3.C
解析:A.该脱除NO过程中存在元素化合价的改变,则存在电子的转移,故有电流产生,A正确;
B.端的氧气得到电子发生还原生成过氧化氢,故为正极,其反应为,B正确;
C.P极NO失去电子为负极,原电池中阳离子向正极移动,C错误;
D.用作催化剂的光催化氧化法脱除NO,催化剂改变反应历程,降低了反应的活化能,D正确;
故选C。
4.D
解析:A.由图可知,t3时刻v逆减小,且是在原来的基础上减小,是改变物质的浓度引起的,可能是减少c(D),故A正确;
B.t5时刻,逆反应速率突然减小,可能是降低温度所致,故B正确;
C.t7时刻,逆反应速率减小,t7之后,逆反应速率不再改变,反应达平衡,反应为气体体积分数不变的反应,所以可能是减小压强所致,故C正确;
D.t5时刻,逆反应速率突然减小,之后在t5~t6时间段内,逆反应速率逐渐增大,说明平衡正向移动,故D错误;
故答案选D。
5.A
解析:5min末已生成0.2molW,则v (w)== =0.02mol·(L·min)-1,根据速率之比等于化学计量数之比,v (Z):v (W) =n:2=0.01mol·(L·min)-1:0.02mol·(L·min)-1,解得n=1;
答案选A。
6.B
解析:A.由方程式可知,反应的平衡常数表达式K=,故A正确;
B.适当提高氨气的浓度,反应速率加快,平衡向正反应方向移动,但氨气的转化率减小,故B错误;
C.由方程式可知,1molN—H断裂同时有1molO—H断裂说明正逆反应速率相等,反应已达到平衡,故C正确;
D.其它条件不变,加入高效的催化剂能提高单位体积内的活化分子百分数,加快反应速率,故D正确;
故选B。
7.B
解析:A.化学反应速率通常用单位时间内反应物或生成物的浓度变化来表示,A错误;
B.用不同物质的浓度变化表示同一时间内、同一反应的速率时,其数值之比等于反应方程式中对应物质的化学计量数之比,B正确;
C.化学反应速率表示化学反应在某一时间段内的平均速率,而不是瞬时速率,C错误;
D.在计算化学反应速率时,取浓度变化的绝对值,故化学反应速率恒为正值,D错误;
故答案为:B。
8.C
【分析】根据速率之比等于化学计量数之比,先都转化为用B表示的反应速率且要统一单位,再进行比较。
解析:A.A为固体,不能用浓度变化量表示其反应速率;
B.;
C. ;
D.;
则反应速率v(C)>v(B)>v(D);
故答案选C。
9.B
解析:A.由质量守恒定律可知,反应前后气体的质量相等,在恒容密闭容器中混合气体的密度始终不变,所以相同条件下,达到平衡时混合气体的密度与反应前相同,故A正确;
B.反应物投料之比增大相当于增大氢气的浓度,平衡向正反应方向移动,一氧化碳的转化率增大,则d点一氧化碳的转化率最大,故B错误;
C.反应物投料之比增大相当于增大氢气的浓度,平衡向正反应方向移动,一氧化碳的转化率增大,则a、b、c、d四点中d点一氧化碳的转化率最大,甲醇的物质的量最大,故C正确;
D.由图可知,c点到d点相当于增大氢气的浓度,平衡向正反应方向移动,故D正确;
故选B。
10.C
解析:①C在该反应中是固体,增加固体的量不会影响反应物浓度等,不会改变化学反应速率;
②N2不参加化学反应,保持体积不变,充入N2不会改变反应物分压,化学反应速率不变;
③压缩体积将使参加反应的物质浓度增大,化学反应速率将增大;
④N2不参加化学反应,保持压强不变,充入N2使容器体积变大,参加反应的各物质的分压将减小,化学反应速率将减小;
综上所述,条件的改变对其反应速率几乎无影响的是①②,故答案为C。
11.C
【分析】根据吉布斯自由能可判断反应是否自发进行,当时,反应能自发进行,据此分析解答。
解析:反应的,,因为T,则一定大于0,即反应在任何温度下都不能自发进行,C项符合题意。
故选C。
12.A
解析:A.t1时,Y的物质的量为6mol,X的物质的量为3mol,容器体积恒定不变,则Y的浓度是X浓度的2倍,故A正确;
B.t2时,X和Y的物质的量均为4mol,X的物质的量增加2mol,Y的物质的量减少4mol,X是生成物,Y是反应物,物质的量变化量之比=反应计量系数之比,反应的方程式为2Y X,故B错误;
C.平衡时反应体系各组分的含量不变,t2时之后,X、Y的量还在变化,反应未达到平衡状态,故C错误;
D.t3时,X、Y的量不再变化,反应达到平衡状态,平衡状态为动态平衡,正逆反应速率相等,但不为零,故D错误;
答案选A。
13.A
解析:A.甲烷的燃烧热ΔH=﹣890.4 kJ/mol,指1mol甲烷完全燃烧生成CO2气体和液态水时放出890.4kJ热量,则甲烷燃烧的热化学方程式可表示为:CH4(g)+O2(g)=CO2(g)+H2O(l) △H=-445.2 kJ/mol,故A正确;
B.合成氨是可逆反应,反应物转化率始终小于100%,则一定条件下,将 0.5 mol N2和 1.5 mol H2置于密闭容器中充分反应生成 NH3放热 19.3 kJ,实际参加反应的N2小于0.5mol,说明1molN2完全转化时释放的能量大于38.6 kJ,则热化学方程式 N2(g)+3H2(g)2NH3(g)中ΔH<﹣38.6 kJ/mol,故B错误;
C.由水电离出的 c(H+)=1×10-12mol·L-1的溶液pH=2或pH=12,Mg2+在碱性溶液中不能大量共存,而酸性溶液中I-能被氧化,不能大量共存,则此溶液中不可能大量存在K+、I-、Mg2+、,故C错误;
D.已知C(s)+CO2(g)=2CO(g) ΔH>0,该反应的Δs>0,则根据ΔG=ΔH-TΔS可知,只有高温下ΔG才可能小于0,反应能自发进行,故D错误;
故答案为A。
14.A
解析:已知反应A═D+E △H-T△S=(-4 500+11T )J·mol-1,(温度单位为K)。要防止A分解反应发生,需要△H-T△S=(-4 500+11T )J·mol-1≥0,计算得到:T≥409K,故选A。
15.D
解析:A.由图示知,整个过程输入H2O2、Cl-、H+、H2O物质的量之比为1:1:1:1,生成H2O、HOCl物质的量之比为2:1,故该反应离子方程式为:H2O2+Cl-+H+= H2O+HOCl,A正确;
B.产物HOCl,即次氯酸,具有强氧化性,可以杀菌消毒,B正确;
C.该催化循环过程中,有V元素形成6根键,也有V元素形成5根键的情况,C正确;
D.钒的配合物在过程中起到催化作用,即作催化剂,而催化剂对平衡移动没有影响,故不会影响H2O2平衡转化率,D错误;
故答案选D。
二、填空题
16.加入催化剂 减小NH3浓度 降温
解析:t4时刻正逆反应速率均变大且相等,所对应的实验条件改变是使用催化剂;t5时刻正反应速率不变,而逆反应速率减小,则说明生成物浓度减小,所对应的实验条件改变是减小NH3浓度;t7时刻正逆反应速率均小,且逆反应速率更小,平衡正向移动,所对应的实验条件改变是降温;
17.(1)A
(2)3A(g)B(g)+3C(g)
(3)0.6mol/(L·min)
(4)AB
(5)42.9%
解析:(1)由A的物质的量浓度不断减小,可以判断A为反应物;
(2)A为反应物,B、C为生成物,又根据反应的系数之比等于反应的物质的量之比,可得反应的方程式为3A(g)B(g)+3C(g);
(3)A的反应速率==0.6mol/(L·min);
(4)A.每有3molA消耗是正反应方向,3molC消耗是逆反应方向,正逆反应速率相等,达到了平衡,正确;
B.B的体积分数保持不变,即B的量不再变化,达到了平衡,正确;
C.气体的容积和质量恒定,即密度恒定,故密度保持不变,不一定平衡,错误;
D.B和C的浓度之比1:3,不一定平衡,错误;
故选AB。
(5)达平衡时,A的体积分数=×100%≈42.9%.
18.(1)越小
(2)20% bd
(3)<
解析:(1)合成氨为放热反应,升高温度,平衡逆移,平衡常数减小,故温度越高,其化学平衡常数的值越小。
(2)把与置于体积为的密闭容器内,设反应达平衡时N2转化的物质的量为x,
根据理想气体状态方程,可知恒温恒容条件下,反应前后的压强之比等于气体的总物质的量之比,则
,解x=2,平衡时氢气的转化率=;
反应体系中全部为气体,气体的总质量为定值,恒容条件下,气体的密度不变,不能作为达平衡的标志,a项错误;
该反应为气体分子数减小的反应,恒容装置中,随着反应的进行,体系的压强减小,容器内压强不变说明反应已经达到平衡状态,b项正确;
根据反应的方程式为,可知达平衡时2v正(N2)= v逆(NH3),c项错误;
c(NH3)会随着反应的进行而变化,混合气体中c(NH3)不变,说明反应已经达到平衡状态,d项正确;
故选bd。
(3)结合图象可知,Q点之前反应未达到平衡,随着反应正向进行,混合体系中X的体积分数逐渐减小,Q点之后反应已经达到平衡状态,升高温度,混合体系中X的体积分数增大,说明升温平衡逆移,则正反应为放热反应,故。
19.079 0.395 79% X+Y 2Z 化学平衡
【分析】(1)根据化学反应速率计算公式计算Z表示的反应速率;
(2)根据图像判断X的物质的量浓度减少量;
(3)根据转化率计算公式计算Y的转化率;
(4)根据各物质曲线的走向和变化的量分析化学反应方程式;
(5)当各物质的物质的量不再变化时,反应达到平衡状态。
解析:(1)根据图像可知,反应开始到10s,Z的物质的量增加了1.58mol,则用Z表示的反应速率为:v(Z)= =0.079 mol/(L·s);
(2)根据图像可知,反应开始到10s,X的物质的量浓度减少量为 =0.395 mol/L ;
(3)反应开始到10s时,Y的转化率=×100%=×100%=79%;
(4)由图像可以看出,X、Y的物质的量减少,Z的物质的量增多,则X、Y为反应物,Z为生成物,到10s后各物质的物质的量均不再变化且不为0,说明该反应为可逆反应,化学反应中各物质的物质的量的变化量之比等于化学计量数之比,则有X∶Y∶Z=(1.20mol-0.41mol)∶(1.0mol-0.21mol)∶1.58mol=1∶1∶2,所以该反应的化学方程式为X+Y 2Z;
(5)根据图像可知,10s后各物质的物质的量不再变化,说明该可逆反应达到了化学平衡状态。
20.15mol/(L·min) 75% 减小 3.15
解析:(1)由题意有物质的量浓度的变化量之比等于化学计量数之比,则,所以平衡时;则氧气的反应速率,二氧化硫的转化率,故答案为:0.15mol/(L·min);75%;
(2)由2SO2(g)+O2(g)2SO3(g) ΔH<0可知,该反应的平衡常数K=,化学平衡常数只与温度有关,由于该反应ΔH<0为放热反应,升高温度平衡逆向移动,平衡常数减小,故答案为:;减小;
(3)由可知该反应的平衡常数;若不改变反应温度和反应物中SO2的起始浓度,使SO2的平衡转化率达到90%,则设O2的起始物质的量浓度为amol/L,则由可得,由于温度不变,所以,则,解得a=3.15mol/L,故答案为:3.15。
21.(1) 吸热 温度升高,化学平衡常数增大,说明平衡向正反应方向移动,该反应为吸热反应
(2)b
(3)1200 CO2(g)+H2(g)CO(g)+H2O(g) △H=+akJ/mol
(4)50% 不变
(5)x+y>z 逆反应 气
解析:(1)
由方程式可知,反应的化学平衡常数K=;由表格数据可知,温度升高,化学平衡常数增大,说明平衡向正反应方向移动,该反应为吸热反应,故答案为:;吸热;温度升高,化学平衡常数增大,说明平衡向正反应方向移动,该反应为吸热反应
(2)
a.由质量守恒定律可知,反应中气体的质量相等,在恒容密闭容器中混合气体的密度始终不变,则混合气体的密度保持不变不能说明正逆反应速率相等,无法判断反应是否达到平衡,故错误;
b.混合气体中一氧化碳浓度不变不变说明正逆反应速率相等,反应已达到平衡,故正确;
c.化学平衡常数为温度函数,温度不变,平衡常数不变,则该反应化学平衡常数的值不再变化不能说明正逆反应速率相等,无法判断反应是否达到平衡,故错误;
d.二氧化碳和氢气的消耗速率都代表正反应速率,则二氧化碳和氢气的消耗速率相等不能说明正逆反应速率相等,无法判断反应是否达到平衡,故错误;
故选b;
(3)
由平衡浓度符合下式13c(CO2)·c(H2)=5c(CO)·c(H2O)可知,该温度下反应的平衡常数K===2.6,由表格数据可知,此时的温度为1200℃;由此时生成物与反应物能量差的绝对值为 a可知,反应的热化学方程式为CO2(g)+H2(g)CO(g)+H2O(g) △H=+akJ/mol,故答案为:1200;CO2(g)+H2(g)CO(g)+H2O(g) △H=+akJ/mol;
(4)
设830℃反应达到平衡时二氧化碳的转化率为a,由题给数据可建立如下三段式:
由平衡常数为1.0可得:=1.0,解得a=0.5,既50%;保持温度不变,在平衡体系中再充入 1mol氢气和 lmol二氧化碳相当于增大压强,该反应是气体体积不变的反应,增大压强,化学平衡不移动,则重新达到化学平衡时,二氧化碳 的平衡转化率不变,故答案为:50%;不变;
(5)
若A、B、C 都是气体,减压后正反应速率小于逆反应速率说明平衡向逆反应方向移动,该反应为是气体体积减小的反应,则x、y、z的关系是x+y>z;若 C 为气体,且 x+y=z,在加压时化学平衡发生移动说明A、B中必定有1个是非气态,该反应为气体体积增大的反应,平衡向逆反应方向移动;如果在体系中增加或减少B 的量,平衡均不发生移动说明B 肯定不能为气态,故答案为:x+y>z;逆反应;气。
22.(1) 溶液变蓝 KSCN
(2)Ag++I-=AgI↓
(3)排除实验④和实验⑤中Fe3+对溶液透光率的干扰
(4)溶液的透光率不再随时间改变后,实验⑤的溶液透光率低于实验④,说明实验④中虽然KI过量但仍有未反应的Fe3+
(5)正 >
(6)浓度
解析:(1)该反应的化学方程式:2Fe3++2I- 2Fe2++I2,产物有碘单质,加入到淀粉溶液,可观察到溶液变蓝,若该反应存在限度,则应剩余Fe3+,实验ii中a是KSCN溶液,Fe3+与SCN 形成配合物,溶液呈红色;
(2)反应2Fe3++2I- 2Fe2++I2,存在反应限度,则还剩余I ,加入AgNO3溶液,形成黄色沉淀,用离子方程式表示为:Ag++I =AgI↓,
(3)该探究实验是探究I 浓度对反应的影响,而透光率与溶液的颜色有关,故用实验③加蒸馏水,把Fe3+的浓度影响控制一致,与实验④、⑤对照,排除实验④和实验⑤中Fe3+对溶液透光率的干扰;
(4)分析实验④和⑤,溶液透光率不再随时间改变后,实验⑤的溶液透光率低于实验④的溶液透光率,说明实验④中虽然KI过量,但仍有未反应的Fe3+,可以说明该反应存在限度;
(5)①电流计指针向右偏转,说明b极Fe3+得到电子,作正极;
②电流计指针向左偏转,说明a极的I2得电子生成I ,由此得出还原性Fe2+>I ;
(6)甲同学实验是为了证明该反应存在限度,乙同学是探究浓度对物质的氧化性和还原性的影响,综合甲、乙两位同学的实验探究过程,得出的结论有:2Fe3++2I- 2Fe2++I2存在限度;改变条件可使平衡移动;物质的氧化性与还原性强弱受浓度影响
同课章节目录
- 第1章 化学反应与能量转化
- 第1节 化学反应的热效应
- 第2节 化学能转化为电能——电池
- 第3节 电能转化为化学能——电解
- 第4节 金属的腐蚀与防护
- 微项目 设计载人航天器用化学电池与氧气再生方案——化学反应中能量及物质的转化利用
- 第2章 化学反应的方向、 限度与速率
- 第1节 化学反应的方向
- 第2节 化学反应的限度
- 第3节 化学反应的速率
- 第4节 化学反应条件的优化——工业合成氨
- 微项目 探讨如何利用工业废气中的二氧化碳合成甲醇——化学反应选择与反应条件优化
- 第3章 物质在水溶液中的行为
- 第1节 水与水溶液
- 第2节 弱电解质的电离 盐类的水解
- 第3节 沉淀溶解平衡
- 第4节 离子反应
- 微项目 揭秘索尔维制碱法和侯氏制碱法——化学平衡思想的创造性应用
