第一章 化学反应的热效应 测试题(含解析) 2023-2024学年高二上学期化学人教版(2019)选择性必修1
文档属性
| 名称 | 第一章 化学反应的热效应 测试题(含解析) 2023-2024学年高二上学期化学人教版(2019)选择性必修1 |  | |
| 格式 | docx | ||
| 文件大小 | 914.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-16 17:29:40 | ||
图片预览


文档简介
第一章 化学反应的热效应 测试题
一、选择题
1.已知
①
②
③
则的值为
A. B.
C. D.
2.下列发电站在发电过程中实现化学能转化为电能的是
A.三峡水利发电站 B.甘肃酒泉风电基地
C.大亚湾核电站 D.天津双港垃圾焚烧发电厂
3.某团队研究在硼基催化剂上丙烷氧化脱氢制丙烯的反应机理,部分反应历程(其中吸附在催化剂表面的物质用“*”表示)如图所示。
下列历程中属于放热过程的是
A.
B.
C.
D.
4.下列有关热化学方程式的叙述正确的是
A.表示氢气的燃烧热
B.等质量的固态硫比液态硫完全燃烧放出的热量多
C.含20.0g NaOH的稀溶液与稀盐酸完全中和,放出28.7kJ的热量,则表示该反应的热化学方程式为
D.已知,,则
5.下列说法不正确的是
A.
B.、、
C.将煤转化为和后燃烧与煤直接燃烧放出的热量一样多
D.将煤转化为水煤气后再燃烧,从提高煤燃烧利用率看是得不偿失
6.已知:反应① ;反应② 。在反应 中,1molC(s)成键释放的热量为709.6kJ,C-H的键能为,则H-H的键能为
A. B.436kJ C. D.872kJ
7.在下列各说法中,正确的是
A.ΔH>0表示放热反应,ΔH<0表示吸热反应
B.1molH2与0.5molO2反应放出的热就是H2的燃烧热
C.0.5molH2SO4与0.5molBa(OH)2反应时放出的热叫做中和热
D.化学方程式中的化学计量数只表示物质的量,可以是分数
8.“千畦细浪舞晴空”,氮肥保障了现代农业的丰收。为探究(NH4)2SO4的离子键强弱,设计如图所示的循环过程,可得△H4/(kJ mol-1)为
A.+533 B.+686 C.+838 D.+1143
9.下列说法中正确的是
A.HCl和NaOH的稀溶液反应生成1mol (l)的反应热,则和的稀溶液反应生成1mol (1)的反应热
B.甲烷的燃烧热,则
C.CO(g)的燃烧热,则
D.已知:500℃、30MPa下, ,将1.5mol 和过量的在此条件下充分反应,放出热量46.2kJ
10.已知,其它相关数据如下表:
物质 HCl
1mol分子中的化学键断裂时吸收的能量/kJ 436 a 431
下列说法正确的是
A.a=243
B.和的总能量小于2HCl(g)
C.完全反应放出183kJ热量
D.生成2HCl(l)的能量变化小于183kJ
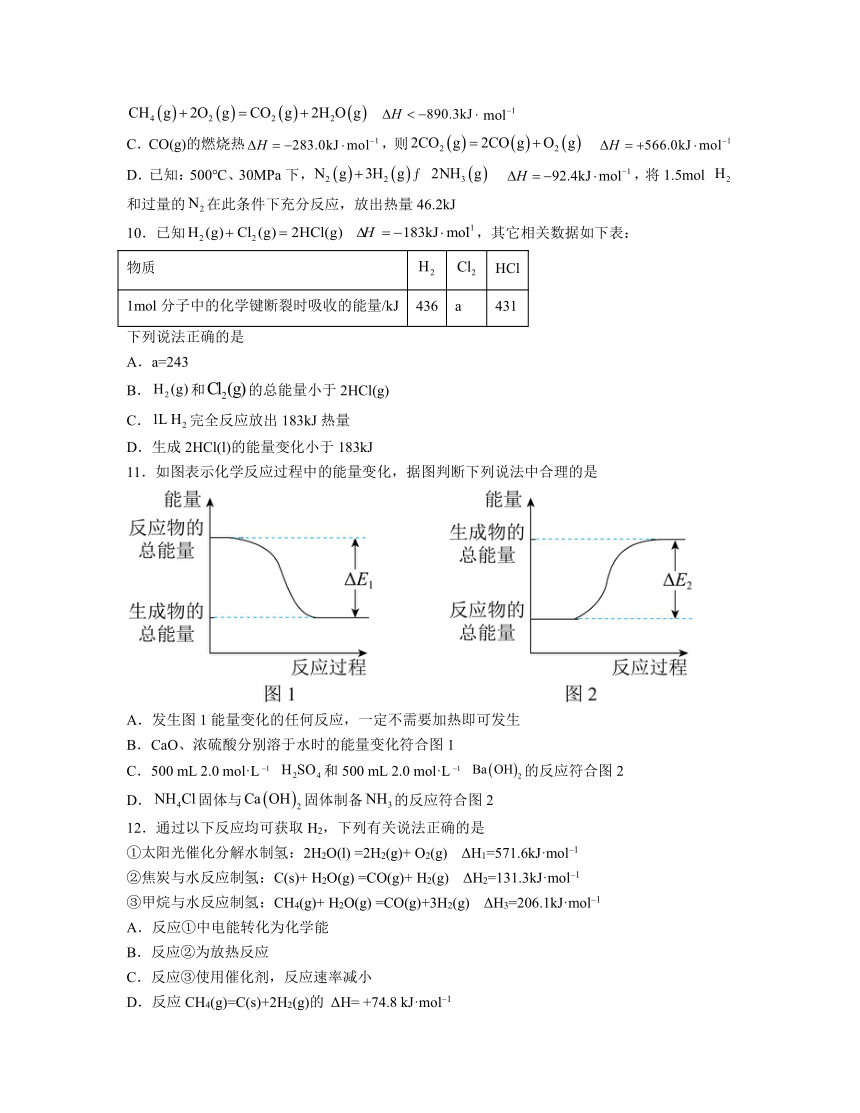
11.如图表示化学反应过程中的能量变化,据图判断下列说法中合理的是
A.发生图1能量变化的任何反应,一定不需要加热即可发生
B.CaO、浓硫酸分别溶于水时的能量变化符合图1
C.500 mL 2.0 mol·L 和500 mL 2.0 mol·L 的反应符合图2
D.固体与固体制备的反应符合图2
12.通过以下反应均可获取H2,下列有关说法正确的是
①太阳光催化分解水制氢:2H2O(l) =2H2(g)+ O2(g) ΔH1=571.6kJ·mol–1
②焦炭与水反应制氢:C(s)+ H2O(g) =CO(g)+ H2(g) ΔH2=131.3kJ·mol–1
③甲烷与水反应制氢:CH4(g)+ H2O(g) =CO(g)+3H2(g) ΔH3=206.1kJ·mol–1
A.反应①中电能转化为化学能
B.反应②为放热反应
C.反应③使用催化剂,反应速率减小
D.反应CH4(g)=C(s)+2H2(g)的 ΔH= +74.8 kJ·mol–1
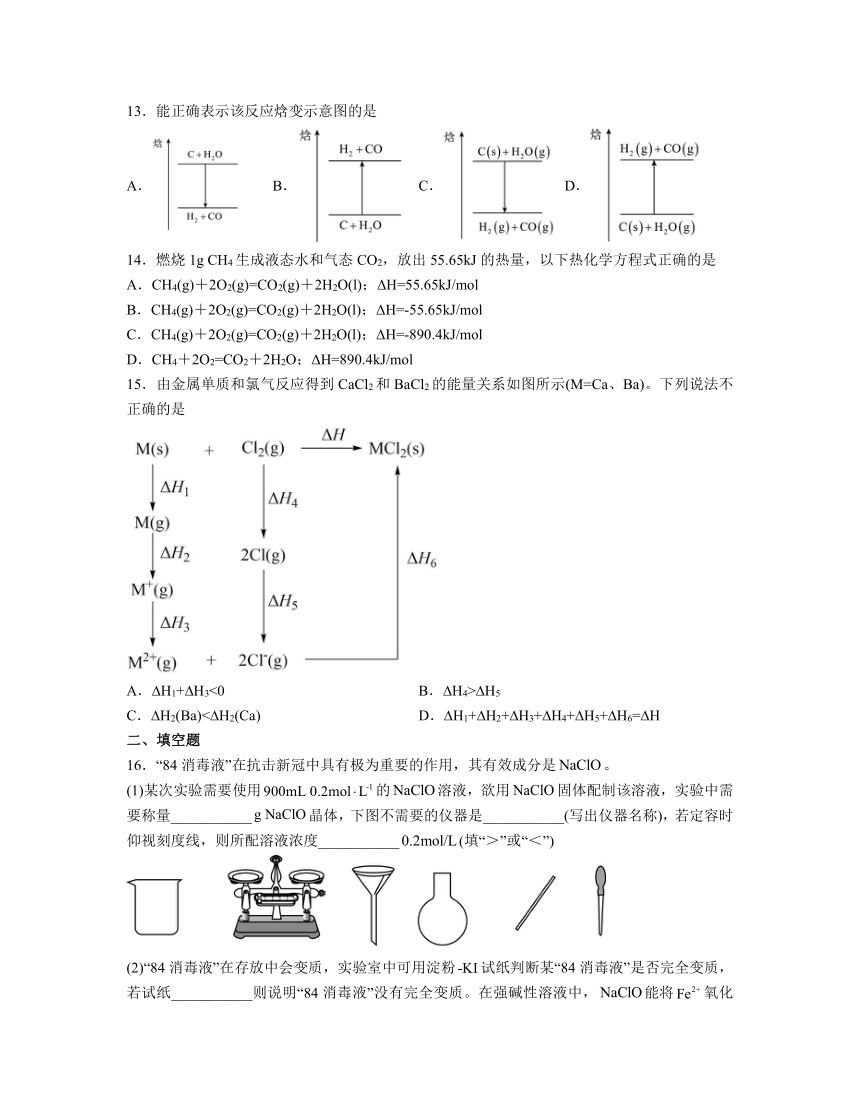
13.能正确表示该反应焓变示意图的是
A. B. C. D.
14.燃烧1g CH4生成液态水和气态CO2,放出55.65kJ的热量,以下热化学方程式正确的是
A.CH4(g)+2O2(g)=CO2(g)+2H2O(l);ΔH=55.65kJ/mol
B.CH4(g)+2O2(g)=CO2(g)+2H2O(l);ΔH=-55.65kJ/mol
C.CH4(g)+2O2(g)=CO2(g)+2H2O(l);ΔH=-890.4kJ/mol
D.CH4+2O2=CO2+2H2O;ΔH=890.4kJ/mol
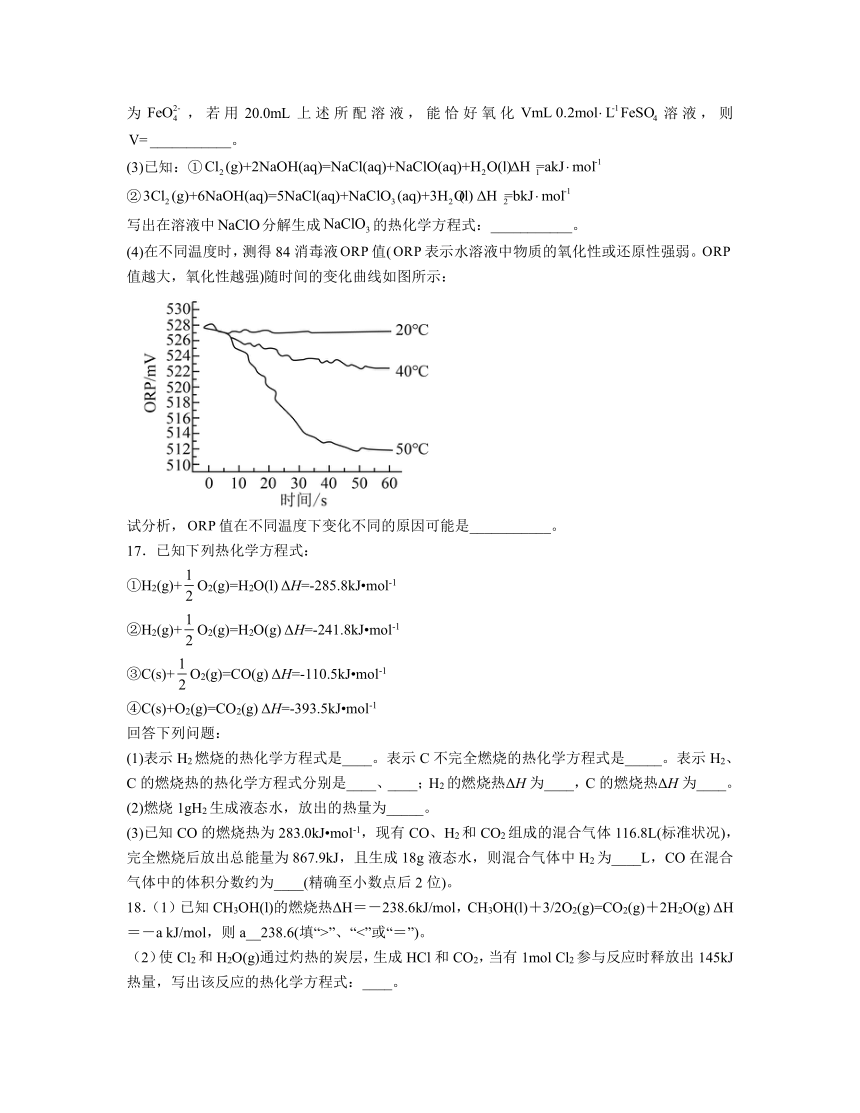
15.由金属单质和氯气反应得到CaCl2和BaCl2的能量关系如图所示(M=Ca、Ba)。下列说法不正确的是
A. H1+ H3<0 B. H4> H5
C. H2(Ba)< H2(Ca) D. H1+ H2+ H3+ H4+ H5+ H6= H
二、填空题
16.“84消毒液”在抗击新冠中具有极为重要的作用,其有效成分是。
(1)某次实验需要使用的溶液,欲用固体配制该溶液,实验中需要称量___________晶体,下图不需要的仪器是___________(写出仪器名称),若定容时仰视刻度线,则所配溶液浓度___________(填“>”或“<”)
(2)“84消毒液”在存放中会变质,实验室中可用淀粉试纸判断某“84消毒液”是否完全变质,若试纸___________则说明“84消毒液”没有完全变质。在强碱性溶液中,能将氧化为,若用上述所配溶液,能恰好氧化溶液,则___________。
(3)已知:①
②
写出在溶液中分解生成的热化学方程式:___________。
(4)在不同温度时,测得84消毒液值(表示水溶液中物质的氧化性或还原性强弱。值越大,氧化性越强)随时间的变化曲线如图所示:
试分析,值在不同温度下变化不同的原因可能是___________。
17.已知下列热化学方程式:
①H2(g)+O2(g)=H2O(l) ΔH=-285.8kJ mol-1
②H2(g)+O2(g)=H2O(g) ΔH=-241.8kJ mol-1
③C(s)+O2(g)=CO(g) ΔH=-110.5kJ mol-1
④C(s)+O2(g)=CO2(g) ΔH=-393.5kJ mol-1
回答下列问题:
(1)表示H2燃烧的热化学方程式是____。表示C不完全燃烧的热化学方程式是_____。表示H2、C的燃烧热的热化学方程式分别是____、____;H2的燃烧热ΔH为____,C的燃烧热ΔH为____。
(2)燃烧1gH2生成液态水,放出的热量为_____。
(3)已知CO的燃烧热为283.0kJ mol-1,现有CO、H2和CO2组成的混合气体116.8L(标准状况),完全燃烧后放出总能量为867.9kJ,且生成18g液态水,则混合气体中H2为____L,CO在混合气体中的体积分数约为____(精确至小数点后2位)。
18.(1)已知CH3OH(l)的燃烧热ΔH=-238.6kJ/mol,CH3OH(l)+3/2O2(g)=CO2(g)+2H2O(g) ΔH=-a kJ/mol,则a__238.6(填“>”、“<”或“=”)。
(2)使Cl2和H2O(g)通过灼热的炭层,生成HCl和CO2,当有1mol Cl2参与反应时释放出145kJ热量,写出该反应的热化学方程式:____。
(3)反应mA(g)+nB(g) pC(g)+qD(g)过程中的能量变化如图所示,回答下列问题。
该反应ΔH=___(用含E1、E2式子表示);在反应体系中加入催化剂,E1__,E2__,(填增大、减小、不变)。
19.家用液化气中主要成分之一是丁烷。在101kPa时,10kg丁烷完全燃烧生成CO2和H2O,放出热量5×105kJ,丁烷的燃烧热为___________。
20.甲烷是一种重要的化工原料,广泛应用于民用和工业中。
(1)已知:①CH4(g)+H2O(g)=CO(g)+3H2(g) H1
②2CO(g)+O2(g)=2CO2(g) H2=-566kJ mol 1
③H2(g)O2(g)=H2O(g) H3=-242kJ mol 1
相关化学键的键能数据如下:
共价键 H O C≡O H H C H
键能/(kJ mol 1) 463 1076 436 413
由此计算 H1=_______kJ mol 1,CH4超干重整CO2技术得到CO和H2的反应的热化学方程式为_______。
21.回答下列问题:
(1)合成氨一直是科学家研究的重要课题,已知破坏有关化学键需要的能量如表所示:
a b c d
则反应生成2mol所释放出的热量为___________。
(2)32.0 g Cu 与 100 mL 10.0 mol·L-1的浓硝酸反应,标准状况下测得反应产生的 NO、NO2混合气体 6.72 L,且充分反应后铜仍有剩余。请计算:
①混合气体中 NO 与 NO2的物质的量之比为___________。
②向反应后的溶液中滴加稀硫酸可使铜完全溶解,离子方程式为___________。若该过程中只有 NO 气体生成,则还能产生 NO 的物质的量为___________。
22.已知甲、乙、丙为常见的单质,A、B、C、D、X、Y、Z为常见化合物,且丙在常温常压下为气体,B为淡黄色固体,Y的摩尔质量数值比Z小16,乙、丙的摩尔质量相同,B的摩尔质量比D小2,B、X的摩尔质量相同。各物质之间的转化关系如图所示(各反应条件略)。
请回答:
(1)在B与二氧化碳的反应中,每有1mol电子转移,生成气体_______L(标准状况)。
(2)X与Y的溶液混合后,再加入适量盐酸,会有乙生成,反应的离子方程式是_____________。
(3)将C通入溴水中,所发生反应的离子方程式是____________。D中含的化学键类型为________。
(4)在101KPa时,4.0g乙在一定条件下与丙完全反应生成C,放出37KJ的热量,该反应的热化学方程式 是____________
(5)比甲元素的原子序数少4的M元素,在一定条件下能与氢元素组成化合物MH5。已知MH5的结构与氯化铵相似,MH5与水作用有氢气生成,则MH5的电子式为_________(M要用元素符号表示)。写出MH5与AlCl3溶液反应的化学方程式_________
23.能源是国民经济发展的重要基础,我国目前使用的能源主要是化石燃料,而氢气、丙烷、乙硼烷等都是很有发展前景的新能源。
(1)未来新能源的特点是资源丰富,在使用时对环境无污染或污染很小,且可以再生,下列属于未来新能源标准的是______(填字母)。
①石油②煤③天然气④沼气⑤太阳能⑥氢能⑦风能
A.③④⑤ B.③⑤⑥⑦ C.③⑤⑥ D.④⑤⑥⑦
(2)25℃、101Pa时,11g丙烷C3H8完全燃烧生成CO2和液态水时放出的热量是555.0kJ,则表示丙烷燃烧热的热化学方程式是______。
(3)运动会上使用的火炬的燃料一般是丙烷(C3H8),丙烷在一定条件下发生脱氢反应可以得到丙烯。已知:C3H8(g)→CH4(g)+HCCH(g)+H2(g)△H=+156.6kJ/mol
CH3CH=CH2(g)→CH4(g)+HCCH(g)△H=+32.4kJ/mol
则相同条件下,反应C3H8(g)→CH3CH=CH2(g)+H2(g)的△H=______kJ/mol。
(4)某学生想通过测定反应过程中所放出的热量来计算中和热。他将50mL0.5mol/L的盐酸与50mL0.55mol/L的NaOH溶液在如图所示的装置中进行中和反应。请回答下列问题:
①从实验装置上看,图中尚缺少的一种玻璃用品是______,烧杯间填满碎塑料泡沫的作用是______。
②大烧杯上如不盖硬纸板,则求得的中和热数值______(填“偏大”“偏小”“无影响”)。
③实验中改用20mL0.5mol/L的盐酸跟20mL0.55mol/L的NaOH溶液进行反应,与上述实验相比,所放出的热量______ (填“相等”或“不相等”);所求中和热的数值会______ (填“相等”或“不相等”)。
【参考答案】
一、选择题
1.A
解析:根据盖斯定理可知:2①+②-③可得目标方程式,=2+-=-393.52+(-571.6)-(-870.3)=,故答案为:A
2.D
解析:A.三峡水利发电站过程中水能转化为机械能,机械能转化为电能,不涉及化学能转化为电能,故A不符合;
B.风电是将风能转化为机械能,机械能转化为电能,不涉及化学能转化为电能,故B不符合;
C.核电是将核能转化为电能,故C不符合;
D.燃烧过程将化学能转化为热能,热能转化为机械能,机械能转化为电能,故D符合;
故选:D。
3.A
解析:反应物的总能量高于生成物则为放热反应,反之则为吸热反应,由图可知,、、均为吸热过程,B、C、D项均不符合题意。
故选A。
4.C
解析:A.氢气的燃烧热是指在101kPa时,1mol氢气完全燃烧生成液态水时放出的热量,故A错误;
B.固态硫的能量小于液态硫,所以固态硫完全燃烧放出的热量少,故B错误;
C.含20.0gNaOH的稀溶液与稀盐酸完全中和,放出28.7kJ的热量,则1mol氢氧化钠和盐酸反应放出热量57.4kJ,表示该反应的热化学方程式为,故C正确;
D.燃烧反应焓变为负值,完全燃烧放热更多,焓变小,则,故D错误;
选C。
5.D
解析:A.根据盖斯定律,反应热与反应路径无关,只与反应体系的始态和终态有关,所以,故A正确;
B.反应①是碳的燃烧,属于放热反应,;反应②是用碳还原水蒸气,属于吸热反应, ;反应③是CO、H2的燃烧反应,属于放热反应,,故B正确;
C.根据盖斯定律,将煤转化为氢气和一氧化碳后燃烧和煤直接燃烧放出的热量相等,故C正确;
D.将煤转化为水煤气后再燃烧,提高了煤燃烧利用率,故D错误;
故选D。
6.A
解析:根据盖斯定律可知,反应②-反应①可得到,对应焓变=;又因为=4E(C-H)-E(C)-2E(H-H),所以H-H的键能E(H-H)= =,A项符合题意。
故选A。
7.D
解析:A.ΔH>0表示吸热反应,ΔH<0表示放热反应,错误;
B.燃烧热为1mol可燃物完全反应生成稳定的氧化物放出的热量,1molH2与0.5molO2反应生成H2O(l)放出的热就是H2的燃烧热,错误;
C.0.5molH2SO4与0.5molBa(OH)2反应生成BaSO4沉淀和1mol H2O,不符合中和热的含义,错误;
D.热化学方程式中的化学计量数只表示物质的量,可以是分数,正确;
故选D。
8.C
解析:①;
②;
③;
④;
⑤;
⑥;则⑤+①-⑥-②+③得④,得到+838 kJ mol-1,所以A B D错误, C正确,
故选C。
9.C
解析:A.和反应的中和热,则和反应的中和热,选项A错误;
B.甲烷的燃烧热,则,选项B错误;
C.的燃烧热是,反应的,则反应的,选项C正确;
D.已知:500℃、下,;该反应是可逆反应,因此将和过量的在此条件下充分反应,放出热量小于46.2kJ,选项D错误;
答案选C。
10.A
解析:A.断键时吸热、成键时放热,则(436+a)-2×431=-183,得,A正确;
B.反应物具有的总能量大于生成物具有的总能量,该反应为放热反应,则和的总能量大于的,B错误;
C.与完全反应生成时放出热量,条件不足,无法求出的物质的量,C错误;
D.的能量比的能量高,则生成的能量变化大于,D错误;
答案选A。
11.D
解析:A.焓变与反应条件没有关系,故A错误;
B.浓硫酸溶于水时放热但是物理变化,图1表示的是化学变化中能量变化,氧化钙和水反应放热,符合图1能量变化,故B错误;
C.酸碱中和放热,500 mL 2.0 mol·L 和500 mL 2.0 mol·L 反应放热,图2是吸热能量变化,故C错误;
D.固体与固体制备反应吸热,图2是吸热能量变化,故D正确;
故选:D。
12.D
解析:A.太阳光催化分解水制氢气,光能转化为化学能,故A错误;
B.反应②的ΔH2=131.3kJ·mol–1>0,则反应②为吸热反应,故B错误;
C.催化剂能降低反应的活化能,增大反应速率,故C错误;
D.根据盖斯定律,将反应③-反应②得, CH4(g)=C(s)+2H2(g) ΔH= +74.8 kJ·mol–1,故D正确;
故答案选D。
13.D
解析:碳和水蒸气反应属于吸热反应,生成物总能量大于反应物总能量,结合物质状态碳是固体、其余物质均为气态,故选D。
14.C
解析:1gCH4在氧气中燃烧生成CO2和液态水,放出55.65kJ热量,16g即1molCH4在氧气中燃烧生成CO2和液态水,放出16×55.65kJ =890.4kJ热量,则热化学方程式为:CH4(g)+2O2(g)═CO2(g)+2H2O(l) △H=-890.4kJ/mol,
故选:C。
15.A
解析:A. H2和 H3分别代表M元素的第一电离能和第二电离能,均大于0,所以 H1+ H3>0,A项错误;
B.Cl2 (g)断键形成两个气态氯原子,该过程吸热,所以 H4>0,气态氯原子得到一个电子可以形成稳定的8电子结构,该过程放热,所以 H5<0,因此 H4> H5,B项正确;
C.同主族元素从上到下第一电离能逐渐减小,所以第一电离能:BaD.由盖斯定律可知: H1+ H2+ H3+ H4+ H5+ H6= H,D项正确;
故选A。
二、填空题
16.(1) 14.9 漏斗、圆底烧瓶 <
(2) 变蓝色 10或10.0
(3)3NaClO(aq)=2NaCl(aq)+NaClO3(aq) ΔH=(b-3a)kJ·mol-1
(4)温度升高使次氯酸分解加快,溶液中次氯酸浓度减小,氧化性减弱
解析:(1)根据题目要求选择1000mL的容量瓶配制溶液,故需要称量NaClO的质量m=1L×0.2mol·L-1×(23+35.5+16)g/mol=14.9g;配制过程中需要用到托盘天平进行称量,烧杯、玻璃棒用于溶解,胶头滴管用于定容,不需要漏斗和圆底烧瓶;定容时仰视,溶液体积偏大,所配溶液浓度小于0.2mol/L;
(2)84消毒液有效成分为具有漂白性的NaClO,NaClO的强氧化性可将I-氧化为I2,遇到淀粉显蓝色;NaClO被还原为Cl-,根据氧化还原反应电子得失守恒可列式0.2×20.0×10-3×2=0.2×V×10-3×4,解得V=10.0mL;
(3)根据盖斯定律可得目标方程式为②-3×①,可得热化学方程式为3NaClO(aq)=2NaCl(aq)+NaClO3(aq) ΔH=(b-3a)kJ·mol-1;
(4)消毒液中有效成分次氯酸受热易分解,温度升高使次氯酸分解加快,溶液中次氯酸浓度减小,氧化性减弱。
17.(1) ①② ③ ① ④ -285.8kJ mol-1 -393.5kJ mol-1
(2)142.9kJ
(3) 22.4 39.45%
解析:(1)氢气燃烧生成水,则表示氢气燃烧的热化学方程式为①②;碳不完全燃烧生成CO,则表示C不完全燃烧的热化学方程式是③;燃烧热指在101KPa下1mol可燃物完全燃烧生成指定产物时所放出的热量,H燃烧生成液态水,C燃烧生成CO2,则表示H2燃烧热的热化学方程式为①,表示C燃烧热的热化学方程式为④;根据反应①可知,氢气的燃烧热ΔH= 285.8 kJ/mol,根据反应④可知,碳的燃烧热ΔH= 393.5 kJ/mol;
(2)1g氢气的物质的量是0.5mol,则燃烧1 g H2 生成液态水,放出的热量为0.5mol×285.8 kJ/mol=142.9 kJ;
(3)n(H2O)=18g÷18g/mol=1mol,根据氢原子守恒得n(H2O)=n(H2)=1mol,则混合气体中H2为22.4L(标准状况下);根据反应①可知,1mol氢气完全燃烧放出的热量是285.8 kJ,则CO完全燃烧放出的热量=867.9 kJ-285.8 kJ=582.1 kJ。设CO的物质的量是x mol,根据CO的燃烧热为283.0 kJ/mol,有283x=582.1,解得x=2.06,标况下体积是2.06mol×22.4L/mol=46.07L,因此CO在混合气体中的体积分数约为 46.07L÷116.8L×100%≈39.45% 。
18. < 2Cl2(g)+2H2O(g)+C(s)=4HCl(g)+CO2(g) ΔH=-290 kJ/mol ΔH=-(E2-E1)kJ/mol 减小 减小
【分析】(1)CH3OH(l)的燃烧热是1mol甲醇燃烧生成CO2(g)和H2O(l)放出的热。
(2)1mol Cl2参与反应时释放出145kJ热量,则2mol Cl2与2mol H2O(g)反应放热290 kJ;
(3)焓变=反应物的总键能-生成物的总键能;催化剂降低活化能;
解析:(1)燃烧热是1mol物质完全燃烧生成稳定氧化物放出的热量,液态水为稳定的氧化物,1mol甲醇燃烧生成CO2(g)和H2O(l)放热238.6kJ,所以1mol甲醇燃烧生成CO2(g)和H2O(g),放出的热量小于燃烧热,故a<238.6;
(2)有1molCl2参与反应时释放出145kJ热量,2mol氯气反应放热290kJ,反应的热化学方程式为:2Cl2(g)+2H2O(g)+C(s)═4HCl(g)+CO2(g) ΔH=-290kJ·mol 1;
(3)由图象可知该反应是一个能量降低的反应,所以属于放热反应;ΔH=反应物的总键能-生成物的总键能,所以ΔH=E1-E2= -(E2-E1)kJ/mol;加入催化剂改变了反应的途径,降低反应的活化能,所以E1和E2都减小。
19.kJ/mol
解析:n(C4H10)=,则1 mol丁烷完全燃烧放出热量Q=,故此处填:2900 kJ/mol。
20. +194 CH4(g)+CO2(g)= 2CO+2H2(g) △H=+235 kJ mol 1
解析:(1)化学反应的△H=旧键断裂吸收的能量-新键形成放出的能量,根据表格数据计算△H1=463 kJ mol 1×2+413 kJ mol 1×4-1076 kJ mol 1-436kJ mol 1×3=+194kJ mol 1,根据盖斯定律,第①个方程式减去第②个方程式的一半,在加上第③个方程式得到CH4超干重整CO2技术得到 CO 和H2 的反应的热化学方程式为CH4(g)+CO2(g)= 2CO+2H2(g) △H=+235 kJ mol 1;故答案为:+194;CH4(g)+CO2(g)= 2CO+2H2(g) △H=+235 kJ mol 1。
21.(1)6b-(3a+d)
(2) 2:1 3Cu+2NO+8H+=3Cu2++2NO↑+4H2O 0.100mol
解析:(1)反应的△H=反应物键能和-生成物键能和=6b-(3a+d)kJ/mol,则生成2mol NH3(g)放出热量为6b-(3a+d)kJ;
(2)①铜与浓硝酸反应的化学方程式为:Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O, 铜与稀硝酸反应的化学方程式为:3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O,充分反应后铜仍有剩余,说明硝酸完全反应,设生成的NO的物质的量为xmol,NO2的物质的量为ymol,则有(x+y)mol×22.4L/mol= 6.72 L,(4x+2y)mol=10.0 mol·L-1×0.1L,联立两式解得x=0.2,y=0.1,混合气体中 NO 与 NO2的物质的量之比为0.2:0.1=2:1;
②向反应后的溶液中滴加稀硫酸后得到稀硝酸溶液,可与铜反应而完全溶解,离子方程式为3Cu+2+8H+=3Cu2++2NO↑+4H2O;原先的硝酸消耗铜为0.05+=0.35mol,32.0 g Cu的物质的量为,则剩余0.5-0.35=0.15mol,由离子方程式为3Cu+2+8H+=3Cu2++2NO↑+4H2O可知还能产生 NO 的物质的量为0.100mol。
22.(1)11.2
(2)
(3) SO2+Br2+2H2O=2HBr+H2SO4 共价键
(4)S(s)+O2(g)=SO2(g);△H = -296kJ/mol
(5) AlCl3+3NH5+3H2O=Al(OH)3↓+3NH4Cl+3H2↑
【分析】甲、乙、丙为常见的单质,A、B、C、D、X、Y、Z为常见化合物,且丙在常温常压下为气体,B为淡黄色固体,则B为Na2O2,甲为Na,丙为O2,B、X的摩尔质量相同,则X为Na2S,乙为S单质,C为SO2,D为SO3,Y为Na2SO3,Z为 Na2SO4。据此作答。
解析:(1)在B与二氧化碳的反应中,每有1mol电子转移,生成气体体积为11.2L;
(2)X与Y的溶液混合后,再加入适量盐酸,会有乙生成,反应的离子方程式是;
(3)将C通入溴水中,所发生反应的离子方程式是SO2+Br2+2H2O=2HBr+H2SO4;D中含的化学键类型为共价键;
(4)在101KPa时,4.0g乙在一定条件下与丙完全反应生成C,放出37KJ的热量,该反应的热化学方程式S(s)+O2(g)=SO2(g);△H =-(32÷4.0×37)= -296kJ/mol;
(5)比甲元素的原子序数少4的M元素,则M为N元素;NH5的结构与氯化铵相似,故化学式为:NH4H,与水作用有氢气生成,则MH5的电子式为,写出NH4H与AlCl3溶液反应,则为NH4H与H2O反应后生成的NH3·H2O与AlCl3反应,故化学方程式:AlCl3+3NH4H+3H2O=Al(OH)3↓+3NH4Cl+3H2↑。
23. D C3H8(g)+5O2(g)=3CO2(g)+4H2O(l) ΔH=-2220.0kJ mol-1 +124.2 kJ mol-1 环形玻璃搅拌棒 保温、隔热,减少实验过程中的热量损失 偏小 不相等 相等
解析:(1)煤、石油、天然气是化石能源,属于不可再生能源,燃烧时生成的污染物较多,不是新能源;太阳能、沼气、潮汐能、风能、氢能等,都是可再生能源、使用时对环境无污染,属于新能源,故选D;
(2)25℃、101Pa时,11g丙烷C3H8完全燃烧生成CO2和液态水时放出的热量是555.0kJ,则1mol丙烷C3H8完全燃烧生成CO2和液态水时放出的热量是2220.0kJ,表示丙烷燃烧热的热化学方程式是C3H8(g)+5O2(g)=3CO2(g)+4H2O(l) ΔH=-2220.0kJ mol-1;
(3)①C3H8(g)→CH4(g)+HCCH(g)+H2(g)△H=+156.6kJ/mol
②CH3CH=CH2(g)→CH4(g)+HCCH(g)△H=+32.4kJ/mol
根据盖斯定律①-②得C3H8(g)→CH3CH=CH2(g)+H2(g) △H=+156.6kJ/mol -32.4kJ/mol =+124.2 kJ mol-1kJ/mol;
(4)①由量热计的构造可知该装置的缺少仪器是环形玻璃搅拌棒;中和热测定实验成败的关键是保温工作,大小烧杯之间填满碎纸条的作用是保温、隔热,减少实验过程中的热量损失;
②大烧杯上如不盖硬纸板,则热量散失较多,求得的中和热数值偏小;
③反应放出的热量和所用酸以及碱的量的多少有关,实验中改用20mL0.5mol/L的盐酸跟20mL0.55mol/L的NaOH溶液进行反应,与上述实验相比,生成水的物质的量不同,所放出的热量不相等;中和热均是强酸和强碱反应生成1mol水时放出的热,与酸碱的用量无关,所求中和热的数值会相等
一、选择题
1.已知
①
②
③
则的值为
A. B.
C. D.
2.下列发电站在发电过程中实现化学能转化为电能的是
A.三峡水利发电站 B.甘肃酒泉风电基地
C.大亚湾核电站 D.天津双港垃圾焚烧发电厂
3.某团队研究在硼基催化剂上丙烷氧化脱氢制丙烯的反应机理,部分反应历程(其中吸附在催化剂表面的物质用“*”表示)如图所示。
下列历程中属于放热过程的是
A.
B.
C.
D.
4.下列有关热化学方程式的叙述正确的是
A.表示氢气的燃烧热
B.等质量的固态硫比液态硫完全燃烧放出的热量多
C.含20.0g NaOH的稀溶液与稀盐酸完全中和,放出28.7kJ的热量,则表示该反应的热化学方程式为
D.已知,,则
5.下列说法不正确的是
A.
B.、、
C.将煤转化为和后燃烧与煤直接燃烧放出的热量一样多
D.将煤转化为水煤气后再燃烧,从提高煤燃烧利用率看是得不偿失
6.已知:反应① ;反应② 。在反应 中,1molC(s)成键释放的热量为709.6kJ,C-H的键能为,则H-H的键能为
A. B.436kJ C. D.872kJ
7.在下列各说法中,正确的是
A.ΔH>0表示放热反应,ΔH<0表示吸热反应
B.1molH2与0.5molO2反应放出的热就是H2的燃烧热
C.0.5molH2SO4与0.5molBa(OH)2反应时放出的热叫做中和热
D.化学方程式中的化学计量数只表示物质的量,可以是分数
8.“千畦细浪舞晴空”,氮肥保障了现代农业的丰收。为探究(NH4)2SO4的离子键强弱,设计如图所示的循环过程,可得△H4/(kJ mol-1)为
A.+533 B.+686 C.+838 D.+1143
9.下列说法中正确的是
A.HCl和NaOH的稀溶液反应生成1mol (l)的反应热,则和的稀溶液反应生成1mol (1)的反应热
B.甲烷的燃烧热,则
C.CO(g)的燃烧热,则
D.已知:500℃、30MPa下, ,将1.5mol 和过量的在此条件下充分反应,放出热量46.2kJ
10.已知,其它相关数据如下表:
物质 HCl
1mol分子中的化学键断裂时吸收的能量/kJ 436 a 431
下列说法正确的是
A.a=243
B.和的总能量小于2HCl(g)
C.完全反应放出183kJ热量
D.生成2HCl(l)的能量变化小于183kJ
11.如图表示化学反应过程中的能量变化,据图判断下列说法中合理的是
A.发生图1能量变化的任何反应,一定不需要加热即可发生
B.CaO、浓硫酸分别溶于水时的能量变化符合图1
C.500 mL 2.0 mol·L 和500 mL 2.0 mol·L 的反应符合图2
D.固体与固体制备的反应符合图2
12.通过以下反应均可获取H2,下列有关说法正确的是
①太阳光催化分解水制氢:2H2O(l) =2H2(g)+ O2(g) ΔH1=571.6kJ·mol–1
②焦炭与水反应制氢:C(s)+ H2O(g) =CO(g)+ H2(g) ΔH2=131.3kJ·mol–1
③甲烷与水反应制氢:CH4(g)+ H2O(g) =CO(g)+3H2(g) ΔH3=206.1kJ·mol–1
A.反应①中电能转化为化学能
B.反应②为放热反应
C.反应③使用催化剂,反应速率减小
D.反应CH4(g)=C(s)+2H2(g)的 ΔH= +74.8 kJ·mol–1
13.能正确表示该反应焓变示意图的是
A. B. C. D.
14.燃烧1g CH4生成液态水和气态CO2,放出55.65kJ的热量,以下热化学方程式正确的是
A.CH4(g)+2O2(g)=CO2(g)+2H2O(l);ΔH=55.65kJ/mol
B.CH4(g)+2O2(g)=CO2(g)+2H2O(l);ΔH=-55.65kJ/mol
C.CH4(g)+2O2(g)=CO2(g)+2H2O(l);ΔH=-890.4kJ/mol
D.CH4+2O2=CO2+2H2O;ΔH=890.4kJ/mol
15.由金属单质和氯气反应得到CaCl2和BaCl2的能量关系如图所示(M=Ca、Ba)。下列说法不正确的是
A. H1+ H3<0 B. H4> H5
C. H2(Ba)< H2(Ca) D. H1+ H2+ H3+ H4+ H5+ H6= H
二、填空题
16.“84消毒液”在抗击新冠中具有极为重要的作用,其有效成分是。
(1)某次实验需要使用的溶液,欲用固体配制该溶液,实验中需要称量___________晶体,下图不需要的仪器是___________(写出仪器名称),若定容时仰视刻度线,则所配溶液浓度___________(填“>”或“<”)
(2)“84消毒液”在存放中会变质,实验室中可用淀粉试纸判断某“84消毒液”是否完全变质,若试纸___________则说明“84消毒液”没有完全变质。在强碱性溶液中,能将氧化为,若用上述所配溶液,能恰好氧化溶液,则___________。
(3)已知:①
②
写出在溶液中分解生成的热化学方程式:___________。
(4)在不同温度时,测得84消毒液值(表示水溶液中物质的氧化性或还原性强弱。值越大,氧化性越强)随时间的变化曲线如图所示:
试分析,值在不同温度下变化不同的原因可能是___________。
17.已知下列热化学方程式:
①H2(g)+O2(g)=H2O(l) ΔH=-285.8kJ mol-1
②H2(g)+O2(g)=H2O(g) ΔH=-241.8kJ mol-1
③C(s)+O2(g)=CO(g) ΔH=-110.5kJ mol-1
④C(s)+O2(g)=CO2(g) ΔH=-393.5kJ mol-1
回答下列问题:
(1)表示H2燃烧的热化学方程式是____。表示C不完全燃烧的热化学方程式是_____。表示H2、C的燃烧热的热化学方程式分别是____、____;H2的燃烧热ΔH为____,C的燃烧热ΔH为____。
(2)燃烧1gH2生成液态水,放出的热量为_____。
(3)已知CO的燃烧热为283.0kJ mol-1,现有CO、H2和CO2组成的混合气体116.8L(标准状况),完全燃烧后放出总能量为867.9kJ,且生成18g液态水,则混合气体中H2为____L,CO在混合气体中的体积分数约为____(精确至小数点后2位)。
18.(1)已知CH3OH(l)的燃烧热ΔH=-238.6kJ/mol,CH3OH(l)+3/2O2(g)=CO2(g)+2H2O(g) ΔH=-a kJ/mol,则a__238.6(填“>”、“<”或“=”)。
(2)使Cl2和H2O(g)通过灼热的炭层,生成HCl和CO2,当有1mol Cl2参与反应时释放出145kJ热量,写出该反应的热化学方程式:____。
(3)反应mA(g)+nB(g) pC(g)+qD(g)过程中的能量变化如图所示,回答下列问题。
该反应ΔH=___(用含E1、E2式子表示);在反应体系中加入催化剂,E1__,E2__,(填增大、减小、不变)。
19.家用液化气中主要成分之一是丁烷。在101kPa时,10kg丁烷完全燃烧生成CO2和H2O,放出热量5×105kJ,丁烷的燃烧热为___________。
20.甲烷是一种重要的化工原料,广泛应用于民用和工业中。
(1)已知:①CH4(g)+H2O(g)=CO(g)+3H2(g) H1
②2CO(g)+O2(g)=2CO2(g) H2=-566kJ mol 1
③H2(g)O2(g)=H2O(g) H3=-242kJ mol 1
相关化学键的键能数据如下:
共价键 H O C≡O H H C H
键能/(kJ mol 1) 463 1076 436 413
由此计算 H1=_______kJ mol 1,CH4超干重整CO2技术得到CO和H2的反应的热化学方程式为_______。
21.回答下列问题:
(1)合成氨一直是科学家研究的重要课题,已知破坏有关化学键需要的能量如表所示:
a b c d
则反应生成2mol所释放出的热量为___________。
(2)32.0 g Cu 与 100 mL 10.0 mol·L-1的浓硝酸反应,标准状况下测得反应产生的 NO、NO2混合气体 6.72 L,且充分反应后铜仍有剩余。请计算:
①混合气体中 NO 与 NO2的物质的量之比为___________。
②向反应后的溶液中滴加稀硫酸可使铜完全溶解,离子方程式为___________。若该过程中只有 NO 气体生成,则还能产生 NO 的物质的量为___________。
22.已知甲、乙、丙为常见的单质,A、B、C、D、X、Y、Z为常见化合物,且丙在常温常压下为气体,B为淡黄色固体,Y的摩尔质量数值比Z小16,乙、丙的摩尔质量相同,B的摩尔质量比D小2,B、X的摩尔质量相同。各物质之间的转化关系如图所示(各反应条件略)。
请回答:
(1)在B与二氧化碳的反应中,每有1mol电子转移,生成气体_______L(标准状况)。
(2)X与Y的溶液混合后,再加入适量盐酸,会有乙生成,反应的离子方程式是_____________。
(3)将C通入溴水中,所发生反应的离子方程式是____________。D中含的化学键类型为________。
(4)在101KPa时,4.0g乙在一定条件下与丙完全反应生成C,放出37KJ的热量,该反应的热化学方程式 是____________
(5)比甲元素的原子序数少4的M元素,在一定条件下能与氢元素组成化合物MH5。已知MH5的结构与氯化铵相似,MH5与水作用有氢气生成,则MH5的电子式为_________(M要用元素符号表示)。写出MH5与AlCl3溶液反应的化学方程式_________
23.能源是国民经济发展的重要基础,我国目前使用的能源主要是化石燃料,而氢气、丙烷、乙硼烷等都是很有发展前景的新能源。
(1)未来新能源的特点是资源丰富,在使用时对环境无污染或污染很小,且可以再生,下列属于未来新能源标准的是______(填字母)。
①石油②煤③天然气④沼气⑤太阳能⑥氢能⑦风能
A.③④⑤ B.③⑤⑥⑦ C.③⑤⑥ D.④⑤⑥⑦
(2)25℃、101Pa时,11g丙烷C3H8完全燃烧生成CO2和液态水时放出的热量是555.0kJ,则表示丙烷燃烧热的热化学方程式是______。
(3)运动会上使用的火炬的燃料一般是丙烷(C3H8),丙烷在一定条件下发生脱氢反应可以得到丙烯。已知:C3H8(g)→CH4(g)+HCCH(g)+H2(g)△H=+156.6kJ/mol
CH3CH=CH2(g)→CH4(g)+HCCH(g)△H=+32.4kJ/mol
则相同条件下,反应C3H8(g)→CH3CH=CH2(g)+H2(g)的△H=______kJ/mol。
(4)某学生想通过测定反应过程中所放出的热量来计算中和热。他将50mL0.5mol/L的盐酸与50mL0.55mol/L的NaOH溶液在如图所示的装置中进行中和反应。请回答下列问题:
①从实验装置上看,图中尚缺少的一种玻璃用品是______,烧杯间填满碎塑料泡沫的作用是______。
②大烧杯上如不盖硬纸板,则求得的中和热数值______(填“偏大”“偏小”“无影响”)。
③实验中改用20mL0.5mol/L的盐酸跟20mL0.55mol/L的NaOH溶液进行反应,与上述实验相比,所放出的热量______ (填“相等”或“不相等”);所求中和热的数值会______ (填“相等”或“不相等”)。
【参考答案】
一、选择题
1.A
解析:根据盖斯定理可知:2①+②-③可得目标方程式,=2+-=-393.52+(-571.6)-(-870.3)=,故答案为:A
2.D
解析:A.三峡水利发电站过程中水能转化为机械能,机械能转化为电能,不涉及化学能转化为电能,故A不符合;
B.风电是将风能转化为机械能,机械能转化为电能,不涉及化学能转化为电能,故B不符合;
C.核电是将核能转化为电能,故C不符合;
D.燃烧过程将化学能转化为热能,热能转化为机械能,机械能转化为电能,故D符合;
故选:D。
3.A
解析:反应物的总能量高于生成物则为放热反应,反之则为吸热反应,由图可知,、、均为吸热过程,B、C、D项均不符合题意。
故选A。
4.C
解析:A.氢气的燃烧热是指在101kPa时,1mol氢气完全燃烧生成液态水时放出的热量,故A错误;
B.固态硫的能量小于液态硫,所以固态硫完全燃烧放出的热量少,故B错误;
C.含20.0gNaOH的稀溶液与稀盐酸完全中和,放出28.7kJ的热量,则1mol氢氧化钠和盐酸反应放出热量57.4kJ,表示该反应的热化学方程式为,故C正确;
D.燃烧反应焓变为负值,完全燃烧放热更多,焓变小,则,故D错误;
选C。
5.D
解析:A.根据盖斯定律,反应热与反应路径无关,只与反应体系的始态和终态有关,所以,故A正确;
B.反应①是碳的燃烧,属于放热反应,;反应②是用碳还原水蒸气,属于吸热反应, ;反应③是CO、H2的燃烧反应,属于放热反应,,故B正确;
C.根据盖斯定律,将煤转化为氢气和一氧化碳后燃烧和煤直接燃烧放出的热量相等,故C正确;
D.将煤转化为水煤气后再燃烧,提高了煤燃烧利用率,故D错误;
故选D。
6.A
解析:根据盖斯定律可知,反应②-反应①可得到,对应焓变=;又因为=4E(C-H)-E(C)-2E(H-H),所以H-H的键能E(H-H)= =,A项符合题意。
故选A。
7.D
解析:A.ΔH>0表示吸热反应,ΔH<0表示放热反应,错误;
B.燃烧热为1mol可燃物完全反应生成稳定的氧化物放出的热量,1molH2与0.5molO2反应生成H2O(l)放出的热就是H2的燃烧热,错误;
C.0.5molH2SO4与0.5molBa(OH)2反应生成BaSO4沉淀和1mol H2O,不符合中和热的含义,错误;
D.热化学方程式中的化学计量数只表示物质的量,可以是分数,正确;
故选D。
8.C
解析:①;
②;
③;
④;
⑤;
⑥;则⑤+①-⑥-②+③得④,得到+838 kJ mol-1,所以A B D错误, C正确,
故选C。
9.C
解析:A.和反应的中和热,则和反应的中和热,选项A错误;
B.甲烷的燃烧热,则,选项B错误;
C.的燃烧热是,反应的,则反应的,选项C正确;
D.已知:500℃、下,;该反应是可逆反应,因此将和过量的在此条件下充分反应,放出热量小于46.2kJ,选项D错误;
答案选C。
10.A
解析:A.断键时吸热、成键时放热,则(436+a)-2×431=-183,得,A正确;
B.反应物具有的总能量大于生成物具有的总能量,该反应为放热反应,则和的总能量大于的,B错误;
C.与完全反应生成时放出热量,条件不足,无法求出的物质的量,C错误;
D.的能量比的能量高,则生成的能量变化大于,D错误;
答案选A。
11.D
解析:A.焓变与反应条件没有关系,故A错误;
B.浓硫酸溶于水时放热但是物理变化,图1表示的是化学变化中能量变化,氧化钙和水反应放热,符合图1能量变化,故B错误;
C.酸碱中和放热,500 mL 2.0 mol·L 和500 mL 2.0 mol·L 反应放热,图2是吸热能量变化,故C错误;
D.固体与固体制备反应吸热,图2是吸热能量变化,故D正确;
故选:D。
12.D
解析:A.太阳光催化分解水制氢气,光能转化为化学能,故A错误;
B.反应②的ΔH2=131.3kJ·mol–1>0,则反应②为吸热反应,故B错误;
C.催化剂能降低反应的活化能,增大反应速率,故C错误;
D.根据盖斯定律,将反应③-反应②得, CH4(g)=C(s)+2H2(g) ΔH= +74.8 kJ·mol–1,故D正确;
故答案选D。
13.D
解析:碳和水蒸气反应属于吸热反应,生成物总能量大于反应物总能量,结合物质状态碳是固体、其余物质均为气态,故选D。
14.C
解析:1gCH4在氧气中燃烧生成CO2和液态水,放出55.65kJ热量,16g即1molCH4在氧气中燃烧生成CO2和液态水,放出16×55.65kJ =890.4kJ热量,则热化学方程式为:CH4(g)+2O2(g)═CO2(g)+2H2O(l) △H=-890.4kJ/mol,
故选:C。
15.A
解析:A. H2和 H3分别代表M元素的第一电离能和第二电离能,均大于0,所以 H1+ H3>0,A项错误;
B.Cl2 (g)断键形成两个气态氯原子,该过程吸热,所以 H4>0,气态氯原子得到一个电子可以形成稳定的8电子结构,该过程放热,所以 H5<0,因此 H4> H5,B项正确;
C.同主族元素从上到下第一电离能逐渐减小,所以第一电离能:Ba
故选A。
二、填空题
16.(1) 14.9 漏斗、圆底烧瓶 <
(2) 变蓝色 10或10.0
(3)3NaClO(aq)=2NaCl(aq)+NaClO3(aq) ΔH=(b-3a)kJ·mol-1
(4)温度升高使次氯酸分解加快,溶液中次氯酸浓度减小,氧化性减弱
解析:(1)根据题目要求选择1000mL的容量瓶配制溶液,故需要称量NaClO的质量m=1L×0.2mol·L-1×(23+35.5+16)g/mol=14.9g;配制过程中需要用到托盘天平进行称量,烧杯、玻璃棒用于溶解,胶头滴管用于定容,不需要漏斗和圆底烧瓶;定容时仰视,溶液体积偏大,所配溶液浓度小于0.2mol/L;
(2)84消毒液有效成分为具有漂白性的NaClO,NaClO的强氧化性可将I-氧化为I2,遇到淀粉显蓝色;NaClO被还原为Cl-,根据氧化还原反应电子得失守恒可列式0.2×20.0×10-3×2=0.2×V×10-3×4,解得V=10.0mL;
(3)根据盖斯定律可得目标方程式为②-3×①,可得热化学方程式为3NaClO(aq)=2NaCl(aq)+NaClO3(aq) ΔH=(b-3a)kJ·mol-1;
(4)消毒液中有效成分次氯酸受热易分解,温度升高使次氯酸分解加快,溶液中次氯酸浓度减小,氧化性减弱。
17.(1) ①② ③ ① ④ -285.8kJ mol-1 -393.5kJ mol-1
(2)142.9kJ
(3) 22.4 39.45%
解析:(1)氢气燃烧生成水,则表示氢气燃烧的热化学方程式为①②;碳不完全燃烧生成CO,则表示C不完全燃烧的热化学方程式是③;燃烧热指在101KPa下1mol可燃物完全燃烧生成指定产物时所放出的热量,H燃烧生成液态水,C燃烧生成CO2,则表示H2燃烧热的热化学方程式为①,表示C燃烧热的热化学方程式为④;根据反应①可知,氢气的燃烧热ΔH= 285.8 kJ/mol,根据反应④可知,碳的燃烧热ΔH= 393.5 kJ/mol;
(2)1g氢气的物质的量是0.5mol,则燃烧1 g H2 生成液态水,放出的热量为0.5mol×285.8 kJ/mol=142.9 kJ;
(3)n(H2O)=18g÷18g/mol=1mol,根据氢原子守恒得n(H2O)=n(H2)=1mol,则混合气体中H2为22.4L(标准状况下);根据反应①可知,1mol氢气完全燃烧放出的热量是285.8 kJ,则CO完全燃烧放出的热量=867.9 kJ-285.8 kJ=582.1 kJ。设CO的物质的量是x mol,根据CO的燃烧热为283.0 kJ/mol,有283x=582.1,解得x=2.06,标况下体积是2.06mol×22.4L/mol=46.07L,因此CO在混合气体中的体积分数约为 46.07L÷116.8L×100%≈39.45% 。
18. < 2Cl2(g)+2H2O(g)+C(s)=4HCl(g)+CO2(g) ΔH=-290 kJ/mol ΔH=-(E2-E1)kJ/mol 减小 减小
【分析】(1)CH3OH(l)的燃烧热是1mol甲醇燃烧生成CO2(g)和H2O(l)放出的热。
(2)1mol Cl2参与反应时释放出145kJ热量,则2mol Cl2与2mol H2O(g)反应放热290 kJ;
(3)焓变=反应物的总键能-生成物的总键能;催化剂降低活化能;
解析:(1)燃烧热是1mol物质完全燃烧生成稳定氧化物放出的热量,液态水为稳定的氧化物,1mol甲醇燃烧生成CO2(g)和H2O(l)放热238.6kJ,所以1mol甲醇燃烧生成CO2(g)和H2O(g),放出的热量小于燃烧热,故a<238.6;
(2)有1molCl2参与反应时释放出145kJ热量,2mol氯气反应放热290kJ,反应的热化学方程式为:2Cl2(g)+2H2O(g)+C(s)═4HCl(g)+CO2(g) ΔH=-290kJ·mol 1;
(3)由图象可知该反应是一个能量降低的反应,所以属于放热反应;ΔH=反应物的总键能-生成物的总键能,所以ΔH=E1-E2= -(E2-E1)kJ/mol;加入催化剂改变了反应的途径,降低反应的活化能,所以E1和E2都减小。
19.kJ/mol
解析:n(C4H10)=,则1 mol丁烷完全燃烧放出热量Q=,故此处填:2900 kJ/mol。
20. +194 CH4(g)+CO2(g)= 2CO+2H2(g) △H=+235 kJ mol 1
解析:(1)化学反应的△H=旧键断裂吸收的能量-新键形成放出的能量,根据表格数据计算△H1=463 kJ mol 1×2+413 kJ mol 1×4-1076 kJ mol 1-436kJ mol 1×3=+194kJ mol 1,根据盖斯定律,第①个方程式减去第②个方程式的一半,在加上第③个方程式得到CH4超干重整CO2技术得到 CO 和H2 的反应的热化学方程式为CH4(g)+CO2(g)= 2CO+2H2(g) △H=+235 kJ mol 1;故答案为:+194;CH4(g)+CO2(g)= 2CO+2H2(g) △H=+235 kJ mol 1。
21.(1)6b-(3a+d)
(2) 2:1 3Cu+2NO+8H+=3Cu2++2NO↑+4H2O 0.100mol
解析:(1)反应的△H=反应物键能和-生成物键能和=6b-(3a+d)kJ/mol,则生成2mol NH3(g)放出热量为6b-(3a+d)kJ;
(2)①铜与浓硝酸反应的化学方程式为:Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O, 铜与稀硝酸反应的化学方程式为:3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O,充分反应后铜仍有剩余,说明硝酸完全反应,设生成的NO的物质的量为xmol,NO2的物质的量为ymol,则有(x+y)mol×22.4L/mol= 6.72 L,(4x+2y)mol=10.0 mol·L-1×0.1L,联立两式解得x=0.2,y=0.1,混合气体中 NO 与 NO2的物质的量之比为0.2:0.1=2:1;
②向反应后的溶液中滴加稀硫酸后得到稀硝酸溶液,可与铜反应而完全溶解,离子方程式为3Cu+2+8H+=3Cu2++2NO↑+4H2O;原先的硝酸消耗铜为0.05+=0.35mol,32.0 g Cu的物质的量为,则剩余0.5-0.35=0.15mol,由离子方程式为3Cu+2+8H+=3Cu2++2NO↑+4H2O可知还能产生 NO 的物质的量为0.100mol。
22.(1)11.2
(2)
(3) SO2+Br2+2H2O=2HBr+H2SO4 共价键
(4)S(s)+O2(g)=SO2(g);△H = -296kJ/mol
(5) AlCl3+3NH5+3H2O=Al(OH)3↓+3NH4Cl+3H2↑
【分析】甲、乙、丙为常见的单质,A、B、C、D、X、Y、Z为常见化合物,且丙在常温常压下为气体,B为淡黄色固体,则B为Na2O2,甲为Na,丙为O2,B、X的摩尔质量相同,则X为Na2S,乙为S单质,C为SO2,D为SO3,Y为Na2SO3,Z为 Na2SO4。据此作答。
解析:(1)在B与二氧化碳的反应中,每有1mol电子转移,生成气体体积为11.2L;
(2)X与Y的溶液混合后,再加入适量盐酸,会有乙生成,反应的离子方程式是;
(3)将C通入溴水中,所发生反应的离子方程式是SO2+Br2+2H2O=2HBr+H2SO4;D中含的化学键类型为共价键;
(4)在101KPa时,4.0g乙在一定条件下与丙完全反应生成C,放出37KJ的热量,该反应的热化学方程式S(s)+O2(g)=SO2(g);△H =-(32÷4.0×37)= -296kJ/mol;
(5)比甲元素的原子序数少4的M元素,则M为N元素;NH5的结构与氯化铵相似,故化学式为:NH4H,与水作用有氢气生成,则MH5的电子式为,写出NH4H与AlCl3溶液反应,则为NH4H与H2O反应后生成的NH3·H2O与AlCl3反应,故化学方程式:AlCl3+3NH4H+3H2O=Al(OH)3↓+3NH4Cl+3H2↑。
23. D C3H8(g)+5O2(g)=3CO2(g)+4H2O(l) ΔH=-2220.0kJ mol-1 +124.2 kJ mol-1 环形玻璃搅拌棒 保温、隔热,减少实验过程中的热量损失 偏小 不相等 相等
解析:(1)煤、石油、天然气是化石能源,属于不可再生能源,燃烧时生成的污染物较多,不是新能源;太阳能、沼气、潮汐能、风能、氢能等,都是可再生能源、使用时对环境无污染,属于新能源,故选D;
(2)25℃、101Pa时,11g丙烷C3H8完全燃烧生成CO2和液态水时放出的热量是555.0kJ,则1mol丙烷C3H8完全燃烧生成CO2和液态水时放出的热量是2220.0kJ,表示丙烷燃烧热的热化学方程式是C3H8(g)+5O2(g)=3CO2(g)+4H2O(l) ΔH=-2220.0kJ mol-1;
(3)①C3H8(g)→CH4(g)+HCCH(g)+H2(g)△H=+156.6kJ/mol
②CH3CH=CH2(g)→CH4(g)+HCCH(g)△H=+32.4kJ/mol
根据盖斯定律①-②得C3H8(g)→CH3CH=CH2(g)+H2(g) △H=+156.6kJ/mol -32.4kJ/mol =+124.2 kJ mol-1kJ/mol;
(4)①由量热计的构造可知该装置的缺少仪器是环形玻璃搅拌棒;中和热测定实验成败的关键是保温工作,大小烧杯之间填满碎纸条的作用是保温、隔热,减少实验过程中的热量损失;
②大烧杯上如不盖硬纸板,则热量散失较多,求得的中和热数值偏小;
③反应放出的热量和所用酸以及碱的量的多少有关,实验中改用20mL0.5mol/L的盐酸跟20mL0.55mol/L的NaOH溶液进行反应,与上述实验相比,生成水的物质的量不同,所放出的热量不相等;中和热均是强酸和强碱反应生成1mol水时放出的热,与酸碱的用量无关,所求中和热的数值会相等
同课章节目录
- 第1章 化学反应与能量转化
- 第1节 化学反应的热效应
- 第2节 化学能转化为电能——电池
- 第3节 电能转化为化学能——电解
- 第4节 金属的腐蚀与防护
- 微项目 设计载人航天器用化学电池与氧气再生方案——化学反应中能量及物质的转化利用
- 第2章 化学反应的方向、 限度与速率
- 第1节 化学反应的方向
- 第2节 化学反应的限度
- 第3节 化学反应的速率
- 第4节 化学反应条件的优化——工业合成氨
- 微项目 探讨如何利用工业废气中的二氧化碳合成甲醇——化学反应选择与反应条件优化
- 第3章 物质在水溶液中的行为
- 第1节 水与水溶液
- 第2节 弱电解质的电离 盐类的水解
- 第3节 沉淀溶解平衡
- 第4节 离子反应
- 微项目 揭秘索尔维制碱法和侯氏制碱法——化学平衡思想的创造性应用
