2.1化学反应速率 同步练习题(含解析) 2023-2024学年高二上学期人教版(2019)化学选择性必修1
文档属性
| 名称 | 2.1化学反应速率 同步练习题(含解析) 2023-2024学年高二上学期人教版(2019)化学选择性必修1 |  | |
| 格式 | docx | ||
| 文件大小 | 908.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-16 17:31:34 | ||
图片预览



文档简介
2.1化学反应速率同步练习题
一、选择题
1.下列各组反应中(表中物质均为反应物,且金属的物质的量均为0.1mol),反应开始时放出的速率最快的是
选项 金属(粉末状) 酸 体积/mL 浓度/(mol/L) 反应温度/℃
A 稀盐酸 10 6 40
B 稀硝酸 10 6 40
C 稀盐酸 20 3 30
D 稀硫酸 10 3 30
A.A B.B C.C D.D
2.盐酸与块状CaCO3反应时,不能使反应最初的速率明显加快的是
A.将盐酸的用量增加一倍 B.盐酸的浓度增加一倍,用量减半
C.温度升高30 ℃ D.将块状CaCO3粉碎后再与盐酸反应
3.,在V2O5存在时,该反应的机理为(快)、(慢)。下列说法正确的是
A.反应速率主要取决于V2O5的质量
B.V2O5是反应的中间产物
C.逆反应的活化能大于198
D.升高温度,正反应速率减慢,逆反应速率加快
4.下列情况下,反应速率相同的是
A.等体积0.1mol/L HCl和0.1mol/L H2SO4分别与0.2mol/L NaOH溶液反应
B.等质量锌粒和锌粉分别与等量1mol/L HCl反应
C.等体积等浓度HCl和HNO3分别与等质量的Na2CO3粉末反应
D.等体积0.2mol/L HCl和0.2mol/L H2SO4与等量等表面积等品质石灰石反应
5.H2O2是常见的氧化剂,一定条件下可发生分解反应。在含有少量I-的溶液中,H2O2分解时能量变化与反应过程如下图所示。过程I的反应为H2O2+I =H2O+IO 。下列说法正确的是
A.过程Ⅱ的反应为H2O2+IO =H2O+I +O2↑
B.决定反应快慢的是过程Ⅱ的反应
C.H2O2分解反应为吸热反应
D.2H2O2(aq)=2H2O(l)+O2(g)反应的ΔH=(a c b)kJ·mol 1
6.亚硝酰氯(NOCl)在有机合成中有重要应用。2NO(g)+Cl2(g)→2NOCl(g)的反应历程如图。下列说法错误的是
A.相对于曲线Ⅱ,曲线Ⅰ表示加入催化剂
B.催化剂能提高反应物的相对能量
C.反应物总能量高于生成物的总能量
D.2NO(g)+Cl2(g)→2NOCl(g)+77.1kJ
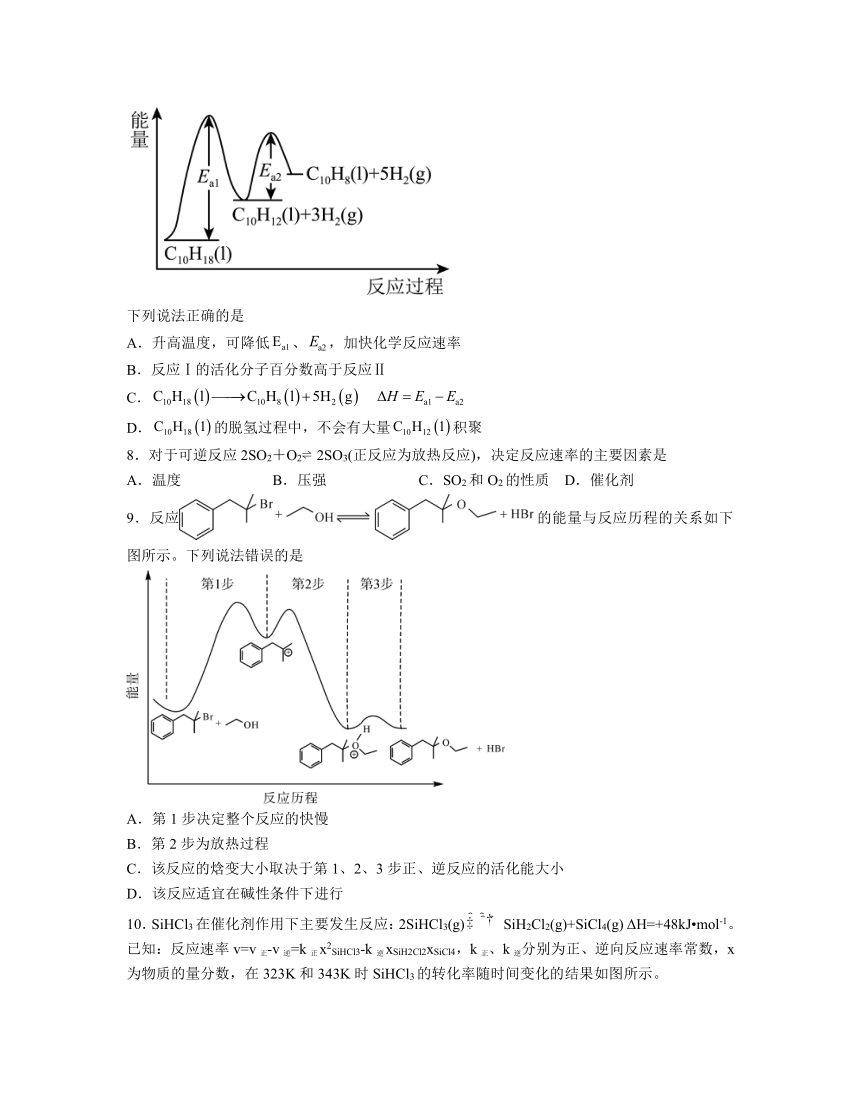
7.十氢化萘(C10H18)是具有高储氢密度的氢能载体,经历“”的脱氢过程释放氢气。
反应Ⅰ:
反应Ⅱ:
在一定温度下,其反应过程对应的能量变化如图。
下列说法正确的是
A.升高温度,可降低、,加快化学反应速率
B.反应Ⅰ的活化分子百分数高于反应Ⅱ
C.
D.的脱氢过程中,不会有大量积聚
8.对于可逆反应2SO2+O2 2SO3(正反应为放热反应),决定反应速率的主要因素是
A.温度 B.压强 C.SO2和O2的性质 D.催化剂
9.反应的能量与反应历程的关系如下图所示。下列说法错误的是
A.第1步决定整个反应的快慢
B.第2步为放热过程
C.该反应的焓变大小取决于第1、2、3步正、逆反应的活化能大小
D.该反应适宜在碱性条件下进行
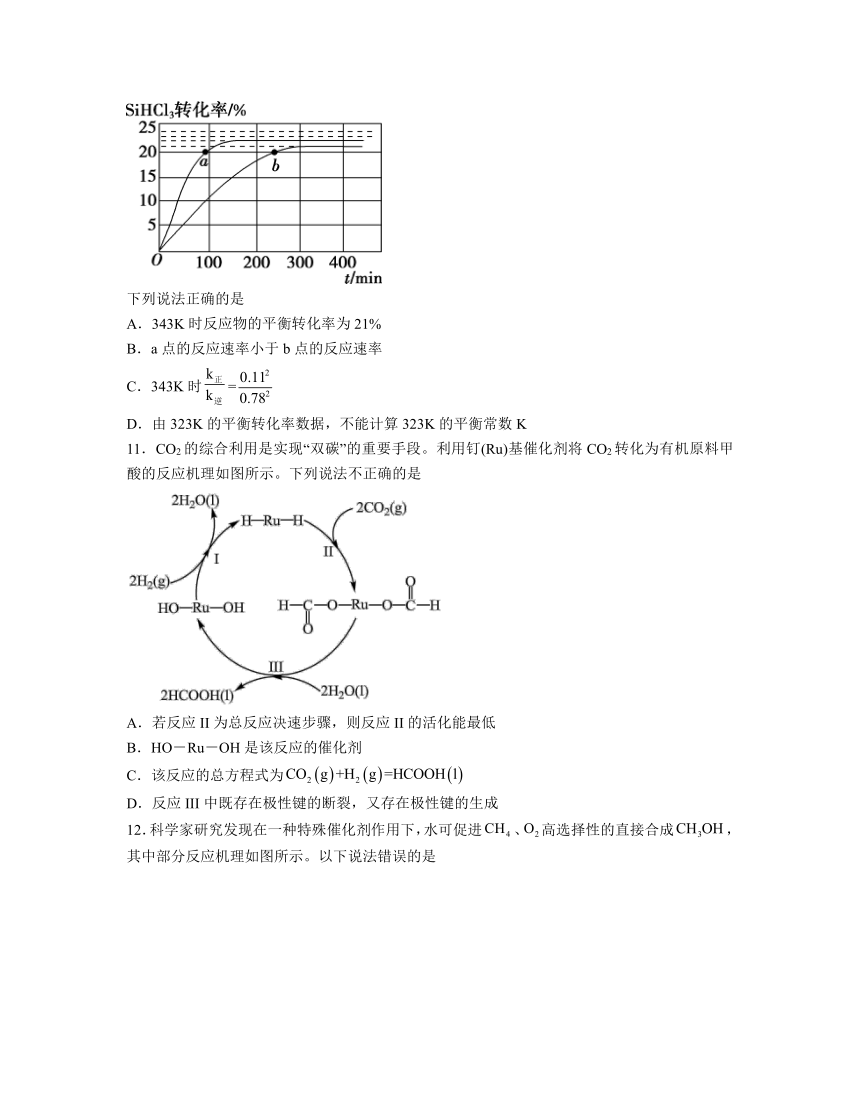
10.SiHCl3在催化剂作用下主要发生反应:2SiHCl3(g)SiH2Cl2(g)+SiCl4(g) ΔH=+48kJ mol-1。已知:反应速率v=v正-v逆=k正x2SiHCl3-k逆xSiH2Cl2xSiCl4,k正、k逆分别为正、逆向反应速率常数,x为物质的量分数,在323K和343K时SiHCl3的转化率随时间变化的结果如图所示。
下列说法正确的是
A.343K时反应物的平衡转化率为21%
B.a点的反应速率小于b点的反应速率
C.343K时=
D.由323K的平衡转化率数据,不能计算323K的平衡常数K
11.CO2的综合利用是实现“双碳”的重要手段。利用钉(Ru)基催化剂将CO2转化为有机原料甲酸的反应机理如图所示。下列说法不正确的是
A.若反应II为总反应决速步骤,则反应II的活化能最低
B.HO-Ru-OH是该反应的催化剂
C.该反应的总方程式为
D.反应III中既存在极性键的断裂,又存在极性键的生成
12.科学家研究发现在一种特殊催化剂作用下,水可促进、高选择性的直接合成,其中部分反应机理如图所示。以下说法错误的是
A.在氧化合成甲醇过程中的作用是提供与结合形成
B.
C.在催化剂表面,比更容易被吸附
D.该过程的决速步反应方程式为:
13.某温度下,体积可变的密闭容器中进行如下反应:,下列叙述正确的是
A.在容器中加入氩气,反应物反应速率减小
B.加入少量W,逆反应速率大
C.升高温度,正反应速率增大,逆反应速率减小
D.将容器的体积压缩,可增大活化分子的百分数,单位时间内有效碰撞次数增大
14.在发展非金属催化剂实现CO2电催化还原制备甲醇方向取得重要进展,该反应历程如图所示(CO、CH2O为副产物).
上述合成甲醇的反应速率较慢,要加快其反应速率,主要需降低过程中能量变化的基元反应为
A. B.
C. D.
15.下列有关实验能够达到相应实验目的的是
A.图甲中补充环形玻璃搅拌棒即可用于中和热的测定
B.图乙可用于测定H2O2溶液的分解速率
C.图丙的实验设计可以探究浓度对化学反应速率的影响
D.图丁可蒸干CuCl2饱和溶液制备无水CuCl2
二、填空题
16.根据有关要求回答问题:
(1)如图是1mol NO2(g)和1mol CO(g)反应生成CO2和NO过程中能量变化示意图,若在反应体系中加入催化剂,反应速率增大,E1的变化是___,△H的变化是___(填“增大”、“减小”、“不变”)。请写出NO2和CO反应的热化学方程式:___。
(2)以太阳能为热源,热化学硫碘循环分解水是一种高效、无污染的制氢方法。其反应过程如图所示。反应Ⅱ包含两步反应:
第一步:H2SO4(l)=SO3(g)+H2O(g) △H1=+177kJ/mol
第二步:2SO3(g)=2SO2(g)+O2(g) △H2=+196kJ/mol
①写出第一步反应自发进行的条件是:___。
②写出反应Ⅱ的热化学方程式:___。
17.在一固定容积的密闭容器中,进行如下反应:CsH2Og COgH2g。
(1)若容积体积为2L,反应10s氢气质量增加0.4g,则该时间内一氧化碳的反应速率为______。若增加炭的量,则正反应速率______(选填“增大”、“减小”、“不变”)。若增大压强,化学平衡向______移动。(选填“正向”、“逆向”或“不”)
(2)该反应达到平衡状态的标志是______(选填编号)
A.压强不变
B.v 正(H2)=v 正(H2O)
C. c(CO)不变
D.cH2OcCO
(3)若降低温度,平衡逆向移动,则正反应是______反应(选填“吸热”或“放热”)
18.在一个容积为3 L的密闭容器内进行如下反应:A2(气)+3B2(气)=aX(气)。反应开始时,n(A2)=1.5 mol,n(B2)=4.0 mol,2 min后,n(B2)=0.4 mol, n(X)=2.4 mol。计算:
(1)a值______________。
(2)X的表示式(用A、B表示)________________。
(3)υ(B2)为_____________。
(4)2 min末的A2的浓度_______________。
19.探究影响KMnO4与草酸(H2C2O4,二元弱酸)反应速率的因素。完成下列填空:
I.配制1.000×10-3 mol·L-1 KMnO4溶液、0.40 mol·L-1草酸溶液。
(1)用5.200×10-3 mol·L-1 KMnO4溶液配制100 mL 1.000×10-3 mol·L-1 KMnO4溶液需要的仪器有:_______。
II.将KMnO4溶液与草酸溶液按如下比例混合。
序号 V(KMnO4) / mL V(草酸) /mL V(H2O) /mL 反应温度
① 2.0 2.0 0 20°C
② 2.0 1.0 1.0 20°C
(2)实验①和②的目的是 _______。
(3)上述实验应控制pH相同,则应加入的试剂是_______(选填选项)。
A.盐酸 B.硫酸 C.草酸
III.将溶液调至pH=1进行实验①和②,发现紫色并未直接褪去,而是分成两个阶段:
i.紫色溶液变为青色溶液;
ii.青色溶液逐渐褪至无色溶液。
资料:(a)Mn2+在溶液中无色;
(b)Mn3+无色,有强氧化性,发生反应Mn3++2[Mn(C2O4)2]-(青绿色)后氧化性减弱;
(c)MnO呈绿色,在酸性条件下不稳定,迅速分解产生和MnO2。
(4)推测阶段i中可能产生了MnO。该观点是否合理,并说明理由:_______。
IV.为证明溶液中含有[Mn(C2O4)2]-,测得反应过程中和[Mn(C2O4)2]-浓度随时间的变化如下图:
(5)第i阶段中检测到有CO2产生,反应的离子方程式为_______。
(6)实验②在第ii阶段反应速率较大,猜测是c(Mn3+)较大引起的,请解释实验②中c(Mn3+)较大的原因_______。
(7)据此推测,若在第ii阶段将c(H+)调节至0.2 mol·L-1,溶液褪至无色的时间会_______(填“增加”“减少” 或“不变”)。
20.对化学反应速率的研究是一个重要课题,对工农业生产有重要意义。根据你所学知识回答下列问题:
(1)用图中装置测定产生相同体积的所用时间长短,给出了甲、乙两套装置。
①小红用的盐酸5mL,小明用的盐酸5mL,他们用的是相同质量,且规格相同的锌粒。你认为应选择_______装置较合理,两同学得到相同体积的所用时间较短的是_______同学,原因是_______。
②小红和小明对该实验进行了新的探究,他们均用6.5g锌,的盐酸,不同的是小红用了200mL盐酸,而小明用了400mL盐酸,当锌粒全部消失时,小红用了t1分钟,小明用了t2分钟,则t1_______ t2 (填“>”、“<”或“=”),理由是_______。
(2)合成氨反应,开始把和充入一2L的密闭容器中,加入一定量的铁触媒,控制500℃和300atm,使之发生反应。10分钟时,测得生成,请回答下列问题:
①用表示的反应速率为_______。
②如果保持容器容积2L不变,控制500℃,再充入1mol He,压强增大,则反应速率_______,理由是_______。
③如果控制500℃和300atm,再充入1mol He,反应速率将_______。(填“变大”、“变小”或“不变”,下同)
④如果从体系中分离出,正反应速率将_______,逆反应速率将_______。
【参考答案】
一、选择题
1.A
解析:硝酸与金属反应不能生成氢气,排除B;金属越活泼与酸反应速率越快,活泼性:Mg>Zn,排除C;A与D相比,溶液中相同,A对应的温度高于D,温度越高反应速率越大,故A放出氢气的速率最快。
故选:A。
2.A
解析:A.盐酸的用量增加,但是浓度不变,化学反应速率不变,A错误;
B.盐酸浓度增大,尽管用量减半了,化学反应速率就会加快,化学反应速率只与浓度有关,跟用量无关,B正确;
C.升高温度,化学反应速率加快,C正确;
D.粉碎后,接触面积增大 ,化学反应速率加快,D正确;
故选A。
3.C
解析:A.由反应机理可得,V2O5是该反应的催化剂,反应速率与催化剂V2O5的质量有一定关系,但主要取决于催化剂V2O5的表面积,A错误;
B.由反应机理可得,V2O5是该反应的催化剂,B错误;
C.正反应的活化能—逆反应的活化能,所以逆反应的活化能大于,C正确;
D.升高温度,正、逆反应速率均增大,D错误;
故选C。
4.C
解析:A.等体积0.1mol/L和0.1mol/L 中不同,与0.2mol/L NaOH溶液反应速率不同,A错误;
B.锌粒和锌粉接触面积不同,与等量盐酸反应速率不同,B错误;
C.等体积等浓度和 中相同,与等质量的Na2CO3粉末反应速率相同,C正确;
D.与石灰石反应,生成是微溶物,覆盖在碳酸钙表面,反应速率比盐酸中的反应慢,D错误;
故选C。
5.A
解析:A.H2O2分解时总反应为2H2O2=2H2O+O2↑,减去过程Ⅰ反应得过程Ⅱ的反应为H2O2+IO =H2O+I +O2↑,A正确;
B.慢反应决定整体反应速率,据图过程Ⅰ活化能更大,则过程Ⅰ为慢反应,决定整体反应速率,B错误;
C.据图可知整个过程中,反应物能量高于生成物,为放热反应,C错误;
D.焓变为生成物能量-反应物能量,所以该反应的ΔH= bkJ·mol 1,D错误;
综上所述答案为A。
6.B
解析:A.相对于曲线Ⅱ,曲线Ⅰ是降低反应所需活化能,则曲线Ⅰ表示加入催化剂,故A正确;
B.催化剂能降低“过渡态”物质的相对能量,降低反应活化能,故B错误;
C.该反应是放热反应,因此反应物总能量高于生成物的总能量,故C正确;
D.该反应是放热反应,放出77.1kJ 的热量,则反应热化学方程式为2NO(g) +Cl2(g)→2NOCl(g)+77.1kJ,故D正确。
综上所述,答案为B。
7.D
解析:A.升高温度,不能改变反应的活化能,即不可降低、,而是通过增大分子的能量使普通分子变为活化分子,增大活化分子百分含量,从而加快化学反应速率,A错误;
B.由图可知,Ea1>Ea2,则说明反应Ⅱ比反应Ⅰ速率快,活化分子百分率越大,反应速率越快,则反应Ⅰ的活化分子百分率低于反应Ⅱ,B错误;
C.总反应的△H等于生成物的总能量减去反应物的总能量,Ea1为C10H18
C10H12的活化能,Ea2为C10H12C10H8的活化能,根据能量变化图,总反应即的△H≠Ea1-Ea2,C错误;
D.由图可知,Ea1>Ea2,则说明反应Ⅱ比反应Ⅰ速率快,即消耗C10H12速率大于生成C10H12,所以C10H18脱氢过程中,不会有大量中间产物C10H12,D正确;
故答案为:D。
8.C
解析:对于一个化学反应来说,化学反应进行的快慢程度由内因决定,即由参加反应的物质本身的性质决定。对于可逆反应2SO2+O2 2SO3(正反应为放热反应),决定反应速率的主要因素是SO2和O2的性质,故合理选项是C。
9.C
解析:A.第1步反应的活化能大,反应速率慢,整个反应由第1步决定,故第1步为决速步骤,选项A正确;
B.由图可知,第2步反应物的总能量高于生成物的总能量,反应为放热过程,选项B正确;
C.焓变等于生成物总能量与反应物总能量之差,即焓变由反应物和生成物总能量决定,不由活化能决定,选项C错误;
D.强碱性条件下反应正向移动,故该反应适宜在强碱性条件下进行,选项D正确;
答案选C。
10.C
解析:A.该可逆反应为气体分子数不变且吸热的反应。则对于该可逆反应来说,温度升高,反应向正反应方向进行。根据题中t-SiHCl3%图,可知曲线a为343K时SiHCl3的转化率-时间曲线,曲线b为323K时SiHCl3的转化率-时间曲线。由分析可知,曲线a为343K时的变化曲线,由图可知,343K时反应物的平衡转化率为22%,A项错误;
B.由图可知,a、b两点的转化率相等,可认为各物质的浓度对应相等,而a点的温度更高,所以速率更快,即a点的反应速率大于b点的反应速率,B项错误;
C.由图可知,343K时SiHCl3的转化率为22%,设起始时SiHCl3的浓度为1mol/L,则根据反应方程式有:
平衡时v正=v逆,则k正x2SiHCl3=k逆xSiH2Cl2xSiCl4,则==,C项正确;
D.由图可知,323K时SiHCl3的转化率为21%,设起始时SiHCl3的浓度为1mol/L,由反应方程式可知:
该可逆反应的平衡常数K==0.0136,故由323K的平衡转化率数据,可以计算323K的平衡常数K,D项错误。
11.A
解析:A.若反应II为决速步骤,则反应II的活化能最高,A项说法错误;
B.由流程可知,HO-Ru-OH是该反应的催化剂,B项说法正确;
C.由图可知该反应的总方程式为,C项说法正确;
D.反应过程中存在极性键H-O的断裂和生成,D项说法正确;
故选A。
12.B
解析:A.从该部分反应机理可看出,水在催化剂表面离解出直接与结合形成,故A正确;
B.图中未说明未吸附在催化剂上的CH4的能量,无法计算的反应热,故B错误;
C.从相对能量看,水吸附在催化剂表面的能量更低,更加稳定,则在催化剂表面,比更容易被吸附,故C正确;
D.由图可知,的活化能最大,反应速率最慢,为该过程的决速步反应,故D正确;
故选B。
13.A
解析:A.在容器中加入氩气,压强增大,但参与反应的物质的浓度不变,所以反应速率不变,A项正确;
B.W是固体,所以加入少量W,正、逆反应速率均不变,B项不正确;
C.升高温度,正、逆反应速率均增大,C项不正确;
D.将容器的体积压缩,可增大单位体积内活化分子数有效碰撞次数增多,反应速率加快,但活化分子的百分数不变,D项不正确;
故答案选A。
14.A
解析:根据图可知合成甲醇的过程中的活化能最大,反应速率最慢,决定整体反应速率,所以主要降低该步骤的能量变化,A符合题意,故答案为:A。
15.C
解析:A.图甲中补充环形玻璃搅拌棒,大小烧杯的上沿齐平,中间填充满碎纸屑即可用于中和热的测定,A与题意不符;
B.图乙中长颈漏斗应换为分液漏斗后,可用于测定溶液的分解速率,B与题意不符;
C.图丙的实验设计,只有草酸的浓度不同,其它条件相同,可以探究浓度对化学反应速率的影响,C符合题意;
D.图丁可蒸干饱和溶液制备无水,需要在气流中蒸干,D与题意不符。
故选C。
二、填空题
16.(1) 减小 不变 NO2(g)+CO(g)=NO(g)+CO2(g) △H=-234kJ mol-1
(2) 高温(或较高温度) 2H2SO4(l)=2SO2(g)+O2(g)+2H2O(g) △H=+550kJ mol-1
解析:(1)加入催化剂,可以降低反应的活化能,加快反应速率,但不影响△H,故E1减小,△H不变;NO2和CO反应生成NO和CO2,由图可知,生成物的总能量小于反应物的总能量,该反应为放热反应,反应的△H=-(368-134)kJ mol-1=-234kJ mol-1,则该反应的热化学方程式为NO2(g)+CO(g)=NO(g)+CO2(g) △H=-234kJ mol-1;
(2)①第一步反应的△H>0,△S>0,根据△H-T△S<0可知,该反应在高温(或较高温度)下可以自发进行;
②由图可知,反应Ⅱ中,H2SO4转化为SO2和O2,对反应进行标号,①H2SO4(l)=SO3(g)+H2O(g) △H1=+177kJ/mol,②2SO3(g)=2SO2(g)+O2(g) △H2=+196kJ/mol,①+②得到2H2SO4(l)=2SO2(g)+O2(g)+2H2O(g),根据盖斯定律,△H=[(+177)+(+196)]kJ/mol=+550kJ/mol,则反应Ⅱ的热化学方程式为2H2SO4(l)=2SO2(g)+O2(g)+2H2O(g) △H=+550kJ/mol。
17.01 不变 逆反应 AC 吸热
【分析】(1)结合v= c/ t及速率之比等于化学计量数之比计算;根据外界条件对反应速率和平衡状态的影响变化规律解答;
(2)结合平衡的特征“等、定”及衍生的物理量判定平衡状态;
(3)升高温度,平衡向吸热的方向移动。
解析:(1)若容器体积为2L,反应l0s氢气质量增加0.4g,物质的量是0.2mol,浓度是0.1mol/L,则v(H2)=0.1mol/L÷10s=0.01mol/(L·s),由速率之比等于化学计量数之比可知,该时间内一氧化碳的反应速率为0.01mol/(L·s);若增加炭的量,则正反应速率不变;该反应为气体体积增大的反应,若增大压强,化学平衡向逆向移动,故答案为0.01;不变;逆向;
(2)A.该反应为气体体积增大的反应,则压强不变,可知达到平衡状态,故A选;
B.v正(H2)=V正(H2O),均为正反应速率,不能判断正逆反应速率关系,不能判定平衡,故B不选;
C.c(CO)不变,符合平衡特征“定”,达到平衡状态,故C选;
D.c(H2O)=c(CO)不能判定平衡状态,与起始量、转化率有关,故D不选;
故答案为AC;
(3)降低温度,平衡向放热的方向移动,则若降低温度,平衡向逆向移动,则正反应是吸热反应,故答案为吸热。
18.(1)2
(2)AB3
(3)0.6 mol·L-1·min-1
(4)0.1 mol。L-1
解析:(1)反应开始时,n(A2)=1.5 mol,n(B2)=4.0 mol,2 min后,n(B2)=0.4 mol,n(X)=2.4 mol,则2 min内B2改变的物质的量△n(B2)=4.0 mol-0.4 mol=3.6 mol,△n(B2):△n(X)=3.6 mol:2.4 mol=3:a,解得a=2;
(2)根据上述计算可知a=2,该反应的化学方程式为:A2(气)+3B2(气)=2X(气),根据反应前后原子守恒可知:X表达式为AB3;
(3)2 min内用B2浓度变化表示的化学反应速率;
(4)根据物质反应转化关系可知:物质在相同时间内转化的物质的量的比等于化学方程式中相应物质的化学计量数的比,则△n(A2):△n(B2)=1:3,所以△n(A2)=△n(B2)=×3.6 mol=1.2 mol,在反应开始时A2的物质的量n(A2)=1.5 mol,则2 min末A2的物质的量n(A2)=1.5 mol-1.2 mol=0.3 mol,故此时A2浓度为c(A)=。
19.(1)量筒、烧杯、玻璃棒、100 mL容量瓶、胶头滴管
(2)探究草酸浓度对反应速率的影响
(3)B
(4)不合理,酸性条件下MnO不稳定,未观察到溶液中产生黑色(MnO2)沉淀
(5)MnO+ 4H2C2O4→[Mn(C2O4)2]-+4CO2↑+4H2O
(6)实验②中c(H2C2O4)低,电离产生的c()少,结合的Mn3+较少使c(Mn3+)较大,反应速率较快
(7)减少
解析:(1)用5.200×10-3 mol·L-1 KMnO4溶液配制100 mL 1.000×10-3 mol·L-1 KMnO4溶液需要的仪器有量筒、烧杯、玻璃棒、100 mL容量瓶、胶头滴管;
(2)将酸性KMnO4溶液与草酸溶液混合,其它条件都相同,只有草酸溶液浓度不同,可利用反应过程中溶液紫色消失快慢的方法探究浓度对化学反应速率的影响。故实验①和②的目的是探究浓度对化学反应速率的影响;
(3)上述实验应控制pH相同,使用的酸不能具有氧化性或还原性。在选项给出的酸中,盐酸、草酸都具有还原性,会反应消耗KMnO4,不能使用,否则会带来实验误差,而应该选择使用不具有还原性的H2SO4,用来调整溶液的酸碱性,故合理选项是B;
(4)推测阶段i中可能产生了MnO,该观点不合理,这是由于酸性条件下MnO不稳定,会迅速发生歧化反应产生和MnO2,但在实验过程中未观察到溶液中产生黑色(MnO2)沉淀,因此反应过程中未产生MnO;
(5)第i阶段中检测到有CO2产生,在酸性条件下,MnO将H2C2O4氧化为CO2,MnO被还原为[Mn(C2O4)2]-,根据电子守恒、电荷守恒、原子守恒,结合物质的拆分原则可知该反应的离子方程式为MnO+ 4H2C2O4→[Mn(C2O4)2]-+4CO2↑+4H2O;
(6)在实验②在第ii阶段反应速率较大,猜测可能是c(Mn3+)较大引起的,实验②中c(H2C2O4)低,电离产生的c()少,结合的Mn3+较少,使c(Mn3+)较大,反应速率较快;
(7)根据图象可知:当草酸浓度较小,溶液酸性较弱,溶液紫色褪色时间较长,说明此时的反应速率较慢,故若在第ii阶段将c(H+ )调节至0.2 mol·L-1,溶液酸性增强,反应速率加快,导致褪至无色的时间会减少。
20.(1) 乙 小明 小明所取盐酸的浓度较大因此反应速率较快,所需时间较短 = 小红和小明所取的稀盐酸体积都剩余,反应速率由锌和盐酸的浓度决定,两者相同,则反应速率相等,反应时间相等
(2) 不变 恒温恒容下,各物质的浓度不变,反应速率不变 变小 不变 变小
解析:锌和稀盐酸反应生成氢气会造成反应容器的压强变大,装置乙中橡皮管可平衡压强,使盐酸顺利流下;在恒容恒温下,加入不反应物质,由于容器体积不变,反应物浓度不变,则反应速率不变,在恒温恒压下,加入稀有气体,由于要保证压强不变,则充入的气体会使容器体积增大,导致反应物浓度减小,则反应速率变小;
(1)①锌和稀盐酸反应生成氢气会造成反应容器的压强变大,装置乙中橡皮管可平衡压强,使盐酸顺利流下,应选择乙装置较合理;反应物浓度越大反应速率越快,小明同学所取盐酸的浓度较大因此反应速率较快,得到相同体积的所用时间较短;故答案为:乙;小明;小明所取盐酸的浓度较大因此反应速率较快,所需时间较短;
②6.5g锌的物质的量为,由反应方程式Zn+2HCl=ZnCl2+H2↑,可知消耗0.2molHCl,至少需要,则小红和小明所取的稀盐酸体积都剩余,反应速率由锌和盐酸的浓度决定,两者相同,则反应速率相等,反应时间相等,则t1= t2,故答案为:=;小红和小明所取的稀盐酸体积都剩余,反应速率由锌和盐酸的浓度决定,两者相同,则反应速率相等,反应时间相等;
(2)①10分钟时,测得生成,反应速率为,由化学反应速率之比等于系数比,反应方程式为,则用表示的反应速率为;
②恒温恒容下,再充入1mol He,压强增大,但各物质的浓度不变,则反应速率不变,故答案为:恒温恒容下,各物质的浓度不变,反应速率不变;
③恒温恒压下,再充入1mol He,容器体积增大,各物质的浓度减小,反应速率将减小,故答案为:变小;
④如果从体系中分离出,反应物浓度不变,正反应速率将不变,生成物浓度减小,逆反应速率将变小,故答案为:不变;变小
一、选择题
1.下列各组反应中(表中物质均为反应物,且金属的物质的量均为0.1mol),反应开始时放出的速率最快的是
选项 金属(粉末状) 酸 体积/mL 浓度/(mol/L) 反应温度/℃
A 稀盐酸 10 6 40
B 稀硝酸 10 6 40
C 稀盐酸 20 3 30
D 稀硫酸 10 3 30
A.A B.B C.C D.D
2.盐酸与块状CaCO3反应时,不能使反应最初的速率明显加快的是
A.将盐酸的用量增加一倍 B.盐酸的浓度增加一倍,用量减半
C.温度升高30 ℃ D.将块状CaCO3粉碎后再与盐酸反应
3.,在V2O5存在时,该反应的机理为(快)、(慢)。下列说法正确的是
A.反应速率主要取决于V2O5的质量
B.V2O5是反应的中间产物
C.逆反应的活化能大于198
D.升高温度,正反应速率减慢,逆反应速率加快
4.下列情况下,反应速率相同的是
A.等体积0.1mol/L HCl和0.1mol/L H2SO4分别与0.2mol/L NaOH溶液反应
B.等质量锌粒和锌粉分别与等量1mol/L HCl反应
C.等体积等浓度HCl和HNO3分别与等质量的Na2CO3粉末反应
D.等体积0.2mol/L HCl和0.2mol/L H2SO4与等量等表面积等品质石灰石反应
5.H2O2是常见的氧化剂,一定条件下可发生分解反应。在含有少量I-的溶液中,H2O2分解时能量变化与反应过程如下图所示。过程I的反应为H2O2+I =H2O+IO 。下列说法正确的是
A.过程Ⅱ的反应为H2O2+IO =H2O+I +O2↑
B.决定反应快慢的是过程Ⅱ的反应
C.H2O2分解反应为吸热反应
D.2H2O2(aq)=2H2O(l)+O2(g)反应的ΔH=(a c b)kJ·mol 1
6.亚硝酰氯(NOCl)在有机合成中有重要应用。2NO(g)+Cl2(g)→2NOCl(g)的反应历程如图。下列说法错误的是
A.相对于曲线Ⅱ,曲线Ⅰ表示加入催化剂
B.催化剂能提高反应物的相对能量
C.反应物总能量高于生成物的总能量
D.2NO(g)+Cl2(g)→2NOCl(g)+77.1kJ
7.十氢化萘(C10H18)是具有高储氢密度的氢能载体,经历“”的脱氢过程释放氢气。
反应Ⅰ:
反应Ⅱ:
在一定温度下,其反应过程对应的能量变化如图。
下列说法正确的是
A.升高温度,可降低、,加快化学反应速率
B.反应Ⅰ的活化分子百分数高于反应Ⅱ
C.
D.的脱氢过程中,不会有大量积聚
8.对于可逆反应2SO2+O2 2SO3(正反应为放热反应),决定反应速率的主要因素是
A.温度 B.压强 C.SO2和O2的性质 D.催化剂
9.反应的能量与反应历程的关系如下图所示。下列说法错误的是
A.第1步决定整个反应的快慢
B.第2步为放热过程
C.该反应的焓变大小取决于第1、2、3步正、逆反应的活化能大小
D.该反应适宜在碱性条件下进行
10.SiHCl3在催化剂作用下主要发生反应:2SiHCl3(g)SiH2Cl2(g)+SiCl4(g) ΔH=+48kJ mol-1。已知:反应速率v=v正-v逆=k正x2SiHCl3-k逆xSiH2Cl2xSiCl4,k正、k逆分别为正、逆向反应速率常数,x为物质的量分数,在323K和343K时SiHCl3的转化率随时间变化的结果如图所示。
下列说法正确的是
A.343K时反应物的平衡转化率为21%
B.a点的反应速率小于b点的反应速率
C.343K时=
D.由323K的平衡转化率数据,不能计算323K的平衡常数K
11.CO2的综合利用是实现“双碳”的重要手段。利用钉(Ru)基催化剂将CO2转化为有机原料甲酸的反应机理如图所示。下列说法不正确的是
A.若反应II为总反应决速步骤,则反应II的活化能最低
B.HO-Ru-OH是该反应的催化剂
C.该反应的总方程式为
D.反应III中既存在极性键的断裂,又存在极性键的生成
12.科学家研究发现在一种特殊催化剂作用下,水可促进、高选择性的直接合成,其中部分反应机理如图所示。以下说法错误的是
A.在氧化合成甲醇过程中的作用是提供与结合形成
B.
C.在催化剂表面,比更容易被吸附
D.该过程的决速步反应方程式为:
13.某温度下,体积可变的密闭容器中进行如下反应:,下列叙述正确的是
A.在容器中加入氩气,反应物反应速率减小
B.加入少量W,逆反应速率大
C.升高温度,正反应速率增大,逆反应速率减小
D.将容器的体积压缩,可增大活化分子的百分数,单位时间内有效碰撞次数增大
14.在发展非金属催化剂实现CO2电催化还原制备甲醇方向取得重要进展,该反应历程如图所示(CO、CH2O为副产物).
上述合成甲醇的反应速率较慢,要加快其反应速率,主要需降低过程中能量变化的基元反应为
A. B.
C. D.
15.下列有关实验能够达到相应实验目的的是
A.图甲中补充环形玻璃搅拌棒即可用于中和热的测定
B.图乙可用于测定H2O2溶液的分解速率
C.图丙的实验设计可以探究浓度对化学反应速率的影响
D.图丁可蒸干CuCl2饱和溶液制备无水CuCl2
二、填空题
16.根据有关要求回答问题:
(1)如图是1mol NO2(g)和1mol CO(g)反应生成CO2和NO过程中能量变化示意图,若在反应体系中加入催化剂,反应速率增大,E1的变化是___,△H的变化是___(填“增大”、“减小”、“不变”)。请写出NO2和CO反应的热化学方程式:___。
(2)以太阳能为热源,热化学硫碘循环分解水是一种高效、无污染的制氢方法。其反应过程如图所示。反应Ⅱ包含两步反应:
第一步:H2SO4(l)=SO3(g)+H2O(g) △H1=+177kJ/mol
第二步:2SO3(g)=2SO2(g)+O2(g) △H2=+196kJ/mol
①写出第一步反应自发进行的条件是:___。
②写出反应Ⅱ的热化学方程式:___。
17.在一固定容积的密闭容器中,进行如下反应:CsH2Og COgH2g。
(1)若容积体积为2L,反应10s氢气质量增加0.4g,则该时间内一氧化碳的反应速率为______。若增加炭的量,则正反应速率______(选填“增大”、“减小”、“不变”)。若增大压强,化学平衡向______移动。(选填“正向”、“逆向”或“不”)
(2)该反应达到平衡状态的标志是______(选填编号)
A.压强不变
B.v 正(H2)=v 正(H2O)
C. c(CO)不变
D.cH2OcCO
(3)若降低温度,平衡逆向移动,则正反应是______反应(选填“吸热”或“放热”)
18.在一个容积为3 L的密闭容器内进行如下反应:A2(气)+3B2(气)=aX(气)。反应开始时,n(A2)=1.5 mol,n(B2)=4.0 mol,2 min后,n(B2)=0.4 mol, n(X)=2.4 mol。计算:
(1)a值______________。
(2)X的表示式(用A、B表示)________________。
(3)υ(B2)为_____________。
(4)2 min末的A2的浓度_______________。
19.探究影响KMnO4与草酸(H2C2O4,二元弱酸)反应速率的因素。完成下列填空:
I.配制1.000×10-3 mol·L-1 KMnO4溶液、0.40 mol·L-1草酸溶液。
(1)用5.200×10-3 mol·L-1 KMnO4溶液配制100 mL 1.000×10-3 mol·L-1 KMnO4溶液需要的仪器有:_______。
II.将KMnO4溶液与草酸溶液按如下比例混合。
序号 V(KMnO4) / mL V(草酸) /mL V(H2O) /mL 反应温度
① 2.0 2.0 0 20°C
② 2.0 1.0 1.0 20°C
(2)实验①和②的目的是 _______。
(3)上述实验应控制pH相同,则应加入的试剂是_______(选填选项)。
A.盐酸 B.硫酸 C.草酸
III.将溶液调至pH=1进行实验①和②,发现紫色并未直接褪去,而是分成两个阶段:
i.紫色溶液变为青色溶液;
ii.青色溶液逐渐褪至无色溶液。
资料:(a)Mn2+在溶液中无色;
(b)Mn3+无色,有强氧化性,发生反应Mn3++2[Mn(C2O4)2]-(青绿色)后氧化性减弱;
(c)MnO呈绿色,在酸性条件下不稳定,迅速分解产生和MnO2。
(4)推测阶段i中可能产生了MnO。该观点是否合理,并说明理由:_______。
IV.为证明溶液中含有[Mn(C2O4)2]-,测得反应过程中和[Mn(C2O4)2]-浓度随时间的变化如下图:
(5)第i阶段中检测到有CO2产生,反应的离子方程式为_______。
(6)实验②在第ii阶段反应速率较大,猜测是c(Mn3+)较大引起的,请解释实验②中c(Mn3+)较大的原因_______。
(7)据此推测,若在第ii阶段将c(H+)调节至0.2 mol·L-1,溶液褪至无色的时间会_______(填“增加”“减少” 或“不变”)。
20.对化学反应速率的研究是一个重要课题,对工农业生产有重要意义。根据你所学知识回答下列问题:
(1)用图中装置测定产生相同体积的所用时间长短,给出了甲、乙两套装置。
①小红用的盐酸5mL,小明用的盐酸5mL,他们用的是相同质量,且规格相同的锌粒。你认为应选择_______装置较合理,两同学得到相同体积的所用时间较短的是_______同学,原因是_______。
②小红和小明对该实验进行了新的探究,他们均用6.5g锌,的盐酸,不同的是小红用了200mL盐酸,而小明用了400mL盐酸,当锌粒全部消失时,小红用了t1分钟,小明用了t2分钟,则t1_______ t2 (填“>”、“<”或“=”),理由是_______。
(2)合成氨反应,开始把和充入一2L的密闭容器中,加入一定量的铁触媒,控制500℃和300atm,使之发生反应。10分钟时,测得生成,请回答下列问题:
①用表示的反应速率为_______。
②如果保持容器容积2L不变,控制500℃,再充入1mol He,压强增大,则反应速率_______,理由是_______。
③如果控制500℃和300atm,再充入1mol He,反应速率将_______。(填“变大”、“变小”或“不变”,下同)
④如果从体系中分离出,正反应速率将_______,逆反应速率将_______。
【参考答案】
一、选择题
1.A
解析:硝酸与金属反应不能生成氢气,排除B;金属越活泼与酸反应速率越快,活泼性:Mg>Zn,排除C;A与D相比,溶液中相同,A对应的温度高于D,温度越高反应速率越大,故A放出氢气的速率最快。
故选:A。
2.A
解析:A.盐酸的用量增加,但是浓度不变,化学反应速率不变,A错误;
B.盐酸浓度增大,尽管用量减半了,化学反应速率就会加快,化学反应速率只与浓度有关,跟用量无关,B正确;
C.升高温度,化学反应速率加快,C正确;
D.粉碎后,接触面积增大 ,化学反应速率加快,D正确;
故选A。
3.C
解析:A.由反应机理可得,V2O5是该反应的催化剂,反应速率与催化剂V2O5的质量有一定关系,但主要取决于催化剂V2O5的表面积,A错误;
B.由反应机理可得,V2O5是该反应的催化剂,B错误;
C.正反应的活化能—逆反应的活化能,所以逆反应的活化能大于,C正确;
D.升高温度,正、逆反应速率均增大,D错误;
故选C。
4.C
解析:A.等体积0.1mol/L和0.1mol/L 中不同,与0.2mol/L NaOH溶液反应速率不同,A错误;
B.锌粒和锌粉接触面积不同,与等量盐酸反应速率不同,B错误;
C.等体积等浓度和 中相同,与等质量的Na2CO3粉末反应速率相同,C正确;
D.与石灰石反应,生成是微溶物,覆盖在碳酸钙表面,反应速率比盐酸中的反应慢,D错误;
故选C。
5.A
解析:A.H2O2分解时总反应为2H2O2=2H2O+O2↑,减去过程Ⅰ反应得过程Ⅱ的反应为H2O2+IO =H2O+I +O2↑,A正确;
B.慢反应决定整体反应速率,据图过程Ⅰ活化能更大,则过程Ⅰ为慢反应,决定整体反应速率,B错误;
C.据图可知整个过程中,反应物能量高于生成物,为放热反应,C错误;
D.焓变为生成物能量-反应物能量,所以该反应的ΔH= bkJ·mol 1,D错误;
综上所述答案为A。
6.B
解析:A.相对于曲线Ⅱ,曲线Ⅰ是降低反应所需活化能,则曲线Ⅰ表示加入催化剂,故A正确;
B.催化剂能降低“过渡态”物质的相对能量,降低反应活化能,故B错误;
C.该反应是放热反应,因此反应物总能量高于生成物的总能量,故C正确;
D.该反应是放热反应,放出77.1kJ 的热量,则反应热化学方程式为2NO(g) +Cl2(g)→2NOCl(g)+77.1kJ,故D正确。
综上所述,答案为B。
7.D
解析:A.升高温度,不能改变反应的活化能,即不可降低、,而是通过增大分子的能量使普通分子变为活化分子,增大活化分子百分含量,从而加快化学反应速率,A错误;
B.由图可知,Ea1>Ea2,则说明反应Ⅱ比反应Ⅰ速率快,活化分子百分率越大,反应速率越快,则反应Ⅰ的活化分子百分率低于反应Ⅱ,B错误;
C.总反应的△H等于生成物的总能量减去反应物的总能量,Ea1为C10H18
C10H12的活化能,Ea2为C10H12C10H8的活化能,根据能量变化图,总反应即的△H≠Ea1-Ea2,C错误;
D.由图可知,Ea1>Ea2,则说明反应Ⅱ比反应Ⅰ速率快,即消耗C10H12速率大于生成C10H12,所以C10H18脱氢过程中,不会有大量中间产物C10H12,D正确;
故答案为:D。
8.C
解析:对于一个化学反应来说,化学反应进行的快慢程度由内因决定,即由参加反应的物质本身的性质决定。对于可逆反应2SO2+O2 2SO3(正反应为放热反应),决定反应速率的主要因素是SO2和O2的性质,故合理选项是C。
9.C
解析:A.第1步反应的活化能大,反应速率慢,整个反应由第1步决定,故第1步为决速步骤,选项A正确;
B.由图可知,第2步反应物的总能量高于生成物的总能量,反应为放热过程,选项B正确;
C.焓变等于生成物总能量与反应物总能量之差,即焓变由反应物和生成物总能量决定,不由活化能决定,选项C错误;
D.强碱性条件下反应正向移动,故该反应适宜在强碱性条件下进行,选项D正确;
答案选C。
10.C
解析:A.该可逆反应为气体分子数不变且吸热的反应。则对于该可逆反应来说,温度升高,反应向正反应方向进行。根据题中t-SiHCl3%图,可知曲线a为343K时SiHCl3的转化率-时间曲线,曲线b为323K时SiHCl3的转化率-时间曲线。由分析可知,曲线a为343K时的变化曲线,由图可知,343K时反应物的平衡转化率为22%,A项错误;
B.由图可知,a、b两点的转化率相等,可认为各物质的浓度对应相等,而a点的温度更高,所以速率更快,即a点的反应速率大于b点的反应速率,B项错误;
C.由图可知,343K时SiHCl3的转化率为22%,设起始时SiHCl3的浓度为1mol/L,则根据反应方程式有:
平衡时v正=v逆,则k正x2SiHCl3=k逆xSiH2Cl2xSiCl4,则==,C项正确;
D.由图可知,323K时SiHCl3的转化率为21%,设起始时SiHCl3的浓度为1mol/L,由反应方程式可知:
该可逆反应的平衡常数K==0.0136,故由323K的平衡转化率数据,可以计算323K的平衡常数K,D项错误。
11.A
解析:A.若反应II为决速步骤,则反应II的活化能最高,A项说法错误;
B.由流程可知,HO-Ru-OH是该反应的催化剂,B项说法正确;
C.由图可知该反应的总方程式为,C项说法正确;
D.反应过程中存在极性键H-O的断裂和生成,D项说法正确;
故选A。
12.B
解析:A.从该部分反应机理可看出,水在催化剂表面离解出直接与结合形成,故A正确;
B.图中未说明未吸附在催化剂上的CH4的能量,无法计算的反应热,故B错误;
C.从相对能量看,水吸附在催化剂表面的能量更低,更加稳定,则在催化剂表面,比更容易被吸附,故C正确;
D.由图可知,的活化能最大,反应速率最慢,为该过程的决速步反应,故D正确;
故选B。
13.A
解析:A.在容器中加入氩气,压强增大,但参与反应的物质的浓度不变,所以反应速率不变,A项正确;
B.W是固体,所以加入少量W,正、逆反应速率均不变,B项不正确;
C.升高温度,正、逆反应速率均增大,C项不正确;
D.将容器的体积压缩,可增大单位体积内活化分子数有效碰撞次数增多,反应速率加快,但活化分子的百分数不变,D项不正确;
故答案选A。
14.A
解析:根据图可知合成甲醇的过程中的活化能最大,反应速率最慢,决定整体反应速率,所以主要降低该步骤的能量变化,A符合题意,故答案为:A。
15.C
解析:A.图甲中补充环形玻璃搅拌棒,大小烧杯的上沿齐平,中间填充满碎纸屑即可用于中和热的测定,A与题意不符;
B.图乙中长颈漏斗应换为分液漏斗后,可用于测定溶液的分解速率,B与题意不符;
C.图丙的实验设计,只有草酸的浓度不同,其它条件相同,可以探究浓度对化学反应速率的影响,C符合题意;
D.图丁可蒸干饱和溶液制备无水,需要在气流中蒸干,D与题意不符。
故选C。
二、填空题
16.(1) 减小 不变 NO2(g)+CO(g)=NO(g)+CO2(g) △H=-234kJ mol-1
(2) 高温(或较高温度) 2H2SO4(l)=2SO2(g)+O2(g)+2H2O(g) △H=+550kJ mol-1
解析:(1)加入催化剂,可以降低反应的活化能,加快反应速率,但不影响△H,故E1减小,△H不变;NO2和CO反应生成NO和CO2,由图可知,生成物的总能量小于反应物的总能量,该反应为放热反应,反应的△H=-(368-134)kJ mol-1=-234kJ mol-1,则该反应的热化学方程式为NO2(g)+CO(g)=NO(g)+CO2(g) △H=-234kJ mol-1;
(2)①第一步反应的△H>0,△S>0,根据△H-T△S<0可知,该反应在高温(或较高温度)下可以自发进行;
②由图可知,反应Ⅱ中,H2SO4转化为SO2和O2,对反应进行标号,①H2SO4(l)=SO3(g)+H2O(g) △H1=+177kJ/mol,②2SO3(g)=2SO2(g)+O2(g) △H2=+196kJ/mol,①+②得到2H2SO4(l)=2SO2(g)+O2(g)+2H2O(g),根据盖斯定律,△H=[(+177)+(+196)]kJ/mol=+550kJ/mol,则反应Ⅱ的热化学方程式为2H2SO4(l)=2SO2(g)+O2(g)+2H2O(g) △H=+550kJ/mol。
17.01 不变 逆反应 AC 吸热
【分析】(1)结合v= c/ t及速率之比等于化学计量数之比计算;根据外界条件对反应速率和平衡状态的影响变化规律解答;
(2)结合平衡的特征“等、定”及衍生的物理量判定平衡状态;
(3)升高温度,平衡向吸热的方向移动。
解析:(1)若容器体积为2L,反应l0s氢气质量增加0.4g,物质的量是0.2mol,浓度是0.1mol/L,则v(H2)=0.1mol/L÷10s=0.01mol/(L·s),由速率之比等于化学计量数之比可知,该时间内一氧化碳的反应速率为0.01mol/(L·s);若增加炭的量,则正反应速率不变;该反应为气体体积增大的反应,若增大压强,化学平衡向逆向移动,故答案为0.01;不变;逆向;
(2)A.该反应为气体体积增大的反应,则压强不变,可知达到平衡状态,故A选;
B.v正(H2)=V正(H2O),均为正反应速率,不能判断正逆反应速率关系,不能判定平衡,故B不选;
C.c(CO)不变,符合平衡特征“定”,达到平衡状态,故C选;
D.c(H2O)=c(CO)不能判定平衡状态,与起始量、转化率有关,故D不选;
故答案为AC;
(3)降低温度,平衡向放热的方向移动,则若降低温度,平衡向逆向移动,则正反应是吸热反应,故答案为吸热。
18.(1)2
(2)AB3
(3)0.6 mol·L-1·min-1
(4)0.1 mol。L-1
解析:(1)反应开始时,n(A2)=1.5 mol,n(B2)=4.0 mol,2 min后,n(B2)=0.4 mol,n(X)=2.4 mol,则2 min内B2改变的物质的量△n(B2)=4.0 mol-0.4 mol=3.6 mol,△n(B2):△n(X)=3.6 mol:2.4 mol=3:a,解得a=2;
(2)根据上述计算可知a=2,该反应的化学方程式为:A2(气)+3B2(气)=2X(气),根据反应前后原子守恒可知:X表达式为AB3;
(3)2 min内用B2浓度变化表示的化学反应速率;
(4)根据物质反应转化关系可知:物质在相同时间内转化的物质的量的比等于化学方程式中相应物质的化学计量数的比,则△n(A2):△n(B2)=1:3,所以△n(A2)=△n(B2)=×3.6 mol=1.2 mol,在反应开始时A2的物质的量n(A2)=1.5 mol,则2 min末A2的物质的量n(A2)=1.5 mol-1.2 mol=0.3 mol,故此时A2浓度为c(A)=。
19.(1)量筒、烧杯、玻璃棒、100 mL容量瓶、胶头滴管
(2)探究草酸浓度对反应速率的影响
(3)B
(4)不合理,酸性条件下MnO不稳定,未观察到溶液中产生黑色(MnO2)沉淀
(5)MnO+ 4H2C2O4→[Mn(C2O4)2]-+4CO2↑+4H2O
(6)实验②中c(H2C2O4)低,电离产生的c()少,结合的Mn3+较少使c(Mn3+)较大,反应速率较快
(7)减少
解析:(1)用5.200×10-3 mol·L-1 KMnO4溶液配制100 mL 1.000×10-3 mol·L-1 KMnO4溶液需要的仪器有量筒、烧杯、玻璃棒、100 mL容量瓶、胶头滴管;
(2)将酸性KMnO4溶液与草酸溶液混合,其它条件都相同,只有草酸溶液浓度不同,可利用反应过程中溶液紫色消失快慢的方法探究浓度对化学反应速率的影响。故实验①和②的目的是探究浓度对化学反应速率的影响;
(3)上述实验应控制pH相同,使用的酸不能具有氧化性或还原性。在选项给出的酸中,盐酸、草酸都具有还原性,会反应消耗KMnO4,不能使用,否则会带来实验误差,而应该选择使用不具有还原性的H2SO4,用来调整溶液的酸碱性,故合理选项是B;
(4)推测阶段i中可能产生了MnO,该观点不合理,这是由于酸性条件下MnO不稳定,会迅速发生歧化反应产生和MnO2,但在实验过程中未观察到溶液中产生黑色(MnO2)沉淀,因此反应过程中未产生MnO;
(5)第i阶段中检测到有CO2产生,在酸性条件下,MnO将H2C2O4氧化为CO2,MnO被还原为[Mn(C2O4)2]-,根据电子守恒、电荷守恒、原子守恒,结合物质的拆分原则可知该反应的离子方程式为MnO+ 4H2C2O4→[Mn(C2O4)2]-+4CO2↑+4H2O;
(6)在实验②在第ii阶段反应速率较大,猜测可能是c(Mn3+)较大引起的,实验②中c(H2C2O4)低,电离产生的c()少,结合的Mn3+较少,使c(Mn3+)较大,反应速率较快;
(7)根据图象可知:当草酸浓度较小,溶液酸性较弱,溶液紫色褪色时间较长,说明此时的反应速率较慢,故若在第ii阶段将c(H+ )调节至0.2 mol·L-1,溶液酸性增强,反应速率加快,导致褪至无色的时间会减少。
20.(1) 乙 小明 小明所取盐酸的浓度较大因此反应速率较快,所需时间较短 = 小红和小明所取的稀盐酸体积都剩余,反应速率由锌和盐酸的浓度决定,两者相同,则反应速率相等,反应时间相等
(2) 不变 恒温恒容下,各物质的浓度不变,反应速率不变 变小 不变 变小
解析:锌和稀盐酸反应生成氢气会造成反应容器的压强变大,装置乙中橡皮管可平衡压强,使盐酸顺利流下;在恒容恒温下,加入不反应物质,由于容器体积不变,反应物浓度不变,则反应速率不变,在恒温恒压下,加入稀有气体,由于要保证压强不变,则充入的气体会使容器体积增大,导致反应物浓度减小,则反应速率变小;
(1)①锌和稀盐酸反应生成氢气会造成反应容器的压强变大,装置乙中橡皮管可平衡压强,使盐酸顺利流下,应选择乙装置较合理;反应物浓度越大反应速率越快,小明同学所取盐酸的浓度较大因此反应速率较快,得到相同体积的所用时间较短;故答案为:乙;小明;小明所取盐酸的浓度较大因此反应速率较快,所需时间较短;
②6.5g锌的物质的量为,由反应方程式Zn+2HCl=ZnCl2+H2↑,可知消耗0.2molHCl,至少需要,则小红和小明所取的稀盐酸体积都剩余,反应速率由锌和盐酸的浓度决定,两者相同,则反应速率相等,反应时间相等,则t1= t2,故答案为:=;小红和小明所取的稀盐酸体积都剩余,反应速率由锌和盐酸的浓度决定,两者相同,则反应速率相等,反应时间相等;
(2)①10分钟时,测得生成,反应速率为,由化学反应速率之比等于系数比,反应方程式为,则用表示的反应速率为;
②恒温恒容下,再充入1mol He,压强增大,但各物质的浓度不变,则反应速率不变,故答案为:恒温恒容下,各物质的浓度不变,反应速率不变;
③恒温恒压下,再充入1mol He,容器体积增大,各物质的浓度减小,反应速率将减小,故答案为:变小;
④如果从体系中分离出,反应物浓度不变,正反应速率将不变,生成物浓度减小,逆反应速率将变小,故答案为:不变;变小
