化学人教版(2019)必修第一册1.2.1电解质的电离(共25张ppt)
文档属性
| 名称 | 化学人教版(2019)必修第一册1.2.1电解质的电离(共25张ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 43.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-16 17:37:14 | ||
图片预览






文档简介
(共25张PPT)
第二节 离子反应
第1课时:电解质的电离
第一章 物质及其变化
电解质和非电解质
01
电离及电离方程式
02
学习目标
1.通过探究几组物质的导电性实验形成电离的概念,能从宏微结合的角度进一步对物质进行分类,以探究的方式建构电离模型。
2.通过合作探究对溶液导电性的分析,知道电解质、非电解质的概念,认识常见的电解质,能从微观的角度(电离)认识酸、碱和盐,并能用电离方程式表示酸、碱、盐的电离过程。
3.通过化学实验认识电解质的电离及电离条件,建立电离方程式的认知模型,激发学习化学的兴趣,培养严谨求实、勇于探索的科学精神。
情境探究
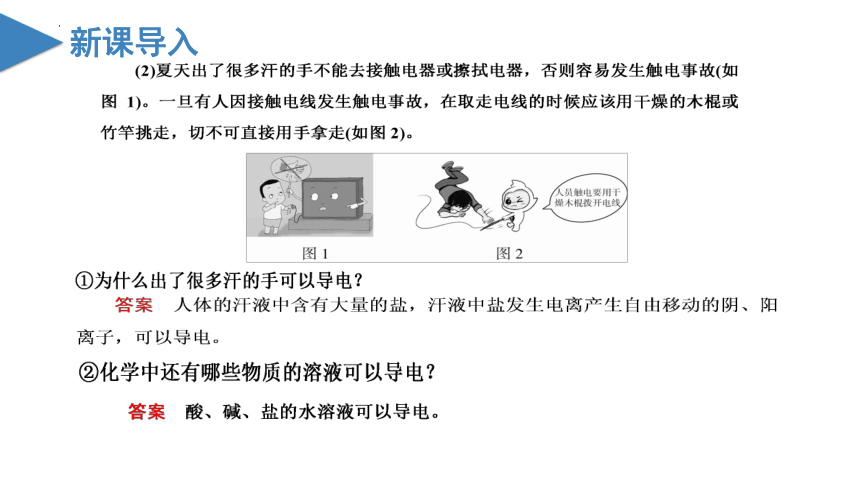
(1)Fe、Cu能导电,故Fe、Cu为电解质,这种说法对吗?为什么?
电解质和非电解质
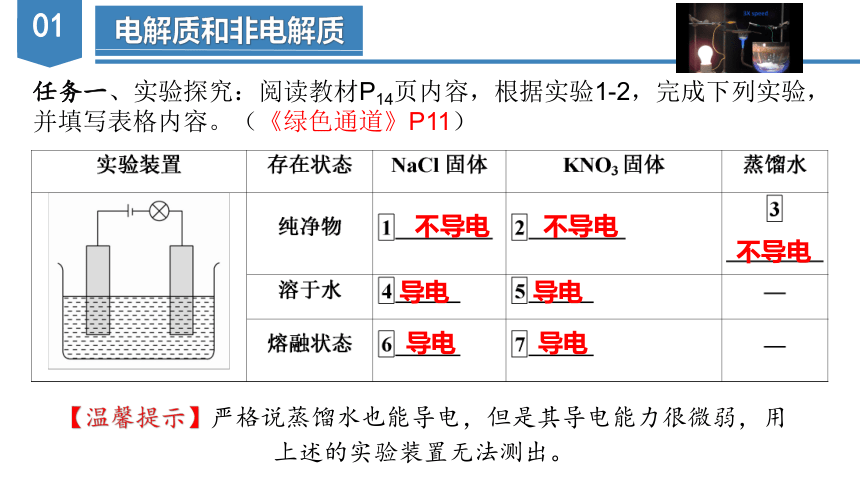
任务一、实验探究:阅读教材P14页内容,根据实验1-2,完成下列实验,并填写表格内容。(《绿色通道》P11)
【温馨提示】严格说蒸馏水也能导电,但是其导电能力很微弱,用上述的实验装置无法测出。
不导电
不导电
不导电
导电
导电
导电
导电
自由移动
带电荷
Na+
Cl-
自由移动
Na+
Cl-
水合钠离子
水合氯离子
负
正
Na+
Cl-
电离及电离方程式
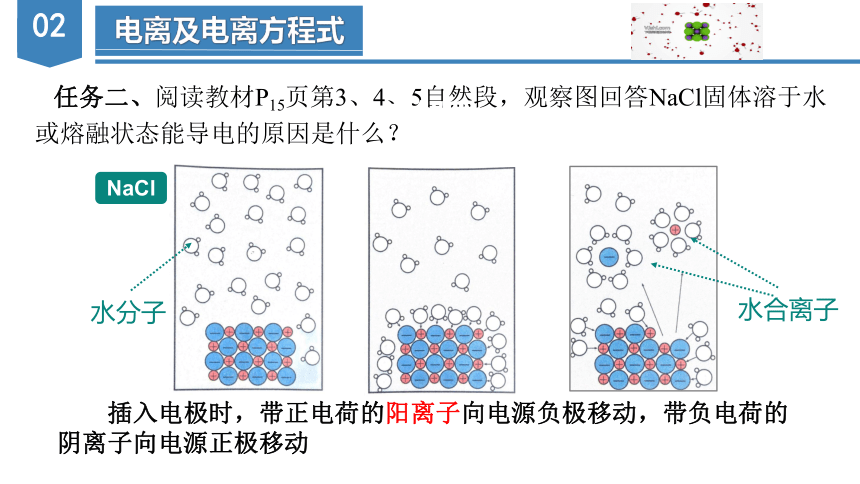
任务二、阅读教材P15页第3、4、5自然段,观察图回答NaCl固体溶于水或熔融状态能导电的原因是什么?
水分子
电解质
NaCl
插入电极时,带正电荷的阳离子向电源负极移动,带负电荷的阴离子向电源正极移动
水合离子
电离及电离方程式
氯化钠熔化过程
【结果】NaCl固体熔化时,产生了自由移动的钠离子和氯离子。
【结论】因此,NaCl固体溶于水或熔融状态能导电的原因是因为在水溶液或熔融状态下均能产生了自由移动的钠离子和氯离子。
电离及电离方程式
【问题探究】为什么蔗糖溶液、酒精不导电?
【结论】蔗糖、酒精本身或溶于水均以分子形式存在,无自由移动的离子。
电解质和非电解质
任务三、讨论交流:根据物质的导电性规律,思考如何对化合物进行再
分类?电解质和非电解质的概念是什么?
化合物的分类
按在一定条件(溶于水或熔融状态)是否导电分
能导电
不能导电
电解质:在水溶液里或在熔融状态下能够导电的化合物。
非电解质:在水溶液里或在熔融状态下不能够导电的化合物。
单质
非电解质
物质
混合物
纯净物
化合物
电解质
弱电解质
强电解质
强酸:如HCl、H2SO4、HNO3
金属氧化物:如MgO、Na2O、Al2O3
大部分盐:如:NaCl、K2SO4、AgNO3、CaCO3、AgCl
强碱:如KOH、NaOH、Ba(OH)2 、Ca(OH)2
电
解
质
强 电 解 质
(全部电离)
弱 电 解 质
(部分电离)
弱酸:如H2CO3、H2S、H2SO3、CH3COOH
弱碱:如NH3 H2O、Cu(OH)2、Mg(OH)2
水:H2O
少数盐:如(CH3COO)2Pb(醋酸铅)
判断:下列哪些物质是电解质,哪些是非电解质?
H2SO4 、稀硫酸、 NaOH、乙醇、CO2 、NH3 、SO2、NH3.H2O、CuO、FeSO4、蔗糖、盐酸、Cu、AgCl、Al、HCl(气体)、KNO3溶液、BaSO4、Na2O
H2SO4 、 NaOH、 NH3.H2O、CuO、FeSO4 、AgCl、 HCl(气体)、BaSO4、Na2O
电解质:
非电解质:
乙醇、CO2 、NH3、 SO2 、蔗糖
NH3、SO2
溶于水(与水反应)
NH3+H2O=NH3.H2O→NH4++OH-
SO2+H2O=H2SO3→ 2H++SO32-
HCl、NaCl
盐酸溶液 → H++Cl-
氯化钠溶液→ Na++Cl-
BaSO4、AgCl
难溶于水
溶于水的BaSO4→(少)Ba2++SO42-
溶于水的AgCl→ (少)Ag++Cl-
自由移动的阴、阳离子
溶于水
概念辨析
1.铁能导电,所以金属是电解质
2.NaCl溶液能导电,NaCl溶液是电解质
3.CO2溶于水能导电,所以CO2是电解质
4.CaCO3难溶于水,所以它是非电解质
5.电解质未必能导电
X
X
1. 电解质和非电解质都是针对化合物而言; 单质和混合物既不是电解质也不是非电解质。
X
2.是电解质先要是纯净的化合物
X
3.电解质要本身能电离
√
如NaCl
√
√
√
×
任务四、根据上面电解质导电的微观探析,思考电解质导电与离子有何关系,什么是电解质的电离?
电解质溶液导电能力与哪些因素有关?
与离子的浓度、离子所带电荷多少有关
电离及电离方程式
认识酸、碱、盐电解质的电离,观察下列各物质的电离方程式,有何规律?
物质 电离方程式 本质
酸 HCl = H+ + Cl-、 H2SO4 = 2H+ + SO42- CH3COOH H+ +CH3COO-
碱 NaOH = Na+ + OH- Ca(OH)2=Ca2++ 2OH- NH3 H2O NH4++OH-
盐 NaCl = Na+ + Cl- (NH4)2S = 2NH4+ + S2-
酸=氢离子(H+)+酸根离子
所有阳离子都是H+
注意:H+半径很小,也可写成H3O+
碱=氢氧根离子(OH-)+金属阳离子或铵根离子
所有阴离子都是OH-
盐=金属阳离子或铵根离子+酸根离子
a.左边写电解质的化学式,右边写阴、阳离子;
b.强酸、强碱、盐(大部分)用“=”号,弱酸、弱碱用“ ”号;
c.原子团不能拆开 ,如 SO42-、NO3-、CO32-、NH4+ 、OH-
d.要遵循质量守恒和电荷守恒(电离方程式右侧的正负电荷数相等,溶液呈电中性)。
小结:书写电离方程式要注意哪些方面?
电离及电离方程式
任务五、讨论交流:联系酸、碱、盐的本质,写出HNO3、
H3PO4、Ba(OH)2、NH3 H2O、Na2SO4、Fe2(SO4)3、(NH4)2SO4的电离
方程式。
【答案】HNO3==H++NO3-、
H3PO4 H++H2PO4-、H2PO4- H++HPO42-、
HPO42- H++PO43-(注意:分步写,用“ ”号)
Ba(OH)2== Ba2++2OH-、NH3 H2O NH4++OH-、
Na2SO4==2Na++SO42-、Fe2(SO4)3== 2Fe3++3SO42- 、
(NH4)2SO4==2NH4+ + SO42-
HS-??H++S2-
H2SO4===2H++SO 2-
4
NaOH===Na++OH-
(NH4)2SO4===2NH++SO2-
4
4
H2S??H++HS-
==
NaHSO4===Na++H++SO2-
4
《绿色通道》P13
单质
非电解质
物质
混合物
纯净物
化合物
电解质
弱电解质
强电解质
强酸:如HCl、H2SO4、HNO3
大部分盐:如:NaCl、AgNO3
强碱:如KOH、NaOH、Ba(OH)2 、Ca(OH)2
电
解
质
强 电 解 质
(全部电离)
弱 电 解 质
(部分电离)
弱酸:如H2CO3、H2S、H2SO3、CH3COOH
弱碱:如NH3 H2O、Cu(OH)2、Mg(OH)2
水:H2O
少数盐:如(CH3COO)2Pb(醋酸铅)
碱
盐
化合物
电
解
质
非电
解质
活泼金属氧化物
H2O
大多数非金属氧化物
大部分有机物
NH3
(Na2O,Al2O3等)
(微弱导电)
溶于水能导电
溶于水或熔融时能导电
蔗糖、CH4、酒精等
导电
不导电
酸
按导电
性分
电离方程式
定义
书写
对应训练
【例1】下列在水溶液中的电离方程式,错误的是 ( )
A.Na2CO3=2Na++CO32-
B.H2SO4=2H++SO42-
C.NaHCO3=Na++H++CO32-
D.NaHSO4=Na++H++SO42-
C
【解析】碳酸钠、硫酸为强电解质,完全电离,A、B两项正确;碳酸氢钠为强电解质,完全电离,HCO3-为弱酸的酸式酸根,不能分开,电离方程式为NaHCO3=Na++HCO3-,C错误;硫酸氢钠在水溶液中完全电离生成Na+、H+和SO42-,D正确。
对应训练
【例2】下列物质在指定条件下电离方程式正确的是( )
A.Na2CO3溶于水:Na2CO3===Na22++CO32-
B.Fe(OH)3部分溶于水电离:Fe(OH)3===Fe3++3OH-
C.NaHS溶于水HS-的电离:HS-+H2O H2S+OH-
D.NaHSO4加热熔化:NaHSO4===Na++HSO4-
D
【解析】A项中正确的电离方程式为Na2CO3===2Na++CO32-;B项中Fe(OH)3是弱碱,正确的电离方程式为Fe(OH)3 Fe3++3OH-;C项中HS-的电离方程式为HS- H++S2-。
第二节 离子反应
第1课时:电解质的电离
第一章 物质及其变化
电解质和非电解质
01
电离及电离方程式
02
学习目标
1.通过探究几组物质的导电性实验形成电离的概念,能从宏微结合的角度进一步对物质进行分类,以探究的方式建构电离模型。
2.通过合作探究对溶液导电性的分析,知道电解质、非电解质的概念,认识常见的电解质,能从微观的角度(电离)认识酸、碱和盐,并能用电离方程式表示酸、碱、盐的电离过程。
3.通过化学实验认识电解质的电离及电离条件,建立电离方程式的认知模型,激发学习化学的兴趣,培养严谨求实、勇于探索的科学精神。
情境探究
(1)Fe、Cu能导电,故Fe、Cu为电解质,这种说法对吗?为什么?
电解质和非电解质
任务一、实验探究:阅读教材P14页内容,根据实验1-2,完成下列实验,并填写表格内容。(《绿色通道》P11)
【温馨提示】严格说蒸馏水也能导电,但是其导电能力很微弱,用上述的实验装置无法测出。
不导电
不导电
不导电
导电
导电
导电
导电
自由移动
带电荷
Na+
Cl-
自由移动
Na+
Cl-
水合钠离子
水合氯离子
负
正
Na+
Cl-
电离及电离方程式
任务二、阅读教材P15页第3、4、5自然段,观察图回答NaCl固体溶于水或熔融状态能导电的原因是什么?
水分子
电解质
NaCl
插入电极时,带正电荷的阳离子向电源负极移动,带负电荷的阴离子向电源正极移动
水合离子
电离及电离方程式
氯化钠熔化过程
【结果】NaCl固体熔化时,产生了自由移动的钠离子和氯离子。
【结论】因此,NaCl固体溶于水或熔融状态能导电的原因是因为在水溶液或熔融状态下均能产生了自由移动的钠离子和氯离子。
电离及电离方程式
【问题探究】为什么蔗糖溶液、酒精不导电?
【结论】蔗糖、酒精本身或溶于水均以分子形式存在,无自由移动的离子。
电解质和非电解质
任务三、讨论交流:根据物质的导电性规律,思考如何对化合物进行再
分类?电解质和非电解质的概念是什么?
化合物的分类
按在一定条件(溶于水或熔融状态)是否导电分
能导电
不能导电
电解质:在水溶液里或在熔融状态下能够导电的化合物。
非电解质:在水溶液里或在熔融状态下不能够导电的化合物。
单质
非电解质
物质
混合物
纯净物
化合物
电解质
弱电解质
强电解质
强酸:如HCl、H2SO4、HNO3
金属氧化物:如MgO、Na2O、Al2O3
大部分盐:如:NaCl、K2SO4、AgNO3、CaCO3、AgCl
强碱:如KOH、NaOH、Ba(OH)2 、Ca(OH)2
电
解
质
强 电 解 质
(全部电离)
弱 电 解 质
(部分电离)
弱酸:如H2CO3、H2S、H2SO3、CH3COOH
弱碱:如NH3 H2O、Cu(OH)2、Mg(OH)2
水:H2O
少数盐:如(CH3COO)2Pb(醋酸铅)
判断:下列哪些物质是电解质,哪些是非电解质?
H2SO4 、稀硫酸、 NaOH、乙醇、CO2 、NH3 、SO2、NH3.H2O、CuO、FeSO4、蔗糖、盐酸、Cu、AgCl、Al、HCl(气体)、KNO3溶液、BaSO4、Na2O
H2SO4 、 NaOH、 NH3.H2O、CuO、FeSO4 、AgCl、 HCl(气体)、BaSO4、Na2O
电解质:
非电解质:
乙醇、CO2 、NH3、 SO2 、蔗糖
NH3、SO2
溶于水(与水反应)
NH3+H2O=NH3.H2O→NH4++OH-
SO2+H2O=H2SO3→ 2H++SO32-
HCl、NaCl
盐酸溶液 → H++Cl-
氯化钠溶液→ Na++Cl-
BaSO4、AgCl
难溶于水
溶于水的BaSO4→(少)Ba2++SO42-
溶于水的AgCl→ (少)Ag++Cl-
自由移动的阴、阳离子
溶于水
概念辨析
1.铁能导电,所以金属是电解质
2.NaCl溶液能导电,NaCl溶液是电解质
3.CO2溶于水能导电,所以CO2是电解质
4.CaCO3难溶于水,所以它是非电解质
5.电解质未必能导电
X
X
1. 电解质和非电解质都是针对化合物而言; 单质和混合物既不是电解质也不是非电解质。
X
2.是电解质先要是纯净的化合物
X
3.电解质要本身能电离
√
如NaCl
√
√
√
×
任务四、根据上面电解质导电的微观探析,思考电解质导电与离子有何关系,什么是电解质的电离?
电解质溶液导电能力与哪些因素有关?
与离子的浓度、离子所带电荷多少有关
电离及电离方程式
认识酸、碱、盐电解质的电离,观察下列各物质的电离方程式,有何规律?
物质 电离方程式 本质
酸 HCl = H+ + Cl-、 H2SO4 = 2H+ + SO42- CH3COOH H+ +CH3COO-
碱 NaOH = Na+ + OH- Ca(OH)2=Ca2++ 2OH- NH3 H2O NH4++OH-
盐 NaCl = Na+ + Cl- (NH4)2S = 2NH4+ + S2-
酸=氢离子(H+)+酸根离子
所有阳离子都是H+
注意:H+半径很小,也可写成H3O+
碱=氢氧根离子(OH-)+金属阳离子或铵根离子
所有阴离子都是OH-
盐=金属阳离子或铵根离子+酸根离子
a.左边写电解质的化学式,右边写阴、阳离子;
b.强酸、强碱、盐(大部分)用“=”号,弱酸、弱碱用“ ”号;
c.原子团不能拆开 ,如 SO42-、NO3-、CO32-、NH4+ 、OH-
d.要遵循质量守恒和电荷守恒(电离方程式右侧的正负电荷数相等,溶液呈电中性)。
小结:书写电离方程式要注意哪些方面?
电离及电离方程式
任务五、讨论交流:联系酸、碱、盐的本质,写出HNO3、
H3PO4、Ba(OH)2、NH3 H2O、Na2SO4、Fe2(SO4)3、(NH4)2SO4的电离
方程式。
【答案】HNO3==H++NO3-、
H3PO4 H++H2PO4-、H2PO4- H++HPO42-、
HPO42- H++PO43-(注意:分步写,用“ ”号)
Ba(OH)2== Ba2++2OH-、NH3 H2O NH4++OH-、
Na2SO4==2Na++SO42-、Fe2(SO4)3== 2Fe3++3SO42- 、
(NH4)2SO4==2NH4+ + SO42-
HS-??H++S2-
H2SO4===2H++SO 2-
4
NaOH===Na++OH-
(NH4)2SO4===2NH++SO2-
4
4
H2S??H++HS-
==
NaHSO4===Na++H++SO2-
4
《绿色通道》P13
单质
非电解质
物质
混合物
纯净物
化合物
电解质
弱电解质
强电解质
强酸:如HCl、H2SO4、HNO3
大部分盐:如:NaCl、AgNO3
强碱:如KOH、NaOH、Ba(OH)2 、Ca(OH)2
电
解
质
强 电 解 质
(全部电离)
弱 电 解 质
(部分电离)
弱酸:如H2CO3、H2S、H2SO3、CH3COOH
弱碱:如NH3 H2O、Cu(OH)2、Mg(OH)2
水:H2O
少数盐:如(CH3COO)2Pb(醋酸铅)
碱
盐
化合物
电
解
质
非电
解质
活泼金属氧化物
H2O
大多数非金属氧化物
大部分有机物
NH3
(Na2O,Al2O3等)
(微弱导电)
溶于水能导电
溶于水或熔融时能导电
蔗糖、CH4、酒精等
导电
不导电
酸
按导电
性分
电离方程式
定义
书写
对应训练
【例1】下列在水溶液中的电离方程式,错误的是 ( )
A.Na2CO3=2Na++CO32-
B.H2SO4=2H++SO42-
C.NaHCO3=Na++H++CO32-
D.NaHSO4=Na++H++SO42-
C
【解析】碳酸钠、硫酸为强电解质,完全电离,A、B两项正确;碳酸氢钠为强电解质,完全电离,HCO3-为弱酸的酸式酸根,不能分开,电离方程式为NaHCO3=Na++HCO3-,C错误;硫酸氢钠在水溶液中完全电离生成Na+、H+和SO42-,D正确。
对应训练
【例2】下列物质在指定条件下电离方程式正确的是( )
A.Na2CO3溶于水:Na2CO3===Na22++CO32-
B.Fe(OH)3部分溶于水电离:Fe(OH)3===Fe3++3OH-
C.NaHS溶于水HS-的电离:HS-+H2O H2S+OH-
D.NaHSO4加热熔化:NaHSO4===Na++HSO4-
D
【解析】A项中正确的电离方程式为Na2CO3===2Na++CO32-;B项中Fe(OH)3是弱碱,正确的电离方程式为Fe(OH)3 Fe3++3OH-;C项中HS-的电离方程式为HS- H++S2-。
