化学人教版(2019)必修第一册2.1.1活泼的金属单质-钠(共33张ppt)
文档属性
| 名称 | 化学人教版(2019)必修第一册2.1.1活泼的金属单质-钠(共33张ppt) |

|
|
| 格式 | pptx | ||
| 文件大小 | 1.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-16 00:00:00 | ||
图片预览









文档简介
(共33张PPT)
第二章 海水中的重要元素——钠和氯
第1课时 活泼的金属单质——钠
人教版化学必修第1册
第一节 钠及其化合物
一 钠的物理性质
镊子
滤纸
银白色
软
小
(1)取用金属钠时,应如何操作?
答案:取用金属钠时,不能用手拿,应该用镊子夹取。
(2)切取钠时,剩余的钠块如何处理?
答案:切取钠时,剩余的钠块不能随意丢弃,应放回原试剂瓶。
(3)钠保存在煤油中的原因是什么?
答案:钠保存在煤油中,是因为钠的密度比煤油大,沉入煤油底部,从而使钠与空气隔绝。
问题探究一
颜色 状态 熔点 密度 硬度
________色 块状固体 ______ 比水______ ______
银白
低
小
小
小结:钠的物理性质
二、钠的化学性质
1.钠与氧气的反应
暗
银白色小球
黄色
淡黄色
4Na+O2====2Na2O
Na2O
Na2O2
2.钠与水反应
浮
小
熔化
低
游动
气体
嘶嘶的响声
2Na+2H2O====2NaOH
红色
碱性
氢氧化钠和
2Na+2H2O====2NaOH
+H2↑
氢气
+H2↑
(1)钠与水反应的现象说明了什么问题?(从活泼性角度)
答案:钠与水反应的现象说明钠是一种非常活泼的金属。
(2)结合钠的性质,想一想为什么不能直接用手取钠?
答案:手上有汗液,钠与水反应放热并生成NaOH,会灼伤皮肤。
问题探究二
(3)把钠投入稀盐酸中,有何现象?相比钠与水的反应哪个更剧烈?为什么?并写出钠与盐酸反应的化学方程式。
答案:浮、熔、游、响,钠与盐酸溶液反应比与水反应更剧烈,因为钠与水反应的实质是钠与H+反应,盐酸中H+浓度比水中的大,所以更剧烈。2Na+2HCl====2NaCl+H2↑。
(4)钠长时间露置于空气中会变暗,然后变成液体,再变成白色
固体,最后变成白色粉末。列出其变化过程并用化学方程式表示。
答案:钠在空气中变质的过程:Na Na2O NaOH
Na2CO3·10H2O Na2CO3,故Na、Na2O、Na2O2、NaOH在空气中
露置时,最终均转化为Na2CO3。
4Na+O2 === 2Na2O;Na2O+H2O == 2NaOH;
2NaOH+CO2+9H2O === Na2CO3·10H2O;
Na2CO3·10H2O===Na2CO3+10H2O。
3.金属钠与盐溶液的反应
将少量金属钠块放入硫酸铜溶液中,观察现象并讨论分析原因。
现象:___________________________________。
化学方程式:________________________
_______________________________。
浮、熔、游、响、溶液中生成蓝色沉淀
2Na+2H2O====2NaOH+H2↑、
2NaOH+CuSO4====Cu(OH)2↓+Na2SO4
(1)钠能不能从盐溶液中置换出金属?为什么?
答案:钠不能从盐溶液中置换出金属,因为钠会先和水反应生成NaOH和H2,NaOH再和盐反应。
(2)钠与熔融态的盐可以反应,可以置换出较不活泼的金属。如4Na+TiCl4 Ti+4NaCl,用钠还可以制取锆、铌、钽等金属。
问题探究三
三 钠的存在、保存及用途
1.存在:钠的化学性质很活泼,在自然界中以_______存在。
2.保存:因为常温下钠能与空气中的_____、___反应,所以钠保存
在_____中,主要是为了隔绝_____。
3.用途:①制取Na2O2等钠的化合物;
②钠和钾的合金(室温呈液态)作原子反应堆的导热剂;
③在电光源上,用钠制造高压钠灯。
化合态
氧气
水
煤油
空气
第二章 海水中的重要元素——钠和氯
第2课时 钠的几种化合物
人教版化学必修第1册
第一节 钠及其化合物
1.氧化钠是一种 色固体。是一种典型的可溶性 氧化物,能与水、酸、酸性氧化物等发生反应。请写出下列反应的化学方程式:
(1)氧化钠与水反应: ;
(2)氧化钠溶于盐酸: ;
(3)氧化钠与CO2反应: 。
2.过氧化钠是一种 色固体。
(1)向盛有粉末状过氧化钠的试管中滴入少量的水
①立即把带火星的木条放在试管口,观察到的现象是_________________
。
一、氧化钠和过氧化钠
白
碱性
Na2O+2HCl===2NaCl+H2O
Na2O+CO2===Na2CO3
淡黄
试管中有大量气泡
产生,带火星的木条复燃
②用手轻摸试管外壁,其感觉是 ,说明该反应是 反应。
③向试管中滴入酚酞溶液,其现象是 。
④由上述实验可知,过氧化钠与水反应有 和 生成,过氧化钠有漂白性。
⑤过氧化钠与水反应的化学方程式是 ,氧化剂是 ,还原剂是 。
(2)过氧化钠与二氧化碳反应的化学方程式是 ,可用于呼吸面具或潜水艇中作为 的来源。
试管壁温度升高
放热
溶液先变红,后褪色
氧气
碱性物质
2Na2O2+2H2O===4NaOH+O2↑
过氧化钠
过氧化钠
2Na2O2+2CO2===2Na2CO3+O2
O2
氧化钠与过氧化钠的比较
名称 氧化钠 过氧化钠
化学式 _____ ______
氧的化合价 ____ ___
颜色状态 ________ ___________
主要用途 漂白剂、供氧剂
化学 性质 相同点 都能与水反应生成氢氧化钠,都能与CO2反应生成Na2CO3 不同点 过氧化钠与水、二氧化碳反应有氧气产生,具有强氧化性,而Na2O不具有强氧化性 Na2O
Na2O2
-2
-1
白色固体
淡黄色固体
小结:
思维启迪 (1)Na2O2是过氧化物,不是碱性氧化物,阴、阳离子个数之比为1∶2。
(2)Na2O2与H2O或CO2反应时,Na2O2既是氧化剂又是还原剂。
①每1 mol Na2O2参加反应转移1 mol电子。
②每生成1 mol O2,反应中转移2 mol电子。
(3)Na2O2与水反应的中间产物(H2O2)具有强氧化性、能够漂白某些有色物质。如向紫色石蕊溶液中加入过量Na2O2粉末,振荡,溶液先变蓝色后褪色,若为酚酞溶液,则先变红色后褪色。
1.碳酸钠、碳酸氢钠的水溶性及酸碱性比较
(1)实验探究
①在两支试管中分别加入少量的碳酸钠和碳酸氢钠(各约1 g)进行比较,它们外观的细小差别是Na2CO3为 色粉末;NaHCO3为 。
②分别向两支试管中加入约10 mL水,用力振荡,分别滴加2~3滴酚酞溶液,其现象是__________________________________________________ 。
白
细小的白色晶体
Na2CO3完全溶解,溶液变红色;NaHCO3部分溶解,溶液变浅红色
二、碳酸钠和碳酸氢钠
(2)实验结论
①水溶性: ,溶解度大小比较:_______
。
②水溶液酸碱性: 。
Na2CO3和NaHCO3都能溶于水
Na2CO3
溶解度大于NaHCO3
Na2CO3、NaHCO3水溶液都呈碱性
(1)按上图要求完成实验:在两支试管中分别加入3 mL稀盐酸,将两个各装有少量等质量的Na2CO3、NaHCO3粉末的小气球分别套在两支试管的管口。将气球内的Na2CO3和NaHCO3同时倒入试管中。观察到的实验现象是________
____________________________________________________________。
2.碳酸钠、碳酸氢钠与盐酸反应快慢的比较
均膨胀;碳酸氢钠与盐酸混合比碳酸钠与盐酸混合气球膨胀得快且大
两个气球
(2)实验结论:____________________________________________________
_________________。
(3)碳酸钠与盐酸反应的化学方程式是_________________________________,离子方程式是_________________________;碳酸氢钠与盐酸反应的化学方程式是________________________________,离子方程式是_____________
____________。
碳酸氢钠与盐酸反应产生气体比等质量的碳酸钠与盐酸反应产生气体多且剧烈
Na2CO3+2HCl===2NaCl+CO2↑+H2O
NaHCO3+HCl===NaCl+CO2↑+H2O
CO2↑+H2O
3.碳酸钠、碳酸氢钠热稳定性的比较
(1)如图所示实验为“套管实验”,小试管
内塞有沾有白色无水硫酸铜粉末的棉花球。
点燃酒精灯加热,能观察到的实验现象是
____________________________________
__________________________________。
(2)实验结论:Na2CO3受热不分解;NaHCO3受热易分解,生成物中含有
。由此可知,Na2CO3的热稳定性比NaHCO3 。
小试管中棉花球变蓝色,B烧杯中澄清石
灰水变浑浊,A烧杯中有少量气泡冒出
CO2和H2O
强
1.碳酸钠和碳酸氢钠的性质比较
名称 碳酸钠(纯碱或苏打) 碳酸氢钠(小苏打)
物理性质 白色粉末,易溶于水 细小白色晶体,能溶于水,溶解度比Na2CO3小
与酸反应 能反应,有气体产生 剧烈反应,有气体产生
与碱反应 能与Ca(OH)2、Ba(OH)2溶液反应 与碱溶液都能反应
热稳定性 稳定、受热不易分解 受热易分解
可相互转化 2.碳酸钠与碳酸氢钠的鉴别
依据 原理 结论
热稳定性 2NaHCO3 Na2CO3+CO2↑+H2O; Na2CO3受热不分解 加热有气体产生的是NaHCO3,无变化的是Na2CO3
与CaCl2、BaCl2的反应 +Ca2+===CaCO3↓, +Ba2+===BaCO3↓; 与Ca2+、Ba2+不反应 有沉淀生成的是Na2CO3,无变化的是NaHCO3
与盐酸反应的剧烈程度 Na2CO3+2HCl===2NaCl+H2O+CO2↑;NaHCO3+HCl===NaCl+H2O+CO2↑ 生成气体剧烈的是NaHCO3,相对不剧烈的是Na2CO3
盐酸逐滴加入时的现象 逐滴加入盐酸立即产生气体的是NaHCO3,开始不产生气体,滴加一会才产生气体的是Na2CO3
3.除杂
混合物 除杂方法及试剂
Na2CO3固体(NaHCO3) 加热
NaHCO3溶液(Na2CO3) 通入足量CO2气体
Na2CO3溶液(NaHCO3) 加入适量NaOH溶液
知识拓展 (1)碳酸及碳酸盐的热稳定性有如下关系:可溶性碳酸盐(不包括铵盐)>不溶性碳酸盐>酸式碳酸盐>碳酸。
例如:Na2CO3>NaHCO3>H2CO3,CaCO3>Ca(HCO3)2>H2CO3。
(2)利用此性质可以鉴别Na2CO3和NaHCO3,还可除去Na2CO3固体中混有的NaHCO3。
1.定义
很多 在灼烧时都会使火焰呈现特殊的颜色。这在化学上称为焰色反应。
三、焰色反应
金属或它们的化合物
2.操作
盐酸
原火焰颜色相同
试样
火焰的颜色
盐酸
无色
3.几种金属的焰色
(1)钠元素的焰色反应呈 色。
(2)钾元素的焰色反应呈 色(透过蓝色的钴玻璃观察)。
4.应用
(1)检验 的存在,如鉴别NaCl和KCl溶液。
(2)利用焰色反应制节日烟火。
黄
浅紫
金属元素
易错警示
(1)焰色反应是元素的性质,而不是单质或化合物的性质,与存在状态无关。
(2)焰色反应可以鉴别物质,这种鉴别物质的方法属于物理方法,而不是化学方法。
THANKS
第二章 海水中的重要元素——钠和氯
第1课时 活泼的金属单质——钠
人教版化学必修第1册
第一节 钠及其化合物
一 钠的物理性质
镊子
滤纸
银白色
软
小
(1)取用金属钠时,应如何操作?
答案:取用金属钠时,不能用手拿,应该用镊子夹取。
(2)切取钠时,剩余的钠块如何处理?
答案:切取钠时,剩余的钠块不能随意丢弃,应放回原试剂瓶。
(3)钠保存在煤油中的原因是什么?
答案:钠保存在煤油中,是因为钠的密度比煤油大,沉入煤油底部,从而使钠与空气隔绝。
问题探究一
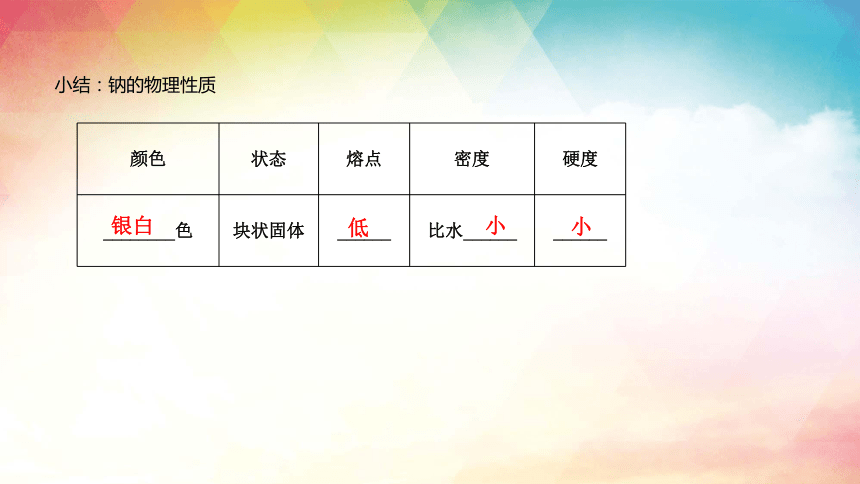
颜色 状态 熔点 密度 硬度
________色 块状固体 ______ 比水______ ______
银白
低
小
小
小结:钠的物理性质
二、钠的化学性质
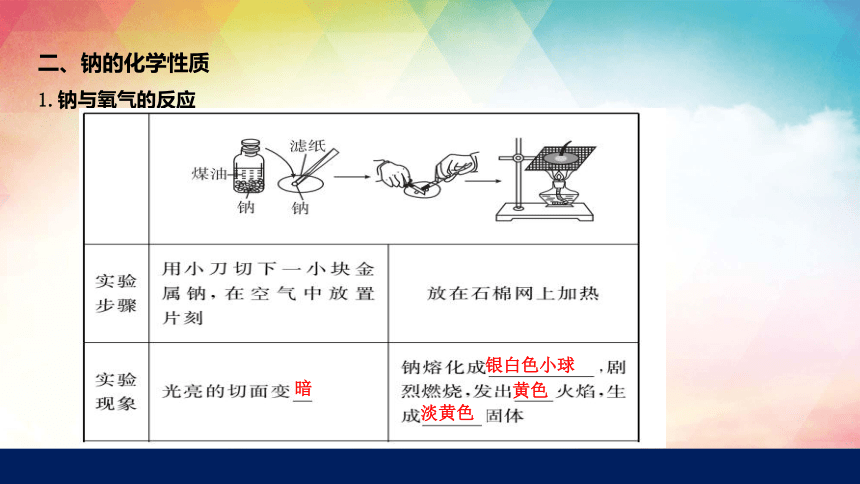
1.钠与氧气的反应
暗
银白色小球
黄色
淡黄色
4Na+O2====2Na2O
Na2O
Na2O2
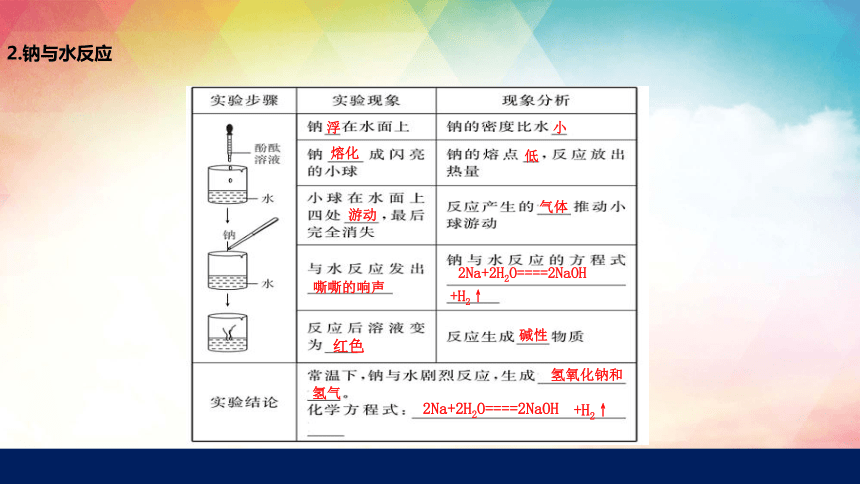
2.钠与水反应
浮
小
熔化
低
游动
气体
嘶嘶的响声
2Na+2H2O====2NaOH
红色
碱性
氢氧化钠和
2Na+2H2O====2NaOH
+H2↑
氢气
+H2↑
(1)钠与水反应的现象说明了什么问题?(从活泼性角度)
答案:钠与水反应的现象说明钠是一种非常活泼的金属。
(2)结合钠的性质,想一想为什么不能直接用手取钠?
答案:手上有汗液,钠与水反应放热并生成NaOH,会灼伤皮肤。
问题探究二
(3)把钠投入稀盐酸中,有何现象?相比钠与水的反应哪个更剧烈?为什么?并写出钠与盐酸反应的化学方程式。
答案:浮、熔、游、响,钠与盐酸溶液反应比与水反应更剧烈,因为钠与水反应的实质是钠与H+反应,盐酸中H+浓度比水中的大,所以更剧烈。2Na+2HCl====2NaCl+H2↑。
(4)钠长时间露置于空气中会变暗,然后变成液体,再变成白色
固体,最后变成白色粉末。列出其变化过程并用化学方程式表示。
答案:钠在空气中变质的过程:Na Na2O NaOH
Na2CO3·10H2O Na2CO3,故Na、Na2O、Na2O2、NaOH在空气中
露置时,最终均转化为Na2CO3。
4Na+O2 === 2Na2O;Na2O+H2O == 2NaOH;
2NaOH+CO2+9H2O === Na2CO3·10H2O;
Na2CO3·10H2O===Na2CO3+10H2O。
3.金属钠与盐溶液的反应
将少量金属钠块放入硫酸铜溶液中,观察现象并讨论分析原因。
现象:___________________________________。
化学方程式:________________________
_______________________________。
浮、熔、游、响、溶液中生成蓝色沉淀
2Na+2H2O====2NaOH+H2↑、
2NaOH+CuSO4====Cu(OH)2↓+Na2SO4
(1)钠能不能从盐溶液中置换出金属?为什么?
答案:钠不能从盐溶液中置换出金属,因为钠会先和水反应生成NaOH和H2,NaOH再和盐反应。
(2)钠与熔融态的盐可以反应,可以置换出较不活泼的金属。如4Na+TiCl4 Ti+4NaCl,用钠还可以制取锆、铌、钽等金属。
问题探究三
三 钠的存在、保存及用途
1.存在:钠的化学性质很活泼,在自然界中以_______存在。
2.保存:因为常温下钠能与空气中的_____、___反应,所以钠保存
在_____中,主要是为了隔绝_____。
3.用途:①制取Na2O2等钠的化合物;
②钠和钾的合金(室温呈液态)作原子反应堆的导热剂;
③在电光源上,用钠制造高压钠灯。
化合态
氧气
水
煤油
空气
第二章 海水中的重要元素——钠和氯
第2课时 钠的几种化合物
人教版化学必修第1册
第一节 钠及其化合物
1.氧化钠是一种 色固体。是一种典型的可溶性 氧化物,能与水、酸、酸性氧化物等发生反应。请写出下列反应的化学方程式:
(1)氧化钠与水反应: ;
(2)氧化钠溶于盐酸: ;
(3)氧化钠与CO2反应: 。
2.过氧化钠是一种 色固体。
(1)向盛有粉末状过氧化钠的试管中滴入少量的水
①立即把带火星的木条放在试管口,观察到的现象是_________________
。
一、氧化钠和过氧化钠
白
碱性
Na2O+2HCl===2NaCl+H2O
Na2O+CO2===Na2CO3
淡黄
试管中有大量气泡
产生,带火星的木条复燃
②用手轻摸试管外壁,其感觉是 ,说明该反应是 反应。
③向试管中滴入酚酞溶液,其现象是 。
④由上述实验可知,过氧化钠与水反应有 和 生成,过氧化钠有漂白性。
⑤过氧化钠与水反应的化学方程式是 ,氧化剂是 ,还原剂是 。
(2)过氧化钠与二氧化碳反应的化学方程式是 ,可用于呼吸面具或潜水艇中作为 的来源。
试管壁温度升高
放热
溶液先变红,后褪色
氧气
碱性物质
2Na2O2+2H2O===4NaOH+O2↑
过氧化钠
过氧化钠
2Na2O2+2CO2===2Na2CO3+O2
O2
氧化钠与过氧化钠的比较
名称 氧化钠 过氧化钠
化学式 _____ ______
氧的化合价 ____ ___
颜色状态 ________ ___________
主要用途 漂白剂、供氧剂
化学 性质 相同点 都能与水反应生成氢氧化钠,都能与CO2反应生成Na2CO3 不同点 过氧化钠与水、二氧化碳反应有氧气产生,具有强氧化性,而Na2O不具有强氧化性 Na2O
Na2O2
-2
-1
白色固体
淡黄色固体
小结:
思维启迪 (1)Na2O2是过氧化物,不是碱性氧化物,阴、阳离子个数之比为1∶2。
(2)Na2O2与H2O或CO2反应时,Na2O2既是氧化剂又是还原剂。
①每1 mol Na2O2参加反应转移1 mol电子。
②每生成1 mol O2,反应中转移2 mol电子。
(3)Na2O2与水反应的中间产物(H2O2)具有强氧化性、能够漂白某些有色物质。如向紫色石蕊溶液中加入过量Na2O2粉末,振荡,溶液先变蓝色后褪色,若为酚酞溶液,则先变红色后褪色。
1.碳酸钠、碳酸氢钠的水溶性及酸碱性比较
(1)实验探究
①在两支试管中分别加入少量的碳酸钠和碳酸氢钠(各约1 g)进行比较,它们外观的细小差别是Na2CO3为 色粉末;NaHCO3为 。
②分别向两支试管中加入约10 mL水,用力振荡,分别滴加2~3滴酚酞溶液,其现象是__________________________________________________ 。
白
细小的白色晶体
Na2CO3完全溶解,溶液变红色;NaHCO3部分溶解,溶液变浅红色
二、碳酸钠和碳酸氢钠
(2)实验结论
①水溶性: ,溶解度大小比较:_______
。
②水溶液酸碱性: 。
Na2CO3和NaHCO3都能溶于水
Na2CO3
溶解度大于NaHCO3
Na2CO3、NaHCO3水溶液都呈碱性
(1)按上图要求完成实验:在两支试管中分别加入3 mL稀盐酸,将两个各装有少量等质量的Na2CO3、NaHCO3粉末的小气球分别套在两支试管的管口。将气球内的Na2CO3和NaHCO3同时倒入试管中。观察到的实验现象是________
____________________________________________________________。
2.碳酸钠、碳酸氢钠与盐酸反应快慢的比较
均膨胀;碳酸氢钠与盐酸混合比碳酸钠与盐酸混合气球膨胀得快且大
两个气球
(2)实验结论:____________________________________________________
_________________。
(3)碳酸钠与盐酸反应的化学方程式是_________________________________,离子方程式是_________________________;碳酸氢钠与盐酸反应的化学方程式是________________________________,离子方程式是_____________
____________。
碳酸氢钠与盐酸反应产生气体比等质量的碳酸钠与盐酸反应产生气体多且剧烈
Na2CO3+2HCl===2NaCl+CO2↑+H2O
NaHCO3+HCl===NaCl+CO2↑+H2O
CO2↑+H2O
3.碳酸钠、碳酸氢钠热稳定性的比较
(1)如图所示实验为“套管实验”,小试管
内塞有沾有白色无水硫酸铜粉末的棉花球。
点燃酒精灯加热,能观察到的实验现象是
____________________________________
__________________________________。
(2)实验结论:Na2CO3受热不分解;NaHCO3受热易分解,生成物中含有
。由此可知,Na2CO3的热稳定性比NaHCO3 。
小试管中棉花球变蓝色,B烧杯中澄清石
灰水变浑浊,A烧杯中有少量气泡冒出
CO2和H2O
强
1.碳酸钠和碳酸氢钠的性质比较
名称 碳酸钠(纯碱或苏打) 碳酸氢钠(小苏打)
物理性质 白色粉末,易溶于水 细小白色晶体,能溶于水,溶解度比Na2CO3小
与酸反应 能反应,有气体产生 剧烈反应,有气体产生
与碱反应 能与Ca(OH)2、Ba(OH)2溶液反应 与碱溶液都能反应
热稳定性 稳定、受热不易分解 受热易分解
可相互转化 2.碳酸钠与碳酸氢钠的鉴别
依据 原理 结论
热稳定性 2NaHCO3 Na2CO3+CO2↑+H2O; Na2CO3受热不分解 加热有气体产生的是NaHCO3,无变化的是Na2CO3
与CaCl2、BaCl2的反应 +Ca2+===CaCO3↓, +Ba2+===BaCO3↓; 与Ca2+、Ba2+不反应 有沉淀生成的是Na2CO3,无变化的是NaHCO3
与盐酸反应的剧烈程度 Na2CO3+2HCl===2NaCl+H2O+CO2↑;NaHCO3+HCl===NaCl+H2O+CO2↑ 生成气体剧烈的是NaHCO3,相对不剧烈的是Na2CO3
盐酸逐滴加入时的现象 逐滴加入盐酸立即产生气体的是NaHCO3,开始不产生气体,滴加一会才产生气体的是Na2CO3
3.除杂
混合物 除杂方法及试剂
Na2CO3固体(NaHCO3) 加热
NaHCO3溶液(Na2CO3) 通入足量CO2气体
Na2CO3溶液(NaHCO3) 加入适量NaOH溶液
知识拓展 (1)碳酸及碳酸盐的热稳定性有如下关系:可溶性碳酸盐(不包括铵盐)>不溶性碳酸盐>酸式碳酸盐>碳酸。
例如:Na2CO3>NaHCO3>H2CO3,CaCO3>Ca(HCO3)2>H2CO3。
(2)利用此性质可以鉴别Na2CO3和NaHCO3,还可除去Na2CO3固体中混有的NaHCO3。
1.定义
很多 在灼烧时都会使火焰呈现特殊的颜色。这在化学上称为焰色反应。
三、焰色反应
金属或它们的化合物
2.操作
盐酸
原火焰颜色相同
试样
火焰的颜色
盐酸
无色
3.几种金属的焰色
(1)钠元素的焰色反应呈 色。
(2)钾元素的焰色反应呈 色(透过蓝色的钴玻璃观察)。
4.应用
(1)检验 的存在,如鉴别NaCl和KCl溶液。
(2)利用焰色反应制节日烟火。
黄
浅紫
金属元素
易错警示
(1)焰色反应是元素的性质,而不是单质或化合物的性质,与存在状态无关。
(2)焰色反应可以鉴别物质,这种鉴别物质的方法属于物理方法,而不是化学方法。
THANKS
