新人教版九年级下册《第9单元 溶液》2023年单元测试卷(一)(含解析)
文档属性
| 名称 | 新人教版九年级下册《第9单元 溶液》2023年单元测试卷(一)(含解析) |  | |
| 格式 | doc | ||
| 文件大小 | 151.5KB | ||
| 资源类型 | 教案 | ||
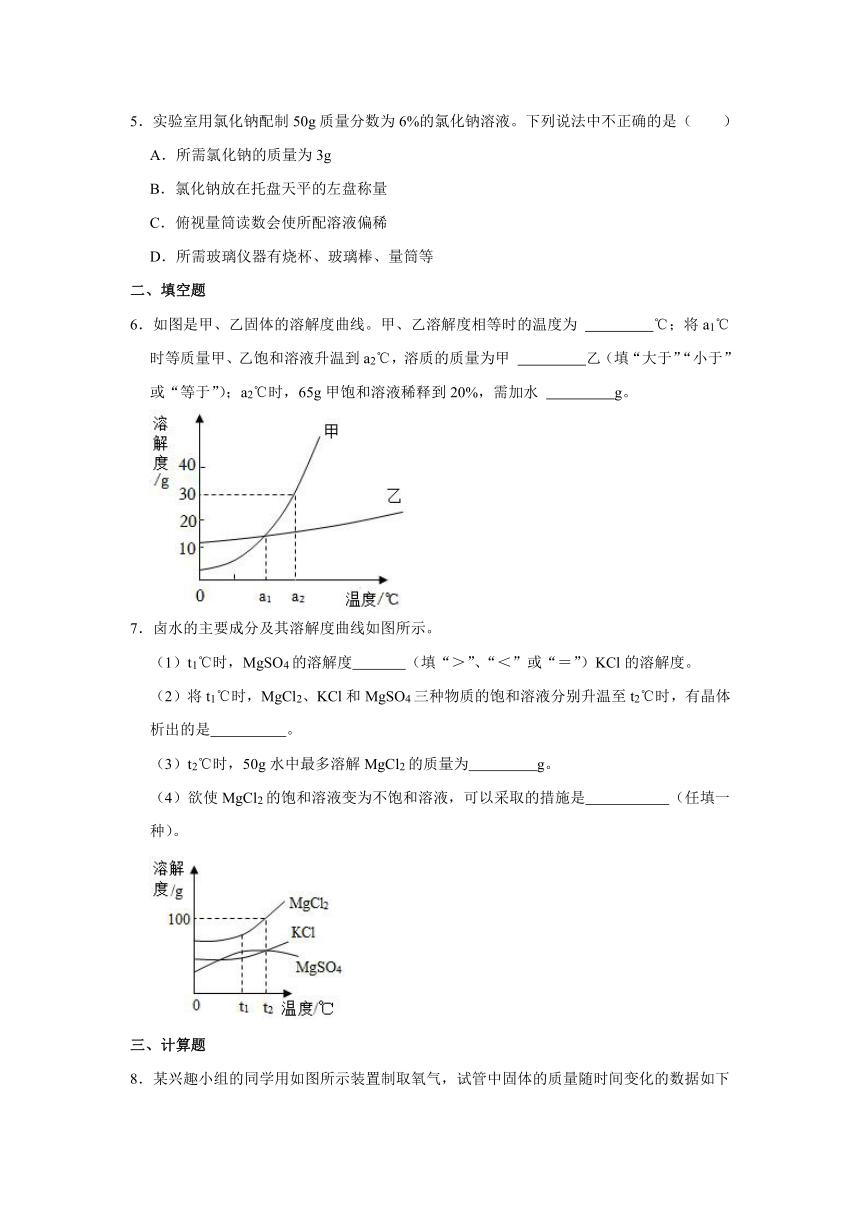
| 版本资源 | 人教版 | ||
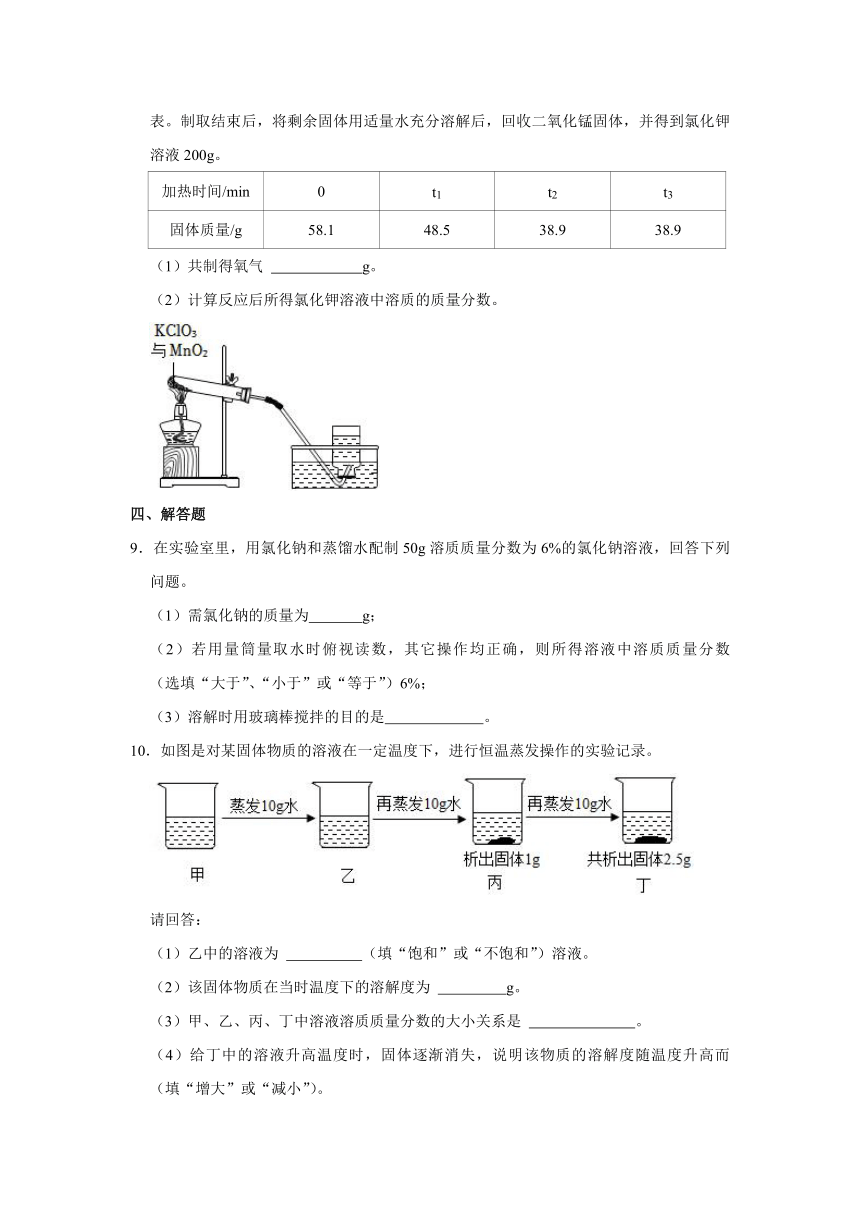
| 科目 | 化学 | ||
| 更新时间 | 2023-12-16 17:01:10 | ||
图片预览


文档简介
新人教版九年级下册《第9单元 溶液》2023年单元测试卷(一)
一、选择题
1.下列说法正确的是( )
A.溶质都是固体
B.乳化能增强乳浊液的稳定性
C.均一、稳定的液体是溶液
D.搅拌可增大物质的溶解度
2.如表给出了氯化钠和碳酸钠在不同温度时的溶解度,根据此表推断合理的是( )
温度/℃ 10 20 30 40
溶解度/g 氯化钠 35.8 36.0 36.3 36.6
碳酸钠 12.2 21.8 39.7 49.6
A.20℃时,将100g水加入30g碳酸钠中,充分搅拌后得到不饱和溶液
B.20℃时,将100g水加入30g氯化钠中,充分搅拌后所得溶液中溶质质量分数为30%
C.两物质的溶解度曲线在20℃﹣30℃之间应出现交点
D.可以采用降温结晶的方法从二者的混合物中提纯氯化钠
3.在25℃时,向不饱和氯化钾溶液加入少量氯化钾固体到溶液刚好饱和,下列各量:
①溶液中水的质量,②溶液中溶质的质量,③溶液中氯化钾的质量分数,⑤氯化钾溶液的质量,其中不变的是( )
A.①和④ B.②和③ C.③和④ D.④和⑤
4.压强为101kPa下,硝酸钾和氨气在不同温度下的溶解度如下表。下列说法正确的是( )
温度/℃ 10 20 30 60
溶解度/g KNO3 20.9 31.6 45.8 110
NH3 70 56 44.5 20
A.两种物质的溶解度均随温度升高而增大
B.20℃时,KNO3饱和溶液中溶质的质量分数为31.6%
C.60℃的KNO3饱和溶液降温至30℃,有晶体析出
D.NH3的溶解度与压强大小无关
5.实验室用氯化钠配制50g质量分数为6%的氯化钠溶液。下列说法中不正确的是( )
A.所需氯化钠的质量为3g
B.氯化钠放在托盘天平的左盘称量
C.俯视量筒读数会使所配溶液偏稀
D.所需玻璃仪器有烧杯、玻璃棒、量筒等
二、填空题
6.如图是甲、乙固体的溶解度曲线。甲、乙溶解度相等时的温度为 ℃;将a1℃时等质量甲、乙饱和溶液升温到a2℃,溶质的质量为甲 乙(填“大于”“小于”或“等于”);a2℃时,65g甲饱和溶液稀释到20%,需加水 g。
7.卤水的主要成分及其溶解度曲线如图所示。
(1)t1℃时,MgSO4的溶解度 (填“>”、“<”或“=”)KCl的溶解度。
(2)将t1℃时,MgCl2、KCl和MgSO4三种物质的饱和溶液分别升温至t2℃时,有晶体析出的是 。
(3)t2℃时,50g水中最多溶解MgCl2的质量为 g。
(4)欲使MgCl2的饱和溶液变为不饱和溶液,可以采取的措施是 (任填一种)。
三、计算题
8.某兴趣小组的同学用如图所示装置制取氧气,试管中固体的质量随时间变化的数据如下表。制取结束后,将剩余固体用适量水充分溶解后,回收二氧化锰固体,并得到氯化钾溶液200g。
加热时间/min 0 t1 t2 t3
固体质量/g 58.1 48.5 38.9 38.9
(1)共制得氧气 g。
(2)计算反应后所得氯化钾溶液中溶质的质量分数。
四、解答题
9.在实验室里,用氯化钠和蒸馏水配制50g溶质质量分数为6%的氯化钠溶液,回答下列问题。
(1)需氯化钠的质量为 g;
(2)若用量筒量取水时俯视读数,其它操作均正确,则所得溶液中溶质质量分数 (选填“大于”、“小于”或“等于”)6%;
(3)溶解时用玻璃棒搅拌的目的是 。
10.如图是对某固体物质的溶液在一定温度下,进行恒温蒸发操作的实验记录。
请回答:
(1)乙中的溶液为 (填“饱和”或“不饱和”)溶液。
(2)该固体物质在当时温度下的溶解度为 g。
(3)甲、乙、丙、丁中溶液溶质质量分数的大小关系是 。
(4)给丁中的溶液升高温度时,固体逐渐消失,说明该物质的溶解度随温度升高而 (填“增大”或“减小”)。
11.溶液在生产和科研中具有广泛的用途,与人们的生活密不可分。
(1)衣服上沾有的油污,可用汽油洗去,是因为汽油能 (填“溶解”或“乳化”)油污。
(2)喝了冰镇汽水以后,常常会打嗝。这种现象说明气体的溶解度与 有关。
(3)某固体物质的溶解度曲线如图所示:
20℃时,要使接近饱和的该物质的溶液变为饱和溶液,通常可采用三种方法 、 、 。
12.溶液与人类生产、生活密切相关,请根据要求回答相关问题。
(1)A、B、C三种固体物质的溶解度曲线如图所示。
①t1℃时,A、B、C三种物质的溶解度由小到大的顺序是 。
②A、B、C三种物质中,溶解度受温度影响较小的是 。
③t2℃时,完全溶解ag A物质最少需要水的质量是 g。
④t2℃时,A饱和溶液的溶质质量分数 B饱和溶液溶质质量分数(填“大于”、“等于”或“小于”)。
(2)实验室欲除去粗盐样品中含有的不溶性泥沙,在过滤操作中需要用到的实验仪器和用品有:烧杯、铁架台(带铁圈)、漏斗、 和滤纸。
(3)在实验室中,配制溶质质量分数为9%的氯化钠溶液100g,需要氯化钠固体的质量是 g.将100g9%的氯化钠溶液配成含氯化钠为0.9%的溶液,需加入蒸馏水的质量至少是 g。
13.KNO3和KCl的溶解度曲线如图所示:
(1)t3℃时,KNO3的溶解度为 。
(2)将t3℃时KCl的饱和溶液70.0g稀释成质量分数为20.0%的KCl溶液,需加水 g(精确到0.1g)。查阅相关物质的密度后,在实验室完成该实验通常需要的仪器有烧杯、量筒、 (填字母标号)。
A.托盘天平 B.药匙 C.胶头滴管 D.玻璃棒
(3)现有t2℃时KNO3的饱和溶液m1g和KCl的饱和溶液m2g.不考虑水的蒸发,下列关系一定成立的是 (填字母标号)。
A.两溶液中溶质的质量分数相等
B.分别降温到t1℃,析出KNO3的质量大于析出KCl的质量
C.分别升温至t3℃,所得溶液中溶质的质量分数相等
D.保持t2℃不变,分别加入等质量的水,混匀后所得溶液中溶质的质量分数相等
14.为测定一瓶敞口放置的浓盐酸的溶质质量分数,某同学量取20mL(密度为1.1g/mL)的该盐酸与大理石充分反应
(1)生成二氧化碳的质量是多少克?
(2)计算该盐酸的溶质质量分数.
新人教版九年级下册《第9单元 溶液》2023年单元测试卷(一)
参考答案与试题解析
一、选择题
1.下列说法正确的是( )
A.溶质都是固体
B.乳化能增强乳浊液的稳定性
C.均一、稳定的液体是溶液
D.搅拌可增大物质的溶解度
【分析】A、根据溶质的状态,进行分析判断。
B、根据乳化作用的原理,进行分析判断。
C、根据溶液是均一稳定的混合物,进行分析判断。
D、溶解度是在一定温度下,某固体溶质在100g溶剂里达到饱和状态所溶解的溶质质量。
【解答】解:A、溶质不一定都是固体,故选项说法错误。
B、乳化剂能使乳浊液变成稳定的混合物的物质,故选项说法正确。
C、均一,如水。
D、溶解度是在一定温度下,搅拌不能增加一定温度下,不能增大物质的溶解度。
故选:B。
2.如表给出了氯化钠和碳酸钠在不同温度时的溶解度,根据此表推断合理的是( )
温度/℃ 10 20 30 40
溶解度/g 氯化钠 35.8 36.0 36.3 36.6
碳酸钠 12.2 21.8 39.7 49.6
A.20℃时,将100g水加入30g碳酸钠中,充分搅拌后得到不饱和溶液
B.20℃时,将100g水加入30g氯化钠中,充分搅拌后所得溶液中溶质质量分数为30%
C.两物质的溶解度曲线在20℃﹣30℃之间应出现交点
D.可以采用降温结晶的方法从二者的混合物中提纯氯化钠
【分析】A、20℃时,碳酸钠的溶解度为21.8g,进行分析解答;
B、根据溶质质量分数=溶质质量/溶液质量进行分析;
C、根据两物质的溶解度曲线变化趋势进行分析;
D、根据碳酸钠的溶解度受温度的影响变化大,氯化钠的溶解度受温度影响不大进行解答.
【解答】解:A、20℃时,将100g水加入30g碳酸钠中将会有部分碳酸钠不能溶解,故错误;
B、20℃时,将100g水加入30g氯化钠中,故错误;
C、根据两物质的溶解度曲线变化趋势可以看出在20℃﹣30℃之间两曲线应出现交点;
D、碳酸钠的溶解度受温度的影响变化大,所以碳酸钠溶液中混有少量的氯化钠;而氯化钠溶液中混有少量的碳酸钠,故错误;
故选:C。
3.在25℃时,向不饱和氯化钾溶液加入少量氯化钾固体到溶液刚好饱和,下列各量:
①溶液中水的质量,②溶液中溶质的质量,③溶液中氯化钾的质量分数,⑤氯化钾溶液的质量,其中不变的是( )
A.①和④ B.②和③ C.③和④ D.④和⑤
【分析】在向溶液中加入溶质的过程中,溶剂的质量不变;物质的溶解度决定于温度,与其它因素无关.
【解答】解:向不饱和氯化钾溶液加入少量氯化钾固体至溶液刚好饱和的过程中,水的质量不变,溶液中氯化钾的质量分数增大,氯化钾溶液的质量增大。
故选:A。
4.压强为101kPa下,硝酸钾和氨气在不同温度下的溶解度如下表。下列说法正确的是( )
温度/℃ 10 20 30 60
溶解度/g KNO3 20.9 31.6 45.8 110
NH3 70 56 44.5 20
A.两种物质的溶解度均随温度升高而增大
B.20℃时,KNO3饱和溶液中溶质的质量分数为31.6%
C.60℃的KNO3饱和溶液降温至30℃,有晶体析出
D.NH3的溶解度与压强大小无关
【分析】根据表中硝酸钾和氨气在不同温度下的溶解度的数据分析溶解度随温度变化的情况,根据溶解度的含义分析判断有关的说法。
【解答】解:A、由表中的数据可知,氨气的溶解度均随温度升高而减小;
B、20℃时3的溶解度是31.6g,饱和溶液中溶质的质量分数为:,故B错误;
C、由于硝酸钾的溶解度随温度的升高而增大3饱和溶液降温至30℃,有晶体析出;
D、NH2是气体,NH3的溶解度随压强增大而增大,故D错误。
故选:C。
5.实验室用氯化钠配制50g质量分数为6%的氯化钠溶液。下列说法中不正确的是( )
A.所需氯化钠的质量为3g
B.氯化钠放在托盘天平的左盘称量
C.俯视量筒读数会使所配溶液偏稀
D.所需玻璃仪器有烧杯、玻璃棒、量筒等
【分析】A、利用溶质质量=溶液质量×溶质的质量分数,进行分析判断。
B、根据托盘天平的使用方法,进行分析判断。
C、用量筒量取水时,俯视液面,读数比实际液体体积大,进行分析判断。
D、操作步骤分别是:计算、称量、溶解,根据各操作所需要使用的仪器进行分析判断。
【解答】解:A、溶质质量=溶液质量×溶质的质量分数,需氯化钠的质量=50g×6%=3g。
B、托盘天平的使用要遵循“左物右码”的原则,故选项说法正确。
C、用量筒量取水时,读数比实际液体体积大,则使溶质质量分数偏大。
D、配制50g质量分数为7%的氯化钠溶液,再称量所需的氯化钠和量取水;在这些操作中需要的仪器:托盘天平、量筒、烧杯和玻璃棒、烧杯、量筒。
故选:C。
二、填空题
6.如图是甲、乙固体的溶解度曲线。甲、乙溶解度相等时的温度为 a1 ℃;将a1℃时等质量甲、乙饱和溶液升温到a2℃,溶质的质量为甲 等于 乙(填“大于”“小于”或“等于”);a2℃时,65g甲饱和溶液稀释到20%,需加水 10 g。
【分析】根据固体的溶解度曲线可以:①查出某物质在一定温度下的溶解度,从而确定物质的溶解性,②比较不同物质在同一温度下的溶解度大小,从而判断饱和溶液中溶质的质量分数的大小,③判断物质的溶解度随温度变化的变化情况,从而判断通过降温结晶还是蒸发结晶的方法达到提纯物质的目的。
【解答】解:据图可以看出,甲、乙溶解度相等时的温度为a1℃;a1℃时,甲和乙的溶解度相等、乙饱和溶液中所含的溶质相等,故升温到a4℃,溶液的组成不变;a2℃时,价的溶解度为30g,设需加水的质量为x=(65g+x)×20%;
故答案为:a1;等于;10g。
7.卤水的主要成分及其溶解度曲线如图所示。
(1)t1℃时,MgSO4的溶解度 > (填“>”、“<”或“=”)KCl的溶解度。
(2)将t1℃时,MgCl2、KCl和MgSO4三种物质的饱和溶液分别升温至t2℃时,有晶体析出的是 硫酸镁 。
(3)t2℃时,50g水中最多溶解MgCl2的质量为 50 g。
(4)欲使MgCl2的饱和溶液变为不饱和溶液,可以采取的措施是 升高温度 (任填一种)。
【分析】根据固体的溶解度曲线可以:①查出某物质在一定温度下的溶解度,从而确定物质的溶解性,②比较不同物质在同一温度下的溶解度大小,从而判断饱和溶液中溶质的质量分数的大小,③判断物质的溶解度随温度变化的变化情况,从而判断通过降温结晶还是蒸发结晶的方法达到提纯物质的目的。
【解答】解:(1)通过分析溶解度曲线可知,t1℃时,MgSO4的溶解度>KCl的溶解度;
(2)将t5℃时,MgCl2、KCl和MgSO4三种物质的饱和溶液分别升温至t8℃时,硫酸镁的溶解度减小、氯化钾的溶解度增大;
(3)t2℃时,氯化镁的溶解度是100g2的质量为50g;
(4)氯化镁的溶解度随温度的升高而增大,所以欲使MgCl6的饱和溶液变为不饱和溶液,可以采取的措施是升高温度或增加溶剂等。
故答案为:(1)>;
(2)硫酸镁;
(3)50;
(4)升高温度(或增加溶剂等其他合理方法)。
三、计算题
8.某兴趣小组的同学用如图所示装置制取氧气,试管中固体的质量随时间变化的数据如下表。制取结束后,将剩余固体用适量水充分溶解后,回收二氧化锰固体,并得到氯化钾溶液200g。
加热时间/min 0 t1 t2 t3
固体质量/g 58.1 48.5 38.9 38.9
(1)共制得氧气 19.2g g。
(2)计算反应后所得氯化钾溶液中溶质的质量分数。
【分析】(1)根据质量守恒定律进行计算;
(2)根据氧气的质量和化学方程式庨同生成氯化钾的质量,然后再根据溶质的质量分数的公式计算反应后所得氯化钾溶液中溶质的质量分数。
【解答】解:(1)氯酸钾在二氧化锰的催化下受热分解生成氯化钾和氧气,反应前后的质量差即为反应生成氧气的质量,共制得氧气的质量为:58.1g﹣38.9g=19.5g;
(2)设反应后生成氯化钾的质量为x。
2KClO32KCl+3O2↑
149
x 19.2g
x=29.3g
则反应后所得氯化钾溶液中溶质的质量分数为:,
答:反应后所得氯化钾溶液中溶质的质量分数为14.2%。
故答案为:
(1)19.2g;
(2)14.9%。
四、解答题
9.在实验室里,用氯化钠和蒸馏水配制50g溶质质量分数为6%的氯化钠溶液,回答下列问题。
(1)需氯化钠的质量为 3 g;
(2)若用量筒量取水时俯视读数,其它操作均正确,则所得溶液中溶质质量分数 大于 (选填“大于”、“小于”或“等于”)6%;
(3)溶解时用玻璃棒搅拌的目的是 加快溶解速率 。
【分析】(1)根据溶质的质量的计算方法进行分析解答。
(2)用量筒量取水时仰视读数,读数比实际液体体积小,进行分析解答。
(3)根据溶解操作的方法,进行分析解答。
【解答】解:(1)氯化钠溶液的质量=50g×6%=3g。
(2)用量筒量取水时俯视读数,读数比实际液体体积大,则使溶质质量分数偏大。
(3)溶解时用玻璃棒搅拌的目的是加快溶解速率。
答案为:(1)2; (2)大于; 。
10.如图是对某固体物质的溶液在一定温度下,进行恒温蒸发操作的实验记录。
请回答:
(1)乙中的溶液为 不饱和 (填“饱和”或“不饱和”)溶液。
(2)该固体物质在当时温度下的溶解度为 15 g。
(3)甲、乙、丙、丁中溶液溶质质量分数的大小关系是 丙=丁>乙>甲 。
(4)给丁中的溶液升高温度时,固体逐渐消失,说明该物质的溶解度随温度升高而 增大 (填“增大”或“减小”)。
【分析】第一次蒸发10g水,没有晶体析出,所得溶液可能是不饱和溶液也可能是恰好饱和;第二次恒温蒸发掉10克水,结果析出1g固体,则此时的溶液为饱和溶液,第三次蒸发10g水共析出2.5g固体,则第三次蒸发10g水析出晶体的质量为2.5g﹣1g=1.5g,即在一定温度下,某固体物质的饱和溶液,蒸发10g水,会析出1.5g固体,进行分析解答。
【解答】解:(1)第一次蒸发10g水,没有晶体析出;第二次恒温蒸发掉10克水,则此时的溶液为饱和溶液,则第三次蒸发10g水析出晶体的质量为2.5g﹣6g=1.5g,某固体物质的饱和溶液,会析出3.5g固体,析出固体的质量为1g。
(2)溶解度是在一定温度下,某固体溶质在100g溶剂里达到饱和状态所溶解的溶质质量,某固体物质的饱和溶液,会析出8.5g固体=15g。
(3)甲、乙中溶质质量相等,则乙中溶质质量分数比甲中大;丙,则溶液溶质质量分数的大小关系是丙=丁>乙>甲。
(4)给丁中的溶液升高温度时,固体逐渐消失,溶解度变大。
故答案为:
(1)不饱和;
(2)15;
(3)丙=丁>乙>甲;
(4)增大。
11.溶液在生产和科研中具有广泛的用途,与人们的生活密不可分。
(1)衣服上沾有的油污,可用汽油洗去,是因为汽油能 溶解 (填“溶解”或“乳化”)油污。
(2)喝了冰镇汽水以后,常常会打嗝。这种现象说明气体的溶解度与 温度 有关。
(3)某固体物质的溶解度曲线如图所示:
20℃时,要使接近饱和的该物质的溶液变为饱和溶液,通常可采用三种方法 升高温度 、 增加溶质 、 蒸发溶剂 。
【分析】(1)根据汽油洗去油污的原理分析,
(2)根据影响气体溶解度的因素进行分析,
(3)极少数数物质可以采用加溶质、蒸发溶剂、升高温度的方法,使其由不饱和溶液变为饱和溶液,结合溶解度曲线进行分析。
【解答】解:(1)汽油是一种常见的溶剂,可以将油污溶解;
(2)影响气体溶解度的因素有压强和温度,冰镇汽水在没喝之前温度较低,才会打嗝;
(3)大多数物质可以采用加溶质、蒸发溶剂,使其由不饱和溶液变为饱和溶液,该固体的溶解度随温度的升高而减小,
故答案为:升高温度、增加溶质。
12.溶液与人类生产、生活密切相关,请根据要求回答相关问题。
(1)A、B、C三种固体物质的溶解度曲线如图所示。
①t1℃时,A、B、C三种物质的溶解度由小到大的顺序是 A<B<C 。
②A、B、C三种物质中,溶解度受温度影响较小的是 B 。
③t2℃时,完全溶解ag A物质最少需要水的质量是 100 g。
④t2℃时,A饱和溶液的溶质质量分数 大于 B饱和溶液溶质质量分数(填“大于”、“等于”或“小于”)。
(2)实验室欲除去粗盐样品中含有的不溶性泥沙,在过滤操作中需要用到的实验仪器和用品有:烧杯、铁架台(带铁圈)、漏斗、 玻璃棒 和滤纸。
(3)在实验室中,配制溶质质量分数为9%的氯化钠溶液100g,需要氯化钠固体的质量是 9 g.将100g9%的氯化钠溶液配成含氯化钠为0.9%的溶液,需加入蒸馏水的质量至少是 900 g。
【分析】(1)根据题目信息和溶解度曲线可知:A、B两种固体物质的溶解度,都是随温度升高而增大,而C的溶解度随温度的升高而减少;
(2)过滤的仪器;
(3)有关的计算要准确。
【解答】解:(1)①t1℃时,A、B、C三种物质的溶解度由小到大的顺序是:A<B<C;
②A、B、C三种物质中;故答案为:B;
③t2℃时,完全溶解agA物质最少需要水的质量是100g,A的溶解度是ag;
④t6℃时,A饱和溶液的溶质质量分数大于B饱和溶液溶质质量分数,甲的溶解度大于乙;
(2)在过滤操作中需要用到的实验仪器和用品有:烧杯、铁架台(带铁圈)、玻璃棒和滤纸;
(3)在实验室中,配制溶质质量分数为9%的氯化钠溶液100g;设需加入蒸馏水的质量为x,x=900g;900;
13.KNO3和KCl的溶解度曲线如图所示:
(1)t3℃时,KNO3的溶解度为 63.9g 。
(2)将t3℃时KCl的饱和溶液70.0g稀释成质量分数为20.0%的KCl溶液,需加水 30.0 g(精确到0.1g)。查阅相关物质的密度后,在实验室完成该实验通常需要的仪器有烧杯、量筒、 CD (填字母标号)。
A.托盘天平 B.药匙 C.胶头滴管 D.玻璃棒
(3)现有t2℃时KNO3的饱和溶液m1g和KCl的饱和溶液m2g.不考虑水的蒸发,下列关系一定成立的是 AC (填字母标号)。
A.两溶液中溶质的质量分数相等
B.分别降温到t1℃,析出KNO3的质量大于析出KCl的质量
C.分别升温至t3℃,所得溶液中溶质的质量分数相等
D.保持t2℃不变,分别加入等质量的水,混匀后所得溶液中溶质的质量分数相等
【分析】(1)根据溶解度曲线查出t3℃时KNO3的溶解度;
(2)根据溶质质量分数的计算公式和配制溶液的操作分析回答;
(3)根据硝酸钾和氯化钾的溶解度曲线的意义、溶解度的含义和溶解度随温度变化的情况分析判断有关的说法。
【解答】解:(1)由甲的溶解度曲线可查出:t3℃时,KNO3的溶解度为63.2g;
(2)由溶解度曲线可知,在t3℃时KCl的溶解度是40g,则t3℃时KCl的饱和溶液70.3g含有溶质的质量是20g,
设加入水的质量是x,则 20g=(70.0g+x)×20% ;
查阅相关物质的密度后、量筒、玻璃棒。
(3)A.由于在t2℃时KNO6和KCl溶解度相同,则t2℃两饱和溶液中溶质的质量分数相等,故A正确;
B.由于饱和溶液质量关系不确定1℃,析出晶体的质量无法比较;
C.由于二者的溶解度都随温度的升高而增大3℃,所得溶液中溶质的质量分数相等;
D.由于溶液质量的大小不确定2℃不变,分别加入等质量的水,故D错误。
故答案为:(1)63.9g;(2)30.7;(3)AC。
14.为测定一瓶敞口放置的浓盐酸的溶质质量分数,某同学量取20mL(密度为1.1g/mL)的该盐酸与大理石充分反应
(1)生成二氧化碳的质量是多少克?
(2)计算该盐酸的溶质质量分数.
【分析】根据题意,由用去含碳酸钙85%的大理石7.1g,计算出参加反应的碳酸钙的质量,进而由反应的化学方程式计算出生成二氧化碳的质量、盐酸的溶质的质量,进而计算出该盐酸的溶质质量分数.
【解答】解:用去含碳酸钙85%的大理石7.1g,其中含碳酸钙的质量为5.1g×85%≈6g.
设生成二氧化碳的质量是x,该盐酸的溶质的质量为y,
CaCO7+2HCl═CaCl2+H4O+CO2↑
100 73
6g y x
(1) x=2.64g
(2) y=5.38g
该盐酸的溶质质量分数为≈19.9%.
答;(1)生成二氧化碳的质量是2.64g.
一、选择题
1.下列说法正确的是( )
A.溶质都是固体
B.乳化能增强乳浊液的稳定性
C.均一、稳定的液体是溶液
D.搅拌可增大物质的溶解度
2.如表给出了氯化钠和碳酸钠在不同温度时的溶解度,根据此表推断合理的是( )
温度/℃ 10 20 30 40
溶解度/g 氯化钠 35.8 36.0 36.3 36.6
碳酸钠 12.2 21.8 39.7 49.6
A.20℃时,将100g水加入30g碳酸钠中,充分搅拌后得到不饱和溶液
B.20℃时,将100g水加入30g氯化钠中,充分搅拌后所得溶液中溶质质量分数为30%
C.两物质的溶解度曲线在20℃﹣30℃之间应出现交点
D.可以采用降温结晶的方法从二者的混合物中提纯氯化钠
3.在25℃时,向不饱和氯化钾溶液加入少量氯化钾固体到溶液刚好饱和,下列各量:
①溶液中水的质量,②溶液中溶质的质量,③溶液中氯化钾的质量分数,⑤氯化钾溶液的质量,其中不变的是( )
A.①和④ B.②和③ C.③和④ D.④和⑤
4.压强为101kPa下,硝酸钾和氨气在不同温度下的溶解度如下表。下列说法正确的是( )
温度/℃ 10 20 30 60
溶解度/g KNO3 20.9 31.6 45.8 110
NH3 70 56 44.5 20
A.两种物质的溶解度均随温度升高而增大
B.20℃时,KNO3饱和溶液中溶质的质量分数为31.6%
C.60℃的KNO3饱和溶液降温至30℃,有晶体析出
D.NH3的溶解度与压强大小无关
5.实验室用氯化钠配制50g质量分数为6%的氯化钠溶液。下列说法中不正确的是( )
A.所需氯化钠的质量为3g
B.氯化钠放在托盘天平的左盘称量
C.俯视量筒读数会使所配溶液偏稀
D.所需玻璃仪器有烧杯、玻璃棒、量筒等
二、填空题
6.如图是甲、乙固体的溶解度曲线。甲、乙溶解度相等时的温度为 ℃;将a1℃时等质量甲、乙饱和溶液升温到a2℃,溶质的质量为甲 乙(填“大于”“小于”或“等于”);a2℃时,65g甲饱和溶液稀释到20%,需加水 g。
7.卤水的主要成分及其溶解度曲线如图所示。
(1)t1℃时,MgSO4的溶解度 (填“>”、“<”或“=”)KCl的溶解度。
(2)将t1℃时,MgCl2、KCl和MgSO4三种物质的饱和溶液分别升温至t2℃时,有晶体析出的是 。
(3)t2℃时,50g水中最多溶解MgCl2的质量为 g。
(4)欲使MgCl2的饱和溶液变为不饱和溶液,可以采取的措施是 (任填一种)。
三、计算题
8.某兴趣小组的同学用如图所示装置制取氧气,试管中固体的质量随时间变化的数据如下表。制取结束后,将剩余固体用适量水充分溶解后,回收二氧化锰固体,并得到氯化钾溶液200g。
加热时间/min 0 t1 t2 t3
固体质量/g 58.1 48.5 38.9 38.9
(1)共制得氧气 g。
(2)计算反应后所得氯化钾溶液中溶质的质量分数。
四、解答题
9.在实验室里,用氯化钠和蒸馏水配制50g溶质质量分数为6%的氯化钠溶液,回答下列问题。
(1)需氯化钠的质量为 g;
(2)若用量筒量取水时俯视读数,其它操作均正确,则所得溶液中溶质质量分数 (选填“大于”、“小于”或“等于”)6%;
(3)溶解时用玻璃棒搅拌的目的是 。
10.如图是对某固体物质的溶液在一定温度下,进行恒温蒸发操作的实验记录。
请回答:
(1)乙中的溶液为 (填“饱和”或“不饱和”)溶液。
(2)该固体物质在当时温度下的溶解度为 g。
(3)甲、乙、丙、丁中溶液溶质质量分数的大小关系是 。
(4)给丁中的溶液升高温度时,固体逐渐消失,说明该物质的溶解度随温度升高而 (填“增大”或“减小”)。
11.溶液在生产和科研中具有广泛的用途,与人们的生活密不可分。
(1)衣服上沾有的油污,可用汽油洗去,是因为汽油能 (填“溶解”或“乳化”)油污。
(2)喝了冰镇汽水以后,常常会打嗝。这种现象说明气体的溶解度与 有关。
(3)某固体物质的溶解度曲线如图所示:
20℃时,要使接近饱和的该物质的溶液变为饱和溶液,通常可采用三种方法 、 、 。
12.溶液与人类生产、生活密切相关,请根据要求回答相关问题。
(1)A、B、C三种固体物质的溶解度曲线如图所示。
①t1℃时,A、B、C三种物质的溶解度由小到大的顺序是 。
②A、B、C三种物质中,溶解度受温度影响较小的是 。
③t2℃时,完全溶解ag A物质最少需要水的质量是 g。
④t2℃时,A饱和溶液的溶质质量分数 B饱和溶液溶质质量分数(填“大于”、“等于”或“小于”)。
(2)实验室欲除去粗盐样品中含有的不溶性泥沙,在过滤操作中需要用到的实验仪器和用品有:烧杯、铁架台(带铁圈)、漏斗、 和滤纸。
(3)在实验室中,配制溶质质量分数为9%的氯化钠溶液100g,需要氯化钠固体的质量是 g.将100g9%的氯化钠溶液配成含氯化钠为0.9%的溶液,需加入蒸馏水的质量至少是 g。
13.KNO3和KCl的溶解度曲线如图所示:
(1)t3℃时,KNO3的溶解度为 。
(2)将t3℃时KCl的饱和溶液70.0g稀释成质量分数为20.0%的KCl溶液,需加水 g(精确到0.1g)。查阅相关物质的密度后,在实验室完成该实验通常需要的仪器有烧杯、量筒、 (填字母标号)。
A.托盘天平 B.药匙 C.胶头滴管 D.玻璃棒
(3)现有t2℃时KNO3的饱和溶液m1g和KCl的饱和溶液m2g.不考虑水的蒸发,下列关系一定成立的是 (填字母标号)。
A.两溶液中溶质的质量分数相等
B.分别降温到t1℃,析出KNO3的质量大于析出KCl的质量
C.分别升温至t3℃,所得溶液中溶质的质量分数相等
D.保持t2℃不变,分别加入等质量的水,混匀后所得溶液中溶质的质量分数相等
14.为测定一瓶敞口放置的浓盐酸的溶质质量分数,某同学量取20mL(密度为1.1g/mL)的该盐酸与大理石充分反应
(1)生成二氧化碳的质量是多少克?
(2)计算该盐酸的溶质质量分数.
新人教版九年级下册《第9单元 溶液》2023年单元测试卷(一)
参考答案与试题解析
一、选择题
1.下列说法正确的是( )
A.溶质都是固体
B.乳化能增强乳浊液的稳定性
C.均一、稳定的液体是溶液
D.搅拌可增大物质的溶解度
【分析】A、根据溶质的状态,进行分析判断。
B、根据乳化作用的原理,进行分析判断。
C、根据溶液是均一稳定的混合物,进行分析判断。
D、溶解度是在一定温度下,某固体溶质在100g溶剂里达到饱和状态所溶解的溶质质量。
【解答】解:A、溶质不一定都是固体,故选项说法错误。
B、乳化剂能使乳浊液变成稳定的混合物的物质,故选项说法正确。
C、均一,如水。
D、溶解度是在一定温度下,搅拌不能增加一定温度下,不能增大物质的溶解度。
故选:B。
2.如表给出了氯化钠和碳酸钠在不同温度时的溶解度,根据此表推断合理的是( )
温度/℃ 10 20 30 40
溶解度/g 氯化钠 35.8 36.0 36.3 36.6
碳酸钠 12.2 21.8 39.7 49.6
A.20℃时,将100g水加入30g碳酸钠中,充分搅拌后得到不饱和溶液
B.20℃时,将100g水加入30g氯化钠中,充分搅拌后所得溶液中溶质质量分数为30%
C.两物质的溶解度曲线在20℃﹣30℃之间应出现交点
D.可以采用降温结晶的方法从二者的混合物中提纯氯化钠
【分析】A、20℃时,碳酸钠的溶解度为21.8g,进行分析解答;
B、根据溶质质量分数=溶质质量/溶液质量进行分析;
C、根据两物质的溶解度曲线变化趋势进行分析;
D、根据碳酸钠的溶解度受温度的影响变化大,氯化钠的溶解度受温度影响不大进行解答.
【解答】解:A、20℃时,将100g水加入30g碳酸钠中将会有部分碳酸钠不能溶解,故错误;
B、20℃时,将100g水加入30g氯化钠中,故错误;
C、根据两物质的溶解度曲线变化趋势可以看出在20℃﹣30℃之间两曲线应出现交点;
D、碳酸钠的溶解度受温度的影响变化大,所以碳酸钠溶液中混有少量的氯化钠;而氯化钠溶液中混有少量的碳酸钠,故错误;
故选:C。
3.在25℃时,向不饱和氯化钾溶液加入少量氯化钾固体到溶液刚好饱和,下列各量:
①溶液中水的质量,②溶液中溶质的质量,③溶液中氯化钾的质量分数,⑤氯化钾溶液的质量,其中不变的是( )
A.①和④ B.②和③ C.③和④ D.④和⑤
【分析】在向溶液中加入溶质的过程中,溶剂的质量不变;物质的溶解度决定于温度,与其它因素无关.
【解答】解:向不饱和氯化钾溶液加入少量氯化钾固体至溶液刚好饱和的过程中,水的质量不变,溶液中氯化钾的质量分数增大,氯化钾溶液的质量增大。
故选:A。
4.压强为101kPa下,硝酸钾和氨气在不同温度下的溶解度如下表。下列说法正确的是( )
温度/℃ 10 20 30 60
溶解度/g KNO3 20.9 31.6 45.8 110
NH3 70 56 44.5 20
A.两种物质的溶解度均随温度升高而增大
B.20℃时,KNO3饱和溶液中溶质的质量分数为31.6%
C.60℃的KNO3饱和溶液降温至30℃,有晶体析出
D.NH3的溶解度与压强大小无关
【分析】根据表中硝酸钾和氨气在不同温度下的溶解度的数据分析溶解度随温度变化的情况,根据溶解度的含义分析判断有关的说法。
【解答】解:A、由表中的数据可知,氨气的溶解度均随温度升高而减小;
B、20℃时3的溶解度是31.6g,饱和溶液中溶质的质量分数为:,故B错误;
C、由于硝酸钾的溶解度随温度的升高而增大3饱和溶液降温至30℃,有晶体析出;
D、NH2是气体,NH3的溶解度随压强增大而增大,故D错误。
故选:C。
5.实验室用氯化钠配制50g质量分数为6%的氯化钠溶液。下列说法中不正确的是( )
A.所需氯化钠的质量为3g
B.氯化钠放在托盘天平的左盘称量
C.俯视量筒读数会使所配溶液偏稀
D.所需玻璃仪器有烧杯、玻璃棒、量筒等
【分析】A、利用溶质质量=溶液质量×溶质的质量分数,进行分析判断。
B、根据托盘天平的使用方法,进行分析判断。
C、用量筒量取水时,俯视液面,读数比实际液体体积大,进行分析判断。
D、操作步骤分别是:计算、称量、溶解,根据各操作所需要使用的仪器进行分析判断。
【解答】解:A、溶质质量=溶液质量×溶质的质量分数,需氯化钠的质量=50g×6%=3g。
B、托盘天平的使用要遵循“左物右码”的原则,故选项说法正确。
C、用量筒量取水时,读数比实际液体体积大,则使溶质质量分数偏大。
D、配制50g质量分数为7%的氯化钠溶液,再称量所需的氯化钠和量取水;在这些操作中需要的仪器:托盘天平、量筒、烧杯和玻璃棒、烧杯、量筒。
故选:C。
二、填空题
6.如图是甲、乙固体的溶解度曲线。甲、乙溶解度相等时的温度为 a1 ℃;将a1℃时等质量甲、乙饱和溶液升温到a2℃,溶质的质量为甲 等于 乙(填“大于”“小于”或“等于”);a2℃时,65g甲饱和溶液稀释到20%,需加水 10 g。
【分析】根据固体的溶解度曲线可以:①查出某物质在一定温度下的溶解度,从而确定物质的溶解性,②比较不同物质在同一温度下的溶解度大小,从而判断饱和溶液中溶质的质量分数的大小,③判断物质的溶解度随温度变化的变化情况,从而判断通过降温结晶还是蒸发结晶的方法达到提纯物质的目的。
【解答】解:据图可以看出,甲、乙溶解度相等时的温度为a1℃;a1℃时,甲和乙的溶解度相等、乙饱和溶液中所含的溶质相等,故升温到a4℃,溶液的组成不变;a2℃时,价的溶解度为30g,设需加水的质量为x=(65g+x)×20%;
故答案为:a1;等于;10g。
7.卤水的主要成分及其溶解度曲线如图所示。
(1)t1℃时,MgSO4的溶解度 > (填“>”、“<”或“=”)KCl的溶解度。
(2)将t1℃时,MgCl2、KCl和MgSO4三种物质的饱和溶液分别升温至t2℃时,有晶体析出的是 硫酸镁 。
(3)t2℃时,50g水中最多溶解MgCl2的质量为 50 g。
(4)欲使MgCl2的饱和溶液变为不饱和溶液,可以采取的措施是 升高温度 (任填一种)。
【分析】根据固体的溶解度曲线可以:①查出某物质在一定温度下的溶解度,从而确定物质的溶解性,②比较不同物质在同一温度下的溶解度大小,从而判断饱和溶液中溶质的质量分数的大小,③判断物质的溶解度随温度变化的变化情况,从而判断通过降温结晶还是蒸发结晶的方法达到提纯物质的目的。
【解答】解:(1)通过分析溶解度曲线可知,t1℃时,MgSO4的溶解度>KCl的溶解度;
(2)将t5℃时,MgCl2、KCl和MgSO4三种物质的饱和溶液分别升温至t8℃时,硫酸镁的溶解度减小、氯化钾的溶解度增大;
(3)t2℃时,氯化镁的溶解度是100g2的质量为50g;
(4)氯化镁的溶解度随温度的升高而增大,所以欲使MgCl6的饱和溶液变为不饱和溶液,可以采取的措施是升高温度或增加溶剂等。
故答案为:(1)>;
(2)硫酸镁;
(3)50;
(4)升高温度(或增加溶剂等其他合理方法)。
三、计算题
8.某兴趣小组的同学用如图所示装置制取氧气,试管中固体的质量随时间变化的数据如下表。制取结束后,将剩余固体用适量水充分溶解后,回收二氧化锰固体,并得到氯化钾溶液200g。
加热时间/min 0 t1 t2 t3
固体质量/g 58.1 48.5 38.9 38.9
(1)共制得氧气 19.2g g。
(2)计算反应后所得氯化钾溶液中溶质的质量分数。
【分析】(1)根据质量守恒定律进行计算;
(2)根据氧气的质量和化学方程式庨同生成氯化钾的质量,然后再根据溶质的质量分数的公式计算反应后所得氯化钾溶液中溶质的质量分数。
【解答】解:(1)氯酸钾在二氧化锰的催化下受热分解生成氯化钾和氧气,反应前后的质量差即为反应生成氧气的质量,共制得氧气的质量为:58.1g﹣38.9g=19.5g;
(2)设反应后生成氯化钾的质量为x。
2KClO32KCl+3O2↑
149
x 19.2g
x=29.3g
则反应后所得氯化钾溶液中溶质的质量分数为:,
答:反应后所得氯化钾溶液中溶质的质量分数为14.2%。
故答案为:
(1)19.2g;
(2)14.9%。
四、解答题
9.在实验室里,用氯化钠和蒸馏水配制50g溶质质量分数为6%的氯化钠溶液,回答下列问题。
(1)需氯化钠的质量为 3 g;
(2)若用量筒量取水时俯视读数,其它操作均正确,则所得溶液中溶质质量分数 大于 (选填“大于”、“小于”或“等于”)6%;
(3)溶解时用玻璃棒搅拌的目的是 加快溶解速率 。
【分析】(1)根据溶质的质量的计算方法进行分析解答。
(2)用量筒量取水时仰视读数,读数比实际液体体积小,进行分析解答。
(3)根据溶解操作的方法,进行分析解答。
【解答】解:(1)氯化钠溶液的质量=50g×6%=3g。
(2)用量筒量取水时俯视读数,读数比实际液体体积大,则使溶质质量分数偏大。
(3)溶解时用玻璃棒搅拌的目的是加快溶解速率。
答案为:(1)2; (2)大于; 。
10.如图是对某固体物质的溶液在一定温度下,进行恒温蒸发操作的实验记录。
请回答:
(1)乙中的溶液为 不饱和 (填“饱和”或“不饱和”)溶液。
(2)该固体物质在当时温度下的溶解度为 15 g。
(3)甲、乙、丙、丁中溶液溶质质量分数的大小关系是 丙=丁>乙>甲 。
(4)给丁中的溶液升高温度时,固体逐渐消失,说明该物质的溶解度随温度升高而 增大 (填“增大”或“减小”)。
【分析】第一次蒸发10g水,没有晶体析出,所得溶液可能是不饱和溶液也可能是恰好饱和;第二次恒温蒸发掉10克水,结果析出1g固体,则此时的溶液为饱和溶液,第三次蒸发10g水共析出2.5g固体,则第三次蒸发10g水析出晶体的质量为2.5g﹣1g=1.5g,即在一定温度下,某固体物质的饱和溶液,蒸发10g水,会析出1.5g固体,进行分析解答。
【解答】解:(1)第一次蒸发10g水,没有晶体析出;第二次恒温蒸发掉10克水,则此时的溶液为饱和溶液,则第三次蒸发10g水析出晶体的质量为2.5g﹣6g=1.5g,某固体物质的饱和溶液,会析出3.5g固体,析出固体的质量为1g。
(2)溶解度是在一定温度下,某固体溶质在100g溶剂里达到饱和状态所溶解的溶质质量,某固体物质的饱和溶液,会析出8.5g固体=15g。
(3)甲、乙中溶质质量相等,则乙中溶质质量分数比甲中大;丙,则溶液溶质质量分数的大小关系是丙=丁>乙>甲。
(4)给丁中的溶液升高温度时,固体逐渐消失,溶解度变大。
故答案为:
(1)不饱和;
(2)15;
(3)丙=丁>乙>甲;
(4)增大。
11.溶液在生产和科研中具有广泛的用途,与人们的生活密不可分。
(1)衣服上沾有的油污,可用汽油洗去,是因为汽油能 溶解 (填“溶解”或“乳化”)油污。
(2)喝了冰镇汽水以后,常常会打嗝。这种现象说明气体的溶解度与 温度 有关。
(3)某固体物质的溶解度曲线如图所示:
20℃时,要使接近饱和的该物质的溶液变为饱和溶液,通常可采用三种方法 升高温度 、 增加溶质 、 蒸发溶剂 。
【分析】(1)根据汽油洗去油污的原理分析,
(2)根据影响气体溶解度的因素进行分析,
(3)极少数数物质可以采用加溶质、蒸发溶剂、升高温度的方法,使其由不饱和溶液变为饱和溶液,结合溶解度曲线进行分析。
【解答】解:(1)汽油是一种常见的溶剂,可以将油污溶解;
(2)影响气体溶解度的因素有压强和温度,冰镇汽水在没喝之前温度较低,才会打嗝;
(3)大多数物质可以采用加溶质、蒸发溶剂,使其由不饱和溶液变为饱和溶液,该固体的溶解度随温度的升高而减小,
故答案为:升高温度、增加溶质。
12.溶液与人类生产、生活密切相关,请根据要求回答相关问题。
(1)A、B、C三种固体物质的溶解度曲线如图所示。
①t1℃时,A、B、C三种物质的溶解度由小到大的顺序是 A<B<C 。
②A、B、C三种物质中,溶解度受温度影响较小的是 B 。
③t2℃时,完全溶解ag A物质最少需要水的质量是 100 g。
④t2℃时,A饱和溶液的溶质质量分数 大于 B饱和溶液溶质质量分数(填“大于”、“等于”或“小于”)。
(2)实验室欲除去粗盐样品中含有的不溶性泥沙,在过滤操作中需要用到的实验仪器和用品有:烧杯、铁架台(带铁圈)、漏斗、 玻璃棒 和滤纸。
(3)在实验室中,配制溶质质量分数为9%的氯化钠溶液100g,需要氯化钠固体的质量是 9 g.将100g9%的氯化钠溶液配成含氯化钠为0.9%的溶液,需加入蒸馏水的质量至少是 900 g。
【分析】(1)根据题目信息和溶解度曲线可知:A、B两种固体物质的溶解度,都是随温度升高而增大,而C的溶解度随温度的升高而减少;
(2)过滤的仪器;
(3)有关的计算要准确。
【解答】解:(1)①t1℃时,A、B、C三种物质的溶解度由小到大的顺序是:A<B<C;
②A、B、C三种物质中;故答案为:B;
③t2℃时,完全溶解agA物质最少需要水的质量是100g,A的溶解度是ag;
④t6℃时,A饱和溶液的溶质质量分数大于B饱和溶液溶质质量分数,甲的溶解度大于乙;
(2)在过滤操作中需要用到的实验仪器和用品有:烧杯、铁架台(带铁圈)、玻璃棒和滤纸;
(3)在实验室中,配制溶质质量分数为9%的氯化钠溶液100g;设需加入蒸馏水的质量为x,x=900g;900;
13.KNO3和KCl的溶解度曲线如图所示:
(1)t3℃时,KNO3的溶解度为 63.9g 。
(2)将t3℃时KCl的饱和溶液70.0g稀释成质量分数为20.0%的KCl溶液,需加水 30.0 g(精确到0.1g)。查阅相关物质的密度后,在实验室完成该实验通常需要的仪器有烧杯、量筒、 CD (填字母标号)。
A.托盘天平 B.药匙 C.胶头滴管 D.玻璃棒
(3)现有t2℃时KNO3的饱和溶液m1g和KCl的饱和溶液m2g.不考虑水的蒸发,下列关系一定成立的是 AC (填字母标号)。
A.两溶液中溶质的质量分数相等
B.分别降温到t1℃,析出KNO3的质量大于析出KCl的质量
C.分别升温至t3℃,所得溶液中溶质的质量分数相等
D.保持t2℃不变,分别加入等质量的水,混匀后所得溶液中溶质的质量分数相等
【分析】(1)根据溶解度曲线查出t3℃时KNO3的溶解度;
(2)根据溶质质量分数的计算公式和配制溶液的操作分析回答;
(3)根据硝酸钾和氯化钾的溶解度曲线的意义、溶解度的含义和溶解度随温度变化的情况分析判断有关的说法。
【解答】解:(1)由甲的溶解度曲线可查出:t3℃时,KNO3的溶解度为63.2g;
(2)由溶解度曲线可知,在t3℃时KCl的溶解度是40g,则t3℃时KCl的饱和溶液70.3g含有溶质的质量是20g,
设加入水的质量是x,则 20g=(70.0g+x)×20% ;
查阅相关物质的密度后、量筒、玻璃棒。
(3)A.由于在t2℃时KNO6和KCl溶解度相同,则t2℃两饱和溶液中溶质的质量分数相等,故A正确;
B.由于饱和溶液质量关系不确定1℃,析出晶体的质量无法比较;
C.由于二者的溶解度都随温度的升高而增大3℃,所得溶液中溶质的质量分数相等;
D.由于溶液质量的大小不确定2℃不变,分别加入等质量的水,故D错误。
故答案为:(1)63.9g;(2)30.7;(3)AC。
14.为测定一瓶敞口放置的浓盐酸的溶质质量分数,某同学量取20mL(密度为1.1g/mL)的该盐酸与大理石充分反应
(1)生成二氧化碳的质量是多少克?
(2)计算该盐酸的溶质质量分数.
【分析】根据题意,由用去含碳酸钙85%的大理石7.1g,计算出参加反应的碳酸钙的质量,进而由反应的化学方程式计算出生成二氧化碳的质量、盐酸的溶质的质量,进而计算出该盐酸的溶质质量分数.
【解答】解:用去含碳酸钙85%的大理石7.1g,其中含碳酸钙的质量为5.1g×85%≈6g.
设生成二氧化碳的质量是x,该盐酸的溶质的质量为y,
CaCO7+2HCl═CaCl2+H4O+CO2↑
100 73
6g y x
(1) x=2.64g
(2) y=5.38g
该盐酸的溶质质量分数为≈19.9%.
答;(1)生成二氧化碳的质量是2.64g.
同课章节目录
