2024年中考化学二轮复习专题《遇见“去污除垢”预见化学新颜》 课件(共41张PPT)
文档属性
| 名称 | 2024年中考化学二轮复习专题《遇见“去污除垢”预见化学新颜》 课件(共41张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 16.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-16 18:18:23 | ||
图片预览




文档简介
(共41张PPT)
遇见“去污除垢” 预见化学新颜
酸碱盐主题复习
活动元一 酸碱盐性质及复分解反应
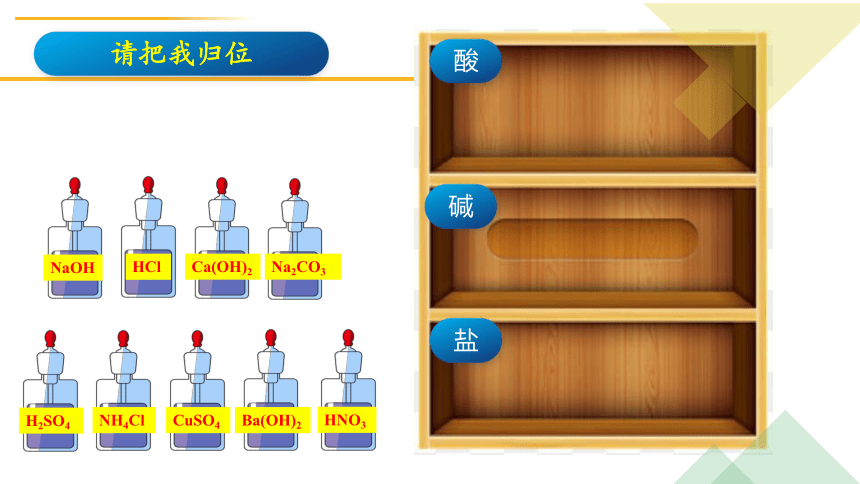
NaOH
HCl
Ca(OH)2
Na2CO3
H2SO4
NH4Cl
CuSO4
Ba(OH)2
HNO3
碱
盐
酸
请把我归位
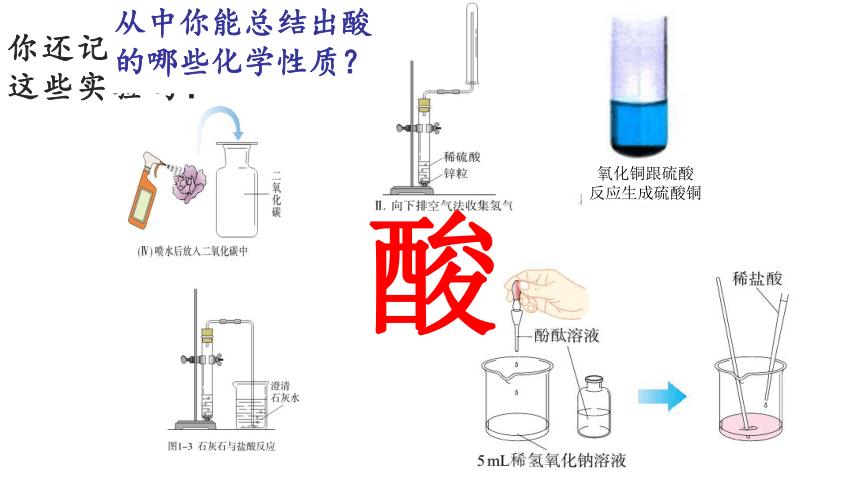
你还记得
这些实验吗?
酸
氧化铜跟硫酸
反应生成硫酸铜
你能写出有关的
反应方程式吗?
从中你能总结出酸的哪些化学性质?
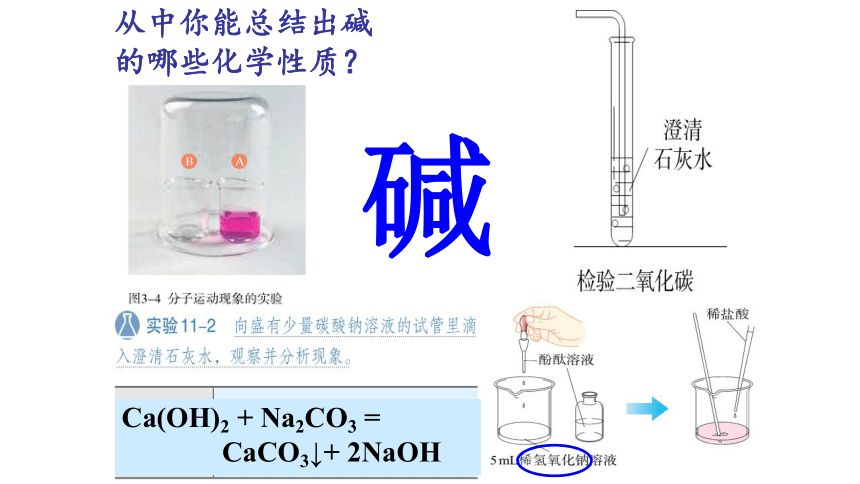
碱
请回忆,我们做过的哪些实验用到过碱?
你能写出有关的
反应方程式吗?
从中你能总结出碱的哪些化学性质?
Ca(OH)2 + Na2CO3 =
CaCO3↓+ 2NaOH
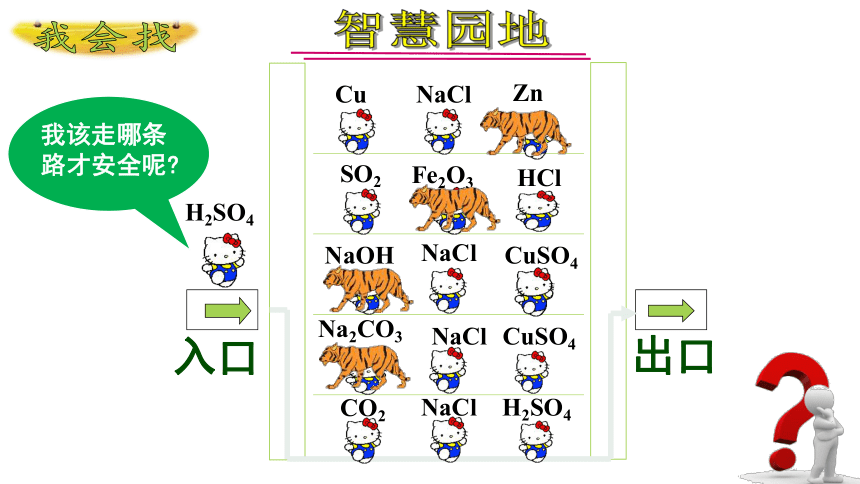
H2SO4
Cu
NaCl
SO2
CO2
NaCl
NaCl
NaCl
H2SO4
CuSO4
CuSO4
HCl
Zn
NaOH
Na2CO3
Fe2O3
入口
出口
我会找
我该走哪条路才安全呢
智慧园地
NaCl
Cu
KOH
NaCl
NaOH
Cu
Fe2O3
Cu
NaCl
Fe2O3
Fe2O3
NaCl
Cu
CuSO4
NaOH
CO2
HCl
CuSO4
入口
出口
我会找
我该走哪条路才安全呢
智慧园地
KCl
Cu
NaOH
NaCl
Na2CO3
CO
Fe3O4
Fe
NaCl
Fe2O3
CaCO3
NaCl
Cu
NaOH
HCl
Ca(OH)2
CaCl2
入口
出口
我会找
我该走哪条路才安全呢
智慧园地
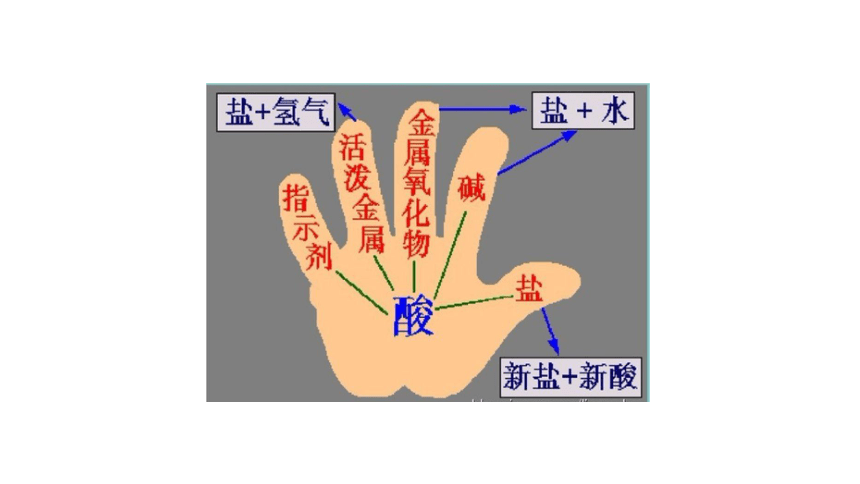
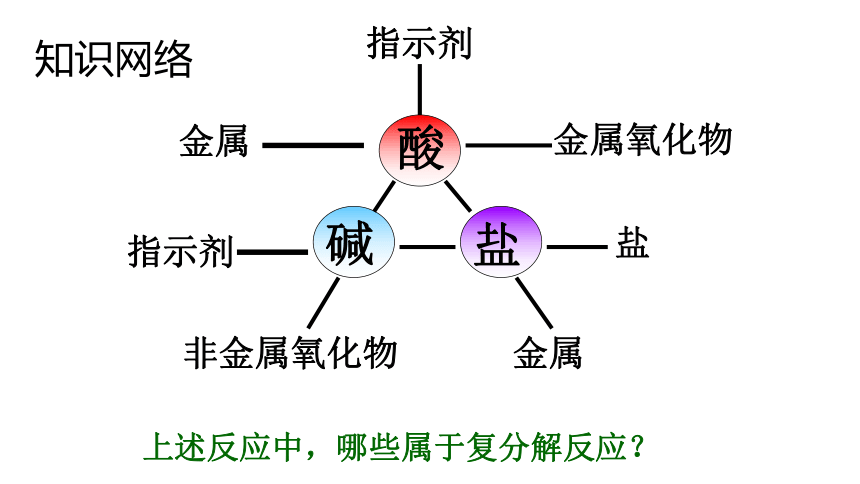
酸
碱
盐
金属
指示剂
金属氧化物
指示剂
非金属氧化物
盐
金属
知识网络
上述反应中,哪些属于复分解反应?
(1)概念:
由两种化合物互相交换成分,
生成另外两种化合物的反应
(2)表达式:
AB + CD = AD + CB
(3)特点:
双交换
价不变
巩固旧知
复分解反应
(4)发生的条件:
生成水或气体或沉淀
水务局
“淀”力局
气象局
小组实验
宏观辨识复分解反应发生的条件
8
9
: NaHCO3 、盐酸、
Na2CO3 、稀硫酸
小组实验
实验药品
实验 试剂一 试剂二 实验现象 化学方程式 生成物的共同特点
1 NaHCO3 盐酸
2 Na2CO3 稀硫酸
气象局
10
:CuSO4、NaOH、
Na2CO3 、Ca(OH)2
小组实验
实验药品
实验 试剂一 试剂二 实验现象 化学方程式 生成物的共同特点
1 CuSO4 NaOH
2 Na2CO3 Ca(OH)2
“淀”力局
11
: NaOH溶液、盐酸、
CuSO4溶液、稀硫酸
小组实验
实验药品
实验 试剂一 试剂二 实验现象 化学方程式 生成物的共同特点
1 NaOH 盐酸
2 Cu(OH)2 稀硫酸
水务局
温馨提示:1、请注意实验操作的规范性和实验安全。
2、时间:3min
实验步骤:
1. 在试管中先加入 2 mL 试剂一
2. 再加入2mL 试剂二
3. 观察实验现象并做好实验记录。
小组实验
12
宏观辨识
问1
如何证明无明显现象的中和反应的发生?
实验现象分析
13
问2
改进后试剂的加入顺序为
微观动画
微观探析复分解反应发生的实质
图1 KNO3 和NaCl反应微观示意图
17
从离子的角度分析复分解反应的实质
HCl + NaOH ==== NaCl + H2O
Na+
OH-
H+
Cl-
H2O
实 质:
当反应物中所含离子之间结合有水生成时,复分解反应能够发生
拓展提升
复分解反应的实质
H2O
Na2CO3 + 2HCl====2NaCl + H2O + CO2↑
Na+
Na+
CO32-
Cl-
H+
Cl-
H+
CO2
实 质:
当反应物中所含离子之间结合有气体生成时,复分解反应能够发生。
拓展提升
复分解反应的实质
BaCl2 + K2SO4 === BaSO4↓ + 2KCl
Ba2+
SO42-
Cl-
Cl-
K+
K+
BaSO4
实 质:
当反应物中所含离子之间结合有沉淀生成时,复分解反应能够发生。
拓展提升
复分解反应的实质
微观探析
动画分析
小组讨论
复分解反应的微观实质是什么?
19
实质:离子+离子→水或沉淀或气体。
23
复分解反应的应用
活动元二 实验室除垢
1
给试管去除污垢
有三支试管其内壁分别沾有:氢氧化铜残留沉淀、铁粉生锈实验的残留痕迹、用石灰水检验CO2后的残留白色固体。请你运用所学知识,选择合适的清洗试剂,以便除去这些残留的污垢。
实验注意事项
记录试管序号 及加入的除垢试剂的名称;
加入除垢试剂的量为1-2mL,约一节手指高;
观察并记录现象;
除垢速度较慢时,可适当加热;
将洗涤液倒入废液缸1,后用蒸馏水冲洗试管。
2
3
5
4
1
洗净标准:
试管内壁的水既不聚集成滴,也不成股流下。
试管编号 1 2 3
污垢成分
去污试剂
实验现象
化学方程式
生成的可溶性物质
Cu(OH)2
Fe2O3
CaCO3
稀盐酸
稀盐酸
稀盐酸
蓝色沉淀消失,
溶液由无色变为蓝色
铁锈消失,
溶液由无色变为黄色
白色固体消失,
产生气泡
Cu(OH)2+2HCl=CuCl2+2H2O
Fe2O3+6HCl=2FeCl3+3H2O
CaCO3+2HCl=CaCl2+2H2O+CO2↑
CuCl2
FeCl3
CaCl2
活动元三 生活中除垢
生活中常见的污垢
水垢
(CaCO3、Mg(OH)2)
食醋
(CH3COOH)
油污
(油脂)
洗洁精
(阴离子表面活性剂)
超级洗油剂
(苛性钠)
乳化作用
化学反应
油脂+氢氧化钠----->高级脂肪酸钠+甘油
厕所中的污垢主要有尿碱、水锈及油污等,用什么清洗?
2
“洁厕灵”中离子检验
“洁厕灵”蓝色----
能除碱性污垢----
实验注意事项
选择加入的试剂;
2
观察并记录现象;
3
将洗涤液倒入废液缸2,后冲洗试管。
5
根据现象写出实验结论;
4
写出你想验证的离子;
1
含有Cu2+
含有H+
验证的离子
选择的试剂
实验现象
实验结论
其他方案
Cu2+
NaOH溶液
镁条
无明显现象,
没有产生蓝色沉淀
产生气泡
不存在Cu2+
存在H+
铁丝
pH试纸
H+
活动元四 生产中除垢
工业上废液处理
测试酸碱性
中 和
金属离子处理
沉 淀
3
对洗涤后的废液再研究
洗涤后的废液缸1中主要有哪些物质?
一定有:
可能有:
洗涤后的废液缸1中主要有哪些离子?
一定有:
可能有:
FeCl3
CuCl2
CaCl2
HCl
Fe3+
Cu2+
Ca2+
H+
污水成分 选择去污试剂
H+
Fe3+
Cu2+
Ca2+
测试酸碱性,若为酸性,加碱调pH
加入过量氢氧化钠溶液,使得Fe3+、Cu2+
完全沉淀
加入过量碳酸钠溶液,使得Ca2+完全沉淀
反应后溶液中剩余NaOH、Na2CO3,加入适量稀盐酸,反应生成NaCl
课堂小结
首先分析污垢的成分:
酸?碱?碳酸盐 金属氧化物?有机物?。。。。
选择恰当的去污除垢剂:
a.能溶于水的污垢,直接用 去除(溶解);
b.油污类污垢考虑 (乳化)或
去除(化学变化);
c.碱、金属氧化物、碳酸盐等污垢用 去除;
d.水中某些金属离子考虑用 将其沉降后除去。
去除污垢时注意自我防护
水
洗涤剂
碱性物质
稀盐酸
OH-/CO32-
谈谈你的收获
知识
操作
方法
疑问
遇见“去污除垢” 预见化学新颜
酸碱盐主题复习
活动元一 酸碱盐性质及复分解反应
NaOH
HCl
Ca(OH)2
Na2CO3
H2SO4
NH4Cl
CuSO4
Ba(OH)2
HNO3
碱
盐
酸
请把我归位
你还记得
这些实验吗?
酸
氧化铜跟硫酸
反应生成硫酸铜
你能写出有关的
反应方程式吗?
从中你能总结出酸的哪些化学性质?
碱
请回忆,我们做过的哪些实验用到过碱?
你能写出有关的
反应方程式吗?
从中你能总结出碱的哪些化学性质?
Ca(OH)2 + Na2CO3 =
CaCO3↓+ 2NaOH
H2SO4
Cu
NaCl
SO2
CO2
NaCl
NaCl
NaCl
H2SO4
CuSO4
CuSO4
HCl
Zn
NaOH
Na2CO3
Fe2O3
入口
出口
我会找
我该走哪条路才安全呢
智慧园地
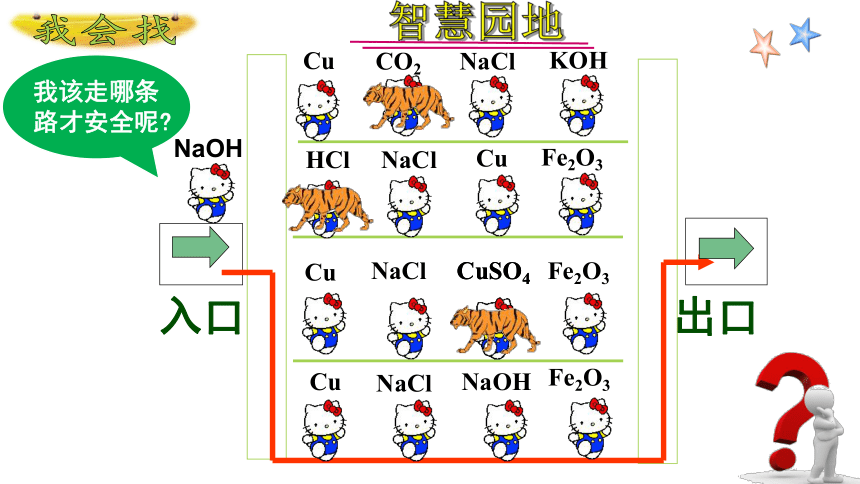
NaCl
Cu
KOH
NaCl
NaOH
Cu
Fe2O3
Cu
NaCl
Fe2O3
Fe2O3
NaCl
Cu
CuSO4
NaOH
CO2
HCl
CuSO4
入口
出口
我会找
我该走哪条路才安全呢
智慧园地
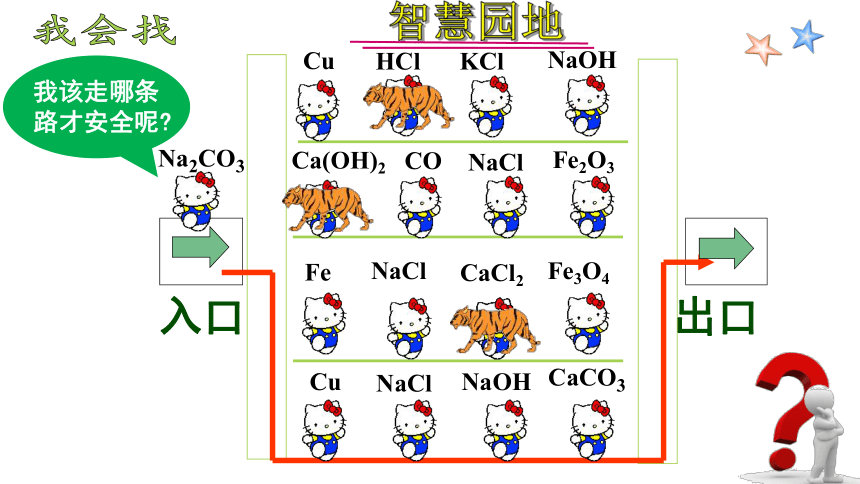
KCl
Cu
NaOH
NaCl
Na2CO3
CO
Fe3O4
Fe
NaCl
Fe2O3
CaCO3
NaCl
Cu
NaOH
HCl
Ca(OH)2
CaCl2
入口
出口
我会找
我该走哪条路才安全呢
智慧园地
酸
碱
盐
金属
指示剂
金属氧化物
指示剂
非金属氧化物
盐
金属
知识网络
上述反应中,哪些属于复分解反应?
(1)概念:
由两种化合物互相交换成分,
生成另外两种化合物的反应
(2)表达式:
AB + CD = AD + CB
(3)特点:
双交换
价不变
巩固旧知
复分解反应
(4)发生的条件:
生成水或气体或沉淀
水务局
“淀”力局
气象局
小组实验
宏观辨识复分解反应发生的条件
8
9
: NaHCO3 、盐酸、
Na2CO3 、稀硫酸
小组实验
实验药品
实验 试剂一 试剂二 实验现象 化学方程式 生成物的共同特点
1 NaHCO3 盐酸
2 Na2CO3 稀硫酸
气象局
10
:CuSO4、NaOH、
Na2CO3 、Ca(OH)2
小组实验
实验药品
实验 试剂一 试剂二 实验现象 化学方程式 生成物的共同特点
1 CuSO4 NaOH
2 Na2CO3 Ca(OH)2
“淀”力局
11
: NaOH溶液、盐酸、
CuSO4溶液、稀硫酸
小组实验
实验药品
实验 试剂一 试剂二 实验现象 化学方程式 生成物的共同特点
1 NaOH 盐酸
2 Cu(OH)2 稀硫酸
水务局
温馨提示:1、请注意实验操作的规范性和实验安全。
2、时间:3min
实验步骤:
1. 在试管中先加入 2 mL 试剂一
2. 再加入2mL 试剂二
3. 观察实验现象并做好实验记录。
小组实验
12
宏观辨识
问1
如何证明无明显现象的中和反应的发生?
实验现象分析
13
问2
改进后试剂的加入顺序为
微观动画
微观探析复分解反应发生的实质
图1 KNO3 和NaCl反应微观示意图
17
从离子的角度分析复分解反应的实质
HCl + NaOH ==== NaCl + H2O
Na+
OH-
H+
Cl-
H2O
实 质:
当反应物中所含离子之间结合有水生成时,复分解反应能够发生
拓展提升
复分解反应的实质
H2O
Na2CO3 + 2HCl====2NaCl + H2O + CO2↑
Na+
Na+
CO32-
Cl-
H+
Cl-
H+
CO2
实 质:
当反应物中所含离子之间结合有气体生成时,复分解反应能够发生。
拓展提升
复分解反应的实质
BaCl2 + K2SO4 === BaSO4↓ + 2KCl
Ba2+
SO42-
Cl-
Cl-
K+
K+
BaSO4
实 质:
当反应物中所含离子之间结合有沉淀生成时,复分解反应能够发生。
拓展提升
复分解反应的实质
微观探析
动画分析
小组讨论
复分解反应的微观实质是什么?
19
实质:离子+离子→水或沉淀或气体。
23
复分解反应的应用
活动元二 实验室除垢
1
给试管去除污垢
有三支试管其内壁分别沾有:氢氧化铜残留沉淀、铁粉生锈实验的残留痕迹、用石灰水检验CO2后的残留白色固体。请你运用所学知识,选择合适的清洗试剂,以便除去这些残留的污垢。
实验注意事项
记录试管序号 及加入的除垢试剂的名称;
加入除垢试剂的量为1-2mL,约一节手指高;
观察并记录现象;
除垢速度较慢时,可适当加热;
将洗涤液倒入废液缸1,后用蒸馏水冲洗试管。
2
3
5
4
1
洗净标准:
试管内壁的水既不聚集成滴,也不成股流下。
试管编号 1 2 3
污垢成分
去污试剂
实验现象
化学方程式
生成的可溶性物质
Cu(OH)2
Fe2O3
CaCO3
稀盐酸
稀盐酸
稀盐酸
蓝色沉淀消失,
溶液由无色变为蓝色
铁锈消失,
溶液由无色变为黄色
白色固体消失,
产生气泡
Cu(OH)2+2HCl=CuCl2+2H2O
Fe2O3+6HCl=2FeCl3+3H2O
CaCO3+2HCl=CaCl2+2H2O+CO2↑
CuCl2
FeCl3
CaCl2
活动元三 生活中除垢
生活中常见的污垢
水垢
(CaCO3、Mg(OH)2)
食醋
(CH3COOH)
油污
(油脂)
洗洁精
(阴离子表面活性剂)
超级洗油剂
(苛性钠)
乳化作用
化学反应
油脂+氢氧化钠----->高级脂肪酸钠+甘油
厕所中的污垢主要有尿碱、水锈及油污等,用什么清洗?
2
“洁厕灵”中离子检验
“洁厕灵”蓝色----
能除碱性污垢----
实验注意事项
选择加入的试剂;
2
观察并记录现象;
3
将洗涤液倒入废液缸2,后冲洗试管。
5
根据现象写出实验结论;
4
写出你想验证的离子;
1
含有Cu2+
含有H+
验证的离子
选择的试剂
实验现象
实验结论
其他方案
Cu2+
NaOH溶液
镁条
无明显现象,
没有产生蓝色沉淀
产生气泡
不存在Cu2+
存在H+
铁丝
pH试纸
H+
活动元四 生产中除垢
工业上废液处理
测试酸碱性
中 和
金属离子处理
沉 淀
3
对洗涤后的废液再研究
洗涤后的废液缸1中主要有哪些物质?
一定有:
可能有:
洗涤后的废液缸1中主要有哪些离子?
一定有:
可能有:
FeCl3
CuCl2
CaCl2
HCl
Fe3+
Cu2+
Ca2+
H+
污水成分 选择去污试剂
H+
Fe3+
Cu2+
Ca2+
测试酸碱性,若为酸性,加碱调pH
加入过量氢氧化钠溶液,使得Fe3+、Cu2+
完全沉淀
加入过量碳酸钠溶液,使得Ca2+完全沉淀
反应后溶液中剩余NaOH、Na2CO3,加入适量稀盐酸,反应生成NaCl
课堂小结
首先分析污垢的成分:
酸?碱?碳酸盐 金属氧化物?有机物?。。。。
选择恰当的去污除垢剂:
a.能溶于水的污垢,直接用 去除(溶解);
b.油污类污垢考虑 (乳化)或
去除(化学变化);
c.碱、金属氧化物、碳酸盐等污垢用 去除;
d.水中某些金属离子考虑用 将其沉降后除去。
去除污垢时注意自我防护
水
洗涤剂
碱性物质
稀盐酸
OH-/CO32-
谈谈你的收获
知识
操作
方法
疑问
同课章节目录
