2024届高三化学二轮复习专题突破练5:物质结构与元素周期律(含解析)
文档属性
| 名称 | 2024届高三化学二轮复习专题突破练5:物质结构与元素周期律(含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 298.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-16 18:01:14 | ||
图片预览



文档简介
专题突破练5 物质结构与元素周期律
一、基础练
1.(2023·沧州高三统考)用α粒子(即氦核He)轰击X产生H的核反应为He+X→Y+H。已知元素Y的氟化物分子的空间构型是正四面体形。下列说法正确的是( )
A.与X同周期的元素中,第一电离能小于X的元素有两个
B.原子半径:XC.一个X2Cl6分子中有两个配位键
D.3H和1H互为同素异形体
2.下列有关SO2、SO3、SO和SO的说法正确的是( )
A.SO中S原子的杂化方式为sp2
B.SO的空间构型为平面正方形
C.SO2分子中的键角小于SO3分子中的键角
D.SO3分子是极性分子
3.(2023·北京昌平区高三统考)下列对物质性质解释合理的是( )
选项 性质 解释
A 热稳定性:H2O(g)>H2S(g) H2O中存在氢键
B 熔点:晶体硅<碳化硅 碳化硅中分子间作用力较大
C 酸性:F-CH2-COOH>Cl-CH2-COOH 电负性:F>Cl
D 熔点:Br24.(2023·河北示范校三模)下列说法错误的是( )
A.阴离子的配位数:CsCl晶体>NaCl晶体>CaF2晶体
B.BF3与NH3可通过配位键形成氨合三氟化硼(BF3·NH3)
C.H3BO3和H3PO3均为三元弱酸,分子结构式均为
D.基态氧原子的电子排布图(轨道表示式)为
5.(2023·全国甲卷)W、X、Y、Z为短周期主族元素,原子序数依次增大,最外层电子数之和为19。Y的最外层电子数与其K层电子数相等,WX2是形成酸雨的物质之一。下列说法正确的是( )
A.原子半径:X>W
B.简单氢化物的沸点:XC.Y与X可形成离子化合物
D.Z的最高价含氧酸是弱酸
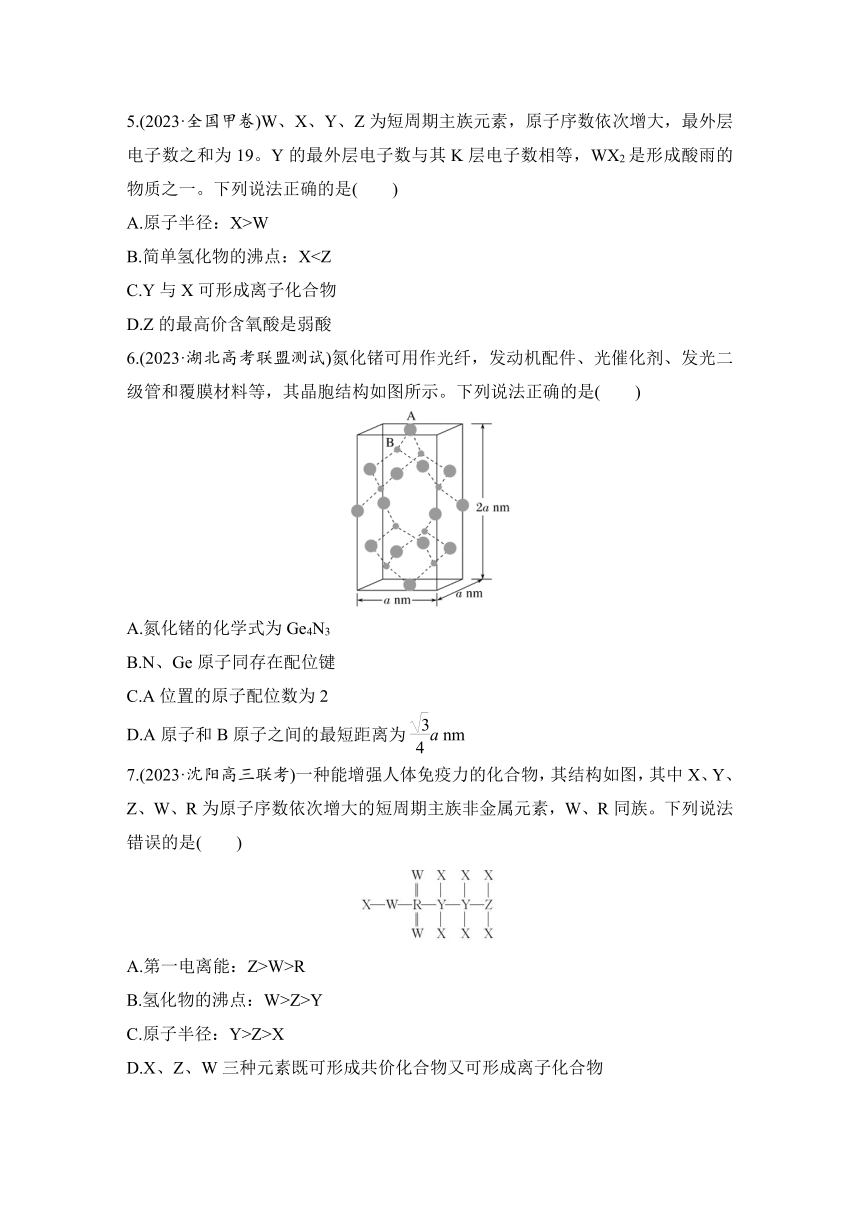
6.(2023·湖北高考联盟测试)氮化锗可用作光纤,发动机配件、光催化剂、发光二级管和覆膜材料等,其晶胞结构如图所示。下列说法正确的是( )
A.氮化锗的化学式为Ge4N3
B.N、Ge原子同存在配位键
C.A位置的原子配位数为2
D.A原子和B原子之间的最短距离为a nm
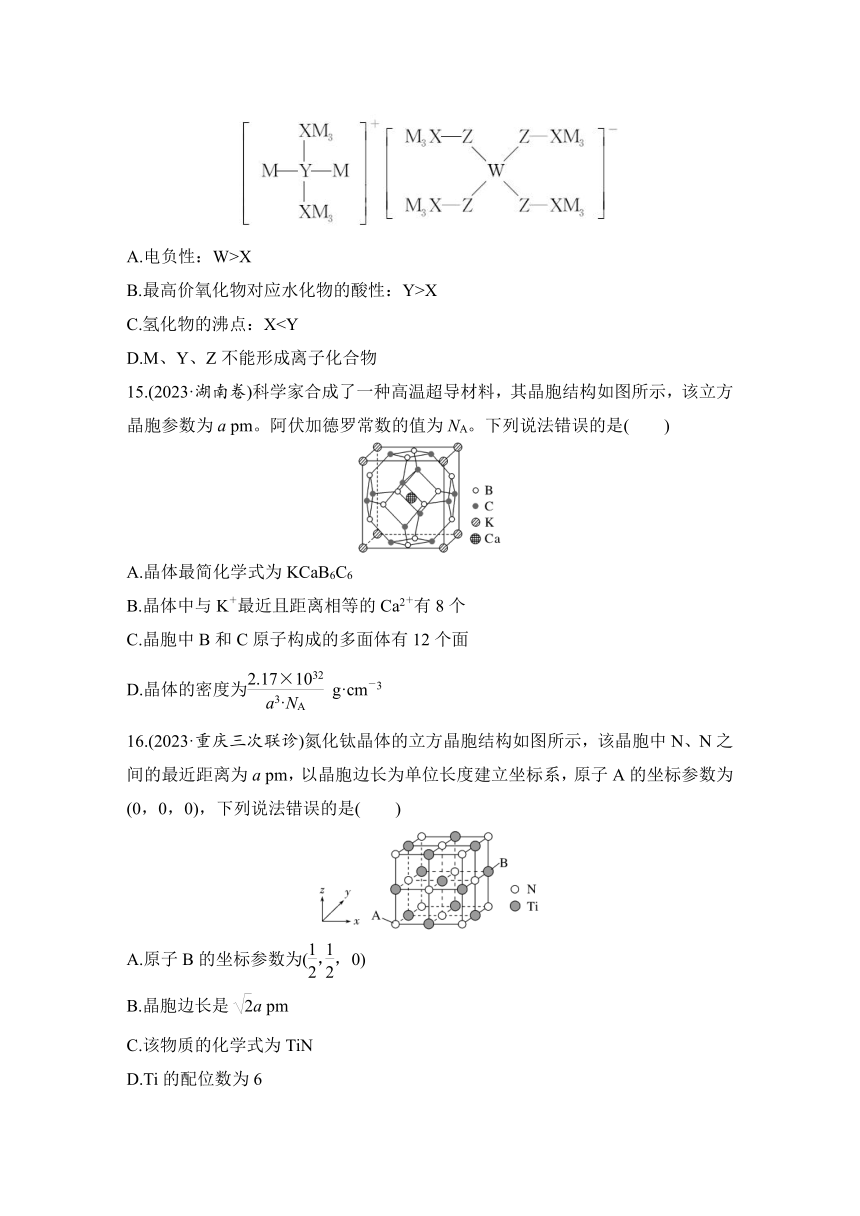
7.(2023·沈阳高三联考)一种能增强人体免疫力的化合物,其结构如图,其中X、Y、Z、W、R为原子序数依次增大的短周期主族非金属元素,W、R同族。下列说法错误的是( )
A.第一电离能:Z>W>R
B.氢化物的沸点:W>Z>Y
C.原子半径:Y>Z>X
D.X、Z、W三种元素既可形成共价化合物又可形成离子化合物
8.(2023·北京顺义区一模)如表为元素周期表的一部分,其中X、Y、W、Z为短周期元素,W的单质常温下为黄绿色气体。下列说法不正确的是( )
Y Z
X W
R T
A.X、Y的单质均存在同素异形体
B.Y、Z的简单氢化物的稳定性依次递增
C.R的单质可用于制造半导体材料
D.工业上电解NaW溶液得W2可使用阴离子交换膜
9.(2023·衡阳一模)“证据推理与模型认知”是化学学科学习的基本素养。下列推论合理的是( )
选项 已知信息 推论
A 酸性:HI>HBr>HCl 酸性:H2Te>H2Se>H2S
B 非金属性:F>O>N 还原性:F->O2->N3-
C 原子半径:Na>Mg>O 离子半径:Na+>Mg2+>O2-
D 熔点:C>Si>Ge 熔点:F2>Cl2>Br2>I2
10.(2023·辽宁卷)晶体结构的缺陷美与对称美同样受关注。某富锂超离子导体的晶胞是立方体(图1),进行镁离子取代及卤素共掺杂后,可获得高性能固体电解质材料(图2)。下列说法错误的是( )
A.图1晶体密度为 g·cm-3
B.图1中O原子的配位数为6
C.图2表示的化学式为LiMg2OClxBr1-x
D.Mg2+取代产生的空位有利于Li+传导
二、提高练
11.(2023·沈阳质监)如图所示的有机化合物是病毒保存液的重要成分之一。已知W、X、Y、Z为原子序数依次增大的短周期元素,其中X和Y同周期,Z的价电子数等于X的原子序数。下列说法正确的是( )
A.第一电离能:X>Y
B.W、Y、Z可形成离子化合物
C.分子中可能所有原子均共面
D.X、Y、Z的最简单氢化物在水中均是强酸
12.(2023·石家庄模拟)如图是元素周期表的一部分,五种元素属于前四周期主族元素,其中只有M为金属元素。下列说法不正确的是( )
A.Y的最高价氧化物对应水化物的酸性比Z的强
B.M元素与Z元素原子序数差为20
C.X的简单气态氢化物的沸点比Y的低
D.N原子的简单氢化物含有四对共用电子对
13.(2023·湖南卷)日光灯中用到的某种荧光粉的主要成分为3W3(ZX4)2·WY2。已知:X、Y、Z和W为原子序数依次增大的前20号元素,W为金属元素。基态X原子s轨道上的电子数和p轨道上的电子数相等,基态X、Y、Z原子的未成对电子数之比为2∶1∶3。下列说法正确的是( )
A.电负性:X>Y>Z>W
B.原子半径:XC.Y和W的单质都能与水反应生成气体
D.Z元素最高价氧化物对应的水化物具有强氧化性
14.(2023·德州高三统考)某多孔储氢材料结构如图,M、W、X、Y、Z均为短周期元素,原子序数依次增大,Z比Y原子序数大9,下列说法正确的是( )
A.电负性:W>X
B.最高价氧化物对应水化物的酸性:Y>X
C.氢化物的沸点:XD.M、Y、Z不能形成离子化合物
15.(2023·湖南卷)科学家合成了一种高温超导材料,其晶胞结构如图所示,该立方晶胞参数为a pm。阿伏加德罗常数的值为NA。下列说法错误的是( )
A.晶体最简化学式为KCaB6C6
B.晶体中与K+最近且距离相等的Ca2+有8个
C.晶胞中B和C原子构成的多面体有12个面
D.晶体的密度为 g·cm-3
16.(2023·重庆三次联诊)氮化钛晶体的立方晶胞结构如图所示,该晶胞中N、N之间的最近距离为a pm,以晶胞边长为单位长度建立坐标系,原子A的坐标参数为(0,0,0),下列说法错误的是( )
A.原子B的坐标参数为(,,0)
B.晶胞边长是a pm
C.该物质的化学式为TiN
D.Ti的配位数为6
17.(2023·湖北卷)W、X、Y、Z为原子序数依次增加的同一短周期元素,其中X、Y、Z相邻,W的核外电子数与X的价层电子数相等,Z2是氧化性最强的单质,4种元素可形成离子化合物(XY)+(WZ4)-。下列说法正确的是( )
A.分子的极性:WZ3B.第一电离能:XC.氧化性:X2Y3D.键能:X218.(2023·重庆巴蜀中学阶段练习)某物质A的结构简式如图所示。X、Y、Z、M、N均为原子序数依次增大的短周期主族元素。Z的族序数是周期序数的三倍。下列说法错误的是( )
A.X最高价氧化物对应的水化物是三元酸
B.A中各原子或离子均达到8电子稳定结构
C.简单氢化物的稳定性:Y<Z<M
D.Z、M、N对应的简单离子半径:Z>M>N
19.(2023·湖北卷)镧La和H可以形成一系列晶体材料LaHn,在储氢和超导等领域具有重要应用。LaHn属于立方晶系,晶胞结构和参数如图所示。高压下,LaH2中的每个H结合4个H形成类似CH4的结构,即得到晶体LaHx。下列说法错误的是( )
A.LaH2晶体中La的配位数为8
B.晶体中H和H的最短距离:LaH2>LaHx
C.在LaHx晶胞中,H形成一个顶点数为40的闭合多面体笼
D.LaHx单位体积中含氢质量的计算式为 g·cm-3
20.(2023·枣庄高三统考)Al—Mn—Cu合金的晶胞如图所示,该晶胞可视为Mn、Al位于Cu形成的立方体体心位置。下列说法正确的是( )
A.Al原子周围等距且最近的Al原子有6个
B.Al—Mn—Cu合金化学式可表示为AlMnCu4
C.若A原子的分数坐标为(0,0,0),则B原子的为
D.沿晶胞对角面的切面图为
参考答案
1.C [依据信息“Y的氟化物分子的空间构型是正四面体形”和核反应方程式,可推出元素X、Y分别为Al和Si,据此分析解题。A.与Al同周期的元素中第一电离能小于Al的只有Na元素,A错误;B.原子半径:Al>Si,B错误;C.Al2Cl6分子中1个Al的周围有4个Cl原子,3个Al-Cl共价键,1个Cl→Al配位键:,C正确;D.3H和1H互为同位素,D错误。]
2.C [A项,SO离子中S原子孤电子对数==1,价层电子对数=3+1=4,形成4个杂化轨道,采用了sp3杂化,A错误;B项,SO中S的价层电子对数为4,无孤对电子,空间构型为正四面体,B错误;C项,SO2中的S采用sp2杂化,三对价层电子对VSEPR模型是平面正三角形,但其中的1对孤电子对2对成键电子对有排斥作用,所以键角小于120°,SO3中的S为+6价,所有电子均参与成键,没有孤对电子,空间构型为平面正三角形,键角为120°,即SO2分子中的键角小于SO3,C正确;D项,SO3为平面正三角形分子,键角120°,分子内正负电荷抵消为非极性分子,D错误。]
3.C [A.气体分子之间距离太大,此时分子间氢键不存在,A错误;B.晶体硅和碳化硅都不是分子,不存在分子间作用力,B错误;C.酸性F-CH2-COOH>Cl-CH2-COOH是因为电负性:F>Cl,C正确;D.I2的熔点较高是因为其分子间作用力较大,D错误。]
4.C [在CsCl晶体、NaCl晶体、CaF2晶体中,阴离子的配位数分别为8、6、4,A正确;BF3与NH3反应生成BF3·NH3,B与N之间形成配位键,N原子提供孤对电子,B原子提供空轨道,B正确;H3BO3分子的结构式为,其水溶液呈酸性是因为H3BO3与H2O发生反应:H3BO3+H2O??[B(OH)4]-+H+,因此H3BO3为一元弱酸。H3PO3分子的结构式为,H3PO3为二元弱酸,C错误;基态氧原子的电子排布图(轨道表示式)为,D正确。]
5.C [W、X、Y、Z为短周期主族元素,原子序数依次增大,Y的最外层电子数与其K层电子数相等,则其可能为Be或Mg,又因WX2是形成酸雨的物质之一,则可能为NO2或SO2,根据原子序数的规律,W、X都小于Y,则W为N,X为O,Y为Mg,四种元素最外层电子数之和为19,则Z的最外层电子数为6,Z为S,据此解答。A.X为O,W为N,同周期从左往右,原子半径依次减小,所以半径大小为W>X,A错误;B.X为O,Z为S,X的简单氢化物为H2O,含有分子间氢键,Z的简单氢化物为H2S,没有氢键,所以简单氢化物的沸点为X>Z,B错误;C.Y为Mg,X为O,他们可形成MgO,为离子化合物,C正确;D.Z为S,硫的最高价含氧酸为硫酸,是强酸,D错误。]
6.D [由均摊法可知,一个晶胞内大球所代表的原子个数为6,小球所代表的原子个数为8,再结合Ge和N的化合价可知,该化合物的化学式为Ge3N4,A错误;由题图可知,B位置的N原子最外层5个电子形成了3个共价键,A位置的Ge原子最外层4个电子形成了4个共价键,故不存在配位键,B错误;晶胞是无隙并置的,A位置的原子配位数为4,C错误;将长方体看作两个立方体,Ge和N之间最短距离为立方体的体对角线长度的1/4,即a nm,D正确。]
7.B [由结构可知R最外层有六个电子,根据题意可知为W、R为第ⅥA族元素,因此W为O元素,R为S元素,再根据结构中的成键数可知X为H元素,Y为C元素,Z为N元素。A.同一周期各元素第一电离能从左往右有逐渐增大的趋势,因为N元素2p轨道为半充满状态,第一电离能大于O元素,同一主族第一电离能从上往下依次降低,O元素大于S元素第一电离能,故第一电离能:Z>W>R,A正确;B.碳元素的氢化物为烷烃,烷烃的沸点随C原子数目增大而增大,存在沸点大于水和氨气的烷烃,B错误;C.原子半径同一周期从左往右依次减小,且H原子半径最小,故原子半径:Y>Z>X,C正确;D.H、N、O,即可形成共价化合物,如HNO3,也可形成离子化合物,如NH4NO3,D正确。]
8.D [W的单质常温下为黄绿色气体,则W为Cl元素,由元素在周期表中的位置可知,X为P元素,Y为O元素,Z为F元素,R为Ge元素,T为Br元素,据此分析解答。A.P对应的同素异形体有红磷、白磷等,O对应的同素异形体有氧气、臭氧等,故A正确;B.同周期主族元素从左到右元素的非金属性增强,元素的非金属性越强,对应的氢化物越稳定,故Y、Z的简单氢化物的稳定性依次递增,故B正确;C.Ge和Si位于同一主族,为重要的半导体材料,故C正确;D.工业上电解饱和食盐水可制得Cl2,因需要将产生的NaOH和Cl2分开,只允许阳离子通过,故需使用阳离子交换膜,故D错误。]
9.A [A.HCl、HBr、HI的酸性由键能决定,键长越长,键能越小,酸性越强,因此推出氧族元素对应氢化物的酸性:H2Te>H2Se>H2S,A项合理;B.元素非金属性越强,对应简单离子的还原性越弱,因此还原性:F-Na+>Mg2+,C项不合理;D.C、Si、Ge均为共价晶体,熔点由键能决定;F2、Cl2、Br2、I2为分子晶体,熔点由范德华力决定,相对分子质量越大,范德华力越大,则熔点:F210.C [A.根据均摊法,图1的晶胞中含Li:8×+1=3,O:2×=1,Cl:4×=1,1个晶胞的质量为 g= g,晶胞的体积为(a×10-10cm)3=a3×10-30cm3,则晶体的密度为g÷(a3×10-30cm3)= g/cm3,A项正确;B.图1晶胞中,O位于面心,与O等距离最近的Li有6个,O原子的配位数为6,B项正确;C.根据均摊法,图2中Li:1,Mg或空位为8×=2,O:2×=1,Cl或Br:4×=1,Mg的个数小于2,根据正负化合价的代数和为0,图2的化学式为LiMgOClxBr1-x,C项错误;D.进行镁离子取代及卤素共掺杂后,可获得高性能固体电解质材料,说明Mg2+取代产生的空位有利于Li+的传导,D项正确。]
11.B [所示物质为有机化合物,根据W形成单键,其原子序数最小,知W为H元素;X的总键数为4,Z形成2个单键,Z的价电子数等于X的原子序数,则Z为S元素,X为C元素;根据Y的总键数为3,X和Y同周期,知Y为N元素。根据同周期元素从左到右第一电离能呈增大趋势,知第一电离能:C12.C [五种元素属于前四周期主族元素,根据周期表可知,M、N、Y位于第二或第三周期,其中只有M为金属元素,则M、N、Y位于第三周期,M为Al,N为Si,Y为P,X为N,Z为As。A.非金属性越强,其最高价氧化物对应的水化物的酸性越强,同族元素,从上至下,非金属性依次减弱,则P的最高价氧化物对应水化物的酸性比As强,A正确;B.M元素与Z元素分别为Al元素和As元素,Al是13号元素,As是33号元素,故两元素的原子序数差为20,B正确;C.X、Y的简单气态氢化物分别为NH3和PH3,由于NH3分子间存在氢键,故NH3的沸点比PH3的高,C错误;D.N原子是Si,其简单氢化物为SiH4,SiH4的电子式为,其中含有四对共用电子对,D正确。]
13.C [根据题中所给的信息,基态X原子s轨道上的电子数与p轨道上的电子数相同,可以推测X为O元素或Mg元素,由荧光粉的结构可知,X主要形成的是酸根,因此X为O元素;基态X原子中未成对电子数为2,因此Y的未成键电子数为1,又因X、Y、Z、W的原子序数依次增大,故Y可能为F元素、Na元素、Al元素、Cl元素,因题目中给出W为金属元素且荧光粉的结构中Y与W化合,故Y为F元素或Cl元素;Z原子的未成键电子数为3,又因其原子序大于Y,故Y应为F元素、Z应为P元素;从荧光粉的结构式可以看出W为某+2价元素,故其为Ca元素;综上所述,X、Y、Z、W四种元素分别为O、F、P、Ca,据此答题。A.同一周期从左到右电负性依次增大,同一主族从上到下电负性依次减小,故四种原子的电负性大小为:Y>X>Z>W,A错误;B.同一周期从左到右原子半径依次减小,同一主族从上到下原子半径依次增大,故四种原子的原子半径大小为:Y14.B [M、W、X、Y、Z均为短周期元素,原子序数依次增大,Z比Y原子序数大9,由图片可知Z能形成2个共价键,则Z为S元素,M能形成1个共价键且原子序数最小,M为H元素,X形成4个共价键,则X为C元素,Y、W能分别形成4个共价键,且分别形成了阳离子、阴离子,结合原子序数大小关系,Y为N元素,W为B元素。A.根据分析可知W是B元素,X是C元素,同一周期的元素,原子序数越大,元素的电负性越大,故电负性X>W,A错误;B.根据分析可知Y是N元素,X是C元素,非金属性越强,最高价含氧酸的酸性越强,非金属性N>C,故最高价氧化物对应水化物的酸性:HNO3>H2CO3,即Y>X,B正确;C.X的氢化物很多,沸点可能比氨气高也可能比氨气低,C错误;D.M、Y、Z分别为H、N、S元素,可以形成离子化合物如(NH4)2S,D错误。]
15.C [A.根据晶胞结构可知,K个数:8×=1,Ca个数:1,B个数:12×=6,C个数:12×=6,故其最简化学式为KCaB6C6,A正确;B.根据晶胞结构可知,K+位于晶胞体心,Ca2+位于顶点,则晶体中与K+最近且距离相等的Ca2+有8个,B正确;C.根据晶胞结构可知,晶胞中B和C原子构成的多面体有14个面,C错误;D.根据选项A分析可知,该晶胞最简化学式为KCaB6C6,则1个晶胞质量为: g,晶胞体积为a3×10-30 cm3,则其密度为 g·cm-3,D正确。]
16.A [原子B的坐标参数为(1,1,),A错误;晶胞中N、N之间的最近距离为a pm,则N与Ti的最近距离是a pm,则晶胞边长为a pm,B正确;该晶胞中,Ti(黑球)的个数为1+12×=4,N(白球)的个数为8×+6×=4,则Ti和N的个数比为1∶1,该物质的化学式为TiN,C正确;如图所示,与Ti距离相等且最近的N有6个,则Ti的配位数为6,D正确。]
17.A [Z2是氧化性最强的单质,则Z是F,X、Y、Z相邻,且X、Y、Z为原子序数依次增加的同一短周期元素,则X为N,Y为O,W的核外电子数与X的价层电子数相等,则W为B,即W为B、X为N、Y为O、Z是F,以此解题。A.由分析可知,WZ3为BF3,XZ3为NF3,其中前者的价层电子对数为3且无孤电子对,空间构型为平面三角形,为非极性分子,后者的价层电子对数为4,有一对孤电子对,空间构型为三角锥形,为极性分子,则分子的极性:BF318.A [X、Y、Z、M、N均为原子序数依次增大的短周期主族元素。由物质A的结构简式可知,N+化合价为+1价,N元素位于第ⅠA族,则N为Na;Z形成2个共价键,且Z的族序数是周期序数的三倍,则Z为O;M形成1个共价键,则M为F;X形成4个共价键,再获得1个电子,则X为B;Y形成4个共价键,则Y为C,综上所述,X、Y、Z、M、N分别为B、C、O、F、Na。A.X为B,其最高价氧化物对应的水化物为H3BO3,H3BO3为一元酸,A错误;B.由物质A的结构简式可知,B、C、O、F、Na均达到了8电子稳定结构,B正确;C.Y、Z、M分别为C、O、F,比较其简单氢化物的稳定性就是比较C、O、F三者的非金属性,同周期主族元素从左到右,非金属性逐渐增强,则简单氢化物的稳定性:Y<Z<M,C正确;D.Z、M、N对应的简单离子分别为O2-、F-、Na+,三者核外电子排布完全相同,核电荷数越大,半径反而越小,则Z、M、N对应的简单离子半径:Z>M>N,D正确。]
19.C [A.由LaH2的晶胞结构可知,La位于顶点和面心,晶胞内8个小立方体的中心各有1个H原子,若以顶点La研究,与之最近的H原子有8个,则La的配位数为8,故A正确;B.由LaHx晶胞结构可知,每个H结合4个H形成类似CH4的结构,H和H之间的最短距离变小,则晶体中H和H的最短距离:LaH2>LaHx,故B正确;C.由题干信息可知,在LaHx晶胞中,每个H结合4个H形成类似CH4的结构,这样的结构有8个,顶点数为4×8=32,且不是闭合的结构,故C错误;D.1个LaHx晶胞中含有5×8=40个H原子,含H质量为 g,晶胞的体积为(4.84×10-8)3 cm3,则LaHx单位体积中含氢质量的计算式为 g·cm-3,故D正确。]
20.D [A.由晶胞结构可知,Al原子周围等距且最近的Al原子有12个,故A错误;B.根据均摊法,该晶胞中Cu原子的个数为8×+6×+12×+1=8,Mn原子的个数为4,Al原子的个数为4,所以该合金的化学式为AlMnCu2,故B错误;C.A为原点,C为(1,1,1),根据图示B的坐标为,故C错误;D.由晶胞结构可知,沿晶胞对角面的切面图为,故D正确
一、基础练
1.(2023·沧州高三统考)用α粒子(即氦核He)轰击X产生H的核反应为He+X→Y+H。已知元素Y的氟化物分子的空间构型是正四面体形。下列说法正确的是( )
A.与X同周期的元素中,第一电离能小于X的元素有两个
B.原子半径:X
D.3H和1H互为同素异形体
2.下列有关SO2、SO3、SO和SO的说法正确的是( )
A.SO中S原子的杂化方式为sp2
B.SO的空间构型为平面正方形
C.SO2分子中的键角小于SO3分子中的键角
D.SO3分子是极性分子
3.(2023·北京昌平区高三统考)下列对物质性质解释合理的是( )
选项 性质 解释
A 热稳定性:H2O(g)>H2S(g) H2O中存在氢键
B 熔点:晶体硅<碳化硅 碳化硅中分子间作用力较大
C 酸性:F-CH2-COOH>Cl-CH2-COOH 电负性:F>Cl
D 熔点:Br2
A.阴离子的配位数:CsCl晶体>NaCl晶体>CaF2晶体
B.BF3与NH3可通过配位键形成氨合三氟化硼(BF3·NH3)
C.H3BO3和H3PO3均为三元弱酸,分子结构式均为
D.基态氧原子的电子排布图(轨道表示式)为
5.(2023·全国甲卷)W、X、Y、Z为短周期主族元素,原子序数依次增大,最外层电子数之和为19。Y的最外层电子数与其K层电子数相等,WX2是形成酸雨的物质之一。下列说法正确的是( )
A.原子半径:X>W
B.简单氢化物的沸点:X
D.Z的最高价含氧酸是弱酸
6.(2023·湖北高考联盟测试)氮化锗可用作光纤,发动机配件、光催化剂、发光二级管和覆膜材料等,其晶胞结构如图所示。下列说法正确的是( )
A.氮化锗的化学式为Ge4N3
B.N、Ge原子同存在配位键
C.A位置的原子配位数为2
D.A原子和B原子之间的最短距离为a nm
7.(2023·沈阳高三联考)一种能增强人体免疫力的化合物,其结构如图,其中X、Y、Z、W、R为原子序数依次增大的短周期主族非金属元素,W、R同族。下列说法错误的是( )
A.第一电离能:Z>W>R
B.氢化物的沸点:W>Z>Y
C.原子半径:Y>Z>X
D.X、Z、W三种元素既可形成共价化合物又可形成离子化合物
8.(2023·北京顺义区一模)如表为元素周期表的一部分,其中X、Y、W、Z为短周期元素,W的单质常温下为黄绿色气体。下列说法不正确的是( )
Y Z
X W
R T
A.X、Y的单质均存在同素异形体
B.Y、Z的简单氢化物的稳定性依次递增
C.R的单质可用于制造半导体材料
D.工业上电解NaW溶液得W2可使用阴离子交换膜
9.(2023·衡阳一模)“证据推理与模型认知”是化学学科学习的基本素养。下列推论合理的是( )
选项 已知信息 推论
A 酸性:HI>HBr>HCl 酸性:H2Te>H2Se>H2S
B 非金属性:F>O>N 还原性:F->O2->N3-
C 原子半径:Na>Mg>O 离子半径:Na+>Mg2+>O2-
D 熔点:C>Si>Ge 熔点:F2>Cl2>Br2>I2
10.(2023·辽宁卷)晶体结构的缺陷美与对称美同样受关注。某富锂超离子导体的晶胞是立方体(图1),进行镁离子取代及卤素共掺杂后,可获得高性能固体电解质材料(图2)。下列说法错误的是( )
A.图1晶体密度为 g·cm-3
B.图1中O原子的配位数为6
C.图2表示的化学式为LiMg2OClxBr1-x
D.Mg2+取代产生的空位有利于Li+传导
二、提高练
11.(2023·沈阳质监)如图所示的有机化合物是病毒保存液的重要成分之一。已知W、X、Y、Z为原子序数依次增大的短周期元素,其中X和Y同周期,Z的价电子数等于X的原子序数。下列说法正确的是( )
A.第一电离能:X>Y
B.W、Y、Z可形成离子化合物
C.分子中可能所有原子均共面
D.X、Y、Z的最简单氢化物在水中均是强酸
12.(2023·石家庄模拟)如图是元素周期表的一部分,五种元素属于前四周期主族元素,其中只有M为金属元素。下列说法不正确的是( )
A.Y的最高价氧化物对应水化物的酸性比Z的强
B.M元素与Z元素原子序数差为20
C.X的简单气态氢化物的沸点比Y的低
D.N原子的简单氢化物含有四对共用电子对
13.(2023·湖南卷)日光灯中用到的某种荧光粉的主要成分为3W3(ZX4)2·WY2。已知:X、Y、Z和W为原子序数依次增大的前20号元素,W为金属元素。基态X原子s轨道上的电子数和p轨道上的电子数相等,基态X、Y、Z原子的未成对电子数之比为2∶1∶3。下列说法正确的是( )
A.电负性:X>Y>Z>W
B.原子半径:X
D.Z元素最高价氧化物对应的水化物具有强氧化性
14.(2023·德州高三统考)某多孔储氢材料结构如图,M、W、X、Y、Z均为短周期元素,原子序数依次增大,Z比Y原子序数大9,下列说法正确的是( )
A.电负性:W>X
B.最高价氧化物对应水化物的酸性:Y>X
C.氢化物的沸点:X
15.(2023·湖南卷)科学家合成了一种高温超导材料,其晶胞结构如图所示,该立方晶胞参数为a pm。阿伏加德罗常数的值为NA。下列说法错误的是( )
A.晶体最简化学式为KCaB6C6
B.晶体中与K+最近且距离相等的Ca2+有8个
C.晶胞中B和C原子构成的多面体有12个面
D.晶体的密度为 g·cm-3
16.(2023·重庆三次联诊)氮化钛晶体的立方晶胞结构如图所示,该晶胞中N、N之间的最近距离为a pm,以晶胞边长为单位长度建立坐标系,原子A的坐标参数为(0,0,0),下列说法错误的是( )
A.原子B的坐标参数为(,,0)
B.晶胞边长是a pm
C.该物质的化学式为TiN
D.Ti的配位数为6
17.(2023·湖北卷)W、X、Y、Z为原子序数依次增加的同一短周期元素,其中X、Y、Z相邻,W的核外电子数与X的价层电子数相等,Z2是氧化性最强的单质,4种元素可形成离子化合物(XY)+(WZ4)-。下列说法正确的是( )
A.分子的极性:WZ3
A.X最高价氧化物对应的水化物是三元酸
B.A中各原子或离子均达到8电子稳定结构
C.简单氢化物的稳定性:Y<Z<M
D.Z、M、N对应的简单离子半径:Z>M>N
19.(2023·湖北卷)镧La和H可以形成一系列晶体材料LaHn,在储氢和超导等领域具有重要应用。LaHn属于立方晶系,晶胞结构和参数如图所示。高压下,LaH2中的每个H结合4个H形成类似CH4的结构,即得到晶体LaHx。下列说法错误的是( )
A.LaH2晶体中La的配位数为8
B.晶体中H和H的最短距离:LaH2>LaHx
C.在LaHx晶胞中,H形成一个顶点数为40的闭合多面体笼
D.LaHx单位体积中含氢质量的计算式为 g·cm-3
20.(2023·枣庄高三统考)Al—Mn—Cu合金的晶胞如图所示,该晶胞可视为Mn、Al位于Cu形成的立方体体心位置。下列说法正确的是( )
A.Al原子周围等距且最近的Al原子有6个
B.Al—Mn—Cu合金化学式可表示为AlMnCu4
C.若A原子的分数坐标为(0,0,0),则B原子的为
D.沿晶胞对角面的切面图为
参考答案
1.C [依据信息“Y的氟化物分子的空间构型是正四面体形”和核反应方程式,可推出元素X、Y分别为Al和Si,据此分析解题。A.与Al同周期的元素中第一电离能小于Al的只有Na元素,A错误;B.原子半径:Al>Si,B错误;C.Al2Cl6分子中1个Al的周围有4个Cl原子,3个Al-Cl共价键,1个Cl→Al配位键:,C正确;D.3H和1H互为同位素,D错误。]
2.C [A项,SO离子中S原子孤电子对数==1,价层电子对数=3+1=4,形成4个杂化轨道,采用了sp3杂化,A错误;B项,SO中S的价层电子对数为4,无孤对电子,空间构型为正四面体,B错误;C项,SO2中的S采用sp2杂化,三对价层电子对VSEPR模型是平面正三角形,但其中的1对孤电子对2对成键电子对有排斥作用,所以键角小于120°,SO3中的S为+6价,所有电子均参与成键,没有孤对电子,空间构型为平面正三角形,键角为120°,即SO2分子中的键角小于SO3,C正确;D项,SO3为平面正三角形分子,键角120°,分子内正负电荷抵消为非极性分子,D错误。]
3.C [A.气体分子之间距离太大,此时分子间氢键不存在,A错误;B.晶体硅和碳化硅都不是分子,不存在分子间作用力,B错误;C.酸性F-CH2-COOH>Cl-CH2-COOH是因为电负性:F>Cl,C正确;D.I2的熔点较高是因为其分子间作用力较大,D错误。]
4.C [在CsCl晶体、NaCl晶体、CaF2晶体中,阴离子的配位数分别为8、6、4,A正确;BF3与NH3反应生成BF3·NH3,B与N之间形成配位键,N原子提供孤对电子,B原子提供空轨道,B正确;H3BO3分子的结构式为,其水溶液呈酸性是因为H3BO3与H2O发生反应:H3BO3+H2O??[B(OH)4]-+H+,因此H3BO3为一元弱酸。H3PO3分子的结构式为,H3PO3为二元弱酸,C错误;基态氧原子的电子排布图(轨道表示式)为,D正确。]
5.C [W、X、Y、Z为短周期主族元素,原子序数依次增大,Y的最外层电子数与其K层电子数相等,则其可能为Be或Mg,又因WX2是形成酸雨的物质之一,则可能为NO2或SO2,根据原子序数的规律,W、X都小于Y,则W为N,X为O,Y为Mg,四种元素最外层电子数之和为19,则Z的最外层电子数为6,Z为S,据此解答。A.X为O,W为N,同周期从左往右,原子半径依次减小,所以半径大小为W>X,A错误;B.X为O,Z为S,X的简单氢化物为H2O,含有分子间氢键,Z的简单氢化物为H2S,没有氢键,所以简单氢化物的沸点为X>Z,B错误;C.Y为Mg,X为O,他们可形成MgO,为离子化合物,C正确;D.Z为S,硫的最高价含氧酸为硫酸,是强酸,D错误。]
6.D [由均摊法可知,一个晶胞内大球所代表的原子个数为6,小球所代表的原子个数为8,再结合Ge和N的化合价可知,该化合物的化学式为Ge3N4,A错误;由题图可知,B位置的N原子最外层5个电子形成了3个共价键,A位置的Ge原子最外层4个电子形成了4个共价键,故不存在配位键,B错误;晶胞是无隙并置的,A位置的原子配位数为4,C错误;将长方体看作两个立方体,Ge和N之间最短距离为立方体的体对角线长度的1/4,即a nm,D正确。]
7.B [由结构可知R最外层有六个电子,根据题意可知为W、R为第ⅥA族元素,因此W为O元素,R为S元素,再根据结构中的成键数可知X为H元素,Y为C元素,Z为N元素。A.同一周期各元素第一电离能从左往右有逐渐增大的趋势,因为N元素2p轨道为半充满状态,第一电离能大于O元素,同一主族第一电离能从上往下依次降低,O元素大于S元素第一电离能,故第一电离能:Z>W>R,A正确;B.碳元素的氢化物为烷烃,烷烃的沸点随C原子数目增大而增大,存在沸点大于水和氨气的烷烃,B错误;C.原子半径同一周期从左往右依次减小,且H原子半径最小,故原子半径:Y>Z>X,C正确;D.H、N、O,即可形成共价化合物,如HNO3,也可形成离子化合物,如NH4NO3,D正确。]
8.D [W的单质常温下为黄绿色气体,则W为Cl元素,由元素在周期表中的位置可知,X为P元素,Y为O元素,Z为F元素,R为Ge元素,T为Br元素,据此分析解答。A.P对应的同素异形体有红磷、白磷等,O对应的同素异形体有氧气、臭氧等,故A正确;B.同周期主族元素从左到右元素的非金属性增强,元素的非金属性越强,对应的氢化物越稳定,故Y、Z的简单氢化物的稳定性依次递增,故B正确;C.Ge和Si位于同一主族,为重要的半导体材料,故C正确;D.工业上电解饱和食盐水可制得Cl2,因需要将产生的NaOH和Cl2分开,只允许阳离子通过,故需使用阳离子交换膜,故D错误。]
9.A [A.HCl、HBr、HI的酸性由键能决定,键长越长,键能越小,酸性越强,因此推出氧族元素对应氢化物的酸性:H2Te>H2Se>H2S,A项合理;B.元素非金属性越强,对应简单离子的还原性越弱,因此还原性:F-
11.B [所示物质为有机化合物,根据W形成单键,其原子序数最小,知W为H元素;X的总键数为4,Z形成2个单键,Z的价电子数等于X的原子序数,则Z为S元素,X为C元素;根据Y的总键数为3,X和Y同周期,知Y为N元素。根据同周期元素从左到右第一电离能呈增大趋势,知第一电离能:C
13.C [根据题中所给的信息,基态X原子s轨道上的电子数与p轨道上的电子数相同,可以推测X为O元素或Mg元素,由荧光粉的结构可知,X主要形成的是酸根,因此X为O元素;基态X原子中未成对电子数为2,因此Y的未成键电子数为1,又因X、Y、Z、W的原子序数依次增大,故Y可能为F元素、Na元素、Al元素、Cl元素,因题目中给出W为金属元素且荧光粉的结构中Y与W化合,故Y为F元素或Cl元素;Z原子的未成键电子数为3,又因其原子序大于Y,故Y应为F元素、Z应为P元素;从荧光粉的结构式可以看出W为某+2价元素,故其为Ca元素;综上所述,X、Y、Z、W四种元素分别为O、F、P、Ca,据此答题。A.同一周期从左到右电负性依次增大,同一主族从上到下电负性依次减小,故四种原子的电负性大小为:Y>X>Z>W,A错误;B.同一周期从左到右原子半径依次减小,同一主族从上到下原子半径依次增大,故四种原子的原子半径大小为:Y
15.C [A.根据晶胞结构可知,K个数:8×=1,Ca个数:1,B个数:12×=6,C个数:12×=6,故其最简化学式为KCaB6C6,A正确;B.根据晶胞结构可知,K+位于晶胞体心,Ca2+位于顶点,则晶体中与K+最近且距离相等的Ca2+有8个,B正确;C.根据晶胞结构可知,晶胞中B和C原子构成的多面体有14个面,C错误;D.根据选项A分析可知,该晶胞最简化学式为KCaB6C6,则1个晶胞质量为: g,晶胞体积为a3×10-30 cm3,则其密度为 g·cm-3,D正确。]
16.A [原子B的坐标参数为(1,1,),A错误;晶胞中N、N之间的最近距离为a pm,则N与Ti的最近距离是a pm,则晶胞边长为a pm,B正确;该晶胞中,Ti(黑球)的个数为1+12×=4,N(白球)的个数为8×+6×=4,则Ti和N的个数比为1∶1,该物质的化学式为TiN,C正确;如图所示,与Ti距离相等且最近的N有6个,则Ti的配位数为6,D正确。]
17.A [Z2是氧化性最强的单质,则Z是F,X、Y、Z相邻,且X、Y、Z为原子序数依次增加的同一短周期元素,则X为N,Y为O,W的核外电子数与X的价层电子数相等,则W为B,即W为B、X为N、Y为O、Z是F,以此解题。A.由分析可知,WZ3为BF3,XZ3为NF3,其中前者的价层电子对数为3且无孤电子对,空间构型为平面三角形,为非极性分子,后者的价层电子对数为4,有一对孤电子对,空间构型为三角锥形,为极性分子,则分子的极性:BF3
19.C [A.由LaH2的晶胞结构可知,La位于顶点和面心,晶胞内8个小立方体的中心各有1个H原子,若以顶点La研究,与之最近的H原子有8个,则La的配位数为8,故A正确;B.由LaHx晶胞结构可知,每个H结合4个H形成类似CH4的结构,H和H之间的最短距离变小,则晶体中H和H的最短距离:LaH2>LaHx,故B正确;C.由题干信息可知,在LaHx晶胞中,每个H结合4个H形成类似CH4的结构,这样的结构有8个,顶点数为4×8=32,且不是闭合的结构,故C错误;D.1个LaHx晶胞中含有5×8=40个H原子,含H质量为 g,晶胞的体积为(4.84×10-8)3 cm3,则LaHx单位体积中含氢质量的计算式为 g·cm-3,故D正确。]
20.D [A.由晶胞结构可知,Al原子周围等距且最近的Al原子有12个,故A错误;B.根据均摊法,该晶胞中Cu原子的个数为8×+6×+12×+1=8,Mn原子的个数为4,Al原子的个数为4,所以该合金的化学式为AlMnCu2,故B错误;C.A为原点,C为(1,1,1),根据图示B的坐标为,故C错误;D.由晶胞结构可知,沿晶胞对角面的切面图为,故D正确
同课章节目录
