4.1原电池第1课时课件(共20张PPT)2023-2024学年高二上学期化学人教版(2019)选择性必修1
文档属性
| 名称 | 4.1原电池第1课时课件(共20张PPT)2023-2024学年高二上学期化学人教版(2019)选择性必修1 |  | |
| 格式 | pptx | ||
| 文件大小 | 64.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-16 19:24:38 | ||
图片预览




文档简介
(共20张PPT)
化学(选择性必修1) 第四章 化学反应与电能
第一节 原电池
第1课时 原电池的工作原理
[知识回顾]
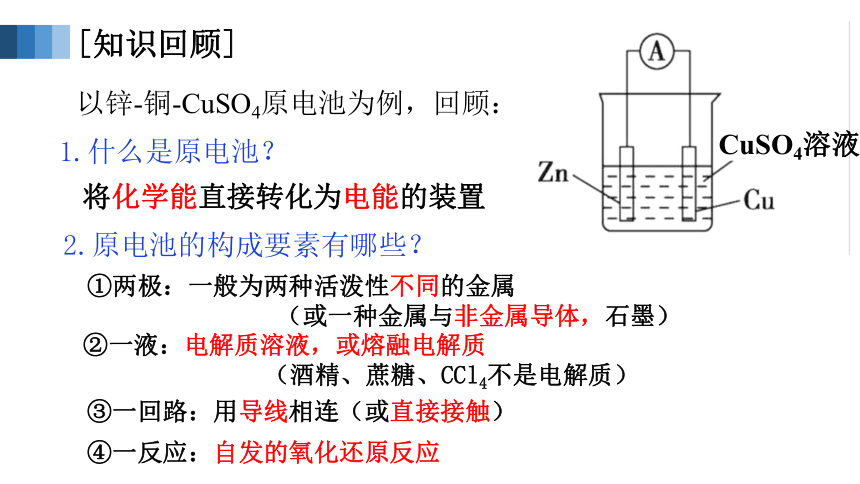
以锌-铜-CuSO4原电池为例,回顾:
CuSO4溶液
1.什么是原电池?
2.原电池的构成要素有哪些?
将化学能直接转化为电能的装置
①两极:一般为两种活泼性不同的金属
(或一种金属与非金属导体,石墨)
②一液:电解质溶液,或熔融电解质
(酒精、蔗糖、CCl4不是电解质)
③一回路:用导线相连(或直接接触)
④一反应:自发的氧化还原反应
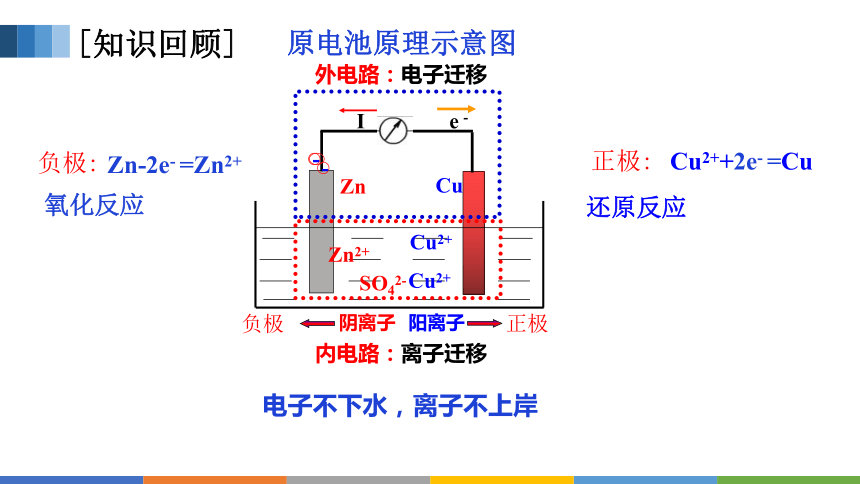
原电池原理示意图
电子不下水,离子不上岸
Cu
Zn
-
-
-
Zn2+
Cu2+
Cu2+
阳离子
阴离子
SO42-
e-
I
外电路:电子迁移
内电路:离子迁移
[知识回顾]
负极:
氧化反应
正极:
还原反应
Zn-2e- =Zn2+
Cu2++2e- =Cu
负极
正极
[知识回顾]
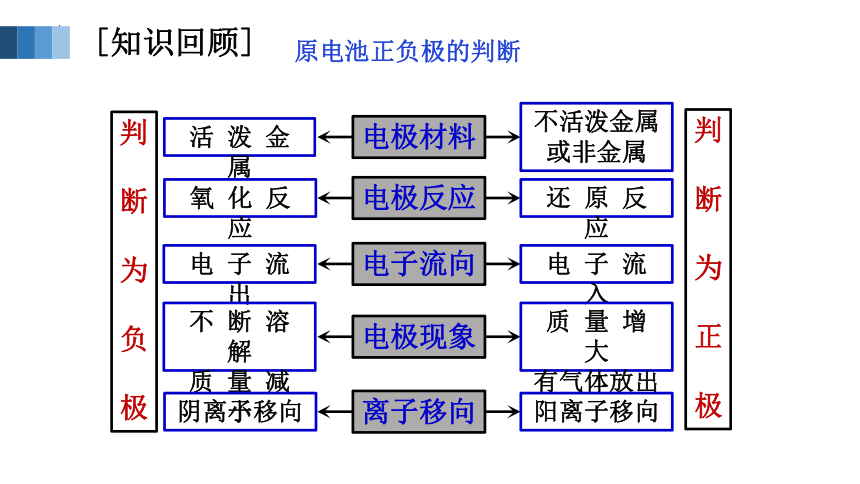
电极材料
电极反应
电子流向
电极现象
离子移向
判
断
为
负
极
判
断
为
正
极
不活泼金属或非金属
活 泼 金 属
氧 化 反 应
还 原 反 应
电 子 流 出
电 子 流 入
不 断 溶 解
质 量 减 小
质 量 增 大
有气体放出
阴离子移向
阳离子移向
原电池正负极的判断
[知识回顾]
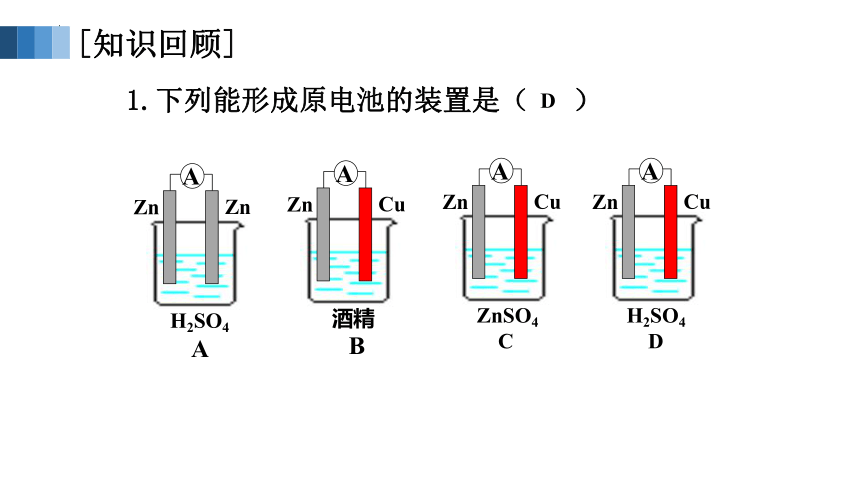
1.下列能形成原电池的装置是( )
Zn
Zn
H2SO4
A
A
Zn
Cu
酒精
B
A
Zn
Cu
ZnSO4
C
A
Zn
Cu
H2SO4
D
A
D
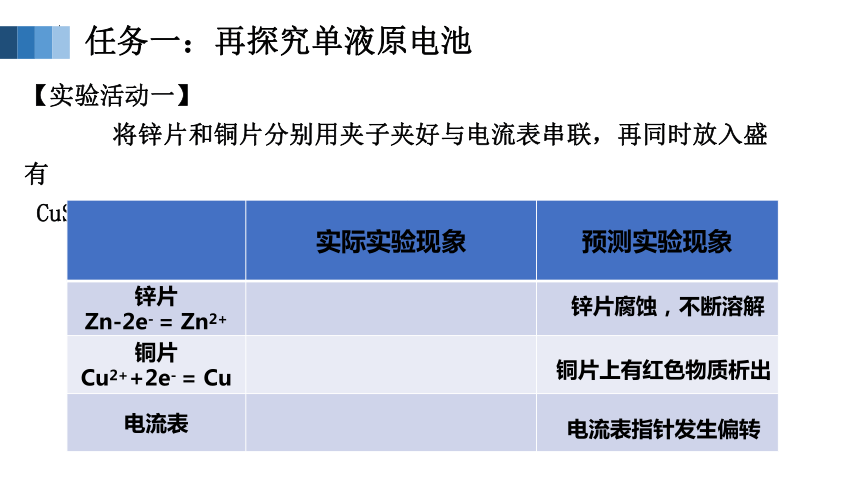
任务一:再探究单液原电池
【实验活动一】
将锌片和铜片分别用夹子夹好与电流表串联,再同时放入盛有
CuSO4溶液的烧杯中。观察实验现象并记录。
实际实验现象 预测实验现象
锌片 Zn-2e- = Zn2+
铜片 Cu2++2e- = Cu
电流表
锌片腐蚀,不断溶解
铜片上有红色物质析出
电流表指针发生偏转
任务一:再探究单液原电池
观察实验现象,分析可能原因:
任务一:再探究单液原电池
【实验活动一】
将锌片和铜片分别用夹子夹好与电流表串联,再同时放入盛有
CuSO4溶液的烧杯中。观察实验现象并记录。
实际实验现象 预测实验现象
锌片 Zn-2e- = Zn2+ 锌片不断溶解
铜片 Cu2++2e- = Cu 铜片上有红色物质析出
电流表 电流表指针发生偏转
锌片被红色物质覆盖
铜片上有红色物质析出
电流表读数不断减小
任务一:再探究单液原电池
【思考与讨论1】分析产生上所述现象的原因
1.锌片上有红色物质析出:
2.电流表读数不断减小:
【解决问题的关键】还原剂Zn与氧化剂CuSO4不直接接触
【原因分析】
如何改进?
锌与CuSO4溶液直接接触发生反应生成铜。
因为铜在锌表面析出后,与CuSO4溶液一起形成
了原电池,产生的电流并没有经过电流表,所以电流表的读数不断减小。
任务二:原电池装置的改进
ZnSO4
Zn Cu
CuSO4
A
ZnSO4
Zn Cu
CuSO4
A
1.有无电流产生?
2.为什么没有电流?该如何解决?
思考
盐桥
一种凝胶态的离子导体
实验结论:锌片(还原剂)在与Cu2+(氧化剂)没有直接接触的情况下也能构成原电池,但是需要合适的“桥梁”连接两种电解
质溶液。
盐桥:
通常是将浸泡了饱和KCl溶液的琼胶装在U型管中。
特点:
1.盐桥中的K+、Cl-可以自由移动
2.琼胶起到固定作用,防止KCl溶液直接流出来。
3.离子只出不进。
任务二:原电池装置的改进——双液原电池
对比下图,分析得出双液电池的优缺点,并思考如何改进。
任务二:原电池装置的改进——双液原电池
优点:电流稳定
不足:电流小
任务二:原电池装置的改进——双液原电池
1、阳离子交换膜:只允许阳离子通过
3、质 子 交 换 膜:只允许H+通过
2、阴离子交换膜:只允许阴离子通过
改进
增大电流呢?
缩短盐桥的长度,增大盐桥的横截面积
能否用一张薄薄的隔膜代替盐桥呢?
思考:双液原电池电流弱的原因?
1.离子运动的距离长
2.离子运动的通道窄
3.离子容量小
任务二:原电池装置的改进——双液原电池
离子交换膜
任务三:原电池装置的设计
请利用Cu+2Fe3+=Cu2++2Fe2+,设计一个原电池
盐桥
Cu
C
CuCl2溶液
FeCl3溶液
G
分析半反应
Cu - 2e- = Cu2+
2Fe3+ + 2e- = 2Fe2+
确定电极材料
电源负极(Cu)
电源正极(C/Ag)
组成原电池
形成闭合回路
FeCl3溶液
比负极金属活泼性
弱的金属或石墨
含氧化剂离子的溶液
A
FeCl3溶液
Cu
C
加快氧化还原
反应的速率
防止金属的腐蚀
判断金属的
活动性强弱
设计简单的
原电池装置
任务四:原电池原理的应用
锌与稀硫酸反应时
加少量CuSO4溶液
[小结]原电池工作原理
缺点:
电流不稳定
优点:电流稳定
缺点:电流小
优点:
电流大且稳定
单液电池
双液电池
隔膜型电池
[小结]原电池工作原理
自发的氧化还原反应
闭合回路
原电池
化学能
电能
离子导体
电极材料
电极反应
电子导体
还原反应
氧化反应
[小结]原电池工作原理
化学(选择性必修1) 第四章 化学反应与电能
第一节 原电池
第1课时 原电池的工作原理
[知识回顾]
以锌-铜-CuSO4原电池为例,回顾:
CuSO4溶液
1.什么是原电池?
2.原电池的构成要素有哪些?
将化学能直接转化为电能的装置
①两极:一般为两种活泼性不同的金属
(或一种金属与非金属导体,石墨)
②一液:电解质溶液,或熔融电解质
(酒精、蔗糖、CCl4不是电解质)
③一回路:用导线相连(或直接接触)
④一反应:自发的氧化还原反应
原电池原理示意图
电子不下水,离子不上岸
Cu
Zn
-
-
-
Zn2+
Cu2+
Cu2+
阳离子
阴离子
SO42-
e-
I
外电路:电子迁移
内电路:离子迁移
[知识回顾]
负极:
氧化反应
正极:
还原反应
Zn-2e- =Zn2+
Cu2++2e- =Cu
负极
正极
[知识回顾]
电极材料
电极反应
电子流向
电极现象
离子移向
判
断
为
负
极
判
断
为
正
极
不活泼金属或非金属
活 泼 金 属
氧 化 反 应
还 原 反 应
电 子 流 出
电 子 流 入
不 断 溶 解
质 量 减 小
质 量 增 大
有气体放出
阴离子移向
阳离子移向
原电池正负极的判断
[知识回顾]
1.下列能形成原电池的装置是( )
Zn
Zn
H2SO4
A
A
Zn
Cu
酒精
B
A
Zn
Cu
ZnSO4
C
A
Zn
Cu
H2SO4
D
A
D
任务一:再探究单液原电池
【实验活动一】
将锌片和铜片分别用夹子夹好与电流表串联,再同时放入盛有
CuSO4溶液的烧杯中。观察实验现象并记录。
实际实验现象 预测实验现象
锌片 Zn-2e- = Zn2+
铜片 Cu2++2e- = Cu
电流表
锌片腐蚀,不断溶解
铜片上有红色物质析出
电流表指针发生偏转
任务一:再探究单液原电池
观察实验现象,分析可能原因:
任务一:再探究单液原电池
【实验活动一】
将锌片和铜片分别用夹子夹好与电流表串联,再同时放入盛有
CuSO4溶液的烧杯中。观察实验现象并记录。
实际实验现象 预测实验现象
锌片 Zn-2e- = Zn2+ 锌片不断溶解
铜片 Cu2++2e- = Cu 铜片上有红色物质析出
电流表 电流表指针发生偏转
锌片被红色物质覆盖
铜片上有红色物质析出
电流表读数不断减小
任务一:再探究单液原电池
【思考与讨论1】分析产生上所述现象的原因
1.锌片上有红色物质析出:
2.电流表读数不断减小:
【解决问题的关键】还原剂Zn与氧化剂CuSO4不直接接触
【原因分析】
如何改进?
锌与CuSO4溶液直接接触发生反应生成铜。
因为铜在锌表面析出后,与CuSO4溶液一起形成
了原电池,产生的电流并没有经过电流表,所以电流表的读数不断减小。
任务二:原电池装置的改进
ZnSO4
Zn Cu
CuSO4
A
ZnSO4
Zn Cu
CuSO4
A
1.有无电流产生?
2.为什么没有电流?该如何解决?
思考
盐桥
一种凝胶态的离子导体
实验结论:锌片(还原剂)在与Cu2+(氧化剂)没有直接接触的情况下也能构成原电池,但是需要合适的“桥梁”连接两种电解
质溶液。
盐桥:
通常是将浸泡了饱和KCl溶液的琼胶装在U型管中。
特点:
1.盐桥中的K+、Cl-可以自由移动
2.琼胶起到固定作用,防止KCl溶液直接流出来。
3.离子只出不进。
任务二:原电池装置的改进——双液原电池
对比下图,分析得出双液电池的优缺点,并思考如何改进。
任务二:原电池装置的改进——双液原电池
优点:电流稳定
不足:电流小
任务二:原电池装置的改进——双液原电池
1、阳离子交换膜:只允许阳离子通过
3、质 子 交 换 膜:只允许H+通过
2、阴离子交换膜:只允许阴离子通过
改进
增大电流呢?
缩短盐桥的长度,增大盐桥的横截面积
能否用一张薄薄的隔膜代替盐桥呢?
思考:双液原电池电流弱的原因?
1.离子运动的距离长
2.离子运动的通道窄
3.离子容量小
任务二:原电池装置的改进——双液原电池
离子交换膜
任务三:原电池装置的设计
请利用Cu+2Fe3+=Cu2++2Fe2+,设计一个原电池
盐桥
Cu
C
CuCl2溶液
FeCl3溶液
G
分析半反应
Cu - 2e- = Cu2+
2Fe3+ + 2e- = 2Fe2+
确定电极材料
电源负极(Cu)
电源正极(C/Ag)
组成原电池
形成闭合回路
FeCl3溶液
比负极金属活泼性
弱的金属或石墨
含氧化剂离子的溶液
A
FeCl3溶液
Cu
C
加快氧化还原
反应的速率
防止金属的腐蚀
判断金属的
活动性强弱
设计简单的
原电池装置
任务四:原电池原理的应用
锌与稀硫酸反应时
加少量CuSO4溶液
[小结]原电池工作原理
缺点:
电流不稳定
优点:电流稳定
缺点:电流小
优点:
电流大且稳定
单液电池
双液电池
隔膜型电池
[小结]原电池工作原理
自发的氧化还原反应
闭合回路
原电池
化学能
电能
离子导体
电极材料
电极反应
电子导体
还原反应
氧化反应
[小结]原电池工作原理
