高中必修第一册化学第二章《章末复习》PPT课件(共35页)
文档属性
| 名称 | 高中必修第一册化学第二章《章末复习》PPT课件(共35页) |  | |
| 格式 | ppt | ||
| 文件大小 | 1.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-16 22:23:56 | ||
图片预览









文档简介
(共35张PPT)
第二章 章末复习
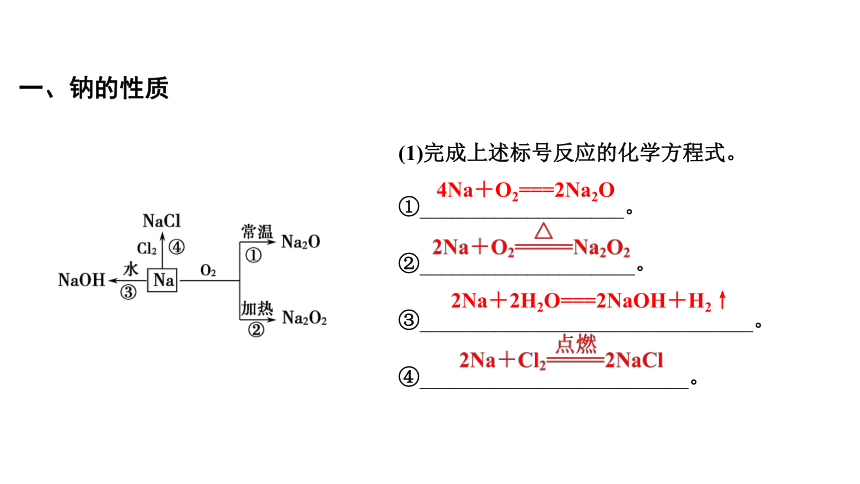
一、钠的性质
(1)完成上述标号反应的化学方程式。
①___________________。
②____________________。
③_______________________________。
④_________________________。
4Na+O2===2Na2O
2Na+2H2O===2NaOH+H2↑
如Na投入CuSO4溶液中,反应的离子方程式为
_________________________________________。
2Na+2H2O+Cu2+===2Na++Cu(OH)2+H2↑
1、取一小块金属钠,放在燃烧匙里加热,下列现象描述正确的是( )
①金属先熔化
②在空气中燃烧,放出黄色火花
③燃烧后得白色固体
④燃烧时火焰为黄色
⑤燃烧后生成淡黄色固体物质
A.②⑤ B.①②③ C.①④⑤ D.④⑤
答案 C
2、下列关于钠的叙述,正确的是( )
A.钠是银白色金属,硬度很大
B.金属钠的熔点很高
C.钠的金属活泼性大于铜,能从CuSO4溶液置换出Cu
D.钠有很强的还原性
答案 D
3、将金属钠放入盛有下列溶液的小烧杯中,既有气体,又有白色沉淀产生的是( )
①MgSO4溶液 ②Na2SO4稀溶液 ③饱和澄清石灰水
④Ca(HCO3)2溶液 ⑤CuSO4溶液 ⑥饱和NaCl溶液
A.①④⑤⑥ B.③④⑤⑥ C.②④⑤⑥ D.①③④⑥
答案 D
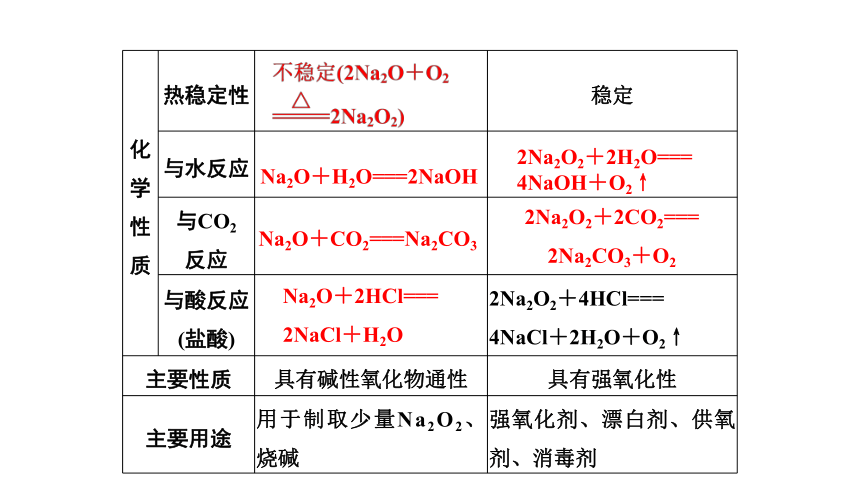
二、氧化钠和过氧化钠的比较
物质 氧化钠(Na2O) 过氧化钠(Na2O2)
色态
类别 过氧化物(非碱性氧化物)
氧的价态
生成条件 常温 加热或点燃
白色固体
淡黄色固体
碱性氧化物
-2
-1
化
学
性
质 热稳定性 稳定
与水反应
与CO2
反应
与酸反应(盐酸) 2Na2O2+4HCl===
4NaCl+2H2O+O2↑
主要性质 具有碱性氧化物通性 具有强氧化性
主要用途 用于制取少量Na2O2、烧碱 强氧化剂、漂白剂、供氧剂、消毒剂
Na2O+H2O===2NaOH
2Na2O2+2H2O===
4NaOH+O2↑
Na2O+CO2===Na2CO3
2Na2O2+2CO2===
2Na2CO3+O2
Na2O+2HCl===
2NaCl+H2O
1、下列各组物质混合后,不能生成NaOH的是( )
A.Na和H2O B.Na2O和H2O
C.Na2O2和H2O D.Ca(OH)2溶液和NaCl溶液
答案 D
2、填空
金属钠露置在空气中会发生一系列变化:银白色金属钠
Na2O
NaOH
溶液
Na2CO3
答案 A
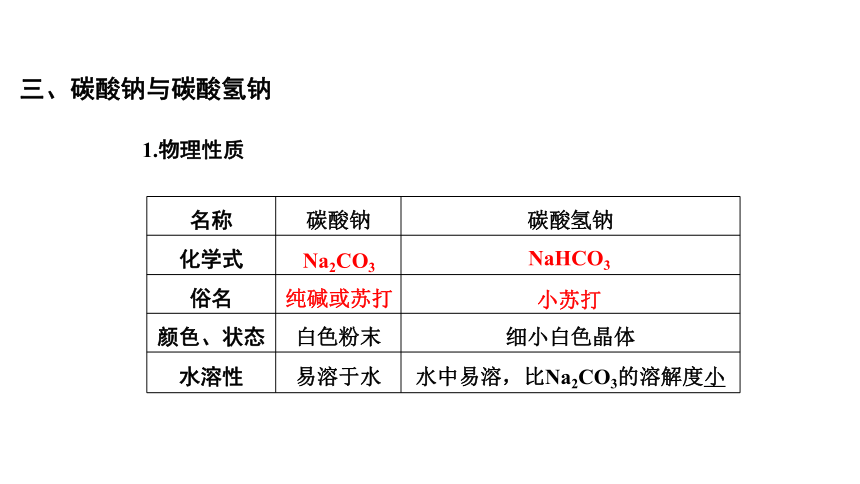
1.物理性质
名称 碳酸钠 碳酸氢钠
化学式
俗名
颜色、状态 白色粉末 细小白色晶体
水溶性 易溶于水 水中易溶,比Na2CO3的溶解度小
Na2CO3
NaHCO3
纯碱或苏打
小苏打
三、碳酸钠与碳酸氢钠
2.化学性质
(1)热稳定性:
①Na2CO3性质稳定,受热难分解。
②NaHCO3性质不稳定,受热易分解,化学方程式为
____________________________________。
(2)与酸(足量盐酸)反应:
①Na2CO3:____________________________________。
②NaHCO3:____________________________________。
Na2CO3+2HCl===2NaCl+CO2↑+H2O
NaHCO3+HCl===NaCl+CO2↑+H2O
(3)与碱(NaOH溶液)反应:
①Na2CO3:与NaOH溶液不反应。
②NaHCO3:________________________________。
提醒:NaHCO3与Ca(OH)2反应与量有关,书写时加以注意。
(4)相互转化:
①Na2CO3―→NaHCO3
向Na2CO3溶液中通入CO2,化学方程式为
_________________________________。
②NaHCO3―→Na2CO3
NaHCO3固体加热分解转化成Na2CO3。
NaHCO3+NaOH===Na2CO3+H2O
Na2CO3+CO2+H2O===2NaHCO3
1、下列说法正确的是( )
A.NaHCO3的热稳定性比Na2CO3强
B.等质量的Na2CO3、NaHCO3分别与足量的盐酸反应,前者产生的CO2多
C.足量的Na2CO3和NaHCO3分别与等物质的量的盐酸反应,两者产生的CO2一样多
D.等物质的量的Na2CO3和NaHCO3分别与足量盐酸反应,前者消耗的盐酸多
答案 D
2、碳酸钠(Na2CO3)俗称纯碱,是一种重要的基础化工原料,广泛应用于玻璃、造纸等工业。下列与碳酸钠有关的说法正确的是( )
A.Na2CO3的稳定性介于Na2CO3·10H2O和NaHCO3之间
B.“侯氏制碱法”制得的碱是指NaHCO3
C.可用盐酸鉴别Na2CO3和NaHCO3固体
D.纯碱有时可代替烧碱使用,比如溶解石英、促进乙酸乙酯的水解等
答案 C
3、有两试管分别装有Na2CO3和NaHCO3溶液,下列操作或判断正确的是( )
方案 操作 判断
A 分别加入澄清石灰水 产生沉淀的为Na2CO3
B 分别加入等浓度的稀盐酸 反应较剧烈的为Na2CO3
C 分别加入CaCl2溶液 产生沉淀的为Na2CO3
D 逐渐加入等浓度的盐酸 立即产生气泡的为Na2CO3
解析 Na2CO3溶液与CaCl2溶液反应产生白色沉淀而NaHCO3溶液与CaCl2溶液不反应,C正确。
答案 C
(1)与非金属反应。
与H2反应:______________________,
苍白
白雾
爆炸
白雾
(2)与水反应:溶于水的氯气部分与水反应。
离子方程式为___________________________。
(3)与碱反应:与NaOH溶液反应。
离子方程式为_______________________________。
Cl2+2OH-===Cl-+ClO-+H2O
四、氯气的性质
(4)与还原性无机化合物反应。
①与碘化钾溶液反应:______________________。
②与SO2水溶液反应:_______________________________。
③与FeCl2溶液反应:
离子方程式为_________________________。
Cl2+2KI===2KCl+I2
Cl2+SO2+2H2O===H2SO4+2HCl
Cl2+2Fe2+===2Fe3++2Cl-
氯的重要化合物
(1)次氯酸
弱
棕色
(2)漂白粉
CaCl2和Ca(ClO)2
Ca(ClO)2
2Cl2+2Ca(OH)2===CaCl2+Ca(ClO)2+2H2O
碱
氧化
Ca(ClO)2+CO2+H2O===CaCO3↓+2HClO
Ca(ClO)2+CO2+H2O===CaCO3↓+2HClO
1、下列物质能使干燥的蓝色石蕊试纸先变红后褪色的是( )
①氯气 ②液氯 ③新制的氯水 ④氯气的酒精溶液 ⑤盐酸 ⑥盐酸酸化的漂白粉溶液
A.①②③ B.①②③⑥ C.③⑥ D.②④⑤⑥
答案 C
2、下列离子方程式中,错误的是( )
A.氯气与烧碱溶液反应:Cl2+2OH-===Cl-+ClO-+H2O
B.氯气与水反应:Cl2+H2O H++Cl-+HClO
C.盐酸与AgNO3溶液反应:HCl+Ag+===H++AgCl↓
D.NaCl溶液与AgNO3溶液反应:Cl-+Ag+===AgCl↓
答案 C
2.氯水中含有多种成分,因而具有多种性质,根据氯水分别与如图四种物质发生的反应填空(a、b、c、d重合部分代表物质间反应,且氯水足量)。
(1)能证明氯水具有漂白性的是________(填“a”、“b”、“c”或“d”)。
(2)c过程中的现象是__________________________________,
b过程中反应的离子方程式为________________________。
(3)a过程中反应的化学方程式为______________________。
五、氯气的实验室制法及性质的实验探究
1.实验装置
2.制取过程
MnO2+
饱和食
盐水
浓H2SO4
向上排
空气法
排饱和食
盐水法
淀粉-
碘化钾
蓝色石蕊
卤素离子的检验方法
(1)AgNO3溶液——沉淀法:
1、某校化学兴趣小组利用在加热条件下浓盐酸与二氧化锰的反应来制取并收集氯气,实验装置如右图所示。
(1)写出该反应的离子方程式:
_________________________________________。
(2)上述反应中,浓盐酸的作用:_______________。
(3)兴趣小组的同学准备在烧杯中加入下列溶液中的一种来吸收残余氯气,你认为其中错误的是___。
A.NaOH溶液 B.Na2CO3溶液 C.浓硫酸
酸性、还原剂
C
2、化学实验有助于理解化学知识,形成化学观念,提高探究与创新能力,提升科学素养。在实验室中用浓盐酸与MnO2共热制取Cl2并进行相关实验。
(1)写出实验室制取Cl2的化学方程式_____________________。
(2) 右图收集Cl2的正确装置是________。
(3)将Cl2通入水中,所得溶液中具有氧化性的含氯粒子是____________________________________。
(4)设计实验比较Cl2和Br2的氧化性,操作与现象是:取少量新制氯水和CCl4于试管中,__________。
六、物质的量浓度及其相关计算
1.物质的量浓度
单位体积溶液
mol·L-1
浓度
物质的量
2.物质的量浓度与溶质质量分数的比较
内容 物质的量浓度 质量分数
定义 以单位体积溶液里所含溶质的物质的量来表示溶液组成的物理量 用溶质质量与溶液质量之比来表示溶液组成的物理量
溶质的单位 mol g
溶液的单位 L g
计算公式
1、如图是实验室配制好的两瓶NaOH溶液的标签(14%的NaOH溶液的密度为1.14 g·cm-3)。
14%的NaOH溶液的物质的量浓度及从瓶中取出20 mL该溶液中含有溶质的质量分别是( )
A.4.0 mol·L-1 3.2 g B.2.0 mol·L-1 3.2 g
C.4.0 mol·L-1 6.4 g D.2.0 mol·L-1 6.4 g
答案 A
2、将30 mL 0.5 mol·L-1 NaOH溶液加水稀释到500 mL,关于稀释后的溶液叙述不正确的是( )
A.浓度为0.03 mol·L-1
B.从中取出10 mL溶液,其浓度为0.03 mol·L-1
C.含NaOH 0.6 g
D.从中取出10 mL溶液,含NaOH 0.015 mol
答案 D
3.以配制480 mL 1 mol·L-1 NaOH溶液为例,所需容量瓶的规格:________。
(1)计算(填写计算过程与结果):
m(NaOH)=____________________________________。
(2)称量:根据计算结果,称量固体质量。
(3)溶解:将称量好的固体放入烧杯中,加适量蒸馏水溶解,并用______搅拌;溶解过程中玻璃棒的作用为_______________。
(4)转移(移液):
①移液前需要将溶液冷却至室温。
②移液中玻璃棒的作用为_____。
500 mL
1 mol·L-1×0.5 L×40 g·mol-1=20.0 g
玻璃棒
搅拌,加速溶解
引流
(6)定容:
①将蒸馏水注入容量瓶,在液面离容量瓶颈刻度线下________时,改用胶头滴管滴加蒸馏水。
②定容时要平视刻度线,至凹液面最低处与刻度线_____。
(7)摇匀:盖好瓶塞,上下反复颠倒,摇匀。
1~2 cm
相切
第二章 章末复习
一、钠的性质
(1)完成上述标号反应的化学方程式。
①___________________。
②____________________。
③_______________________________。
④_________________________。
4Na+O2===2Na2O
2Na+2H2O===2NaOH+H2↑
如Na投入CuSO4溶液中,反应的离子方程式为
_________________________________________。
2Na+2H2O+Cu2+===2Na++Cu(OH)2+H2↑
1、取一小块金属钠,放在燃烧匙里加热,下列现象描述正确的是( )
①金属先熔化
②在空气中燃烧,放出黄色火花
③燃烧后得白色固体
④燃烧时火焰为黄色
⑤燃烧后生成淡黄色固体物质
A.②⑤ B.①②③ C.①④⑤ D.④⑤
答案 C
2、下列关于钠的叙述,正确的是( )
A.钠是银白色金属,硬度很大
B.金属钠的熔点很高
C.钠的金属活泼性大于铜,能从CuSO4溶液置换出Cu
D.钠有很强的还原性
答案 D
3、将金属钠放入盛有下列溶液的小烧杯中,既有气体,又有白色沉淀产生的是( )
①MgSO4溶液 ②Na2SO4稀溶液 ③饱和澄清石灰水
④Ca(HCO3)2溶液 ⑤CuSO4溶液 ⑥饱和NaCl溶液
A.①④⑤⑥ B.③④⑤⑥ C.②④⑤⑥ D.①③④⑥
答案 D
二、氧化钠和过氧化钠的比较
物质 氧化钠(Na2O) 过氧化钠(Na2O2)
色态
类别 过氧化物(非碱性氧化物)
氧的价态
生成条件 常温 加热或点燃
白色固体
淡黄色固体
碱性氧化物
-2
-1
化
学
性
质 热稳定性 稳定
与水反应
与CO2
反应
与酸反应(盐酸) 2Na2O2+4HCl===
4NaCl+2H2O+O2↑
主要性质 具有碱性氧化物通性 具有强氧化性
主要用途 用于制取少量Na2O2、烧碱 强氧化剂、漂白剂、供氧剂、消毒剂
Na2O+H2O===2NaOH
2Na2O2+2H2O===
4NaOH+O2↑
Na2O+CO2===Na2CO3
2Na2O2+2CO2===
2Na2CO3+O2
Na2O+2HCl===
2NaCl+H2O
1、下列各组物质混合后,不能生成NaOH的是( )
A.Na和H2O B.Na2O和H2O
C.Na2O2和H2O D.Ca(OH)2溶液和NaCl溶液
答案 D
2、填空
金属钠露置在空气中会发生一系列变化:银白色金属钠
Na2O
NaOH
溶液
Na2CO3
答案 A
1.物理性质
名称 碳酸钠 碳酸氢钠
化学式
俗名
颜色、状态 白色粉末 细小白色晶体
水溶性 易溶于水 水中易溶,比Na2CO3的溶解度小
Na2CO3
NaHCO3
纯碱或苏打
小苏打
三、碳酸钠与碳酸氢钠
2.化学性质
(1)热稳定性:
①Na2CO3性质稳定,受热难分解。
②NaHCO3性质不稳定,受热易分解,化学方程式为
____________________________________。
(2)与酸(足量盐酸)反应:
①Na2CO3:____________________________________。
②NaHCO3:____________________________________。
Na2CO3+2HCl===2NaCl+CO2↑+H2O
NaHCO3+HCl===NaCl+CO2↑+H2O
(3)与碱(NaOH溶液)反应:
①Na2CO3:与NaOH溶液不反应。
②NaHCO3:________________________________。
提醒:NaHCO3与Ca(OH)2反应与量有关,书写时加以注意。
(4)相互转化:
①Na2CO3―→NaHCO3
向Na2CO3溶液中通入CO2,化学方程式为
_________________________________。
②NaHCO3―→Na2CO3
NaHCO3固体加热分解转化成Na2CO3。
NaHCO3+NaOH===Na2CO3+H2O
Na2CO3+CO2+H2O===2NaHCO3
1、下列说法正确的是( )
A.NaHCO3的热稳定性比Na2CO3强
B.等质量的Na2CO3、NaHCO3分别与足量的盐酸反应,前者产生的CO2多
C.足量的Na2CO3和NaHCO3分别与等物质的量的盐酸反应,两者产生的CO2一样多
D.等物质的量的Na2CO3和NaHCO3分别与足量盐酸反应,前者消耗的盐酸多
答案 D
2、碳酸钠(Na2CO3)俗称纯碱,是一种重要的基础化工原料,广泛应用于玻璃、造纸等工业。下列与碳酸钠有关的说法正确的是( )
A.Na2CO3的稳定性介于Na2CO3·10H2O和NaHCO3之间
B.“侯氏制碱法”制得的碱是指NaHCO3
C.可用盐酸鉴别Na2CO3和NaHCO3固体
D.纯碱有时可代替烧碱使用,比如溶解石英、促进乙酸乙酯的水解等
答案 C
3、有两试管分别装有Na2CO3和NaHCO3溶液,下列操作或判断正确的是( )
方案 操作 判断
A 分别加入澄清石灰水 产生沉淀的为Na2CO3
B 分别加入等浓度的稀盐酸 反应较剧烈的为Na2CO3
C 分别加入CaCl2溶液 产生沉淀的为Na2CO3
D 逐渐加入等浓度的盐酸 立即产生气泡的为Na2CO3
解析 Na2CO3溶液与CaCl2溶液反应产生白色沉淀而NaHCO3溶液与CaCl2溶液不反应,C正确。
答案 C
(1)与非金属反应。
与H2反应:______________________,
苍白
白雾
爆炸
白雾
(2)与水反应:溶于水的氯气部分与水反应。
离子方程式为___________________________。
(3)与碱反应:与NaOH溶液反应。
离子方程式为_______________________________。
Cl2+2OH-===Cl-+ClO-+H2O
四、氯气的性质
(4)与还原性无机化合物反应。
①与碘化钾溶液反应:______________________。
②与SO2水溶液反应:_______________________________。
③与FeCl2溶液反应:
离子方程式为_________________________。
Cl2+2KI===2KCl+I2
Cl2+SO2+2H2O===H2SO4+2HCl
Cl2+2Fe2+===2Fe3++2Cl-
氯的重要化合物
(1)次氯酸
弱
棕色
(2)漂白粉
CaCl2和Ca(ClO)2
Ca(ClO)2
2Cl2+2Ca(OH)2===CaCl2+Ca(ClO)2+2H2O
碱
氧化
Ca(ClO)2+CO2+H2O===CaCO3↓+2HClO
Ca(ClO)2+CO2+H2O===CaCO3↓+2HClO
1、下列物质能使干燥的蓝色石蕊试纸先变红后褪色的是( )
①氯气 ②液氯 ③新制的氯水 ④氯气的酒精溶液 ⑤盐酸 ⑥盐酸酸化的漂白粉溶液
A.①②③ B.①②③⑥ C.③⑥ D.②④⑤⑥
答案 C
2、下列离子方程式中,错误的是( )
A.氯气与烧碱溶液反应:Cl2+2OH-===Cl-+ClO-+H2O
B.氯气与水反应:Cl2+H2O H++Cl-+HClO
C.盐酸与AgNO3溶液反应:HCl+Ag+===H++AgCl↓
D.NaCl溶液与AgNO3溶液反应:Cl-+Ag+===AgCl↓
答案 C
2.氯水中含有多种成分,因而具有多种性质,根据氯水分别与如图四种物质发生的反应填空(a、b、c、d重合部分代表物质间反应,且氯水足量)。
(1)能证明氯水具有漂白性的是________(填“a”、“b”、“c”或“d”)。
(2)c过程中的现象是__________________________________,
b过程中反应的离子方程式为________________________。
(3)a过程中反应的化学方程式为______________________。
五、氯气的实验室制法及性质的实验探究
1.实验装置
2.制取过程
MnO2+
饱和食
盐水
浓H2SO4
向上排
空气法
排饱和食
盐水法
淀粉-
碘化钾
蓝色石蕊
卤素离子的检验方法
(1)AgNO3溶液——沉淀法:
1、某校化学兴趣小组利用在加热条件下浓盐酸与二氧化锰的反应来制取并收集氯气,实验装置如右图所示。
(1)写出该反应的离子方程式:
_________________________________________。
(2)上述反应中,浓盐酸的作用:_______________。
(3)兴趣小组的同学准备在烧杯中加入下列溶液中的一种来吸收残余氯气,你认为其中错误的是___。
A.NaOH溶液 B.Na2CO3溶液 C.浓硫酸
酸性、还原剂
C
2、化学实验有助于理解化学知识,形成化学观念,提高探究与创新能力,提升科学素养。在实验室中用浓盐酸与MnO2共热制取Cl2并进行相关实验。
(1)写出实验室制取Cl2的化学方程式_____________________。
(2) 右图收集Cl2的正确装置是________。
(3)将Cl2通入水中,所得溶液中具有氧化性的含氯粒子是____________________________________。
(4)设计实验比较Cl2和Br2的氧化性,操作与现象是:取少量新制氯水和CCl4于试管中,__________。
六、物质的量浓度及其相关计算
1.物质的量浓度
单位体积溶液
mol·L-1
浓度
物质的量
2.物质的量浓度与溶质质量分数的比较
内容 物质的量浓度 质量分数
定义 以单位体积溶液里所含溶质的物质的量来表示溶液组成的物理量 用溶质质量与溶液质量之比来表示溶液组成的物理量
溶质的单位 mol g
溶液的单位 L g
计算公式
1、如图是实验室配制好的两瓶NaOH溶液的标签(14%的NaOH溶液的密度为1.14 g·cm-3)。
14%的NaOH溶液的物质的量浓度及从瓶中取出20 mL该溶液中含有溶质的质量分别是( )
A.4.0 mol·L-1 3.2 g B.2.0 mol·L-1 3.2 g
C.4.0 mol·L-1 6.4 g D.2.0 mol·L-1 6.4 g
答案 A
2、将30 mL 0.5 mol·L-1 NaOH溶液加水稀释到500 mL,关于稀释后的溶液叙述不正确的是( )
A.浓度为0.03 mol·L-1
B.从中取出10 mL溶液,其浓度为0.03 mol·L-1
C.含NaOH 0.6 g
D.从中取出10 mL溶液,含NaOH 0.015 mol
答案 D
3.以配制480 mL 1 mol·L-1 NaOH溶液为例,所需容量瓶的规格:________。
(1)计算(填写计算过程与结果):
m(NaOH)=____________________________________。
(2)称量:根据计算结果,称量固体质量。
(3)溶解:将称量好的固体放入烧杯中,加适量蒸馏水溶解,并用______搅拌;溶解过程中玻璃棒的作用为_______________。
(4)转移(移液):
①移液前需要将溶液冷却至室温。
②移液中玻璃棒的作用为_____。
500 mL
1 mol·L-1×0.5 L×40 g·mol-1=20.0 g
玻璃棒
搅拌,加速溶解
引流
(6)定容:
①将蒸馏水注入容量瓶,在液面离容量瓶颈刻度线下________时,改用胶头滴管滴加蒸馏水。
②定容时要平视刻度线,至凹液面最低处与刻度线_____。
(7)摇匀:盖好瓶塞,上下反复颠倒,摇匀。
1~2 cm
相切
