河南省获嘉县2023-2024学年高二上学期12月月考化学试卷(含解析)
文档属性
| 名称 | 河南省获嘉县2023-2024学年高二上学期12月月考化学试卷(含解析) |

|
|
| 格式 | docx | ||
| 文件大小 | 740.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-17 00:00:00 | ||
图片预览




文档简介
绝密★启用前
获嘉县2023-2024学年高二上学期12月月考化学试卷
姓名:_________班级:_________考号:_________
注意事项
1.答题前填写好自己的姓名、班级、考号等信息
2.请将答案正确填写在答题卡上
一、选择题:本题共16小题,每小题3分,共48分.在每小题给出的四个选项中,只有一项是符合题目要求的.
1.下列有关碰撞理论的说法正确的是( )
A.活化分子数目越多,反应速率越快 B.反应速率与有效碰撞次数成正比
C.活化分子的平均能量就是活化能 D.升高温度,活化分子百分数增大,反应速率加快
2.化学反应总是伴随着能量的变化,下列反应的能量变化与图中所示能量变化一致的是( )
A.甲烷燃烧 B.钠放入水中
C.和在催化剂作用下生成 D.和晶体混合
3.已知,若该反应的反应速率分别用、、、表示,则下列关系式正确的是( )
A、 B、
C、 D、
4.下列有关反应热和能量的说法正确的是( )
A.任何条件下,同一反应的热与反应的焓变都是相等的
B.有能量变化的过程不一定是化学变化
C.形成新的化学键的过程不一定会释放能量
D.高温条件下发生的反应一定是吸热反应
5.在某一恒容密闭容器中发生反应:.下列叙述不能说明该反应已达到化学平衡状态的是( )
A.容器内的总压强不随时间而变化 B.三种气体的浓度相等
C.的分解速率与生成速率相等 D.混合气体的平均相对分子质量不再发生变化
6.已知的氧化反应:分两步进行:
步骤Ⅰ.
步骤Ⅱ.
反应过程中能量变化如图所示.下列说法正确的是( )
A. B.决定氧化反应速率的是步骤Ⅱ
C.步骤Ⅰ的活化能为 D.的总能量一定高于的总能量
7.常温常压下,甲醇完全燃烧生成和液态水时放热,下列热化学方程式正确的是( )
A.
B.
C.
D.
8.氟利昂-11是一种常见的制冷剂.破坏臭氧层的过程如图所示,下列说法错误的是( )
A.过程Ⅰ的 B.过程Ⅱ可表示为
C.过程Ⅲ中有非极性共价键形成 D.上述过程说明是臭氧分解的催化剂
9.一定温度下,在某恒容密闭容器中加入一定量X(?)发生反应:,反应达到平衡后,仅降低温度,容器内气体的密度增大.下列叙述正确的是( )
A.若正反应是吸热反应,则X为非气态
B.若正反应是放热反应,则X为气态
C.若X为气态,则向平衡体系中加入少量X,X的平衡转化率不变
D.若X为非气态,则向平衡体系中加入少量X,反应的平衡常数增大
10.温度为T℃时,在4L恒容密闭容器中充入X、Y两种气体后生成Z气体,其中各组分的物质的量随时间的变化关系如图所示,下列说法正确的是( )
A.该反应的化学方程式是
B.内的平均反应速率
C.达到平衡时,X、Y的转化率相等
D.其他条件不变,升高温度,反应速率加快
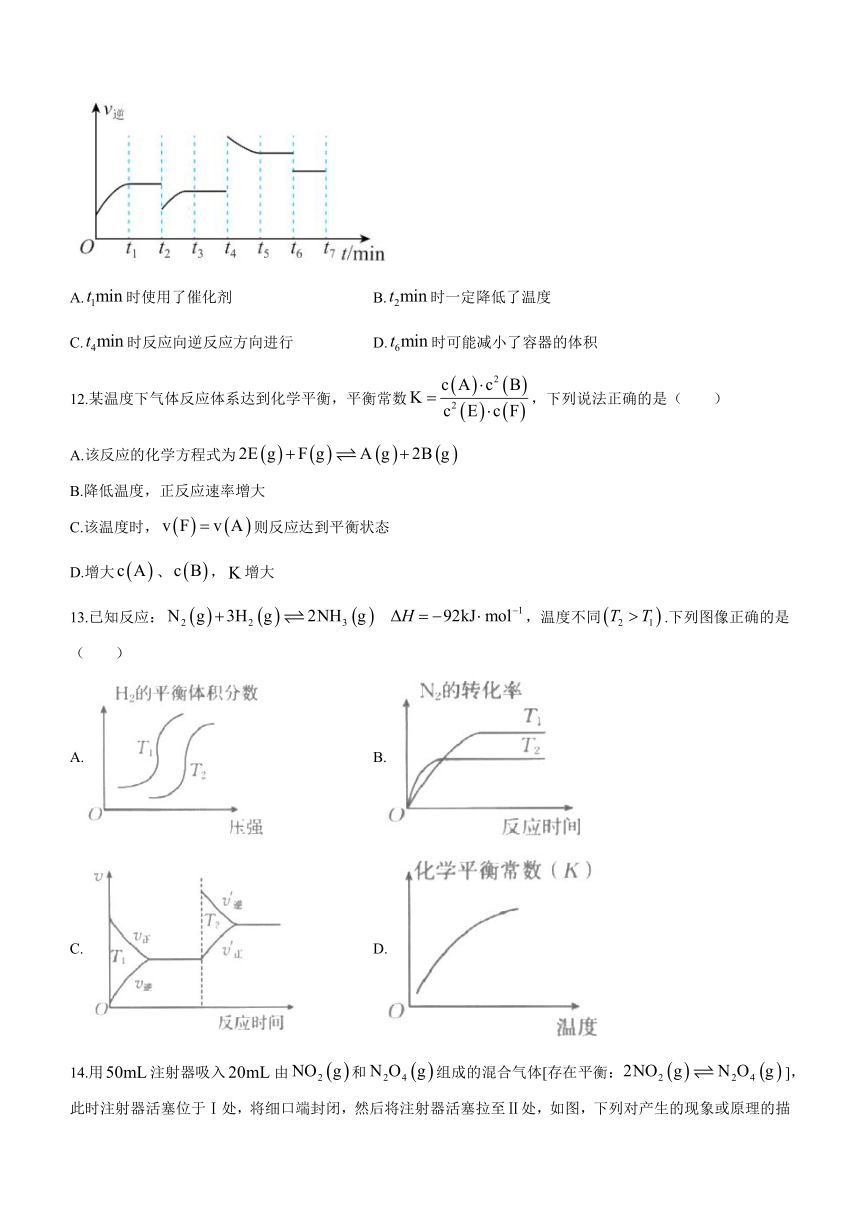
11.在密闭容器中进行反应,逆反应的反应速率随时间变化的关系如图所示.下列有关说法正确的是( )
A.时使用了催化剂 B.时一定降低了温度
C.时反应向逆反应方向进行 D.时可能减小了容器的体积
12.某温度下气体反应体系达到化学平衡,平衡常数,下列说法正确的是( )
A.该反应的化学方程式为
B.降低温度,正反应速率增大
C.该温度时,则反应达到平衡状态
D.增大、,增大
13.已知反应:,温度不同.下列图像正确的是( )
A. B.
C. D.
14.用注射器吸入由和组成的混合气体[存在平衡:],此时注射器活塞位于Ⅰ处,将细口端封闭,然后将注射器活塞拉至Ⅱ处,如图,下列对产生的现象或原理的描述正确的是( )
A.把活塞从Ⅰ处拉到Ⅱ处,过程中注射器中颜色一直变深,然后保持不变
B.当体系处于稳定状态时,混合气体中的百分含量:ⅠⅡ
C.若将活塞固定在Ⅰ处,升高温度,注射器中颜色变深,则说明
D.若再把活塞从Ⅱ处推回Ⅰ处,则过程中注射器中颜色先变深后变浅
15.在恒温的密闭容器中,加入和足量活性炭发生反应,测得平衡时和的物质的量浓度与平衡总压的关系如图所示(为以分压表示的平衡常数,分压总压×物质的量分数).下列说法错误的是( )
A.图示的三个点中,a点的转化率最高 B.该温度下,c点的
C.减小容器体积可实现从c点到b点的移动 D.a、b、c三点的大小相同
16.铁触媒催化合成氨的反应历程如图所示,其中吸附在催化剂表面的物质用“ad”表示,下列说法正确的是( )
A.“吸附”过程吸热,“脱附”过程放热
B.合成氨反应的
C.降温或加压可以增大反应速率
D.该历程中反应速率最慢的过程为
二、非选择题:(本题共4小题,共52分)
17.(14分)盐酸与溶液在如图所示装置中进行中和反应,通过测定反应过程中所放出的热量可计算中和反应反应热.回答下列问题:
(1)从实验装置上看,图中尚缺少的一种玻璃仪器是______________________(2分)
(2)大烧杯上若不盖硬纸板,则求得的中和反应反应热______________________(2分)(填“偏大”“偏小”或“无影响”),在操作正确的前提下,提高中和反应反应热的测定准确性的关键是____________________________________________.(2分)
(3)计算中和反应反应热时,至少需要的数据是______________________(填标号).(2分)
a.盐酸的浓度
b.溶液的浓度
c.比热容
d.反应后溶液的质量
e.生成水的物质的量
f.反应前后溶液温度的变化
g.操作所需的时间
(4)实验中改用盐酸与溶液进行反应,与上述实验相比,所放出的热量______________________(填“相等”或“不相等”,下同)(2分)
所求的生成时中和反应反应热______________________,(2分)
(5)进行中和反应反应热的测定时,保持其他条件相同,使用的酸碱组合:
①稀硫酸、溶液;②稀盐酸、溶液;③醋酸溶液、氨水;④稀硫酸、氨水
测得生成时的中和反应反应热由大到小的顺序为______________________(填标号).(2分)
18.(14分)、、是工业上重要的化工原料.
已知:①
②
③
请回答下列问题:
(1)上述反应中属于放热反应的是______________________(填标号).(2分)
(2)完全燃烧放出的热量为______________________.(2分)
(3)表示的燃烧热的热化学方程式为______________________(2分)
(4)由和组成的混合气体在足量氧气中充分燃烧放出的热量为,则混合气体中、的物质的量分别为______________mol、(2分)______________________mol.(2分)
(5)等质量的、、完全燃烧,放热最多的是________(填化学式).(2分)
(6)某些常见化学键的键能数据如下表:
化学键
键能 803 463 436 1076
则__________.(2分)
19.(10分)丙烯是三大合成材料的基本原料之一,其中生产聚丙烯时丙烯用量最大.另外,丙烯还可用于生产多种重要有机化工原料.由丙烷制丙烯的两种方法如下:
Ⅰ.丙烷催化脱氢法:
Ⅱ.丙烷催化氧化法:
请回答下列问题:
(1)已知,由此计算_________.(2分)
(2)下,向恒容密闭容器中充入,加入催化剂发生催化脱氢反应.体系内压强变化如表所示.
时间/min 0 1 3 5 7
压强 /kPa
①下列能说明该反应达到平衡状态的是____________(填标号).(2分)
a.丙烷的消耗速率等于丙烯的生成速率 b.容器内气体的密度不再发生变化
c.容器内的压强不再发生变化 d.容器内气体平均相对分子质量不再变化
②内,用表示该反应的反应速率为___________.(2分)
③的平衡转化率为_________,(2分)该反应的平衡常数_________(为以分压表示的平衡常数,分压总压×物质的量分数,保留2位小数).(2分)
20.(14分)一定温度下,在密闭容器中发生反应,正反应速率表达式为(是正反应速率常数,只与温度有关).测得正反应速率常数与浓度关系如表所示:
序号
Ⅰ 0.10 0.10 0.15
Ⅱ 0.20 0.20 2.40
Ⅲ 0.20 0.10 1.20
(1)_____________,(2分)___________.(2分)
(2)向容积为的恒容密闭容器中仅充入和,发生上述反应,测得随时间的变化如图所示.
①__________(填“>”、“<”或“=”,下同),(2分)物质D的聚集状态为____________;(2分)a点时气体A的(正)__________b点时气体A的(正).(2分)
②时,此反应的平衡常数__________(不写单位).(2分)
③a、b、c三点气体C的逆反应速率由大到小的顺序为__________(用a、b、c表示).(2分)
获嘉县2023-2024学年高二上学期12月月考化学试卷答案
1.D 【解析】A.单位体积的活化分子数越多,单位时间内有效碰撞次数越多,反应速率越快,A错误;
B.反应速率与单位时间内有效碰撞次数成正比,B错误;
C.活化分子的平均能量与所有分子的平均能量之差称为活化能,C错误;
D.升高温度,活化分子百分数增大,单位体积活化分子数增多,反应速率加快,D正确;故选D.
2.D 【解析】A.甲烷燃烧的反应为放热反应,反应的能量变化与图中所示能量变化不一致,故A不符合题意;
B.钠与水的反应为放热反应,反应的能量变化与图中所示能量变化不一致,故B不符合题意;
C.合成氨反应为放热反应,反应的能量变化与图中所示能量变化不一致,故C不符合题意;
D.八水氢氧化钡与氯化铵固体的反应为吸热反应,反应的能量变化与图中所示能量变化一致,故D符合题意;故选D.
3.A 【解析】用不同物质表示同一反应速率,速率之比等于化学计量使之比,则,由此得出、、、,则BCD错误,A正确;答案选A.
4.B 【解析】同一反应的热与反应的焓变不一定相等,故A项错误;
有能量变化的过程不一定是化学变化,可能是物理变化,故B项正确;
形成新的化学键的过程一定会释放能量,故C项错误;
高温条件下发生的反应可能是放热反应,故D项错误.
5.B 【解析】A.反应前后气体物质的量变化,容器体积不变,容器内总压强是变量,容器内的总压强不随时间而变化,说明反应达到平衡状态,A错误;
B.三种气体的浓度保持不变是平衡的标志,但浓度相同不能说明,B正确;
C.的分解速率与生成速率相等证明氨气的正逆反应速率相同,说明反应达到平衡状态,C错误;
D.反应前后气体质量不变,但反应前后气体物质的量变化,当混合气体的平均相对分子质量不再发生变化,说明反应达到平衡,D错误;故选B.
6.B 【解析】.A.由图中信息可知,反应物的总能量为,生成物的总能量为,则,A不正确;B.从图中可以看出,步骤Ⅰ的活化能小于步骤Ⅱ的活化能,则决定氧化反应速率的是步骤Ⅱ,B正确;C.步骤Ⅰ中,反应物的总能量为,活化分子的最低能量为,则活化能为,C不正确;D.因为反应为放热反应,则与的总能量一定高于的总能量,但的总能量不一定高于的总能量,D不正确;故选B.
7.A 【解析】A.甲醇的燃烧热的热化学方程式为,A项正确;
B.燃烧热的热化学方程式中甲醇的系数应为1,且根据计算可知甲醇燃烧放出的热量为,B项错误;
C.甲醇燃烧为放热反应,应为负值,C项错误;
D.甲醇的燃烧热为甲醇完全燃烧生成和时所放出的热量,D项错误;
故选A.
8.D
9.C 【解析】A.若正反应是吸热反应,则降低温度,平衡将逆向移动,要使得容器内气体总质量增大,根据反应过程中质量守恒定律可知,X一定为气态,故A项错误;
B.若正反应是放热反应,则降低温度,平衡将正向移动,若X为气态,根据反应过程中质量守恒定律可知,平衡移动会使得容器内气体总质量降低,因此X一定为非气态,故B项错误;
C.若X为气态,则反应前后气体的物质的量不变,向平衡体系中加入少量X,加入X瞬间,平衡将正向移动,但压强对该反应的平衡无影响,两平衡互为等效,因此X的平衡转化率不变,故C项正确;
D.平衡常数只与反应本身以及温度有关,当温度不变时,达到平衡时的平衡常数相同,故D项错误;
综上所述,说法正确的是C项.
10.D 【解析】A.X、Y的物质的量减少,Z物质的量增多,X、Y是反应物,Z是生成物,X、Y、Z的物质的量变化分别是2mol、1mol、1mol,变化量比等于系数比,该反应的化学方程式是,故A错误;
B.内的平均反应速率,故B错误;
C.达到平衡时,X的转化率为,Y的转化率为,故C错误;
D.其他条件不变,升高温度,活化分子百分数增大,有效碰撞几率增大,反应速率加快,故D正确.
11.C 【解析】.A.时逆反应速率不变,说明反应达平衡,没有使用催化剂,A项错误;
B.后达新平衡的速率与前小一些,故改变的条件是C的浓度降低,或者降低温度,B项错误;
C.时改变的条件是升温,该反应是是放热反应,故此时反应逆向进行,C项正确;
D.时,逆反应速率降低后不再变化,说明平衡未移动,因此可能是增大了容器的体积,D错误.
故答案选C.
12.A 【解析】A.化学平衡常数是生成物浓度的系数次方的乘积与反应物浓度系数次方的乘积的比值,根据该反应的平衡常数表达式可知,该反应的化学方程式为,故A正确;
B.降低温度,活化分子百分数减小,有效碰撞几率减小,正逆反应速率都减慢,故B错误;
C.未说明F、A是正反应速率还是逆反应速率,不能判断反应是否达到平衡状态,反应不一定达到平衡状态,故C错误;
D.平衡常数只与温度有关,若温度不变,、,K不变,故D错误;选A.
13.B 【解析】该反应是一个正向放热、气体体积缩小的反应.
固定温度,增大压强,平衡正移,的平衡体积分数减小,A项错误;
温度高,反应先达到平衡状态,,降温,平衡正向移动,转化率升高,B项正确;
平衡后,升高温度,瞬间正、逆反应速率均增大,C项错误;
升高温度,平衡逆向移动,化学平衡常数减小,D项错误.
综上所述,故选B项.
14.D 【解析】.A.把活塞从Ⅰ处拉到Ⅱ处,过程中由于体积增大,注射器中颜色先变浅,后由于平衡逆向移动,颜色后又变深,最终达到新平衡,颜色保持不变,A项错误;
B.当体系处于稳定状态时,Ⅱ处相对于Ⅰ处为减小压强,平衡逆向移动,混合气体中的百分含量:Ⅰ<Ⅱ,B项错误;
C.若将活塞固定在Ⅰ处,升高温度,注射器中颜色变深,说明平衡逆向移动,逆反应为吸热反应,则,C项错误;
D.若再把活塞从Ⅱ处推回Ⅰ处,过程中由于体积缩小,注射器中颜色先变深,后由于平衡正向移动,颜色后又变浅,D项正确;答案选D.
15.B 【解析】A.该反应为正向气体体积增大的反应,压强小有利于正反应的进行,故图示的三个点中,点的转化率最高,A正确;
B.点时,的平衡浓度与的平衡浓度相等,列三段式可求出该条件下平衡时:、,可求出,B错误;
C.减小容器体积(即增大反应的压强)可实现从c点到b点的移动,C正确;
D.恒温条件下保持不变,D正确;故选B.
16.B 【解析】A.由图可知,“吸附”是放热过程,而“脱附”则是吸热过程,选项A错误;
B.由图像可知,,即,选项B正确;
C.降温减小反应速率,选项C错误;
D.反应历程中反应速率最慢的过程应为活化能最大的过程,由图可知的活化能不为最大,选项D错误;答案选B.
二、非选择题:本题共4小题,共55分.
17.(14分)【答案】
(1)玻璃搅拌器(2分)
(2)偏大(2分) 提高装置的保温效果(2分)
(3)cdef(2分)
(4)不相等(2分) 相等(2分)(5)③>④>②>①(2分)
【解析】
(1)根据量热计的构造可知该装置的缺少仪器是环形玻璃搅拌器.
(2)大烧杯上如不盖硬纸板,会有一部分热量散失,求得的中和热数值将会减小,中和反应反应热偏大;提高中和反应反应热的测定准确性的关键是提高装置的保温效果.
(3)根据反应热的计算公式可知,酸碱反应的中和热计算时,至少需要的数据有:比热容、反应后溶液的质量以及生成水的物质的量、反应前后温度,根据反应前后的温度获得反应前后温度变化,故选cdef项.
(4)反应放出的热量和所用酸以及碱的量的多少有关,并若用盐酸跟溶液进行反应,与上述实验相比,生成水的量增多,所放出的热量偏高,但是中和热的均是强酸和强碱反应生成水时放出的热,与酸碱的用量无关,所以测得中和热数值相等.
(5)①中生成水和硫酸钡,放出的能量最多,④中氨水电离吸热,③中醋酸和氨水电离均要吸热,放出的能量最少,因此中和反应反应热:③>④>②>①.
18.(14分)
【答案】
(1)①②(2分)
(2)(2分)
(3)(2分)
(4)1(2分)0.5(2分)
(5)(2分)
(6)-40(2分)
【解析】
(1)根据热化学方程式可知,属于放热反应的是①②;
(2)根据方程式②可知,完全燃烧,放出的热量为,则完全燃烧放出的热量为;
(3)根据盖斯定律计算②(③+①)得到表示燃烧热的热化学方程式为;
(4)设,则,根据二者的热化学方程式可列方程:,,解得,故答案为:1;0.5;
(5)完全燃烧放出的热量为:;
完全燃烧放出的热量为;
甲醇完全燃烧放出的热量为,故放热最多;
(6)反应热等于反应物的键能减去生成物的键能为:;故.
19.(10分)
【答案】
(1)+124(2分)
(2)①cd(2分)
②0.04(2分)
③(2分)(2分)
20.(14分)
【答案】
(1)3(2分)1(2分)
(2)>(2分)气体(2分)>(2分)0.675或(2分)(2分)
【解析】
(1)将Ⅰ和Ⅲ数据代入正反应速率表达式可得:解得;将Ⅱ和Ⅲ数据代入正反应速率表达式可得:解得.故答案为:3;1;
(2)①比较、和、:压强相同,由到,增大,平衡正移,由于反应放热,故此过程温度降低,故;
比较、和、:温度相同,时反应速率大于,故,从到,减小,平衡逆移,即压强增大,平衡逆移,故该反应正方向气体系数增大,则D为气体;
a点到b点过程中,继续增大,平衡正移,正反应速率不断减小,逆反应速率不断增大,故a点的(正)大于b点的(正),又b点(正)(逆),所以a点时的(正)点时的(逆);
②
起始 0.5 0.3 0 0
转化 0.3 0.1 0.2 0.3
平衡 0.2 0.2 0.2 0.3
或,故答案为:>;气体;>;;0.675或.
③b点和c点都处于平衡状态,逆反应速率达到最大值,但c点的温度比b点高,故c>b,又a点到b点过程中,继续增大,平衡正移,正反应速率不断减小,逆反应速率不断增大,故b大于a,综上a、b、c三点气体C的逆反应速率由大到小的顺序:;
获嘉县2023-2024学年高二上学期12月月考化学试卷
姓名:_________班级:_________考号:_________
注意事项
1.答题前填写好自己的姓名、班级、考号等信息
2.请将答案正确填写在答题卡上
一、选择题:本题共16小题,每小题3分,共48分.在每小题给出的四个选项中,只有一项是符合题目要求的.
1.下列有关碰撞理论的说法正确的是( )
A.活化分子数目越多,反应速率越快 B.反应速率与有效碰撞次数成正比
C.活化分子的平均能量就是活化能 D.升高温度,活化分子百分数增大,反应速率加快
2.化学反应总是伴随着能量的变化,下列反应的能量变化与图中所示能量变化一致的是( )
A.甲烷燃烧 B.钠放入水中
C.和在催化剂作用下生成 D.和晶体混合
3.已知,若该反应的反应速率分别用、、、表示,则下列关系式正确的是( )
A、 B、
C、 D、
4.下列有关反应热和能量的说法正确的是( )
A.任何条件下,同一反应的热与反应的焓变都是相等的
B.有能量变化的过程不一定是化学变化
C.形成新的化学键的过程不一定会释放能量
D.高温条件下发生的反应一定是吸热反应
5.在某一恒容密闭容器中发生反应:.下列叙述不能说明该反应已达到化学平衡状态的是( )
A.容器内的总压强不随时间而变化 B.三种气体的浓度相等
C.的分解速率与生成速率相等 D.混合气体的平均相对分子质量不再发生变化
6.已知的氧化反应:分两步进行:
步骤Ⅰ.
步骤Ⅱ.
反应过程中能量变化如图所示.下列说法正确的是( )
A. B.决定氧化反应速率的是步骤Ⅱ
C.步骤Ⅰ的活化能为 D.的总能量一定高于的总能量
7.常温常压下,甲醇完全燃烧生成和液态水时放热,下列热化学方程式正确的是( )
A.
B.
C.
D.
8.氟利昂-11是一种常见的制冷剂.破坏臭氧层的过程如图所示,下列说法错误的是( )
A.过程Ⅰ的 B.过程Ⅱ可表示为
C.过程Ⅲ中有非极性共价键形成 D.上述过程说明是臭氧分解的催化剂
9.一定温度下,在某恒容密闭容器中加入一定量X(?)发生反应:,反应达到平衡后,仅降低温度,容器内气体的密度增大.下列叙述正确的是( )
A.若正反应是吸热反应,则X为非气态
B.若正反应是放热反应,则X为气态
C.若X为气态,则向平衡体系中加入少量X,X的平衡转化率不变
D.若X为非气态,则向平衡体系中加入少量X,反应的平衡常数增大
10.温度为T℃时,在4L恒容密闭容器中充入X、Y两种气体后生成Z气体,其中各组分的物质的量随时间的变化关系如图所示,下列说法正确的是( )
A.该反应的化学方程式是
B.内的平均反应速率
C.达到平衡时,X、Y的转化率相等
D.其他条件不变,升高温度,反应速率加快
11.在密闭容器中进行反应,逆反应的反应速率随时间变化的关系如图所示.下列有关说法正确的是( )
A.时使用了催化剂 B.时一定降低了温度
C.时反应向逆反应方向进行 D.时可能减小了容器的体积
12.某温度下气体反应体系达到化学平衡,平衡常数,下列说法正确的是( )
A.该反应的化学方程式为
B.降低温度,正反应速率增大
C.该温度时,则反应达到平衡状态
D.增大、,增大
13.已知反应:,温度不同.下列图像正确的是( )
A. B.
C. D.
14.用注射器吸入由和组成的混合气体[存在平衡:],此时注射器活塞位于Ⅰ处,将细口端封闭,然后将注射器活塞拉至Ⅱ处,如图,下列对产生的现象或原理的描述正确的是( )
A.把活塞从Ⅰ处拉到Ⅱ处,过程中注射器中颜色一直变深,然后保持不变
B.当体系处于稳定状态时,混合气体中的百分含量:ⅠⅡ
C.若将活塞固定在Ⅰ处,升高温度,注射器中颜色变深,则说明
D.若再把活塞从Ⅱ处推回Ⅰ处,则过程中注射器中颜色先变深后变浅
15.在恒温的密闭容器中,加入和足量活性炭发生反应,测得平衡时和的物质的量浓度与平衡总压的关系如图所示(为以分压表示的平衡常数,分压总压×物质的量分数).下列说法错误的是( )
A.图示的三个点中,a点的转化率最高 B.该温度下,c点的
C.减小容器体积可实现从c点到b点的移动 D.a、b、c三点的大小相同
16.铁触媒催化合成氨的反应历程如图所示,其中吸附在催化剂表面的物质用“ad”表示,下列说法正确的是( )
A.“吸附”过程吸热,“脱附”过程放热
B.合成氨反应的
C.降温或加压可以增大反应速率
D.该历程中反应速率最慢的过程为
二、非选择题:(本题共4小题,共52分)
17.(14分)盐酸与溶液在如图所示装置中进行中和反应,通过测定反应过程中所放出的热量可计算中和反应反应热.回答下列问题:
(1)从实验装置上看,图中尚缺少的一种玻璃仪器是______________________(2分)
(2)大烧杯上若不盖硬纸板,则求得的中和反应反应热______________________(2分)(填“偏大”“偏小”或“无影响”),在操作正确的前提下,提高中和反应反应热的测定准确性的关键是____________________________________________.(2分)
(3)计算中和反应反应热时,至少需要的数据是______________________(填标号).(2分)
a.盐酸的浓度
b.溶液的浓度
c.比热容
d.反应后溶液的质量
e.生成水的物质的量
f.反应前后溶液温度的变化
g.操作所需的时间
(4)实验中改用盐酸与溶液进行反应,与上述实验相比,所放出的热量______________________(填“相等”或“不相等”,下同)(2分)
所求的生成时中和反应反应热______________________,(2分)
(5)进行中和反应反应热的测定时,保持其他条件相同,使用的酸碱组合:
①稀硫酸、溶液;②稀盐酸、溶液;③醋酸溶液、氨水;④稀硫酸、氨水
测得生成时的中和反应反应热由大到小的顺序为______________________(填标号).(2分)
18.(14分)、、是工业上重要的化工原料.
已知:①
②
③
请回答下列问题:
(1)上述反应中属于放热反应的是______________________(填标号).(2分)
(2)完全燃烧放出的热量为______________________.(2分)
(3)表示的燃烧热的热化学方程式为______________________(2分)
(4)由和组成的混合气体在足量氧气中充分燃烧放出的热量为,则混合气体中、的物质的量分别为______________mol、(2分)______________________mol.(2分)
(5)等质量的、、完全燃烧,放热最多的是________(填化学式).(2分)
(6)某些常见化学键的键能数据如下表:
化学键
键能 803 463 436 1076
则__________.(2分)
19.(10分)丙烯是三大合成材料的基本原料之一,其中生产聚丙烯时丙烯用量最大.另外,丙烯还可用于生产多种重要有机化工原料.由丙烷制丙烯的两种方法如下:
Ⅰ.丙烷催化脱氢法:
Ⅱ.丙烷催化氧化法:
请回答下列问题:
(1)已知,由此计算_________.(2分)
(2)下,向恒容密闭容器中充入,加入催化剂发生催化脱氢反应.体系内压强变化如表所示.
时间/min 0 1 3 5 7
压强 /kPa
①下列能说明该反应达到平衡状态的是____________(填标号).(2分)
a.丙烷的消耗速率等于丙烯的生成速率 b.容器内气体的密度不再发生变化
c.容器内的压强不再发生变化 d.容器内气体平均相对分子质量不再变化
②内,用表示该反应的反应速率为___________.(2分)
③的平衡转化率为_________,(2分)该反应的平衡常数_________(为以分压表示的平衡常数,分压总压×物质的量分数,保留2位小数).(2分)
20.(14分)一定温度下,在密闭容器中发生反应,正反应速率表达式为(是正反应速率常数,只与温度有关).测得正反应速率常数与浓度关系如表所示:
序号
Ⅰ 0.10 0.10 0.15
Ⅱ 0.20 0.20 2.40
Ⅲ 0.20 0.10 1.20
(1)_____________,(2分)___________.(2分)
(2)向容积为的恒容密闭容器中仅充入和,发生上述反应,测得随时间的变化如图所示.
①__________(填“>”、“<”或“=”,下同),(2分)物质D的聚集状态为____________;(2分)a点时气体A的(正)__________b点时气体A的(正).(2分)
②时,此反应的平衡常数__________(不写单位).(2分)
③a、b、c三点气体C的逆反应速率由大到小的顺序为__________(用a、b、c表示).(2分)
获嘉县2023-2024学年高二上学期12月月考化学试卷答案
1.D 【解析】A.单位体积的活化分子数越多,单位时间内有效碰撞次数越多,反应速率越快,A错误;
B.反应速率与单位时间内有效碰撞次数成正比,B错误;
C.活化分子的平均能量与所有分子的平均能量之差称为活化能,C错误;
D.升高温度,活化分子百分数增大,单位体积活化分子数增多,反应速率加快,D正确;故选D.
2.D 【解析】A.甲烷燃烧的反应为放热反应,反应的能量变化与图中所示能量变化不一致,故A不符合题意;
B.钠与水的反应为放热反应,反应的能量变化与图中所示能量变化不一致,故B不符合题意;
C.合成氨反应为放热反应,反应的能量变化与图中所示能量变化不一致,故C不符合题意;
D.八水氢氧化钡与氯化铵固体的反应为吸热反应,反应的能量变化与图中所示能量变化一致,故D符合题意;故选D.
3.A 【解析】用不同物质表示同一反应速率,速率之比等于化学计量使之比,则,由此得出、、、,则BCD错误,A正确;答案选A.
4.B 【解析】同一反应的热与反应的焓变不一定相等,故A项错误;
有能量变化的过程不一定是化学变化,可能是物理变化,故B项正确;
形成新的化学键的过程一定会释放能量,故C项错误;
高温条件下发生的反应可能是放热反应,故D项错误.
5.B 【解析】A.反应前后气体物质的量变化,容器体积不变,容器内总压强是变量,容器内的总压强不随时间而变化,说明反应达到平衡状态,A错误;
B.三种气体的浓度保持不变是平衡的标志,但浓度相同不能说明,B正确;
C.的分解速率与生成速率相等证明氨气的正逆反应速率相同,说明反应达到平衡状态,C错误;
D.反应前后气体质量不变,但反应前后气体物质的量变化,当混合气体的平均相对分子质量不再发生变化,说明反应达到平衡,D错误;故选B.
6.B 【解析】.A.由图中信息可知,反应物的总能量为,生成物的总能量为,则,A不正确;B.从图中可以看出,步骤Ⅰ的活化能小于步骤Ⅱ的活化能,则决定氧化反应速率的是步骤Ⅱ,B正确;C.步骤Ⅰ中,反应物的总能量为,活化分子的最低能量为,则活化能为,C不正确;D.因为反应为放热反应,则与的总能量一定高于的总能量,但的总能量不一定高于的总能量,D不正确;故选B.
7.A 【解析】A.甲醇的燃烧热的热化学方程式为,A项正确;
B.燃烧热的热化学方程式中甲醇的系数应为1,且根据计算可知甲醇燃烧放出的热量为,B项错误;
C.甲醇燃烧为放热反应,应为负值,C项错误;
D.甲醇的燃烧热为甲醇完全燃烧生成和时所放出的热量,D项错误;
故选A.
8.D
9.C 【解析】A.若正反应是吸热反应,则降低温度,平衡将逆向移动,要使得容器内气体总质量增大,根据反应过程中质量守恒定律可知,X一定为气态,故A项错误;
B.若正反应是放热反应,则降低温度,平衡将正向移动,若X为气态,根据反应过程中质量守恒定律可知,平衡移动会使得容器内气体总质量降低,因此X一定为非气态,故B项错误;
C.若X为气态,则反应前后气体的物质的量不变,向平衡体系中加入少量X,加入X瞬间,平衡将正向移动,但压强对该反应的平衡无影响,两平衡互为等效,因此X的平衡转化率不变,故C项正确;
D.平衡常数只与反应本身以及温度有关,当温度不变时,达到平衡时的平衡常数相同,故D项错误;
综上所述,说法正确的是C项.
10.D 【解析】A.X、Y的物质的量减少,Z物质的量增多,X、Y是反应物,Z是生成物,X、Y、Z的物质的量变化分别是2mol、1mol、1mol,变化量比等于系数比,该反应的化学方程式是,故A错误;
B.内的平均反应速率,故B错误;
C.达到平衡时,X的转化率为,Y的转化率为,故C错误;
D.其他条件不变,升高温度,活化分子百分数增大,有效碰撞几率增大,反应速率加快,故D正确.
11.C 【解析】.A.时逆反应速率不变,说明反应达平衡,没有使用催化剂,A项错误;
B.后达新平衡的速率与前小一些,故改变的条件是C的浓度降低,或者降低温度,B项错误;
C.时改变的条件是升温,该反应是是放热反应,故此时反应逆向进行,C项正确;
D.时,逆反应速率降低后不再变化,说明平衡未移动,因此可能是增大了容器的体积,D错误.
故答案选C.
12.A 【解析】A.化学平衡常数是生成物浓度的系数次方的乘积与反应物浓度系数次方的乘积的比值,根据该反应的平衡常数表达式可知,该反应的化学方程式为,故A正确;
B.降低温度,活化分子百分数减小,有效碰撞几率减小,正逆反应速率都减慢,故B错误;
C.未说明F、A是正反应速率还是逆反应速率,不能判断反应是否达到平衡状态,反应不一定达到平衡状态,故C错误;
D.平衡常数只与温度有关,若温度不变,、,K不变,故D错误;选A.
13.B 【解析】该反应是一个正向放热、气体体积缩小的反应.
固定温度,增大压强,平衡正移,的平衡体积分数减小,A项错误;
温度高,反应先达到平衡状态,,降温,平衡正向移动,转化率升高,B项正确;
平衡后,升高温度,瞬间正、逆反应速率均增大,C项错误;
升高温度,平衡逆向移动,化学平衡常数减小,D项错误.
综上所述,故选B项.
14.D 【解析】.A.把活塞从Ⅰ处拉到Ⅱ处,过程中由于体积增大,注射器中颜色先变浅,后由于平衡逆向移动,颜色后又变深,最终达到新平衡,颜色保持不变,A项错误;
B.当体系处于稳定状态时,Ⅱ处相对于Ⅰ处为减小压强,平衡逆向移动,混合气体中的百分含量:Ⅰ<Ⅱ,B项错误;
C.若将活塞固定在Ⅰ处,升高温度,注射器中颜色变深,说明平衡逆向移动,逆反应为吸热反应,则,C项错误;
D.若再把活塞从Ⅱ处推回Ⅰ处,过程中由于体积缩小,注射器中颜色先变深,后由于平衡正向移动,颜色后又变浅,D项正确;答案选D.
15.B 【解析】A.该反应为正向气体体积增大的反应,压强小有利于正反应的进行,故图示的三个点中,点的转化率最高,A正确;
B.点时,的平衡浓度与的平衡浓度相等,列三段式可求出该条件下平衡时:、,可求出,B错误;
C.减小容器体积(即增大反应的压强)可实现从c点到b点的移动,C正确;
D.恒温条件下保持不变,D正确;故选B.
16.B 【解析】A.由图可知,“吸附”是放热过程,而“脱附”则是吸热过程,选项A错误;
B.由图像可知,,即,选项B正确;
C.降温减小反应速率,选项C错误;
D.反应历程中反应速率最慢的过程应为活化能最大的过程,由图可知的活化能不为最大,选项D错误;答案选B.
二、非选择题:本题共4小题,共55分.
17.(14分)【答案】
(1)玻璃搅拌器(2分)
(2)偏大(2分) 提高装置的保温效果(2分)
(3)cdef(2分)
(4)不相等(2分) 相等(2分)(5)③>④>②>①(2分)
【解析】
(1)根据量热计的构造可知该装置的缺少仪器是环形玻璃搅拌器.
(2)大烧杯上如不盖硬纸板,会有一部分热量散失,求得的中和热数值将会减小,中和反应反应热偏大;提高中和反应反应热的测定准确性的关键是提高装置的保温效果.
(3)根据反应热的计算公式可知,酸碱反应的中和热计算时,至少需要的数据有:比热容、反应后溶液的质量以及生成水的物质的量、反应前后温度,根据反应前后的温度获得反应前后温度变化,故选cdef项.
(4)反应放出的热量和所用酸以及碱的量的多少有关,并若用盐酸跟溶液进行反应,与上述实验相比,生成水的量增多,所放出的热量偏高,但是中和热的均是强酸和强碱反应生成水时放出的热,与酸碱的用量无关,所以测得中和热数值相等.
(5)①中生成水和硫酸钡,放出的能量最多,④中氨水电离吸热,③中醋酸和氨水电离均要吸热,放出的能量最少,因此中和反应反应热:③>④>②>①.
18.(14分)
【答案】
(1)①②(2分)
(2)(2分)
(3)(2分)
(4)1(2分)0.5(2分)
(5)(2分)
(6)-40(2分)
【解析】
(1)根据热化学方程式可知,属于放热反应的是①②;
(2)根据方程式②可知,完全燃烧,放出的热量为,则完全燃烧放出的热量为;
(3)根据盖斯定律计算②(③+①)得到表示燃烧热的热化学方程式为;
(4)设,则,根据二者的热化学方程式可列方程:,,解得,故答案为:1;0.5;
(5)完全燃烧放出的热量为:;
完全燃烧放出的热量为;
甲醇完全燃烧放出的热量为,故放热最多;
(6)反应热等于反应物的键能减去生成物的键能为:;故.
19.(10分)
【答案】
(1)+124(2分)
(2)①cd(2分)
②0.04(2分)
③(2分)(2分)
20.(14分)
【答案】
(1)3(2分)1(2分)
(2)>(2分)气体(2分)>(2分)0.675或(2分)(2分)
【解析】
(1)将Ⅰ和Ⅲ数据代入正反应速率表达式可得:解得;将Ⅱ和Ⅲ数据代入正反应速率表达式可得:解得.故答案为:3;1;
(2)①比较、和、:压强相同,由到,增大,平衡正移,由于反应放热,故此过程温度降低,故;
比较、和、:温度相同,时反应速率大于,故,从到,减小,平衡逆移,即压强增大,平衡逆移,故该反应正方向气体系数增大,则D为气体;
a点到b点过程中,继续增大,平衡正移,正反应速率不断减小,逆反应速率不断增大,故a点的(正)大于b点的(正),又b点(正)(逆),所以a点时的(正)点时的(逆);
②
起始 0.5 0.3 0 0
转化 0.3 0.1 0.2 0.3
平衡 0.2 0.2 0.2 0.3
或,故答案为:>;气体;>;;0.675或.
③b点和c点都处于平衡状态,逆反应速率达到最大值,但c点的温度比b点高,故c>b,又a点到b点过程中,继续增大,平衡正移,正反应速率不断减小,逆反应速率不断增大,故b大于a,综上a、b、c三点气体C的逆反应速率由大到小的顺序:;
同课章节目录
