第四章 物质结构元素周期律 (含解析)测试题 2023-2024学年高一上学期化学人教版(2019)必修第一册
文档属性
| 名称 | 第四章 物质结构元素周期律 (含解析)测试题 2023-2024学年高一上学期化学人教版(2019)必修第一册 |  | |
| 格式 | docx | ||
| 文件大小 | 733.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-17 00:19:53 | ||
图片预览




文档简介
第四章 物质结构元素周期律 测试题
一、选择题
1.国家速滑馆的建设应用了智慧建造技术,减少使用钢材。采用非常环保的二氧化碳跨临界直接制冰技术,通过压力变化使二氧化碳汽化实现制冷。下列说法中不正确的是
A.钢材属于金属材料
B.CO2分子含有非极性共价键
C.二氧化碳跨临界直接制冰技术利用了其物理性质
D.应用二氧化碳跨临界直接制冰技术符合“绿色奥运”理念
2.下列物质只含有共价键的是
A.CO2 B.KCl C.NaOH D.NH4Cl
3.化合物A主要用作磷化铝中间体,也用于医药,其结构如图所示。已知:W、X、Y、Z为四种短周期主族元素,原子序数依次增大,Z的某种单质是生命活动中不能缺少的物质,下列说法错误的是
A.原子半径: B.化合物A中Y显价
C.简单氢化物稳定性: D.由W、Y、Z三种元素组成的化合物一定抑制水的电离
4.短周期元素W、X、Y、Z在元素周期表中的位置如图所示,其中Y元素的原子最外层电子数是K层电子数的两倍,下列说法中不正确的是
A.原子半径大小:
B.Y、Z最简单的氢化物的热稳定性:
C.W的最高价氧化物对应水化物的酸性比Y的强
D.W、Z和氢3种元素可以形成离子化合物
5.W、X、Y、Z是原子序数依次增大的短周期主族元素,W和Z原子的最外层电子数都是其电子层数的2倍,W和X同周期且相邻,Y原子最外层只有1个电子。下列说法错误的是
A.W是碳元素 B.的原子核内中子数为7
C.Z的氧化物对应的水化物属于强酸 D.Y的一种氧化物的化学式是
6.在生物科技领域,通过追踪植物中放射性P发出的射线,来确定磷在植物中的作用部位。该核素原子核外电子数为
A.15 B.32 C.17 D.47
7.下列各组物质互为同分异构体的是
A.CO与N2 B.CH3CH2OH与CH3COOH
C.12C与13C D.CH3CH2CH2CH3与
8.下列比较正确的是
A.原子半径: Cl > S B.碱性:Mg(OH)2>Ca(OH)2
C.稳定性:AsH3 > PH3 D.非金属性:O>P
9.下列元素属于第IIA族的是
A.锂 B.镁 C.氧 D.氯
10.下列说法正确的是
A.锂在空气中燃烧生成Li2O2
B.常温下,用铝质容器盛装浓硫酸
C.Na、Al、Fe的氧化物均是碱性氧化物
D.制NO、NO2气体时,均可以用排空气收集
11.碘是人体必需的微量元素之一,国家规定在食盐中添加碘的标准为20-30mg/kg。已知碘的一种核素是,则该原子的中子数是
A.53 B.74 C.127 D.180
12.下列原子中半径最大的是
A.S B.Na C.Cl D.O
二、非选择题
13.有下列四种微粒:① ② ③ ④。(只填序号,下同)。
(1)按原子半径由大到小的顺序排列为 ;微粒中质子数小于中子数的是 。
(2)能形成型化合物的是 ;通常情况下,化合价有零价、正价和负价的是 。
14.铝及其化合物在生产生活中用途广泛。
(1)含有、的混合溶液中,加入足量的NaOH溶液可以分离和,发生反应的离子方程式为 。
(2)下列有关说法正确的是__________。
A.还原铁粉与水蒸气在高温条件下反应可转化为磁性氧化铁
B.将溶液中加入NaOH溶液至恰好完全沉淀,过滤,将所得固体充分灼烧得到红棕色固体
C.实用的储氢合金储氢量大,形成的金属氢化物稳定
D.将铝片分别放入稀盐酸和氢氧化钠溶液中,两支试管中均立刻放出 种可燃性气体
(3)下列各组含铝物质发生的反应,前者逐滴滴加到后者中直至过量,先出现白色沉淀,后来沉淀又消失的是__________。
A.滴入溶液中 B.溶液滴入溶液中
C.溶液滴入NaOH溶液中 D.氨水滴入溶液中
(4)写出溶液中逐滴滴入NaOH溶液反应的离子方程式 。
(5)写出制备反应的离子方程式 。
15.核武器是利用能自持进行核裂变或聚变反应释放的能量,产生爆炸作用,并具有大规模杀伤破坏效应的武器的总称。其中主要利用铀—235(235U)或钚—239(239Pu)等重原子核的裂变链式反应原理制成的裂变武器,通常称为原子弹;主要利用重氢(2H,氘)或超重氢(3H,氚)等轻原子核的热核反应原理制成的热核武器或聚变武器,通常称为氢弹。
(1)问题一:235U与234U、238U属于什么关系 ?
(2)问题二:2H2与3H2互为同位素吗 ?为什么 ?
(3)问题三:原子弹爆炸是化学变化吗 ?为什么 ?
16.I.有200 mL氯化镁和氯化铝的混合溶液,其中c(Mg2+)为0.2mol·L-1,c(Cl-)为1.3mol·L-1。要使Mg2+全部转化为沉淀分离出来,至少需加4mol·L-1NaOH溶液的体积为 mL
II.焊接铜件时常用的焊药为氯化铵,其作用是消除焊接处的氧化铜。其反应式为 NH4C1+ CuO→Cu+CuCl2+ N2↑+ H2O
(1)配平,并用双线桥法标出电子转移情况。:
(2)该反应中,氧化剂和还原剂的物质的量之比为: 。
(3)若反应中电子转移了0.3mol,则产生的气体在标准状况下的体积为 L。
17.将一定质量的镁铝合金投入100 mL一定浓度的盐酸中,合金完全溶解。向所得溶液中滴加浓度为5 mol·L-1的氢氧化钠溶液,生成的沉淀跟加入的氢氧化钠溶液的体积关系如图(横坐标体积单位是mL,纵坐标质量单位是g)。
(1)合金中镁的质量是 。
(2)所用盐酸的物质的量浓度是 。
18.2022年9月9日,我国首次发现月球新矿物“嫦娥石”,其中一种物质的化学式为,W、X、Y、Z、Q五种原子序数依次增大的前20号元素,最外层电子数之和为16,W与X形成的某淡黄色离子化合物可用作漂白剂,Y的单质被誉为“国防金属”,Z的最高价氧化物对应的水化物为中强酸。请回答下列问题:
(1)W在元素周期表中的位置 。
(2)试从原子结构角度解释X与Y的金属性大小 。
(3)W、Z分别形成的气态氢化物分子中均含有的化学键类型为 ,其稳定性较强的是 (填化学式)
(4)X的氢化物可在野外用作生氢剂,氢元素为-1价,写出该物质与水反应的化学方程式 。
(5)除发现“嫦娥石”外,科学院还首次成功获得嫦娥五号月壤中未来聚变能源资源—3He。
①利用核聚变发电,3He是最安全的最清洁的能源,下列说法正确的是 。
A.、的化学性质基本相同 B.、互为同素异形体
C.与的中子数相同 D.液化是化学变化
②还可以用来人工合成一些半衰期短,自然界中不能稳定存在的原子,例如:,请问新合成的粒子的符号是 (用原子符号表示)
19.如表为元素周期表的一部分,表中所列的每个字母分别代表一种元素。
a
b c
d e f g
回答下列问题:
(1)元素f的原子结构示意图为 。
(2)a与元素c和g形成的简单氢化物中稳定性强的是 。(写化学式)
(3)由上述元素形成的最高价氧化物对应水化物中,酸性最强的是 (填化学式)。
(4)hc2的电子式为 。
(5)元素d的最高价氧化物对应的水化物与元素e的最高价氧化物对应的水化物反应的离子方程式为 。
(6)bg3与水反应生成两种物质,其中一种使pH试纸先变红又褪色,写出化学方程式 。
(7)c、d、e的简单离子半径由大到小的顺序为 (用离子符号表示)。
(8)c与d形成的原子个数比为1:1的化合物中含有的化学键类型为 。
(9)下列事实能说明d元素原子的失电子能力比e强的是 (填标号)。
A.单质的熔点:d<c
B.简单阳离子的氧化性:e>d
C.常温下,d单质能与水剧烈反应而e不能
D.相同物质的量的d、e单质分别与足量盐酸反应,生成的H2的量:d<c
20.按下面的实验过程填空:
浅绿色FeBr2溶液黄色液体
a. 色,b. 色,c. 色,写出上述第1、2步反应的化学方程式: , 。
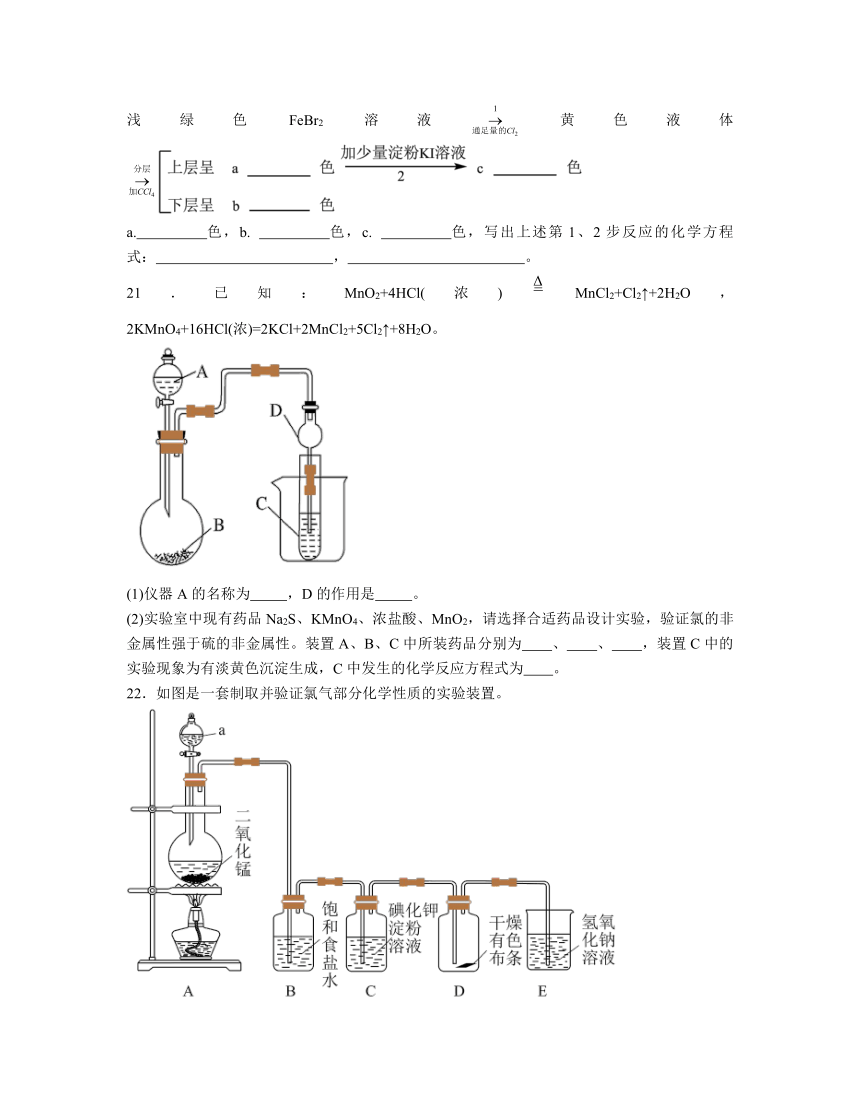
21.已知:MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O,2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O。
(1)仪器A的名称为 ,D的作用是 。
(2)实验室中现有药品Na2S、KMnO4、浓盐酸、MnO2,请选择合适药品设计实验,验证氯的非金属性强于硫的非金属性。装置A、B、C中所装药品分别为 、 、 ,装置C中的实验现象为有淡黄色沉淀生成,C中发生的化学反应方程式为 。
22.如图是一套制取并验证氯气部分化学性质的实验装置。
回答下列问题:
(1)装置A中,仪器a的名称是 ,写出装置A中发生反应的离子方程式: 。
(2)当有少量通过后,观察到装置C中现象为 。
(3)当持续通过时,装置D中现象为 。
(4)若要证明无漂白性,则必须在装置 (填字母)之前增加装有浓硫酸的洗气装置。
(5)装置E的作用是 ,该反应的离子方程式为 。
(6)ClO2是高效水处理剂,用NaClO2与NCl3反应可以制得ClO2.完成下列化学方程式并配平: 。
_______NaClO2+_______NCl3+_______H2O→ _______ClO2↑+_______NH3↑+_______NaCl+_______
【参考答案】
一、选择题
1.B
解析:A.钢材含有金属铁,属于金属材料,故A正确;
B.CO2分子含有碳氧极性共价键,故B错误;
C.二氧化碳跨临界直接制冰,利用压力变化使二氧化碳汽化实现,将气态二氧化碳变为固态二氧化碳,利用了其物理性质,故C正确;
D.应用二氧化碳跨临界直接制冰技术,不会造成环境污染,更符合“绿色奥运”理念,故D正确。
综上所述,答案为B。
2.A
解析:A.二氧化碳是只含有共价键的共价化合物,故A符合题意;
B.氯化钾是只含有离子键的离子化合物,故B不符合题意;
C.氢氧化钠是含有离子键和共价键的离子化合物,故C不符合题意;
D.氯化铵是含有离子键和共价键的离子化合物,故D不符合题意;
故选A。
3.D
【分析】W、X、Y、Z为四种短周期主族元素,原子序数依次增大,Z的某种单质是生命活动中不能缺少的物质,Z是O元素;W能形成1个共价键,W是H元素;X形成4个共价键,X是C元素;Y能形成3个共价键,Y是N元素。
解析:A.同周期主族元素从左到右,原子半径依次减小,则原子半径:,故A正确;
B.化合物A是氨基甲酸铵,A中N显价,故B正确;
C.元素的非金属性越强,氢化物越稳定,则简单氢化物稳定性:,故C正确;
D.H、N、O三种元素组成的化合物中,硝酸铵促进水电离,故D错误;
选D。
4.A
【分析】已知Y的最外层电子数是K层电子数的两倍,则Y为Si。则W、X、Z分别为N、O、Cl。
解析:A.粒子半径:电子层越多半径越大,同电子层结构核电荷数越多半径越小,则半径大小:Y>Z>W>X,A项不正确;
B.同周期从左往右非金属性增强,即简单氢化物的稳定性增强:HZ>YH4,B项正确;
C.同族至上而下非金属性减弱,最高价氧化物的水化物酸性减弱;而同周期从左往右非金属性增强,最高价氧化为的水化物酸性增强。即W>P、P>Y,则最高价氧化物的水化物酸性:W>Y,C项正确;
D.W、Z、H可与形成NH4Cl为离子化合物,D项正确;
故选A。
5.C
【分析】W、X、Y、Z是原子序数依次增大的短周期主族元素,W和Z原子的最外层电子数都是其电子层数的2倍,W是C,Z是S,W和X同周期且相邻,X是N,Y原子最外层只有1个电子,Y是Na。
解析:A.根据分析,W是碳元素,A正确;
B.X是N,原子序数为7,的原子核内中子数为7,B正确;
C.Z是S,Z的最高氧化物对应的水化物H2SO4属于强酸,C错误;
D.Y是Na,Y的一种氧化物的化学式是,D正确;
故选C。
6.A
解析:P的质子数为15,原子中质子数=核外电子数,所以该核素原子核外电子数为15,故选A。
7.D
【分析】同分异构体的定义:分子式相同、结构不同的化合物互称同分异构体,据此分析。
解析:A.CO与N2分子式不同,不符合同分异构体的定义,A不选;
B.CH3CH2OH与CH3COOH分子式不同,不符合同分异构体的定义,B不选;
C.12C与13C为同一元素的不同原子,故二者之间互为同位素,C不选;
D.CH3CH2CH2CH3与二者的分子均为C4H10,二者结构不同,符合同分异构体的定义,选D;
故本题选D。
8.D
解析:A.同一周期从左到右,元素原子半径逐渐减小,则半径:ClB.金属性:Ca>Mg,元素的金属性越强,对应最高价氧化物的水化物的碱性越强,则碱性:Ca(OH)2> Mg(OH)2,B错误;
C.非金属性:P>As,元素的非金属性越强,对应的氢化物稳定性越强,则稳定性:PH3> AsH3,C错误;
D.同周期从左到右,金属性减弱,非金属性变强;同主族由上而下,金属性增强,非金属性变弱;非金属性:O>P,故D正确;
故选D。
9.B
解析:A.锂元素是3号元素,最外层1个电子,是第IA族元素,故A不符合题意;
B.镁元素是12号元素,最外层2个电子,是第IIA族元素,故B符合题意;
C.氧元素是8号元素,最外层6个电子,是第VIA族元素,故C不符合题意;
D.氯元素是17号元素,最外层7个电子,是第VIIA族元素,故D不符合题意。
综上所述,答案为B。
10.B
解析:A.锂的金属性比钠的弱,在空气中燃烧只能生成,A错误;
B.常温下,铝遇浓硫酸钝化,所以可用铝质容器盛装浓硫酸,B正确;
C.钠的氧化物有和,为碱性氧化物,为过氧化物,铝的氧化物为两性氧化物,C错误;
D.NO要与反应,生成,不能用排空气法收集,D错误;
故选B。
11.B
解析:中子数=质量数-质子数=127-53=74,故B正确;
故选:B。
12.B
解析:原子核外电子层数越多,原子半径越大。当原子核外电子层数相同时,原子序数越小,原子半径越大。在上述元素中O是第二周期元素,其余元素是第三周期,在Na、S、Cl中,原子序数最小的Na,所以原子半径最大的元素是Na元素;
故合理选项是B。
二、非选择题
13.(1) ②③④① ①②
(2)①② ④
解析: (1)一般地,电子层数越多,原子半径越大,若电子层数相同,则原子序数越大,原子半径越小。所以这四种元素的原子半径从大到小的顺序为:②③④①;在元素符号左上角的数字是质量数,左下角的数字是质子数,质量数减去质子数等于中子数,所以这四种微粒的质子数小于中子数的是①②。
(2)Na和O能形成Na2O2,故能形成 X2Y2 型化合物的是①②;金属元素没有负价,通常情况下,O没有正价,所以化合价有零价、正价和负价的是N,故选④。
14.(1)
(2)ABC
(3)A
(4)和
(5)//、、
解析:(1)含有、的混合溶液中,加入足量的NaOH溶液,可以和碱反应转化为Fe(OH)3沉淀,,而和过量的强碱会转化为偏铝酸钠,,过滤可以分离和,发生反应的离子方程式为,故答案为:;
(2)A. 还原铁粉与水蒸气在高温条件下反应:3Fe+4H2O(g)Fe3O4+4H2,可转化为磁性氧化铁,故A正确;
B. 将溶液中加入NaOH溶液至恰好完全沉淀,,过滤,所得Fe(OH)2固体还原性较强,易被氧化为Fe(OH)3固体,充分灼烧得到红棕色固体氧化铁,故B正确;
C. 一定温度和压力下,某些金属可以大量“吸氢”,形成金属氢化物,而且放出热量,金属氢化物的储氢能力都很强,一般呈固态,比较稳定,故C正确;
D. 将铝片分别放入稀盐酸和氢氧化钠溶液中,铝片表面一般都有氧化膜,先发生和,再发生和,两支试管中均会放出一种可燃性气体,但不是立刻,应该过一段时间,故D错误;
故答案为:ABC;
(3)A. 滴入溶液中,先发生,再发生,所以先出现白色沉淀,后来沉淀又消失,故A符合题意;
B. 溶液滴入溶液中会产生BaSO4和Al(OH)3沉淀,当溶液过量时,Al(OH)3沉淀会溶解,所以沉淀会减少但不会消失,故B不符合题意;
C. 溶液滴入NaOH溶液中,先发生,再发生,所以是刚开始没有沉淀,后来沉淀逐渐增加至不变,故C不符合题意;
D. 氨水滴入溶液中只发生,只产生沉淀不会溶解,故D不符合题意;
故答案为:A;
(4)溶液中逐滴滴入NaOH溶液,会先生成沉淀,然后沉淀逐渐溶解,依次发生的离子方程式为:和,故答案为:和;
(5)制备氢氧化铝可以有三种方法:一是可溶性铝盐和弱碱溶液反应,离子方程式为:;二是可溶性的偏铝酸盐溶液中通入过量的二氧化碳,离子方程式为;三是用单质铝、强酸、强碱来制备,其中四分之三的铝与强碱反应:,四分之一的铝与强酸反应:,再将二者混合可得氢氧化铝沉淀,,故答案为:或或、、。
15.(1)同位素
(2)不是 2H2与3H2不是核素原子,不互为同位素
(3)原子弹爆炸不是化学变化 因为原子的种类发生了变化,不是生成新物质的变化
解析:(1)235U与234U、238U是质子数相同的不同原子,三者互为同位素;
(2)2H2与3H2两者是氢气单质,不是核素原子,不互为同位素;
(3)原子弹爆炸没有生成新物质,只是原子裂变生成了新原子,不是化学变化。
16.0 3∶2 1.12
【分析】I.根据电荷守恒计算混合溶液中n(Al3+),向MgCl2和AlCl3的混合溶液加入NaOH溶液,使Mg2+全部转化为沉淀分离出来,Al3+应恰好转化为,反应后溶液为NaCl、NaAlO2的混合液,根据钠离子守恒n(NaOH)=n(NaCl)+n(NaAlO2),再结合氯离子守恒、Al原子守恒可知n(NaOH)=n(Cl-)+n(Al3+),再根据计算;
II.(1)根据Cu元素的化合价降低、N元素的化合价升高,利用电子守恒及质量守恒定律来配平反应;
(2)该反应中氧化剂为CuO,还原剂为NH4Cl,由(1)中双线桥可知,氧化剂和还原剂的物质的量之比为3:2;
(3)生成1个N2分子转移电子数为6,若反应中电子转移了0.3mol,则产生的N2的物质的量为=0.05mol,带入V=nVm计算。
解析:I.溶液中n(Cl )=0.2L×1.3mol/L=0.26mol,
溶液中n(Mg2+)=0.2mol/L×0.2L=0.04mol,
根据电荷守恒,溶液中n(Al3+)==0.06mol,
将200mL此溶液中的Mg2+转化为Mg(OH)2沉淀并分离析出,反应后溶液为NaCl、NaAlO2的混合液,根据钠离子守恒:n(NaOH)=n(NaCl)+n(NaAlO2),再结合氯离子守恒、Al原子守恒可知:n(NaOH)=n(Cl )+n(Al3+)=0.26mol+0.06mol=0.32mol,所以至少需要4mol/L氢氧化钠溶液的体积为:=0.08L=80mL;
II.(1)根据Cu元素的化合价由+2价降至0价,得到2mol电子生成1molCu,N元素的化合价由-3价升至0价,失去6mol电子生成1molN2,利用电子守恒及质量守恒定律来配平反应得2NH4Cl+4CuO=3Cu+CuCl2+N2↑+4H2O,双线桥法标出电子转移情况为:;
(2)该反应中氧化剂为CuO,还原剂为NH4Cl,由(1)中双线桥可知,4molCuO参与反应,做氧化剂的为3mol,氧化剂和还原剂的物质的量之比为3:2;
(3)生成1个N2分子转移电子数为6,若反应中电子转移了0.3mol,则产生的N2的物质的量为=0.05mol,则产生的N2在标准状况下的体积V=nVm=0.05mol×22.4L/mol=1.12L。
17.8 g 8 mol·L-1
【分析】在合金中,Mg与HCl反应生成MgCl2,MgCl2与NaOH反应转化为Mg(OH)2,由图象中11.6g为Mg(OH)2的质量,可求出合金中镁的质量。在图象的0点,溶液的成分为MgCl2、AlCl3、HCl,在沉淀的最高点,溶液中只有NaCl,由NaOH的体积,结合其物质的量浓度,可求出HCl的物质的量,从而求出其物质的量浓度。
解析:(1)由图象可知,氢氧化镁的质量为11.6 g,根据镁元素守恒:
合金中镁的质量=11.6 g÷58 g·mol-1×24 g·mol-1=4.8 g。答案为:4.8 g;
(2)当沉淀的量最大时,溶液中溶质为氯化钠,
盐酸的物质的量浓度=0.16 L×5 mol·L-1÷0.1 L=8 mol·L-1。答案为:8 mol·L-1。
18.(1)第二周期第VIA族
(2)同一周期从左往右,与核外电子层数相同,但的核电荷数比大,原子半径小,失电子能力弱,故金属性
(3) 共价键 H2O
(4)
(5) A
【分析】W、X、Y、Z、Q五种原子序数依次增大的前20号元素,最外层电子数之和为16,W与X形成的某淡黄色离子化合物可用作漂白剂,为过氧化钠,则W为氧元素,X为钠元素,Y的单质被誉为“国防金属”,为镁元素,Z的最高价氧化物对应的水化物为中强酸,为磷元素,根据最外层电子数之和为16分析,Q的最外层电子数为2,则为钙元素,据此解答。
解析:(1)氧元素在第二周期第VIA族。
(2)同一周期从左往右,与核外电子层数相同,但的核电荷数比大,原子半径小,失电子能力弱,故金属性
(3)氧和磷分别形成的气态氢化物分子为水或磷化氢,均含有的化学键类型为共价键,其稳定性较强的是水。
(4)钠的氢化物可在野外用作生氢剂,氢元素为-1价,为氢化钠,与水反应的化学方程式为。
(5)①A.、的核外电子数相同,故化学性质基本相同,正确; B.、互为同位素,不是同素异形体,故错误;C.与的中子数分别为1和2,不同; D.液化没有新物质生成,不是化学变化,故选A。
②还可以用来人工合成一些半衰期短,自然界中不能稳定存在的原子,例如:,根据质子数计算,m=8+2-2=8,,为氧元素,n=16+3-4=15新合成的粒子的符号是。
19.(1)
(2)HF
(3)HClO4
(4)
(5)Al(OH)3+OH-= +2H2O或Al(OH)3+OH-=[Al(OH)4]-
(6)NCl3+3H2O=3HClO+NH3
(7)F->Na+>Al3+
(8)离子键
(9)BC
【分析】根据元素周期表中各元素的位置可知,a为H、b为N、c为F、d为Na、e为Al、f为S、g为Cl;
解析:(1)元素f为S元素,其原子结构示意图为;
(2)同主族从上而下非金属性增强,气态氢化物的稳定性增强,故a与元素c和g形成的简单氢化物HF、HCl中稳定性强的是HF;
(3)元素非金属性越强其最高价氧化物的水化物的酸性越强,但F没有正价,故由上述元素形成的最高价氧化物对应水化物中,酸性最强的是HClO4;
(4)hc2为CaF2,电子式为;
(5)元素d的最高价氧化物对应的水化物NaOH与元素e的最高价氧化物对应的水化物Al(OH)3反应生成偏铝酸钠和水,反应的离子方程式为Al(OH)3+OH-= +2H2O或Al(OH)3+OH-=[Al(OH)4]-;
(6)bg3为NCl3,与水反应生成两种物质,其中一种使pH试纸先变红又褪色,为HClO,反应的化学方程式为NCl3+3H2O=3HClO+NH3;
(7)具有相同电子层结构的离子,核电荷数越大半径越小,故 c、d、e的简单离子半径由大到小的顺序为F->Na+>Al3+;
(8)c与d形成的原子个数比为1:1的化合物NaF中含有的化学键类型为离子键;
(9)d为Na、e为Al,
A. 单质的熔点是物理性质,不能利用熔点判断金属性强弱,选项A错误;
B. 单质的还原性越强,其简单阳离子的氧化性越弱,故简单阳离子的氧化性:Al3+>Na+,可证明钠的金属性强于铝,选项B正确;
C. 金属性越强,与水反应的剧烈程度越大,常温下,Na单质能与水剧烈反应而Al不能,可证明钠的金属性强于铝,选项C正确;
D. 金属单质与盐酸反应产生氢气的多少不能证明金属性强弱,应利用失电子能力强弱判断金属性强弱,选项D错误;
答案选BC。
20.棕黄 橙红 蓝 2FeBr2+3Cl2═2FeCl3+2Br2 2FeCl3+2KI═2FeCl2+2KCl+I2
解析:FeBr2溶液中通入足量氯气,反应生成FeCl3、Br2,加四氯化碳萃取后,溴溶解在四氯化碳中,且分层后在下层,而上层为氯化铁溶液,氯化铁与KI发生氧化还原反应生成碘,淀粉遇碘变蓝,由上述分析可知,上层a(氯化铁溶液)为棕黄色,下层b(溴的四氯化碳溶液)为橙红色,c为蓝色,上述反应的化学方程式为2FeBr2+3Cl2=2FeCl3+2Br2、2FeCl3+2KI=2FeCl2+2KCl+I2。
21.(1) 分液漏斗 防止倒吸
(2) 浓盐酸 KMnO4 Na2S溶液 Cl2+Na2S=2NaCl+S↓
【分析】先用浓盐酸和高锰酸钾常温下反应制取氯气,生成的氯气通入硫化钠溶液中,置换出硫单质,证明氯气的氧化性比硫强。
解析:(1)依据仪器构造可知,A为分液漏斗,氯气与硫化钠溶液反应,气体体积减少,D起到防倒吸的作用。
(2)要验证氯的非金属性比硫强,可验证氯气的氧化性比硫单质强,题给发生装置为固-液不加热装置,因此应选择浓盐酸和高锰酸钾常温下反应制取氯气,A中盛放浓盐酸、B中盛放高锰酸钾,将生成的氯气通入硫化钠溶液中,氯气与硫化钠反应生成氯化钠和硫单质,从而证明氯气的氧化性比硫单质强,则C中盛放硫化钠溶液,反应的化学方程式为:Cl2+Na2S=2NaCl+S↓。
22.(1)分液漏斗
(2)溶液变成蓝色
(3)有色布条褪色
(4)D
(5)尾气处理,防止污染空气
(6)6NaClO2 + NCl3 + 3H2O==6ClO2↑+NH3↑+ 3NaCl + 3NaOH
【分析】装置A为氯气的发生装置,MnO2与浓盐酸共热产生氯气,因为盐酸具有挥发性,需用盛有饱和食盐水的洗气瓶B除去氯气中的HCl,氯气具有氧化性,可氧化装置C溶液中的I ,生成I2,淀粉遇I2变蓝,氯气能与水反应生成HClO,HClO具有漂白性,能使装置D中的有色布条褪色,而氯气有毒,需要用烧杯E中的NaOH溶液吸收多余的氯气,以防污染空气。
解析:(1)实验室制备时,分液漏斗中盛放的是浓盐酸,装置A中与浓盐酸反应的离子方程式为;故答案为分液漏斗;;
(2)装置C中发生反应,I2遇淀粉变蓝;故答案为:溶液变成蓝色;
(3)此时氯气中混入了水蒸气,当持续通过时,装置D中干燥有色布条遇潮湿的氯气会被漂白褪色;故答案为有色布条褪色;
(4)干燥的无漂白性,若要证明此结论,需在通入装置D前对其进行干燥,即在装置D前增加装有浓硫酸的洗气装置;故答案为D;
(5)氯气可以和氢氧化钠反应,装置E中NaOH溶液可进行尾气处理,防止污染空气,反应的离子方程式为;故答案为吸收多余的氯气,防止污染空气;;
(6)据化合价升降可知:NaClO2 中的Cl为+3价,NCl3中的Cl为+1价,产物中的ClO2中的Cl为+4价,NaCl中的Cl为—1价,按照价态不交叉规律可知,NaClO2为还原剂,生成氧化产物ClO2,NCl3为氧化剂,生成还原产物NaCl,配平方程式为:6NaClO2 + NCl3 + 3H2O==6ClO2↑+NH3↑+ 3NaCl + 3NaOH
一、选择题
1.国家速滑馆的建设应用了智慧建造技术,减少使用钢材。采用非常环保的二氧化碳跨临界直接制冰技术,通过压力变化使二氧化碳汽化实现制冷。下列说法中不正确的是
A.钢材属于金属材料
B.CO2分子含有非极性共价键
C.二氧化碳跨临界直接制冰技术利用了其物理性质
D.应用二氧化碳跨临界直接制冰技术符合“绿色奥运”理念
2.下列物质只含有共价键的是
A.CO2 B.KCl C.NaOH D.NH4Cl
3.化合物A主要用作磷化铝中间体,也用于医药,其结构如图所示。已知:W、X、Y、Z为四种短周期主族元素,原子序数依次增大,Z的某种单质是生命活动中不能缺少的物质,下列说法错误的是
A.原子半径: B.化合物A中Y显价
C.简单氢化物稳定性: D.由W、Y、Z三种元素组成的化合物一定抑制水的电离
4.短周期元素W、X、Y、Z在元素周期表中的位置如图所示,其中Y元素的原子最外层电子数是K层电子数的两倍,下列说法中不正确的是
A.原子半径大小:
B.Y、Z最简单的氢化物的热稳定性:
C.W的最高价氧化物对应水化物的酸性比Y的强
D.W、Z和氢3种元素可以形成离子化合物
5.W、X、Y、Z是原子序数依次增大的短周期主族元素,W和Z原子的最外层电子数都是其电子层数的2倍,W和X同周期且相邻,Y原子最外层只有1个电子。下列说法错误的是
A.W是碳元素 B.的原子核内中子数为7
C.Z的氧化物对应的水化物属于强酸 D.Y的一种氧化物的化学式是
6.在生物科技领域,通过追踪植物中放射性P发出的射线,来确定磷在植物中的作用部位。该核素原子核外电子数为
A.15 B.32 C.17 D.47
7.下列各组物质互为同分异构体的是
A.CO与N2 B.CH3CH2OH与CH3COOH
C.12C与13C D.CH3CH2CH2CH3与
8.下列比较正确的是
A.原子半径: Cl > S B.碱性:Mg(OH)2>Ca(OH)2
C.稳定性:AsH3 > PH3 D.非金属性:O>P
9.下列元素属于第IIA族的是
A.锂 B.镁 C.氧 D.氯
10.下列说法正确的是
A.锂在空气中燃烧生成Li2O2
B.常温下,用铝质容器盛装浓硫酸
C.Na、Al、Fe的氧化物均是碱性氧化物
D.制NO、NO2气体时,均可以用排空气收集
11.碘是人体必需的微量元素之一,国家规定在食盐中添加碘的标准为20-30mg/kg。已知碘的一种核素是,则该原子的中子数是
A.53 B.74 C.127 D.180
12.下列原子中半径最大的是
A.S B.Na C.Cl D.O
二、非选择题
13.有下列四种微粒:① ② ③ ④。(只填序号,下同)。
(1)按原子半径由大到小的顺序排列为 ;微粒中质子数小于中子数的是 。
(2)能形成型化合物的是 ;通常情况下,化合价有零价、正价和负价的是 。
14.铝及其化合物在生产生活中用途广泛。
(1)含有、的混合溶液中,加入足量的NaOH溶液可以分离和,发生反应的离子方程式为 。
(2)下列有关说法正确的是__________。
A.还原铁粉与水蒸气在高温条件下反应可转化为磁性氧化铁
B.将溶液中加入NaOH溶液至恰好完全沉淀,过滤,将所得固体充分灼烧得到红棕色固体
C.实用的储氢合金储氢量大,形成的金属氢化物稳定
D.将铝片分别放入稀盐酸和氢氧化钠溶液中,两支试管中均立刻放出 种可燃性气体
(3)下列各组含铝物质发生的反应,前者逐滴滴加到后者中直至过量,先出现白色沉淀,后来沉淀又消失的是__________。
A.滴入溶液中 B.溶液滴入溶液中
C.溶液滴入NaOH溶液中 D.氨水滴入溶液中
(4)写出溶液中逐滴滴入NaOH溶液反应的离子方程式 。
(5)写出制备反应的离子方程式 。
15.核武器是利用能自持进行核裂变或聚变反应释放的能量,产生爆炸作用,并具有大规模杀伤破坏效应的武器的总称。其中主要利用铀—235(235U)或钚—239(239Pu)等重原子核的裂变链式反应原理制成的裂变武器,通常称为原子弹;主要利用重氢(2H,氘)或超重氢(3H,氚)等轻原子核的热核反应原理制成的热核武器或聚变武器,通常称为氢弹。
(1)问题一:235U与234U、238U属于什么关系 ?
(2)问题二:2H2与3H2互为同位素吗 ?为什么 ?
(3)问题三:原子弹爆炸是化学变化吗 ?为什么 ?
16.I.有200 mL氯化镁和氯化铝的混合溶液,其中c(Mg2+)为0.2mol·L-1,c(Cl-)为1.3mol·L-1。要使Mg2+全部转化为沉淀分离出来,至少需加4mol·L-1NaOH溶液的体积为 mL
II.焊接铜件时常用的焊药为氯化铵,其作用是消除焊接处的氧化铜。其反应式为 NH4C1+ CuO→Cu+CuCl2+ N2↑+ H2O
(1)配平,并用双线桥法标出电子转移情况。:
(2)该反应中,氧化剂和还原剂的物质的量之比为: 。
(3)若反应中电子转移了0.3mol,则产生的气体在标准状况下的体积为 L。
17.将一定质量的镁铝合金投入100 mL一定浓度的盐酸中,合金完全溶解。向所得溶液中滴加浓度为5 mol·L-1的氢氧化钠溶液,生成的沉淀跟加入的氢氧化钠溶液的体积关系如图(横坐标体积单位是mL,纵坐标质量单位是g)。
(1)合金中镁的质量是 。
(2)所用盐酸的物质的量浓度是 。
18.2022年9月9日,我国首次发现月球新矿物“嫦娥石”,其中一种物质的化学式为,W、X、Y、Z、Q五种原子序数依次增大的前20号元素,最外层电子数之和为16,W与X形成的某淡黄色离子化合物可用作漂白剂,Y的单质被誉为“国防金属”,Z的最高价氧化物对应的水化物为中强酸。请回答下列问题:
(1)W在元素周期表中的位置 。
(2)试从原子结构角度解释X与Y的金属性大小 。
(3)W、Z分别形成的气态氢化物分子中均含有的化学键类型为 ,其稳定性较强的是 (填化学式)
(4)X的氢化物可在野外用作生氢剂,氢元素为-1价,写出该物质与水反应的化学方程式 。
(5)除发现“嫦娥石”外,科学院还首次成功获得嫦娥五号月壤中未来聚变能源资源—3He。
①利用核聚变发电,3He是最安全的最清洁的能源,下列说法正确的是 。
A.、的化学性质基本相同 B.、互为同素异形体
C.与的中子数相同 D.液化是化学变化
②还可以用来人工合成一些半衰期短,自然界中不能稳定存在的原子,例如:,请问新合成的粒子的符号是 (用原子符号表示)
19.如表为元素周期表的一部分,表中所列的每个字母分别代表一种元素。
a
b c
d e f g
回答下列问题:
(1)元素f的原子结构示意图为 。
(2)a与元素c和g形成的简单氢化物中稳定性强的是 。(写化学式)
(3)由上述元素形成的最高价氧化物对应水化物中,酸性最强的是 (填化学式)。
(4)hc2的电子式为 。
(5)元素d的最高价氧化物对应的水化物与元素e的最高价氧化物对应的水化物反应的离子方程式为 。
(6)bg3与水反应生成两种物质,其中一种使pH试纸先变红又褪色,写出化学方程式 。
(7)c、d、e的简单离子半径由大到小的顺序为 (用离子符号表示)。
(8)c与d形成的原子个数比为1:1的化合物中含有的化学键类型为 。
(9)下列事实能说明d元素原子的失电子能力比e强的是 (填标号)。
A.单质的熔点:d<c
B.简单阳离子的氧化性:e>d
C.常温下,d单质能与水剧烈反应而e不能
D.相同物质的量的d、e单质分别与足量盐酸反应,生成的H2的量:d<c
20.按下面的实验过程填空:
浅绿色FeBr2溶液黄色液体
a. 色,b. 色,c. 色,写出上述第1、2步反应的化学方程式: , 。
21.已知:MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O,2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O。
(1)仪器A的名称为 ,D的作用是 。
(2)实验室中现有药品Na2S、KMnO4、浓盐酸、MnO2,请选择合适药品设计实验,验证氯的非金属性强于硫的非金属性。装置A、B、C中所装药品分别为 、 、 ,装置C中的实验现象为有淡黄色沉淀生成,C中发生的化学反应方程式为 。
22.如图是一套制取并验证氯气部分化学性质的实验装置。
回答下列问题:
(1)装置A中,仪器a的名称是 ,写出装置A中发生反应的离子方程式: 。
(2)当有少量通过后,观察到装置C中现象为 。
(3)当持续通过时,装置D中现象为 。
(4)若要证明无漂白性,则必须在装置 (填字母)之前增加装有浓硫酸的洗气装置。
(5)装置E的作用是 ,该反应的离子方程式为 。
(6)ClO2是高效水处理剂,用NaClO2与NCl3反应可以制得ClO2.完成下列化学方程式并配平: 。
_______NaClO2+_______NCl3+_______H2O→ _______ClO2↑+_______NH3↑+_______NaCl+_______
【参考答案】
一、选择题
1.B
解析:A.钢材含有金属铁,属于金属材料,故A正确;
B.CO2分子含有碳氧极性共价键,故B错误;
C.二氧化碳跨临界直接制冰,利用压力变化使二氧化碳汽化实现,将气态二氧化碳变为固态二氧化碳,利用了其物理性质,故C正确;
D.应用二氧化碳跨临界直接制冰技术,不会造成环境污染,更符合“绿色奥运”理念,故D正确。
综上所述,答案为B。
2.A
解析:A.二氧化碳是只含有共价键的共价化合物,故A符合题意;
B.氯化钾是只含有离子键的离子化合物,故B不符合题意;
C.氢氧化钠是含有离子键和共价键的离子化合物,故C不符合题意;
D.氯化铵是含有离子键和共价键的离子化合物,故D不符合题意;
故选A。
3.D
【分析】W、X、Y、Z为四种短周期主族元素,原子序数依次增大,Z的某种单质是生命活动中不能缺少的物质,Z是O元素;W能形成1个共价键,W是H元素;X形成4个共价键,X是C元素;Y能形成3个共价键,Y是N元素。
解析:A.同周期主族元素从左到右,原子半径依次减小,则原子半径:,故A正确;
B.化合物A是氨基甲酸铵,A中N显价,故B正确;
C.元素的非金属性越强,氢化物越稳定,则简单氢化物稳定性:,故C正确;
D.H、N、O三种元素组成的化合物中,硝酸铵促进水电离,故D错误;
选D。
4.A
【分析】已知Y的最外层电子数是K层电子数的两倍,则Y为Si。则W、X、Z分别为N、O、Cl。
解析:A.粒子半径:电子层越多半径越大,同电子层结构核电荷数越多半径越小,则半径大小:Y>Z>W>X,A项不正确;
B.同周期从左往右非金属性增强,即简单氢化物的稳定性增强:HZ>YH4,B项正确;
C.同族至上而下非金属性减弱,最高价氧化物的水化物酸性减弱;而同周期从左往右非金属性增强,最高价氧化为的水化物酸性增强。即W>P、P>Y,则最高价氧化物的水化物酸性:W>Y,C项正确;
D.W、Z、H可与形成NH4Cl为离子化合物,D项正确;
故选A。
5.C
【分析】W、X、Y、Z是原子序数依次增大的短周期主族元素,W和Z原子的最外层电子数都是其电子层数的2倍,W是C,Z是S,W和X同周期且相邻,X是N,Y原子最外层只有1个电子,Y是Na。
解析:A.根据分析,W是碳元素,A正确;
B.X是N,原子序数为7,的原子核内中子数为7,B正确;
C.Z是S,Z的最高氧化物对应的水化物H2SO4属于强酸,C错误;
D.Y是Na,Y的一种氧化物的化学式是,D正确;
故选C。
6.A
解析:P的质子数为15,原子中质子数=核外电子数,所以该核素原子核外电子数为15,故选A。
7.D
【分析】同分异构体的定义:分子式相同、结构不同的化合物互称同分异构体,据此分析。
解析:A.CO与N2分子式不同,不符合同分异构体的定义,A不选;
B.CH3CH2OH与CH3COOH分子式不同,不符合同分异构体的定义,B不选;
C.12C与13C为同一元素的不同原子,故二者之间互为同位素,C不选;
D.CH3CH2CH2CH3与二者的分子均为C4H10,二者结构不同,符合同分异构体的定义,选D;
故本题选D。
8.D
解析:A.同一周期从左到右,元素原子半径逐渐减小,则半径:Cl
C.非金属性:P>As,元素的非金属性越强,对应的氢化物稳定性越强,则稳定性:PH3> AsH3,C错误;
D.同周期从左到右,金属性减弱,非金属性变强;同主族由上而下,金属性增强,非金属性变弱;非金属性:O>P,故D正确;
故选D。
9.B
解析:A.锂元素是3号元素,最外层1个电子,是第IA族元素,故A不符合题意;
B.镁元素是12号元素,最外层2个电子,是第IIA族元素,故B符合题意;
C.氧元素是8号元素,最外层6个电子,是第VIA族元素,故C不符合题意;
D.氯元素是17号元素,最外层7个电子,是第VIIA族元素,故D不符合题意。
综上所述,答案为B。
10.B
解析:A.锂的金属性比钠的弱,在空气中燃烧只能生成,A错误;
B.常温下,铝遇浓硫酸钝化,所以可用铝质容器盛装浓硫酸,B正确;
C.钠的氧化物有和,为碱性氧化物,为过氧化物,铝的氧化物为两性氧化物,C错误;
D.NO要与反应,生成,不能用排空气法收集,D错误;
故选B。
11.B
解析:中子数=质量数-质子数=127-53=74,故B正确;
故选:B。
12.B
解析:原子核外电子层数越多,原子半径越大。当原子核外电子层数相同时,原子序数越小,原子半径越大。在上述元素中O是第二周期元素,其余元素是第三周期,在Na、S、Cl中,原子序数最小的Na,所以原子半径最大的元素是Na元素;
故合理选项是B。
二、非选择题
13.(1) ②③④① ①②
(2)①② ④
解析: (1)一般地,电子层数越多,原子半径越大,若电子层数相同,则原子序数越大,原子半径越小。所以这四种元素的原子半径从大到小的顺序为:②③④①;在元素符号左上角的数字是质量数,左下角的数字是质子数,质量数减去质子数等于中子数,所以这四种微粒的质子数小于中子数的是①②。
(2)Na和O能形成Na2O2,故能形成 X2Y2 型化合物的是①②;金属元素没有负价,通常情况下,O没有正价,所以化合价有零价、正价和负价的是N,故选④。
14.(1)
(2)ABC
(3)A
(4)和
(5)//、、
解析:(1)含有、的混合溶液中,加入足量的NaOH溶液,可以和碱反应转化为Fe(OH)3沉淀,,而和过量的强碱会转化为偏铝酸钠,,过滤可以分离和,发生反应的离子方程式为,故答案为:;
(2)A. 还原铁粉与水蒸气在高温条件下反应:3Fe+4H2O(g)Fe3O4+4H2,可转化为磁性氧化铁,故A正确;
B. 将溶液中加入NaOH溶液至恰好完全沉淀,,过滤,所得Fe(OH)2固体还原性较强,易被氧化为Fe(OH)3固体,充分灼烧得到红棕色固体氧化铁,故B正确;
C. 一定温度和压力下,某些金属可以大量“吸氢”,形成金属氢化物,而且放出热量,金属氢化物的储氢能力都很强,一般呈固态,比较稳定,故C正确;
D. 将铝片分别放入稀盐酸和氢氧化钠溶液中,铝片表面一般都有氧化膜,先发生和,再发生和,两支试管中均会放出一种可燃性气体,但不是立刻,应该过一段时间,故D错误;
故答案为:ABC;
(3)A. 滴入溶液中,先发生,再发生,所以先出现白色沉淀,后来沉淀又消失,故A符合题意;
B. 溶液滴入溶液中会产生BaSO4和Al(OH)3沉淀,当溶液过量时,Al(OH)3沉淀会溶解,所以沉淀会减少但不会消失,故B不符合题意;
C. 溶液滴入NaOH溶液中,先发生,再发生,所以是刚开始没有沉淀,后来沉淀逐渐增加至不变,故C不符合题意;
D. 氨水滴入溶液中只发生,只产生沉淀不会溶解,故D不符合题意;
故答案为:A;
(4)溶液中逐滴滴入NaOH溶液,会先生成沉淀,然后沉淀逐渐溶解,依次发生的离子方程式为:和,故答案为:和;
(5)制备氢氧化铝可以有三种方法:一是可溶性铝盐和弱碱溶液反应,离子方程式为:;二是可溶性的偏铝酸盐溶液中通入过量的二氧化碳,离子方程式为;三是用单质铝、强酸、强碱来制备,其中四分之三的铝与强碱反应:,四分之一的铝与强酸反应:,再将二者混合可得氢氧化铝沉淀,,故答案为:或或、、。
15.(1)同位素
(2)不是 2H2与3H2不是核素原子,不互为同位素
(3)原子弹爆炸不是化学变化 因为原子的种类发生了变化,不是生成新物质的变化
解析:(1)235U与234U、238U是质子数相同的不同原子,三者互为同位素;
(2)2H2与3H2两者是氢气单质,不是核素原子,不互为同位素;
(3)原子弹爆炸没有生成新物质,只是原子裂变生成了新原子,不是化学变化。
16.0 3∶2 1.12
【分析】I.根据电荷守恒计算混合溶液中n(Al3+),向MgCl2和AlCl3的混合溶液加入NaOH溶液,使Mg2+全部转化为沉淀分离出来,Al3+应恰好转化为,反应后溶液为NaCl、NaAlO2的混合液,根据钠离子守恒n(NaOH)=n(NaCl)+n(NaAlO2),再结合氯离子守恒、Al原子守恒可知n(NaOH)=n(Cl-)+n(Al3+),再根据计算;
II.(1)根据Cu元素的化合价降低、N元素的化合价升高,利用电子守恒及质量守恒定律来配平反应;
(2)该反应中氧化剂为CuO,还原剂为NH4Cl,由(1)中双线桥可知,氧化剂和还原剂的物质的量之比为3:2;
(3)生成1个N2分子转移电子数为6,若反应中电子转移了0.3mol,则产生的N2的物质的量为=0.05mol,带入V=nVm计算。
解析:I.溶液中n(Cl )=0.2L×1.3mol/L=0.26mol,
溶液中n(Mg2+)=0.2mol/L×0.2L=0.04mol,
根据电荷守恒,溶液中n(Al3+)==0.06mol,
将200mL此溶液中的Mg2+转化为Mg(OH)2沉淀并分离析出,反应后溶液为NaCl、NaAlO2的混合液,根据钠离子守恒:n(NaOH)=n(NaCl)+n(NaAlO2),再结合氯离子守恒、Al原子守恒可知:n(NaOH)=n(Cl )+n(Al3+)=0.26mol+0.06mol=0.32mol,所以至少需要4mol/L氢氧化钠溶液的体积为:=0.08L=80mL;
II.(1)根据Cu元素的化合价由+2价降至0价,得到2mol电子生成1molCu,N元素的化合价由-3价升至0价,失去6mol电子生成1molN2,利用电子守恒及质量守恒定律来配平反应得2NH4Cl+4CuO=3Cu+CuCl2+N2↑+4H2O,双线桥法标出电子转移情况为:;
(2)该反应中氧化剂为CuO,还原剂为NH4Cl,由(1)中双线桥可知,4molCuO参与反应,做氧化剂的为3mol,氧化剂和还原剂的物质的量之比为3:2;
(3)生成1个N2分子转移电子数为6,若反应中电子转移了0.3mol,则产生的N2的物质的量为=0.05mol,则产生的N2在标准状况下的体积V=nVm=0.05mol×22.4L/mol=1.12L。
17.8 g 8 mol·L-1
【分析】在合金中,Mg与HCl反应生成MgCl2,MgCl2与NaOH反应转化为Mg(OH)2,由图象中11.6g为Mg(OH)2的质量,可求出合金中镁的质量。在图象的0点,溶液的成分为MgCl2、AlCl3、HCl,在沉淀的最高点,溶液中只有NaCl,由NaOH的体积,结合其物质的量浓度,可求出HCl的物质的量,从而求出其物质的量浓度。
解析:(1)由图象可知,氢氧化镁的质量为11.6 g,根据镁元素守恒:
合金中镁的质量=11.6 g÷58 g·mol-1×24 g·mol-1=4.8 g。答案为:4.8 g;
(2)当沉淀的量最大时,溶液中溶质为氯化钠,
盐酸的物质的量浓度=0.16 L×5 mol·L-1÷0.1 L=8 mol·L-1。答案为:8 mol·L-1。
18.(1)第二周期第VIA族
(2)同一周期从左往右,与核外电子层数相同,但的核电荷数比大,原子半径小,失电子能力弱,故金属性
(3) 共价键 H2O
(4)
(5) A
【分析】W、X、Y、Z、Q五种原子序数依次增大的前20号元素,最外层电子数之和为16,W与X形成的某淡黄色离子化合物可用作漂白剂,为过氧化钠,则W为氧元素,X为钠元素,Y的单质被誉为“国防金属”,为镁元素,Z的最高价氧化物对应的水化物为中强酸,为磷元素,根据最外层电子数之和为16分析,Q的最外层电子数为2,则为钙元素,据此解答。
解析:(1)氧元素在第二周期第VIA族。
(2)同一周期从左往右,与核外电子层数相同,但的核电荷数比大,原子半径小,失电子能力弱,故金属性
(3)氧和磷分别形成的气态氢化物分子为水或磷化氢,均含有的化学键类型为共价键,其稳定性较强的是水。
(4)钠的氢化物可在野外用作生氢剂,氢元素为-1价,为氢化钠,与水反应的化学方程式为。
(5)①A.、的核外电子数相同,故化学性质基本相同,正确; B.、互为同位素,不是同素异形体,故错误;C.与的中子数分别为1和2,不同; D.液化没有新物质生成,不是化学变化,故选A。
②还可以用来人工合成一些半衰期短,自然界中不能稳定存在的原子,例如:,根据质子数计算,m=8+2-2=8,,为氧元素,n=16+3-4=15新合成的粒子的符号是。
19.(1)
(2)HF
(3)HClO4
(4)
(5)Al(OH)3+OH-= +2H2O或Al(OH)3+OH-=[Al(OH)4]-
(6)NCl3+3H2O=3HClO+NH3
(7)F->Na+>Al3+
(8)离子键
(9)BC
【分析】根据元素周期表中各元素的位置可知,a为H、b为N、c为F、d为Na、e为Al、f为S、g为Cl;
解析:(1)元素f为S元素,其原子结构示意图为;
(2)同主族从上而下非金属性增强,气态氢化物的稳定性增强,故a与元素c和g形成的简单氢化物HF、HCl中稳定性强的是HF;
(3)元素非金属性越强其最高价氧化物的水化物的酸性越强,但F没有正价,故由上述元素形成的最高价氧化物对应水化物中,酸性最强的是HClO4;
(4)hc2为CaF2,电子式为;
(5)元素d的最高价氧化物对应的水化物NaOH与元素e的最高价氧化物对应的水化物Al(OH)3反应生成偏铝酸钠和水,反应的离子方程式为Al(OH)3+OH-= +2H2O或Al(OH)3+OH-=[Al(OH)4]-;
(6)bg3为NCl3,与水反应生成两种物质,其中一种使pH试纸先变红又褪色,为HClO,反应的化学方程式为NCl3+3H2O=3HClO+NH3;
(7)具有相同电子层结构的离子,核电荷数越大半径越小,故 c、d、e的简单离子半径由大到小的顺序为F->Na+>Al3+;
(8)c与d形成的原子个数比为1:1的化合物NaF中含有的化学键类型为离子键;
(9)d为Na、e为Al,
A. 单质的熔点是物理性质,不能利用熔点判断金属性强弱,选项A错误;
B. 单质的还原性越强,其简单阳离子的氧化性越弱,故简单阳离子的氧化性:Al3+>Na+,可证明钠的金属性强于铝,选项B正确;
C. 金属性越强,与水反应的剧烈程度越大,常温下,Na单质能与水剧烈反应而Al不能,可证明钠的金属性强于铝,选项C正确;
D. 金属单质与盐酸反应产生氢气的多少不能证明金属性强弱,应利用失电子能力强弱判断金属性强弱,选项D错误;
答案选BC。
20.棕黄 橙红 蓝 2FeBr2+3Cl2═2FeCl3+2Br2 2FeCl3+2KI═2FeCl2+2KCl+I2
解析:FeBr2溶液中通入足量氯气,反应生成FeCl3、Br2,加四氯化碳萃取后,溴溶解在四氯化碳中,且分层后在下层,而上层为氯化铁溶液,氯化铁与KI发生氧化还原反应生成碘,淀粉遇碘变蓝,由上述分析可知,上层a(氯化铁溶液)为棕黄色,下层b(溴的四氯化碳溶液)为橙红色,c为蓝色,上述反应的化学方程式为2FeBr2+3Cl2=2FeCl3+2Br2、2FeCl3+2KI=2FeCl2+2KCl+I2。
21.(1) 分液漏斗 防止倒吸
(2) 浓盐酸 KMnO4 Na2S溶液 Cl2+Na2S=2NaCl+S↓
【分析】先用浓盐酸和高锰酸钾常温下反应制取氯气,生成的氯气通入硫化钠溶液中,置换出硫单质,证明氯气的氧化性比硫强。
解析:(1)依据仪器构造可知,A为分液漏斗,氯气与硫化钠溶液反应,气体体积减少,D起到防倒吸的作用。
(2)要验证氯的非金属性比硫强,可验证氯气的氧化性比硫单质强,题给发生装置为固-液不加热装置,因此应选择浓盐酸和高锰酸钾常温下反应制取氯气,A中盛放浓盐酸、B中盛放高锰酸钾,将生成的氯气通入硫化钠溶液中,氯气与硫化钠反应生成氯化钠和硫单质,从而证明氯气的氧化性比硫单质强,则C中盛放硫化钠溶液,反应的化学方程式为:Cl2+Na2S=2NaCl+S↓。
22.(1)分液漏斗
(2)溶液变成蓝色
(3)有色布条褪色
(4)D
(5)尾气处理,防止污染空气
(6)6NaClO2 + NCl3 + 3H2O==6ClO2↑+NH3↑+ 3NaCl + 3NaOH
【分析】装置A为氯气的发生装置,MnO2与浓盐酸共热产生氯气,因为盐酸具有挥发性,需用盛有饱和食盐水的洗气瓶B除去氯气中的HCl,氯气具有氧化性,可氧化装置C溶液中的I ,生成I2,淀粉遇I2变蓝,氯气能与水反应生成HClO,HClO具有漂白性,能使装置D中的有色布条褪色,而氯气有毒,需要用烧杯E中的NaOH溶液吸收多余的氯气,以防污染空气。
解析:(1)实验室制备时,分液漏斗中盛放的是浓盐酸,装置A中与浓盐酸反应的离子方程式为;故答案为分液漏斗;;
(2)装置C中发生反应,I2遇淀粉变蓝;故答案为:溶液变成蓝色;
(3)此时氯气中混入了水蒸气,当持续通过时,装置D中干燥有色布条遇潮湿的氯气会被漂白褪色;故答案为有色布条褪色;
(4)干燥的无漂白性,若要证明此结论,需在通入装置D前对其进行干燥,即在装置D前增加装有浓硫酸的洗气装置;故答案为D;
(5)氯气可以和氢氧化钠反应,装置E中NaOH溶液可进行尾气处理,防止污染空气,反应的离子方程式为;故答案为吸收多余的氯气,防止污染空气;;
(6)据化合价升降可知:NaClO2 中的Cl为+3价,NCl3中的Cl为+1价,产物中的ClO2中的Cl为+4价,NaCl中的Cl为—1价,按照价态不交叉规律可知,NaClO2为还原剂,生成氧化产物ClO2,NCl3为氧化剂,生成还原产物NaCl,配平方程式为:6NaClO2 + NCl3 + 3H2O==6ClO2↑+NH3↑+ 3NaCl + 3NaOH
