第四章 化学反应与电能(含解析) 测试题 2023-2024学年高二上学期化学人教版(2019)选择性必修1
文档属性
| 名称 | 第四章 化学反应与电能(含解析) 测试题 2023-2024学年高二上学期化学人教版(2019)选择性必修1 |  | |
| 格式 | docx | ||
| 文件大小 | 865.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-17 00:10:53 | ||
图片预览


文档简介
第四章 化学反应与电能测试题
一、选择题
1.化学与生产、生活密切相关。下列说法错误的是
A.冶炼铝是电能转化为化学能的过程
B.水垢中的,可直接加盐酸除去
C.汽车尾气系统中使用催化转化器可减少有害气体的排放
D.盐碱地(含较多的NaCl、)不利于农作物生长,可施加适量石膏降低土壤碱性
2.2022年11月,我国“天舟五号”货运飞船搭载的燃料电池成功完成在轨试验。下列关于氢氧燃料电池的说法不正确的是
A.电池工作时将电能转化为化学能 B.H2在电池的负极放电
C.O2反应中得到电子 D.氢气、氧气可通过电解水产生
3.下列说法中不正确的是
A.硅酸钠水溶液可用作胶粘剂和木材防火剂
B.速滑馆使用CO2制冰,比用氟利昂制冰更环保
C.当镀锡铁制品的镀层破损时,镀层能对铁制品起保护作用
D.化石燃料和植物燃料燃烧时放出的能量最初来源于太阳能
4.室温下,下列实验探究方案能达到探究目的的是
选项 探究方案 探究目的
A 向盛有少量酸性溶液的试管中滴加足量乙醇,充分振荡,观察溶液颜色变化 乙醇具有还原性
B 用铂丝蘸取某溶液进行焰色试验,观察火焰颜色 溶液中存在
C 向盛有3 mL 0.1 mol·L 溶液的试管中滴加2滴0.1 mol·L NaCl溶液,振荡试管,再向试管中滴加2滴0.1 mol·L KI溶液,观察生成沉淀的颜色
D 将中间裹有锌皮的铁钉放在滴有酚酞的饱和NaCl溶液中,一段时间后观察铁钉周围溶液颜色变化 铁钉能发生吸氧腐蚀
A.A B.B C.C D.D
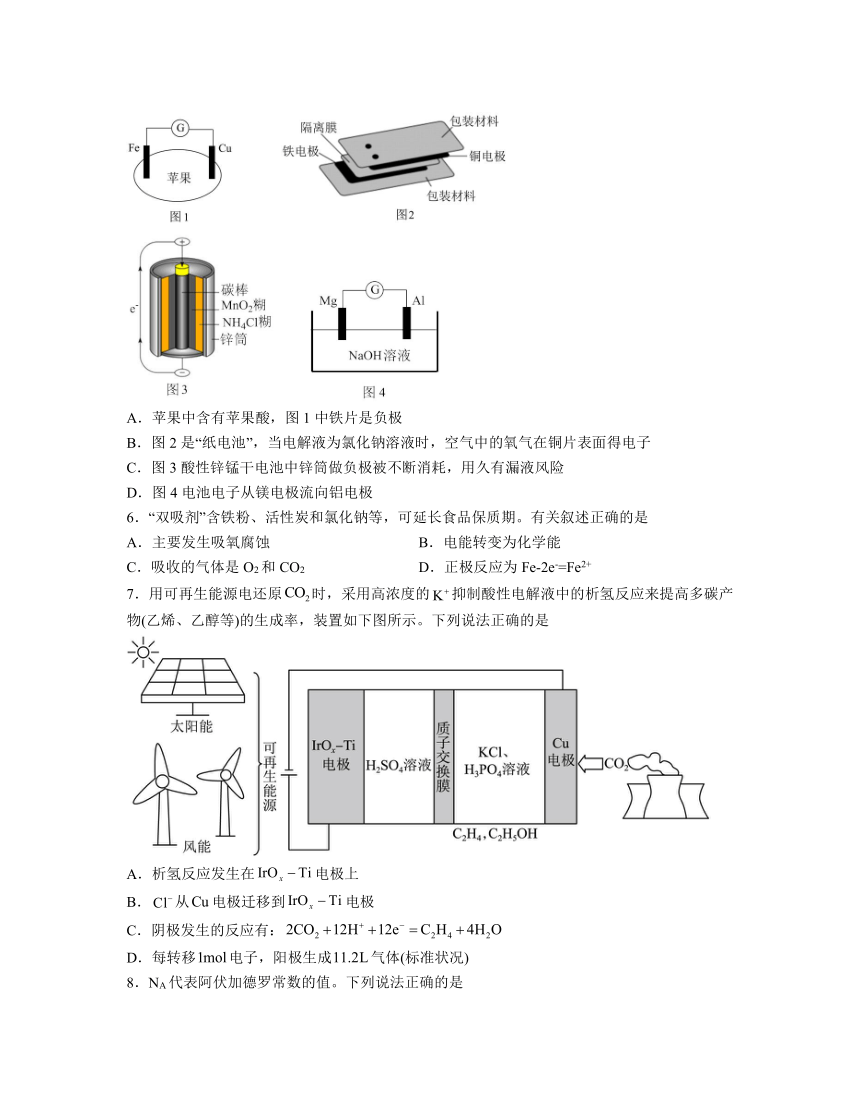
5.我们在课堂上学习和接触过许多有趣的电池,关于下列电池的说法不正确的是
A.苹果中含有苹果酸,图1中铁片是负极
B.图2是“纸电池”,当电解液为氯化钠溶液时,空气中的氧气在铜片表面得电子
C.图3酸性锌锰干电池中锌筒做负极被不断消耗,用久有漏液风险
D.图4电池电子从镁电极流向铝电极
6.“双吸剂”含铁粉、活性炭和氯化钠等,可延长食品保质期。有关叙述正确的是
A.主要发生吸氧腐蚀 B.电能转变为化学能
C.吸收的气体是O2和CO2 D.正极反应为Fe-2e-=Fe2+
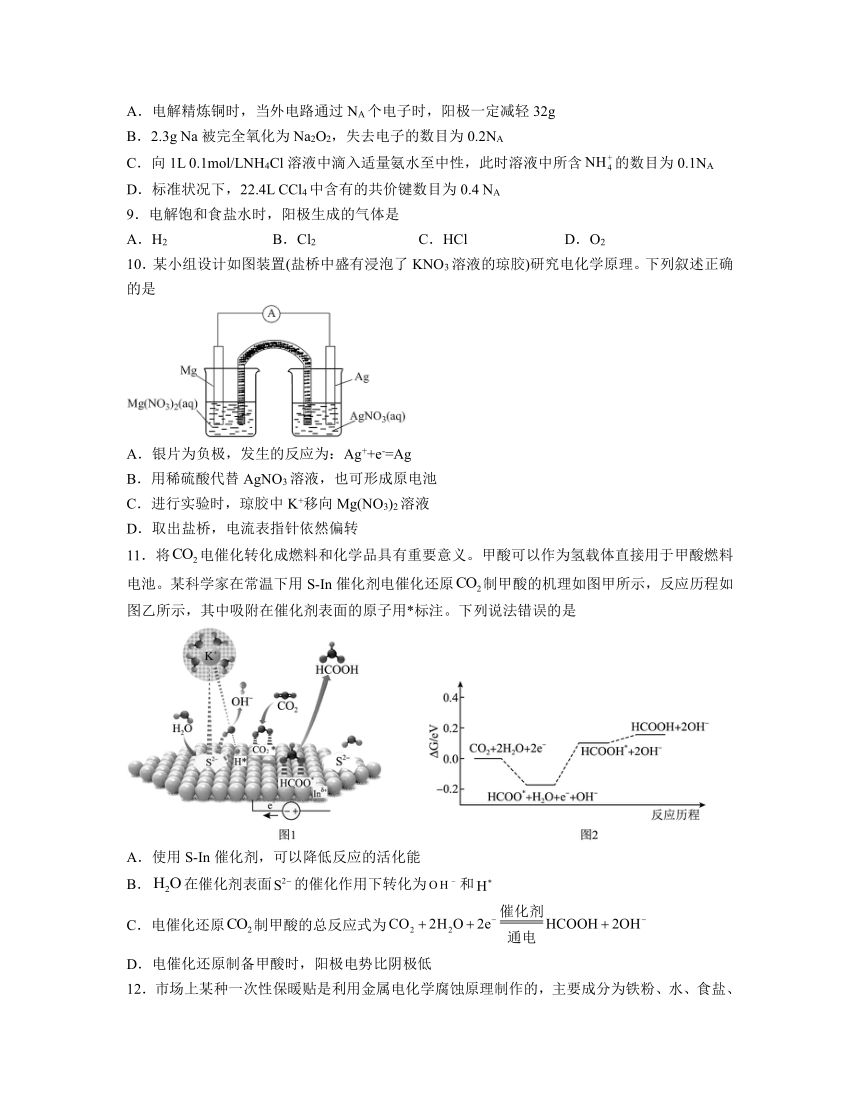
7.用可再生能源电还原时,采用高浓度的抑制酸性电解液中的析氢反应来提高多碳产物(乙烯、乙醇等)的生成率,装置如下图所示。下列说法正确的是
A.析氢反应发生在电极上
B.从电极迁移到电极
C.阴极发生的反应有:
D.每转移电子,阳极生成气体(标准状况)
8.NA代表阿伏加德罗常数的值。下列说法正确的是
A.电解精炼铜时,当外电路通过NA个电子时,阳极一定减轻32g
B.2.3g Na被完全氧化为Na2O2,失去电子的数目为0.2NA
C.向1L 0.1mol/LNH4Cl溶液中滴入适量氨水至中性,此时溶液中所含的数目为0.1NA
D.标准状况下,22.4L CCl4中含有的共价键数目为0.4 NA
9.电解饱和食盐水时,阳极生成的气体是
A.H2 B.Cl2 C.HCl D.O2
10.某小组设计如图装置(盐桥中盛有浸泡了KNO3溶液的琼胶)研究电化学原理。下列叙述正确的是
A.银片为负极,发生的反应为:Ag++e-=Ag
B.用稀硫酸代替AgNO3溶液,也可形成原电池
C.进行实验时,琼胶中K+移向Mg(NO3)2溶液
D.取出盐桥,电流表指针依然偏转
11.将电催化转化成燃料和化学品具有重要意义。甲酸可以作为氢载体直接用于甲酸燃料电池。某科学家在常温下用S-In催化剂电催化还原制甲酸的机理如图甲所示,反应历程如图乙所示,其中吸附在催化剂表面的原子用*标注。下列说法错误的是
A.使用S-In催化剂,可以降低反应的活化能
B.在催化剂表面的催化作用下转化为和
C.电催化还原制甲酸的总反应式为
D.电催化还原制备甲酸时,阳极电势比阴极低
12.市场上某种一次性保暖贴是利用金属电化学腐蚀原理制作的,主要成分为铁粉、水、食盐、活性炭、蛭石等,其中,活性炭是电极材料之一,食盐水为电解质溶液。下列有关保暖贴的说法错误的是
A.该保暖贴中铁作负极,发生的电极反应是
B.活性炭作正极,发生的电极反应是
C.该一次性保暖贴放出的热量是氧气与铁粉发生氧化反应时产生的
D.保暖贴使用前要密封保存,使之与空气隔绝
二、非选择题
13.日常生产、生活中用到许多金属制品,从实用美观角度考虑选择下列合适的金属材料或保护(防腐蚀)方法,将序号填入下表相应空格中。
①不锈钢 ②白铁(镀锌铁皮) ③铝合金 ④镀铬铁管 ⑤涂漆 ⑥镶嵌锌块 ⑦与直流电源负极相连(阴极保护法)
用途 选用材料或保护方法
菜刀 _______________
楼梯扶手或阳台护栏 _______________
水桶 _______________
航海轮船 _______________
水闸 _______________
吊车塔架 _______________
房门窗框 _______________
14.某课外活动小组进行电解饱和食盐水的实验(如图)。请回答下列问题。
(1)通电一段时间后,可观察到___________电极(填“阴极”或“阳极”)附近溶液颜色先变红,该电极上的电极反应式为___________。
(2)该溶液电解反应的化学方程式为___________。
(3)若开始时改用铁棒做阳极,阳极的电极反应式为___________。
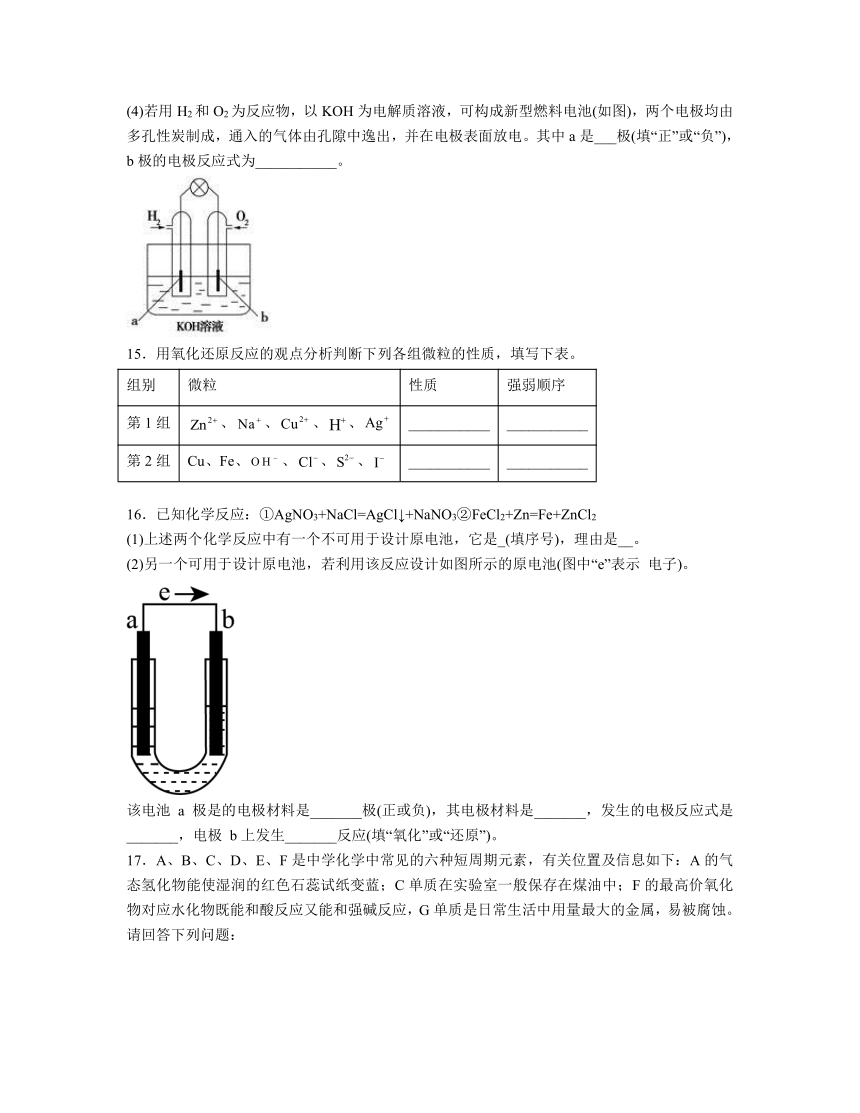
(4)若用H2和O2为反应物,以KOH为电解质溶液,可构成新型燃料电池(如图),两个电极均由多孔性炭制成,通入的气体由孔隙中逸出,并在电极表面放电。其中a是___极(填“正”或“负”),b极的电极反应式为___________。
15.用氧化还原反应的观点分析判断下列各组微粒的性质,填写下表。
组别 微粒 性质 强弱顺序
第1组 、、、、 ___________ ___________
第2组 Cu、Fe、、、、 ___________ ___________
16.已知化学反应:①AgNO3+NaCl=AgCl↓+NaNO3②FeCl2+Zn=Fe+ZnCl2
(1)上述两个化学反应中有一个不可用于设计原电池,它是_(填序号),理由是__。
(2)另一个可用于设计原电池,若利用该反应设计如图所示的原电池(图中“e”表示 电子)。
该电池 a 极是的电极材料是_______极(正或负),其电极材料是_______,发生的电极反应式是_______,电极 b上发生_______反应(填“氧化”或“还原”)。
17.A、B、C、D、E、F是中学化学中常见的六种短周期元素,有关位置及信息如下:A的气态氢化物能使湿润的红色石蕊试纸变蓝;C单质在实验室一般保存在煤油中;F的最高价氧化物对应水化物既能和酸反应又能和强碱反应,G单质是日常生活中用量最大的金属,易被腐蚀。请回答下列问题:
(1)A元素在周期表中的位置是____________。
(2)A与B可组成质量比为7:16的三原子分子,该分子释放在空气中可能引起的环境问题有:(任写一种)。__________________;
(3)同温同压下,将a L A氢化物的气体和b L D的氢化物气体通入水中,若a=b,则所得溶液的pH__7(填 “>"或“<”或“=”),若使所得溶液pH=7,则a_________b(填“>"或“<”或“=”)。
(4)写出F的单质与NaOH溶液反应的离子方程式:____________________。
(5)已知一定量的E单质能在B2(g)中燃烧,其可能的产物及能量关系如下左图所示:请写出一定条件下EB2(g) 与E(s)反应生成EB(g)的热化学方程式__________________。
(6)若在D与G组成的某种化合物的溶液甲中,加入铜片,溶液会慢慢变为蓝色,依据产生该现象的反应原理,所设计的原电池如上右图所示,其反应中正极反应式为______________。某同学假设正极产物是Fe2+,请你设计实验证明该假设___________________。
18.I.已知K、L、M、P、Q、R是原子序数依次增大的短周期主族元素。K和Q同主族,L是可以形成化合物种类最多的元素,M与K形成的化合物常作制冷剂,P元素原子的最外层电子数是电子层数的3倍,R是地壳中含量最丰富的金属元素。回答下列问题:
(1)L元素在元素周期表中的位置是___________。
(2)Q元素的最高价氧化物对应的水化物与R单质反应的离子方程式为___________;向反应后的溶液中持续滴加稀盐酸,能看到的现象是___________。
(3)K与P形成的原子个数比为1∶1的物质的电子式为___________。
II.氮及其化合物在生产、生活与环境中有着重要的研究和应用价值。
(4)是制碱工业中不可缺少的物质,写出实验室制备的化学反应方程式___________;验证已经集满的方法是___________。
(5)是一种强氧化剂,常与肼组成双组元液体推进剂,用于火箭发射,二者反应生成无毒无污染的物质,则该反应的化学方程式为___________。
(6)一种电解处理含氮废水的方法如图所示,写出阴极的电极反应式___________。
19.2019年是元素周期表诞生150周年,元素周期表在学习、研究和生产实践中有很重要的作用。已知、、、是中学常见的四种元素.原子序数依次增大。的原子最外层电子数是次外层的2倍。的氧化物属于两性氧化物,、位于同周期,、、的原子最外层电子数之和为14,是人体必需的微量元素,缺乏会导致贫血症状。
(1)硒是人体必需的微量元素。人体内产生的活性氧能加速人体衰老,被称为“生命杀手”。化学家尝试用及其他富硒物质清除人体内的活性氧,此时表现出_______性。
(2)下列事实能用元素周期律解释的是_______(填序号)。
a. 的最高价氧化物对应水化物的碱性弱于
b. 的气态氢化物的稳定性小于
c. 的溶液可用于刻蚀铜制的印刷电路板
(3)的单质可用于处理酸性废水中的,使其转换为,同时生成有磁性的的氧化物,再进行后续处理。
①上述反应的离子方程式为_______。
②的单质与在高温下反应的化学方程式为_______。
(4)铅和元素同主族,可发生反应。请写出草酸的电子式:_______。与性质相似,与氢氧化钠溶液反应的离子方程式是_______。
(5)金属镓有“电子工业脊梁”的美誉,它与同主族,其氧化物和氢氧化物均为两性化合物。工业上通常用电解精炼法提纯镓。某待提纯的粗镓内含、、杂质,以水溶液为电解质溶液。在电流作用下使粗镓溶解进入电解质溶液,通过某种离子迁移技术到达阴极,并在阴极放电析出高纯镓。(离子氧化性顺序为:)下列有关电解精炼镓的说法正确的是_______(填序号)。
A.阳极发生氧化反应,其主要电极反应式:
B.电解过程中,阳极质量的减少与阴极质量的增加相等
C.在阴极除了析出高纯度的镓之外,还可能有产生
D.电解后,电解槽底部的阳极泥中只有和
20.可用作净水剂、还原剂等。回答下列问题:
Ⅰ.制备。装置如图所示(夹持装置省略)。已知极易水解。
(1)仪器a的名称是___________。
(2)装置Ⅱ中制备的化学方程式为___________,装置Ⅲ的作用:①吸收尾气;②___________。
(3)该装置存在的缺陷是___________。
Ⅱ.利用惰性电极电解溶液,探究外界条件对电极反应产物的影响。
(4)实验数据如下表所示:
实验编号 电压 阳极现象 阴极现象
1 1.5 5.52 无气泡,滴加显红色 无气泡,银白色金属析出
2 3.0 5.52 少量气泡,滴加显红色 无气泡,银白色金属析出
3 4.5 5.52 大量气泡,滴加显红色 较多气泡,极少量金属析出
4 1.5 无气泡,滴加显红色 较多气泡,极少量金属析出
①实验2、3中阳极产生的气体是___________(填化学式)。
②实验中,调节溶液的宜选用___________(填“盐酸”、“硝酸”或“硫酸”)。
③由实验1、2现象可以得出结论___________;由实验1、4现象可以得出结论___________。
21.阿伏加德罗常数是一座“桥梁”,连接了宏观世界和微观世界的数量关系。通过电解法可测得的数值。
已知:i.1个电子所带电量为库仑。
ii.(乙二胺四乙酸二钠)能形成可溶含铜配离子。
iii.,。
【实验一】用铜片和铂丝为电极,电解硫酸酸化的溶液。测得通过电路的电量为x库仑。电解完成后,取出铜片,洗净晾干,铜片质量增加了。
(1)铜片应连接电源的___________(填“正极”或“负极”)。铂丝尖端产生气泡,其电极反应式为___________。理论上,产生气体与析出铜的物质的量之比为___________。
(2)本实验测得___________(列出计算式)。
【实验二】为减少含重金属电解液的使用,更换电解液,同时更换电极与电源的连接方式。电解完成后,取出铜片,洗净晾干,铜片质量减小。
实验 电解液 实验现象
① 溶液 铜片表面为灰蓝色
② 和混合液 铜片表面仍为红色
(3)实验①和②中各配制电解液,使用的主要仪器有天平、烧杯、玻璃棒、胶头滴管和___________。
(4)经检验,实验①中的灰蓝色成分主要是。从平衡移动角度解释在测定的数值中的作用:___________。
(5)电解过程中,若观察到铜片上有小气泡产生,利用铜片质量减小计算的数值___________(填“偏大”、“偏小”或“不变”)。
(6)实验结束后处理电解液:将取出的电解液加入过量硫酸,过滤,得到白色固体和滤液a;向滤液a中先加入调,再加入,解释不直接加入的原因及的作用:___________。
22.为了研究硫酸铜的量对氢气生成速率的影响,某同学设计了如下一系列的实验:将表中所给的混合溶液分别加入到6个盛有过量Zn粒的容器中,收集产生的气体,记录获得相同体积的气体所需时间。
A B C D E F
4mol/LH2SO4溶液(mL) 30 V1 V2 V3 V4 V5
饱和CuSO4溶液(mL) 0 0.5 2.5 5 V6 20
H2O(mL) V7 V8 V9 V10 10 0
(1)请完成此实验设计,其中V7=______,V9=______。
(2)在D组实验中,按照反应发生的先后顺序写出发生反应的离子方程式:①______、②_____。
(3)该同学最后得出的结论为:当加入少量CuSO4溶液时,生成氢气的速率会大大提高,但当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降。请分析氢气生成速率下降的主要原因:___。
【参考答案】
一、选择题
1.B
解析:A.工业上冶炼金属铝的反应为,电解时,电能转化为化学能,故A正确;
B.不溶于盐酸,可用碳酸钠溶液浸泡后,加稀盐酸洗涤,故B错误;
C.汽车尾气含有NO和CO等有害气体,使用催化转化器可以将有害气体转化为无害气体氮气和二氧化碳,减少有害气体的排放,故C正确;
D.石膏为,可以与反应生成难溶的碳酸钙和硫酸钠,降低土壤的碱性,故D正确;
故选B。
2.A
【分析】氢氧燃料电池中氢气失去电子,在负极发生反应,氧气得到电子,在正极发生反应。
解析:A.电池是将化学能转化为电能,故A错误;
B.根据分析可知,H2失电子,在电池的负极放电,故B正确;
C.O2反应中得到电子,故C正确;
D.电解水发生反应2H2O2H2↑+O2↑,故D正确;
故选A。
3.C
解析:A.硅酸钠(Na2SiO3)的水溶液俗称“水玻璃”,是建筑行业经常使用的一种黏胶剂,也称为泡花碱,可用作肥皂填料,硅酸钠也可作木材和纺织品的防火剂,A正确;
B.二氧化碳跨临界制冰技术,与传统制冷剂氟利昂相比更加环保,减少了氟利昂对臭氧层的破坏作用,B正确;
C.锡的金属性大于铁的金属,当镀锡铁制品的镀层破损时,铁会先腐蚀,故镀层不能对铁制品起保护作用,C不正确;
D.植物在光合作用中的物质转化和能量转化,植物的光合作用是将光能(太阳能)转化为化学能,将无机物转化为有机物,D正确;
故选C。
4.A
解析:A.酸性溶液的试管中滴加足量乙醇,若溶液褪色说明被还原为无色离子,则乙醇表现还原性,否则则无还原性,故A正确;
B.焰色试验只能确定金属元素是否存在,不能确定具体物质,故B错误;
C.所用硝酸银溶液过量,滴入的碘化钾直接与硝酸银反应生成AgI沉淀,不能说明是AgCl转化为AgI,因此不能验证Ksp大小,故C错误;
D.锌比铁活泼,形成原电池时Zn作负极,Fe作正极,铁钉不被腐蚀,故D错误;
故选:A。
5.D
解析:A.苹果中含有苹果酸,苹果酸属于电解质,Fe、Cu两种金属性不同的金属,铁比铜活泼,图1构成原电池,铁作负极,故A说法正确;
B.铁比铜活泼,当电解液为氯化钠溶液时,发生吸氧腐蚀,铁作负极,铜作正极,氧气在铜片表面得电子,故B说法正确;
C.锌为活泼金属,锌锰干电池中锌作负极,锌发生氧化反应,被消耗,锌铜会变薄,有漏液风险,故C说法正确;
D.Mg虽然比Al活泼,但Mg不与氢氧化钠溶液反应,而Al能与氢氧化钠溶液发生氧化还原反应,则Al作负极,Mg作正极,根据原电池工作原理,电子从Al经外电路流向Mg电极,故D说法错误;
答案为D。
6.A
解析:A.铁为金属,活泼性大于碳,氯化钠为电解质,潮湿环境中形成原电池,为中性环境,发生铁的吸氧腐蚀,A正确;
B.形成原电池,将化学能转化为电能,B错误;
C.该过程发生铁的吸氧腐蚀,正极上氧气得电子和水反应生成氢氧根离子,吸收的气体是O2和水,C错误;
D.Fe-2e-=Fe2+为负极反应,正极反应是O2+4e-+2H2O=4OH-,D错误;
综上所述答案为A。
7.C
【分析】由图可知,该装置为电解池,与直流电源正极相连的IrOx-Ti电极为电解池的阳极,水在阳极失去电子发生氧化反应生成氧气和氢离子,电极反应式为2H2O-4e—=O2↑+4H+,铜电极为阴极,酸性条件下二氧化碳在阴极得到电子发生还原反应生成乙烯、乙醇等,电极反应式为2CO2+12H++12e =C2H4+4H2O、2CO2+12H++12e =C2H5OH+3H2O,电解池工作时,氢离子通过质子交换膜由阳极室进入阴极室。
解析:A.析氢反应为还原反应,应在阴极发生,即在铜电极上发生,故A错误;
B.离子交换膜为质子交换膜,只允许氢离子通过,Cl-不能通过,故B错误;
C.由分析可知,铜电极为阴极,酸性条件下二氧化碳在阴极得到电子发生还原反应生成乙烯、乙醇等,电极反应式有2CO2+12H++12e =C2H4+4H2O,故C正确;
D.水在阳极失去电子发生氧化反应生成氧气和氢离子,电极反应式为2H2O-4e—=O2↑+4H+,每转移1mol电子,生成0.25molO2,在标况下体积为5.6L,故D错误;
答案选C。
8.C
解析:A.电解精炼铜时,当外电路通过NA个电子时,由于阳极含锌、铁等杂质也会失去电子,因此阳极减轻的质量无法计算,故A错误;
B.2.3g Na(物质的量为0.1mol)被完全氧化为Na2O2,因此失去电子的数目为0.1NA,故B错误;
C.向1L 0.1 mol L 1NH4Cl溶液中滴入适量氨水至中性,根据电荷守恒,铵根离子浓度氯离子浓度,因此铵根离子浓度为0.1 mol L 1,则此时溶液中所含的数目为0.1NA,故C正确;
D.标准状况下,CCl4是非气态物质,无法利用所给条件计算其内部共价键数目,故D错误。
综上所述,答案为C。
9.B
解析:电解饱和食盐水时,阳极氯离子放电生成氯气,阴极氢离子放电生成氢气;
故选B。
10.B
解析:A.该装置为MgAg原电池,镁的活泼性大于银,镁作负极,失电子形成镁离子,故A错误;
B.若把硝酸银换成稀硫酸,H+同样在银电极处得到电子析出氢气,可以构成原电池,故B正确;
C.MgAg原电池,镁的活泼性大于银,镁作负极、银为正极,原电池中阳离子移向正极,所以盐桥中的阳离子往右侧硝酸银溶液迁移,故C错误;
D.取出盐桥,由于无法构成闭合回路,不能形成原电池,所以电流表不发生偏转,D错误;
选B。
11.D
解析:A.催化剂的催化原理是降低反应的活化能,提高反应速率,故A正确;
B.根据图甲可知,催化剂活性位点在催化过程中的作用是活化水分子,将转化为和,故B正确;
C.结合图乙反应历程图的起始物质和最终物质,可以得出电催化二氧化碳转化为甲酸的总反应式为,故C正确;
D.电解池中,阳极与电源正极相连,阴极与电源负极相连,电源正极电势高于负极,所以电解池的阳极电势高于阴极,故D错误;
故答案选D。
【点睛】本题主要考查催化机理分析、根据催化机理图能判断微粒的转化及作用、根据反应历程图书写转化反应、综合应用信息书写总的反应方程式、判断电解池中阳极、阴极电势高低,注意对题干中信息的提取和应用。
12.C
解析:A.该保暖贴中,发生的是铁的吸氧腐蚀,铁作负极,电极反应是,A项正确;
B.活性炭作正极,氧气得电子,发生还原反应,电极反应为,B项正确;
C.铁粉与氧气通过无数个微小的电池发生氧化还原反应,放出大量的热,C项错误;
D.铁粉、活性炭、水、食盐等可以构成一个原电池,发生的是铁的吸氧腐蚀,要延长其保质期,应在使用前隔绝空气,密封保存,D项正确;
答案选C。
二、非选择题
13. ① ④ ② ⑥ ⑦ ⑤ ③
解析:(1)菜刀接触潮湿较多,且要求机械强度大,清洁卫生等,故选不锈钢;选①;
(2)楼梯扶手、护栏等要求安全美观,经济实惠,故选镀铬铁管;选④
(3)水桶处于潮湿环境,且摩擦碰撞较多,故选镀锌铁皮;选②
(4)航海轮船则采用镶嵌锌块法保护,效果良好,故选镶嵌锌块;选⑥
(5)水闸位置固定宜采用外加电流的阴极保护法,故选与直流电源负极相连(阴极保护法);选⑦
(6)吊车塔架只求坚固防锈且经济,故涂漆保护就可以了,故选涂漆;选⑤
(7)门窗框要轻便美观,故选用铝合金材料。选③
14. 阴极 2H++2e-=H2↑ 2NaCl+2H2OCl2↑+H2↑+2NaOH Fe-2e-═Fe2+ 负 O2+2H2O+4e-→4OH-
解析:(1)阴极氢离子放电产生氢氧根离子使附近溶液颜色先变红,电极反应方程式为:2H++2e-=H2↑,故答案为阴极;2H++2e-=H2↑;
(2)阳极是还原性强的氯离子放电生成氯气,阴极是氢离子放电生成氢气,所以电解反应的化学方程式为2NaCl+2H2OCl2↑+H2↑+2NaOH;
(3)金属作阳极,阳极是活泼金属铁本身放电,电极反应方程式为:Fe-2e-═Fe2+;
(4)通氢气的一极发生氧化反应是负极;b极氧气发生还原反应是正极,故答案为负;O2+2H2O+4e-═4OH-。
15. 氧化性 还原性
解析:略
16. ① ①为非氧化还原反应,没有电子转移 负 Zn Zn-2e-=Zn2+ 还原
解析:(1)原电池是基于氧化还原反应的原理,上述反应中①没有价态变化,是非氧化还原反应,②有价态变化属于氧化还原反应,故①可设计成原电池,故答案为:①;①为非氧化还原反应,没有电子转移;
(2)FeCl2+Zn=Fe+ZnCl2用于设计原电池,Zn失电子作负极,FeCl2得电子在正极发生反应,由图电子由a流向b,则a为负极发生氧化反应,b为正极,发生还原反应,a极上发生的反应为:Zn-2e-=Zn2+,故答案为:负;Zn;Zn-2e-=Zn2+;还原;
17. 第二周期第VA族 酸雨(或光化学烟雾) < > 2Al + 2OH- + 2H2O=2AlO2- + 3H2↑ CO2(g) + C(s)=2CO(g) △H=+172.5kJ/mol或1/2CO2(g) + 1/2 C(s)= CO(g) △H=+86.25kJ/mol Fe3++ e-=Fe2+ 滴加酸性高锰酸钾溶液(或铁氰化钾溶液),若溶液紫色褪去(或产生蓝色沉淀),则产品中含有Fe2+
解析:A的气态氢化物能使湿润的红色石蕊试纸变蓝,则A是N元素;C单质在实验室一般保存在煤油中,所以C是Na元素;F的最高价氧化物对应的水化物既能与酸反应又能与碱反应,F是Al元素,G单质是日常生活中用量最大的金属,易被腐蚀,则G是Fe元素。其余E是C元素,B是O元素,D是Cl元素。
(1)N元素在周期表中的位置是第二周期第VA族;
(2)N与O可组成质量比为7:16的三原子分子,该分子的化学式是NO2,该分子释放在空气中可能引起的酸雨问题;
(3)a L A氢化物的气体和b L D的氢化物气体通入水中,若a=b,则二者恰好反应生成氯化铵,溶液呈酸性,pH<7。如果使溶液的pH=7,呈中性,所以氨气稍过量,a>b;
(4)Al与氢氧化钠溶液反应生成偏铝酸钠和氢气,离子方程式为2Al+2OH—+2H2O=2AlO2—+3H2↑;
(5)由图可知,1mol C(s)与氧气反应生成1molCO气体放出的热量是393.5kJ-283kJ=110.5kJ,1mol C(s)与氧气完全燃烧生成二氧化碳气体放出393.5kJ的热量,根据盖斯定律,所以EB2(g) 与E(s)反应生成EB(g)的热化学方程式为CO2(g) +C(s)=2CO(g) △H=(-110.5kJ/mol)×2-(-393.5kJ/mol)=+172.5kJ/mol;
(6)Cu与氯化铁溶液反应生成氯化亚铁和氯化铜,溶液逐渐变为蓝色,Cu作负极,发生氧化反应,则正极反应是铁离子得电子生成亚铁离子,电极反应式为Fe3++e-= Fe2+。亚铁离子具有还原性,所以检验亚铁离子的实验方法是滴加酸性高锰酸钾溶液(或铁氰化钾溶液),若溶液紫色褪去(或产生蓝色沉淀),则产品中含有Fe2+。
18.(1)第二周期第IVA族
(2) (或) 先有白色沉淀产生,然后沉淀逐渐溶解消失
(3)
(4) (或) 用湿润的红色石蕊试纸置于试管口,试纸变蓝色或将蘸有浓盐酸的玻璃棒置于试管口,现象是有白烟产生
(5)
(6)
解析:L是可以形成化合物种类最多的元素,则L是C元素,M与K形成的化合物常作制冷剂,则M为N元素,K为H元素,K和Q同主族,则Q为Na元素,P元素原子的最外层电子数是电子层数的3倍,则P为O元素,R是地壳中含量最丰富的金属元素,则R为Al元素。
(1)C元素的原子序数为6,在元素周期表中的位置是第二周期第IVA族。
(2)Na的最高价氧化物对应的水化物是NaOH,与Al反应的离子方程式为(或),向反应后的溶液中持续滴加稀盐酸,先生成Al(OH)3,然后Al(OH)3逐渐溶解为,故能看到的现象是先有白色沉淀产生,然后沉淀逐渐溶解消失。
(3)H与O形成的原子个数比为1∶1的物质是,其电子式为。
(4)实验室制备的反应方程式为(或),验证已经集满常用的方法是用湿润的红色石蕊试纸置于试管口,试纸变蓝色或将蘸有浓盐酸的玻璃棒置于试管口,现象是有白烟产生。
(5)生成的无毒无污染的物质为氮气,因为是双组元液体推进剂,所以产物N2要写气体符号,依据氧化还原原理,配平方程式为。
(6)根据图中所示信息,阴极反应是转化为N2,电极反应式为。
19.(1)还原性
(2)ab
(3)
(4)
(5)CD
解析:A的原子最外层电子数是次外层的2倍,则A为碳元素,D的氧化物属于两性氧化物,则D为铝元素,A、D、E的原子最外层电子数之和为14,则E的最外层电子数=14-4-3=7,D、E位于同周期,则E为氯元素,W是人体必需的微量元素,缺乏W会导致贫血症状,则W为铁元素。
(1)清除人体内的活性氧需要还原剂,所以此时表现出还原性;
(2)a.同周期从左到右元素金属性依次减弱,铝在镁的右边,金属性弱于镁,所以Al的最高价氧化物对应水化物氢氧化铝的碱性弱于Mg(OH)2,故A符合题意;
b.同主族元素从上至下非金属性逐渐减弱,元素的非金属性越强,气态氢化物越稳定,则氯的气态氢化物(HCl)的稳定性小于HF,故B符合题意;
c.氯化铁溶液与铜发生氧化还原反应生成氯化亚铁和氯化铜,不能说明金属性的强弱,不能用元素周期律解释,故C不合题意;
故选ab;
(3)Fe可用于处理酸性废水中的,使其转换为,同时生成有磁性的铁的氧化物X(Fe3O4)。
①上述反应中氮元素的化合价由+5价降低至-3价,铁元素的化合价由0价升高至价(平均化合价),由化合价升降守恒、电荷守恒和质量守恒可配平离子方程式;
②Al与Fe3O4在高温下发生铝热反应生成Al2O3和Fe,化学方程式为;
(4)草酸的结构式为HOOC-COOH,所以电子式为,PbO与碱反应类似Al2O3,所以离子方程式为:,
(5)A.由离子氧化性可知,金属活动性Zn >Ga> Fe,阳极发生氧化反应,其主要电极反应除外,还有锌失电子,故A错误;
B.电解过程中,阳极有Zn、Ga失电子,而阴极只析出Ga ,则阳极质量的减少与阴极质量的增加不相等,故B错误;
C.在阴极除了析出高纯度的家之外,还可能有H+放电有H2产生,故C正确;
D.由于Fe、Cu的活动性比Ga差,则电解后,电解槽底部的阳极泥中只有Cu和Fe,故D正确;
故选CD。
20.(1)长颈漏斗
(2) 2FeCl3+H22FeCl2+2HCl 防止空气中的水蒸气进入装置II中,引起FeCl3水解
(3)装置I和装置II之间缺少一个干燥H2的装置
(4) Cl2 盐酸 电压小时,只有Fe2+放电,电压大时,Fe2+和Cl-放电 pH小时,H+放电、Fe2+几乎不放电,pH大时,Fe2+放电,H+不放电
【分析】实验I中装置I为H2的发生装置,反应原理为:Fe+H2SO4(稀)=FeSO4+H2↑,装置II中为H2还原FeCl3制备FeCl2的装置,反应原理为:2FeCl3+H22FeCl2+2HCl,由于装置II中产生了HCl,故装置III为吸收HCl,同时可以防止空气中的水蒸气进入装置II,引起FeCl3和FeCl2水解,实验II中通过实验现象:阳极区加入KSCN溶液显红色,说明阳极区有Fe3+生成,阳极区产生气泡说明产生了Cl2,阴极区上有银白色金属析出,说明有Fe单质生成,阴极区产生气泡,说明有H2生成,对照各组实验条件的不同进行解题,据此分析解题。
解析:(1)由题干实验装置图可知,仪器a的名称是长颈漏斗,故答案为:长颈漏斗;
(2)装置Ⅱ中制备即FeCl3与H2反应制备FeCl2,故其反应的化学方程式为2FeCl3+H22FeCl2+2HCl,由题干信息可知,极易水解,FeCl2也会水解,则装置Ⅲ的作用:①吸收尾气;②防止空气中的水蒸气进入装置II中,引起FeCl3水解,故答案为:2FeCl3+H22FeCl2+2HCl;防止空气中的水蒸气进入装置II中,引起FeCl3水解;
(3)由题干信息可知,极易水解,则该装置存在的缺陷是装置I和装置II之间缺少一个干燥H2的装置,可以用装有浓硫酸的洗气瓶进行干燥H2,故答案为:装置I和装置II之间缺少一个干燥H2的装置;
(4)①电解池中阳极发生氧化反应,根据实验现象可知,实验2、3中阳极电极反应为:Fe2+-e-=Fe3+、2Cl--2e-=Cl2↑,故产生的气体是Cl2,故答案为:Cl2;
②HNO3具有强氧化性,能将Fe2+氧化为Fe3+,并引入杂质,H2SO4会引入新的杂质,则实验中,调节溶液的宜选用盐酸,故答案为:盐酸;
③比较实验1、2可知,仅仅是由于电压的不同,阳极上的电极反应分别为:Fe2+-e-=Fe3+和Fe2+-e-=Fe3+、2Cl--2e-=Cl2↑,阴极反应均为:Fe2++2e-=Fe,由实验1、2现象可以得出结论电压小时,只有Fe2+放电,电压大时,Fe2+和Cl-放电;比较实验1,4可知,仅仅是由于溶液的pH值或酸碱性,由实验现象可知,阳极电极反应为:Fe2+-e-=Fe3+,阴极电极反应分别为:Fe2++2e-=Fe,2H++2e-=H2↑和Fe2++2e-=Fe,故由实验1、4现象可以得出结论:pH小时,H+放电、Fe2+几乎不放电,pH大时,Fe2+放电,H+不放电,故答案为:电压小时,只有Fe2+放电,电压大时,Fe2+和Cl-放电;pH小时,H+放电、Fe2+几乎不放电,pH大时,Fe2+放电,H+不放电。
21.(1) 负极 2H2O 4e-=4H++O2↑ 1:2
(2)
(3)500mL容量瓶
(4)与铜离子形成可溶铜配离子,降低溶液中的铜离子浓度,避免过量铜离子与氢氧根形成氢氧化铜沉淀,阻止铜的电解
(5)偏大
(6)溶液显强酸性,酸与硫化钠反应会生成硫化氢污染性气体,污染环境;硫化钠的作用是将生成的氢氧化铜沉淀转化为更难溶的CuS沉淀来除掉铜离子
【分析】用铜片和铂丝为电极,电解硫酸酸化的溶液。测得通过电路的电量为x库仑,电解完成后,得到铜片质量增加了。为减少含重金属电解液的使用,更换电解液,同时更换电极与电源的连接方式,铜作阳极,利用电解铜消耗的质量来测定。
解析:(1)电解硫酸铜溶液,取出铜片,洗净晾干,铜片质量增加了,则铜片应连接电源的负极,铜离子在阴极出得到电子变为铜单质,铂丝尖端产生气泡,气泡为氧气,其电极反应式为2H2O 4e-=4H++O2↑。根据4e-~2Cu~O2,理论上,产生气体与析出铜的物质的量之比为1:2;故答案为:负极;2H2O 4e-=4H++O2↑;1:2。
(2)根据电子转移建立等式,因此本实验测得;故答案为:。
(3)实验①和②中各配制电解液,使用的主要仪器有天平、烧杯、玻璃棒、胶头滴管和500mL容量瓶(需要配制500mL电解液);故答案为:500mL容量瓶。
(4)从平衡移动角度解释在测定的数值中的作用:根据实验①中的灰蓝色成分主要是和(乙二胺四乙酸二钠)能形成可溶含铜配离子信息得到与铜离子形成可溶铜配离子,降低溶液中的铜离子浓度,避免过量铜离子与氢氧根形成氢氧化铜沉淀,阻止铜的电解;故答案为:与铜离子形成可溶铜配离子,降低溶液中的铜离子浓度,避免过量铜离子与氢氧根形成氢氧化铜沉淀,阻止铜的电解。
(5)电解过程中,若观察到铜片上有小气泡产生,说明还有一部分生成氧气,则铜片质量减小量偏低,根据得到的数值偏大;故答案为:偏大。
(6)实验结束后处理电解液:将取出的电解液加入过量硫酸,过滤,得到白色固体和滤液a;直接加入硫化钠,溶液显强酸性,酸与硫化钠反应会生成硫化氢污染性气体,污染环境,而先向滤液a中先加入调,再加入,根据,分析出CuS溶解度更小,将生成的氢氧化铜沉淀转化为更难溶的CuS沉淀来除掉铜离子;故答案为:溶液显强酸性,酸与硫化钠反应会生成硫化氢污染性气体,污染环境;硫化钠的作用是将生成的氢氧化铜沉淀转化为更难溶的CuS沉淀来除掉铜离子。
22.17.5 Zn+Cu2+=Zn2++Cu Zn+2H+=Zn2++H2↑ 生成的Cu覆盖在Zn的表面,Zn与H2SO4的接触面积减小,反应速率减慢
解析:(1)由实验目的为研究硫酸铜的量对氢气生成速率的影响可知,实验时需要控制硫酸铜的量为唯一变量,则每组实验中硫酸的量要相同,溶液的总体积也应该相同;由A组中硫酸溶液体积为30mL可知,其他组中硫酸溶液的体积也都为30mL;由F组实验数据可知,溶液的总体积为50mL;由题给数据可知,V7=(50—30—0)mL=20mL、V9=(50—30—2.5)mL=17.5mL,故答案为:20;17.5;
(2)铜离子的氧化性强于氢离子,在混合溶液中,铜离子会优于氢离子与锌反应,则在D组实验中,锌会先与硫酸铜溶液反应生成铜和硫酸锌,直至硫酸铜消耗完才与稀硫酸反应生成氢气和硫酸锌,反应的离子方程式为Zn+Cu2+=Zn2++Cu、Zn+2H+=Zn2++H2↑,故答案为:Zn+Cu2+=Zn2++Cu;Zn+2H+=Zn2++H2↑;
(3) 铜离子的氧化性强于氢离子,在混合溶液中,铜离子会优于氢离子与锌反应,当加入少量硫酸铜溶液时,反应生成的铜和锌在稀硫酸溶液中构成锌铜原电池,原电池反应使生成氢气的速率大大提高;当加入的硫酸铜溶液超过一定量时,生成的铜会沉积在锌粒表面,阻碍锌粒与稀硫酸反应,导致氢气的生成速率下降,故答案为:生成的Cu覆盖在Zn的表面,Zn与H2SO4的接触面积减小,反应速率减慢
一、选择题
1.化学与生产、生活密切相关。下列说法错误的是
A.冶炼铝是电能转化为化学能的过程
B.水垢中的,可直接加盐酸除去
C.汽车尾气系统中使用催化转化器可减少有害气体的排放
D.盐碱地(含较多的NaCl、)不利于农作物生长,可施加适量石膏降低土壤碱性
2.2022年11月,我国“天舟五号”货运飞船搭载的燃料电池成功完成在轨试验。下列关于氢氧燃料电池的说法不正确的是
A.电池工作时将电能转化为化学能 B.H2在电池的负极放电
C.O2反应中得到电子 D.氢气、氧气可通过电解水产生
3.下列说法中不正确的是
A.硅酸钠水溶液可用作胶粘剂和木材防火剂
B.速滑馆使用CO2制冰,比用氟利昂制冰更环保
C.当镀锡铁制品的镀层破损时,镀层能对铁制品起保护作用
D.化石燃料和植物燃料燃烧时放出的能量最初来源于太阳能
4.室温下,下列实验探究方案能达到探究目的的是
选项 探究方案 探究目的
A 向盛有少量酸性溶液的试管中滴加足量乙醇,充分振荡,观察溶液颜色变化 乙醇具有还原性
B 用铂丝蘸取某溶液进行焰色试验,观察火焰颜色 溶液中存在
C 向盛有3 mL 0.1 mol·L 溶液的试管中滴加2滴0.1 mol·L NaCl溶液,振荡试管,再向试管中滴加2滴0.1 mol·L KI溶液,观察生成沉淀的颜色
D 将中间裹有锌皮的铁钉放在滴有酚酞的饱和NaCl溶液中,一段时间后观察铁钉周围溶液颜色变化 铁钉能发生吸氧腐蚀
A.A B.B C.C D.D
5.我们在课堂上学习和接触过许多有趣的电池,关于下列电池的说法不正确的是
A.苹果中含有苹果酸,图1中铁片是负极
B.图2是“纸电池”,当电解液为氯化钠溶液时,空气中的氧气在铜片表面得电子
C.图3酸性锌锰干电池中锌筒做负极被不断消耗,用久有漏液风险
D.图4电池电子从镁电极流向铝电极
6.“双吸剂”含铁粉、活性炭和氯化钠等,可延长食品保质期。有关叙述正确的是
A.主要发生吸氧腐蚀 B.电能转变为化学能
C.吸收的气体是O2和CO2 D.正极反应为Fe-2e-=Fe2+
7.用可再生能源电还原时,采用高浓度的抑制酸性电解液中的析氢反应来提高多碳产物(乙烯、乙醇等)的生成率,装置如下图所示。下列说法正确的是
A.析氢反应发生在电极上
B.从电极迁移到电极
C.阴极发生的反应有:
D.每转移电子,阳极生成气体(标准状况)
8.NA代表阿伏加德罗常数的值。下列说法正确的是
A.电解精炼铜时,当外电路通过NA个电子时,阳极一定减轻32g
B.2.3g Na被完全氧化为Na2O2,失去电子的数目为0.2NA
C.向1L 0.1mol/LNH4Cl溶液中滴入适量氨水至中性,此时溶液中所含的数目为0.1NA
D.标准状况下,22.4L CCl4中含有的共价键数目为0.4 NA
9.电解饱和食盐水时,阳极生成的气体是
A.H2 B.Cl2 C.HCl D.O2
10.某小组设计如图装置(盐桥中盛有浸泡了KNO3溶液的琼胶)研究电化学原理。下列叙述正确的是
A.银片为负极,发生的反应为:Ag++e-=Ag
B.用稀硫酸代替AgNO3溶液,也可形成原电池
C.进行实验时,琼胶中K+移向Mg(NO3)2溶液
D.取出盐桥,电流表指针依然偏转
11.将电催化转化成燃料和化学品具有重要意义。甲酸可以作为氢载体直接用于甲酸燃料电池。某科学家在常温下用S-In催化剂电催化还原制甲酸的机理如图甲所示,反应历程如图乙所示,其中吸附在催化剂表面的原子用*标注。下列说法错误的是
A.使用S-In催化剂,可以降低反应的活化能
B.在催化剂表面的催化作用下转化为和
C.电催化还原制甲酸的总反应式为
D.电催化还原制备甲酸时,阳极电势比阴极低
12.市场上某种一次性保暖贴是利用金属电化学腐蚀原理制作的,主要成分为铁粉、水、食盐、活性炭、蛭石等,其中,活性炭是电极材料之一,食盐水为电解质溶液。下列有关保暖贴的说法错误的是
A.该保暖贴中铁作负极,发生的电极反应是
B.活性炭作正极,发生的电极反应是
C.该一次性保暖贴放出的热量是氧气与铁粉发生氧化反应时产生的
D.保暖贴使用前要密封保存,使之与空气隔绝
二、非选择题
13.日常生产、生活中用到许多金属制品,从实用美观角度考虑选择下列合适的金属材料或保护(防腐蚀)方法,将序号填入下表相应空格中。
①不锈钢 ②白铁(镀锌铁皮) ③铝合金 ④镀铬铁管 ⑤涂漆 ⑥镶嵌锌块 ⑦与直流电源负极相连(阴极保护法)
用途 选用材料或保护方法
菜刀 _______________
楼梯扶手或阳台护栏 _______________
水桶 _______________
航海轮船 _______________
水闸 _______________
吊车塔架 _______________
房门窗框 _______________
14.某课外活动小组进行电解饱和食盐水的实验(如图)。请回答下列问题。
(1)通电一段时间后,可观察到___________电极(填“阴极”或“阳极”)附近溶液颜色先变红,该电极上的电极反应式为___________。
(2)该溶液电解反应的化学方程式为___________。
(3)若开始时改用铁棒做阳极,阳极的电极反应式为___________。
(4)若用H2和O2为反应物,以KOH为电解质溶液,可构成新型燃料电池(如图),两个电极均由多孔性炭制成,通入的气体由孔隙中逸出,并在电极表面放电。其中a是___极(填“正”或“负”),b极的电极反应式为___________。
15.用氧化还原反应的观点分析判断下列各组微粒的性质,填写下表。
组别 微粒 性质 强弱顺序
第1组 、、、、 ___________ ___________
第2组 Cu、Fe、、、、 ___________ ___________
16.已知化学反应:①AgNO3+NaCl=AgCl↓+NaNO3②FeCl2+Zn=Fe+ZnCl2
(1)上述两个化学反应中有一个不可用于设计原电池,它是_(填序号),理由是__。
(2)另一个可用于设计原电池,若利用该反应设计如图所示的原电池(图中“e”表示 电子)。
该电池 a 极是的电极材料是_______极(正或负),其电极材料是_______,发生的电极反应式是_______,电极 b上发生_______反应(填“氧化”或“还原”)。
17.A、B、C、D、E、F是中学化学中常见的六种短周期元素,有关位置及信息如下:A的气态氢化物能使湿润的红色石蕊试纸变蓝;C单质在实验室一般保存在煤油中;F的最高价氧化物对应水化物既能和酸反应又能和强碱反应,G单质是日常生活中用量最大的金属,易被腐蚀。请回答下列问题:
(1)A元素在周期表中的位置是____________。
(2)A与B可组成质量比为7:16的三原子分子,该分子释放在空气中可能引起的环境问题有:(任写一种)。__________________;
(3)同温同压下,将a L A氢化物的气体和b L D的氢化物气体通入水中,若a=b,则所得溶液的pH__7(填 “>"或“<”或“=”),若使所得溶液pH=7,则a_________b(填“>"或“<”或“=”)。
(4)写出F的单质与NaOH溶液反应的离子方程式:____________________。
(5)已知一定量的E单质能在B2(g)中燃烧,其可能的产物及能量关系如下左图所示:请写出一定条件下EB2(g) 与E(s)反应生成EB(g)的热化学方程式__________________。
(6)若在D与G组成的某种化合物的溶液甲中,加入铜片,溶液会慢慢变为蓝色,依据产生该现象的反应原理,所设计的原电池如上右图所示,其反应中正极反应式为______________。某同学假设正极产物是Fe2+,请你设计实验证明该假设___________________。
18.I.已知K、L、M、P、Q、R是原子序数依次增大的短周期主族元素。K和Q同主族,L是可以形成化合物种类最多的元素,M与K形成的化合物常作制冷剂,P元素原子的最外层电子数是电子层数的3倍,R是地壳中含量最丰富的金属元素。回答下列问题:
(1)L元素在元素周期表中的位置是___________。
(2)Q元素的最高价氧化物对应的水化物与R单质反应的离子方程式为___________;向反应后的溶液中持续滴加稀盐酸,能看到的现象是___________。
(3)K与P形成的原子个数比为1∶1的物质的电子式为___________。
II.氮及其化合物在生产、生活与环境中有着重要的研究和应用价值。
(4)是制碱工业中不可缺少的物质,写出实验室制备的化学反应方程式___________;验证已经集满的方法是___________。
(5)是一种强氧化剂,常与肼组成双组元液体推进剂,用于火箭发射,二者反应生成无毒无污染的物质,则该反应的化学方程式为___________。
(6)一种电解处理含氮废水的方法如图所示,写出阴极的电极反应式___________。
19.2019年是元素周期表诞生150周年,元素周期表在学习、研究和生产实践中有很重要的作用。已知、、、是中学常见的四种元素.原子序数依次增大。的原子最外层电子数是次外层的2倍。的氧化物属于两性氧化物,、位于同周期,、、的原子最外层电子数之和为14,是人体必需的微量元素,缺乏会导致贫血症状。
(1)硒是人体必需的微量元素。人体内产生的活性氧能加速人体衰老,被称为“生命杀手”。化学家尝试用及其他富硒物质清除人体内的活性氧,此时表现出_______性。
(2)下列事实能用元素周期律解释的是_______(填序号)。
a. 的最高价氧化物对应水化物的碱性弱于
b. 的气态氢化物的稳定性小于
c. 的溶液可用于刻蚀铜制的印刷电路板
(3)的单质可用于处理酸性废水中的,使其转换为,同时生成有磁性的的氧化物,再进行后续处理。
①上述反应的离子方程式为_______。
②的单质与在高温下反应的化学方程式为_______。
(4)铅和元素同主族,可发生反应。请写出草酸的电子式:_______。与性质相似,与氢氧化钠溶液反应的离子方程式是_______。
(5)金属镓有“电子工业脊梁”的美誉,它与同主族,其氧化物和氢氧化物均为两性化合物。工业上通常用电解精炼法提纯镓。某待提纯的粗镓内含、、杂质,以水溶液为电解质溶液。在电流作用下使粗镓溶解进入电解质溶液,通过某种离子迁移技术到达阴极,并在阴极放电析出高纯镓。(离子氧化性顺序为:)下列有关电解精炼镓的说法正确的是_______(填序号)。
A.阳极发生氧化反应,其主要电极反应式:
B.电解过程中,阳极质量的减少与阴极质量的增加相等
C.在阴极除了析出高纯度的镓之外,还可能有产生
D.电解后,电解槽底部的阳极泥中只有和
20.可用作净水剂、还原剂等。回答下列问题:
Ⅰ.制备。装置如图所示(夹持装置省略)。已知极易水解。
(1)仪器a的名称是___________。
(2)装置Ⅱ中制备的化学方程式为___________,装置Ⅲ的作用:①吸收尾气;②___________。
(3)该装置存在的缺陷是___________。
Ⅱ.利用惰性电极电解溶液,探究外界条件对电极反应产物的影响。
(4)实验数据如下表所示:
实验编号 电压 阳极现象 阴极现象
1 1.5 5.52 无气泡,滴加显红色 无气泡,银白色金属析出
2 3.0 5.52 少量气泡,滴加显红色 无气泡,银白色金属析出
3 4.5 5.52 大量气泡,滴加显红色 较多气泡,极少量金属析出
4 1.5 无气泡,滴加显红色 较多气泡,极少量金属析出
①实验2、3中阳极产生的气体是___________(填化学式)。
②实验中,调节溶液的宜选用___________(填“盐酸”、“硝酸”或“硫酸”)。
③由实验1、2现象可以得出结论___________;由实验1、4现象可以得出结论___________。
21.阿伏加德罗常数是一座“桥梁”,连接了宏观世界和微观世界的数量关系。通过电解法可测得的数值。
已知:i.1个电子所带电量为库仑。
ii.(乙二胺四乙酸二钠)能形成可溶含铜配离子。
iii.,。
【实验一】用铜片和铂丝为电极,电解硫酸酸化的溶液。测得通过电路的电量为x库仑。电解完成后,取出铜片,洗净晾干,铜片质量增加了。
(1)铜片应连接电源的___________(填“正极”或“负极”)。铂丝尖端产生气泡,其电极反应式为___________。理论上,产生气体与析出铜的物质的量之比为___________。
(2)本实验测得___________(列出计算式)。
【实验二】为减少含重金属电解液的使用,更换电解液,同时更换电极与电源的连接方式。电解完成后,取出铜片,洗净晾干,铜片质量减小。
实验 电解液 实验现象
① 溶液 铜片表面为灰蓝色
② 和混合液 铜片表面仍为红色
(3)实验①和②中各配制电解液,使用的主要仪器有天平、烧杯、玻璃棒、胶头滴管和___________。
(4)经检验,实验①中的灰蓝色成分主要是。从平衡移动角度解释在测定的数值中的作用:___________。
(5)电解过程中,若观察到铜片上有小气泡产生,利用铜片质量减小计算的数值___________(填“偏大”、“偏小”或“不变”)。
(6)实验结束后处理电解液:将取出的电解液加入过量硫酸,过滤,得到白色固体和滤液a;向滤液a中先加入调,再加入,解释不直接加入的原因及的作用:___________。
22.为了研究硫酸铜的量对氢气生成速率的影响,某同学设计了如下一系列的实验:将表中所给的混合溶液分别加入到6个盛有过量Zn粒的容器中,收集产生的气体,记录获得相同体积的气体所需时间。
A B C D E F
4mol/LH2SO4溶液(mL) 30 V1 V2 V3 V4 V5
饱和CuSO4溶液(mL) 0 0.5 2.5 5 V6 20
H2O(mL) V7 V8 V9 V10 10 0
(1)请完成此实验设计,其中V7=______,V9=______。
(2)在D组实验中,按照反应发生的先后顺序写出发生反应的离子方程式:①______、②_____。
(3)该同学最后得出的结论为:当加入少量CuSO4溶液时,生成氢气的速率会大大提高,但当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降。请分析氢气生成速率下降的主要原因:___。
【参考答案】
一、选择题
1.B
解析:A.工业上冶炼金属铝的反应为,电解时,电能转化为化学能,故A正确;
B.不溶于盐酸,可用碳酸钠溶液浸泡后,加稀盐酸洗涤,故B错误;
C.汽车尾气含有NO和CO等有害气体,使用催化转化器可以将有害气体转化为无害气体氮气和二氧化碳,减少有害气体的排放,故C正确;
D.石膏为,可以与反应生成难溶的碳酸钙和硫酸钠,降低土壤的碱性,故D正确;
故选B。
2.A
【分析】氢氧燃料电池中氢气失去电子,在负极发生反应,氧气得到电子,在正极发生反应。
解析:A.电池是将化学能转化为电能,故A错误;
B.根据分析可知,H2失电子,在电池的负极放电,故B正确;
C.O2反应中得到电子,故C正确;
D.电解水发生反应2H2O2H2↑+O2↑,故D正确;
故选A。
3.C
解析:A.硅酸钠(Na2SiO3)的水溶液俗称“水玻璃”,是建筑行业经常使用的一种黏胶剂,也称为泡花碱,可用作肥皂填料,硅酸钠也可作木材和纺织品的防火剂,A正确;
B.二氧化碳跨临界制冰技术,与传统制冷剂氟利昂相比更加环保,减少了氟利昂对臭氧层的破坏作用,B正确;
C.锡的金属性大于铁的金属,当镀锡铁制品的镀层破损时,铁会先腐蚀,故镀层不能对铁制品起保护作用,C不正确;
D.植物在光合作用中的物质转化和能量转化,植物的光合作用是将光能(太阳能)转化为化学能,将无机物转化为有机物,D正确;
故选C。
4.A
解析:A.酸性溶液的试管中滴加足量乙醇,若溶液褪色说明被还原为无色离子,则乙醇表现还原性,否则则无还原性,故A正确;
B.焰色试验只能确定金属元素是否存在,不能确定具体物质,故B错误;
C.所用硝酸银溶液过量,滴入的碘化钾直接与硝酸银反应生成AgI沉淀,不能说明是AgCl转化为AgI,因此不能验证Ksp大小,故C错误;
D.锌比铁活泼,形成原电池时Zn作负极,Fe作正极,铁钉不被腐蚀,故D错误;
故选:A。
5.D
解析:A.苹果中含有苹果酸,苹果酸属于电解质,Fe、Cu两种金属性不同的金属,铁比铜活泼,图1构成原电池,铁作负极,故A说法正确;
B.铁比铜活泼,当电解液为氯化钠溶液时,发生吸氧腐蚀,铁作负极,铜作正极,氧气在铜片表面得电子,故B说法正确;
C.锌为活泼金属,锌锰干电池中锌作负极,锌发生氧化反应,被消耗,锌铜会变薄,有漏液风险,故C说法正确;
D.Mg虽然比Al活泼,但Mg不与氢氧化钠溶液反应,而Al能与氢氧化钠溶液发生氧化还原反应,则Al作负极,Mg作正极,根据原电池工作原理,电子从Al经外电路流向Mg电极,故D说法错误;
答案为D。
6.A
解析:A.铁为金属,活泼性大于碳,氯化钠为电解质,潮湿环境中形成原电池,为中性环境,发生铁的吸氧腐蚀,A正确;
B.形成原电池,将化学能转化为电能,B错误;
C.该过程发生铁的吸氧腐蚀,正极上氧气得电子和水反应生成氢氧根离子,吸收的气体是O2和水,C错误;
D.Fe-2e-=Fe2+为负极反应,正极反应是O2+4e-+2H2O=4OH-,D错误;
综上所述答案为A。
7.C
【分析】由图可知,该装置为电解池,与直流电源正极相连的IrOx-Ti电极为电解池的阳极,水在阳极失去电子发生氧化反应生成氧气和氢离子,电极反应式为2H2O-4e—=O2↑+4H+,铜电极为阴极,酸性条件下二氧化碳在阴极得到电子发生还原反应生成乙烯、乙醇等,电极反应式为2CO2+12H++12e =C2H4+4H2O、2CO2+12H++12e =C2H5OH+3H2O,电解池工作时,氢离子通过质子交换膜由阳极室进入阴极室。
解析:A.析氢反应为还原反应,应在阴极发生,即在铜电极上发生,故A错误;
B.离子交换膜为质子交换膜,只允许氢离子通过,Cl-不能通过,故B错误;
C.由分析可知,铜电极为阴极,酸性条件下二氧化碳在阴极得到电子发生还原反应生成乙烯、乙醇等,电极反应式有2CO2+12H++12e =C2H4+4H2O,故C正确;
D.水在阳极失去电子发生氧化反应生成氧气和氢离子,电极反应式为2H2O-4e—=O2↑+4H+,每转移1mol电子,生成0.25molO2,在标况下体积为5.6L,故D错误;
答案选C。
8.C
解析:A.电解精炼铜时,当外电路通过NA个电子时,由于阳极含锌、铁等杂质也会失去电子,因此阳极减轻的质量无法计算,故A错误;
B.2.3g Na(物质的量为0.1mol)被完全氧化为Na2O2,因此失去电子的数目为0.1NA,故B错误;
C.向1L 0.1 mol L 1NH4Cl溶液中滴入适量氨水至中性,根据电荷守恒,铵根离子浓度氯离子浓度,因此铵根离子浓度为0.1 mol L 1,则此时溶液中所含的数目为0.1NA,故C正确;
D.标准状况下,CCl4是非气态物质,无法利用所给条件计算其内部共价键数目,故D错误。
综上所述,答案为C。
9.B
解析:电解饱和食盐水时,阳极氯离子放电生成氯气,阴极氢离子放电生成氢气;
故选B。
10.B
解析:A.该装置为MgAg原电池,镁的活泼性大于银,镁作负极,失电子形成镁离子,故A错误;
B.若把硝酸银换成稀硫酸,H+同样在银电极处得到电子析出氢气,可以构成原电池,故B正确;
C.MgAg原电池,镁的活泼性大于银,镁作负极、银为正极,原电池中阳离子移向正极,所以盐桥中的阳离子往右侧硝酸银溶液迁移,故C错误;
D.取出盐桥,由于无法构成闭合回路,不能形成原电池,所以电流表不发生偏转,D错误;
选B。
11.D
解析:A.催化剂的催化原理是降低反应的活化能,提高反应速率,故A正确;
B.根据图甲可知,催化剂活性位点在催化过程中的作用是活化水分子,将转化为和,故B正确;
C.结合图乙反应历程图的起始物质和最终物质,可以得出电催化二氧化碳转化为甲酸的总反应式为,故C正确;
D.电解池中,阳极与电源正极相连,阴极与电源负极相连,电源正极电势高于负极,所以电解池的阳极电势高于阴极,故D错误;
故答案选D。
【点睛】本题主要考查催化机理分析、根据催化机理图能判断微粒的转化及作用、根据反应历程图书写转化反应、综合应用信息书写总的反应方程式、判断电解池中阳极、阴极电势高低,注意对题干中信息的提取和应用。
12.C
解析:A.该保暖贴中,发生的是铁的吸氧腐蚀,铁作负极,电极反应是,A项正确;
B.活性炭作正极,氧气得电子,发生还原反应,电极反应为,B项正确;
C.铁粉与氧气通过无数个微小的电池发生氧化还原反应,放出大量的热,C项错误;
D.铁粉、活性炭、水、食盐等可以构成一个原电池,发生的是铁的吸氧腐蚀,要延长其保质期,应在使用前隔绝空气,密封保存,D项正确;
答案选C。
二、非选择题
13. ① ④ ② ⑥ ⑦ ⑤ ③
解析:(1)菜刀接触潮湿较多,且要求机械强度大,清洁卫生等,故选不锈钢;选①;
(2)楼梯扶手、护栏等要求安全美观,经济实惠,故选镀铬铁管;选④
(3)水桶处于潮湿环境,且摩擦碰撞较多,故选镀锌铁皮;选②
(4)航海轮船则采用镶嵌锌块法保护,效果良好,故选镶嵌锌块;选⑥
(5)水闸位置固定宜采用外加电流的阴极保护法,故选与直流电源负极相连(阴极保护法);选⑦
(6)吊车塔架只求坚固防锈且经济,故涂漆保护就可以了,故选涂漆;选⑤
(7)门窗框要轻便美观,故选用铝合金材料。选③
14. 阴极 2H++2e-=H2↑ 2NaCl+2H2OCl2↑+H2↑+2NaOH Fe-2e-═Fe2+ 负 O2+2H2O+4e-→4OH-
解析:(1)阴极氢离子放电产生氢氧根离子使附近溶液颜色先变红,电极反应方程式为:2H++2e-=H2↑,故答案为阴极;2H++2e-=H2↑;
(2)阳极是还原性强的氯离子放电生成氯气,阴极是氢离子放电生成氢气,所以电解反应的化学方程式为2NaCl+2H2OCl2↑+H2↑+2NaOH;
(3)金属作阳极,阳极是活泼金属铁本身放电,电极反应方程式为:Fe-2e-═Fe2+;
(4)通氢气的一极发生氧化反应是负极;b极氧气发生还原反应是正极,故答案为负;O2+2H2O+4e-═4OH-。
15. 氧化性 还原性
解析:略
16. ① ①为非氧化还原反应,没有电子转移 负 Zn Zn-2e-=Zn2+ 还原
解析:(1)原电池是基于氧化还原反应的原理,上述反应中①没有价态变化,是非氧化还原反应,②有价态变化属于氧化还原反应,故①可设计成原电池,故答案为:①;①为非氧化还原反应,没有电子转移;
(2)FeCl2+Zn=Fe+ZnCl2用于设计原电池,Zn失电子作负极,FeCl2得电子在正极发生反应,由图电子由a流向b,则a为负极发生氧化反应,b为正极,发生还原反应,a极上发生的反应为:Zn-2e-=Zn2+,故答案为:负;Zn;Zn-2e-=Zn2+;还原;
17. 第二周期第VA族 酸雨(或光化学烟雾) < > 2Al + 2OH- + 2H2O=2AlO2- + 3H2↑ CO2(g) + C(s)=2CO(g) △H=+172.5kJ/mol或1/2CO2(g) + 1/2 C(s)= CO(g) △H=+86.25kJ/mol Fe3++ e-=Fe2+ 滴加酸性高锰酸钾溶液(或铁氰化钾溶液),若溶液紫色褪去(或产生蓝色沉淀),则产品中含有Fe2+
解析:A的气态氢化物能使湿润的红色石蕊试纸变蓝,则A是N元素;C单质在实验室一般保存在煤油中,所以C是Na元素;F的最高价氧化物对应的水化物既能与酸反应又能与碱反应,F是Al元素,G单质是日常生活中用量最大的金属,易被腐蚀,则G是Fe元素。其余E是C元素,B是O元素,D是Cl元素。
(1)N元素在周期表中的位置是第二周期第VA族;
(2)N与O可组成质量比为7:16的三原子分子,该分子的化学式是NO2,该分子释放在空气中可能引起的酸雨问题;
(3)a L A氢化物的气体和b L D的氢化物气体通入水中,若a=b,则二者恰好反应生成氯化铵,溶液呈酸性,pH<7。如果使溶液的pH=7,呈中性,所以氨气稍过量,a>b;
(4)Al与氢氧化钠溶液反应生成偏铝酸钠和氢气,离子方程式为2Al+2OH—+2H2O=2AlO2—+3H2↑;
(5)由图可知,1mol C(s)与氧气反应生成1molCO气体放出的热量是393.5kJ-283kJ=110.5kJ,1mol C(s)与氧气完全燃烧生成二氧化碳气体放出393.5kJ的热量,根据盖斯定律,所以EB2(g) 与E(s)反应生成EB(g)的热化学方程式为CO2(g) +C(s)=2CO(g) △H=(-110.5kJ/mol)×2-(-393.5kJ/mol)=+172.5kJ/mol;
(6)Cu与氯化铁溶液反应生成氯化亚铁和氯化铜,溶液逐渐变为蓝色,Cu作负极,发生氧化反应,则正极反应是铁离子得电子生成亚铁离子,电极反应式为Fe3++e-= Fe2+。亚铁离子具有还原性,所以检验亚铁离子的实验方法是滴加酸性高锰酸钾溶液(或铁氰化钾溶液),若溶液紫色褪去(或产生蓝色沉淀),则产品中含有Fe2+。
18.(1)第二周期第IVA族
(2) (或) 先有白色沉淀产生,然后沉淀逐渐溶解消失
(3)
(4) (或) 用湿润的红色石蕊试纸置于试管口,试纸变蓝色或将蘸有浓盐酸的玻璃棒置于试管口,现象是有白烟产生
(5)
(6)
解析:L是可以形成化合物种类最多的元素,则L是C元素,M与K形成的化合物常作制冷剂,则M为N元素,K为H元素,K和Q同主族,则Q为Na元素,P元素原子的最外层电子数是电子层数的3倍,则P为O元素,R是地壳中含量最丰富的金属元素,则R为Al元素。
(1)C元素的原子序数为6,在元素周期表中的位置是第二周期第IVA族。
(2)Na的最高价氧化物对应的水化物是NaOH,与Al反应的离子方程式为(或),向反应后的溶液中持续滴加稀盐酸,先生成Al(OH)3,然后Al(OH)3逐渐溶解为,故能看到的现象是先有白色沉淀产生,然后沉淀逐渐溶解消失。
(3)H与O形成的原子个数比为1∶1的物质是,其电子式为。
(4)实验室制备的反应方程式为(或),验证已经集满常用的方法是用湿润的红色石蕊试纸置于试管口,试纸变蓝色或将蘸有浓盐酸的玻璃棒置于试管口,现象是有白烟产生。
(5)生成的无毒无污染的物质为氮气,因为是双组元液体推进剂,所以产物N2要写气体符号,依据氧化还原原理,配平方程式为。
(6)根据图中所示信息,阴极反应是转化为N2,电极反应式为。
19.(1)还原性
(2)ab
(3)
(4)
(5)CD
解析:A的原子最外层电子数是次外层的2倍,则A为碳元素,D的氧化物属于两性氧化物,则D为铝元素,A、D、E的原子最外层电子数之和为14,则E的最外层电子数=14-4-3=7,D、E位于同周期,则E为氯元素,W是人体必需的微量元素,缺乏W会导致贫血症状,则W为铁元素。
(1)清除人体内的活性氧需要还原剂,所以此时表现出还原性;
(2)a.同周期从左到右元素金属性依次减弱,铝在镁的右边,金属性弱于镁,所以Al的最高价氧化物对应水化物氢氧化铝的碱性弱于Mg(OH)2,故A符合题意;
b.同主族元素从上至下非金属性逐渐减弱,元素的非金属性越强,气态氢化物越稳定,则氯的气态氢化物(HCl)的稳定性小于HF,故B符合题意;
c.氯化铁溶液与铜发生氧化还原反应生成氯化亚铁和氯化铜,不能说明金属性的强弱,不能用元素周期律解释,故C不合题意;
故选ab;
(3)Fe可用于处理酸性废水中的,使其转换为,同时生成有磁性的铁的氧化物X(Fe3O4)。
①上述反应中氮元素的化合价由+5价降低至-3价,铁元素的化合价由0价升高至价(平均化合价),由化合价升降守恒、电荷守恒和质量守恒可配平离子方程式;
②Al与Fe3O4在高温下发生铝热反应生成Al2O3和Fe,化学方程式为;
(4)草酸的结构式为HOOC-COOH,所以电子式为,PbO与碱反应类似Al2O3,所以离子方程式为:,
(5)A.由离子氧化性可知,金属活动性Zn >Ga> Fe,阳极发生氧化反应,其主要电极反应除外,还有锌失电子,故A错误;
B.电解过程中,阳极有Zn、Ga失电子,而阴极只析出Ga ,则阳极质量的减少与阴极质量的增加不相等,故B错误;
C.在阴极除了析出高纯度的家之外,还可能有H+放电有H2产生,故C正确;
D.由于Fe、Cu的活动性比Ga差,则电解后,电解槽底部的阳极泥中只有Cu和Fe,故D正确;
故选CD。
20.(1)长颈漏斗
(2) 2FeCl3+H22FeCl2+2HCl 防止空气中的水蒸气进入装置II中,引起FeCl3水解
(3)装置I和装置II之间缺少一个干燥H2的装置
(4) Cl2 盐酸 电压小时,只有Fe2+放电,电压大时,Fe2+和Cl-放电 pH小时,H+放电、Fe2+几乎不放电,pH大时,Fe2+放电,H+不放电
【分析】实验I中装置I为H2的发生装置,反应原理为:Fe+H2SO4(稀)=FeSO4+H2↑,装置II中为H2还原FeCl3制备FeCl2的装置,反应原理为:2FeCl3+H22FeCl2+2HCl,由于装置II中产生了HCl,故装置III为吸收HCl,同时可以防止空气中的水蒸气进入装置II,引起FeCl3和FeCl2水解,实验II中通过实验现象:阳极区加入KSCN溶液显红色,说明阳极区有Fe3+生成,阳极区产生气泡说明产生了Cl2,阴极区上有银白色金属析出,说明有Fe单质生成,阴极区产生气泡,说明有H2生成,对照各组实验条件的不同进行解题,据此分析解题。
解析:(1)由题干实验装置图可知,仪器a的名称是长颈漏斗,故答案为:长颈漏斗;
(2)装置Ⅱ中制备即FeCl3与H2反应制备FeCl2,故其反应的化学方程式为2FeCl3+H22FeCl2+2HCl,由题干信息可知,极易水解,FeCl2也会水解,则装置Ⅲ的作用:①吸收尾气;②防止空气中的水蒸气进入装置II中,引起FeCl3水解,故答案为:2FeCl3+H22FeCl2+2HCl;防止空气中的水蒸气进入装置II中,引起FeCl3水解;
(3)由题干信息可知,极易水解,则该装置存在的缺陷是装置I和装置II之间缺少一个干燥H2的装置,可以用装有浓硫酸的洗气瓶进行干燥H2,故答案为:装置I和装置II之间缺少一个干燥H2的装置;
(4)①电解池中阳极发生氧化反应,根据实验现象可知,实验2、3中阳极电极反应为:Fe2+-e-=Fe3+、2Cl--2e-=Cl2↑,故产生的气体是Cl2,故答案为:Cl2;
②HNO3具有强氧化性,能将Fe2+氧化为Fe3+,并引入杂质,H2SO4会引入新的杂质,则实验中,调节溶液的宜选用盐酸,故答案为:盐酸;
③比较实验1、2可知,仅仅是由于电压的不同,阳极上的电极反应分别为:Fe2+-e-=Fe3+和Fe2+-e-=Fe3+、2Cl--2e-=Cl2↑,阴极反应均为:Fe2++2e-=Fe,由实验1、2现象可以得出结论电压小时,只有Fe2+放电,电压大时,Fe2+和Cl-放电;比较实验1,4可知,仅仅是由于溶液的pH值或酸碱性,由实验现象可知,阳极电极反应为:Fe2+-e-=Fe3+,阴极电极反应分别为:Fe2++2e-=Fe,2H++2e-=H2↑和Fe2++2e-=Fe,故由实验1、4现象可以得出结论:pH小时,H+放电、Fe2+几乎不放电,pH大时,Fe2+放电,H+不放电,故答案为:电压小时,只有Fe2+放电,电压大时,Fe2+和Cl-放电;pH小时,H+放电、Fe2+几乎不放电,pH大时,Fe2+放电,H+不放电。
21.(1) 负极 2H2O 4e-=4H++O2↑ 1:2
(2)
(3)500mL容量瓶
(4)与铜离子形成可溶铜配离子,降低溶液中的铜离子浓度,避免过量铜离子与氢氧根形成氢氧化铜沉淀,阻止铜的电解
(5)偏大
(6)溶液显强酸性,酸与硫化钠反应会生成硫化氢污染性气体,污染环境;硫化钠的作用是将生成的氢氧化铜沉淀转化为更难溶的CuS沉淀来除掉铜离子
【分析】用铜片和铂丝为电极,电解硫酸酸化的溶液。测得通过电路的电量为x库仑,电解完成后,得到铜片质量增加了。为减少含重金属电解液的使用,更换电解液,同时更换电极与电源的连接方式,铜作阳极,利用电解铜消耗的质量来测定。
解析:(1)电解硫酸铜溶液,取出铜片,洗净晾干,铜片质量增加了,则铜片应连接电源的负极,铜离子在阴极出得到电子变为铜单质,铂丝尖端产生气泡,气泡为氧气,其电极反应式为2H2O 4e-=4H++O2↑。根据4e-~2Cu~O2,理论上,产生气体与析出铜的物质的量之比为1:2;故答案为:负极;2H2O 4e-=4H++O2↑;1:2。
(2)根据电子转移建立等式,因此本实验测得;故答案为:。
(3)实验①和②中各配制电解液,使用的主要仪器有天平、烧杯、玻璃棒、胶头滴管和500mL容量瓶(需要配制500mL电解液);故答案为:500mL容量瓶。
(4)从平衡移动角度解释在测定的数值中的作用:根据实验①中的灰蓝色成分主要是和(乙二胺四乙酸二钠)能形成可溶含铜配离子信息得到与铜离子形成可溶铜配离子,降低溶液中的铜离子浓度,避免过量铜离子与氢氧根形成氢氧化铜沉淀,阻止铜的电解;故答案为:与铜离子形成可溶铜配离子,降低溶液中的铜离子浓度,避免过量铜离子与氢氧根形成氢氧化铜沉淀,阻止铜的电解。
(5)电解过程中,若观察到铜片上有小气泡产生,说明还有一部分生成氧气,则铜片质量减小量偏低,根据得到的数值偏大;故答案为:偏大。
(6)实验结束后处理电解液:将取出的电解液加入过量硫酸,过滤,得到白色固体和滤液a;直接加入硫化钠,溶液显强酸性,酸与硫化钠反应会生成硫化氢污染性气体,污染环境,而先向滤液a中先加入调,再加入,根据,分析出CuS溶解度更小,将生成的氢氧化铜沉淀转化为更难溶的CuS沉淀来除掉铜离子;故答案为:溶液显强酸性,酸与硫化钠反应会生成硫化氢污染性气体,污染环境;硫化钠的作用是将生成的氢氧化铜沉淀转化为更难溶的CuS沉淀来除掉铜离子。
22.17.5 Zn+Cu2+=Zn2++Cu Zn+2H+=Zn2++H2↑ 生成的Cu覆盖在Zn的表面,Zn与H2SO4的接触面积减小,反应速率减慢
解析:(1)由实验目的为研究硫酸铜的量对氢气生成速率的影响可知,实验时需要控制硫酸铜的量为唯一变量,则每组实验中硫酸的量要相同,溶液的总体积也应该相同;由A组中硫酸溶液体积为30mL可知,其他组中硫酸溶液的体积也都为30mL;由F组实验数据可知,溶液的总体积为50mL;由题给数据可知,V7=(50—30—0)mL=20mL、V9=(50—30—2.5)mL=17.5mL,故答案为:20;17.5;
(2)铜离子的氧化性强于氢离子,在混合溶液中,铜离子会优于氢离子与锌反应,则在D组实验中,锌会先与硫酸铜溶液反应生成铜和硫酸锌,直至硫酸铜消耗完才与稀硫酸反应生成氢气和硫酸锌,反应的离子方程式为Zn+Cu2+=Zn2++Cu、Zn+2H+=Zn2++H2↑,故答案为:Zn+Cu2+=Zn2++Cu;Zn+2H+=Zn2++H2↑;
(3) 铜离子的氧化性强于氢离子,在混合溶液中,铜离子会优于氢离子与锌反应,当加入少量硫酸铜溶液时,反应生成的铜和锌在稀硫酸溶液中构成锌铜原电池,原电池反应使生成氢气的速率大大提高;当加入的硫酸铜溶液超过一定量时,生成的铜会沉积在锌粒表面,阻碍锌粒与稀硫酸反应,导致氢气的生成速率下降,故答案为:生成的Cu覆盖在Zn的表面,Zn与H2SO4的接触面积减小,反应速率减慢
