河南省濮阳市名校2023-2024学年高三上学期期中质量检测化学试题(含答案)
文档属性
| 名称 | 河南省濮阳市名校2023-2024学年高三上学期期中质量检测化学试题(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 722.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-17 00:27:45 | ||
图片预览



文档简介
濮阳市名校2023-2024学年高三上学期期中质量检测
化学试题
注意事项:
1.本试卷共10页,满分100分,考试时间90分钟。
2.试题卷上不要答题,请用0.5毫米黑色签字笔直接把答案写在答题卡上对应的答题区域内。答在试题卷上的答案无效。
可能用到的相对原子质量:H-1、C-12、N-14、O-16、Na-23、Fe-56、Ag-108
第Ⅰ卷(共48分)
一、选择题(每小题3分,共48分。每小题只有一个选项符合题意。)
1.化学与人们的生活、生产密切相关。下列有关叙述正确的是( )
A.“沙里淘金”、“丹炉炼丹”过程均涉及物理变化和化学变化
B.中国天眼FAST用到的碳化硅是一种新型无机非金属材料
C.漂白粉、酒精、双氧水杀菌消毒均利用其氧化性
D.光伏发电的核心材料是,光导纤维的成分是单质Si
2.下列有关化学用语的使用正确的是( )
A.反-2-丁烯的结构简式:
B.的电子式:
C.次氯酸的结构式:
D.基态铜原子的价层电子轨道表示式:
3.设表示阿伏加德罗常数的值。下列叙述正确的是( )
A.与光照条件下充分反应,当消耗16 g 时,生成氯代烃的分子数目为
B.常温下,28 g Fe投入足量浓中可得到的分子数为
C.标准状况下,2.24 L 溶于水形成的溶液中
D.含0.1 mol 的溶液经反应后,完全转化为胶体,所得胶体中含胶粒数为
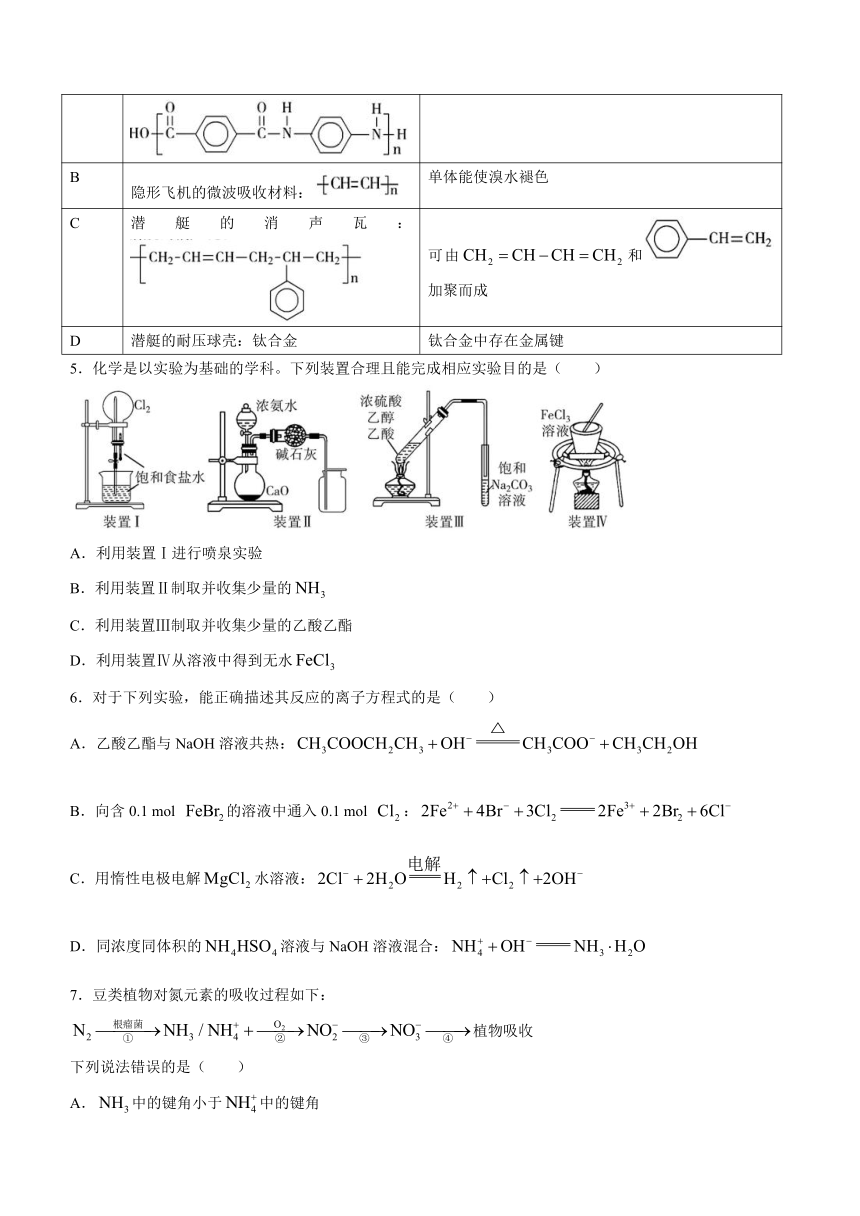
4.化学在国防领域发挥着重要作用。关于下列装备涉及材料的描述错误的是( )
选项 装备涉及材料 描述
A 防弹衣的主要材料: 两种单体的核磁共振氢谱峰数、峰面积之比均相同
B 隐形飞机的微波吸收材料: 单体能使溴水褪色
C 潜艇的消声瓦: 可由和加聚而成
D 潜艇的耐压球壳:钛合金 钛合金中存在金属键
5.化学是以实验为基础的学科。下列装置合理且能完成相应实验目的是( )
A.利用装置Ⅰ进行喷泉实验
B.利用装置Ⅱ制取并收集少量的
C.利用装置Ⅲ制取并收集少量的乙酸乙酯
D.利用装置Ⅳ从溶液中得到无水
6.对于下列实验,能正确描述其反应的离子方程式的是( )
A.乙酸乙酯与NaOH溶液共热:
B.向含0.1 mol 的溶液中通入0.1 mol :
C.用惰性电极电解水溶液:
D.同浓度同体积的溶液与NaOH溶液混合:
7.豆类植物对氮元素的吸收过程如下:
植物吸收
下列说法错误的是( )
A.中的键角小于中的键角
B.、中N的杂化方式不同
C.因P的原子半径大于N,故P原子间难形成p-pπ键
D.当有9.2 g 生成时,过程②转移的电子为1.2 mol
8.是一种重要的化工原料,其有关制备途径及性质如图所示。
下列说法错误的是( )
A.Y可以是甲酸乙酯
B.制取等量的,途径①消耗的是途径②的2倍
C.“混合气体”中一定含有
D.在①~⑤中,Cu元素被氧化的反应有3个
9.下列实验操作中,对应的实验现象和实验结论都正确,且两者具有因果关系的是( )
选项 实验操作 实验现象 实验结论
A 向NaBr溶液中加入少量的氯水和适量苯,振荡、静置 溶液上层呈橙红色 还原性强于
B 将少量铜粉加入1.0 mol·L 溶液中 固体溶解,溶液变蓝色 金属铁比铜活泼
C 将稀硝酸加入过量铁粉中,充分反应后滴加KSCN溶液 有气体生成,溶液呈血红色 稀硝酸将Fe氧化为
D 向淀粉的酸性水解液中滴入少量新制悬浊液并加热 有砖红色沉淀生成 葡萄糖具有还原性
10.物质M(结构如下图)常作为锂离子电池、锂离子电容器等的非水电解液添加剂。X、Y、Z、W为原子序数依次增大的短周期主族元素,基态W原子中有3个未成对电子。
下列说法正确的是( )
A.电负性:W>Z B.最简单氢化物的沸点:Y>X
C.最高价含氧酸的酸性:X>W D.第一电离能:X>Y
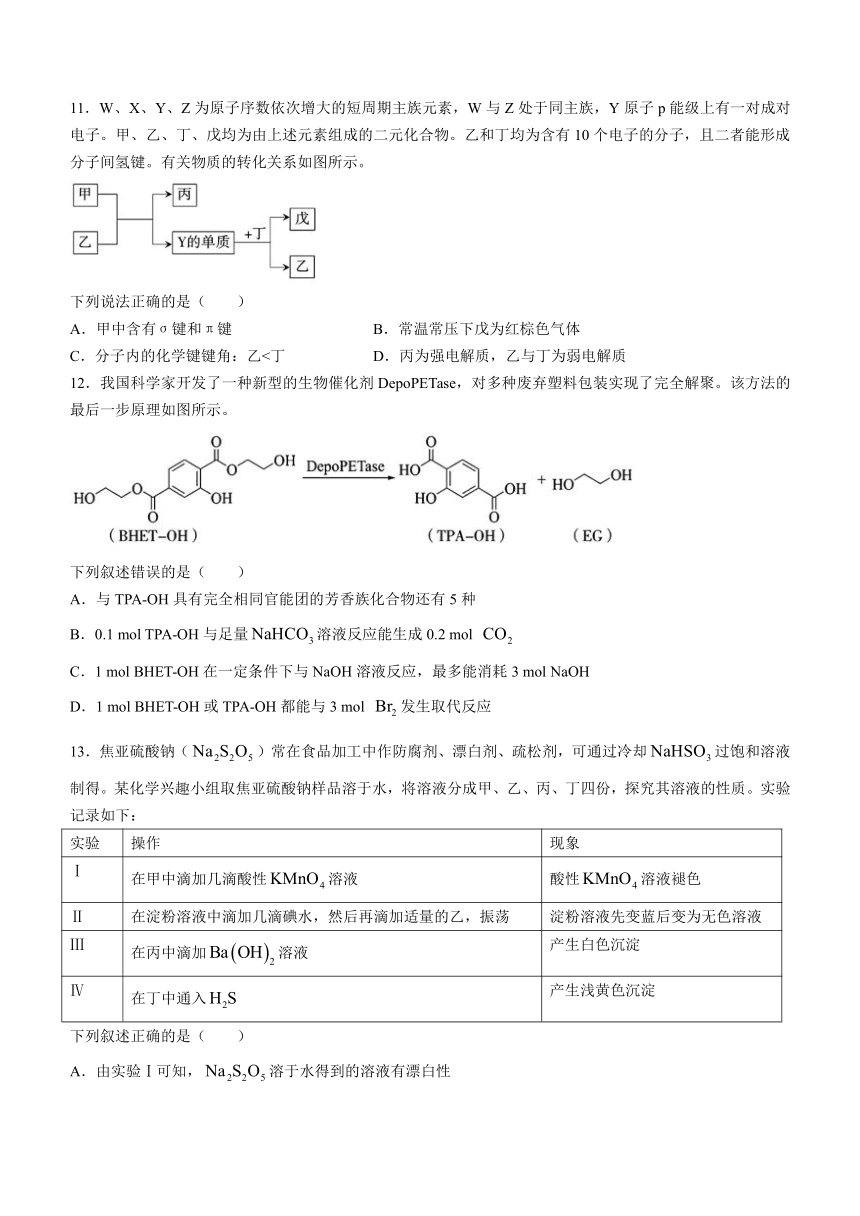
11.W、X、Y、Z为原子序数依次增大的短周期主族元素,W与Z处于同主族,Y原子p能级上有一对成对电子。甲、乙、丁、戊均为由上述元素组成的二元化合物。乙和丁均为含有10个电子的分子,且二者能形成分子间氢键。有关物质的转化关系如图所示。
下列说法正确的是( )
A.甲中含有σ键和π键 B.常温常压下戊为红棕色气体
C.分子内的化学键键角:乙<丁 D.丙为强电解质,乙与丁为弱电解质
12.我国科学家开发了一种新型的生物催化剂DepoPETase,对多种废弃塑料包装实现了完全解聚。该方法的最后一步原理如图所示。
下列叙述错误的是( )
A.与TPA-OH具有完全相同官能团的芳香族化合物还有5种
B.0.1 mol TPA-OH与足量溶液反应能生成0.2 mol
C.1 mol BHET-OH在一定条件下与NaOH溶液反应,最多能消耗3 mol NaOH
D.1 mol BHET-OH或TPA-OH都能与3 mol 发生取代反应
13.焦亚硫酸钠()常在食品加工中作防腐剂、漂白剂、疏松剂,可通过冷却过饱和溶液制得。某化学兴趣小组取焦亚硫酸钠样品溶于水,将溶液分成甲、乙、丙、丁四份,探究其溶液的性质。实验记录如下:
实验 操作 现象
Ⅰ 在甲中滴加几滴酸性溶液 酸性溶液褪色
Ⅱ 在淀粉溶液中滴加几滴碘水,然后再滴加适量的乙,振荡 淀粉溶液先变蓝后变为无色溶液
Ⅲ 在丙中滴加溶液 产生白色沉淀
Ⅳ 在丁中通入 产生浅黄色沉淀
下列叙述正确的是( )
A.由实验Ⅰ可知,溶于水得到的溶液有漂白性
B.由实验Ⅱ可知,溶于水得到的溶液能使溴水褪色
C.取实验Ⅲ中的白色沉淀加入过量稀硝酸,若沉淀不溶解,则白色沉淀为
D.由实验Ⅳ可知,溶于水得到的溶液有还原性
14.利用间接成对电化学法,以间硝基甲苯为原料合成间氨基苯甲酸的工作原理如下图。
下列说法错误的是( )
A.物质X为间硝基苯甲酸
B.间硝基甲苯与间氨基苯甲酸互为同分异构体
C.N电极上的电极反应为
D.当电路中转移6 mol 时,理论上可得到1 mol间氨基苯甲酸
15.某透明溶液X可能含有、、、、、、、、、中若干种,且各离子浓度相同。为确定其组成,依次进行下列实验。
①取少量溶液X,向其中加入足量的氢氧化钠溶液,有红褐色沉淀A产生;微热,闻到刺激性气味。
②过滤①中的混合物,在滤液中加入足量的氢氧化钡溶液,有白色沉淀B产生,再加入足量的稀硝酸,沉淀不溶解。
根据上述实验,下列说法正确的是( )
A.溶液X中一定含有N、、,可能含有
B.溶液X中是否含有、需要通过焰色试验确定
C.红褐色沉淀A和白色沉淀B都是纯净物
D.无法确定溶液中是否含有和
16.硒化锌是一种重要的半导体材料,其晶胞结构如图甲所示。已知晶胞参数为q nm,乙图为晶胞的俯视图,a点的原子分数坐标为。
下列说法正确的是( )
A.晶胞中硒原子的配位数为12
B.晶胞中d点的原子分数坐标为
C.相邻两个Zn原子的最短距离为nm
D.Zn和Se在元素周期表中分别位于d区与p区
第Ⅱ卷(共52分)
二、非选择题(本题包括4小题,除标注外,每空2分,共52分)
17.(14分)某化学兴趣小组在实验室研究从医用废感光胶片中回收银的方法。
已知:ⅰ.溶液与溶液直接混合能发生氧化还原反应;
ⅱ.;Ag1能溶于溶液;
ⅲ.可看作是中的一个O原子被S原子取代的产物。
(1)银的浸出
Ⅰ.两步法:
①溶液将胶片上的单质银转化为AgCl,其离子方程式为____________。
②在中,做配位原子的是中的______(填“中心”或“端基”)S原子。
Ⅱ.一步法:用水溶解和乙二胺四乙酸二钠(用表示)的混合固体,调节pH形成溶液,再加入一定量,配成浸取液。将废感光胶片浸入浸取液中,发生反应:
。
③从物质氧化性或还原性的角度分析加入的作用为____________。
(2)银的还原
调节(1)所得浸出液的pH,向其中加入溶液(已知电负性:B补全离子方程式:BH______4^-+∏[Ag(S______2O______3)]^(-3)+〖┬ 〗=[B(0H)4]^-+〖┬ 〗+〖┬ 〗+。
(3)银浸出率的测定
称取mg洗净干燥的原胶片,灼烧灰化后用足量稀溶解,过滤。滤液用c mol L 标准溶液滴定至终点,消耗标准溶液 mL。另取洗净干燥的浸取后胶片,用同样方法处理,滴定,消耗标准溶液 mL。
已知:ⅰ.
ⅱ.银的浸出率。
①银溶于稀的化学方程式为______。
②银的浸出率为______(用含、、、的代数式表示,须化简)。
(4)实验发现在浸取试剂均过量、浸取时间足够长的情况下,与Ⅱ相比,Ⅰ中银的浸出率明显偏低,其原因可能是____________。
18.(10分)实验室要用通过两步反应制备,装置如下图(加热装置与尾气处理装置略去)。
有关数据列表如下:
乙醚
状态 无色液体 无色液体 无色液体
密度/g·cm 0.79 2.2 0.71
沸点/℃ 78.5 132 34.6
熔点/℃ -130 9 -116
回答下列问题:
(1)装置A用来制取乙烯,给装置A进行加热时最好选用______(填“水浴”、“油浴”)加热。
(2)装置A中发生的主要化学方程式为____________。
(3)在此制备实验中,要尽可能迅速地把反应温度提高到指定温度,其最主要目的是______(填字母序号)。
A.引发反应 B.加快反应速度 C.防止乙醇挥发 D.减少副产物乙醚生成
(4)判断该制备反应已经结束的最简单方法是____________。
(5)将粗产品置于分液漏斗中加水,振荡后静置,进行分液,产物应从______(填“上口倒出”、“下口放出”)。
(6)若产物中有少量副产物乙醚,可用______(填“操作名称”)的方法除去。
(7)反应过程中应用冷水冷却装置D,以避免溴的大量挥发,但又不能过度冷却(如用冰水),其原因为____________。
19.(14分)钴酸锂()电池是一种应用广泛的新型电源,放电时的电池反应方程式为。电池正极材料有和少量的铝、铁、碳等单质。可利用以下工艺流程回收正极材料中的某些金属资源(还原性:)。
回答下列问题:
(1)基态Co原子的价层电子排布式为______。
(2)“放电处理”时正极的电极反应式为____________。
(3)“放电处理”除了考虑“拆解”时的安全因素外,还有利于______。
(4)NaOH溶液浸泡时发生的主要反应的离子方程式为____________。
(5)“适量盐酸浸泡”时,与盐酸反应的化学方程式为____________。
滤液Ⅱ中的溶质除HCl、LiCl、外还有______(填化学式)。
(6)加入“溶液”发生反应的离子方程式为____________。
20.(14分)氯吡格雷是一种用于抑制血小板聚集的药物,根据原料的不同,该药物的合成路线通常有两条,其中以2-氯苯甲醛为原料的合成路线如下:
(1)X的名称为______。
(2)Y的结构简式为______,Y分子中存在大π键(),则Y分子中S原子的杂化方式为______。
(3)C中官能团的名称为______。
(4)A发生银镜反应的化学方程式为____________。
(5)D→E的反应类型为____________。
(6)两分子C在一定条件下反应能生成一种含有3个六元环的产物,该产物的结构简式为______。
(7)A在一定条件下与发生加成反应可得芳香族化合物G,G的同分异构体有多种,其中能与溶液反应显紫色共有______种。
濮阳市名校2023-2024学年高三上学期期中质量检测
化学试题参考答案及评分标准
说明:①化学方程式或离子方程式若没有配平均不得分,若漏写(错写)反应条件扣1分,“↑”与“↓”漏写或多写均不扣分。
②出现关键错别字不得分。
一、选择题(本题包括16小题。每小题3分,共48分。)
1.B 2.C 3.A 4.A 5.C 6.A 7.B 8.D 9.A 10.B 11.C 12.D 13.B 14.C 15.C 16.B
二、非选择题(本题包括4小题,除标注外,每空2分,共52分。)
17.(14分)
(1)①②端基
③将转化为,降低了,使氧化性降低,避免被氧化
(“氧化性降低”1分,“避免被氧化”1分)
(2)
“8,,,4(见错得0分)”
(3)①②
(4)I中第一步反应生成的AgCl附着在Ag表面,阻碍溶液与Ag继续反应,未被氧化的Ag无法在第二步被浸出
18.(10分)
(1)油浴(1分)
(2)(条件错误或漏写得0分)
(3)D(1分)
(4)D中溴的颜色完全褪去
(5)下口放出(1分)
(6)蒸馏(或分馏)(1分)
(7)的凝固点较低(9℃),过度冷却会使其凝固而使气路堵塞
19.(14分)
(1)
(2)
(3)得到更多的,使锂(元素)在正极更多的回收(2处画“﹏”部分答出1处即可得2分)
(4)
(或)
5) (或)
(6)
20.(14分)
(1)甲醇(1分)
(2)(结构式与键线式均可) ((书写不规范不得分)
(3)羧基、氨基、氯原子(共2分,少写1个扣1分,扣完为止,错写得0分)
(4)
(5)取代反应(只写“取代”也得分)(1分)
(6)
(7)13
化学试题
注意事项:
1.本试卷共10页,满分100分,考试时间90分钟。
2.试题卷上不要答题,请用0.5毫米黑色签字笔直接把答案写在答题卡上对应的答题区域内。答在试题卷上的答案无效。
可能用到的相对原子质量:H-1、C-12、N-14、O-16、Na-23、Fe-56、Ag-108
第Ⅰ卷(共48分)
一、选择题(每小题3分,共48分。每小题只有一个选项符合题意。)
1.化学与人们的生活、生产密切相关。下列有关叙述正确的是( )
A.“沙里淘金”、“丹炉炼丹”过程均涉及物理变化和化学变化
B.中国天眼FAST用到的碳化硅是一种新型无机非金属材料
C.漂白粉、酒精、双氧水杀菌消毒均利用其氧化性
D.光伏发电的核心材料是,光导纤维的成分是单质Si
2.下列有关化学用语的使用正确的是( )
A.反-2-丁烯的结构简式:
B.的电子式:
C.次氯酸的结构式:
D.基态铜原子的价层电子轨道表示式:
3.设表示阿伏加德罗常数的值。下列叙述正确的是( )
A.与光照条件下充分反应,当消耗16 g 时,生成氯代烃的分子数目为
B.常温下,28 g Fe投入足量浓中可得到的分子数为
C.标准状况下,2.24 L 溶于水形成的溶液中
D.含0.1 mol 的溶液经反应后,完全转化为胶体,所得胶体中含胶粒数为
4.化学在国防领域发挥着重要作用。关于下列装备涉及材料的描述错误的是( )
选项 装备涉及材料 描述
A 防弹衣的主要材料: 两种单体的核磁共振氢谱峰数、峰面积之比均相同
B 隐形飞机的微波吸收材料: 单体能使溴水褪色
C 潜艇的消声瓦: 可由和加聚而成
D 潜艇的耐压球壳:钛合金 钛合金中存在金属键
5.化学是以实验为基础的学科。下列装置合理且能完成相应实验目的是( )
A.利用装置Ⅰ进行喷泉实验
B.利用装置Ⅱ制取并收集少量的
C.利用装置Ⅲ制取并收集少量的乙酸乙酯
D.利用装置Ⅳ从溶液中得到无水
6.对于下列实验,能正确描述其反应的离子方程式的是( )
A.乙酸乙酯与NaOH溶液共热:
B.向含0.1 mol 的溶液中通入0.1 mol :
C.用惰性电极电解水溶液:
D.同浓度同体积的溶液与NaOH溶液混合:
7.豆类植物对氮元素的吸收过程如下:
植物吸收
下列说法错误的是( )
A.中的键角小于中的键角
B.、中N的杂化方式不同
C.因P的原子半径大于N,故P原子间难形成p-pπ键
D.当有9.2 g 生成时,过程②转移的电子为1.2 mol
8.是一种重要的化工原料,其有关制备途径及性质如图所示。
下列说法错误的是( )
A.Y可以是甲酸乙酯
B.制取等量的,途径①消耗的是途径②的2倍
C.“混合气体”中一定含有
D.在①~⑤中,Cu元素被氧化的反应有3个
9.下列实验操作中,对应的实验现象和实验结论都正确,且两者具有因果关系的是( )
选项 实验操作 实验现象 实验结论
A 向NaBr溶液中加入少量的氯水和适量苯,振荡、静置 溶液上层呈橙红色 还原性强于
B 将少量铜粉加入1.0 mol·L 溶液中 固体溶解,溶液变蓝色 金属铁比铜活泼
C 将稀硝酸加入过量铁粉中,充分反应后滴加KSCN溶液 有气体生成,溶液呈血红色 稀硝酸将Fe氧化为
D 向淀粉的酸性水解液中滴入少量新制悬浊液并加热 有砖红色沉淀生成 葡萄糖具有还原性
10.物质M(结构如下图)常作为锂离子电池、锂离子电容器等的非水电解液添加剂。X、Y、Z、W为原子序数依次增大的短周期主族元素,基态W原子中有3个未成对电子。
下列说法正确的是( )
A.电负性:W>Z B.最简单氢化物的沸点:Y>X
C.最高价含氧酸的酸性:X>W D.第一电离能:X>Y
11.W、X、Y、Z为原子序数依次增大的短周期主族元素,W与Z处于同主族,Y原子p能级上有一对成对电子。甲、乙、丁、戊均为由上述元素组成的二元化合物。乙和丁均为含有10个电子的分子,且二者能形成分子间氢键。有关物质的转化关系如图所示。
下列说法正确的是( )
A.甲中含有σ键和π键 B.常温常压下戊为红棕色气体
C.分子内的化学键键角:乙<丁 D.丙为强电解质,乙与丁为弱电解质
12.我国科学家开发了一种新型的生物催化剂DepoPETase,对多种废弃塑料包装实现了完全解聚。该方法的最后一步原理如图所示。
下列叙述错误的是( )
A.与TPA-OH具有完全相同官能团的芳香族化合物还有5种
B.0.1 mol TPA-OH与足量溶液反应能生成0.2 mol
C.1 mol BHET-OH在一定条件下与NaOH溶液反应,最多能消耗3 mol NaOH
D.1 mol BHET-OH或TPA-OH都能与3 mol 发生取代反应
13.焦亚硫酸钠()常在食品加工中作防腐剂、漂白剂、疏松剂,可通过冷却过饱和溶液制得。某化学兴趣小组取焦亚硫酸钠样品溶于水,将溶液分成甲、乙、丙、丁四份,探究其溶液的性质。实验记录如下:
实验 操作 现象
Ⅰ 在甲中滴加几滴酸性溶液 酸性溶液褪色
Ⅱ 在淀粉溶液中滴加几滴碘水,然后再滴加适量的乙,振荡 淀粉溶液先变蓝后变为无色溶液
Ⅲ 在丙中滴加溶液 产生白色沉淀
Ⅳ 在丁中通入 产生浅黄色沉淀
下列叙述正确的是( )
A.由实验Ⅰ可知,溶于水得到的溶液有漂白性
B.由实验Ⅱ可知,溶于水得到的溶液能使溴水褪色
C.取实验Ⅲ中的白色沉淀加入过量稀硝酸,若沉淀不溶解,则白色沉淀为
D.由实验Ⅳ可知,溶于水得到的溶液有还原性
14.利用间接成对电化学法,以间硝基甲苯为原料合成间氨基苯甲酸的工作原理如下图。
下列说法错误的是( )
A.物质X为间硝基苯甲酸
B.间硝基甲苯与间氨基苯甲酸互为同分异构体
C.N电极上的电极反应为
D.当电路中转移6 mol 时,理论上可得到1 mol间氨基苯甲酸
15.某透明溶液X可能含有、、、、、、、、、中若干种,且各离子浓度相同。为确定其组成,依次进行下列实验。
①取少量溶液X,向其中加入足量的氢氧化钠溶液,有红褐色沉淀A产生;微热,闻到刺激性气味。
②过滤①中的混合物,在滤液中加入足量的氢氧化钡溶液,有白色沉淀B产生,再加入足量的稀硝酸,沉淀不溶解。
根据上述实验,下列说法正确的是( )
A.溶液X中一定含有N、、,可能含有
B.溶液X中是否含有、需要通过焰色试验确定
C.红褐色沉淀A和白色沉淀B都是纯净物
D.无法确定溶液中是否含有和
16.硒化锌是一种重要的半导体材料,其晶胞结构如图甲所示。已知晶胞参数为q nm,乙图为晶胞的俯视图,a点的原子分数坐标为。
下列说法正确的是( )
A.晶胞中硒原子的配位数为12
B.晶胞中d点的原子分数坐标为
C.相邻两个Zn原子的最短距离为nm
D.Zn和Se在元素周期表中分别位于d区与p区
第Ⅱ卷(共52分)
二、非选择题(本题包括4小题,除标注外,每空2分,共52分)
17.(14分)某化学兴趣小组在实验室研究从医用废感光胶片中回收银的方法。
已知:ⅰ.溶液与溶液直接混合能发生氧化还原反应;
ⅱ.;Ag1能溶于溶液;
ⅲ.可看作是中的一个O原子被S原子取代的产物。
(1)银的浸出
Ⅰ.两步法:
①溶液将胶片上的单质银转化为AgCl,其离子方程式为____________。
②在中,做配位原子的是中的______(填“中心”或“端基”)S原子。
Ⅱ.一步法:用水溶解和乙二胺四乙酸二钠(用表示)的混合固体,调节pH形成溶液,再加入一定量,配成浸取液。将废感光胶片浸入浸取液中,发生反应:
。
③从物质氧化性或还原性的角度分析加入的作用为____________。
(2)银的还原
调节(1)所得浸出液的pH,向其中加入溶液(已知电负性:B
(3)银浸出率的测定
称取mg洗净干燥的原胶片,灼烧灰化后用足量稀溶解,过滤。滤液用c mol L 标准溶液滴定至终点,消耗标准溶液 mL。另取洗净干燥的浸取后胶片,用同样方法处理,滴定,消耗标准溶液 mL。
已知:ⅰ.
ⅱ.银的浸出率。
①银溶于稀的化学方程式为______。
②银的浸出率为______(用含、、、的代数式表示,须化简)。
(4)实验发现在浸取试剂均过量、浸取时间足够长的情况下,与Ⅱ相比,Ⅰ中银的浸出率明显偏低,其原因可能是____________。
18.(10分)实验室要用通过两步反应制备,装置如下图(加热装置与尾气处理装置略去)。
有关数据列表如下:
乙醚
状态 无色液体 无色液体 无色液体
密度/g·cm 0.79 2.2 0.71
沸点/℃ 78.5 132 34.6
熔点/℃ -130 9 -116
回答下列问题:
(1)装置A用来制取乙烯,给装置A进行加热时最好选用______(填“水浴”、“油浴”)加热。
(2)装置A中发生的主要化学方程式为____________。
(3)在此制备实验中,要尽可能迅速地把反应温度提高到指定温度,其最主要目的是______(填字母序号)。
A.引发反应 B.加快反应速度 C.防止乙醇挥发 D.减少副产物乙醚生成
(4)判断该制备反应已经结束的最简单方法是____________。
(5)将粗产品置于分液漏斗中加水,振荡后静置,进行分液,产物应从______(填“上口倒出”、“下口放出”)。
(6)若产物中有少量副产物乙醚,可用______(填“操作名称”)的方法除去。
(7)反应过程中应用冷水冷却装置D,以避免溴的大量挥发,但又不能过度冷却(如用冰水),其原因为____________。
19.(14分)钴酸锂()电池是一种应用广泛的新型电源,放电时的电池反应方程式为。电池正极材料有和少量的铝、铁、碳等单质。可利用以下工艺流程回收正极材料中的某些金属资源(还原性:)。
回答下列问题:
(1)基态Co原子的价层电子排布式为______。
(2)“放电处理”时正极的电极反应式为____________。
(3)“放电处理”除了考虑“拆解”时的安全因素外,还有利于______。
(4)NaOH溶液浸泡时发生的主要反应的离子方程式为____________。
(5)“适量盐酸浸泡”时,与盐酸反应的化学方程式为____________。
滤液Ⅱ中的溶质除HCl、LiCl、外还有______(填化学式)。
(6)加入“溶液”发生反应的离子方程式为____________。
20.(14分)氯吡格雷是一种用于抑制血小板聚集的药物,根据原料的不同,该药物的合成路线通常有两条,其中以2-氯苯甲醛为原料的合成路线如下:
(1)X的名称为______。
(2)Y的结构简式为______,Y分子中存在大π键(),则Y分子中S原子的杂化方式为______。
(3)C中官能团的名称为______。
(4)A发生银镜反应的化学方程式为____________。
(5)D→E的反应类型为____________。
(6)两分子C在一定条件下反应能生成一种含有3个六元环的产物,该产物的结构简式为______。
(7)A在一定条件下与发生加成反应可得芳香族化合物G,G的同分异构体有多种,其中能与溶液反应显紫色共有______种。
濮阳市名校2023-2024学年高三上学期期中质量检测
化学试题参考答案及评分标准
说明:①化学方程式或离子方程式若没有配平均不得分,若漏写(错写)反应条件扣1分,“↑”与“↓”漏写或多写均不扣分。
②出现关键错别字不得分。
一、选择题(本题包括16小题。每小题3分,共48分。)
1.B 2.C 3.A 4.A 5.C 6.A 7.B 8.D 9.A 10.B 11.C 12.D 13.B 14.C 15.C 16.B
二、非选择题(本题包括4小题,除标注外,每空2分,共52分。)
17.(14分)
(1)①②端基
③将转化为,降低了,使氧化性降低,避免被氧化
(“氧化性降低”1分,“避免被氧化”1分)
(2)
“8,,,4(见错得0分)”
(3)①②
(4)I中第一步反应生成的AgCl附着在Ag表面,阻碍溶液与Ag继续反应,未被氧化的Ag无法在第二步被浸出
18.(10分)
(1)油浴(1分)
(2)(条件错误或漏写得0分)
(3)D(1分)
(4)D中溴的颜色完全褪去
(5)下口放出(1分)
(6)蒸馏(或分馏)(1分)
(7)的凝固点较低(9℃),过度冷却会使其凝固而使气路堵塞
19.(14分)
(1)
(2)
(3)得到更多的,使锂(元素)在正极更多的回收(2处画“﹏”部分答出1处即可得2分)
(4)
(或)
5) (或)
(6)
20.(14分)
(1)甲醇(1分)
(2)(结构式与键线式均可) ((书写不规范不得分)
(3)羧基、氨基、氯原子(共2分,少写1个扣1分,扣完为止,错写得0分)
(4)
(5)取代反应(只写“取代”也得分)(1分)
(6)
(7)13
同课章节目录
