辽宁省辽东南协作校2023-2024学年高二上学期12月月考化学(A卷)试题(含解析)
文档属性
| 名称 | 辽宁省辽东南协作校2023-2024学年高二上学期12月月考化学(A卷)试题(含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 699.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-17 10:14:54 | ||
图片预览



文档简介
辽宁省辽东南协作校2023—2024学年高二上学期12月月考
化学试题(A)
时间:75分钟 分数:100分
考试范围:选择性必修一第一章~第四章
一、单项选择题:每题3分,共45分
1.“夏禹铸九鼎,天下分九州”。青铜器在古时被称为“吉金”,是红铜与锡、铅等的合金。其表面铜锈大多呈青绿色,主要含有Cu2(OH)3Cl和Cu2(OH)2CO3。下列说法错误的是
A.青铜器中锡、铅对铜有保护作用
B.Cu2(OH)3Cl和Cu2(OH)2CO3都属于盐类
C.可用NH4Cl溶液浸泡青铜器来清洗铜锈
D.博物馆中贵重青铜器常放在银质托盘上进行展示
2.下列关于平衡常数K的说法正确的是
A.平衡常数K与反应本身及温度有关 B.改变反应物浓度能改变平衡常数K
C.加入催化剂可能会改变平衡常数K D.K越大,反应物的转化率越小
3.在实验室进行中和热测定实验,下列有关叙述错误的是
A.大小烧杯之间塞满碎泡沫,目的是减少热量损失
B.测量终止温度时,应当记录混合溶液的最高温度
C.为了使酸碱充分反应,应当缓慢分次倒入NaOH溶液并搅拌
D.碱过量的目的是保证盐酸完全反应
4.下列操作会使水的电离平衡向电离方向移动,且的是
A.将纯水加热到80℃ B.向水中加入少量的
C.向水中加入少量的固体 D.向水中加入少量的固体
5.常温下,①pH=3的醋酸和②0.01mol·L-1NaOH溶液两种溶液中,由水电离产生的氢离子浓度之比(①∶②)是( )
A.1∶10 B.1∶4 C.10∶1 D.无法计算
6.反应 aX(g)+bY(g) cZ(g);△H=QkJ/mol,有如图所示关系,下列判断中正确的是
A.a+b>c,Q<0 B.a+b>c,Q>0 C.a+b<c,Q<0 D.a+b<c,Q>0
7.下列事实不能用勒夏特列原理解释的是
A.在合成氨实际生产中,使气态氨变成液氨后及时从平衡混合物中分离出去,以提高原料的利用率
B.、、组成的平衡体系,加压后体系颜色变深
C.向重铬酸钾()溶液中滴加少量NaOH溶液,溶液颜色由橙色变为黄色
D.实验室中常用排饱和食盐水的方法收集氯气
8.下列反应的能量变化规律与图示相符的是
①氯化铵分解
②镁条溶于盐酸
③盐酸与碳酸氢钠反应
④氢氧化钡与氯化铵反应
⑤氢气在氯气中燃烧
⑥硫酸和氢氧化钡溶液反应
A.①②⑤ B.①②③ C.①③④ D.②④⑥
9.用铂作为电极电解某种溶液,通电一段时间,溶液的酸性增强,并且在阳极得到0.1mol气体,阴极得到0.2mol气体(两种气体均在相同条件下测定)。由此可知溶液可能是
A.稀盐酸 B.稀硫酸 C.CuSO4溶液 D.KNO3溶液
10.强酸与强碱的稀溶液发生中和反应的热效应为 。进行中和反应反应热的测定时,保持其他条件相同,使用以下4组酸碱组合:①稀盐酸、NaOH溶液;②浓硫酸、NaOH溶液;③醋酸溶液、氨水;④稀硫酸、NaOH溶液,则测得的中和反应反应热的大小顺序为
A.②>①=④>③ B.②>④>①>③ C.③>①>④>② D.③>①=④>②
11.一定温度下,将3mol A和2mol B混合于2L的恒容密闭容器中,发生如下反应:,反应5min时,测得D的浓度为0.75mol/L,以C表示的平均反应速率,下列说法正确的是
A.0~5min内,以B表示的平均反应速率为
B.5min时,向容器中再加入1mol氦气,可以减慢化学反应速率
C.5min时,D的物质的量为1.25mol
D.该反应方程式中,
12.常温下,一种解释乙酰水杨酸(用表示,)药物在人体吸收模式如下:
假设离子不会穿过组织薄膜,而未电离的则可自由穿过该膜且达到平衡。下列说法错误的是
A.血浆中电离程度比胃中大 B.在胃中,
C.在血浆中, D.血浆与胃中相同
13.下列热化学相关的描述正确的是
A.在光照和点燃条件下不同
B.已知 , ,则
C.表示的燃烧热:
D.一定条件下 ,则和置于密闭容器中充分反应放热
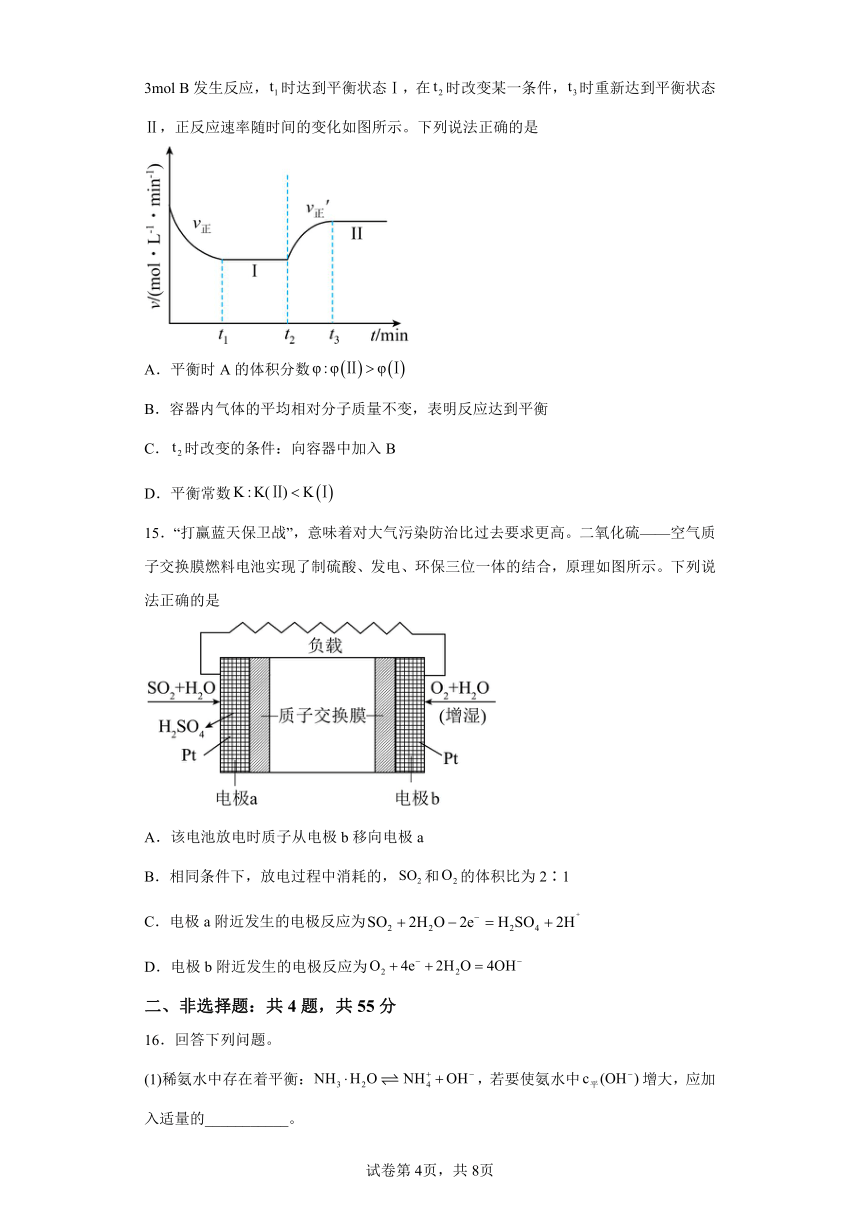
14.已知: 向一恒温恒容的密闭容器中充入1mol A和3mol B发生反应,时达到平衡状态Ⅰ,在时改变某一条件,时重新达到平衡状态Ⅱ,正反应速率随时间的变化如图所示。下列说法正确的是
A.平衡时A的体积分数
B.容器内气体的平均相对分子质量不变,表明反应达到平衡
C.时改变的条件:向容器中加入B
D.平衡常数
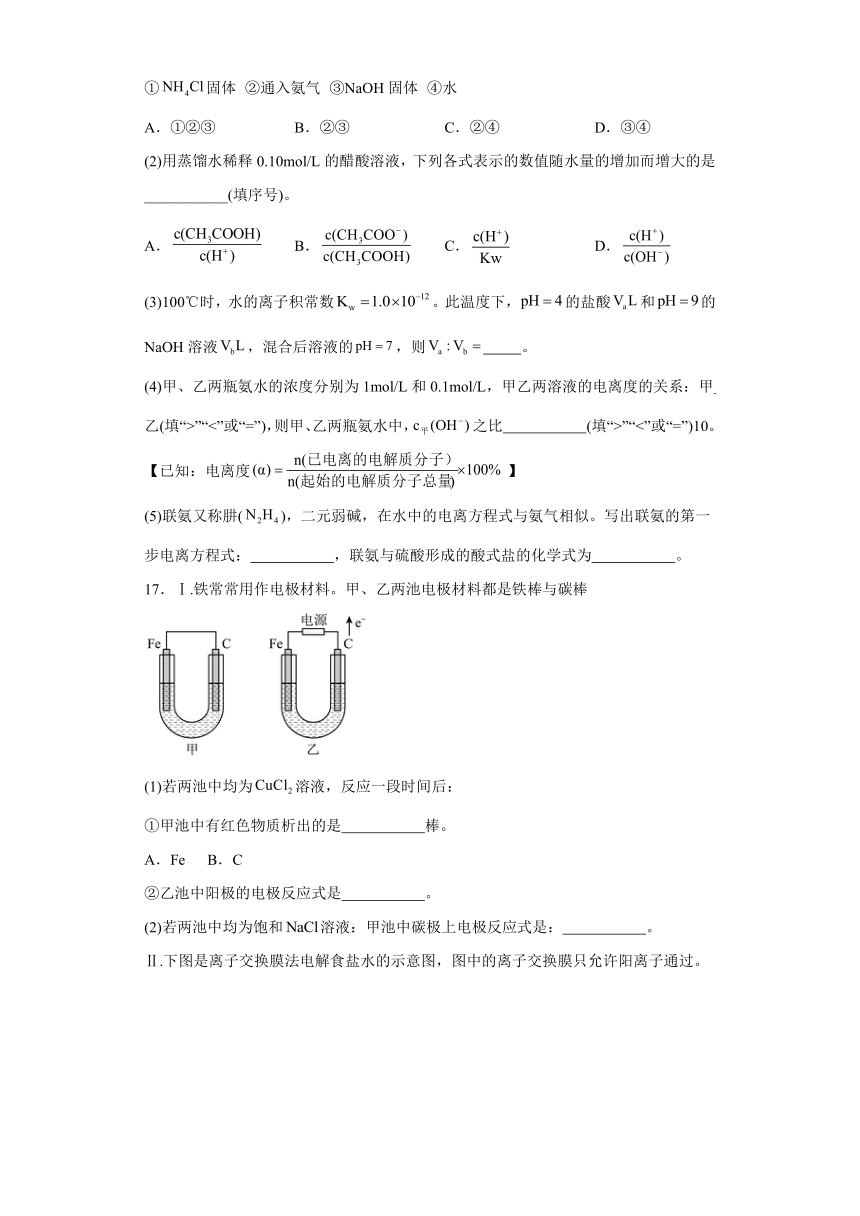
15.“打赢蓝天保卫战”,意味着对大气污染防治比过去要求更高。二氧化硫——空气质子交换膜燃料电池实现了制硫酸、发电、环保三位一体的结合,原理如图所示。下列说法正确的是
A.该电池放电时质子从电极b移向电极a
B.相同条件下,放电过程中消耗的,和的体积比为2∶1
C.电极a附近发生的电极反应为
D.电极b附近发生的电极反应为
二、非选择题:共4题,共55分
16.回答下列问题。
(1)稀氨水中存在着平衡:,若要使氨水中增大,应加入适量的___________。
①固体 ②通入氨气 ③NaOH固体 ④水
A.①②③ B.②③ C.②④ D.③④
(2)用蒸馏水稀释0.10mol/L的醋酸溶液,下列各式表示的数值随水量的增加而增大的是___________(填序号)。
A. B. C. D.
(3)100℃时,水的离子积常数。此温度下,的盐酸和的NaOH溶液,混合后溶液的,则 。
(4)甲、乙两瓶氨水的浓度分别为1mol/L和0.1mol/L,甲乙两溶液的电离度的关系:甲 乙(填“>”“<”或“=”),则甲、乙两瓶氨水中,之比 (填“>”“<”或“=”)10。【已知:电离度】
(5)联氨又称肼(),二元弱碱,在水中的电离方程式与氨气相似。写出联氨的第一步电离方程式: ,联氨与硫酸形成的酸式盐的化学式为 。
17.Ⅰ.铁常常用作电极材料。甲、乙两池电极材料都是铁棒与碳棒
(1)若两池中均为溶液,反应一段时间后:
①甲池中有红色物质析出的是 棒。
A.Fe B.C
②乙池中阳极的电极反应式是 。
(2)若两池中均为饱和溶液:甲池中碳极上电极反应式是: 。
Ⅱ.下图是离子交换膜法电解食盐水的示意图,图中的离子交换膜只允许阳离子通过。
请回答下列问题:
(3)写出电解饱和食盐水的离子方程式: 。
(4)离子交换膜的作用为一、阻止阳极产生的和阴极产生的混合发生爆炸;二、阻止 。
(5)精制饱和食盐水从图中 (选填“a”、“b”、“c”或“d”)位置补充。
(6)电解时用盐酸控制阳极区溶液的pH在,用化学平衡移动原理解释盐酸的作用: 。
18.常温下,有浓度均为的下列4种溶液:
①溶液、②溶液、③溶液、④溶液。
(1)这4种溶液由大到小的顺序是 (填序号)。
(2)溶液显碱性的原因(用离子方程式说明): 。
(3)若向等体积的③和④中滴加盐酸至呈中性,则消耗盐酸的体积③ (填“>”、“<”或“=”)④。
(4)时,将的醋酸和溶液等体积混合后,溶液的,则 (填“>”、“<”或“=”)0.1。
(5)溶液中离子浓度大小为 。
(6)向溶液中通入,则发生反应的离子方程式为 。
19.实现碳中和已经成为全球的广泛共识,化学科学在此过程中发挥着至关重要的作用。
(1)加氢可制备甲酸(HCOOH)。
①工业上利用甲酸的能量关系转换图如图所示:
反应的焓变 。
②温度为时,将等物质的量的和充入体积为的恒容密闭容器中发生反应:。
实验测得:为速率常数。保持其他条件不变,温度为时,,则时平衡压强 (填“>”“<”或“=”)时平衡压强。
(2)研究表明,二氧化碳与氢气在某催化剂作用下可以还原为甲醇,甲醇是一种重要的化工原料,应用前景广阔。该反应如下:。反应历程如图所示(吸附在催化剂表面的物质用*标注,如表示吸附在催化剂表面;图中已省略)。
①上述合成甲醇的反应过程中决定反应速率的步骤是 (用化学方程式表示)。
②有利于提高平衡时转化率的措施有 (填字母)。
a.使用催化剂 b.加压 c.增大和的初始投料比
③研究温度对甲醇产率的影响时发现,在,保持原料气中和的投料比不变,得到平衡时甲醇的产率与温度的关系如图所示,则该反应的 (填“>”“=”或“<”)0。
试卷第2页,共8页
1.D
【详解】A.锡、铅的金属性比铜强,在形成原电池时,作原电池的负极,能阻止铜失电子,从而保护青铜器中的铜,A正确;
B.Cu2(OH)3Cl和Cu2(OH)2CO3中都含有Cu2+和Cl-或CO,二者都属于盐类,B正确;
C.NH4Cl在溶液中能发生水解而使溶液显酸性,浸泡青铜器能清洗青铜器的铜锈,C正确;
D. 青铜器常放在银质托盘上,可以形成原电池,青铜器作原电池的负极,从而会加快青铜器的腐蚀,D错误;
故选:D。
2.A
【详解】A.平衡常数K只与反应本身及温度有关,改变其他条件,平衡常数不变,A正确;
B.平衡常数K只与反应本身及温度有关,改变反应物浓度无影响,B错误;
C.平衡常数K只与反应本身及温度有关,加入催化剂无影响,C错误;
D.K越大,反应进行的程度越大,反应物的转化率越大,D错误;
答案选A。
3.C
【详解】A.大小烧杯之间塞满碎泡沫,目的是减少热量损失,减小测量误差,故A正确;
B.充分反应,放出热量最多时,温度最高,测量终止温度时,应当记录混合溶液的最高温度,故B正确;
C.为了使酸碱充分反应,应当快速一次倒入溶液并搅拌,防止热量散失,故C错误;
D.碱过量的目的是保证盐酸完全反应,防止出现实验误差,故D正确;
故选C。
4.D
【详解】A.将纯水加热会促进水的电离平衡向电离方向移动,氢离子浓度增大,pH减小,所以pH小于7,故A错误;
B.向水中加少量的,铁离子水解会促进水电离,使电离平衡向电离方向移动,且使溶液呈酸性pH小于7,故B错误;
C.向水中加入少量的固体,电离的氢离子会使水的电离平衡向左移动,但溶液成酸性pH小于7,故C错误;
D.向水中加入少量的固体,碳酸氢根水解会促进水的电离使电离平衡向电离方向移动,溶液呈碱性pH大于7,故D正确;
故答案为:D。
5.C
【详解】①pH=3的醋酸,溶液中氢离子浓度为0.001mol/L,溶液中氢氧根离子是水电离,根据常温下水的离子积,溶液中氢氧根离子的浓度为mol/L=1×10-11mol/L,即水电离的氢离子浓度为1×10-10mol/L;②0.01mol/LNaOH溶液,溶液中氢氧根离子的浓度为0.01mol/L,氢氧化钠溶液中氢离子是水电离的,根据常温下水的离子积,溶液中氢离子的浓度为mol/L=1×10-12mol/L,所以两溶液中水的氢离子浓度之比为1×10-11mol/L∶1×10-12mol/L=10∶1,故选C。
【点睛】准确判断酸溶液和碱溶液中水的电离情况是解题的关键。解答本题要注意酸溶液中氢氧根离子是水电离产生的,或碱溶液中氢离子是水电离产生的。
6.A
【详解】由图可知,温度都为T2时,压强P1先到达平衡,则压强P1>P2,压强越大,平衡时X的体积分数越小,说明增大压强平衡向正反应方向移动,则正反应是气体体积减小的反应,即a+b>c,压强都为P2时,温度T1先到达平衡,故温度T1>T2,温度越高,平衡时X的体积分数越大,说明升高温度平衡向逆反应方向移动,该反应的正反应为放热反应,即Q<0,故选:A。
7.B
【详解】A.在合成氨实际生产中,使气态氨变成液氨后及时从平衡混合物中分离出去,生成物浓度减小,平衡正向移动,则原料转化率增大,提高了原料的利用率,能用勒夏特列原理解释,故A不符合题意;
B.、、组成的平衡体系,加压后体系颜色变深是由于浓度增大,平衡未移动,不能用勒夏特列原理解释,故B符合题意;
C.根据,向重铬酸钾()溶液中滴加少量NaOH溶液,氢离子消耗,平衡逆向移动,因此溶液颜色由橙色变为黄色,能用勒夏特列原理解释,故C不符合题意;
D.,实验室中常用排饱和食盐水的方法收集氯气,氯离子浓度增大,抑制氯气的溶解,能用勒夏特列原理解释,故D不符合题意。
综上所述,答案为B。
8.C
【详解】图示反应物能量低于生成物能量,则反应为吸收能量的反应,①③④为吸热反应,②⑤⑥为放热反应,C项符合题意。
故选:C。
9.B
【分析】阳极与阴极产生的气体体积比为1:2,相当于电解水,pH变小,说明电解了含氧酸;
【详解】A.电解稀盐酸溶液,两极上分别为Cl-和H+放电,两极气体体积之比是1:1,A不符合题意;
B.电解稀硫酸,两极上分别为OH-和H+放电,消耗水,H+浓度增大,溶液的pH变小,B符合题意;
C.电解CuSO4溶液,阴极析出铜,如时间较少,没有气体放出,C不符合题意;
D.电解硝酸钾溶液,两极上分别为OH-和H+放电,消耗水,溶液呈中性,pH不变,D不符合题意;
故选B。
10.D
【详解】②中浓硫酸稀释过程中会放热,放出热量最多,最小;③中醋酸和氨水电离吸收热量,放出热量最少,最大;①和④放出的热量理论上相等;所以的大小顺序为③>①=④>②,故选D。
11.D
【详解】A.B为固体,没有浓度变化量,不能用B的浓度变化表示该反应的反应速率,故A错误;
B.恒容容器中,向容器中再加入1mol氦气,反应物、生成物的浓度不变,则反应速率不变,故B错误;
C.反应5min,测得D的浓度为0.75mol/L,D的物质的量为0.75mol/L×2L=1.5mol,故C错误;
D.反应5min,测得D的浓度为0.75mol/L,即D的浓度变化量为0.75mol/L;C表示的平均反应速率v(C)=0.3,则C的浓度变化量为0.3×5min=1.5mol/L,根据反应计量系数比等于浓度变化量之比,则0.75:1.5=2:x,解得x=4,故D正确;
答案选D。
12.C
【详解】A.HA的电离方程式为HAH++A-,血浆中pH=7.4,呈弱碱性,促进HA电离,胃中pH=1.0,呈酸性,抑制HA的电离,血浆中HA的电离程度比胃中大,A项正确;
B.Ka==1×10-3.0,胃中pH=1.0,c(H+)=0.1mol/L,则胃中=1×10-2.0,B项正确;
C.Ka==1×10-3.0,血浆中pH=7.4,c(H+)=10-7.4mol/L,则血浆中=1×104.4,=1+=1+1×104.4>1×104.4,C项错误;
D.假设离子不会穿过组织薄膜,而未电离的HA则可自由穿过该膜且达到平衡,故血浆与胃中c(HA)相同,D项正确;
答案选C。
13.B
【详解】A.在光照和点燃条件下都能发生反应,且相同,A不正确;
B.已知 , ,由于SO2(g)=SO2(l) △H<0,所以<△H2,B正确;
C.表示的燃烧热时,NH3(g)的化学计量数应为“1”,且水应呈液态,C不正确;
D.一定条件下 ,由于反应可逆,将和置于密闭容器中充分反应,放热小于,D不正确;
故选B。
14.A
【详解】A.根据图中信息,在时是加入C,平衡逆向移动A的物质的量增加,因此A的体积分数增大,即平衡时A的体积分数,故A正确;
B.平均摩尔质量等于气体质量除以气体物质的量,气体质量不变,该反应是等体积反应,气体物质的量不变,平均摩尔质量不变,因此容器内气体的平均相对分子质量不变,不能说明反应达到平衡,故B错误;
C.时刻正反应速率不变,逆反应速率增大,则改变的条件:向容器中加入C,故C错误;
D.反应是恒温,因此温度不变,平衡常数不变即平衡常数K:,故D错误;
答案为A。
15.B
【分析】电极a中SO2转化为H2SO4,发生氧化反应,则a电极为负极,发生的电极反应为;电极b中消耗O2,则b电极为正极,发生的电极反应为。
【详解】A.由分析可得,电极a为负极,电极b为正极,阳离子向正极移动,则质子从电极a向电极b移动,A错误;
B.电池总反应为,相同条件下,放电过程中,和的体积比为2∶1,B正确;
C.电极a附近发生的电极反应为,C错误;
D.电极b附近发生的电极反应为,D错误;
故选B。
16.(1)B
(2)B
(3)9:1
(4) < <
(5) 或
【详解】(1)向氨水中加入氯化铵固体,溶液中铵根离子浓度增大,电离平衡左移,溶液中氢氧根离子浓度减小,故错误;
②向氨水中通入氨气,一水合氨的浓度增大,电离平衡右移,溶液中氢氧根离子浓度增大,故正确;
③向氨水中加入强碱氢氧化钠固体,溶液中溶液中氢氧根离子浓度增大,故正确;
④向氨水中加入水稀释,溶液中氢氧根离子浓度减小,故错误;
②③正确,故选B;
(2)用蒸馏水稀释0.10mol/L的醋酸溶液时,溶液中的醋酸分子、醋酸根离子、氢离子的浓度均减小,温度不变,电离常数、水的离子积常数均不变;
A.由电离平衡常数公式可知,溶液中=,稀释时,醋酸根离子浓度减小,电离常数不变,则溶液中和的值减小,故A错误;
B.由电离平衡常数公式可知,溶液中=,稀释时,氢离子浓度减小,电离常数不变,则溶液中和的值增大,故B正确;
C.稀释时,氢离子浓度减小,水的离子积常数不变,则溶液中的值减小,故C错误;
D.稀释时,氢离子浓度减小,水的离子积常数不变,则溶液中氢氧根离子浓度增大,的值减小,故D错误;
故选B;
(3)由100℃时,将pH=9的氢氧化钠溶液与pH=4的盐酸溶液混合所得混合溶液pH=7即混合后溶液显碱性,可得:=10—5,解得;
(4)氨水的浓度越大,一水合氨的电离度越小,则α乙大于α甲,甲、乙两瓶氨水中之比为,由于α乙大于α甲,所以的值小于10,故答案为:<;<;
(5)联氨为二元弱碱,在水中的电离方程式与氨相似,第一步电离方程式:或,联氨为二元弱碱,联氨与硫酸形成的酸式盐的化学式为
17.(1) B
(2)
(3)2Cl-+2H2O2OH-+H2↑+Cl2↑
(4)阻止OH-进入阳极室,与Cl2发生反应Cl2+2NaOH=NaCl+NaClO+H2O
(5)a
(6)Cl2与水反应:Cl2+H2OHCl+HClO,增大HCl的浓度使平衡逆向移动,减少Cl2在水中的溶解,有利于Cl2逸出
【分析】Ⅰ(1)①甲为原电池,Fe失电子为负极,C为正极,铜离子在正极上得电子生成Cu;②乙为电解池,由电子流向可知,Fe为阴极,C为阳极,阳极上氯离子失去电子生成氯气;(2)若两池中均盛放 NaCl溶液,则甲池发生金属的吸氧腐蚀,正极为2H2O+O2+4e-=4OH-,负极为Fe-2e-=Fe2+,乙池为电解食盐水装置,阳极反应为4OH--4e-═O2↑+2H2O,阴极反应为2H++2e-=H2↑,Ⅱ电解饱和食盐时阳极阴离子Cl-、OH-放电,Cl-的放电能力强于OH-,阳极发生的方程式为:2Cl--2e-═Cl2↑,阴极:2H++2e-═H2↑;H2、NaOH在阴极,NaOH溶液的出口为d,Cl2在阳极,精制饱和食盐水从阳极进入,据此分析解题。
【详解】(1)①甲为原电池,Fe失电子为负极,C为正极,铜离子在正极上得电子生成Cu,故答案为:B;
②乙为电解池,由电子流向可知,Fe为阴极,C为阳极,阳极上氯离子失去电子生成氯气,则阳极的电极反应式为:2Cl--2e-=Cl2↑,故答案为:2Cl--2e-=Cl2↑;
(2)由以上分析可知,甲池中正极的电极反应式为2H2O+O2+4e-=4OH-,故答案为:2H2O+O2+4e-=4OH-;
(3)电解精制饱和食盐水的方法制取氯气、氢气、烧碱,反应的离子方程式为:2Cl-+2H2O2OH-+H2↑+Cl2↑,故答案为:2Cl-+2H2O2OH-+H2↑+Cl2↑;
(4)阳离子交换膜只能阳离子通过,阴离子和气体不能通过,用石墨作电极电解饱和氯化钠时,阳极上氯离子放电生成氯气,氯气不能通过阳离子交换膜而进入阴极,如果氯气进入阴极易和氢气混合产生爆炸,且易和氢氧化钠溶液反应生成氯化钠、次氯酸钠而导致制取的氢氧化钠不纯;故答案为:阻止OH-进入阳极室,与Cl2发生反应Cl2+2NaOH=NaCl+NaClO+H2O;
(5)Cl2在阳极,依据装置图分析可知精制饱和食盐水从阳极进入,即进口为a,故答案为:a;
(6)阳极产生的氯气,氯气能够溶于水,存在着下列平衡,Cl2+H2OHCl+HClO,加入盐酸,增大氢离子浓度,平衡逆向移动,有利于氯气逸出收集,故答案为:Cl2+H2OHCl+HClO,用盐酸控制阳极的pH,增大氢离子浓度,平衡逆向移动,有利于氯气逸出收集。
18.(1)②>④>①>③
(2)
(3)<
(4)>
(5)
(6)
【详解】(1)根据题目中的电离平衡常数分析,平衡常数越大,弱酸的酸性越强,对应酸根离子水解程度越弱,钠盐的碱性越弱。已知酸性CH3COOH>H2CO3>HCN>,4种溶液①NaCN溶液、②NaOH溶液、③CH3COONa溶液、④Na2CO3溶液中氢氧化钠为强碱,碱性最大,则四种溶液碱性大小是②>④>①>③,故这4种溶液的pH由大到小的顺序是②>④>①>③;
(2))NaCN溶液呈碱性的原因是CN-发生水解反应生成HCN和氢氧根离子,离子方程式是;
(3)等体积③CH3COONa溶液和④Na2CO3溶液中分别滴加盐酸至溶液呈中性,由于同浓度下,CH3COONa溶液的pH较小,则需要盐酸中和至中性的量较少,故答案是<;
(4)若a=0.1 mol·L 1,等体积混合后,与氢氧化钠恰好反应生成醋酸钠和水,醋酸钠水解使得溶液呈碱性,则可推知,将amol·L 1的醋酸和0.1mol·L 1NaOH溶液等体积混合后,溶液的pH=7,则醋酸的浓度a大于0.1mol·L 1,反应后剩余一些醋酸,使得醋酸和醋酸钠共存,溶液呈中性,故答案是>;
(5)溶液中以钠离子和碳酸根离子为主,碳酸根离子水解生成碳酸氢根离子和氢氧根离子,使得溶液显碱性,水也会电离出氢氧根离子,故氢氧根离子浓度大于碳酸氢根离子大于氢离子,所以离子浓度大小为;
(6)由于醋酸的酸性比HCN强,故向NaCN溶液中通入醋酸反应生成HCN和醋酸根离子,则发生反应的离子方程式为。
19.(1) -31.4 >
(2) b <
【详解】(1)①根据盖斯定律,③-②-①可得;
②当反应达到平衡时,正逆反应速率相等,则,,温度为T1℃时,K=2,温度为T2℃时 ,平衡逆向移动,反应为放热反应,可知T2>T1,又逆反应气体分子数多,物质的量与温度增大均导致压强变大。
故答案为:-31.4、>;
(2)①从图中可以看出的活化能最大,因此反应速率由决定;
②图中显示是吸热反应,正向体积变小,催化剂不影响平衡;增大压强平衡正向移动,可以增大二氧化碳转化率;增大二氧化碳和氢气的初始投料比,会增加氢气的转化率,二氧化碳的转化率不会增加;
③由图可知,升高温度,甲醇的产率下降,升高温度平衡逆向移动,反应正向放热;
故答案为:、b、<。
答案第8页,共9页
答案第9页,共9页
化学试题(A)
时间:75分钟 分数:100分
考试范围:选择性必修一第一章~第四章
一、单项选择题:每题3分,共45分
1.“夏禹铸九鼎,天下分九州”。青铜器在古时被称为“吉金”,是红铜与锡、铅等的合金。其表面铜锈大多呈青绿色,主要含有Cu2(OH)3Cl和Cu2(OH)2CO3。下列说法错误的是
A.青铜器中锡、铅对铜有保护作用
B.Cu2(OH)3Cl和Cu2(OH)2CO3都属于盐类
C.可用NH4Cl溶液浸泡青铜器来清洗铜锈
D.博物馆中贵重青铜器常放在银质托盘上进行展示
2.下列关于平衡常数K的说法正确的是
A.平衡常数K与反应本身及温度有关 B.改变反应物浓度能改变平衡常数K
C.加入催化剂可能会改变平衡常数K D.K越大,反应物的转化率越小
3.在实验室进行中和热测定实验,下列有关叙述错误的是
A.大小烧杯之间塞满碎泡沫,目的是减少热量损失
B.测量终止温度时,应当记录混合溶液的最高温度
C.为了使酸碱充分反应,应当缓慢分次倒入NaOH溶液并搅拌
D.碱过量的目的是保证盐酸完全反应
4.下列操作会使水的电离平衡向电离方向移动,且的是
A.将纯水加热到80℃ B.向水中加入少量的
C.向水中加入少量的固体 D.向水中加入少量的固体
5.常温下,①pH=3的醋酸和②0.01mol·L-1NaOH溶液两种溶液中,由水电离产生的氢离子浓度之比(①∶②)是( )
A.1∶10 B.1∶4 C.10∶1 D.无法计算
6.反应 aX(g)+bY(g) cZ(g);△H=QkJ/mol,有如图所示关系,下列判断中正确的是
A.a+b>c,Q<0 B.a+b>c,Q>0 C.a+b<c,Q<0 D.a+b<c,Q>0
7.下列事实不能用勒夏特列原理解释的是
A.在合成氨实际生产中,使气态氨变成液氨后及时从平衡混合物中分离出去,以提高原料的利用率
B.、、组成的平衡体系,加压后体系颜色变深
C.向重铬酸钾()溶液中滴加少量NaOH溶液,溶液颜色由橙色变为黄色
D.实验室中常用排饱和食盐水的方法收集氯气
8.下列反应的能量变化规律与图示相符的是
①氯化铵分解
②镁条溶于盐酸
③盐酸与碳酸氢钠反应
④氢氧化钡与氯化铵反应
⑤氢气在氯气中燃烧
⑥硫酸和氢氧化钡溶液反应
A.①②⑤ B.①②③ C.①③④ D.②④⑥
9.用铂作为电极电解某种溶液,通电一段时间,溶液的酸性增强,并且在阳极得到0.1mol气体,阴极得到0.2mol气体(两种气体均在相同条件下测定)。由此可知溶液可能是
A.稀盐酸 B.稀硫酸 C.CuSO4溶液 D.KNO3溶液
10.强酸与强碱的稀溶液发生中和反应的热效应为 。进行中和反应反应热的测定时,保持其他条件相同,使用以下4组酸碱组合:①稀盐酸、NaOH溶液;②浓硫酸、NaOH溶液;③醋酸溶液、氨水;④稀硫酸、NaOH溶液,则测得的中和反应反应热的大小顺序为
A.②>①=④>③ B.②>④>①>③ C.③>①>④>② D.③>①=④>②
11.一定温度下,将3mol A和2mol B混合于2L的恒容密闭容器中,发生如下反应:,反应5min时,测得D的浓度为0.75mol/L,以C表示的平均反应速率,下列说法正确的是
A.0~5min内,以B表示的平均反应速率为
B.5min时,向容器中再加入1mol氦气,可以减慢化学反应速率
C.5min时,D的物质的量为1.25mol
D.该反应方程式中,
12.常温下,一种解释乙酰水杨酸(用表示,)药物在人体吸收模式如下:
假设离子不会穿过组织薄膜,而未电离的则可自由穿过该膜且达到平衡。下列说法错误的是
A.血浆中电离程度比胃中大 B.在胃中,
C.在血浆中, D.血浆与胃中相同
13.下列热化学相关的描述正确的是
A.在光照和点燃条件下不同
B.已知 , ,则
C.表示的燃烧热:
D.一定条件下 ,则和置于密闭容器中充分反应放热
14.已知: 向一恒温恒容的密闭容器中充入1mol A和3mol B发生反应,时达到平衡状态Ⅰ,在时改变某一条件,时重新达到平衡状态Ⅱ,正反应速率随时间的变化如图所示。下列说法正确的是
A.平衡时A的体积分数
B.容器内气体的平均相对分子质量不变,表明反应达到平衡
C.时改变的条件:向容器中加入B
D.平衡常数
15.“打赢蓝天保卫战”,意味着对大气污染防治比过去要求更高。二氧化硫——空气质子交换膜燃料电池实现了制硫酸、发电、环保三位一体的结合,原理如图所示。下列说法正确的是
A.该电池放电时质子从电极b移向电极a
B.相同条件下,放电过程中消耗的,和的体积比为2∶1
C.电极a附近发生的电极反应为
D.电极b附近发生的电极反应为
二、非选择题:共4题,共55分
16.回答下列问题。
(1)稀氨水中存在着平衡:,若要使氨水中增大,应加入适量的___________。
①固体 ②通入氨气 ③NaOH固体 ④水
A.①②③ B.②③ C.②④ D.③④
(2)用蒸馏水稀释0.10mol/L的醋酸溶液,下列各式表示的数值随水量的增加而增大的是___________(填序号)。
A. B. C. D.
(3)100℃时,水的离子积常数。此温度下,的盐酸和的NaOH溶液,混合后溶液的,则 。
(4)甲、乙两瓶氨水的浓度分别为1mol/L和0.1mol/L,甲乙两溶液的电离度的关系:甲 乙(填“>”“<”或“=”),则甲、乙两瓶氨水中,之比 (填“>”“<”或“=”)10。【已知:电离度】
(5)联氨又称肼(),二元弱碱,在水中的电离方程式与氨气相似。写出联氨的第一步电离方程式: ,联氨与硫酸形成的酸式盐的化学式为 。
17.Ⅰ.铁常常用作电极材料。甲、乙两池电极材料都是铁棒与碳棒
(1)若两池中均为溶液,反应一段时间后:
①甲池中有红色物质析出的是 棒。
A.Fe B.C
②乙池中阳极的电极反应式是 。
(2)若两池中均为饱和溶液:甲池中碳极上电极反应式是: 。
Ⅱ.下图是离子交换膜法电解食盐水的示意图,图中的离子交换膜只允许阳离子通过。
请回答下列问题:
(3)写出电解饱和食盐水的离子方程式: 。
(4)离子交换膜的作用为一、阻止阳极产生的和阴极产生的混合发生爆炸;二、阻止 。
(5)精制饱和食盐水从图中 (选填“a”、“b”、“c”或“d”)位置补充。
(6)电解时用盐酸控制阳极区溶液的pH在,用化学平衡移动原理解释盐酸的作用: 。
18.常温下,有浓度均为的下列4种溶液:
①溶液、②溶液、③溶液、④溶液。
(1)这4种溶液由大到小的顺序是 (填序号)。
(2)溶液显碱性的原因(用离子方程式说明): 。
(3)若向等体积的③和④中滴加盐酸至呈中性,则消耗盐酸的体积③ (填“>”、“<”或“=”)④。
(4)时,将的醋酸和溶液等体积混合后,溶液的,则 (填“>”、“<”或“=”)0.1。
(5)溶液中离子浓度大小为 。
(6)向溶液中通入,则发生反应的离子方程式为 。
19.实现碳中和已经成为全球的广泛共识,化学科学在此过程中发挥着至关重要的作用。
(1)加氢可制备甲酸(HCOOH)。
①工业上利用甲酸的能量关系转换图如图所示:
反应的焓变 。
②温度为时,将等物质的量的和充入体积为的恒容密闭容器中发生反应:。
实验测得:为速率常数。保持其他条件不变,温度为时,,则时平衡压强 (填“>”“<”或“=”)时平衡压强。
(2)研究表明,二氧化碳与氢气在某催化剂作用下可以还原为甲醇,甲醇是一种重要的化工原料,应用前景广阔。该反应如下:。反应历程如图所示(吸附在催化剂表面的物质用*标注,如表示吸附在催化剂表面;图中已省略)。
①上述合成甲醇的反应过程中决定反应速率的步骤是 (用化学方程式表示)。
②有利于提高平衡时转化率的措施有 (填字母)。
a.使用催化剂 b.加压 c.增大和的初始投料比
③研究温度对甲醇产率的影响时发现,在,保持原料气中和的投料比不变,得到平衡时甲醇的产率与温度的关系如图所示,则该反应的 (填“>”“=”或“<”)0。
试卷第2页,共8页
1.D
【详解】A.锡、铅的金属性比铜强,在形成原电池时,作原电池的负极,能阻止铜失电子,从而保护青铜器中的铜,A正确;
B.Cu2(OH)3Cl和Cu2(OH)2CO3中都含有Cu2+和Cl-或CO,二者都属于盐类,B正确;
C.NH4Cl在溶液中能发生水解而使溶液显酸性,浸泡青铜器能清洗青铜器的铜锈,C正确;
D. 青铜器常放在银质托盘上,可以形成原电池,青铜器作原电池的负极,从而会加快青铜器的腐蚀,D错误;
故选:D。
2.A
【详解】A.平衡常数K只与反应本身及温度有关,改变其他条件,平衡常数不变,A正确;
B.平衡常数K只与反应本身及温度有关,改变反应物浓度无影响,B错误;
C.平衡常数K只与反应本身及温度有关,加入催化剂无影响,C错误;
D.K越大,反应进行的程度越大,反应物的转化率越大,D错误;
答案选A。
3.C
【详解】A.大小烧杯之间塞满碎泡沫,目的是减少热量损失,减小测量误差,故A正确;
B.充分反应,放出热量最多时,温度最高,测量终止温度时,应当记录混合溶液的最高温度,故B正确;
C.为了使酸碱充分反应,应当快速一次倒入溶液并搅拌,防止热量散失,故C错误;
D.碱过量的目的是保证盐酸完全反应,防止出现实验误差,故D正确;
故选C。
4.D
【详解】A.将纯水加热会促进水的电离平衡向电离方向移动,氢离子浓度增大,pH减小,所以pH小于7,故A错误;
B.向水中加少量的,铁离子水解会促进水电离,使电离平衡向电离方向移动,且使溶液呈酸性pH小于7,故B错误;
C.向水中加入少量的固体,电离的氢离子会使水的电离平衡向左移动,但溶液成酸性pH小于7,故C错误;
D.向水中加入少量的固体,碳酸氢根水解会促进水的电离使电离平衡向电离方向移动,溶液呈碱性pH大于7,故D正确;
故答案为:D。
5.C
【详解】①pH=3的醋酸,溶液中氢离子浓度为0.001mol/L,溶液中氢氧根离子是水电离,根据常温下水的离子积,溶液中氢氧根离子的浓度为mol/L=1×10-11mol/L,即水电离的氢离子浓度为1×10-10mol/L;②0.01mol/LNaOH溶液,溶液中氢氧根离子的浓度为0.01mol/L,氢氧化钠溶液中氢离子是水电离的,根据常温下水的离子积,溶液中氢离子的浓度为mol/L=1×10-12mol/L,所以两溶液中水的氢离子浓度之比为1×10-11mol/L∶1×10-12mol/L=10∶1,故选C。
【点睛】准确判断酸溶液和碱溶液中水的电离情况是解题的关键。解答本题要注意酸溶液中氢氧根离子是水电离产生的,或碱溶液中氢离子是水电离产生的。
6.A
【详解】由图可知,温度都为T2时,压强P1先到达平衡,则压强P1>P2,压强越大,平衡时X的体积分数越小,说明增大压强平衡向正反应方向移动,则正反应是气体体积减小的反应,即a+b>c,压强都为P2时,温度T1先到达平衡,故温度T1>T2,温度越高,平衡时X的体积分数越大,说明升高温度平衡向逆反应方向移动,该反应的正反应为放热反应,即Q<0,故选:A。
7.B
【详解】A.在合成氨实际生产中,使气态氨变成液氨后及时从平衡混合物中分离出去,生成物浓度减小,平衡正向移动,则原料转化率增大,提高了原料的利用率,能用勒夏特列原理解释,故A不符合题意;
B.、、组成的平衡体系,加压后体系颜色变深是由于浓度增大,平衡未移动,不能用勒夏特列原理解释,故B符合题意;
C.根据,向重铬酸钾()溶液中滴加少量NaOH溶液,氢离子消耗,平衡逆向移动,因此溶液颜色由橙色变为黄色,能用勒夏特列原理解释,故C不符合题意;
D.,实验室中常用排饱和食盐水的方法收集氯气,氯离子浓度增大,抑制氯气的溶解,能用勒夏特列原理解释,故D不符合题意。
综上所述,答案为B。
8.C
【详解】图示反应物能量低于生成物能量,则反应为吸收能量的反应,①③④为吸热反应,②⑤⑥为放热反应,C项符合题意。
故选:C。
9.B
【分析】阳极与阴极产生的气体体积比为1:2,相当于电解水,pH变小,说明电解了含氧酸;
【详解】A.电解稀盐酸溶液,两极上分别为Cl-和H+放电,两极气体体积之比是1:1,A不符合题意;
B.电解稀硫酸,两极上分别为OH-和H+放电,消耗水,H+浓度增大,溶液的pH变小,B符合题意;
C.电解CuSO4溶液,阴极析出铜,如时间较少,没有气体放出,C不符合题意;
D.电解硝酸钾溶液,两极上分别为OH-和H+放电,消耗水,溶液呈中性,pH不变,D不符合题意;
故选B。
10.D
【详解】②中浓硫酸稀释过程中会放热,放出热量最多,最小;③中醋酸和氨水电离吸收热量,放出热量最少,最大;①和④放出的热量理论上相等;所以的大小顺序为③>①=④>②,故选D。
11.D
【详解】A.B为固体,没有浓度变化量,不能用B的浓度变化表示该反应的反应速率,故A错误;
B.恒容容器中,向容器中再加入1mol氦气,反应物、生成物的浓度不变,则反应速率不变,故B错误;
C.反应5min,测得D的浓度为0.75mol/L,D的物质的量为0.75mol/L×2L=1.5mol,故C错误;
D.反应5min,测得D的浓度为0.75mol/L,即D的浓度变化量为0.75mol/L;C表示的平均反应速率v(C)=0.3,则C的浓度变化量为0.3×5min=1.5mol/L,根据反应计量系数比等于浓度变化量之比,则0.75:1.5=2:x,解得x=4,故D正确;
答案选D。
12.C
【详解】A.HA的电离方程式为HAH++A-,血浆中pH=7.4,呈弱碱性,促进HA电离,胃中pH=1.0,呈酸性,抑制HA的电离,血浆中HA的电离程度比胃中大,A项正确;
B.Ka==1×10-3.0,胃中pH=1.0,c(H+)=0.1mol/L,则胃中=1×10-2.0,B项正确;
C.Ka==1×10-3.0,血浆中pH=7.4,c(H+)=10-7.4mol/L,则血浆中=1×104.4,=1+=1+1×104.4>1×104.4,C项错误;
D.假设离子不会穿过组织薄膜,而未电离的HA则可自由穿过该膜且达到平衡,故血浆与胃中c(HA)相同,D项正确;
答案选C。
13.B
【详解】A.在光照和点燃条件下都能发生反应,且相同,A不正确;
B.已知 , ,由于SO2(g)=SO2(l) △H<0,所以<△H2,B正确;
C.表示的燃烧热时,NH3(g)的化学计量数应为“1”,且水应呈液态,C不正确;
D.一定条件下 ,由于反应可逆,将和置于密闭容器中充分反应,放热小于,D不正确;
故选B。
14.A
【详解】A.根据图中信息,在时是加入C,平衡逆向移动A的物质的量增加,因此A的体积分数增大,即平衡时A的体积分数,故A正确;
B.平均摩尔质量等于气体质量除以气体物质的量,气体质量不变,该反应是等体积反应,气体物质的量不变,平均摩尔质量不变,因此容器内气体的平均相对分子质量不变,不能说明反应达到平衡,故B错误;
C.时刻正反应速率不变,逆反应速率增大,则改变的条件:向容器中加入C,故C错误;
D.反应是恒温,因此温度不变,平衡常数不变即平衡常数K:,故D错误;
答案为A。
15.B
【分析】电极a中SO2转化为H2SO4,发生氧化反应,则a电极为负极,发生的电极反应为;电极b中消耗O2,则b电极为正极,发生的电极反应为。
【详解】A.由分析可得,电极a为负极,电极b为正极,阳离子向正极移动,则质子从电极a向电极b移动,A错误;
B.电池总反应为,相同条件下,放电过程中,和的体积比为2∶1,B正确;
C.电极a附近发生的电极反应为,C错误;
D.电极b附近发生的电极反应为,D错误;
故选B。
16.(1)B
(2)B
(3)9:1
(4) < <
(5) 或
【详解】(1)向氨水中加入氯化铵固体,溶液中铵根离子浓度增大,电离平衡左移,溶液中氢氧根离子浓度减小,故错误;
②向氨水中通入氨气,一水合氨的浓度增大,电离平衡右移,溶液中氢氧根离子浓度增大,故正确;
③向氨水中加入强碱氢氧化钠固体,溶液中溶液中氢氧根离子浓度增大,故正确;
④向氨水中加入水稀释,溶液中氢氧根离子浓度减小,故错误;
②③正确,故选B;
(2)用蒸馏水稀释0.10mol/L的醋酸溶液时,溶液中的醋酸分子、醋酸根离子、氢离子的浓度均减小,温度不变,电离常数、水的离子积常数均不变;
A.由电离平衡常数公式可知,溶液中=,稀释时,醋酸根离子浓度减小,电离常数不变,则溶液中和的值减小,故A错误;
B.由电离平衡常数公式可知,溶液中=,稀释时,氢离子浓度减小,电离常数不变,则溶液中和的值增大,故B正确;
C.稀释时,氢离子浓度减小,水的离子积常数不变,则溶液中的值减小,故C错误;
D.稀释时,氢离子浓度减小,水的离子积常数不变,则溶液中氢氧根离子浓度增大,的值减小,故D错误;
故选B;
(3)由100℃时,将pH=9的氢氧化钠溶液与pH=4的盐酸溶液混合所得混合溶液pH=7即混合后溶液显碱性,可得:=10—5,解得;
(4)氨水的浓度越大,一水合氨的电离度越小,则α乙大于α甲,甲、乙两瓶氨水中之比为,由于α乙大于α甲,所以的值小于10,故答案为:<;<;
(5)联氨为二元弱碱,在水中的电离方程式与氨相似,第一步电离方程式:或,联氨为二元弱碱,联氨与硫酸形成的酸式盐的化学式为
17.(1) B
(2)
(3)2Cl-+2H2O2OH-+H2↑+Cl2↑
(4)阻止OH-进入阳极室,与Cl2发生反应Cl2+2NaOH=NaCl+NaClO+H2O
(5)a
(6)Cl2与水反应:Cl2+H2OHCl+HClO,增大HCl的浓度使平衡逆向移动,减少Cl2在水中的溶解,有利于Cl2逸出
【分析】Ⅰ(1)①甲为原电池,Fe失电子为负极,C为正极,铜离子在正极上得电子生成Cu;②乙为电解池,由电子流向可知,Fe为阴极,C为阳极,阳极上氯离子失去电子生成氯气;(2)若两池中均盛放 NaCl溶液,则甲池发生金属的吸氧腐蚀,正极为2H2O+O2+4e-=4OH-,负极为Fe-2e-=Fe2+,乙池为电解食盐水装置,阳极反应为4OH--4e-═O2↑+2H2O,阴极反应为2H++2e-=H2↑,Ⅱ电解饱和食盐时阳极阴离子Cl-、OH-放电,Cl-的放电能力强于OH-,阳极发生的方程式为:2Cl--2e-═Cl2↑,阴极:2H++2e-═H2↑;H2、NaOH在阴极,NaOH溶液的出口为d,Cl2在阳极,精制饱和食盐水从阳极进入,据此分析解题。
【详解】(1)①甲为原电池,Fe失电子为负极,C为正极,铜离子在正极上得电子生成Cu,故答案为:B;
②乙为电解池,由电子流向可知,Fe为阴极,C为阳极,阳极上氯离子失去电子生成氯气,则阳极的电极反应式为:2Cl--2e-=Cl2↑,故答案为:2Cl--2e-=Cl2↑;
(2)由以上分析可知,甲池中正极的电极反应式为2H2O+O2+4e-=4OH-,故答案为:2H2O+O2+4e-=4OH-;
(3)电解精制饱和食盐水的方法制取氯气、氢气、烧碱,反应的离子方程式为:2Cl-+2H2O2OH-+H2↑+Cl2↑,故答案为:2Cl-+2H2O2OH-+H2↑+Cl2↑;
(4)阳离子交换膜只能阳离子通过,阴离子和气体不能通过,用石墨作电极电解饱和氯化钠时,阳极上氯离子放电生成氯气,氯气不能通过阳离子交换膜而进入阴极,如果氯气进入阴极易和氢气混合产生爆炸,且易和氢氧化钠溶液反应生成氯化钠、次氯酸钠而导致制取的氢氧化钠不纯;故答案为:阻止OH-进入阳极室,与Cl2发生反应Cl2+2NaOH=NaCl+NaClO+H2O;
(5)Cl2在阳极,依据装置图分析可知精制饱和食盐水从阳极进入,即进口为a,故答案为:a;
(6)阳极产生的氯气,氯气能够溶于水,存在着下列平衡,Cl2+H2OHCl+HClO,加入盐酸,增大氢离子浓度,平衡逆向移动,有利于氯气逸出收集,故答案为:Cl2+H2OHCl+HClO,用盐酸控制阳极的pH,增大氢离子浓度,平衡逆向移动,有利于氯气逸出收集。
18.(1)②>④>①>③
(2)
(3)<
(4)>
(5)
(6)
【详解】(1)根据题目中的电离平衡常数分析,平衡常数越大,弱酸的酸性越强,对应酸根离子水解程度越弱,钠盐的碱性越弱。已知酸性CH3COOH>H2CO3>HCN>,4种溶液①NaCN溶液、②NaOH溶液、③CH3COONa溶液、④Na2CO3溶液中氢氧化钠为强碱,碱性最大,则四种溶液碱性大小是②>④>①>③,故这4种溶液的pH由大到小的顺序是②>④>①>③;
(2))NaCN溶液呈碱性的原因是CN-发生水解反应生成HCN和氢氧根离子,离子方程式是;
(3)等体积③CH3COONa溶液和④Na2CO3溶液中分别滴加盐酸至溶液呈中性,由于同浓度下,CH3COONa溶液的pH较小,则需要盐酸中和至中性的量较少,故答案是<;
(4)若a=0.1 mol·L 1,等体积混合后,与氢氧化钠恰好反应生成醋酸钠和水,醋酸钠水解使得溶液呈碱性,则可推知,将amol·L 1的醋酸和0.1mol·L 1NaOH溶液等体积混合后,溶液的pH=7,则醋酸的浓度a大于0.1mol·L 1,反应后剩余一些醋酸,使得醋酸和醋酸钠共存,溶液呈中性,故答案是>;
(5)溶液中以钠离子和碳酸根离子为主,碳酸根离子水解生成碳酸氢根离子和氢氧根离子,使得溶液显碱性,水也会电离出氢氧根离子,故氢氧根离子浓度大于碳酸氢根离子大于氢离子,所以离子浓度大小为;
(6)由于醋酸的酸性比HCN强,故向NaCN溶液中通入醋酸反应生成HCN和醋酸根离子,则发生反应的离子方程式为。
19.(1) -31.4 >
(2) b <
【详解】(1)①根据盖斯定律,③-②-①可得;
②当反应达到平衡时,正逆反应速率相等,则,,温度为T1℃时,K=2,温度为T2℃时 ,平衡逆向移动,反应为放热反应,可知T2>T1,又逆反应气体分子数多,物质的量与温度增大均导致压强变大。
故答案为:-31.4、>;
(2)①从图中可以看出的活化能最大,因此反应速率由决定;
②图中显示是吸热反应,正向体积变小,催化剂不影响平衡;增大压强平衡正向移动,可以增大二氧化碳转化率;增大二氧化碳和氢气的初始投料比,会增加氢气的转化率,二氧化碳的转化率不会增加;
③由图可知,升高温度,甲醇的产率下降,升高温度平衡逆向移动,反应正向放热;
故答案为:、b、<。
答案第8页,共9页
答案第9页,共9页
同课章节目录
