高中化学必修第一册《第三节 氧化还原反应》PPT课件(共20张PPT)
文档属性
| 名称 | 高中化学必修第一册《第三节 氧化还原反应》PPT课件(共20张PPT) |  | |
| 格式 | ppt | ||
| 文件大小 | 1.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-17 10:59:07 | ||
图片预览






文档简介
(共20张PPT)
氧化还原反应
得到氧,被氧化(氧化反应)
失去氧,被还原(还原反应)
一、多角度认识氧化还原反应
1.从得失氧的角度可得出氧化还原反应的定义:
一种物质失去氧,同时另一种物质得到氧的反应,叫做氧化还原反应(同步伴随)。
CuO +H2 Cu+H2O
高温
2CuO+C 2Cu+CO2
得氧, 被氧化(氧化反应)
失氧, 被还原(还原反应)
Fe2O3 + 3CO ==== 2Fe + 3CO2
练一练
请从得失氧的角度判断下列反应是否为氧化还原反应?
失氧, 被还原(还原反应)
得氧, 被氧化(氧化反应)
化合价升高,氧化反应
化合价降低,还原反应
H2 + CuO H2O + Cu
+2
0
0
+1
想一想
如下氧化还原反应中,除了物质得失氧以外还有什么特点?
Fe2O3 + 3CO 2Fe + 3CO2
+3
+2
0
+4
高温
化合价降低,还原反应
化合价升高,氧化反应
2.从化合价升降的角度定义:
有元素化合价升降的反应,叫氧化还原反应。
化合价升高发生氧化反应
化合价降低发生还原反应
氧化还原反应的特征:
有元素化合价的升降
氧化还原反应的判断依据是:
元素有无化合价的升降
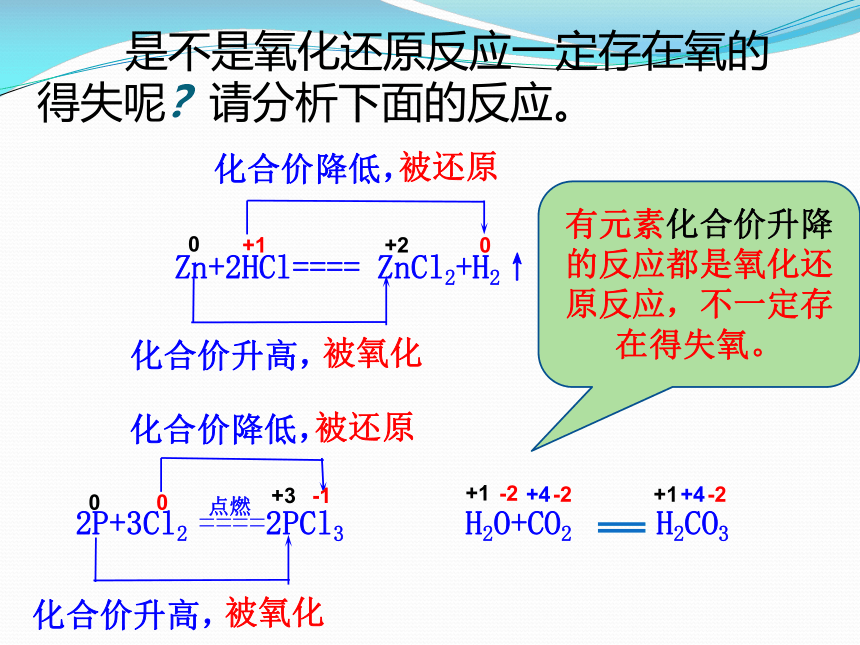
是不是氧化还原反应一定存在氧的得失呢?请分析下面的反应。
Zn+2HCl==== ZnCl2+H2↑
化合价降低,
被还原
化合价升高,
被氧化
2P+3Cl2 ====2PCl3
点燃
化合价降低,
被还原
化合价升高,
被氧化
有元素化合价升降的反应都是氧化还原反应,不一定存在得失氧。
0
+1
+2
0
0
0
+3
-1
H2O+CO2 H2CO3
+1
+1
-2
-2
-2
+4
+4
想一想
1、什么是稳定结构?
2、原子在化学变化中,都有通过不同方式达到稳定结构的趋势。方式有哪些?
稀有气体原子结构(最外层为2e-或8e-)
Na
Cl-
Na+
Cl
Na+
Cl-
结论:1.通过电子得失可以达到稳定结构
2.电子得失导致元素化合价升降
H2+Cl2 2HCl
●
●
●
●
●
●
●
●
结论: 1.通过形成共用电子对达到稳定结构
2.共用电子对的偏移(偏向或偏离) 导致元素化合价升降
H
点燃
0
0
+1
-1
氧化还原反应的实质:
有电子转移(得失或偏移)的反应都是氧化还原反应。
得电子发生还原反应
失电子发生氧化反应
3.从电子转移的角度分析
总结:
失电子
(或电子对偏离)
→
化合价
升高
→
氧化反应
得电子
(或电子对偏向)
→
化合价
降低
→
还原反应
↓
本质
↓
特征
规律:升、失、氧;降、得、还
下面是我们学过的生成CO2的化学反应。请判断是否是氧化还原反应。
CaCO3 ==== CaO + CO2↑
高温
C + O2 ==== CO2
点燃
CaCO3 + 2HCl ==== CaCl2 + CO2↑ + H2O
不是
是
不是
【练一练】
+2
+2
+4
+4
+4
0
0
-2
+2
+2
+4
+4
-1
-1
根据元素化合价是否有变化把化学反应分为:
氧化还原反应
非氧化还原反应
我们初中学过的四大基本反应类型有哪些?
氧化还原反应与四大基本反应类型的关系是怎样的?
化合反应、分解反应、置换反应、复分解反应
【想一想】
H2O+CO2 H2CO3
C+O2 CO2
2H2O2 2H2O+O2
H2CO3 H2O+CO2
Fe+CuSO4 FeSO4+Cu
NaOH+HCl NaCl+H2O
下列反应分别属于哪类基本反应?
点燃
化合反应
MnO2
分解反应
置换反应
复分解反应
0
0
+4
-2
-1
0
-2
0
+2
+2
0
-1
-1
-2
-2
氧化还原反应
非氧化还原反应
置换反应
分解反应
复分解反应
化合反应
化学反应
二、氧化还原反应和四大基本反应类型的关系:
1.辨析下列说法的正误。
(1)氧化还原反应中一定有氧元素参加。 ( )
(2)有单质生成的反应一定是氧化还原反应。 ( )
(3)在氧化还原反应中可能只有元素的化合价的升高,而无化合价的降低。 ( )
x
x
x
3O2 2O3
0
0
2.下列反应不属于四种基本反应类型,但属于氧化还原反应的是 ( )
A.Fe+CuSO4====FeSO4+Cu
B.AgNO3+NaCl====AgCl↓+NaNO3
C.Fe2O3+3CO ==== 2Fe+3CO2
D.MgCl2(熔融)=== Mg+Cl2↑
高温
电解
C
0
0
+2
+2
+3
+4
+2
0
+2
0
-2
0
(复分解反应)
(置换反应)
(分解反应)
3.下列反应属于氧化还原反应的是( )
A.CuO+2HCl====CuCl2 +H2O
B.CaCO3+2HCl====2NaCl+CO2↑+H2O
C.2KMnO4====K2MnO4+MnO2+O2 ↑
D.Ca(OH)2+CO2====CaCO3↓+ H2O
C
+7
0
-2
+6
+4
(复分解反应)
(复分解反应)
(复分解反应)
(分解反应)
课堂小结
一、多角度认识氧化还原反应
1.从得失氧的角度
2.从化合价升降的角度
3.从电子转移的角度
二、氧化还原反应和四大基本反应类型的关系
课后作业:课本38页 1、4、5、6
氧化还原反应
得到氧,被氧化(氧化反应)
失去氧,被还原(还原反应)
一、多角度认识氧化还原反应
1.从得失氧的角度可得出氧化还原反应的定义:
一种物质失去氧,同时另一种物质得到氧的反应,叫做氧化还原反应(同步伴随)。
CuO +H2 Cu+H2O
高温
2CuO+C 2Cu+CO2
得氧, 被氧化(氧化反应)
失氧, 被还原(还原反应)
Fe2O3 + 3CO ==== 2Fe + 3CO2
练一练
请从得失氧的角度判断下列反应是否为氧化还原反应?
失氧, 被还原(还原反应)
得氧, 被氧化(氧化反应)
化合价升高,氧化反应
化合价降低,还原反应
H2 + CuO H2O + Cu
+2
0
0
+1
想一想
如下氧化还原反应中,除了物质得失氧以外还有什么特点?
Fe2O3 + 3CO 2Fe + 3CO2
+3
+2
0
+4
高温
化合价降低,还原反应
化合价升高,氧化反应
2.从化合价升降的角度定义:
有元素化合价升降的反应,叫氧化还原反应。
化合价升高发生氧化反应
化合价降低发生还原反应
氧化还原反应的特征:
有元素化合价的升降
氧化还原反应的判断依据是:
元素有无化合价的升降
是不是氧化还原反应一定存在氧的得失呢?请分析下面的反应。
Zn+2HCl==== ZnCl2+H2↑
化合价降低,
被还原
化合价升高,
被氧化
2P+3Cl2 ====2PCl3
点燃
化合价降低,
被还原
化合价升高,
被氧化
有元素化合价升降的反应都是氧化还原反应,不一定存在得失氧。
0
+1
+2
0
0
0
+3
-1
H2O+CO2 H2CO3
+1
+1
-2
-2
-2
+4
+4
想一想
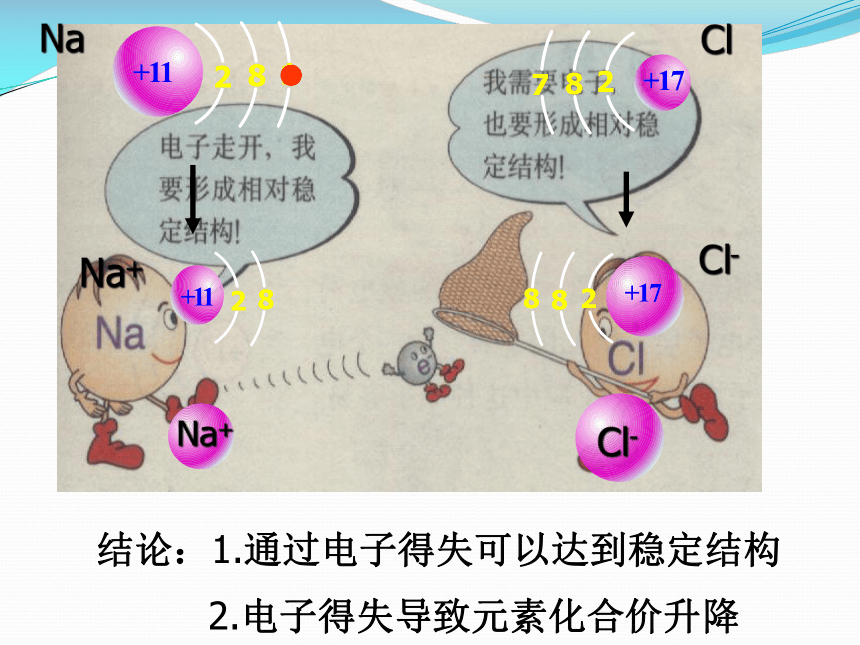
1、什么是稳定结构?
2、原子在化学变化中,都有通过不同方式达到稳定结构的趋势。方式有哪些?
稀有气体原子结构(最外层为2e-或8e-)
Na
Cl-
Na+
Cl
Na+
Cl-
结论:1.通过电子得失可以达到稳定结构
2.电子得失导致元素化合价升降
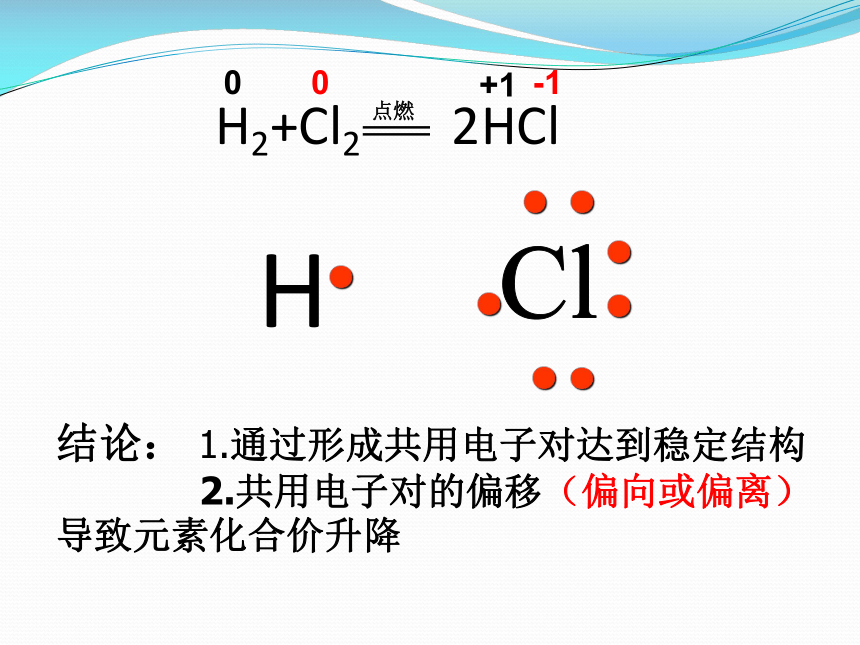
H2+Cl2 2HCl
●
●
●
●
●
●
●
●
结论: 1.通过形成共用电子对达到稳定结构
2.共用电子对的偏移(偏向或偏离) 导致元素化合价升降
H
点燃
0
0
+1
-1
氧化还原反应的实质:
有电子转移(得失或偏移)的反应都是氧化还原反应。
得电子发生还原反应
失电子发生氧化反应
3.从电子转移的角度分析
总结:
失电子
(或电子对偏离)
→
化合价
升高
→
氧化反应
得电子
(或电子对偏向)
→
化合价
降低
→
还原反应
↓
本质
↓
特征
规律:升、失、氧;降、得、还
下面是我们学过的生成CO2的化学反应。请判断是否是氧化还原反应。
CaCO3 ==== CaO + CO2↑
高温
C + O2 ==== CO2
点燃
CaCO3 + 2HCl ==== CaCl2 + CO2↑ + H2O
不是
是
不是
【练一练】
+2
+2
+4
+4
+4
0
0
-2
+2
+2
+4
+4
-1
-1
根据元素化合价是否有变化把化学反应分为:
氧化还原反应
非氧化还原反应
我们初中学过的四大基本反应类型有哪些?
氧化还原反应与四大基本反应类型的关系是怎样的?
化合反应、分解反应、置换反应、复分解反应
【想一想】
H2O+CO2 H2CO3
C+O2 CO2
2H2O2 2H2O+O2
H2CO3 H2O+CO2
Fe+CuSO4 FeSO4+Cu
NaOH+HCl NaCl+H2O
下列反应分别属于哪类基本反应?
点燃
化合反应
MnO2
分解反应
置换反应
复分解反应
0
0
+4
-2
-1
0
-2
0
+2
+2
0
-1
-1
-2
-2
氧化还原反应
非氧化还原反应
置换反应
分解反应
复分解反应
化合反应
化学反应
二、氧化还原反应和四大基本反应类型的关系:
1.辨析下列说法的正误。
(1)氧化还原反应中一定有氧元素参加。 ( )
(2)有单质生成的反应一定是氧化还原反应。 ( )
(3)在氧化还原反应中可能只有元素的化合价的升高,而无化合价的降低。 ( )
x
x
x
3O2 2O3
0
0
2.下列反应不属于四种基本反应类型,但属于氧化还原反应的是 ( )
A.Fe+CuSO4====FeSO4+Cu
B.AgNO3+NaCl====AgCl↓+NaNO3
C.Fe2O3+3CO ==== 2Fe+3CO2
D.MgCl2(熔融)=== Mg+Cl2↑
高温
电解
C
0
0
+2
+2
+3
+4
+2
0
+2
0
-2
0
(复分解反应)
(置换反应)
(分解反应)
3.下列反应属于氧化还原反应的是( )
A.CuO+2HCl====CuCl2 +H2O
B.CaCO3+2HCl====2NaCl+CO2↑+H2O
C.2KMnO4====K2MnO4+MnO2+O2 ↑
D.Ca(OH)2+CO2====CaCO3↓+ H2O
C
+7
0
-2
+6
+4
(复分解反应)
(复分解反应)
(复分解反应)
(分解反应)
课堂小结
一、多角度认识氧化还原反应
1.从得失氧的角度
2.从化合价升降的角度
3.从电子转移的角度
二、氧化还原反应和四大基本反应类型的关系
课后作业:课本38页 1、4、5、6
