高中化学必修第一册第一章《物质及其变化》复习课PPT课件(共26张PPT)
文档属性
| 名称 | 高中化学必修第一册第一章《物质及其变化》复习课PPT课件(共26张PPT) |  | |
| 格式 | ppt | ||
| 文件大小 | 878.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-17 12:22:11 | ||
图片预览





文档简介
(共26张PPT)
第一章· 物质及其变化
复 习 课
创原家独
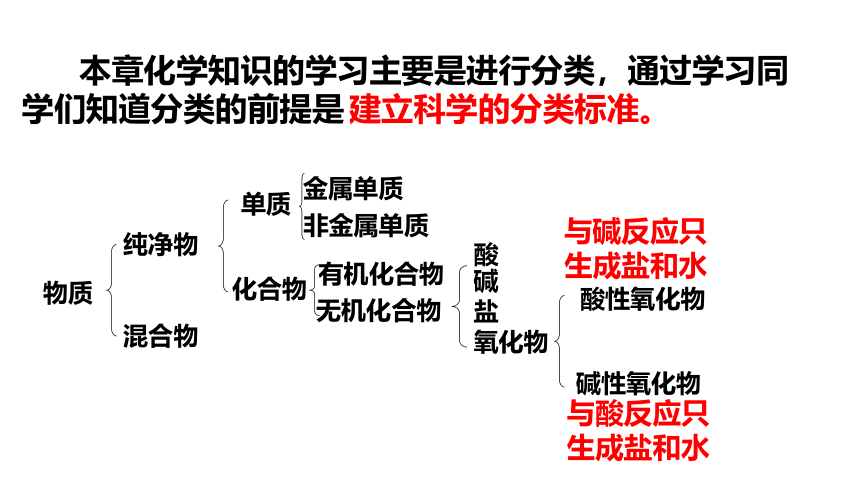
本章化学知识的学习主要是进行分类,通过学习同学们知道分类的前提是
建立科学的分类标准。
物质
纯净物
金属单质
非金属单质
化合物
酸
碱
盐
氧化物
单质
混合物
有机化合物
无机化合物
酸性氧化物
碱性氧化物
与碱反应只生成盐和水
与酸反应只生成盐和水
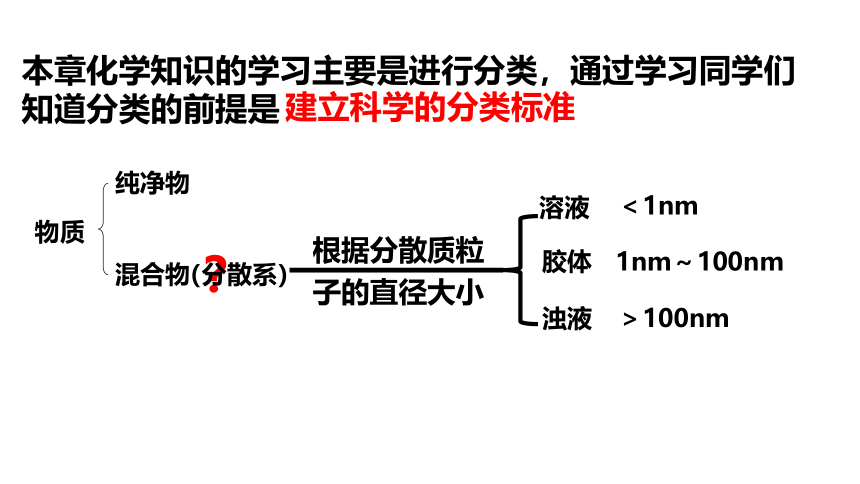
本章化学知识的学习主要是进行分类,通过学习同学们知道分类的前提是
建立科学的分类标准
物质
纯净物
混合物
?
(分散系)
溶液
浊液
根据分散质粒
子的直径大小
胶体
<1nm
1nm~100nm
>100nm
网
创原家独
一、胶体和分散系
分散系:
分散质:
——分散系中被分散成微粒的物质。
分散剂:
——把一种(或几种)物质的微粒分散于另一种(或几种)物质里所形成的混合物。
——分散系中容纳被分散的微粒在其中的物质。
分散质分散在分散剂里形成分散系
胶 体:
——分散质粒子直径介于1nm~100nm之间的分散系
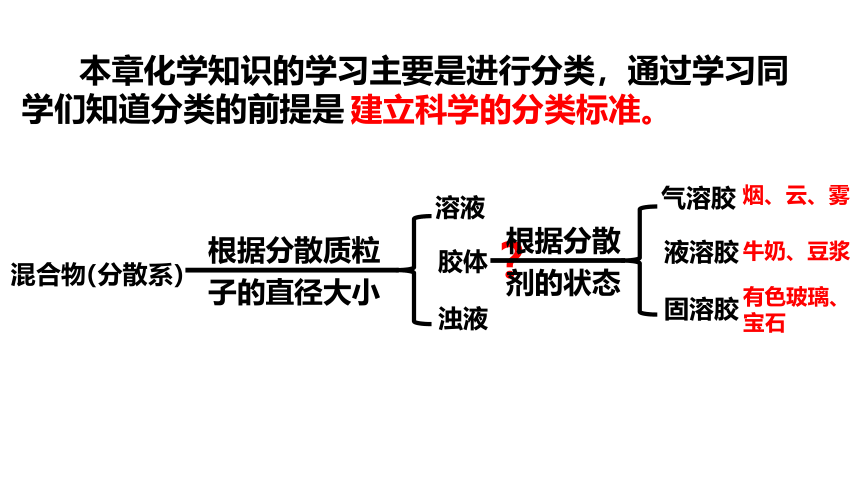
本章化学知识的学习主要是进行分类,通过学习同学们知道分类的前提是
建立科学的分类标准。
混合物
?
(分散系)
溶液
浊液
根据分散质粒
子的直径大小
胶体
气溶胶
固溶胶
根据分散
剂的状态
液溶胶
烟、云、雾
牛奶、豆浆
有色玻璃、宝石
科
胶体的制备
向沸腾的水中滴加FeCl3的饱和溶液至液体呈红褐色
胶体的性质
一束光通过胶体时,从侧面可观察到胶体里产生一条光亮的“通路”。
丁达尔效应
区别溶液和胶体的有效方法
本章化学知识的学习主要是进行分类,通过学习同学们知道分类的前提是
建立科学的分类标准。
物质
纯净物
金属单质
非金属单质
化合物
单质
混合物
电解质
非电解质
?
电解质:在水溶液中或者熔融状态下能够导电的化合物就叫做电解质
非电解质:在水溶液中和熔融状态下都不能导电的化合物就叫做非电解质
学
二、电解质和非电解质
电解质:在水溶液中或者熔融状态下能导电的化合物
非电解质:在水溶液中和熔融状态下都不能导电的化合物
主要包括:酸、碱、盐、活泼金属氧化物等
主要包括:非金属氧化物、多数有机物、NH3等
例:下列物质哪些属于电解质,哪些是非电解质?
(1)NaCl (2)NaOH (3)H2SO4 (4)H2O (5)盐酸溶液 (6)小苏打(NaHCO3) (7)Fe (8)Cu(OH)2 (9)Na2O (10) CO2 (11)蔗糖 (12)乙醇 (13)H2CO3
电解质:(1)(2)(3)(4)(6)(8)(9)(13)
非电解质:(10)(11)(12)
本章化学知识的学习主要是进行分类,通过学习同学们知道分类的前提是
建立科学的分类标准。
离子反应
非离子反应
根据是否有离
子参加或生成
化学反应
三、离子反应
1、溶液导电的原因:
电解质在溶于水或熔融状态下,电离为可以自由移动的离子
存在可以自由移动的离子
KNO3 = K+ + NO3- HNO3 = H+ + NO3-
BaCl2 = Ba2+ + 2Cl- HCl = H+ + Cl-
NaOH = Na+ + OH- H2SO4 = 2H+ + SO42-
酸:电离时生成的阳离子全部是氢离子的化合物。
碱?盐?
碱:电离时生成的阴离子全部是氢氧根离子的化合物。
盐:电离时生成金属阳离子(或者铵根离子)和酸根的化合物。
三、离子反应
1、溶液导电的原因:
存在可以自由移动的离子
2、离子方程式:
用实际参加反应的离子符号来表示反应的式子
(1)写出化学方程式
(2)将易溶于水且易电离的物质拆写成离子形式,其余物质仍以化学式表示
(3)删去方程式两边不参加反应的离子,并将方程式化成最简
(4)检查方程式两边元素的原子个数和电荷总数是否相等
练习 离子方程式正误判断
①铁与稀盐酸反应:2Fe+6H+ = 2Fe3++3H2↑
②铝与稀盐酸反应:Al+3H+ = Al3++H2↑
③2FeCl3+Fe = 3FeCl2 (正确)
Fe3++Fe = 2Fe2+
√
④碳酸钡和稀硝酸反应
CO32- +2H+ = H2O+CO2↑
BaCO3+2H+ = Ba2++H2O+CO2↑
⑤氢氧化钡和稀硫酸
Ba2++SO42-=BaSO4↓
√
Ba2++OH-+H++SO42-=BaSO4↓+H2O
Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O
本章化学知识的学习主要是进行分类,通过学习同学们知道分类的前提是
建立科学的分类标准。
氧化还原反应
非氧化还原反应
根据是否有
电子转移
化学反应
四、氧化还原反应
1、概念:
◆从得氧失氧角度分析
一种物质得到氧被氧化,同时另一种物质失去氧被还原的化学反应是氧化还原反应。
特点:局限于得氧失氧的反应,是氧化还原反应的表观现象。
◆从化合价升降角度分析
有元素化合价升降的化学反应
特点:可作为氧化还原反应的判断依据
◆从电子转移角度分析
有电子转移(得失或共用电子对偏移)的化学反应
特点:揭示氧化还原反应的本质
2.用双线桥法、单桥法分析氧化还原反应
②2KClO3 2KCl+3O2↑
2Al + Fe2O3 2Fe + A l2O3
失去2×3e-,化合价升高,被氧化
得到2×3e-,化合价降低,被还原
0
+3
0
+3
-2
-1
0
+5
得到2×6e-,化合价降低,被还原
失去6×2e-,化合价升高,被氧化
6e-
12e-
单线桥法
只要标明电子转移的数目(不要标明“得、失”电子)
+4
0
+2
-1
③ MnO2+ 4HCl(浓) MnCl2 + Cl2 ↑+ 2H2O
失去2×e-,化合价升高,被氧化
得到2e-,化合价降低,被还原
2e-
④3Cu + 8HNO3(稀) 3Cu(NO3)2+ 2 NO↑+ 4H2O
0
+2
+2
+5
得到2×3e-,化合价降低,被还原
失去3×2e-,化合价升高,被氧化
6e-
氧化剂:定义:得到电子(或电子对偏向)的物质
还原剂:定义:失去电子(或电子对偏离)的物质
3.氧化剂和还原剂
表现:在反应时所含元素化合价降低
表现:在反应时所含元素化合价升高
氧化产物:还原剂被氧化后的生成物
还原产物:氧化剂被还原后的生成物
失电子,化合价升高,被氧化,发生氧化反应
氧化剂 + 还原剂 = 还原产物 + 氧化产物
得电子,化合价降低,被还原,发生还原反应
4.氧化性和还原性
氧化性: 得电子的能力( 氧化剂的性质 )
还原性: 失电子的能力( 还原剂的性质 )
氧化性:氧化剂>氧化产物 还原性:还原剂>还原产物
元素处于最低价:只有还原性,无氧化性
元素处于最高价:只有氧化性,无还原性
元素处于中间价态:具有双重性
练习 在Fe2+、Fe3+、Al3+、H+、S、Fe、S2-、HCl中:
只有还原性的是: ,
只有氧化性的是: ,
既有氧化性又有还原性的是: 。
Fe、S2-
Fe3+、Al3+、H+
Fe2+ 、S、HCl
4.氧化性和还原性
氧化性: 得电子的能力( 氧化剂的性质 )
还原性: 失电子的能力( 还原剂的性质 )
氧化性:氧化剂>氧化产物 还原性:还原剂>还原产物
练习 根据下列反应判断有关物质还原性强弱的顺序 ( )
H2SO3>I->Fe2+ B. I- > Fe2+>H2SO3
Fe2+>I- >H2SO3 C. Fe2+>H2SO3>I-
H2SO3 + I2 + H2O == 2HI + H2SO4
2FeCl3 + 2HI == 2FeCl2 + 2HCl + I2
A
例:已知M2O7 x-+ 3S 2-+ 14H+ = 2 M3+3S↓+7H2O,则M2O7 x-中的M的化合价为 ( )
A.+2价 B.+3价 C.+4价 D.+6价
章节综合性例题:
方法1:离子方程式电荷守恒
(x-)+3×(2-)+14×(1+)=2×(3+)
x=2
M为+6价
方法2:氧化还原反应电子得失守恒
S化合价升高失电子:3×2e-=6e-
设M2O7 x-中的M的化合价为+a价,其得电子:2×(a-3)e-=6e-
a=6
M为+6价
例:已知Cu+HNO3——Cu(NO3)2+NO↑+H2O
1.配平该反应式
2.用单线桥标出电子转移方向和数目
3.指出氧化剂、还原剂、氧化产物和还原产物
4.还原性: > .
5.氧化性: > .
6.若生成60g NO则被还原的硝酸的质量为 g
7.离子方程式为: .
例:已知Cu+HNO3——Cu(NO3)2+NO↑+H2O
1.配平该反应式
Cu + HNO3—— Cu(NO3)2 + NO↑+ H2O
↑2
↓3
3
2
3
8
4
——
例:已知Cu+HNO3——Cu(NO3)2+NO↑+H2O
2.用单线桥标出电子转移方向和数目
3Cu + 8HNO3 = 3Cu(NO3)2 + 2NO↑ + 4H2O
6e-
例:已知Cu+HNO3——Cu(NO3)2+NO↑+H2O
3.指出氧化剂、还原剂、氧化产物和还原产物
3Cu + 8HNO3 = 3Cu(NO3)2 + 2NO↑ + 4H2O
还原剂
氧化剂
氧化产物
还原产物
4.还原性: > .
5.氧化性: > .
Cu
NO
HNO3
Cu(NO3)2
例:已知Cu+HNO3——Cu(NO3)2+NO↑+H2O
6.若生成60g NO则被还原的硝酸的质量为 g
3Cu + 8HNO3 = 3Cu(NO3)2 + 2NO↑ + 4H2O
2×63
2×30
60g
126g
126
7.离子方程式为:
3Cu + 8H+ + 2NO3- = 3Cu2+ + 2NO↑ + 4H2O
第一章· 物质及其变化
复 习 课
创原家独
本章化学知识的学习主要是进行分类,通过学习同学们知道分类的前提是
建立科学的分类标准。
物质
纯净物
金属单质
非金属单质
化合物
酸
碱
盐
氧化物
单质
混合物
有机化合物
无机化合物
酸性氧化物
碱性氧化物
与碱反应只生成盐和水
与酸反应只生成盐和水
本章化学知识的学习主要是进行分类,通过学习同学们知道分类的前提是
建立科学的分类标准
物质
纯净物
混合物
?
(分散系)
溶液
浊液
根据分散质粒
子的直径大小
胶体
<1nm
1nm~100nm
>100nm
网
创原家独
一、胶体和分散系
分散系:
分散质:
——分散系中被分散成微粒的物质。
分散剂:
——把一种(或几种)物质的微粒分散于另一种(或几种)物质里所形成的混合物。
——分散系中容纳被分散的微粒在其中的物质。
分散质分散在分散剂里形成分散系
胶 体:
——分散质粒子直径介于1nm~100nm之间的分散系
本章化学知识的学习主要是进行分类,通过学习同学们知道分类的前提是
建立科学的分类标准。
混合物
?
(分散系)
溶液
浊液
根据分散质粒
子的直径大小
胶体
气溶胶
固溶胶
根据分散
剂的状态
液溶胶
烟、云、雾
牛奶、豆浆
有色玻璃、宝石
科
胶体的制备
向沸腾的水中滴加FeCl3的饱和溶液至液体呈红褐色
胶体的性质
一束光通过胶体时,从侧面可观察到胶体里产生一条光亮的“通路”。
丁达尔效应
区别溶液和胶体的有效方法
本章化学知识的学习主要是进行分类,通过学习同学们知道分类的前提是
建立科学的分类标准。
物质
纯净物
金属单质
非金属单质
化合物
单质
混合物
电解质
非电解质
?
电解质:在水溶液中或者熔融状态下能够导电的化合物就叫做电解质
非电解质:在水溶液中和熔融状态下都不能导电的化合物就叫做非电解质
学
二、电解质和非电解质
电解质:在水溶液中或者熔融状态下能导电的化合物
非电解质:在水溶液中和熔融状态下都不能导电的化合物
主要包括:酸、碱、盐、活泼金属氧化物等
主要包括:非金属氧化物、多数有机物、NH3等
例:下列物质哪些属于电解质,哪些是非电解质?
(1)NaCl (2)NaOH (3)H2SO4 (4)H2O (5)盐酸溶液 (6)小苏打(NaHCO3) (7)Fe (8)Cu(OH)2 (9)Na2O (10) CO2 (11)蔗糖 (12)乙醇 (13)H2CO3
电解质:(1)(2)(3)(4)(6)(8)(9)(13)
非电解质:(10)(11)(12)
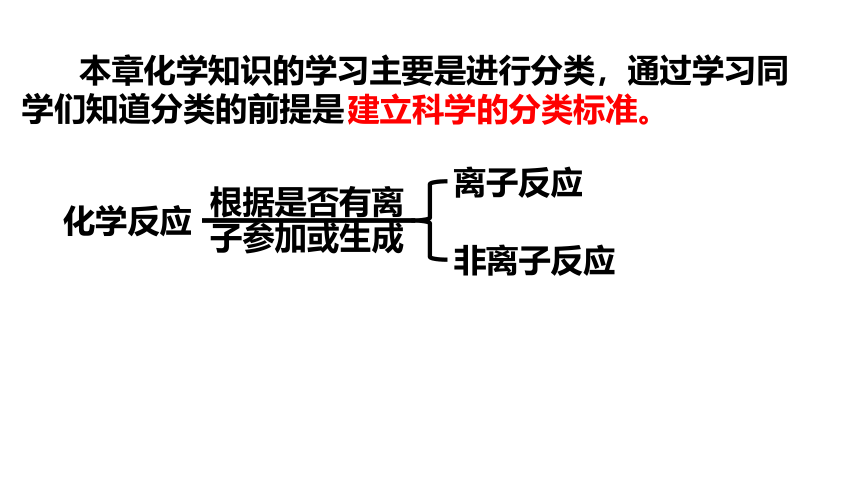
本章化学知识的学习主要是进行分类,通过学习同学们知道分类的前提是
建立科学的分类标准。
离子反应
非离子反应
根据是否有离
子参加或生成
化学反应
三、离子反应
1、溶液导电的原因:
电解质在溶于水或熔融状态下,电离为可以自由移动的离子
存在可以自由移动的离子
KNO3 = K+ + NO3- HNO3 = H+ + NO3-
BaCl2 = Ba2+ + 2Cl- HCl = H+ + Cl-
NaOH = Na+ + OH- H2SO4 = 2H+ + SO42-
酸:电离时生成的阳离子全部是氢离子的化合物。
碱?盐?
碱:电离时生成的阴离子全部是氢氧根离子的化合物。
盐:电离时生成金属阳离子(或者铵根离子)和酸根的化合物。
三、离子反应
1、溶液导电的原因:
存在可以自由移动的离子
2、离子方程式:
用实际参加反应的离子符号来表示反应的式子
(1)写出化学方程式
(2)将易溶于水且易电离的物质拆写成离子形式,其余物质仍以化学式表示
(3)删去方程式两边不参加反应的离子,并将方程式化成最简
(4)检查方程式两边元素的原子个数和电荷总数是否相等
练习 离子方程式正误判断
①铁与稀盐酸反应:2Fe+6H+ = 2Fe3++3H2↑
②铝与稀盐酸反应:Al+3H+ = Al3++H2↑
③2FeCl3+Fe = 3FeCl2 (正确)
Fe3++Fe = 2Fe2+
√
④碳酸钡和稀硝酸反应
CO32- +2H+ = H2O+CO2↑
BaCO3+2H+ = Ba2++H2O+CO2↑
⑤氢氧化钡和稀硫酸
Ba2++SO42-=BaSO4↓
√
Ba2++OH-+H++SO42-=BaSO4↓+H2O
Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O
本章化学知识的学习主要是进行分类,通过学习同学们知道分类的前提是
建立科学的分类标准。
氧化还原反应
非氧化还原反应
根据是否有
电子转移
化学反应
四、氧化还原反应
1、概念:
◆从得氧失氧角度分析
一种物质得到氧被氧化,同时另一种物质失去氧被还原的化学反应是氧化还原反应。
特点:局限于得氧失氧的反应,是氧化还原反应的表观现象。
◆从化合价升降角度分析
有元素化合价升降的化学反应
特点:可作为氧化还原反应的判断依据
◆从电子转移角度分析
有电子转移(得失或共用电子对偏移)的化学反应
特点:揭示氧化还原反应的本质
2.用双线桥法、单桥法分析氧化还原反应
②2KClO3 2KCl+3O2↑
2Al + Fe2O3 2Fe + A l2O3
失去2×3e-,化合价升高,被氧化
得到2×3e-,化合价降低,被还原
0
+3
0
+3
-2
-1
0
+5
得到2×6e-,化合价降低,被还原
失去6×2e-,化合价升高,被氧化
6e-
12e-
单线桥法
只要标明电子转移的数目(不要标明“得、失”电子)
+4
0
+2
-1
③ MnO2+ 4HCl(浓) MnCl2 + Cl2 ↑+ 2H2O
失去2×e-,化合价升高,被氧化
得到2e-,化合价降低,被还原
2e-
④3Cu + 8HNO3(稀) 3Cu(NO3)2+ 2 NO↑+ 4H2O
0
+2
+2
+5
得到2×3e-,化合价降低,被还原
失去3×2e-,化合价升高,被氧化
6e-
氧化剂:定义:得到电子(或电子对偏向)的物质
还原剂:定义:失去电子(或电子对偏离)的物质
3.氧化剂和还原剂
表现:在反应时所含元素化合价降低
表现:在反应时所含元素化合价升高
氧化产物:还原剂被氧化后的生成物
还原产物:氧化剂被还原后的生成物
失电子,化合价升高,被氧化,发生氧化反应
氧化剂 + 还原剂 = 还原产物 + 氧化产物
得电子,化合价降低,被还原,发生还原反应
4.氧化性和还原性
氧化性: 得电子的能力( 氧化剂的性质 )
还原性: 失电子的能力( 还原剂的性质 )
氧化性:氧化剂>氧化产物 还原性:还原剂>还原产物
元素处于最低价:只有还原性,无氧化性
元素处于最高价:只有氧化性,无还原性
元素处于中间价态:具有双重性
练习 在Fe2+、Fe3+、Al3+、H+、S、Fe、S2-、HCl中:
只有还原性的是: ,
只有氧化性的是: ,
既有氧化性又有还原性的是: 。
Fe、S2-
Fe3+、Al3+、H+
Fe2+ 、S、HCl
4.氧化性和还原性
氧化性: 得电子的能力( 氧化剂的性质 )
还原性: 失电子的能力( 还原剂的性质 )
氧化性:氧化剂>氧化产物 还原性:还原剂>还原产物
练习 根据下列反应判断有关物质还原性强弱的顺序 ( )
H2SO3>I->Fe2+ B. I- > Fe2+>H2SO3
Fe2+>I- >H2SO3 C. Fe2+>H2SO3>I-
H2SO3 + I2 + H2O == 2HI + H2SO4
2FeCl3 + 2HI == 2FeCl2 + 2HCl + I2
A
例:已知M2O7 x-+ 3S 2-+ 14H+ = 2 M3+3S↓+7H2O,则M2O7 x-中的M的化合价为 ( )
A.+2价 B.+3价 C.+4价 D.+6价
章节综合性例题:
方法1:离子方程式电荷守恒
(x-)+3×(2-)+14×(1+)=2×(3+)
x=2
M为+6价
方法2:氧化还原反应电子得失守恒
S化合价升高失电子:3×2e-=6e-
设M2O7 x-中的M的化合价为+a价,其得电子:2×(a-3)e-=6e-
a=6
M为+6价
例:已知Cu+HNO3——Cu(NO3)2+NO↑+H2O
1.配平该反应式
2.用单线桥标出电子转移方向和数目
3.指出氧化剂、还原剂、氧化产物和还原产物
4.还原性: > .
5.氧化性: > .
6.若生成60g NO则被还原的硝酸的质量为 g
7.离子方程式为: .
例:已知Cu+HNO3——Cu(NO3)2+NO↑+H2O
1.配平该反应式
Cu + HNO3—— Cu(NO3)2 + NO↑+ H2O
↑2
↓3
3
2
3
8
4
——
例:已知Cu+HNO3——Cu(NO3)2+NO↑+H2O
2.用单线桥标出电子转移方向和数目
3Cu + 8HNO3 = 3Cu(NO3)2 + 2NO↑ + 4H2O
6e-
例:已知Cu+HNO3——Cu(NO3)2+NO↑+H2O
3.指出氧化剂、还原剂、氧化产物和还原产物
3Cu + 8HNO3 = 3Cu(NO3)2 + 2NO↑ + 4H2O
还原剂
氧化剂
氧化产物
还原产物
4.还原性: > .
5.氧化性: > .
Cu
NO
HNO3
Cu(NO3)2
例:已知Cu+HNO3——Cu(NO3)2+NO↑+H2O
6.若生成60g NO则被还原的硝酸的质量为 g
3Cu + 8HNO3 = 3Cu(NO3)2 + 2NO↑ + 4H2O
2×63
2×30
60g
126g
126
7.离子方程式为:
3Cu + 8H+ + 2NO3- = 3Cu2+ + 2NO↑ + 4H2O
