高中化学必修第一册第一章《物质及其变化》章末复习教学课件(共32张PPT)
文档属性
| 名称 | 高中化学必修第一册第一章《物质及其变化》章末复习教学课件(共32张PPT) |  | |
| 格式 | ppt | ||
| 文件大小 | 1.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-17 12:23:02 | ||
图片预览




文档简介
(共32张PPT)
创原家独
知识回顾
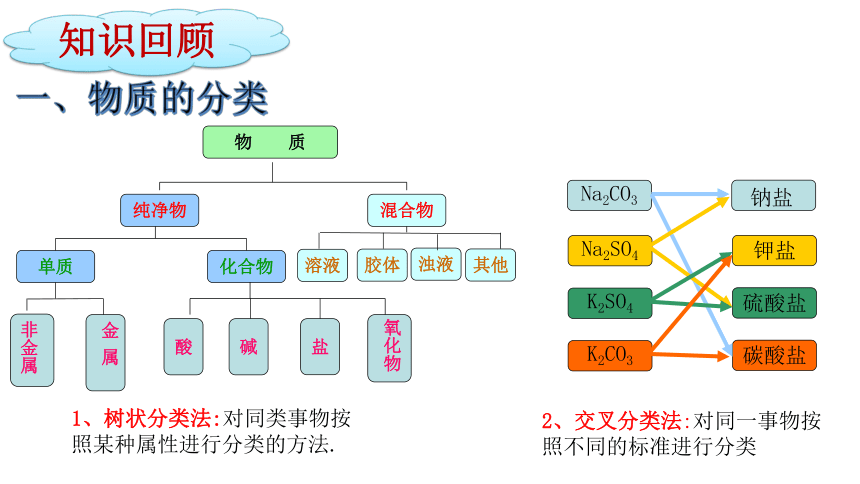
Na2SO4
K2SO4
K2CO3
碳酸盐
硫酸盐
钾盐
Na2CO3
钠盐
1、树状分类法:对同类事物按照某种属性进行分类的方法.
其他
物 质
纯净物
混合物
溶液
化合物
单质
盐
碱
酸
非金属
金 属
氧化物
胶体
浊液
2、交叉分类法:对同一事物按照不同的标准进行分类
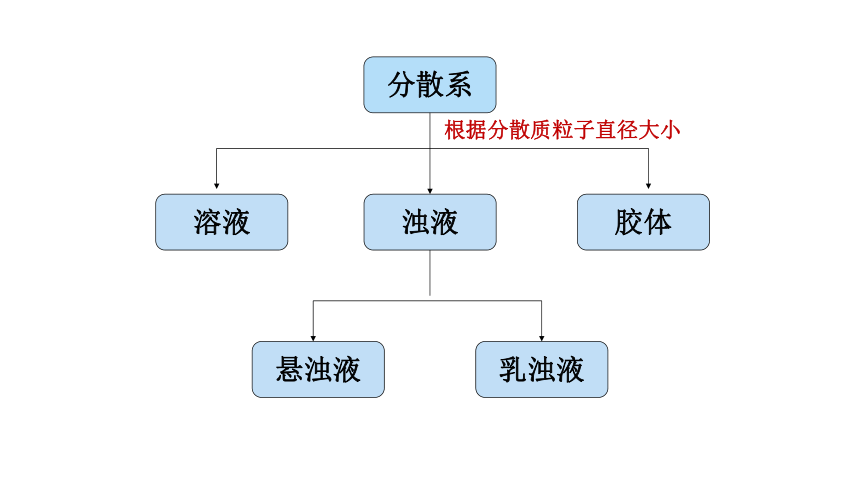
分散系
胶体
浊液
溶液
悬浊液
乳浊液
根据分散质粒子直径大小
网
盐
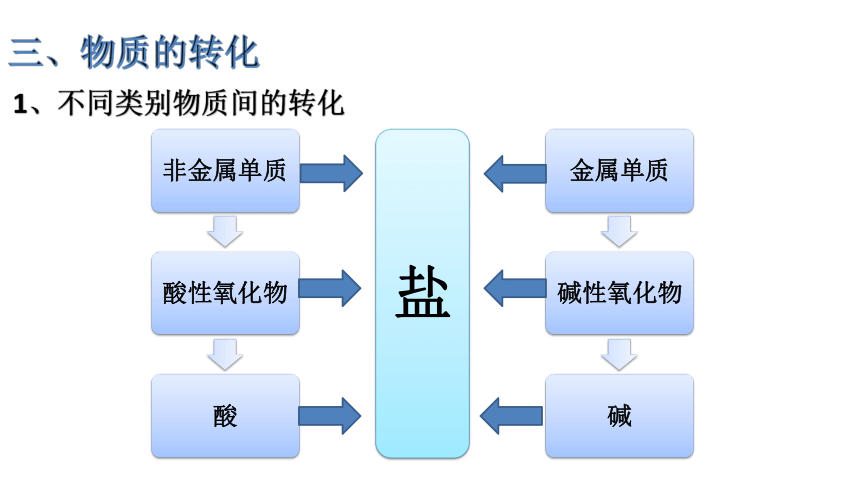
1、不同类别物质间的转化
科
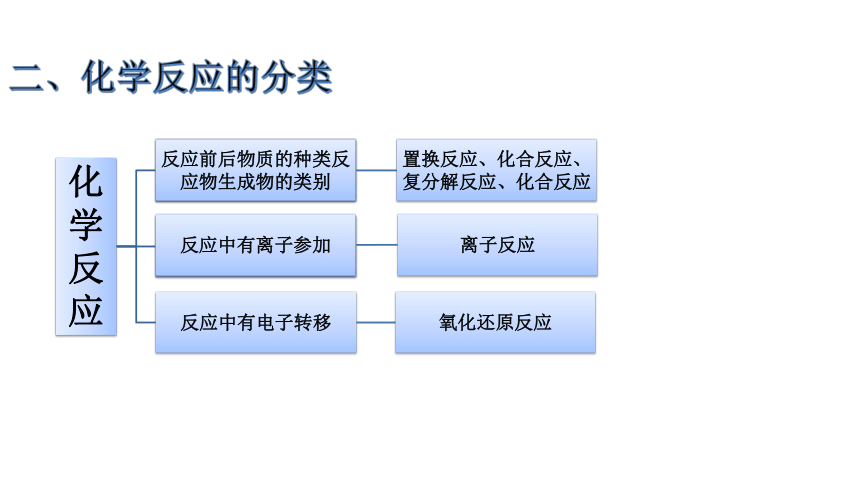
2、离子反应
3、氧化还原反应
12字记忆口诀:还原剂,升失氧;氧化剂,降得还
学
要点强化
要点一 胶体的考察
分散系 溶液 胶体 浊液
分散质微粒直径
< 1nm
1 ~100 nm
>100 nm
丁达尔效应
空气
云、雾
烟、尘
泡沫
乳浊液:牛奶
悬浊液:
泡沫塑料
珍珠
有色玻璃、合金
1、用特殊方法把固体物质加工到纳米级(1nm~100nm,1nm=10-9m)的超细粉末粒子,然后制得纳米材料。下列分散系中的分散质的粒子直径和这种粒子具有相同数量级的是 ( )
A、溶液 B、悬浊液 C、胶体 D、乳浊液
2、胶体的最本质的特征是( )
A、属于一种分散系
B、有丁达尔效应
C、可以通过滤纸
D、分散质粒子的直径在1nm ~100nm之间
(1)电解质和非电解质都是化合物。
(2)电解质应是一定条件下本身电离而导电的化合物。
(3)酸、碱、盐、水是电解质;蔗糖、酒精是非电解质。
(4)离子型氧化物(如Na2O、CaO等)虽然溶于水后并非自身电离,但熔融时却可电离,因此,也是电解质。
要点二 电解质
2、下列物质的水溶液能导电,但属于非电解质是( )
A、HClO B、Cl2 C、CO2 D、 NH4HCO3
1、下列物质中,属于电解质的是( )
①熔融态铁 ②液氯 ③ Na2SO4 ④ NaCl固体 ⑤ SO2 ⑥ NaCl溶液
A、①② B、②③④ C、③④ D、全部
要点三 电解质的电离
1、 电离时生成的阳离子全部是氢离子(H+)的化合物叫做酸。
2、电离时生成的阴离子全部是氢氧根离子(OH-)的化合物叫做碱。
3、电离时能生成金属阳离子(或者NH4+)和酸根阴离子的化合物叫做盐。
HCl =
H+ +Cl-
H2SO4 =
2H++SO42-
HNO3 =
H+ +NO3-
NaOH =
OH- +Na+
KOH =
OH- +K+
Ba(OH)2 =
2OH- +Ba+
NaCl =
Na+ + Cl -
K2SO4 =
2K+ + SO4 2-
NH4NO3 =
NH4+ + NO3-
酸的电离
碱的电离
盐的电离
要点四 离子方程式书写
1、写出反应的化学方程式:
Na2SO4 + BaCl2 = 2NaCl+ BaSO4↓
2、把易溶于水、易电离的物质写成离子形式,把难溶的物质、气体和弱电解质(水、醋酸、氨水)等仍用化学式表示。
2Na++SO42-+Ba2++2Cl- =2Na++2Cl- + BaSO4↓
3、删去方程式两边不参加反应的离子:
4、检查方程式两边各元素的原子个数和电荷总数是否相等。
Ba2+ +SO42-= BaSO4↓
1、以下三个反应对应的离子方程式是否相同?
①CuCl2与NaOH反应
②Cu(NO3)2与KOH反应
③CuSO4与NaOH反应
Cu2++2OH-=Cu(OH)2↓
2、练习:写出下列反应的离子方程式
1、锌和硫酸铜溶液反应:
2、氧化铁与盐酸溶液反应:
5、醋酸和氨水反应
3、向NaOH浓溶液中滴加CaCl2溶液
4、稀硫酸和氢氧化钡反应
Ca2++2OH- = Ca(OH)2↓
2H++SO42-+Ba2++2OH- = BaSO4↓+2H2O
CH3COOH+NH3·H2O=CH3COO-+NH4+ +H2O
要点五 离子方程式的正误判断
1、以客观事实为依据
2、以质量守恒为依据
3、以电荷守恒为依据
4、以物质的实际状态为依据
5、以物质的组成为依据
6、注意物质的状态,是否漏写
1、下列离子方程式正确的是 ( )
A、碳酸钙和稀盐酸反应 CO32-+2H+=H2O+CO2↑
B、铁和稀硫酸反应 2Fe+6H+=2Fe3++3H2↑
C、铝和硝酸铜溶液反应 Al+Cu2+=Al3++Cu
D、碳酸钠和稀硫酸反应 CO32-+2H+=CO2↑+H2O
2、下列离子方程式正确的是( )
A、氢氧化钡溶液中滴入少量硫酸
Ba2+ + OH- + SO42- + H+ = BaSO4↓ + H2O
B、氢氟酸与氢氧化钠溶液反应:
H+ + OH- == H2O
C、用澄清石灰水吸收二氧化碳气体:
Ca(OH)2+CO2==CaCO3↓+H2O
D、碳酸钡与盐酸反应:
BaCO3 + 2H+ ==Ba2++ CO2↑ + H2O
要点六 离子大量共存问题
1、同一溶液中若离子间符合下列任意一个条件就会发生离子反应,离子之间便不能在溶液中大量共存。
⑴生成难溶物或微溶物:
如:Ba2+与CO32-、Ag+与Cl-、Ca2+与SO42-等
⑵生成气体或挥发性物质:
如:NH4+与OH-、H+与CO32-、HCO3-、S2- 、HS-、SO32-、HSO3-等
⑶生成难电离物质:
如:H+与Ac-、CO32-、S2-、SO32-等生成弱酸;
OH-与NH4+生成的弱碱;
H+与OH-生成水。
⑷发生氧化还原反应:
氧化性离子(如Fe3+、NO3-、ClO-、MnO4-等)与还原性离子(如S2-、I-、Fe2+、SO32-等)不能大量共存。
2Fe3+ + 2I- = 2Fe2+ + I2
2、附加隐含条件的应用规律:
⑴溶液无色透明
则溶液中一定没有色离子。
常见的有色离子:Cu2+、Fe3+、Fe2+、MnO4-等
⑵强碱性溶液
肯定不存在与OH-反应的离子。如H+、NH4+、Fe3+、HCO3-等
⑶强酸性溶液
肯定不存在与H+反应的离子。如:OH-、HCO3-、S2-、SO32-、HSO3-、CH3COO-等
1、下列离子在水溶液中,能大量共存的是
A、Na+ 、 K+ 、 CO32-、H+
B、Fe3+、K+ 、 Cl-、 OH-
C、K+ 、NH4+ 、 H+ 、SO42-
D、 Ba2+、Cu2+ 、NO3- 、SO42-
2、下列离子在水溶液中,无色且能大量共存的是
A. Fe3+ 、K+ 、NO3- 、Cl-
B. Ba2+ 、K+ 、Cl- 、OH-
C. H+ 、Mg2+ 、HCO3- 、SO42-
D. Na+ 、K+ 、MnO4- 、NO3-
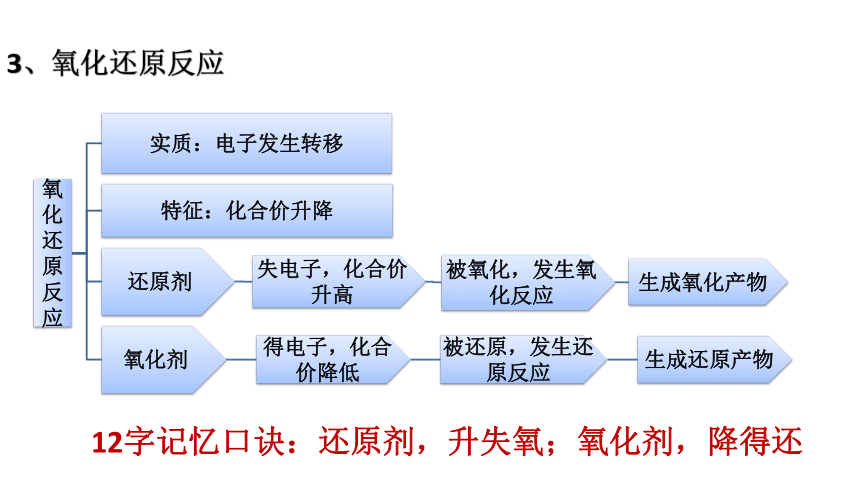
要点七 氧化还原反应
氧化剂→氧化性→得电子→价降低→被还原→还原产物
↑ ↑ ↑ ↑ ↑ ↑
反应物—性质 — 本质 — 特征 —反应 — 生成物
↓ ↓ ↓ ↓ ↓ ↓
还原剂→还原性→失电子→价升高→被氧化→氧化产物
CuO + H2 = Cu + H2O
氧化剂 + 还原剂 还原产物 + 氧化产物
1、吸进人体内的O2有2%转化为氧化性极强的活性氧,它能加速人体衰老,因而被称为“夺命杀手”。我国科学家尝试用含硒化合物Na2SeO3消除人体内的活性氧,则Na2SeO3所起的作用是 ( )。
A.氧化剂 B.还原剂
C.催化剂 D.缓释剂
2、农药波尔多液不能用铁制容器盛放,是因为铁与该农药中的硫酸铜起反应。在该反应中,对铁的叙述错误的是( )。
A.铁发生还原反应 B.铁发生氧化反应
C.铁是还原剂 D.铁失去电子
要点八 氧化还原反应的基本规律
1.守恒规律
还原剂失电子总数=氧化剂得电子总数或氧化剂化合价降低的总数=还原剂化合价升高的总数。
应用:氧化还原反应方程式的配平和相关计算。
2.强弱规律
在一个氧化还原反应中,各物质的氧化性、还原性强弱为:氧化性:氧化剂>氧化产物;还原性:还原剂>还原产物。
应用:比较物质间氧化性或还原性的强弱。
3.先后规律
多种氧化剂与一种还原剂相遇,氧化性强的首先得电子被还原;多种还原剂与一种氧化剂相遇,还原性强的首先失电子被氧化。
如:把氯气通入FeBr2溶液时,还原性Fe2+>Br-,若氯气量不足时首先氧化Fe2+;把氯气通入FeI2溶液时,还原性I->Fe2+,若氯气量不足时首先氧化I-。
应用:判断物质的稳定性和反应顺序。
4.价态规律
(1)高低规律:最高价态只有氧化性,最低价态只有还原性,中间价态既有氧化性又有还原性。
(2)价态归中规律:同种元素不同价态之间发生氧化还原反应时,高价态+低价态―→中间价态,即“只靠拢,不交叉”。
应用:判断元素或物质的氧化性、还原性。
1、在KClO3+6HCl(浓)===KCl+3Cl2↑+3H2O的反应中,被氧化的氯与被还原的氯的原子个数比为 ( )。
A.1∶6 B.6∶1
C.1∶5 D.5∶1
2、已知常温下,在溶液中可发生如下反应:Ce4++Fe2+===Fe3++Ce3+,Sn2++2Fe3+===2Fe2++Sn4+。由此推断Fe2+、Ce3+、Sn2+的还原性由强到弱的顺序是 ( )。
A.Sn2+、Fe2+、Ce3+
B.Fe2+、Ce3+、Sn2+
C.Fe2+、Sn2+、Ce3+
D.Ce3+、Fe2+、Sn2+
创原家独
知识回顾
Na2SO4
K2SO4
K2CO3
碳酸盐
硫酸盐
钾盐
Na2CO3
钠盐
1、树状分类法:对同类事物按照某种属性进行分类的方法.
其他
物 质
纯净物
混合物
溶液
化合物
单质
盐
碱
酸
非金属
金 属
氧化物
胶体
浊液
2、交叉分类法:对同一事物按照不同的标准进行分类
分散系
胶体
浊液
溶液
悬浊液
乳浊液
根据分散质粒子直径大小
网
盐
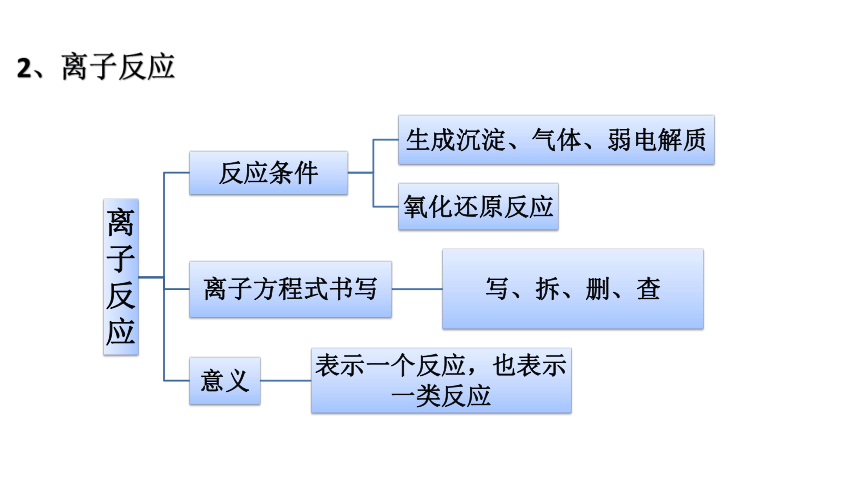
1、不同类别物质间的转化
科
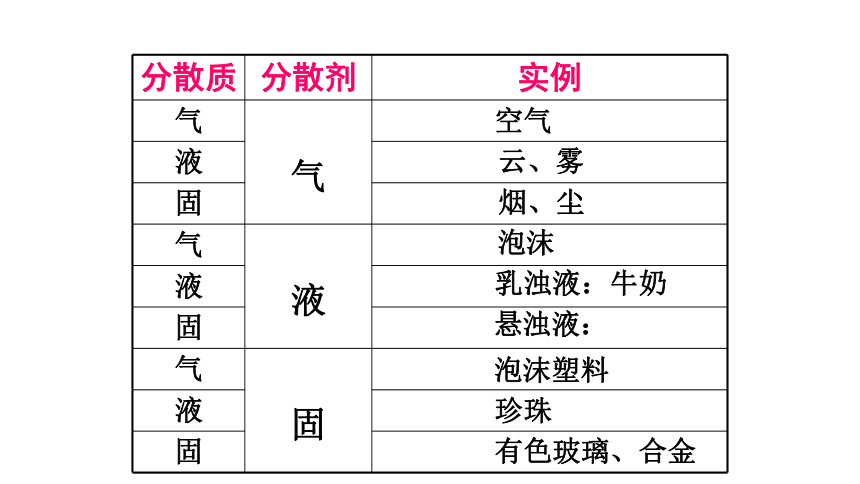
2、离子反应
3、氧化还原反应
12字记忆口诀:还原剂,升失氧;氧化剂,降得还
学
要点强化
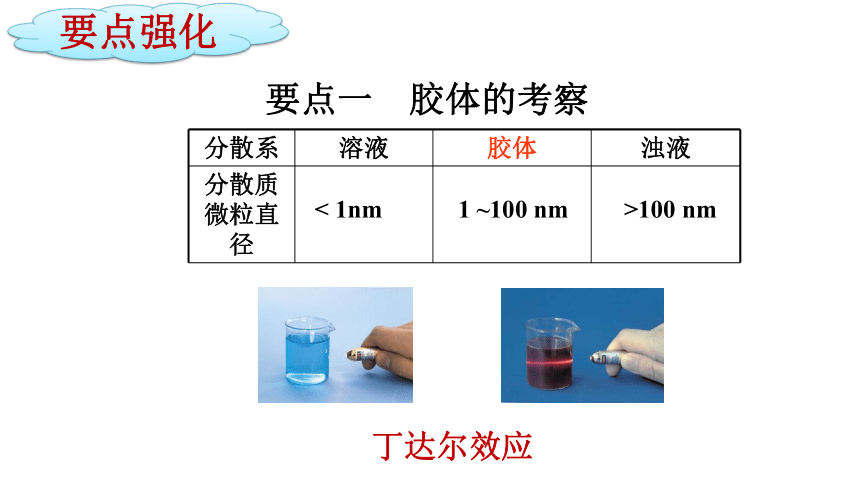
要点一 胶体的考察
分散系 溶液 胶体 浊液
分散质微粒直径
< 1nm
1 ~100 nm
>100 nm
丁达尔效应
空气
云、雾
烟、尘
泡沫
乳浊液:牛奶
悬浊液:
泡沫塑料
珍珠
有色玻璃、合金
1、用特殊方法把固体物质加工到纳米级(1nm~100nm,1nm=10-9m)的超细粉末粒子,然后制得纳米材料。下列分散系中的分散质的粒子直径和这种粒子具有相同数量级的是 ( )
A、溶液 B、悬浊液 C、胶体 D、乳浊液
2、胶体的最本质的特征是( )
A、属于一种分散系
B、有丁达尔效应
C、可以通过滤纸
D、分散质粒子的直径在1nm ~100nm之间
(1)电解质和非电解质都是化合物。
(2)电解质应是一定条件下本身电离而导电的化合物。
(3)酸、碱、盐、水是电解质;蔗糖、酒精是非电解质。
(4)离子型氧化物(如Na2O、CaO等)虽然溶于水后并非自身电离,但熔融时却可电离,因此,也是电解质。
要点二 电解质
2、下列物质的水溶液能导电,但属于非电解质是( )
A、HClO B、Cl2 C、CO2 D、 NH4HCO3
1、下列物质中,属于电解质的是( )
①熔融态铁 ②液氯 ③ Na2SO4 ④ NaCl固体 ⑤ SO2 ⑥ NaCl溶液
A、①② B、②③④ C、③④ D、全部
要点三 电解质的电离
1、 电离时生成的阳离子全部是氢离子(H+)的化合物叫做酸。
2、电离时生成的阴离子全部是氢氧根离子(OH-)的化合物叫做碱。
3、电离时能生成金属阳离子(或者NH4+)和酸根阴离子的化合物叫做盐。
HCl =
H+ +Cl-
H2SO4 =
2H++SO42-
HNO3 =
H+ +NO3-
NaOH =
OH- +Na+
KOH =
OH- +K+
Ba(OH)2 =
2OH- +Ba+
NaCl =
Na+ + Cl -
K2SO4 =
2K+ + SO4 2-
NH4NO3 =
NH4+ + NO3-
酸的电离
碱的电离
盐的电离
要点四 离子方程式书写
1、写出反应的化学方程式:
Na2SO4 + BaCl2 = 2NaCl+ BaSO4↓
2、把易溶于水、易电离的物质写成离子形式,把难溶的物质、气体和弱电解质(水、醋酸、氨水)等仍用化学式表示。
2Na++SO42-+Ba2++2Cl- =2Na++2Cl- + BaSO4↓
3、删去方程式两边不参加反应的离子:
4、检查方程式两边各元素的原子个数和电荷总数是否相等。
Ba2+ +SO42-= BaSO4↓
1、以下三个反应对应的离子方程式是否相同?
①CuCl2与NaOH反应
②Cu(NO3)2与KOH反应
③CuSO4与NaOH反应
Cu2++2OH-=Cu(OH)2↓
2、练习:写出下列反应的离子方程式
1、锌和硫酸铜溶液反应:
2、氧化铁与盐酸溶液反应:
5、醋酸和氨水反应
3、向NaOH浓溶液中滴加CaCl2溶液
4、稀硫酸和氢氧化钡反应
Ca2++2OH- = Ca(OH)2↓
2H++SO42-+Ba2++2OH- = BaSO4↓+2H2O
CH3COOH+NH3·H2O=CH3COO-+NH4+ +H2O
要点五 离子方程式的正误判断
1、以客观事实为依据
2、以质量守恒为依据
3、以电荷守恒为依据
4、以物质的实际状态为依据
5、以物质的组成为依据
6、注意物质的状态,是否漏写
1、下列离子方程式正确的是 ( )
A、碳酸钙和稀盐酸反应 CO32-+2H+=H2O+CO2↑
B、铁和稀硫酸反应 2Fe+6H+=2Fe3++3H2↑
C、铝和硝酸铜溶液反应 Al+Cu2+=Al3++Cu
D、碳酸钠和稀硫酸反应 CO32-+2H+=CO2↑+H2O
2、下列离子方程式正确的是( )
A、氢氧化钡溶液中滴入少量硫酸
Ba2+ + OH- + SO42- + H+ = BaSO4↓ + H2O
B、氢氟酸与氢氧化钠溶液反应:
H+ + OH- == H2O
C、用澄清石灰水吸收二氧化碳气体:
Ca(OH)2+CO2==CaCO3↓+H2O
D、碳酸钡与盐酸反应:
BaCO3 + 2H+ ==Ba2++ CO2↑ + H2O
要点六 离子大量共存问题
1、同一溶液中若离子间符合下列任意一个条件就会发生离子反应,离子之间便不能在溶液中大量共存。
⑴生成难溶物或微溶物:
如:Ba2+与CO32-、Ag+与Cl-、Ca2+与SO42-等
⑵生成气体或挥发性物质:
如:NH4+与OH-、H+与CO32-、HCO3-、S2- 、HS-、SO32-、HSO3-等
⑶生成难电离物质:
如:H+与Ac-、CO32-、S2-、SO32-等生成弱酸;
OH-与NH4+生成的弱碱;
H+与OH-生成水。
⑷发生氧化还原反应:
氧化性离子(如Fe3+、NO3-、ClO-、MnO4-等)与还原性离子(如S2-、I-、Fe2+、SO32-等)不能大量共存。
2Fe3+ + 2I- = 2Fe2+ + I2
2、附加隐含条件的应用规律:
⑴溶液无色透明
则溶液中一定没有色离子。
常见的有色离子:Cu2+、Fe3+、Fe2+、MnO4-等
⑵强碱性溶液
肯定不存在与OH-反应的离子。如H+、NH4+、Fe3+、HCO3-等
⑶强酸性溶液
肯定不存在与H+反应的离子。如:OH-、HCO3-、S2-、SO32-、HSO3-、CH3COO-等
1、下列离子在水溶液中,能大量共存的是
A、Na+ 、 K+ 、 CO32-、H+
B、Fe3+、K+ 、 Cl-、 OH-
C、K+ 、NH4+ 、 H+ 、SO42-
D、 Ba2+、Cu2+ 、NO3- 、SO42-
2、下列离子在水溶液中,无色且能大量共存的是
A. Fe3+ 、K+ 、NO3- 、Cl-
B. Ba2+ 、K+ 、Cl- 、OH-
C. H+ 、Mg2+ 、HCO3- 、SO42-
D. Na+ 、K+ 、MnO4- 、NO3-
要点七 氧化还原反应
氧化剂→氧化性→得电子→价降低→被还原→还原产物
↑ ↑ ↑ ↑ ↑ ↑
反应物—性质 — 本质 — 特征 —反应 — 生成物
↓ ↓ ↓ ↓ ↓ ↓
还原剂→还原性→失电子→价升高→被氧化→氧化产物
CuO + H2 = Cu + H2O
氧化剂 + 还原剂 还原产物 + 氧化产物
1、吸进人体内的O2有2%转化为氧化性极强的活性氧,它能加速人体衰老,因而被称为“夺命杀手”。我国科学家尝试用含硒化合物Na2SeO3消除人体内的活性氧,则Na2SeO3所起的作用是 ( )。
A.氧化剂 B.还原剂
C.催化剂 D.缓释剂
2、农药波尔多液不能用铁制容器盛放,是因为铁与该农药中的硫酸铜起反应。在该反应中,对铁的叙述错误的是( )。
A.铁发生还原反应 B.铁发生氧化反应
C.铁是还原剂 D.铁失去电子
要点八 氧化还原反应的基本规律
1.守恒规律
还原剂失电子总数=氧化剂得电子总数或氧化剂化合价降低的总数=还原剂化合价升高的总数。
应用:氧化还原反应方程式的配平和相关计算。
2.强弱规律
在一个氧化还原反应中,各物质的氧化性、还原性强弱为:氧化性:氧化剂>氧化产物;还原性:还原剂>还原产物。
应用:比较物质间氧化性或还原性的强弱。
3.先后规律
多种氧化剂与一种还原剂相遇,氧化性强的首先得电子被还原;多种还原剂与一种氧化剂相遇,还原性强的首先失电子被氧化。
如:把氯气通入FeBr2溶液时,还原性Fe2+>Br-,若氯气量不足时首先氧化Fe2+;把氯气通入FeI2溶液时,还原性I->Fe2+,若氯气量不足时首先氧化I-。
应用:判断物质的稳定性和反应顺序。
4.价态规律
(1)高低规律:最高价态只有氧化性,最低价态只有还原性,中间价态既有氧化性又有还原性。
(2)价态归中规律:同种元素不同价态之间发生氧化还原反应时,高价态+低价态―→中间价态,即“只靠拢,不交叉”。
应用:判断元素或物质的氧化性、还原性。
1、在KClO3+6HCl(浓)===KCl+3Cl2↑+3H2O的反应中,被氧化的氯与被还原的氯的原子个数比为 ( )。
A.1∶6 B.6∶1
C.1∶5 D.5∶1
2、已知常温下,在溶液中可发生如下反应:Ce4++Fe2+===Fe3++Ce3+,Sn2++2Fe3+===2Fe2++Sn4+。由此推断Fe2+、Ce3+、Sn2+的还原性由强到弱的顺序是 ( )。
A.Sn2+、Fe2+、Ce3+
B.Fe2+、Ce3+、Sn2+
C.Fe2+、Sn2+、Ce3+
D.Ce3+、Fe2+、Sn2+
