化学高中必修第一册《第一节 原子结构与元素周期表》PPT课件(共26张PPT)
文档属性
| 名称 | 化学高中必修第一册《第一节 原子结构与元素周期表》PPT课件(共26张PPT) |

|
|
| 格式 | ppt | ||
| 文件大小 | 3.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-17 00:00:00 | ||
图片预览






文档简介
(共26张PPT)
第一节 原子结构与元素周期表之
原子结构
我们已经知道,原子是由原子核和核外电子所构成的。电子围绕着原子核做高速运动。在多电子原子里,电子是怎样运动的呢?
一、原子结构
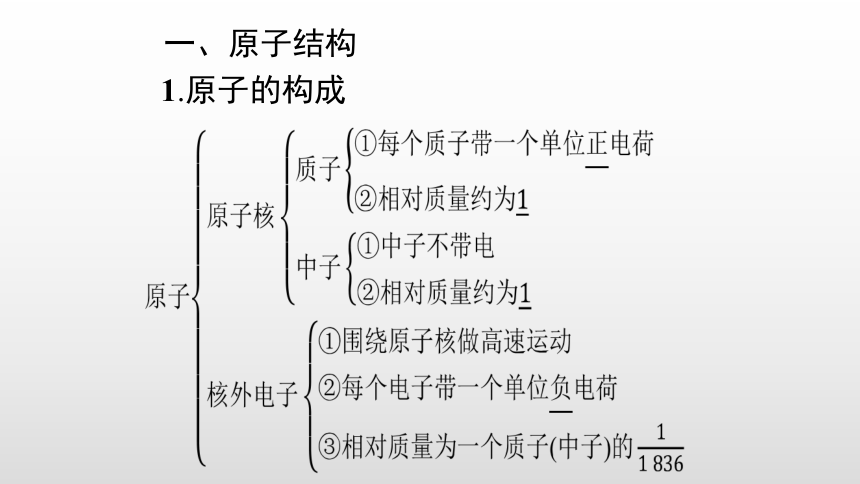
1.原子的构成
2.质量数
(1)质量数:将核内所有质子和中子的相对质量取近似整数值相加,所得的数值叫做质量数。
(2)等量关系:质量数(A)=质子数(Z)+中子数(N)。
3.原子核外电子的排布规律
(1)电子层的划分
①核外电子的能量及运动区域
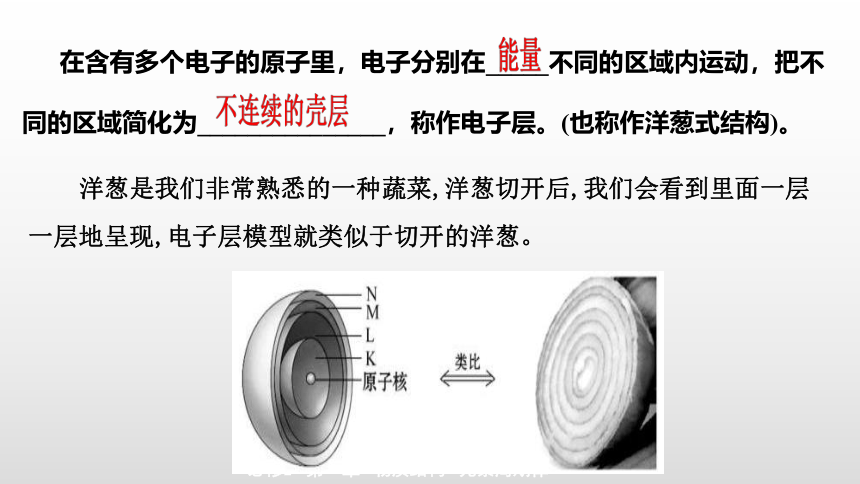
在含有多个电子的原子里,电子分别在_____不同的区域内运动,把不同的区域简化为_______________,称作电子层。(也称作洋葱式结构)。
洋葱是我们非常熟悉的一种蔬菜,洋葱切开后,我们会看到里面一层一层地呈现,电子层模型就类似于切开的洋葱。
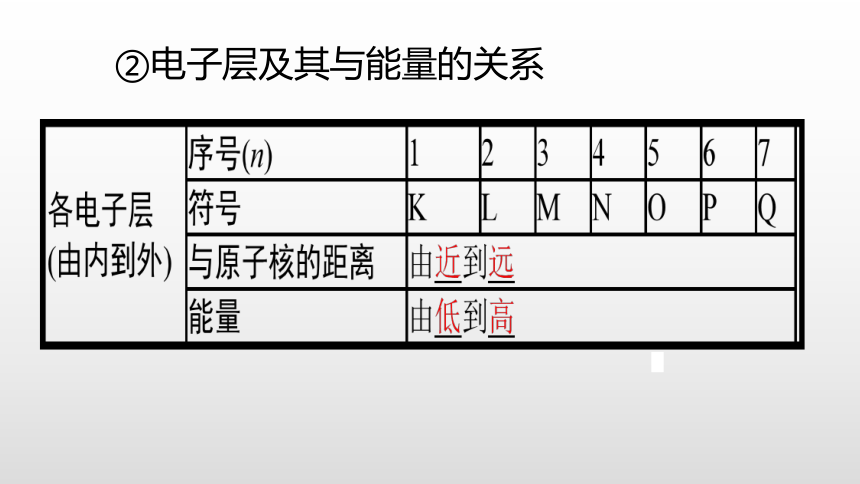
人们将电子运动的区域简化为不连续的壳层,称之为“电子层”。从第一层到第七层的符号分别为:K、L、M、N、O、P、Q。
(1)原子核周围是否真实存在这样的壳层
提示:电子层不是真实存在的,是科学家为了表达形象,根据电子经常出现的区域而设想的结构模型。
(2)电子在原子核外是否沿固定轨迹做高速旋转
提示:电子在某一区域内做无规则运动。
②电子层及其与能量的关系
下表是稀有气体元素原子的电子层排布,从中你能发现什么规律?
【思考·讨论】
(1)K层为最外层时,最多容纳多少电子?其余层为最外层,最多容纳多少电子?
(1)K层为最外层时,最多容纳2个电子,其余层为最外层,最多容纳8个电子。
(2)次外层最多容纳多少电子?
(3)第n层最多容纳多少电子?
(4)用原子结构示意图表示1~20号元素的核外电子排布
(2)次外层最多容纳18个电子。
(3)第n层最多容纳2×n2个电子。
前20号元素的核外电子排布
原子的核外电子排布规律:
(1)电子总是尽先由里向外排列;
(2)每个电子层最多可以容纳2×n2个电子;
(3)最外层最多可以容纳8个电子(K层为最外层时,最多容纳2个);
(4)次外层最多容纳18个电子。
根据上述规律,写出33号元素的原子结构示意图
4、核外电子排布的表示方法-原子结构示意图
+
15
第1层
第2层
第3层
K层
L层
M层
原子核
原子核带正电
2
8
5
P:
质子数
离子结构示意图
离子结构示意图中各符号与原子结构示意图含义一样,但注意原子结构示意图中质子数等于核外电子数,而离子结构示意图中质子数与核外电子数不相等。如
特别关注:质子数与核外电子数的关系
原子:核内质子数=核外电子数
阳离子:核内质子数=核外电子数+离子所带电荷数
阴离子:核内质子数=核外电子数-离子所带电荷数
5.原子结构模型的演变
人类对原子结构认识经历了如下演变过程:道尔顿模型→汤姆孙原子模型→卢瑟福原子模型→玻尔原子模型→电子云模型等。
年代 模型 观点或理论
1803年 道尔顿
模型 原子是构成物质的基本粒子,是坚实的、不可再分的实心球。
年代 模型 观点或理论
1904年 汤姆孙
模型 原子是一个平均分布着正电荷的粒子,其中镶嵌着许多电子,中和了正电荷,从而形成了中性原子。
年代 模型 观点或理论
1911年 卢瑟福
原子
模型 在原子的中心有一个带正电荷的核,它的质量几乎等于原子的全部质量,电子在它的周围沿着不同的轨道运转,就像行星环绕太阳运转一样。
年代 模型 观点或理论
1913年 玻尔原子
模型 电子在原子核外空间的一定轨道上绕核做高速圆周运动。
1926~
1935年 电子云
模型 电子在原子核外很小的空间内做高速运动,其运动规律与一般物体不同,没有确定的轨道。
1.已知R原子有b个中子,R2+核外有a个电子。则R原子的质量数为( )
A.b B.a+b-2 C.a+b+2 D.a+b
解析:R2+核外有a个电子,则R原子的质子数为a+2,质量数为a+b+2。
C
2.下面关于多电子原子的核外电子的运动规律的叙述正确的是( )
①核外电子是分层运动的
②所有电子在同一区域里运动
③能量高的电子在离核近的区域内运动
④能量低的电子在离核近的区域内运动
A.①④ B.②③ C.①③ D.②④
解析:原子的核外电子是分层运动的,能量越低离核越近,能量越高离核越远。
A
3.在化学变化过程中,原子中的下列粒子数可能发生改变的是( )
A.质子数 B.中子数
C.质量数 D.电子数
解析: 化学反应中原子的种类不变,质子数、中子数、质量数不变,电子数可能改变。
D
A
第一节 原子结构与元素周期表之
原子结构
我们已经知道,原子是由原子核和核外电子所构成的。电子围绕着原子核做高速运动。在多电子原子里,电子是怎样运动的呢?
一、原子结构
1.原子的构成
2.质量数
(1)质量数:将核内所有质子和中子的相对质量取近似整数值相加,所得的数值叫做质量数。
(2)等量关系:质量数(A)=质子数(Z)+中子数(N)。
3.原子核外电子的排布规律
(1)电子层的划分
①核外电子的能量及运动区域
在含有多个电子的原子里,电子分别在_____不同的区域内运动,把不同的区域简化为_______________,称作电子层。(也称作洋葱式结构)。
洋葱是我们非常熟悉的一种蔬菜,洋葱切开后,我们会看到里面一层一层地呈现,电子层模型就类似于切开的洋葱。
人们将电子运动的区域简化为不连续的壳层,称之为“电子层”。从第一层到第七层的符号分别为:K、L、M、N、O、P、Q。
(1)原子核周围是否真实存在这样的壳层
提示:电子层不是真实存在的,是科学家为了表达形象,根据电子经常出现的区域而设想的结构模型。
(2)电子在原子核外是否沿固定轨迹做高速旋转
提示:电子在某一区域内做无规则运动。
②电子层及其与能量的关系
下表是稀有气体元素原子的电子层排布,从中你能发现什么规律?
【思考·讨论】
(1)K层为最外层时,最多容纳多少电子?其余层为最外层,最多容纳多少电子?
(1)K层为最外层时,最多容纳2个电子,其余层为最外层,最多容纳8个电子。
(2)次外层最多容纳多少电子?
(3)第n层最多容纳多少电子?
(4)用原子结构示意图表示1~20号元素的核外电子排布
(2)次外层最多容纳18个电子。
(3)第n层最多容纳2×n2个电子。
前20号元素的核外电子排布
原子的核外电子排布规律:
(1)电子总是尽先由里向外排列;
(2)每个电子层最多可以容纳2×n2个电子;
(3)最外层最多可以容纳8个电子(K层为最外层时,最多容纳2个);
(4)次外层最多容纳18个电子。
根据上述规律,写出33号元素的原子结构示意图
4、核外电子排布的表示方法-原子结构示意图
+
15
第1层
第2层
第3层
K层
L层
M层
原子核
原子核带正电
2
8
5
P:
质子数
离子结构示意图
离子结构示意图中各符号与原子结构示意图含义一样,但注意原子结构示意图中质子数等于核外电子数,而离子结构示意图中质子数与核外电子数不相等。如
特别关注:质子数与核外电子数的关系
原子:核内质子数=核外电子数
阳离子:核内质子数=核外电子数+离子所带电荷数
阴离子:核内质子数=核外电子数-离子所带电荷数
5.原子结构模型的演变
人类对原子结构认识经历了如下演变过程:道尔顿模型→汤姆孙原子模型→卢瑟福原子模型→玻尔原子模型→电子云模型等。
年代 模型 观点或理论
1803年 道尔顿
模型 原子是构成物质的基本粒子,是坚实的、不可再分的实心球。
年代 模型 观点或理论
1904年 汤姆孙
模型 原子是一个平均分布着正电荷的粒子,其中镶嵌着许多电子,中和了正电荷,从而形成了中性原子。
年代 模型 观点或理论
1911年 卢瑟福
原子
模型 在原子的中心有一个带正电荷的核,它的质量几乎等于原子的全部质量,电子在它的周围沿着不同的轨道运转,就像行星环绕太阳运转一样。
年代 模型 观点或理论
1913年 玻尔原子
模型 电子在原子核外空间的一定轨道上绕核做高速圆周运动。
1926~
1935年 电子云
模型 电子在原子核外很小的空间内做高速运动,其运动规律与一般物体不同,没有确定的轨道。
1.已知R原子有b个中子,R2+核外有a个电子。则R原子的质量数为( )
A.b B.a+b-2 C.a+b+2 D.a+b
解析:R2+核外有a个电子,则R原子的质子数为a+2,质量数为a+b+2。
C
2.下面关于多电子原子的核外电子的运动规律的叙述正确的是( )
①核外电子是分层运动的
②所有电子在同一区域里运动
③能量高的电子在离核近的区域内运动
④能量低的电子在离核近的区域内运动
A.①④ B.②③ C.①③ D.②④
解析:原子的核外电子是分层运动的,能量越低离核越近,能量越高离核越远。
A
3.在化学变化过程中,原子中的下列粒子数可能发生改变的是( )
A.质子数 B.中子数
C.质量数 D.电子数
解析: 化学反应中原子的种类不变,质子数、中子数、质量数不变,电子数可能改变。
D
A
