选择题标准练(八)(含答案)-2024年江苏高考化学二轮复习
文档属性
| 名称 | 选择题标准练(八)(含答案)-2024年江苏高考化学二轮复习 |
|
|
| 格式 | docx | ||
| 文件大小 | 380.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-17 00:00:00 | ||
图片预览




文档简介
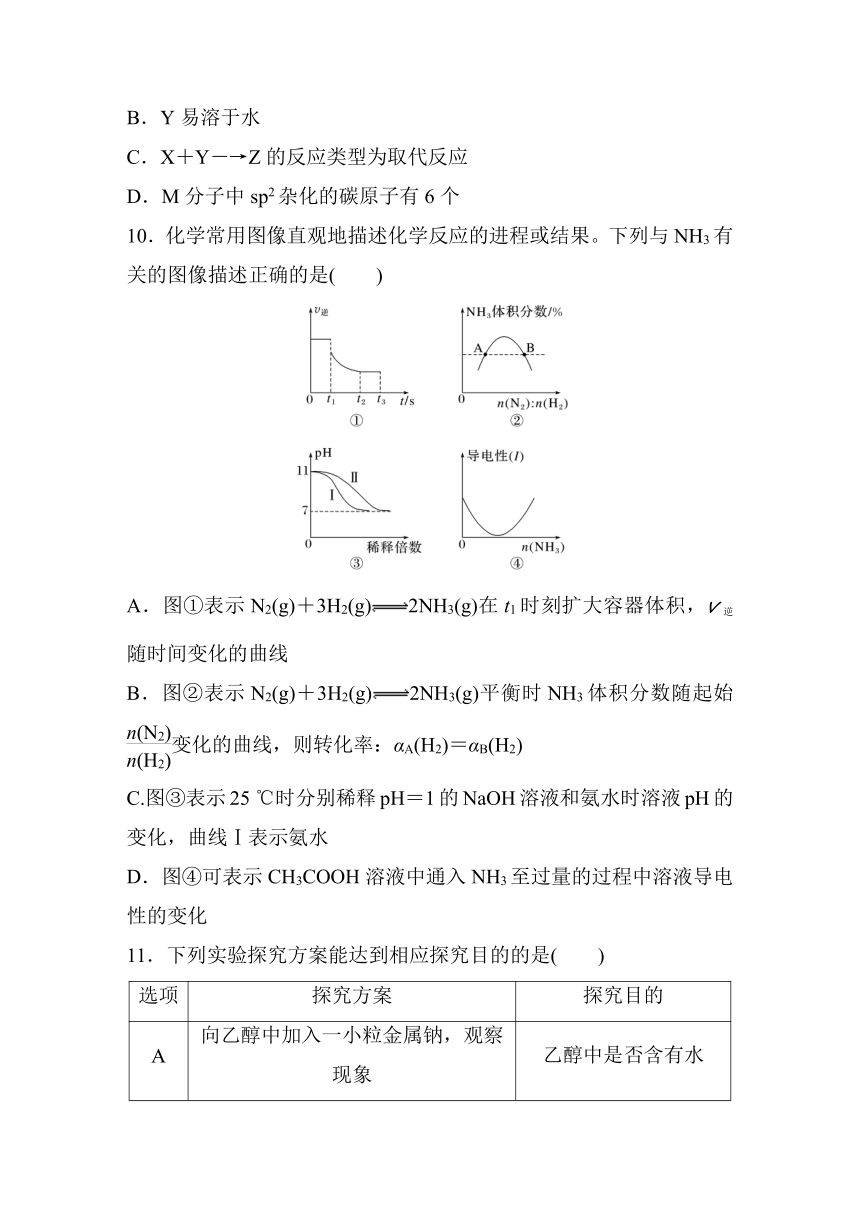
2024年高考化学 选择题标准练(八)
1.NaClO是家用消毒液的有效成分,这是利用了NaClO的( )
A.碱性 B.强氧化性
C.还原性 D.受热后不稳定性
2.Cu2O可用作涂料,可由反应2CuSO4+3Na2SO3===Cu2O↓+3Na2SO4+2SO2↑制得。下列说法正确的是( )
A.基态Cu原子的电子排布式为[Ar]3d104s1
B.Cu2O中O元素的化合价为-4
C.SO的空间构型为平面四边形
D.SO2晶体的类型为共价晶体
3.实验室用如图装置制备溴苯并验证反应有HBr生成。下列说法正确的是( )
A.X为苯和溴水的混合液
B.Y可以是CCl4
C.Z可以是淀粉和KI混合液
D.苯和溴苯可以用如图丁所示装置分离
4.LiAlH4是重要的还原剂,合成方法:NaAlH4+LiCl===LiAlH4+NaCl。下列说法正确的是( )
A.半径大小:r(Al3+)>r(Na+)
B.电负性大小:χ(Na)>χ(H)
C.第一电离能:I1(Li)>I1(Na)
D.碱性强弱:LiOH>NaOH
阅读下列材料,回答5~7题。
铜、银位于周期表中第ⅠB族。铜、硫酸铜、硝酸银、银氨溶液是实验室常用的含铜或银的化学试剂。从废定影液[主要含有H+、Ag(S2O3)、H2SO3、Br-等微粒]中回收Ag和Br2的主要步骤:向该废定影液中加入氢氧化钠调节pH在7.5~8.5之间,然后再加入稍过量Na2S溶液沉银,过滤、洗涤及干燥,灼烧Ag2S制Ag;滤液中通入Cl2氧化Br-,用苯萃取分液。
5.下列有关物质的性质与用途具有对应关系的是( )
A.铜具有良好导热性,可用于制作印刷电路板
B.硫酸铜溶液显酸性,可用作泳池杀菌剂
C.溴化银呈淡黄色,可用于制作相机胶片
D.银氨溶液具有弱氧化性,可用于制作银镜
6.下列有关从废定影液中回收Ag和Br2的说法正确的是( )
A.过滤时,为加快滤液流下,可以用玻璃棒搅拌漏斗中的液体
B.配制Na2S溶液时,向其中加入少量NaOH溶液,的值增大
C.灼烧Ag2S生成Ag和SO2,该反应每生成1 mol Ag转移3 mol电子
D.分液时,先放出水层,再从分液漏斗下口放出含有苯和溴的有机层
7.下列化学反应表示正确的是( )
A.硫酸铜溶液中加入小粒金属钠:Cu2++2Na===Cu+2Na+
B.用铜电极电解硫酸铜溶液:2Cu2++2H2O2Cu+O2↑+4H+
C.稀硝酸洗涤做过银镜反应的试管:Ag+2H++NO===Ag++NO↑+H2O
D.多余的[Ag(NH3)2]OH用硝酸处理:[Ag(NH3)2]++OH-+3H+===Ag++2NH+H2O
8.室温时,实验室以含铬废液(主要离子含K+、Fe3+、Cr3+、SO)制取含K2Cr2O7溶液的流程如下:
已知:①室温时,Ksp[Cr(OH)3]=6×10-31,Ksp[Fe(OH)3]=4×10-38;
②“氧化”时Cr(OH)3转化为CrO。
下列说法正确的是( )
A.“过滤Ⅰ”所得滤液中c(Cr3+)=6×10-7 mol·L-1
B.“氧化”时的离子方程式为4OH-+2Cr(OH)3+3H2O2===2CrO+8H2O
C.“酸化”时溶液pH越低,CrO转化为Cr2O的比例越低
D.将“含K2Cr2O7溶液”蒸干可得纯净的K2Cr2O7固体
9.物质M是一种治疗心血管药物的中间体,其合成路线如图所示。下列说法正确的是( )
A.X分子中所有碳原子不可能在同一平面
B.Y易溶于水
C.X+Y―→Z的反应类型为取代反应
D.M分子中sp2杂化的碳原子有6个
10.化学常用图像直观地描述化学反应的进程或结果。下列与NH3有关的图像描述正确的是( )
A.图①表示N2(g)+3H2(g)2NH3(g)在t1时刻扩大容器体积,v逆随时间变化的曲线
B.图②表示N2(g)+3H2(g)2NH3(g)平衡时NH3体积分数随起始变化的曲线,则转化率:αA(H2)=αB(H2)
C.图③表示25 ℃时分别稀释pH=1的NaOH溶液和氨水时溶液pH的变化,曲线Ⅰ表示氨水
D.图④可表示CH3COOH溶液中通入NH3至过量的过程中溶液导电性的变化
11.下列实验探究方案能达到相应探究目的的是( )
选项 探究方案 探究目的
A 向乙醇中加入一小粒金属钠,观察现象 乙醇中是否含有水
B 取少量久置的Na2SO3粉末于试管中,向其中滴加H2SO4酸化,再滴加BaCl2溶液,观察现象 Na2SO3是否变质
C 将乙醇和浓硫酸在170 ℃时共热所得气体通入酸性KMnO4溶液中,观察现象 乙烯具有还原性
D 室温下,测定0.1 mol·L-1 NaHC2O4溶液的pH 比较Ka1(H2C2O4)·Ka2(H2C2O4)与Kw的大小
12.工业上以羟磷灰石精矿[主要成分是Ca5(PO4)3OH,还含有少量石英和氧化铁等杂质]为原料,生产磷酸二氢钾(KH2PO4)的流程如下:
已知:溶液中H3PO4、H2PO、HPO、PO的分布分数δ随pH的变化如图所示。
下列说法正确的是( )
A.“制酸过滤”过程所得滤渣的主要成分为硅酸
B.三辛胺的结构简式为N(C8H17)3,与盐酸反应时,三辛胺提供空轨道
C.“反应”中为获得较纯净KH2PO4,当pH=10时,停止加入三辛胺
D.0.1 mol·L-1 KH2PO4溶液中:2c(H3PO4)+c(H2PO)<0.1 mol·L-1+c(PO)
13.碘甲烷(CH3I)可裂解制取低碳烯烃。碘甲烷裂解时可发生如下反应:
反应1:2CH3I(g)C2H4(g)+2HI(g) ΔH=+80.2 kJ·mol-1
反应2:3C2H4(g)2C3H6(g) ΔH=-108.1 kJ·mol-1
反应3:2C2H4(g)C4H8(g) ΔH=-120.6 kJ·mol-1
向密闭容器中充入一定量的碘甲烷,维持容器内p=0.1 MPa,平衡时C2H4、C3H6和C4H8的物质的量分数与温度的关系如图所示。已知容器中某气体的分压p=φ(物质的量分数)×p总,用气体物质的分压替换浓度计算得到的平衡常数称为分压平衡常数(Kp)。下列说法正确的是( )
A.图中物质X表示的是C2H4
B.700 K时,反应2的分压平衡常数Kp=3
C.700 K时,从反应开始至恰好平衡,反应2的速率大于反应3的速率
D.700 K时,其他条件不变,将容器内p增大为0.2 MPa,C2H4的体积分数将减小
选择题标准练(八)
1.B [NaClO具有强氧化性,可以使蛋白质变性,从而起到杀菌消毒的作用,选项B正确。]
2.A [已知Cu为29号元素,故基态Cu原子的电子排布式为[Ar]3d104s1,A正确;Cu2O中O元素的化合价为-2,Cu为+1价,B错误;SO中心原子S原子的价层电子对数为4+×(6+2-4×2)=4,故其空间结构为正四面体形,C错误;SO2晶体是由SO2分子通过范德华力作用形成的分子晶体,D错误。]
3.B [苯与溴水不反应,应该使用液溴,A项错误;溴易溶于四氯化碳,装置中挥发的Br2被CCl4吸收,防止对HBr的检测产生干扰,B项正确;HBr不和KI反应,故淀粉和KI混合液不可检测HBr,丙中试剂检验HBr可用硝酸银溶液等,C项错误;苯和溴苯可以用蒸馏的方法分离,图丁所示装置温度计水银球应位于蒸馏烧瓶的支管口处,D项错误。]
4.C [电子层数越多半径越大,电子层数相同时,核电荷数越大,半径越小,半径大小:r(Al3+)<r(Na+),A错误;同主族元素由上而下,金属性增强,非金属性逐渐减弱,元素电负性减弱,电负性大小:χ(Na)<χ(H),B错误;同主族元素随原子序数变大,原子半径变大,第一电离能变小,第一电离能:I1(Li)>I1(Na),C正确;金属性越强,最高价氧化物对应水化物的碱性越强,碱性强弱:LiOH<NaOH,D错误。]
5.D [铜可用作印刷电路板是因为铜可以与铁离子反应,与导热性无关,故A不符合题意;硫酸铜溶液可用作泳池杀菌剂是因为硫酸铜具有杀菌消毒作用,与酸性无关,故B不符合题意;溴化银可用于制作相机胶片是因为溴化银具有感光性,与颜色无关,故C不符合题意;银氨溶液具有弱氧化性,可以和具有还原性的醛基发生氧化还原反应而被还原为银,故D符合题意。]
6.C [过滤时不能用玻璃棒搅拌漏斗中的液体,防止滤纸破损,A错误;配制Na2S溶液时,向其中加入少量NaOH溶液,可抑制硫离子水解,但OH-浓度增大的更多,的值减小,B错误;灼烧Ag2S生成Ag和SO2,S元素化合价从-2价升高到+4价,失去6个电子,所以该反应每生成1 mol Ag,同时有0.5 mol硫元素被氧化,转移3 mol电子,C正确;分液时,先放出水层,再从分液漏斗上口倒出含有苯和溴的有机层,D错误。]
7.D [Na与CuSO4溶液反应生成硫酸钠、氢气和氢氧化铜,不会置换出Cu:2Na+Cu2++2H2O===Cu(OH)2↓+2Na++H2↑,A错误;用惰性电极电解硫酸铜溶液:2Cu2++2H2O2Cu+O2↑+4H+,用铜电极时阳极铜失去电子被氧化,B错误;稀硝酸洗涤做过银镜反应的试管,银与硝酸反应生成硝酸银、水和一氧化氮:3Ag+4H++NO===3Ag++NO↑+2H2O,C错误。]
8.B [含铬废液加入氢氧化钾调节pH,将三价铬转化为Cr(OH)3、将铁离子转化为氢氧化铁,过滤后滤渣加入过氧化氢、氢氧化钾将Cr(OH)3转化为CrO,过滤分离出滤液,向滤液中加入盐酸酸化得到含有K2Cr2O7的溶液;“过滤Ⅰ”所得滤液中pH=8,则pOH=6,
c(OH-)=1×10-6 mol·L-1,c(Cr3+)===6×10-13 mol·L-1,A错误;已知“氧化”时Cr(OH)3转化为CrO,过氧化氢具有强氧化性,“氧化”时过氧化氢在碱性条件下将Cr(OH)3氧化为CrO,离子方程式为4OH-+2Cr(OH)3+3H2O2===2CrO+8H2O,B正确;Cr2O(橙色)+H2O2H++2CrO(黄色),“酸化”时溶液pH越低,氢离子浓度越大,平衡逆向移动,使得CrO转化为Cr2O的比例越高,C错误;K2Cr2O7在高温下会分解,将“含K2Cr2O7溶液”蒸干得不到纯净的K2Cr2O7固体,D错误。]
9.B [饱和碳原子具有甲烷结构特点,甲烷分子中最多有3个原子共平面,苯环上所有原子共平面,丙酮中3个碳原子共平面,单键可以旋转,X相当于苯分子中的2个氢原子被丙酮基、CH3O—取代,所以该分子中所有碳原子可能共平面,A错误;Y中含有亲水基氨基、羟基且Y相对分子质量较小,所以Y易溶于水,B正确;根据M的结构简式、Z的分子式知,X中羰基和Y中氨基发生加成反应生成Z为,该反应为加成反应,C错误;M分子中连接双键及苯环上的碳原子都采用sp2杂化,所以M中采用sp2杂化的碳原子有7个,D错误。]
10.A [N2(g)+3H2(g)2NH3(g)的正反应是气体体积减小的反应,在t1时刻扩大容器体积,导致NH3气体的浓度降低,体系的压强减小,v逆减小,化学平衡向气体体积增大的逆反应方向移动,导致NH3的浓度进一步减小,v逆减小,后到t2时反应达到平衡状态,故可以表示v逆随时间变化的曲线,A正确;A、B两点NH3的平衡含量相同,但反应体系中越大反应的H2的物质的量就越多,H2的转化率就越大,所以转化率:αA(H2)<αB(H2),B错误;开始时溶液pH相等,溶液中c(OH-)相等,但NaOH是强电解质完全电离,而氨水中存在电离平衡,所以开始时浓度c(NH3·H2O)>c(NaOH),当二者稀释相同倍数时,稀释使溶液中c(OH-)减小,氨水中电离平衡正向移动,最终达到平衡时氨水中c(OH-)比NaOH大,溶液pH更大,故曲线Ⅰ表示NaOH溶液,曲线Ⅱ表示氨水,C错误;CH3COOH溶液中存在电离平衡:CH3COOHCH3COO-+H+,溶液中含有自由移动的离子,因此能够导电,向溶液中通入NH3,反应产生盐CH3COONH4,导致溶液中自由移动的离子浓度增大,溶液导电性增强,当二者恰好反应时离子浓度最大,溶液导电能力最强,因此图示不能表示CH3COOH溶液中通入NH3至过量的过程中溶液导电性的变化,D错误。]
11.D [乙醇和水均能与钠反应放出氢气,A不选;久置的Na2SO3会被氧气氧化为Na2SO4,通过检验硫酸根离子可探究Na2SO3是否变质,但该实验方案中滴加H2SO4酸化引入了SO,对硫酸根离子的检验会造成干扰,因此不能达到探究目的,B不选;反应生成的乙烯和挥发出来的乙醇都能使酸性KMnO4溶液褪色,因此不能达到探究乙烯具有还原性的目的,C不选;室温下,通过测定0.1 mol·L-1 NaHC2O4溶液的pH,可知HC2O电离程度与水解程度的大小,进而通过比较Kh=和Ka2(H2C2O4)的大小,可得出Ka1(H2C2O4)·Ka2(H2C2O4)与Kw的大小,能达到目的,D选。]
12.D [“制酸过滤”过程所得滤渣的主要成分为二氧化硅,A错误;三辛胺的结构简式为N(C8H17)3,与盐酸反应时,三辛胺的N原子提供孤电子对,H+提供空轨道,B错误;曲线A表示H3PO4、曲线B表示H2PO、曲线C表示HPO、曲线D表示PO的分布分数与溶液pH的关系,根据图示可知“反应”中为获得较纯净KH2PO4,当溶液pH=4.5时,H2PO的含量最大,此时应该停止加入三辛胺,C错误;对于0.1 mol·L-1 KH2PO4溶液,根据质子守恒可得:①c(H+)=c(OH-)+c(HPO)+2c(PO)-c(H3PO4);根据元素质量守恒可得:②c(K+)=c(H3PO4)+c(H2PO)+c(HPO)+c(PO),将②-①整理可得c(K+)-c(H+)=2c(H3PO4)+c(H2PO)-c(PO)-c(OH-),c(H+)-c(OH-)=c(K+)-2c(H3PO4)-c(H2PO)+c(PO),H2PO水解小于电离,溶液显酸性,所以c(H+)-c(OH-)>0,根据溶液组成可知c(K+)=0.1 mol·L-1,所以2c(H3PO4)+c(H2PO)<0.1 mol·L-1+c(PO),D正确。]
13.D [由热化学方程式可知,反应1为吸热反应,升高温度,平衡向正反应方向移动,C2H4的物质的量分数增大,反应2和反应3都是放热反应,升高温度,平衡向逆反应方向移动,C2H4的物质的量分数增大、C3H6的物质的量分数减小,从以上两个角度考虑,C2H4的含量会随着温度的升高不断增大,故物质Y代表C2H4,而物质X代表C3H6,从反应热效应的角度考虑,反应2放出的热量小,温度升高对其影响更小,图中物质X即C3H6含量开始下降对应的温度比C4H8的更高也验证了这一点,故可知曲线X表示C3H6的物质的量分数随温度的变化,故A错误;由图可知,700 K时产物C3H6的物质的量分数为7.5%,故p(C3H6)=0.007 5 MPa,反应物p(C2H4)=0.002 5 MPa,根据分压平衡常数计算公式可得Kp==3 600 MPa-1,故B错误;考查反应2和反应3的速率可以从二者共同的反应物C2H4的消耗速率出发,达到平衡时两反应所用时间相同,反应2的产物C3H6的含量低于反应3的产物C4H8的含量,再乘上各自反应计量数比例可得反应2的速率明显小于反应3,故C错误;由题意可知增大压强的方法应当是直接压缩容器,此时反应平衡会朝着使气体分子数减少的方向移动。即反应1向逆反应方向移动,反应2和反应3均向正反应方向移动,C2H4的含量会减少即体积分数减小,故D正确。]
1.NaClO是家用消毒液的有效成分,这是利用了NaClO的( )
A.碱性 B.强氧化性
C.还原性 D.受热后不稳定性
2.Cu2O可用作涂料,可由反应2CuSO4+3Na2SO3===Cu2O↓+3Na2SO4+2SO2↑制得。下列说法正确的是( )
A.基态Cu原子的电子排布式为[Ar]3d104s1
B.Cu2O中O元素的化合价为-4
C.SO的空间构型为平面四边形
D.SO2晶体的类型为共价晶体
3.实验室用如图装置制备溴苯并验证反应有HBr生成。下列说法正确的是( )
A.X为苯和溴水的混合液
B.Y可以是CCl4
C.Z可以是淀粉和KI混合液
D.苯和溴苯可以用如图丁所示装置分离
4.LiAlH4是重要的还原剂,合成方法:NaAlH4+LiCl===LiAlH4+NaCl。下列说法正确的是( )
A.半径大小:r(Al3+)>r(Na+)
B.电负性大小:χ(Na)>χ(H)
C.第一电离能:I1(Li)>I1(Na)
D.碱性强弱:LiOH>NaOH
阅读下列材料,回答5~7题。
铜、银位于周期表中第ⅠB族。铜、硫酸铜、硝酸银、银氨溶液是实验室常用的含铜或银的化学试剂。从废定影液[主要含有H+、Ag(S2O3)、H2SO3、Br-等微粒]中回收Ag和Br2的主要步骤:向该废定影液中加入氢氧化钠调节pH在7.5~8.5之间,然后再加入稍过量Na2S溶液沉银,过滤、洗涤及干燥,灼烧Ag2S制Ag;滤液中通入Cl2氧化Br-,用苯萃取分液。
5.下列有关物质的性质与用途具有对应关系的是( )
A.铜具有良好导热性,可用于制作印刷电路板
B.硫酸铜溶液显酸性,可用作泳池杀菌剂
C.溴化银呈淡黄色,可用于制作相机胶片
D.银氨溶液具有弱氧化性,可用于制作银镜
6.下列有关从废定影液中回收Ag和Br2的说法正确的是( )
A.过滤时,为加快滤液流下,可以用玻璃棒搅拌漏斗中的液体
B.配制Na2S溶液时,向其中加入少量NaOH溶液,的值增大
C.灼烧Ag2S生成Ag和SO2,该反应每生成1 mol Ag转移3 mol电子
D.分液时,先放出水层,再从分液漏斗下口放出含有苯和溴的有机层
7.下列化学反应表示正确的是( )
A.硫酸铜溶液中加入小粒金属钠:Cu2++2Na===Cu+2Na+
B.用铜电极电解硫酸铜溶液:2Cu2++2H2O2Cu+O2↑+4H+
C.稀硝酸洗涤做过银镜反应的试管:Ag+2H++NO===Ag++NO↑+H2O
D.多余的[Ag(NH3)2]OH用硝酸处理:[Ag(NH3)2]++OH-+3H+===Ag++2NH+H2O
8.室温时,实验室以含铬废液(主要离子含K+、Fe3+、Cr3+、SO)制取含K2Cr2O7溶液的流程如下:
已知:①室温时,Ksp[Cr(OH)3]=6×10-31,Ksp[Fe(OH)3]=4×10-38;
②“氧化”时Cr(OH)3转化为CrO。
下列说法正确的是( )
A.“过滤Ⅰ”所得滤液中c(Cr3+)=6×10-7 mol·L-1
B.“氧化”时的离子方程式为4OH-+2Cr(OH)3+3H2O2===2CrO+8H2O
C.“酸化”时溶液pH越低,CrO转化为Cr2O的比例越低
D.将“含K2Cr2O7溶液”蒸干可得纯净的K2Cr2O7固体
9.物质M是一种治疗心血管药物的中间体,其合成路线如图所示。下列说法正确的是( )
A.X分子中所有碳原子不可能在同一平面
B.Y易溶于水
C.X+Y―→Z的反应类型为取代反应
D.M分子中sp2杂化的碳原子有6个
10.化学常用图像直观地描述化学反应的进程或结果。下列与NH3有关的图像描述正确的是( )
A.图①表示N2(g)+3H2(g)2NH3(g)在t1时刻扩大容器体积,v逆随时间变化的曲线
B.图②表示N2(g)+3H2(g)2NH3(g)平衡时NH3体积分数随起始变化的曲线,则转化率:αA(H2)=αB(H2)
C.图③表示25 ℃时分别稀释pH=1的NaOH溶液和氨水时溶液pH的变化,曲线Ⅰ表示氨水
D.图④可表示CH3COOH溶液中通入NH3至过量的过程中溶液导电性的变化
11.下列实验探究方案能达到相应探究目的的是( )
选项 探究方案 探究目的
A 向乙醇中加入一小粒金属钠,观察现象 乙醇中是否含有水
B 取少量久置的Na2SO3粉末于试管中,向其中滴加H2SO4酸化,再滴加BaCl2溶液,观察现象 Na2SO3是否变质
C 将乙醇和浓硫酸在170 ℃时共热所得气体通入酸性KMnO4溶液中,观察现象 乙烯具有还原性
D 室温下,测定0.1 mol·L-1 NaHC2O4溶液的pH 比较Ka1(H2C2O4)·Ka2(H2C2O4)与Kw的大小
12.工业上以羟磷灰石精矿[主要成分是Ca5(PO4)3OH,还含有少量石英和氧化铁等杂质]为原料,生产磷酸二氢钾(KH2PO4)的流程如下:
已知:溶液中H3PO4、H2PO、HPO、PO的分布分数δ随pH的变化如图所示。
下列说法正确的是( )
A.“制酸过滤”过程所得滤渣的主要成分为硅酸
B.三辛胺的结构简式为N(C8H17)3,与盐酸反应时,三辛胺提供空轨道
C.“反应”中为获得较纯净KH2PO4,当pH=10时,停止加入三辛胺
D.0.1 mol·L-1 KH2PO4溶液中:2c(H3PO4)+c(H2PO)<0.1 mol·L-1+c(PO)
13.碘甲烷(CH3I)可裂解制取低碳烯烃。碘甲烷裂解时可发生如下反应:
反应1:2CH3I(g)C2H4(g)+2HI(g) ΔH=+80.2 kJ·mol-1
反应2:3C2H4(g)2C3H6(g) ΔH=-108.1 kJ·mol-1
反应3:2C2H4(g)C4H8(g) ΔH=-120.6 kJ·mol-1
向密闭容器中充入一定量的碘甲烷,维持容器内p=0.1 MPa,平衡时C2H4、C3H6和C4H8的物质的量分数与温度的关系如图所示。已知容器中某气体的分压p=φ(物质的量分数)×p总,用气体物质的分压替换浓度计算得到的平衡常数称为分压平衡常数(Kp)。下列说法正确的是( )
A.图中物质X表示的是C2H4
B.700 K时,反应2的分压平衡常数Kp=3
C.700 K时,从反应开始至恰好平衡,反应2的速率大于反应3的速率
D.700 K时,其他条件不变,将容器内p增大为0.2 MPa,C2H4的体积分数将减小
选择题标准练(八)
1.B [NaClO具有强氧化性,可以使蛋白质变性,从而起到杀菌消毒的作用,选项B正确。]
2.A [已知Cu为29号元素,故基态Cu原子的电子排布式为[Ar]3d104s1,A正确;Cu2O中O元素的化合价为-2,Cu为+1价,B错误;SO中心原子S原子的价层电子对数为4+×(6+2-4×2)=4,故其空间结构为正四面体形,C错误;SO2晶体是由SO2分子通过范德华力作用形成的分子晶体,D错误。]
3.B [苯与溴水不反应,应该使用液溴,A项错误;溴易溶于四氯化碳,装置中挥发的Br2被CCl4吸收,防止对HBr的检测产生干扰,B项正确;HBr不和KI反应,故淀粉和KI混合液不可检测HBr,丙中试剂检验HBr可用硝酸银溶液等,C项错误;苯和溴苯可以用蒸馏的方法分离,图丁所示装置温度计水银球应位于蒸馏烧瓶的支管口处,D项错误。]
4.C [电子层数越多半径越大,电子层数相同时,核电荷数越大,半径越小,半径大小:r(Al3+)<r(Na+),A错误;同主族元素由上而下,金属性增强,非金属性逐渐减弱,元素电负性减弱,电负性大小:χ(Na)<χ(H),B错误;同主族元素随原子序数变大,原子半径变大,第一电离能变小,第一电离能:I1(Li)>I1(Na),C正确;金属性越强,最高价氧化物对应水化物的碱性越强,碱性强弱:LiOH<NaOH,D错误。]
5.D [铜可用作印刷电路板是因为铜可以与铁离子反应,与导热性无关,故A不符合题意;硫酸铜溶液可用作泳池杀菌剂是因为硫酸铜具有杀菌消毒作用,与酸性无关,故B不符合题意;溴化银可用于制作相机胶片是因为溴化银具有感光性,与颜色无关,故C不符合题意;银氨溶液具有弱氧化性,可以和具有还原性的醛基发生氧化还原反应而被还原为银,故D符合题意。]
6.C [过滤时不能用玻璃棒搅拌漏斗中的液体,防止滤纸破损,A错误;配制Na2S溶液时,向其中加入少量NaOH溶液,可抑制硫离子水解,但OH-浓度增大的更多,的值减小,B错误;灼烧Ag2S生成Ag和SO2,S元素化合价从-2价升高到+4价,失去6个电子,所以该反应每生成1 mol Ag,同时有0.5 mol硫元素被氧化,转移3 mol电子,C正确;分液时,先放出水层,再从分液漏斗上口倒出含有苯和溴的有机层,D错误。]
7.D [Na与CuSO4溶液反应生成硫酸钠、氢气和氢氧化铜,不会置换出Cu:2Na+Cu2++2H2O===Cu(OH)2↓+2Na++H2↑,A错误;用惰性电极电解硫酸铜溶液:2Cu2++2H2O2Cu+O2↑+4H+,用铜电极时阳极铜失去电子被氧化,B错误;稀硝酸洗涤做过银镜反应的试管,银与硝酸反应生成硝酸银、水和一氧化氮:3Ag+4H++NO===3Ag++NO↑+2H2O,C错误。]
8.B [含铬废液加入氢氧化钾调节pH,将三价铬转化为Cr(OH)3、将铁离子转化为氢氧化铁,过滤后滤渣加入过氧化氢、氢氧化钾将Cr(OH)3转化为CrO,过滤分离出滤液,向滤液中加入盐酸酸化得到含有K2Cr2O7的溶液;“过滤Ⅰ”所得滤液中pH=8,则pOH=6,
c(OH-)=1×10-6 mol·L-1,c(Cr3+)===6×10-13 mol·L-1,A错误;已知“氧化”时Cr(OH)3转化为CrO,过氧化氢具有强氧化性,“氧化”时过氧化氢在碱性条件下将Cr(OH)3氧化为CrO,离子方程式为4OH-+2Cr(OH)3+3H2O2===2CrO+8H2O,B正确;Cr2O(橙色)+H2O2H++2CrO(黄色),“酸化”时溶液pH越低,氢离子浓度越大,平衡逆向移动,使得CrO转化为Cr2O的比例越高,C错误;K2Cr2O7在高温下会分解,将“含K2Cr2O7溶液”蒸干得不到纯净的K2Cr2O7固体,D错误。]
9.B [饱和碳原子具有甲烷结构特点,甲烷分子中最多有3个原子共平面,苯环上所有原子共平面,丙酮中3个碳原子共平面,单键可以旋转,X相当于苯分子中的2个氢原子被丙酮基、CH3O—取代,所以该分子中所有碳原子可能共平面,A错误;Y中含有亲水基氨基、羟基且Y相对分子质量较小,所以Y易溶于水,B正确;根据M的结构简式、Z的分子式知,X中羰基和Y中氨基发生加成反应生成Z为,该反应为加成反应,C错误;M分子中连接双键及苯环上的碳原子都采用sp2杂化,所以M中采用sp2杂化的碳原子有7个,D错误。]
10.A [N2(g)+3H2(g)2NH3(g)的正反应是气体体积减小的反应,在t1时刻扩大容器体积,导致NH3气体的浓度降低,体系的压强减小,v逆减小,化学平衡向气体体积增大的逆反应方向移动,导致NH3的浓度进一步减小,v逆减小,后到t2时反应达到平衡状态,故可以表示v逆随时间变化的曲线,A正确;A、B两点NH3的平衡含量相同,但反应体系中越大反应的H2的物质的量就越多,H2的转化率就越大,所以转化率:αA(H2)<αB(H2),B错误;开始时溶液pH相等,溶液中c(OH-)相等,但NaOH是强电解质完全电离,而氨水中存在电离平衡,所以开始时浓度c(NH3·H2O)>c(NaOH),当二者稀释相同倍数时,稀释使溶液中c(OH-)减小,氨水中电离平衡正向移动,最终达到平衡时氨水中c(OH-)比NaOH大,溶液pH更大,故曲线Ⅰ表示NaOH溶液,曲线Ⅱ表示氨水,C错误;CH3COOH溶液中存在电离平衡:CH3COOHCH3COO-+H+,溶液中含有自由移动的离子,因此能够导电,向溶液中通入NH3,反应产生盐CH3COONH4,导致溶液中自由移动的离子浓度增大,溶液导电性增强,当二者恰好反应时离子浓度最大,溶液导电能力最强,因此图示不能表示CH3COOH溶液中通入NH3至过量的过程中溶液导电性的变化,D错误。]
11.D [乙醇和水均能与钠反应放出氢气,A不选;久置的Na2SO3会被氧气氧化为Na2SO4,通过检验硫酸根离子可探究Na2SO3是否变质,但该实验方案中滴加H2SO4酸化引入了SO,对硫酸根离子的检验会造成干扰,因此不能达到探究目的,B不选;反应生成的乙烯和挥发出来的乙醇都能使酸性KMnO4溶液褪色,因此不能达到探究乙烯具有还原性的目的,C不选;室温下,通过测定0.1 mol·L-1 NaHC2O4溶液的pH,可知HC2O电离程度与水解程度的大小,进而通过比较Kh=和Ka2(H2C2O4)的大小,可得出Ka1(H2C2O4)·Ka2(H2C2O4)与Kw的大小,能达到目的,D选。]
12.D [“制酸过滤”过程所得滤渣的主要成分为二氧化硅,A错误;三辛胺的结构简式为N(C8H17)3,与盐酸反应时,三辛胺的N原子提供孤电子对,H+提供空轨道,B错误;曲线A表示H3PO4、曲线B表示H2PO、曲线C表示HPO、曲线D表示PO的分布分数与溶液pH的关系,根据图示可知“反应”中为获得较纯净KH2PO4,当溶液pH=4.5时,H2PO的含量最大,此时应该停止加入三辛胺,C错误;对于0.1 mol·L-1 KH2PO4溶液,根据质子守恒可得:①c(H+)=c(OH-)+c(HPO)+2c(PO)-c(H3PO4);根据元素质量守恒可得:②c(K+)=c(H3PO4)+c(H2PO)+c(HPO)+c(PO),将②-①整理可得c(K+)-c(H+)=2c(H3PO4)+c(H2PO)-c(PO)-c(OH-),c(H+)-c(OH-)=c(K+)-2c(H3PO4)-c(H2PO)+c(PO),H2PO水解小于电离,溶液显酸性,所以c(H+)-c(OH-)>0,根据溶液组成可知c(K+)=0.1 mol·L-1,所以2c(H3PO4)+c(H2PO)<0.1 mol·L-1+c(PO),D正确。]
13.D [由热化学方程式可知,反应1为吸热反应,升高温度,平衡向正反应方向移动,C2H4的物质的量分数增大,反应2和反应3都是放热反应,升高温度,平衡向逆反应方向移动,C2H4的物质的量分数增大、C3H6的物质的量分数减小,从以上两个角度考虑,C2H4的含量会随着温度的升高不断增大,故物质Y代表C2H4,而物质X代表C3H6,从反应热效应的角度考虑,反应2放出的热量小,温度升高对其影响更小,图中物质X即C3H6含量开始下降对应的温度比C4H8的更高也验证了这一点,故可知曲线X表示C3H6的物质的量分数随温度的变化,故A错误;由图可知,700 K时产物C3H6的物质的量分数为7.5%,故p(C3H6)=0.007 5 MPa,反应物p(C2H4)=0.002 5 MPa,根据分压平衡常数计算公式可得Kp==3 600 MPa-1,故B错误;考查反应2和反应3的速率可以从二者共同的反应物C2H4的消耗速率出发,达到平衡时两反应所用时间相同,反应2的产物C3H6的含量低于反应3的产物C4H8的含量,再乘上各自反应计量数比例可得反应2的速率明显小于反应3,故C错误;由题意可知增大压强的方法应当是直接压缩容器,此时反应平衡会朝着使气体分子数减少的方向移动。即反应1向逆反应方向移动,反应2和反应3均向正反应方向移动,C2H4的含量会减少即体积分数减小,故D正确。]
同课章节目录
