综合大题标准练(四)(含答案)-2024年江苏高考化学二轮复习
文档属性
| 名称 | 综合大题标准练(四)(含答案)-2024年江苏高考化学二轮复习 |  | |
| 格式 | docx | ||
| 文件大小 | 740.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-17 15:25:57 | ||
图片预览




文档简介
2024年江苏高考化学 综合大题标准练(四)
1.用镍铂合金废料(主要成分为Ni、Pt,含少量Al和难溶于硫酸的重金属)回收镍和铂的一种工艺流程如下:
(1)“酸浸”后分离出的溶液中c(Ni2+)=0.2 mol·L-1,c(Al3+)=0.01 mol·L-1,当溶液中离子浓度<10-5 mol·L-1时可认为沉淀完全,则“调pH”应控制pH的范围是____________。{设“调pH”时溶液体积不变,已知:Ksp[Ni(OH)2]=2×10-15、Ksp[Al(OH)3]=1×10-33}
(2)“控温氧化”时控制其他条件一定,Ni2O3的产率与温度和时间的关系如图所示。20 ℃、40 ℃时反应后所得滤液主要成分为NaCl、NaOH和Na2SO4,60 ℃时反应后所得滤液主要成分为NaCl、NaClO3、NaOH和Na2SO4。反应相同时间,60 ℃时Ni2O3的产率低于40 ℃时,原因可能是_____________________________________________________________________________________________________________________________________________________。
(3)“含Pt滤渣”中的Pt可以用王水(体积比3∶1的浓盐酸和浓硝酸的混合液)浸出。浸出时有H2PtCl6和NO生成。向H2PtCl6溶液中加入NH4Cl会生成(NH4)2PtCl6沉淀。
①写出浸出时Pt所发生反应的化学方程式:_________________________________________________________。
②(NH4)2PtCl6在一定温度下可以分解生成Pt(NH3)2Cl2。Pt(NH3)2Cl2存在顺式和反式两种结构。请在如图的两个结构中,选择其中一个,填入相应的基团表示Pt(NH3)2Cl2的顺式结构。
(4)Ni2O3产品中可能含少量NiO,为测定Ni2O3的纯度,进行如下实验:称取5.000 g样品,加入足量硫酸后,再加入100 mL 1.000 mol·L-1Fe2+标准溶液,充分反应,加水定容至200 mL。取出20.00 mL,用0.100 mol·L-1 KMnO4标准溶液滴定,到达滴定终点时消耗KMnO4标准溶液10.00 mL。实验过程中发生反应如下:
Ni2O3+Fe2++H+―→Ni2++Fe3++H2O(未配平)
Fe2++MnO+H+―→Fe3++Mn2++H2O(未配平)
试通过计算确定Ni2O3的质量分数,并写出计算过程。
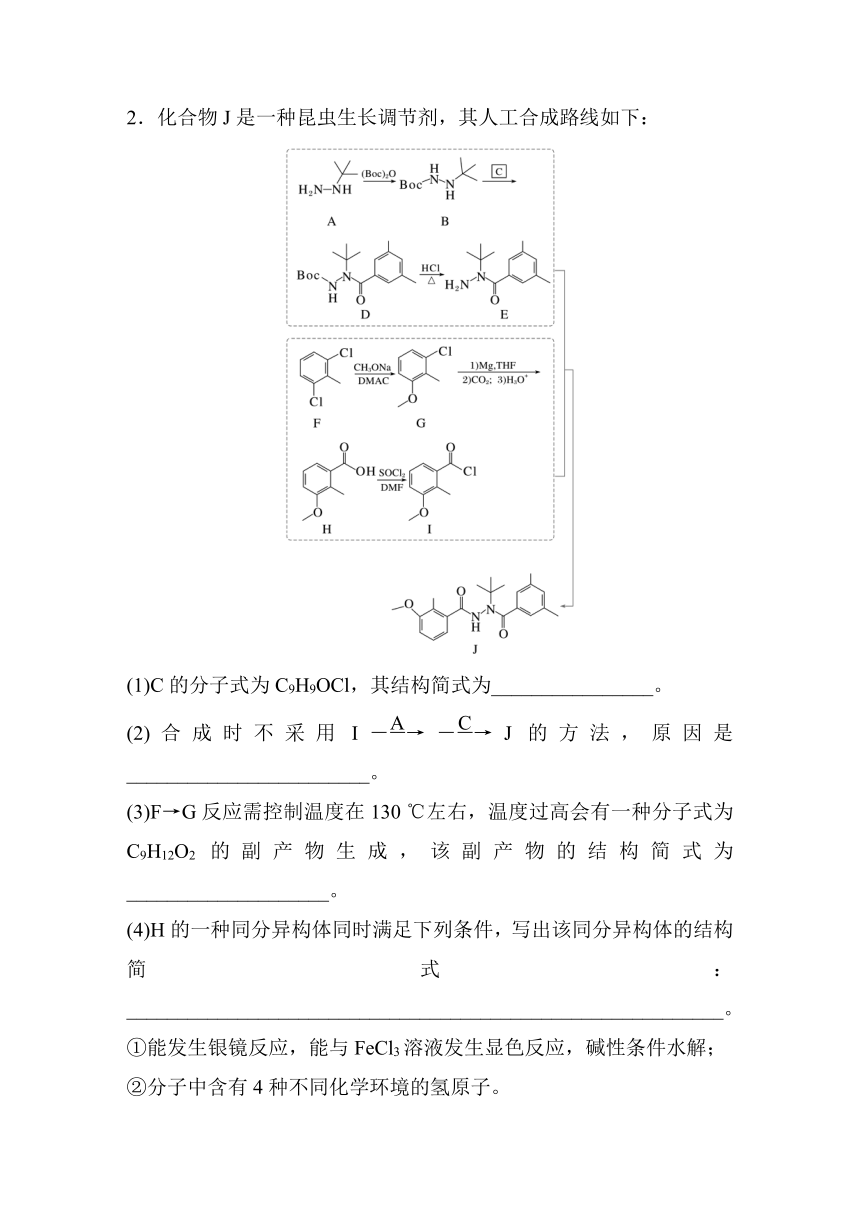
2.化合物J是一种昆虫生长调节剂,其人工合成路线如下:
(1)C的分子式为C9H9OCl,其结构简式为________________。
(2)合成时不采用IJ的方法,原因是________________________。
(3)F→G反应需控制温度在130 ℃左右,温度过高会有一种分子式为C9H12O2的副产物生成,该副产物的结构简式为____________________。
(4)H的一种同分异构体同时满足下列条件,写出该同分异构体的结构简式:___________________________________________________________。
①能发生银镜反应,能与FeCl3溶液发生显色反应,碱性条件水解;
②分子中含有4种不同化学环境的氢原子。
(5)已知:。写出以甲苯、BocNHNH2为原料制备的合成路线流程图(无机试剂和有机溶剂任用,合成路线流程图示例见本题题干)。
3.LiFePO4和Li2CO3都是重要的锂的化合物。
Ⅰ.LiFePO4电极材料是动力型锂离子电池的理想正极材料。它可以通过H3PO4、LiOH和(NH4)2Fe(SO4)2溶液发生共沉淀反应、将所得沉淀干燥、高温成型而制得。实验室制备LiFePO4的方法如下:
步骤1 将LiOH置于如图所示实验装置的三颈烧瓶中,加入煮沸过的蒸馏水,搅拌使其溶解。从分液漏斗中滴加H3PO4溶液,并持续通入氮气。
步骤2 将(NH4)2Fe(SO4)2固体溶于蒸馏水中,迅速倒入三颈烧瓶中,快速搅拌,充分反应后,过滤、洗涤滤渣得LiFePO4固体。
(1)共沉淀反应投料时,不将FeSO4和LiOH溶液直接混合的原因是_____________________________________________________________________________________________________。
(2)写出共沉淀反应的化学方程式:__________________________________。
(3)工业制取LiFePO4在高温成型前,常向LiFePO4中加入少量活性炭黑,其作用除了可以改善成型后LiFePO4的导电性能外,还能____________________________________________。
Ⅱ.磷酸锂渣(主要成分为Li3PO4)和废旧电极材料(含铝、炭、LiFePO4和FePO4)均可用于制取Li2CO3。
(4)实验室以磷酸锂渣为原料制备高纯Li2CO3的部分实验流程如下:
①“低酸转化”使Li3PO4转化为Li2HPO4。写出“磷锂分离”的化学方程式:___________________________________________________________________________________________。
②已知:三辛胺[N(C8H17)3]是一种有机碱,难溶于水。向“萃取”后的溶液中加入三辛胺再通入CO2得到Li2CO3沉淀,加入三辛胺的目的是_________________________________________________________。
(5)已知:Li2CO3微溶于水;LiFePO4、FePO4难溶于水和碱,可溶于盐酸生成LiCl、FeCl2、FeCl3和H3PO4;pH>3.2时,Fe3+沉淀完全。完善由某废旧电极材料制取Li2CO3的实验方案:边搅拌边向废旧电极材料中加入NaOH溶液至不再产生气泡,过滤,__________________
______________________________________________________________________________,过滤、洗涤,低温干燥得Li2CO3固体。(实验中须使用的试剂有双氧水、盐酸、NaOH溶液、Na2CO3溶液)
4.烟气中的NOx是大气的主要污染物之一,NOx的吸收处理是当前研究的热点。
(1)还原吸收法
方法1:直接使用尿素[CO(NH2)2]溶液吸收烟气中的NOx。
方法2:先用合适的氧化剂将NOx中的NO氧化为NO2,再用CO(NH2)2溶液去还原吸收。
还原吸收等量的NOx,消耗尿素较多的是________(填“方法1”或“方法2”)。工业上选择方法2处理NOx的原因是____________________________________________________。
(2)水吸收法
NO2和N2O4均能被水吸收,不同初始压强下,NO2和N2O4的混合气体被水吸收前和吸收达到平衡后,气体中NO2和N2O4的体积分数如图所示。混合气体中与水反应的主要成分是________________。达到平衡后,气体中NO2和N2O4的体积分数之和远小于100%,原因是____________________。
(3)配合物吸收法
钴氨配合物吸收NO的主要原理如图。已知[Co(NH3)6]2+对NO的配合能力很强,而[Co(NH3)6]3+对NO的配合能力极低。
①与NO反应的[Co(NH3)6]2+和与O2反应的[Co(NH3)6]2+物质的量之比为__________。
②钴氨溶液经过多次循环吸收NO后,其吸收NO的能力会降低,为了恢复钴氨溶液吸收NO的能力,需采取的方法是__________。
(4)NO与O2在某催化剂表面反应生成NO2的过程中,O2在催化剂表面能形成被吸附的O(用O-Site表示),接下来的机理可能有两种:
机理1:NO(g)+O-SiteNO2-Site
机理2:NO-Site+O-SiteSite+NO2-Site
上述两个反应均为基元反应。保持温度和NO的浓度不变,测得NO与O2在该催化剂作用下反应的初始速率与O2浓度的关系如图所示。能合理解释图中曲线变化的机理为_________(填“机理1”或“机理2”);判断的依据是________________________________________。
综合大题标准练(四)
1.(1)4.7≤pH<7
(2)60 ℃,部分NaClO分解生成NaCl和NaClO3,NaClO浓度减小,反应速率减慢
(3)①3Pt+18HCl+4HNO3===3H2PtCl6+4NO↑+8H2O
②
(4)n(KMnO4)=0.100 mol·L-1×0.010 L=1×10-3 mol,n(Fe2+)=1.000 mol·L-1×0.100 L=0.1 mol,与KMnO4标准溶液反应的n(Fe2+)=5×1×10-3 mol=5×10-3 mol,与Ni2O3反应的
n(Fe2+)=0.1 mol-×5×10-3 mol=0.05 mol,n(Ni2O3)=×0.05 mol=0.025 mol,m(Ni2O3)=0.025 mol×166 g·mol-1=4.15 g,Ni2O3的质量分数为×100%=83%
解析 (1)调pH的目的是为了让Al3+完全沉淀,根据Ksp[Al(OH)3]=1×10-33,当溶液中的c(Al3+)=10-5 mol·L-1时,溶液的pH≈4.7,此时溶液中的Ni2+不能沉淀,结合Ksp[Ni(OH)2]=2×10-15,溶液中c(Ni2+)=0.2 mol·L-1,当Ni2+开始沉淀时,溶液pH=7,故pH<7时不会影响Ni2+,所以调节溶液pH的范围应为4.7≤pH<7。
(3)①用王水浸出Pt时有H2PtCl6和NO生成,据此推断出反应物为Pt、HCl和HNO3,生成物为H2PtCl6和NO,根据元素守恒、得失电子守恒进行方程式的书写配平,并确定另一产物为H2O,故浸出时Pt所发生反应的化学方程式为3Pt+18HCl+4HNO3===3H2PtCl6+4NO↑+8H2O。②顺、反式结构的研究对象一般为有机物,通常两个相同原子或基团在双键同一侧的为顺式异构体,在两侧的为反式结构,故答案为。
2.(1) (2)I直接与A反应有副产物生成 (3)
(4)(或)
(5)
解析 (1)结合C的分子式C9H9OCl和B、D的结构简式可知,B中N—H键断裂,则C中断C—Cl键,发生取代反应生成产物HCl,据此可知C为。(3)F→G反应温度过高,可能导致另外一个碳氯键同样发生取代反应得到醚结构,结合分子式C9H12O2可知副产物为。(4)H的同分异构体能发生银镜反应,能与FeCl3溶液发生显色反应,碱性条件水解说明既含有酚羟基又含有甲酸酯基,结合分子中含有4种不同化学环境的氢原子可知H的同分异构体为或。
3.(1)FeSO4和LiOH溶液直接混合生成Fe(OH)2,而Fe(OH)2极易被氧化,最终产品中混有Fe(Ⅲ)化合物
(2)(NH4)2Fe(SO4)2+LiOH+H3PO4===LiFePO4↓+2NH4HSO4+H2O
(3)利用其还原性,防止Fe(Ⅱ)被氧化
(4)①2Li2HPO4+3CaCl2===Ca3(PO4)2↓+4LiCl+2HCl
②萃取后的LiCl溶液中混有HCl,三辛胺将溶液中的HCl反应除去,减小溶液中H+浓度,又能增大CO浓度,从而有利于Li2CO3生成
(5)向滤渣中边搅拌边加入盐酸,至固体不再减少,过滤;向滤液中加入过量的双氧水,再逐滴加入NaOH溶液至溶液pH大于3.2,过滤;边搅拌边向滤液中滴加Na2CO3溶液至产生大量沉淀,静置,向上层清液中滴加Na2CO3溶液,若无沉淀生成
解析 (4)①根据流程图可知“磷锂分离”的原理是Li2HPO4与CaCl2反应,化学方程式为2Li2HPO4+3CaCl2===Ca3(PO4)2↓+4LiCl+2HCl。(5)废旧电极材料中加入NaOH溶液至不再产生气泡,过滤,已将铝溶解除去,剩余固体成分为炭、LiFePO4和FePO4,从中获得含Li+溶液并沉淀生成Li2CO3的基本思路:用酸溶解、过滤,除炭;将Fe2+氧化、调节pH除Fe3+;用Na2CO3溶液沉淀Li+得Li2CO3。
4.(1)方法2 NO2在水中溶解性好,与尿素溶液反应速率快;NO2的氧化性强于NO (2)N2O4 NO2和N2O4与水反应后生成了NO (3)①1∶2 ②将[Co(NH3)6]3+还原为[Co(NH3)6]2+
(4)机理2 机理2认为反应速率与O吸附量和NO吸附量有关;O2浓度较小时,增加c(O2),O吸附量增大,反应速率加快;O2浓度较大时,增加c(O2),O吸附量增大、NO吸附量减小,反应速率减慢
解析 (1)NO转化为NO2后在水中溶解性好,与尿素溶液反应速率快,且NO2的氧化性强于NO,故工业上选择方法2处理NOx。(2)由图示信息可知,水吸收过程中N2O4的初始和平衡气体的体积分数变化比较明显,而NO2的变化不明显,即可推知混合气体中与水反应的主要成分是N2O4,已知3NO2+H2O===2HNO3+NO,3N2O4+2H2O===4HNO3+2NO,即NO2和N2O4与水反应后生成了NO,导致达到平衡后,气体中NO2和N2O4的体积分数之和远小于100%。(3)①由图示信息可知,[Co(NH3)6]2++NO===[Co(NH3)5NO]2++NH3,2[Co(NH3)6]2++O2===[(NH3)3Co—O—O—Co(NH3)3]4++6NH3,[Co(NH3)5NO]2++[(NH3)3Co—O—O—Co(NH3)3]4++6NH3+H2O===[Co(NH3)5NO2]2++2[Co(NH3)6]3++2OH-,由此分析可知,与NO反应的[Co(NH3)6]2+和与O2反应的[Co(NH3)6]2+物质的量之比为1∶2。
1.用镍铂合金废料(主要成分为Ni、Pt,含少量Al和难溶于硫酸的重金属)回收镍和铂的一种工艺流程如下:
(1)“酸浸”后分离出的溶液中c(Ni2+)=0.2 mol·L-1,c(Al3+)=0.01 mol·L-1,当溶液中离子浓度<10-5 mol·L-1时可认为沉淀完全,则“调pH”应控制pH的范围是____________。{设“调pH”时溶液体积不变,已知:Ksp[Ni(OH)2]=2×10-15、Ksp[Al(OH)3]=1×10-33}
(2)“控温氧化”时控制其他条件一定,Ni2O3的产率与温度和时间的关系如图所示。20 ℃、40 ℃时反应后所得滤液主要成分为NaCl、NaOH和Na2SO4,60 ℃时反应后所得滤液主要成分为NaCl、NaClO3、NaOH和Na2SO4。反应相同时间,60 ℃时Ni2O3的产率低于40 ℃时,原因可能是_____________________________________________________________________________________________________________________________________________________。
(3)“含Pt滤渣”中的Pt可以用王水(体积比3∶1的浓盐酸和浓硝酸的混合液)浸出。浸出时有H2PtCl6和NO生成。向H2PtCl6溶液中加入NH4Cl会生成(NH4)2PtCl6沉淀。
①写出浸出时Pt所发生反应的化学方程式:_________________________________________________________。
②(NH4)2PtCl6在一定温度下可以分解生成Pt(NH3)2Cl2。Pt(NH3)2Cl2存在顺式和反式两种结构。请在如图的两个结构中,选择其中一个,填入相应的基团表示Pt(NH3)2Cl2的顺式结构。
(4)Ni2O3产品中可能含少量NiO,为测定Ni2O3的纯度,进行如下实验:称取5.000 g样品,加入足量硫酸后,再加入100 mL 1.000 mol·L-1Fe2+标准溶液,充分反应,加水定容至200 mL。取出20.00 mL,用0.100 mol·L-1 KMnO4标准溶液滴定,到达滴定终点时消耗KMnO4标准溶液10.00 mL。实验过程中发生反应如下:
Ni2O3+Fe2++H+―→Ni2++Fe3++H2O(未配平)
Fe2++MnO+H+―→Fe3++Mn2++H2O(未配平)
试通过计算确定Ni2O3的质量分数,并写出计算过程。
2.化合物J是一种昆虫生长调节剂,其人工合成路线如下:
(1)C的分子式为C9H9OCl,其结构简式为________________。
(2)合成时不采用IJ的方法,原因是________________________。
(3)F→G反应需控制温度在130 ℃左右,温度过高会有一种分子式为C9H12O2的副产物生成,该副产物的结构简式为____________________。
(4)H的一种同分异构体同时满足下列条件,写出该同分异构体的结构简式:___________________________________________________________。
①能发生银镜反应,能与FeCl3溶液发生显色反应,碱性条件水解;
②分子中含有4种不同化学环境的氢原子。
(5)已知:。写出以甲苯、BocNHNH2为原料制备的合成路线流程图(无机试剂和有机溶剂任用,合成路线流程图示例见本题题干)。
3.LiFePO4和Li2CO3都是重要的锂的化合物。
Ⅰ.LiFePO4电极材料是动力型锂离子电池的理想正极材料。它可以通过H3PO4、LiOH和(NH4)2Fe(SO4)2溶液发生共沉淀反应、将所得沉淀干燥、高温成型而制得。实验室制备LiFePO4的方法如下:
步骤1 将LiOH置于如图所示实验装置的三颈烧瓶中,加入煮沸过的蒸馏水,搅拌使其溶解。从分液漏斗中滴加H3PO4溶液,并持续通入氮气。
步骤2 将(NH4)2Fe(SO4)2固体溶于蒸馏水中,迅速倒入三颈烧瓶中,快速搅拌,充分反应后,过滤、洗涤滤渣得LiFePO4固体。
(1)共沉淀反应投料时,不将FeSO4和LiOH溶液直接混合的原因是_____________________________________________________________________________________________________。
(2)写出共沉淀反应的化学方程式:__________________________________。
(3)工业制取LiFePO4在高温成型前,常向LiFePO4中加入少量活性炭黑,其作用除了可以改善成型后LiFePO4的导电性能外,还能____________________________________________。
Ⅱ.磷酸锂渣(主要成分为Li3PO4)和废旧电极材料(含铝、炭、LiFePO4和FePO4)均可用于制取Li2CO3。
(4)实验室以磷酸锂渣为原料制备高纯Li2CO3的部分实验流程如下:
①“低酸转化”使Li3PO4转化为Li2HPO4。写出“磷锂分离”的化学方程式:___________________________________________________________________________________________。
②已知:三辛胺[N(C8H17)3]是一种有机碱,难溶于水。向“萃取”后的溶液中加入三辛胺再通入CO2得到Li2CO3沉淀,加入三辛胺的目的是_________________________________________________________。
(5)已知:Li2CO3微溶于水;LiFePO4、FePO4难溶于水和碱,可溶于盐酸生成LiCl、FeCl2、FeCl3和H3PO4;pH>3.2时,Fe3+沉淀完全。完善由某废旧电极材料制取Li2CO3的实验方案:边搅拌边向废旧电极材料中加入NaOH溶液至不再产生气泡,过滤,__________________
______________________________________________________________________________,过滤、洗涤,低温干燥得Li2CO3固体。(实验中须使用的试剂有双氧水、盐酸、NaOH溶液、Na2CO3溶液)
4.烟气中的NOx是大气的主要污染物之一,NOx的吸收处理是当前研究的热点。
(1)还原吸收法
方法1:直接使用尿素[CO(NH2)2]溶液吸收烟气中的NOx。
方法2:先用合适的氧化剂将NOx中的NO氧化为NO2,再用CO(NH2)2溶液去还原吸收。
还原吸收等量的NOx,消耗尿素较多的是________(填“方法1”或“方法2”)。工业上选择方法2处理NOx的原因是____________________________________________________。
(2)水吸收法
NO2和N2O4均能被水吸收,不同初始压强下,NO2和N2O4的混合气体被水吸收前和吸收达到平衡后,气体中NO2和N2O4的体积分数如图所示。混合气体中与水反应的主要成分是________________。达到平衡后,气体中NO2和N2O4的体积分数之和远小于100%,原因是____________________。
(3)配合物吸收法
钴氨配合物吸收NO的主要原理如图。已知[Co(NH3)6]2+对NO的配合能力很强,而[Co(NH3)6]3+对NO的配合能力极低。
①与NO反应的[Co(NH3)6]2+和与O2反应的[Co(NH3)6]2+物质的量之比为__________。
②钴氨溶液经过多次循环吸收NO后,其吸收NO的能力会降低,为了恢复钴氨溶液吸收NO的能力,需采取的方法是__________。
(4)NO与O2在某催化剂表面反应生成NO2的过程中,O2在催化剂表面能形成被吸附的O(用O-Site表示),接下来的机理可能有两种:
机理1:NO(g)+O-SiteNO2-Site
机理2:NO-Site+O-SiteSite+NO2-Site
上述两个反应均为基元反应。保持温度和NO的浓度不变,测得NO与O2在该催化剂作用下反应的初始速率与O2浓度的关系如图所示。能合理解释图中曲线变化的机理为_________(填“机理1”或“机理2”);判断的依据是________________________________________。
综合大题标准练(四)
1.(1)4.7≤pH<7
(2)60 ℃,部分NaClO分解生成NaCl和NaClO3,NaClO浓度减小,反应速率减慢
(3)①3Pt+18HCl+4HNO3===3H2PtCl6+4NO↑+8H2O
②
(4)n(KMnO4)=0.100 mol·L-1×0.010 L=1×10-3 mol,n(Fe2+)=1.000 mol·L-1×0.100 L=0.1 mol,与KMnO4标准溶液反应的n(Fe2+)=5×1×10-3 mol=5×10-3 mol,与Ni2O3反应的
n(Fe2+)=0.1 mol-×5×10-3 mol=0.05 mol,n(Ni2O3)=×0.05 mol=0.025 mol,m(Ni2O3)=0.025 mol×166 g·mol-1=4.15 g,Ni2O3的质量分数为×100%=83%
解析 (1)调pH的目的是为了让Al3+完全沉淀,根据Ksp[Al(OH)3]=1×10-33,当溶液中的c(Al3+)=10-5 mol·L-1时,溶液的pH≈4.7,此时溶液中的Ni2+不能沉淀,结合Ksp[Ni(OH)2]=2×10-15,溶液中c(Ni2+)=0.2 mol·L-1,当Ni2+开始沉淀时,溶液pH=7,故pH<7时不会影响Ni2+,所以调节溶液pH的范围应为4.7≤pH<7。
(3)①用王水浸出Pt时有H2PtCl6和NO生成,据此推断出反应物为Pt、HCl和HNO3,生成物为H2PtCl6和NO,根据元素守恒、得失电子守恒进行方程式的书写配平,并确定另一产物为H2O,故浸出时Pt所发生反应的化学方程式为3Pt+18HCl+4HNO3===3H2PtCl6+4NO↑+8H2O。②顺、反式结构的研究对象一般为有机物,通常两个相同原子或基团在双键同一侧的为顺式异构体,在两侧的为反式结构,故答案为。
2.(1) (2)I直接与A反应有副产物生成 (3)
(4)(或)
(5)
解析 (1)结合C的分子式C9H9OCl和B、D的结构简式可知,B中N—H键断裂,则C中断C—Cl键,发生取代反应生成产物HCl,据此可知C为。(3)F→G反应温度过高,可能导致另外一个碳氯键同样发生取代反应得到醚结构,结合分子式C9H12O2可知副产物为。(4)H的同分异构体能发生银镜反应,能与FeCl3溶液发生显色反应,碱性条件水解说明既含有酚羟基又含有甲酸酯基,结合分子中含有4种不同化学环境的氢原子可知H的同分异构体为或。
3.(1)FeSO4和LiOH溶液直接混合生成Fe(OH)2,而Fe(OH)2极易被氧化,最终产品中混有Fe(Ⅲ)化合物
(2)(NH4)2Fe(SO4)2+LiOH+H3PO4===LiFePO4↓+2NH4HSO4+H2O
(3)利用其还原性,防止Fe(Ⅱ)被氧化
(4)①2Li2HPO4+3CaCl2===Ca3(PO4)2↓+4LiCl+2HCl
②萃取后的LiCl溶液中混有HCl,三辛胺将溶液中的HCl反应除去,减小溶液中H+浓度,又能增大CO浓度,从而有利于Li2CO3生成
(5)向滤渣中边搅拌边加入盐酸,至固体不再减少,过滤;向滤液中加入过量的双氧水,再逐滴加入NaOH溶液至溶液pH大于3.2,过滤;边搅拌边向滤液中滴加Na2CO3溶液至产生大量沉淀,静置,向上层清液中滴加Na2CO3溶液,若无沉淀生成
解析 (4)①根据流程图可知“磷锂分离”的原理是Li2HPO4与CaCl2反应,化学方程式为2Li2HPO4+3CaCl2===Ca3(PO4)2↓+4LiCl+2HCl。(5)废旧电极材料中加入NaOH溶液至不再产生气泡,过滤,已将铝溶解除去,剩余固体成分为炭、LiFePO4和FePO4,从中获得含Li+溶液并沉淀生成Li2CO3的基本思路:用酸溶解、过滤,除炭;将Fe2+氧化、调节pH除Fe3+;用Na2CO3溶液沉淀Li+得Li2CO3。
4.(1)方法2 NO2在水中溶解性好,与尿素溶液反应速率快;NO2的氧化性强于NO (2)N2O4 NO2和N2O4与水反应后生成了NO (3)①1∶2 ②将[Co(NH3)6]3+还原为[Co(NH3)6]2+
(4)机理2 机理2认为反应速率与O吸附量和NO吸附量有关;O2浓度较小时,增加c(O2),O吸附量增大,反应速率加快;O2浓度较大时,增加c(O2),O吸附量增大、NO吸附量减小,反应速率减慢
解析 (1)NO转化为NO2后在水中溶解性好,与尿素溶液反应速率快,且NO2的氧化性强于NO,故工业上选择方法2处理NOx。(2)由图示信息可知,水吸收过程中N2O4的初始和平衡气体的体积分数变化比较明显,而NO2的变化不明显,即可推知混合气体中与水反应的主要成分是N2O4,已知3NO2+H2O===2HNO3+NO,3N2O4+2H2O===4HNO3+2NO,即NO2和N2O4与水反应后生成了NO,导致达到平衡后,气体中NO2和N2O4的体积分数之和远小于100%。(3)①由图示信息可知,[Co(NH3)6]2++NO===[Co(NH3)5NO]2++NH3,2[Co(NH3)6]2++O2===[(NH3)3Co—O—O—Co(NH3)3]4++6NH3,[Co(NH3)5NO]2++[(NH3)3Co—O—O—Co(NH3)3]4++6NH3+H2O===[Co(NH3)5NO2]2++2[Co(NH3)6]3++2OH-,由此分析可知,与NO反应的[Co(NH3)6]2+和与O2反应的[Co(NH3)6]2+物质的量之比为1∶2。
同课章节目录
