高中化学必修第二册《第二节 化学反应的速率与限度》ppt课件(共31张PPT)
文档属性
| 名称 | 高中化学必修第二册《第二节 化学反应的速率与限度》ppt课件(共31张PPT) |

|
|
| 格式 | ppt | ||
| 文件大小 | 6.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-17 17:23:13 | ||
图片预览











文档简介
(共31张PPT)
化学反应的速率与限度
快慢差别很大的化学变化
化学反应速率
概念:化学反应速率用来衡量化学反应进行的快慢程度。
表示方法:化学反应速率通常用单位时间内反应物浓度的减少或生成物浓度的增加来表示。(通常用符号v表示)
计算公式: v =Δc/Δt
单位: mol/(L·min)或mol/(L·s)
例题:向一个容积为1L的密闭容器中放入2mol SO2和1mol O2,在一定条件下,2s末测得容器内有0.8mol SO2,求2s内SO2、O2、SO3的平均反应速率。
解: 2SO2 + O2 2SO3
n(起始) 2mol 1mol 0
n(变化)
n(2s后) 0.8mol
1.2mol
0.6mol
1.2mol
在一定条件下:N2O4 2NO2在20秒内N2O4的浓度由0.1mol/L降到0.06mol/L,则v(N2O4)[单位:mol/(L·s)]为 A、0.1 B、0.002 C、0.06 D、0.04
思考题:为什么卤素单质与氢气反应的条件和剧烈程度不相同?决定化学反应速率的主要因素是什么?
H2+F2=2HF 在暗处能剧烈化合并发生爆炸
H2+Cl2=2HCl 光照或点燃发生反应,光照时发生爆炸化合,H2在Cl2中点燃时安静燃烧,发出苍白色火焰
H2+Br2=2HBr 加热至一定温度才能反应
H2+I2=2HI 不断加热才能缓慢反应
影响化学反应速率的因素
内因:反应物的性质——决定因素
外因:外界条件,包括浓度、温度等各项反应条件
思考1:为什么要将食物存放在温度低的地方(如电冰箱)?
食物的变质腐败是食物的缓慢氧化过程。
低温下食物腐败速率大大降低,不易变质。
温度越低,化学反应速率越小。
思考2:实验时,通常要将两种块状或颗粒状的固体药品研细,并混匀后再进行反应。原因是什么?
固体研细后其表面积极大地增加,大大增加了反应物之间的接触机会,可以提高反应速率,有利于反应的进行。
固体表面积越大,化学反应速率越大。
思考3:人们常把固体试剂溶于水配成溶液再进行化学实验,原因是什么?
溶液中溶质以分子或离子形式存在,且分布均匀,使反应物分子或离子之间直接接触的机会极大地增加,可以大大提高反应速率。
当物质以溶液状态存在时,能增大化学反应速率。
思考4:实验室常用约30%左右的硫酸溶液与锌粒反应制取氢气,当反应进行一段时间后,气泡变少(锌粒有剩余),如果添加一些适当浓度的硫酸溶液到反应容器中,气泡又会重新增多起来。原因是什么?
反应进行一段时间后,气泡变少的原因是c(H+)减小,反应速率减小;如果添加适当浓度的硫酸溶液,由于溶液中c(H+)增大,所以反应速率增大,气泡重新增多起来。
反应物浓度越大,化学反应速率越大。
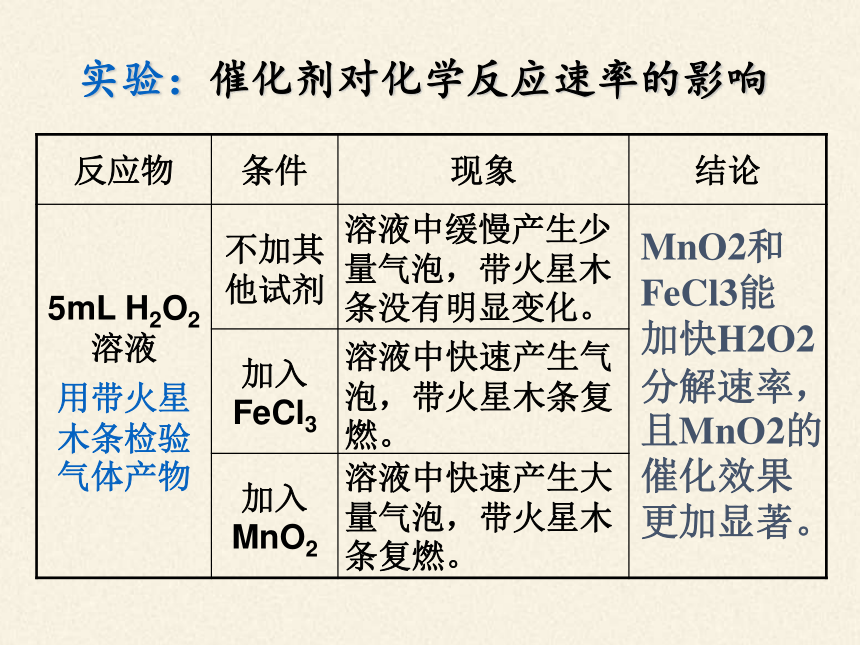
实验:催化剂对化学反应速率的影响
反应物 条件 现象 结论
5mL H2O2溶液
用带火星木条检验气体产物 不加其他试剂
加入FeCl3
加入MnO2
溶液中快速产生大量气泡,带火星木条复燃。
溶液中快速产生气泡,带火星木条复燃。
溶液中缓慢产生少量气泡,带火星木条没有明显变化。
MnO2和FeCl3能 加快H2O2分解速率,且MnO2的催化效果 更加显著。
结 论
影响化学反应速率的外界条件包括:
温度
固体的表面积
反应物的状态
溶液的浓度
催化剂……
小 结
化学反应速率:衡量化学反应进行的快慢程度的物理量。
计算公式: v =Δc/Δt
影响因素:
内因——反应物的性质(决定因素)
外因——温度、固体的表面积、反应物的状态、溶液的浓度、催化剂等。
可逆反应
可逆反应:在同一条件下正反应方向和逆反应方向均能进行的化学反应。
思考与交流:水的生成与电解,二次电池的放电与充电,CO2和H2O在植物体中通过光合作用合成糖与糖在人体内氧化生成CO2和H2O,它们是否属于“可逆反应”?
练习:
对于可逆反应2SO2+O2 2SO3,在混合气体中充入一定量的18O2足够长时间后,18O原子( )
A、只存在于O2中
B、只存在于O2和SO3中
C、只存在于SO2和O2中
D、存在于SO2、O2和SO3
D
化学反应的限度
化学平衡状态:在一定条件下,一个可逆反应进行到一定程度时,正向反应速率与逆向反应速率相等时,反应物浓度和生成物浓度不再改变,达到一种表面静止的状态。
特征:
宏观——反应物和生成物的浓度不在改变
微观——v(正反应)=v(逆反应)≠0。
化学反应的限度
化学平衡状态是可逆反应达到的一种特殊状态,是在给定条件下化学反应所能达到或完成的最大程度,即该反应进行的限度。
改变条件可以改变一个化学反应的限度,即改变化学平衡状态——化学平衡的移动。
练习:
对化学反应限度的叙述,错误的是( )
A、任何可逆反应都有一定的限度
B、化学反应的限度是不可改变的
C、化学反应的限度与时间的长短无关
D、化学反应达到限度时,正逆反应速率相等
B
思考:下图是建筑物的定向爆破,
你从中得到什么启示?
化学反应条件的控制
——如何提高煤的燃烧效率
思考1:煤的状态与煤燃烧的速率有何关系?与煤的充分燃烧有何关系?
煤被研得越细,粉末越小,与空气中O2的接触面积越大,燃烧越充分,反应速率越快。
思考2:空气用量对煤的充分燃烧有什么影响?原因是什么?
空气充足,煤燃烧得充分,产物主要为CO2,放热量大;
空气不足,则煤燃烧不充分,部分生成CO,CO排放到空气中造成污染,且生成CO时,放出的热量大大减小。
思考3:应选择什么样的炉(灶)膛材料?理由是什么?
应选择保温隔热且耐热的炉(灶)膛材料。
尽管煤燃烧是放热反应,但反应过程中煤燃烧需要提供部分能量才能进行,而利用煤燃烧放出的部分热量就可维持反应的持续进行。
选用保温隔热材料的目的,正式防止热量散失。
思考4:如何充分利用煤燃烧后的废气中的热量?
可将燃烧后的废气通过热交换装置,供其他方面使用。
这样做是为了尽可能充分地利用燃料燃烧所释放的热量,提高热能的利用率。
思考5:燃料不充分燃烧有何危害?
产生热量少,浪费资源。
产生污染物,危害人体健康。
思考6:燃料充分燃烧的条件是什么?
燃料燃烧必须与空气接触,且温度要达到燃料的着火点。
燃料充分燃烧要考虑到两点:一是燃烧时要有足够多的空气;二是燃料与空气要有足够大的接触面。
小结:反应条件的控制
关于人类需要或对人类有利的化学反应
升高反应温度、使用催化剂等增大反应速率,以提高生产或工作效率;
增大廉价反应物的浓度、或增大气体反应物的压强,以提高原料的利用率或转化率。
小结:反应条件的控制
关于有害或人类不需要的化学反应
降低反应温度、使用负催化剂等,降低反应速率;
隔离会引发反应的物质,如在金属表面形成保护层、森林火灾时制造隔离带等。
小结:反应条件的控制
关于特定环境或特殊需要的化学反应
对反应条件进行特殊的控制,如定向爆破、火箭发射等。
谢 谢
化学反应的速率与限度
快慢差别很大的化学变化
化学反应速率
概念:化学反应速率用来衡量化学反应进行的快慢程度。
表示方法:化学反应速率通常用单位时间内反应物浓度的减少或生成物浓度的增加来表示。(通常用符号v表示)
计算公式: v =Δc/Δt
单位: mol/(L·min)或mol/(L·s)
例题:向一个容积为1L的密闭容器中放入2mol SO2和1mol O2,在一定条件下,2s末测得容器内有0.8mol SO2,求2s内SO2、O2、SO3的平均反应速率。
解: 2SO2 + O2 2SO3
n(起始) 2mol 1mol 0
n(变化)
n(2s后) 0.8mol
1.2mol
0.6mol
1.2mol
在一定条件下:N2O4 2NO2在20秒内N2O4的浓度由0.1mol/L降到0.06mol/L,则v(N2O4)[单位:mol/(L·s)]为 A、0.1 B、0.002 C、0.06 D、0.04
思考题:为什么卤素单质与氢气反应的条件和剧烈程度不相同?决定化学反应速率的主要因素是什么?
H2+F2=2HF 在暗处能剧烈化合并发生爆炸
H2+Cl2=2HCl 光照或点燃发生反应,光照时发生爆炸化合,H2在Cl2中点燃时安静燃烧,发出苍白色火焰
H2+Br2=2HBr 加热至一定温度才能反应
H2+I2=2HI 不断加热才能缓慢反应
影响化学反应速率的因素
内因:反应物的性质——决定因素
外因:外界条件,包括浓度、温度等各项反应条件
思考1:为什么要将食物存放在温度低的地方(如电冰箱)?
食物的变质腐败是食物的缓慢氧化过程。
低温下食物腐败速率大大降低,不易变质。
温度越低,化学反应速率越小。
思考2:实验时,通常要将两种块状或颗粒状的固体药品研细,并混匀后再进行反应。原因是什么?
固体研细后其表面积极大地增加,大大增加了反应物之间的接触机会,可以提高反应速率,有利于反应的进行。
固体表面积越大,化学反应速率越大。
思考3:人们常把固体试剂溶于水配成溶液再进行化学实验,原因是什么?
溶液中溶质以分子或离子形式存在,且分布均匀,使反应物分子或离子之间直接接触的机会极大地增加,可以大大提高反应速率。
当物质以溶液状态存在时,能增大化学反应速率。
思考4:实验室常用约30%左右的硫酸溶液与锌粒反应制取氢气,当反应进行一段时间后,气泡变少(锌粒有剩余),如果添加一些适当浓度的硫酸溶液到反应容器中,气泡又会重新增多起来。原因是什么?
反应进行一段时间后,气泡变少的原因是c(H+)减小,反应速率减小;如果添加适当浓度的硫酸溶液,由于溶液中c(H+)增大,所以反应速率增大,气泡重新增多起来。
反应物浓度越大,化学反应速率越大。
实验:催化剂对化学反应速率的影响
反应物 条件 现象 结论
5mL H2O2溶液
用带火星木条检验气体产物 不加其他试剂
加入FeCl3
加入MnO2
溶液中快速产生大量气泡,带火星木条复燃。
溶液中快速产生气泡,带火星木条复燃。
溶液中缓慢产生少量气泡,带火星木条没有明显变化。
MnO2和FeCl3能 加快H2O2分解速率,且MnO2的催化效果 更加显著。
结 论
影响化学反应速率的外界条件包括:
温度
固体的表面积
反应物的状态
溶液的浓度
催化剂……
小 结
化学反应速率:衡量化学反应进行的快慢程度的物理量。
计算公式: v =Δc/Δt
影响因素:
内因——反应物的性质(决定因素)
外因——温度、固体的表面积、反应物的状态、溶液的浓度、催化剂等。
可逆反应
可逆反应:在同一条件下正反应方向和逆反应方向均能进行的化学反应。
思考与交流:水的生成与电解,二次电池的放电与充电,CO2和H2O在植物体中通过光合作用合成糖与糖在人体内氧化生成CO2和H2O,它们是否属于“可逆反应”?
练习:
对于可逆反应2SO2+O2 2SO3,在混合气体中充入一定量的18O2足够长时间后,18O原子( )
A、只存在于O2中
B、只存在于O2和SO3中
C、只存在于SO2和O2中
D、存在于SO2、O2和SO3
D
化学反应的限度
化学平衡状态:在一定条件下,一个可逆反应进行到一定程度时,正向反应速率与逆向反应速率相等时,反应物浓度和生成物浓度不再改变,达到一种表面静止的状态。
特征:
宏观——反应物和生成物的浓度不在改变
微观——v(正反应)=v(逆反应)≠0。
化学反应的限度
化学平衡状态是可逆反应达到的一种特殊状态,是在给定条件下化学反应所能达到或完成的最大程度,即该反应进行的限度。
改变条件可以改变一个化学反应的限度,即改变化学平衡状态——化学平衡的移动。
练习:
对化学反应限度的叙述,错误的是( )
A、任何可逆反应都有一定的限度
B、化学反应的限度是不可改变的
C、化学反应的限度与时间的长短无关
D、化学反应达到限度时,正逆反应速率相等
B
思考:下图是建筑物的定向爆破,
你从中得到什么启示?
化学反应条件的控制
——如何提高煤的燃烧效率
思考1:煤的状态与煤燃烧的速率有何关系?与煤的充分燃烧有何关系?
煤被研得越细,粉末越小,与空气中O2的接触面积越大,燃烧越充分,反应速率越快。
思考2:空气用量对煤的充分燃烧有什么影响?原因是什么?
空气充足,煤燃烧得充分,产物主要为CO2,放热量大;
空气不足,则煤燃烧不充分,部分生成CO,CO排放到空气中造成污染,且生成CO时,放出的热量大大减小。
思考3:应选择什么样的炉(灶)膛材料?理由是什么?
应选择保温隔热且耐热的炉(灶)膛材料。
尽管煤燃烧是放热反应,但反应过程中煤燃烧需要提供部分能量才能进行,而利用煤燃烧放出的部分热量就可维持反应的持续进行。
选用保温隔热材料的目的,正式防止热量散失。
思考4:如何充分利用煤燃烧后的废气中的热量?
可将燃烧后的废气通过热交换装置,供其他方面使用。
这样做是为了尽可能充分地利用燃料燃烧所释放的热量,提高热能的利用率。
思考5:燃料不充分燃烧有何危害?
产生热量少,浪费资源。
产生污染物,危害人体健康。
思考6:燃料充分燃烧的条件是什么?
燃料燃烧必须与空气接触,且温度要达到燃料的着火点。
燃料充分燃烧要考虑到两点:一是燃烧时要有足够多的空气;二是燃料与空气要有足够大的接触面。
小结:反应条件的控制
关于人类需要或对人类有利的化学反应
升高反应温度、使用催化剂等增大反应速率,以提高生产或工作效率;
增大廉价反应物的浓度、或增大气体反应物的压强,以提高原料的利用率或转化率。
小结:反应条件的控制
关于有害或人类不需要的化学反应
降低反应温度、使用负催化剂等,降低反应速率;
隔离会引发反应的物质,如在金属表面形成保护层、森林火灾时制造隔离带等。
小结:反应条件的控制
关于特定环境或特殊需要的化学反应
对反应条件进行特殊的控制,如定向爆破、火箭发射等。
谢 谢
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
