高中必修第二册化学《第二节 化学反应的速率与限度》ppt课件(共42张PPT)
文档属性
| 名称 | 高中必修第二册化学《第二节 化学反应的速率与限度》ppt课件(共42张PPT) |  | |
| 格式 | ppt | ||
| 文件大小 | 29.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-17 17:28:54 | ||
图片预览









文档简介
(共42张PPT)
第二节 化学反应的速率与限度之影响化学反应速率的因素
一辆汽车行驶速率的决定因素是什么?影响因素是什么?
决定因素是:汽车的性能(如功率等)
影响因素:
⑴天气
⑵路况
⑶燃料质量
⑷司机的驾驶水平和经验……
思考:
新问题
对于下列反应,你是希望其反应速率越快越好还是越慢越好?
■钢铁腐蚀 ■ 食物腐坏 ■ 炼钢 ■ 合成氨
改变化学反应速率在实践中有很重要的意义,我们可以根据生产和生活的需要,采取适当措施改变化学反应速率。那么,如何能够改变化学反应速率呢?
在相同条件下,等质量(金属颗粒大小相同)的下列金属与足量1mol/L 盐酸反应时,速率最快的是
A 镁 B 铝 C 钠 D 铁
影响化学反应速率的因素
化学反应速率是由反应物的性质决定的;
内因是主要因素
影响化学反应速率的外界因素
温度的影响:
实验操作
实验现象 _______________________________
___________________________
实验结论 _________________
浸在热水里的试管中产生气泡的速
率明显快于浸在冷水中的试管
温度越高速率越快
外因因素:
实验2-5
现象 结论
热水中
常温
冷水中
产生气泡速率增大,带火星火柴 复燃
升高温度,
反应速率增大
有气泡冒出
产生气泡速率减小
降低温度,
反应速率减小
2H2O2 = 2H2O +O2
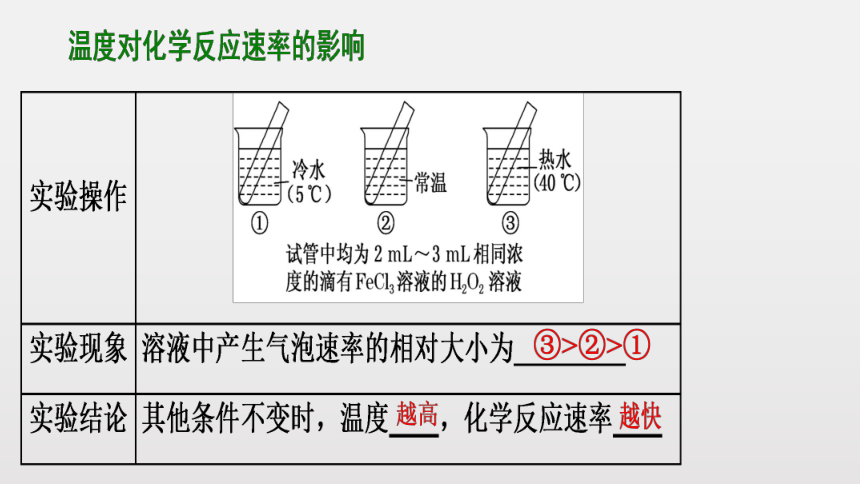
结论1:当其它条件不变时,升高温度,化学反应速率增大;降低温度,化学反应速率减小
规律:当其它条件不变时,升高温度,化学反应速率增大。降低温度,化学反应速率减小。
实验测得,温度每升高10度,化学反应速率通常增大原来的2~4倍。
注意:温度对反应速率的影响不受反应物状态的限制。
(1)温度对化学反应速率的影响
例子:
夏天气温高,食物的变质快;冬天气温低,食物的变质慢。
应用:
使用电冰箱储存食物。
特别提醒 不论是吸热反应还是放热反应,升高温度都能加快化学反应速率。不能认为升高温度只会加快吸热反应的反应速率。
实验操作
实验现象
实验结论
加入FeCl3溶液产生气泡的速率明显加快
催化剂可以加快反应速率
催化剂的影响:
实验2-6
现象 结论
加入MnO2
加入FeCl3
不加其他试剂
气泡冒出速率增大
气泡冒出速率增大
有气泡冒出,较慢
MnO2能加快
反应速率
FeCl3能加快
反应速率
无催化剂
反应较慢
外因因素:
结论2:加入催化剂(正)能加快化学反应的速率。
规律:催化剂能改变化学反应的速率。(不能改变反应的本质)
有的催化剂能加快化学反应的速率,叫正催化剂;有的催化剂能减慢化学反应速率,叫负催化剂。在实践中,如没有特殊说明,凡说催化剂都是指正催化剂。
催化剂只有在一定的温度下才能最大限度的显示其催化作用,不同的催化剂对温度的要求不一样。
(2)催化剂对化学反应速率的影响
浓度的影响:
实验操作
实验现象
实验结论
不加水的试管中产生气泡的速率更快
浓度越大反应速率越快
思考与交流
1.请预计大理石( CaCO3 )分别与0.1mol/L和1mol/L的盐酸反应的快慢。你能得出什么结论吗?
结论3:增大反应物的浓度反应速率加快,减小反应物的浓度反应速率减慢.
2.块状CaCO3、粉末状CaCO3与0.1 mol/L的盐酸反应谁快谁慢?为什么?
结论4:增大固体表面积可以加快反应速率(接触充分).
思考与交流
SO2、O2
结论5:对于气体参加的反应来说,压强增大化学反应速率增大;减小压强,化学反应速率减小
HCl、NaOH
本质是通过影响c来影响v
压强:对于有气体参加的反应
1 .n、T不变,增大压强,即体积减小,反 应物浓度增大,化学反应速率加快。
2.①恒温恒容时,若通入参加反应的气体,则反应物浓度增大,化学 反应速率加快。
②恒温恒容时,若通入稀有气体(或不参加反应的气体),则反应物浓度不变,反应速率不变
③恒温恒压时,若通入稀有气体(或不参加反应的气体),则体积增大,反应物浓度减少,反应速率减少
注意:
①对于只有固体、液体或溶液而无气体参加的反应,认为压强对之无影响;
②压强的改变必须以浓度的改变为前提,否则哪怕压强改变了速率也不会发生变化
(3)其他影响因素
除温度、催化剂外,固体的表面积、反应物的状态、溶液的浓度、气体的压强、溶剂、光照、原电池、光波、电磁波、超声波等都可以影响化学反应速率。
影响化学反应速率的条件
内因
外因
物质本身的性质
温度、浓度、压强、催化剂等
使用催化剂,化学反应速率加快
催化剂
升高温度,化学反应速率加快;反之减慢
温度
外 因
反应物的化学性质越活泼,化学反应速率越快;反之则越慢
性质
内 因
规律
(在其它条件相同时)
影响化学反应速率的因素
光波,电磁波,超声波,溶剂等
其它
增大固体反应物的表面积,化学反应速率加快;反之减慢
固体反应物的表面积
增大气态反应物的压强,化学反应速率加快;反之减慢
气态反应物的压强
增大反应物的浓度,化学反应加快;反之减慢
反应物的浓度
外
因
思考与交流
1.人们为什么使用电冰箱储存食物?
温度越高,食物腐败变质的速率越快,电冰箱能提供较低的温度,减缓食物的腐败。
2.实验室通常要将两种块状或颗粒状的固体药品研细,并混匀后再进行反应。原因是什么?
能增大反应物的接触面积,使反应物充分接触,使反应速率加快
3.实验室进行化学反应时,通常把一些固体物质溶于水配成溶液再进行反应。原因是什么?
配成溶液能增大接触面积,从而加快反应反应速率。
是因为反应一段时间后,硫酸浓度降低,加入新酸后浓度升高,气泡增多。
4.实验室常用30%左右的硫酸溶液(约3.7mol/L)与锌粒反应制取氢气,当反应进行一段时间后,气泡变得稀少了(锌粒还有剩余),如果添加一些适当浓度的硫酸溶液到反应器中,气泡又会重新增多起来。原因是什么?
思考、下图表示锌和稀盐酸反应时产生氢气的速率与反应时间的关系,回答下列问题:
V(H2)
t/秒
0 a b
(1)从0到a时间段内反应速率加快的原因是:
(2)从a到b时间段内反应速率减慢的原因是:
该反应是放热反应,在0到a时间段内浓度变化不大,但温度升高,所以反应速率增大。
随着反应的进行,到a 后盐酸的浓度不断降低,反应速率将不断减小。
【方法规律】 分析判断反应速率大小时应遵循的思路
1.判断正误(正确的打“√”,错误的打“×”)。
(1)表面积相同的钠和镁分别与足量1 mol·L-1的盐酸反应,反应速率相同。( )
(2)增加反应物的量一定能加快化学反应速率。( )
(3)增大反应体系的压强,反应速率一定增大。( )
(4)用粗锌和稀硫酸反应制取氢气比用纯锌快。( )
练习
×
×
×
√
2:下列关于化学反应速率的说法正确的是( )
A化学反应速率是指一定时间内任何一种反应物物质的量的减少或任何一种生成物物质的量的增加.
B化学反应速率为0.8 mol/(L.S)是指1秒钟时某物质的浓度为0.8 mol/L.
C根据化学反应速率的大小可以知道化学反应进行的快慢.
D对于任何化学反应来说,反应速度越快,反应现象就越明显.
C
3:下列变化过程中如果加快化学反应速率,对环境保护有利的是( )
A橡胶的老化
B白色垃圾塑料的分解
C事物腐败
D钢铁的腐蚀
B
练习3
4:决定化学反应速率的主要因素是( )
①温度 ②压强 ③催化剂 ④浓度 ⑤反应物本身的性质
A ①②③④⑤ B⑤
C ①④ D ①②③④
B
5.将20 mL 0.5 mol·L-1盐酸与一块状大理石反应,下列措施不能提高化学反应速率的是( )
A.加入10 mL 3 mol·L-1 盐酸
B.给反应混合物加热
C.将所用的块状大理石研磨成粉末
D.加入10 mL蒸馏水
D
6:2019年7月1日,《上海市生活垃圾管理条例》正式施行,上海开启了生活垃圾分类 “强制时代”。按照总体部署,继上海之后,全国另外45座城市也将跟进实施生活垃圾强制分类。
生活中有很多资源容易被浪费,如废铁、旧塑料等。为了变废为宝,某同学利用废铁片与盐酸的反应制备氢气时,经过测定产生H2的速率随时间的变化如图所示。
(1)对于该反应,影响反应速率的因素有哪些
提示:这是固体与水溶液之间进行的反应,影响反应速率的因素有盐酸的浓度、温度和铁片的表面积。
(2)分析O~a段产生氢气速率几乎为零的原因
提示:废铁片的表面有铁锈,开始阶段盐酸先与铁的氧化物反应,无氢气产生。
(3)随着反应的进行盐酸的浓度逐渐减小,但a~b段产生氢气的速率却逐渐增大的原因是什么
提示:铁与盐酸的反应是放热反应,放出的热量使溶液的温度升高,使反应速率增大,且增大的程度大于盐酸浓度减小使速率减小的程度,故速率逐渐增大。
(4)b~c段产生氢气的速率逐渐减小的原因是什么
提示:随着反应进行到最后阶段,发生反应的反应物的量减小,放出的热量减小,盐酸浓度减小使速率减小起到了主要作用,故速率逐渐减小。
(5)还可以采取什么措施加快该反应的速率
提示:将铁片粉碎、滴入几滴硫酸铜溶液等。
古代皇室专用版冰箱——“冰鉴”
在周朝的时候,古人就发明了一种东西,专门用来保存“冰”。最开始的时候,冰鉴只是用来保存冰,让皇帝解暑用的,而到了后面,有个御膳房的厨师发现:在北方,冬天下雪的时候,寒气可以让食物“更长久”的保鲜,而冰也是一种寒气,所以就发明了用冰鉴进行保鲜。
(1)古代的“冰鉴”和现代的冰箱能够较长时间保存食物的原理是什么
提示:通过降低温度,降低化学反应的速率,起到延长食品保存时间的作用。
(2)生活中用煤粉代替煤块并向炉膛鼓风,可以使炉火更旺,原理是什么
提示:增大煤与空气的接触面积,加快反应速率。
第二节 化学反应的速率与限度之影响化学反应速率的因素
一辆汽车行驶速率的决定因素是什么?影响因素是什么?
决定因素是:汽车的性能(如功率等)
影响因素:
⑴天气
⑵路况
⑶燃料质量
⑷司机的驾驶水平和经验……
思考:
新问题
对于下列反应,你是希望其反应速率越快越好还是越慢越好?
■钢铁腐蚀 ■ 食物腐坏 ■ 炼钢 ■ 合成氨
改变化学反应速率在实践中有很重要的意义,我们可以根据生产和生活的需要,采取适当措施改变化学反应速率。那么,如何能够改变化学反应速率呢?
在相同条件下,等质量(金属颗粒大小相同)的下列金属与足量1mol/L 盐酸反应时,速率最快的是
A 镁 B 铝 C 钠 D 铁
影响化学反应速率的因素
化学反应速率是由反应物的性质决定的;
内因是主要因素
影响化学反应速率的外界因素
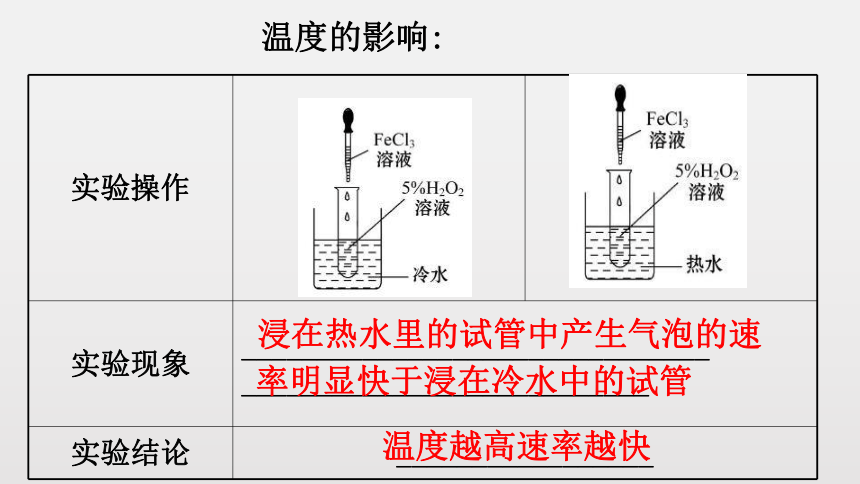
温度的影响:
实验操作
实验现象 _______________________________
___________________________
实验结论 _________________
浸在热水里的试管中产生气泡的速
率明显快于浸在冷水中的试管
温度越高速率越快
外因因素:
实验2-5
现象 结论
热水中
常温
冷水中
产生气泡速率增大,带火星火柴 复燃
升高温度,
反应速率增大
有气泡冒出
产生气泡速率减小
降低温度,
反应速率减小
2H2O2 = 2H2O +O2
结论1:当其它条件不变时,升高温度,化学反应速率增大;降低温度,化学反应速率减小
规律:当其它条件不变时,升高温度,化学反应速率增大。降低温度,化学反应速率减小。
实验测得,温度每升高10度,化学反应速率通常增大原来的2~4倍。
注意:温度对反应速率的影响不受反应物状态的限制。
(1)温度对化学反应速率的影响
例子:
夏天气温高,食物的变质快;冬天气温低,食物的变质慢。
应用:
使用电冰箱储存食物。
特别提醒 不论是吸热反应还是放热反应,升高温度都能加快化学反应速率。不能认为升高温度只会加快吸热反应的反应速率。
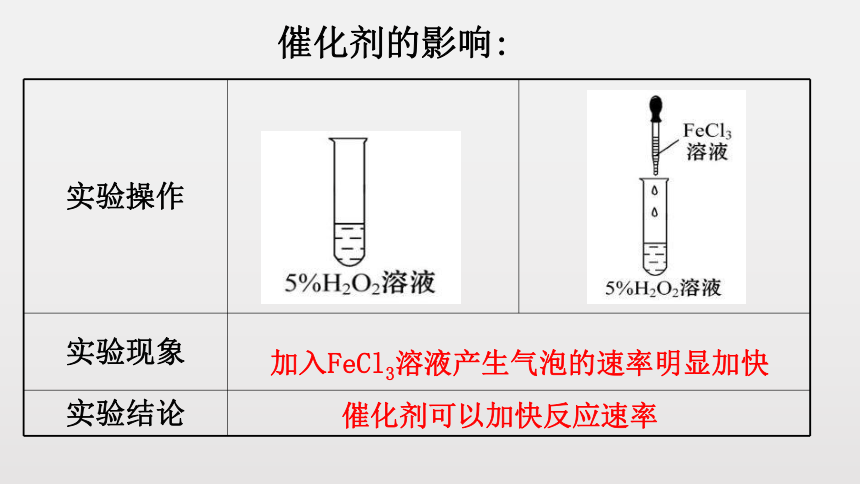
实验操作
实验现象
实验结论
加入FeCl3溶液产生气泡的速率明显加快
催化剂可以加快反应速率
催化剂的影响:
实验2-6
现象 结论
加入MnO2
加入FeCl3
不加其他试剂
气泡冒出速率增大
气泡冒出速率增大
有气泡冒出,较慢
MnO2能加快
反应速率
FeCl3能加快
反应速率
无催化剂
反应较慢
外因因素:
结论2:加入催化剂(正)能加快化学反应的速率。
规律:催化剂能改变化学反应的速率。(不能改变反应的本质)
有的催化剂能加快化学反应的速率,叫正催化剂;有的催化剂能减慢化学反应速率,叫负催化剂。在实践中,如没有特殊说明,凡说催化剂都是指正催化剂。
催化剂只有在一定的温度下才能最大限度的显示其催化作用,不同的催化剂对温度的要求不一样。
(2)催化剂对化学反应速率的影响
浓度的影响:
实验操作
实验现象
实验结论
不加水的试管中产生气泡的速率更快
浓度越大反应速率越快
思考与交流
1.请预计大理石( CaCO3 )分别与0.1mol/L和1mol/L的盐酸反应的快慢。你能得出什么结论吗?
结论3:增大反应物的浓度反应速率加快,减小反应物的浓度反应速率减慢.
2.块状CaCO3、粉末状CaCO3与0.1 mol/L的盐酸反应谁快谁慢?为什么?
结论4:增大固体表面积可以加快反应速率(接触充分).
思考与交流
SO2、O2
结论5:对于气体参加的反应来说,压强增大化学反应速率增大;减小压强,化学反应速率减小
HCl、NaOH
本质是通过影响c来影响v
压强:对于有气体参加的反应
1 .n、T不变,增大压强,即体积减小,反 应物浓度增大,化学反应速率加快。
2.①恒温恒容时,若通入参加反应的气体,则反应物浓度增大,化学 反应速率加快。
②恒温恒容时,若通入稀有气体(或不参加反应的气体),则反应物浓度不变,反应速率不变
③恒温恒压时,若通入稀有气体(或不参加反应的气体),则体积增大,反应物浓度减少,反应速率减少
注意:
①对于只有固体、液体或溶液而无气体参加的反应,认为压强对之无影响;
②压强的改变必须以浓度的改变为前提,否则哪怕压强改变了速率也不会发生变化
(3)其他影响因素
除温度、催化剂外,固体的表面积、反应物的状态、溶液的浓度、气体的压强、溶剂、光照、原电池、光波、电磁波、超声波等都可以影响化学反应速率。
影响化学反应速率的条件
内因
外因
物质本身的性质
温度、浓度、压强、催化剂等
使用催化剂,化学反应速率加快
催化剂
升高温度,化学反应速率加快;反之减慢
温度
外 因
反应物的化学性质越活泼,化学反应速率越快;反之则越慢
性质
内 因
规律
(在其它条件相同时)
影响化学反应速率的因素
光波,电磁波,超声波,溶剂等
其它
增大固体反应物的表面积,化学反应速率加快;反之减慢
固体反应物的表面积
增大气态反应物的压强,化学反应速率加快;反之减慢
气态反应物的压强
增大反应物的浓度,化学反应加快;反之减慢
反应物的浓度
外
因
思考与交流
1.人们为什么使用电冰箱储存食物?
温度越高,食物腐败变质的速率越快,电冰箱能提供较低的温度,减缓食物的腐败。
2.实验室通常要将两种块状或颗粒状的固体药品研细,并混匀后再进行反应。原因是什么?
能增大反应物的接触面积,使反应物充分接触,使反应速率加快
3.实验室进行化学反应时,通常把一些固体物质溶于水配成溶液再进行反应。原因是什么?
配成溶液能增大接触面积,从而加快反应反应速率。
是因为反应一段时间后,硫酸浓度降低,加入新酸后浓度升高,气泡增多。
4.实验室常用30%左右的硫酸溶液(约3.7mol/L)与锌粒反应制取氢气,当反应进行一段时间后,气泡变得稀少了(锌粒还有剩余),如果添加一些适当浓度的硫酸溶液到反应器中,气泡又会重新增多起来。原因是什么?
思考、下图表示锌和稀盐酸反应时产生氢气的速率与反应时间的关系,回答下列问题:
V(H2)
t/秒
0 a b
(1)从0到a时间段内反应速率加快的原因是:
(2)从a到b时间段内反应速率减慢的原因是:
该反应是放热反应,在0到a时间段内浓度变化不大,但温度升高,所以反应速率增大。
随着反应的进行,到a 后盐酸的浓度不断降低,反应速率将不断减小。
【方法规律】 分析判断反应速率大小时应遵循的思路
1.判断正误(正确的打“√”,错误的打“×”)。
(1)表面积相同的钠和镁分别与足量1 mol·L-1的盐酸反应,反应速率相同。( )
(2)增加反应物的量一定能加快化学反应速率。( )
(3)增大反应体系的压强,反应速率一定增大。( )
(4)用粗锌和稀硫酸反应制取氢气比用纯锌快。( )
练习
×
×
×
√
2:下列关于化学反应速率的说法正确的是( )
A化学反应速率是指一定时间内任何一种反应物物质的量的减少或任何一种生成物物质的量的增加.
B化学反应速率为0.8 mol/(L.S)是指1秒钟时某物质的浓度为0.8 mol/L.
C根据化学反应速率的大小可以知道化学反应进行的快慢.
D对于任何化学反应来说,反应速度越快,反应现象就越明显.
C
3:下列变化过程中如果加快化学反应速率,对环境保护有利的是( )
A橡胶的老化
B白色垃圾塑料的分解
C事物腐败
D钢铁的腐蚀
B
练习3
4:决定化学反应速率的主要因素是( )
①温度 ②压强 ③催化剂 ④浓度 ⑤反应物本身的性质
A ①②③④⑤ B⑤
C ①④ D ①②③④
B
5.将20 mL 0.5 mol·L-1盐酸与一块状大理石反应,下列措施不能提高化学反应速率的是( )
A.加入10 mL 3 mol·L-1 盐酸
B.给反应混合物加热
C.将所用的块状大理石研磨成粉末
D.加入10 mL蒸馏水
D
6:2019年7月1日,《上海市生活垃圾管理条例》正式施行,上海开启了生活垃圾分类 “强制时代”。按照总体部署,继上海之后,全国另外45座城市也将跟进实施生活垃圾强制分类。
生活中有很多资源容易被浪费,如废铁、旧塑料等。为了变废为宝,某同学利用废铁片与盐酸的反应制备氢气时,经过测定产生H2的速率随时间的变化如图所示。
(1)对于该反应,影响反应速率的因素有哪些
提示:这是固体与水溶液之间进行的反应,影响反应速率的因素有盐酸的浓度、温度和铁片的表面积。
(2)分析O~a段产生氢气速率几乎为零的原因
提示:废铁片的表面有铁锈,开始阶段盐酸先与铁的氧化物反应,无氢气产生。
(3)随着反应的进行盐酸的浓度逐渐减小,但a~b段产生氢气的速率却逐渐增大的原因是什么
提示:铁与盐酸的反应是放热反应,放出的热量使溶液的温度升高,使反应速率增大,且增大的程度大于盐酸浓度减小使速率减小的程度,故速率逐渐增大。
(4)b~c段产生氢气的速率逐渐减小的原因是什么
提示:随着反应进行到最后阶段,发生反应的反应物的量减小,放出的热量减小,盐酸浓度减小使速率减小起到了主要作用,故速率逐渐减小。
(5)还可以采取什么措施加快该反应的速率
提示:将铁片粉碎、滴入几滴硫酸铜溶液等。
古代皇室专用版冰箱——“冰鉴”
在周朝的时候,古人就发明了一种东西,专门用来保存“冰”。最开始的时候,冰鉴只是用来保存冰,让皇帝解暑用的,而到了后面,有个御膳房的厨师发现:在北方,冬天下雪的时候,寒气可以让食物“更长久”的保鲜,而冰也是一种寒气,所以就发明了用冰鉴进行保鲜。
(1)古代的“冰鉴”和现代的冰箱能够较长时间保存食物的原理是什么
提示:通过降低温度,降低化学反应的速率,起到延长食品保存时间的作用。
(2)生活中用煤粉代替煤块并向炉膛鼓风,可以使炉火更旺,原理是什么
提示:增大煤与空气的接触面积,加快反应速率。
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
