强化练三 综合实验探究(含答案)-2024年江苏高考化学二轮复习
文档属性
| 名称 | 强化练三 综合实验探究(含答案)-2024年江苏高考化学二轮复习 |  | |
| 格式 | docx | ||
| 文件大小 | 485.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-17 15:52:43 | ||
图片预览


文档简介
2024年江苏高考化学 强化练三 综合实验探究
1.(2023·徐州市高三考前模拟)亚硝酸钠(NaNO2)在工业上多个领域有着广泛应用。
(1)实验室利用工业废气(主要含NO、NO2、CO2)模拟制备NaNO2的装置如图所示:
已知:室温下,2NO+Na2O2===2NaNO2;酸性条件下,NO或NO都能与MnO反应生成NO和Mn2+。
①装置A中使用稀硫酸的目的是________________________________________________。
②装置B内盛放的试剂可能是________(填字母)。
a.P2O5 b.碱石灰
c.无水CaCl2 d.无水硫酸铜
③装置D中发生反应的离子方程式为__________________________________________________________。
(2)实验室将含NO、NO的酸性工业废水的NO全部氧化为NO,分别用铝、铁和铝铁合金对NO进行脱除。在0~3 h内,铝和铁对NO几乎未脱除,而铝铁合金的脱除效率高,其可能的原因是____________________________________________________。
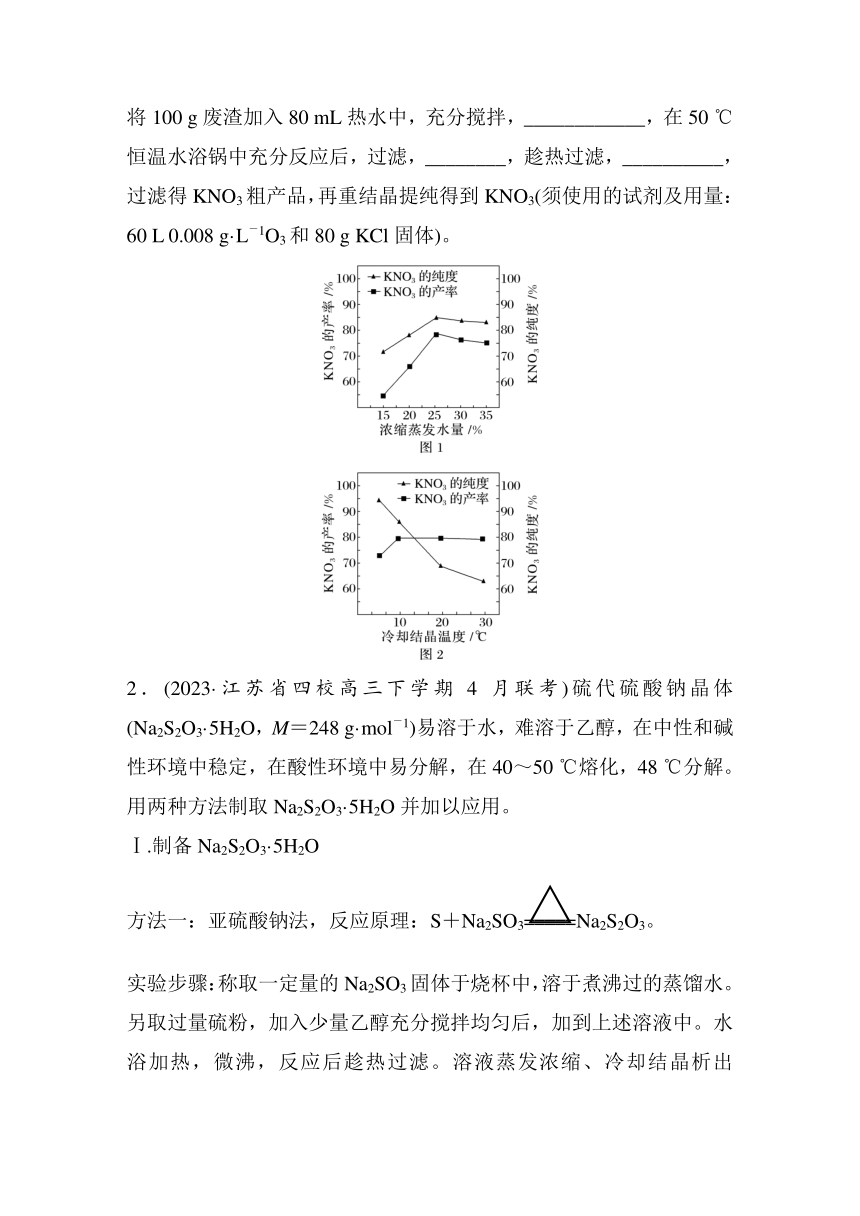
(3)某科研机构经多次实验,利用O3、KCl和工业废渣(主要成分为NaNO2和NaNO3)制得KNO3,相关工艺参数如图1和图2[浓缩蒸发水量=],请选择最佳实验方案,完成他们的制备:将100 g废渣加入80 mL热水中,充分搅拌,____________,在50 ℃恒温水浴锅中充分反应后,过滤,________,趁热过滤,__________,过滤得KNO3粗产品,再重结晶提纯得到KNO3(须使用的试剂及用量:60 L 0.008 g·L-1O3和80 g KCl固体)。
2.(2023·江苏省四校高三下学期4月联考)硫代硫酸钠晶体(Na2S2O3·5H2O,M=248 g·mol-1)易溶于水,难溶于乙醇,在中性和碱性环境中稳定,在酸性环境中易分解,在40~50 ℃熔化,48 ℃分解。用两种方法制取Na2S2O3·5H2O并加以应用。
Ⅰ.制备Na2S2O3·5H2O
方法一:亚硫酸钠法,反应原理:S+Na2SO3Na2S2O3。
实验步骤:称取一定量的Na2SO3固体于烧杯中,溶于煮沸过的蒸馏水。另取过量硫粉,加入少量乙醇充分搅拌均匀后,加到上述溶液中。水浴加热,微沸,反应后趁热过滤。溶液蒸发浓缩、冷却结晶析出Na2S2O3·5H2O晶体。再进行减压过滤、洗涤并低温干燥。
(1)S2O中心硫原子的杂化方式为__________。
(2)向硫粉中加入少量乙醇充分搅拌均匀的目的是______________________________________________________________________________。
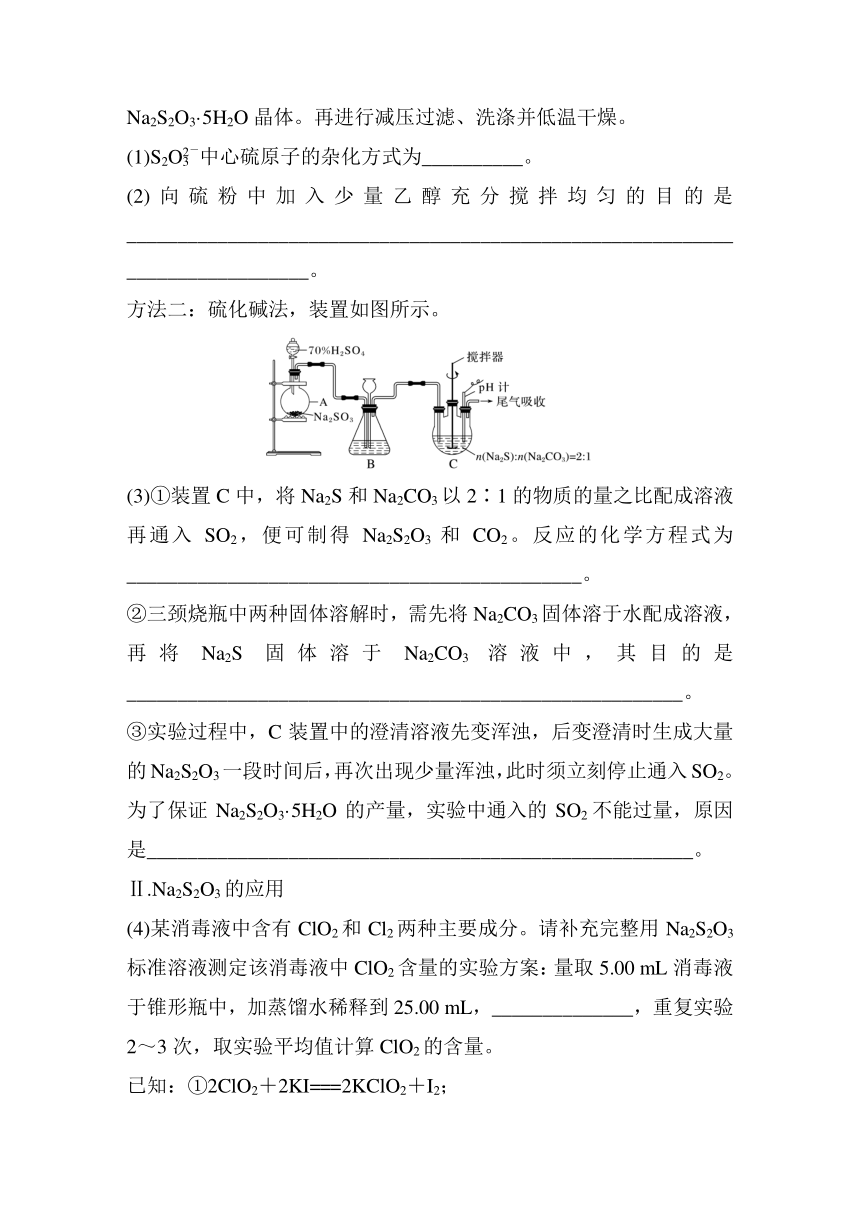
方法二:硫化碱法,装置如图所示。
(3)①装置C中,将Na2S和Na2CO3以2∶1的物质的量之比配成溶液再通入SO2,便可制得Na2S2O3和CO2。反应的化学方程式为_____________________________________________。
②三颈烧瓶中两种固体溶解时,需先将Na2CO3固体溶于水配成溶液,再将Na2S固体溶于Na2CO3溶液中,其目的是_______________________________________________________。
③实验过程中,C装置中的澄清溶液先变浑浊,后变澄清时生成大量的Na2S2O3一段时间后,再次出现少量浑浊,此时须立刻停止通入SO2。为了保证Na2S2O3·5H2O的产量,实验中通入的SO2不能过量,原因是______________________________________________________。
Ⅱ.Na2S2O3的应用
(4)某消毒液中含有ClO2和Cl2两种主要成分。请补充完整用Na2S2O3标准溶液测定该消毒液中ClO2含量的实验方案:量取5.00 mL消毒液于锥形瓶中,加蒸馏水稀释到25.00 mL,______________,重复实验2~3次,取实验平均值计算ClO2的含量。
已知:①2ClO2+2KI===2KClO2+I2;
②KClO2+4KI+2H2SO4===KCl+2K2SO4+2I2+2H2O;
③2Na2S2O3+I2===Na2S4O6+2NaI;且反应②在pH=3时完全进行。
(须使用的试剂:0.100 0 mol·L-1Na2S2O3标准溶液、淀粉溶液、KI溶液、稀硫酸)
(5)设计以下实验测定粗产品中Na2S2O3·5H2O的含量:
步骤1:准确称取8.000 0 g样品溶于水,加入5 mL甲醛,配成100 mL溶液。
步骤2:准确称取0.294 0 g K2Cr2O7固体于碘量瓶中,加入20 mL蒸馏水溶解,再加入10 mL 2 mol·L-1H2SO4和20 mL 10%KI溶液使铬元素完全转化为Cr3+,加水稀释至100 mL。
步骤3:向碘量瓶中加入1 mL 1%淀粉,用待测Na2S2O3溶液滴定碘量瓶中溶液至滴定终点,消耗Na2S2O3溶液20.00 mL。(已知:I2+2S2O===2I-+S4O)
试计算Na2S2O3·5H2O的纯度(写出计算过程)。
3.(2023·江苏省苏锡常镇四市高三教学情况调研)对SiO2为载体的加氢废催化剂(主要含有WS2、NiS、Al2S3,含少量碳、磷)处理的实验流程如下:
(1)NiS中,基态镍离子的电子排布式为______________。
(2)高温氧化焙烧时,WS2发生反应的化学方程式为____________。
(3)滤渣X的成分为H2SiO3和________________。
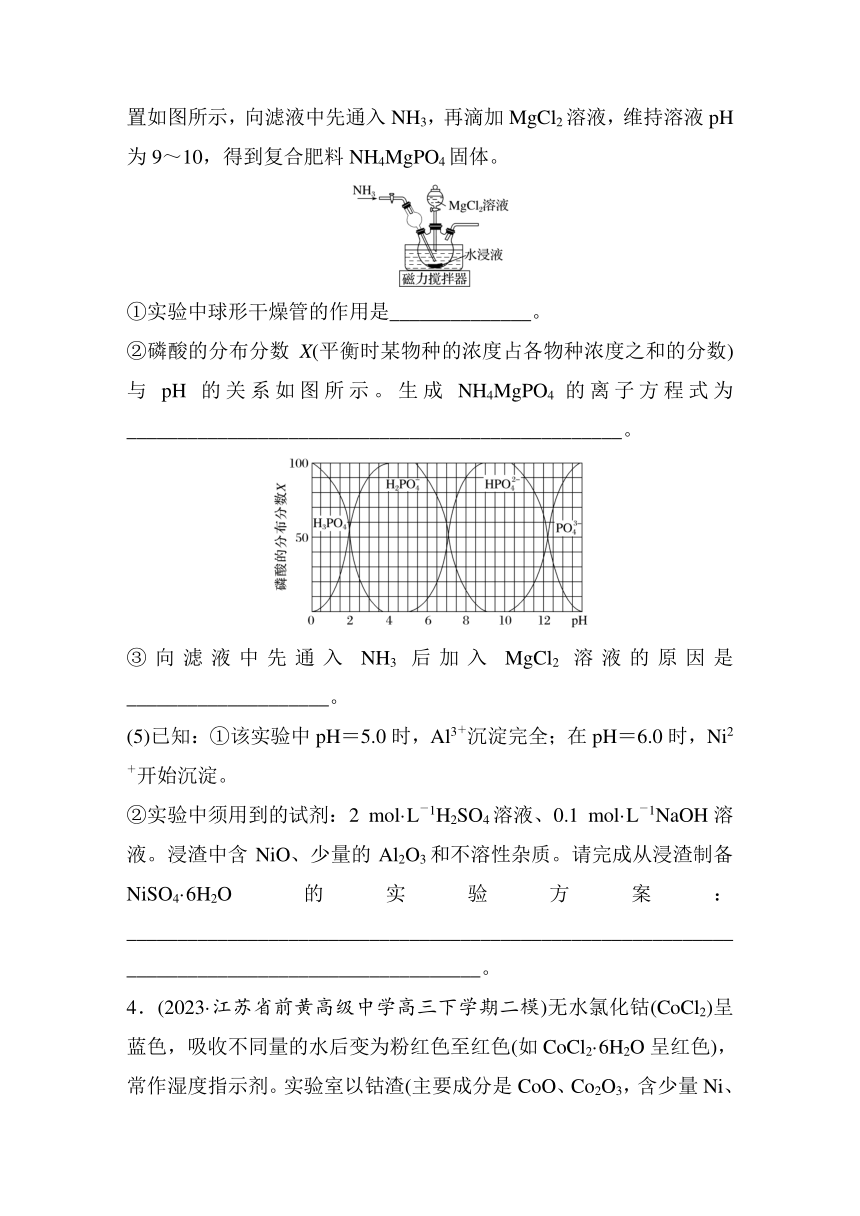
(4)Mg(H2PO4)2易溶于水,MgHPO4、Mg3(PO4)2均难溶于水。除磷装置如图所示,向滤液中先通入NH3,再滴加MgCl2溶液,维持溶液pH为9~10,得到复合肥料NH4MgPO4固体。
①实验中球形干燥管的作用是______________。
②磷酸的分布分数X(平衡时某物种的浓度占各物种浓度之和的分数)与pH的关系如图所示。生成NH4MgPO4的离子方程式为_________________________________________________。
③向滤液中先通入NH3后加入MgCl2溶液的原因是____________________。
(5)已知:①该实验中pH=5.0时,Al3+沉淀完全;在pH=6.0时,Ni2+开始沉淀。
②实验中须用到的试剂:2 mol·L-1H2SO4溶液、0.1 mol·L-1NaOH溶液。浸渣中含NiO、少量的Al2O3和不溶性杂质。请完成从浸渣制备NiSO4·6H2O的实验方案:_______________________________________________________________________________________________。
4.(2023·江苏省前黄高级中学高三下学期二模)无水氯化钴(CoCl2)呈蓝色,吸收不同量的水后变为粉红色至红色(如CoCl2·6H2O呈红色),常作湿度指示剂。实验室以钴渣(主要成分是CoO、Co2O3,含少量Ni、Al2O3等杂质)为原料制备无水氯化钴的流程如图(部分产物和条件省略):
已知:①几种金属离子转化为氢氧化物沉淀的pH如表所示:
金属离子 Al3+ Co2+ Ni2+
开始沉淀的pH 4.0 7.6 7.7
完全沉淀的pH 5.2 9.2 9.5
②SOCl2极易水解生成两种气体,其中一种气体能使品红溶液褪色。
回答下列问题:
(1)酸浸。将一定量钴渣加入三颈瓶中(装置如图所示),将稀硫酸通过分液漏斗加入其中,再向悬浊液中通入SO2。写出SO2参与反应的离子方程式______________________________。
(2)除铝。得到固体的主要成分是___________(填化学式),该步调节pH的范围为__________。
(3)制备无水CoCl2。实验室由CoCO3制备无水CoCl2,请补充实验方案:①________________________________________________,用蒸馏水洗涤2~3次,低温干燥。将所得固体(CoCl2·6H2O)置于圆底烧瓶中,②________________________________________________,停止加热,得到无水CoCl2。(实验中须使用的试剂:SOCl2、2 mol·L-1盐酸、1 mol·L-1NaOH溶液)
(4)钴(Ⅲ)可形成CoCl3·xNH3(x=3,4,5,6)等一系列配位数为6的配合物。现取10.00 mL 0.100 0 mol·L-1某钴(Ⅲ)配合物的水溶液,向其中滴加50.00 mL 0.200 0 mol·L-1 AgNO3溶液,立即产生白色沉淀0.143 5 g,过滤,充分加热滤液,将氨气全部逸出,又生成一定量的白色沉淀。通过计算求出该配合物的化学式(写出计算过程)。
强化练三 综合实验探究
1.(1)①使NO(或NO2)充分转化为NO,提高氮元素的利用率 ②b ③3MnO+4H++5NO===3Mn2++5NO+2H2O (2)金属铝、铁表面有氧化膜,阻碍了NO的脱除反应;铝铁合金中,铁和铝可以构成原电池,加快化学反应速率 (3)缓慢通入60 L 0.008 g·L-1O3充分反应,再分批加入80 g KCl固体充分反应 将滤液浓缩蒸发水量25% 将滤液冷却到10 ℃结晶
解析 工业废气通过A装置时其中的二氧化氮与水反应生成硝酸,在硫酸存在条件下,氢离子、硝酸根离子与铜反应生成一氧化氮,废气中的二氧化碳可通过装置B吸收,所以装置B盛放的试剂可能是碱石灰,吸收二氧化碳的同时吸收水分,干燥的一氧化氮与过氧化钠反应生成亚硝酸钠,D装置是尾气吸收装置。
(1)②P2O5、无水CaCl2、无水硫酸铜只能吸收水不能吸收二氧化碳,a、c、d错误;碱石灰既能吸收水也能吸收二氧化碳,b正确。③由题意知酸性条件下,NO能与MnO反应生成NO和Mn2+,所以装置D中发生反应的离子方程式为3MnO+4H++5NO===3Mn2++5NO+2H2O。
2.(1)sp3 (2)硫粉微溶于乙醇,在乙醇中有一定的溶解度,从而增大反应物的接触面积,加快反应速率 (3)①4SO2+2Na2S+Na2CO3===3Na2S2O3+CO2 ②Na2CO3溶液呈碱性,可以抑制Na2S水解,防止产生H2S气体 ③若SO2过量,溶液显酸性,产物分解 (4)向其中加入过量KI溶液,充分振荡,以淀粉溶液为指示剂,用0.100 0 mol·L-1Na2S2O3标准溶液滴定至终点,加入稀硫酸调节溶液pH=3,再以淀粉溶液为指示剂,用0.100 0 mol·L-1Na2S2O3标准溶液滴定至终点,记录第二次滴定消耗Na2S2O3溶液的体积
(5)K2Cr2O7溶液加入H2SO4和KI溶液使铬元素完全转化为Cr3+,离子方程式为Cr2O+6I-+14H+===2Cr3++3I2+7H2O,再根据反应I2+2S2O===S4O+2I-,可以得到关系式6S2O~Cr2O,n(K2Cr2O7)===0.001 mol,所以Na2S2O3·5H2O的质量为6×0.001×248×5 g=7.44 g,所以Na2S2O3·5H2O的纯度×100%=93%
3.(1)1s22s22p63s23p63d8(或[Ar]3d8)
(2)2WS2+7O22WO3+4SO2
(3)Al(OH)3
(4)①防止倒吸 ②NH3·H2O+HPO+Mg2+===NH4MgPO4↓+H2O ③避免生成MgHPO4沉淀,提高NH4MgPO4产率和纯度
(5)向浸渣中加入稍过量的2 mol·L-1H2SO4溶液中,充分搅拌至固体不再溶解;边搅拌边滴加0.1 mol·L-1NaOH溶液,调节溶液的pH为5.0~6.0,过滤;将滤液加热浓缩、冷却结晶、过滤得到NiSO4·6H2O
4.(1)Co2O3+SO2+2H+===2Co2++SO+H2O
(2)Al(OH)3 5.2≤pH<7.6 (3)边搅拌边向2 mol·L-1盐酸中分批加入CoCO3,至无气泡产生,蒸发浓缩至溶液表面有晶膜出现,冷却结晶,过滤 向其中加入适量SOCl2,加热,并将气体产物通入1 mol·L-1 NaOH溶液中,至红色固体完全变为蓝色
(4)反应生成沉淀分两步进行,说明氯离子存在两种形式,则该配合物的物质的量n(配合物)=×0.100 0 mol·L-1=1.000×10-3mol,外界Cl-的物质的量n(外界Cl-)=n(AgCl)==1.000×10-3mol,则内界Cl-的物质的量n(内界Cl-)=3×1.000×10-3mol-1.000×10-3 mol=2.000×10-3 mol,内、外界Cl-的个数之比(2.000×10-3mol)∶(1.000×
10-3 mol)=2∶1,所以该配合物的化学式为[Co(NH3)4Cl2]Cl
解析 以钴液(主要成分是CoO、Co2O3,含少量Ni、Al2O3等杂质)为原料制备无水氯化钴(CoCl2),硫酸酸浸后Al2O3转化为Al3+,Co2O3转化为Co3+,CoO转化为Co2+,Ni转化为Ni2+,通入SO2的目的是将Co3+还原为Co2+;加入碳酸钠固体将铝离子转化为Al(OH)3沉淀,加入萃取剂HX除去Ni2+,镍最终转化为NiSO4·7H2O,加入碳酸钠沉钴得到碳酸钴,加入盐酸酸溶后经过一系列操作得到CoCl2,以此解答。
(1)由分析可知,“酸浸”中SO2的作用是将Co2O3还原为Co2+,该反应中SO2中S元素化合价由+4价升高到+6价,根据得失电子守恒和原子守恒配平方程式为Co2O3+SO2+2H+===2Co2++SO+H2O。
(2)由分析可知,加入碳酸钠固体发生相互促进的水解反应得到Al(OH)3沉淀,由表格可知该步调节pH的范围为5.2≤pH<7.6。
1.(2023·徐州市高三考前模拟)亚硝酸钠(NaNO2)在工业上多个领域有着广泛应用。
(1)实验室利用工业废气(主要含NO、NO2、CO2)模拟制备NaNO2的装置如图所示:
已知:室温下,2NO+Na2O2===2NaNO2;酸性条件下,NO或NO都能与MnO反应生成NO和Mn2+。
①装置A中使用稀硫酸的目的是________________________________________________。
②装置B内盛放的试剂可能是________(填字母)。
a.P2O5 b.碱石灰
c.无水CaCl2 d.无水硫酸铜
③装置D中发生反应的离子方程式为__________________________________________________________。
(2)实验室将含NO、NO的酸性工业废水的NO全部氧化为NO,分别用铝、铁和铝铁合金对NO进行脱除。在0~3 h内,铝和铁对NO几乎未脱除,而铝铁合金的脱除效率高,其可能的原因是____________________________________________________。
(3)某科研机构经多次实验,利用O3、KCl和工业废渣(主要成分为NaNO2和NaNO3)制得KNO3,相关工艺参数如图1和图2[浓缩蒸发水量=],请选择最佳实验方案,完成他们的制备:将100 g废渣加入80 mL热水中,充分搅拌,____________,在50 ℃恒温水浴锅中充分反应后,过滤,________,趁热过滤,__________,过滤得KNO3粗产品,再重结晶提纯得到KNO3(须使用的试剂及用量:60 L 0.008 g·L-1O3和80 g KCl固体)。
2.(2023·江苏省四校高三下学期4月联考)硫代硫酸钠晶体(Na2S2O3·5H2O,M=248 g·mol-1)易溶于水,难溶于乙醇,在中性和碱性环境中稳定,在酸性环境中易分解,在40~50 ℃熔化,48 ℃分解。用两种方法制取Na2S2O3·5H2O并加以应用。
Ⅰ.制备Na2S2O3·5H2O
方法一:亚硫酸钠法,反应原理:S+Na2SO3Na2S2O3。
实验步骤:称取一定量的Na2SO3固体于烧杯中,溶于煮沸过的蒸馏水。另取过量硫粉,加入少量乙醇充分搅拌均匀后,加到上述溶液中。水浴加热,微沸,反应后趁热过滤。溶液蒸发浓缩、冷却结晶析出Na2S2O3·5H2O晶体。再进行减压过滤、洗涤并低温干燥。
(1)S2O中心硫原子的杂化方式为__________。
(2)向硫粉中加入少量乙醇充分搅拌均匀的目的是______________________________________________________________________________。
方法二:硫化碱法,装置如图所示。
(3)①装置C中,将Na2S和Na2CO3以2∶1的物质的量之比配成溶液再通入SO2,便可制得Na2S2O3和CO2。反应的化学方程式为_____________________________________________。
②三颈烧瓶中两种固体溶解时,需先将Na2CO3固体溶于水配成溶液,再将Na2S固体溶于Na2CO3溶液中,其目的是_______________________________________________________。
③实验过程中,C装置中的澄清溶液先变浑浊,后变澄清时生成大量的Na2S2O3一段时间后,再次出现少量浑浊,此时须立刻停止通入SO2。为了保证Na2S2O3·5H2O的产量,实验中通入的SO2不能过量,原因是______________________________________________________。
Ⅱ.Na2S2O3的应用
(4)某消毒液中含有ClO2和Cl2两种主要成分。请补充完整用Na2S2O3标准溶液测定该消毒液中ClO2含量的实验方案:量取5.00 mL消毒液于锥形瓶中,加蒸馏水稀释到25.00 mL,______________,重复实验2~3次,取实验平均值计算ClO2的含量。
已知:①2ClO2+2KI===2KClO2+I2;
②KClO2+4KI+2H2SO4===KCl+2K2SO4+2I2+2H2O;
③2Na2S2O3+I2===Na2S4O6+2NaI;且反应②在pH=3时完全进行。
(须使用的试剂:0.100 0 mol·L-1Na2S2O3标准溶液、淀粉溶液、KI溶液、稀硫酸)
(5)设计以下实验测定粗产品中Na2S2O3·5H2O的含量:
步骤1:准确称取8.000 0 g样品溶于水,加入5 mL甲醛,配成100 mL溶液。
步骤2:准确称取0.294 0 g K2Cr2O7固体于碘量瓶中,加入20 mL蒸馏水溶解,再加入10 mL 2 mol·L-1H2SO4和20 mL 10%KI溶液使铬元素完全转化为Cr3+,加水稀释至100 mL。
步骤3:向碘量瓶中加入1 mL 1%淀粉,用待测Na2S2O3溶液滴定碘量瓶中溶液至滴定终点,消耗Na2S2O3溶液20.00 mL。(已知:I2+2S2O===2I-+S4O)
试计算Na2S2O3·5H2O的纯度(写出计算过程)。
3.(2023·江苏省苏锡常镇四市高三教学情况调研)对SiO2为载体的加氢废催化剂(主要含有WS2、NiS、Al2S3,含少量碳、磷)处理的实验流程如下:
(1)NiS中,基态镍离子的电子排布式为______________。
(2)高温氧化焙烧时,WS2发生反应的化学方程式为____________。
(3)滤渣X的成分为H2SiO3和________________。
(4)Mg(H2PO4)2易溶于水,MgHPO4、Mg3(PO4)2均难溶于水。除磷装置如图所示,向滤液中先通入NH3,再滴加MgCl2溶液,维持溶液pH为9~10,得到复合肥料NH4MgPO4固体。
①实验中球形干燥管的作用是______________。
②磷酸的分布分数X(平衡时某物种的浓度占各物种浓度之和的分数)与pH的关系如图所示。生成NH4MgPO4的离子方程式为_________________________________________________。
③向滤液中先通入NH3后加入MgCl2溶液的原因是____________________。
(5)已知:①该实验中pH=5.0时,Al3+沉淀完全;在pH=6.0时,Ni2+开始沉淀。
②实验中须用到的试剂:2 mol·L-1H2SO4溶液、0.1 mol·L-1NaOH溶液。浸渣中含NiO、少量的Al2O3和不溶性杂质。请完成从浸渣制备NiSO4·6H2O的实验方案:_______________________________________________________________________________________________。
4.(2023·江苏省前黄高级中学高三下学期二模)无水氯化钴(CoCl2)呈蓝色,吸收不同量的水后变为粉红色至红色(如CoCl2·6H2O呈红色),常作湿度指示剂。实验室以钴渣(主要成分是CoO、Co2O3,含少量Ni、Al2O3等杂质)为原料制备无水氯化钴的流程如图(部分产物和条件省略):
已知:①几种金属离子转化为氢氧化物沉淀的pH如表所示:
金属离子 Al3+ Co2+ Ni2+
开始沉淀的pH 4.0 7.6 7.7
完全沉淀的pH 5.2 9.2 9.5
②SOCl2极易水解生成两种气体,其中一种气体能使品红溶液褪色。
回答下列问题:
(1)酸浸。将一定量钴渣加入三颈瓶中(装置如图所示),将稀硫酸通过分液漏斗加入其中,再向悬浊液中通入SO2。写出SO2参与反应的离子方程式______________________________。
(2)除铝。得到固体的主要成分是___________(填化学式),该步调节pH的范围为__________。
(3)制备无水CoCl2。实验室由CoCO3制备无水CoCl2,请补充实验方案:①________________________________________________,用蒸馏水洗涤2~3次,低温干燥。将所得固体(CoCl2·6H2O)置于圆底烧瓶中,②________________________________________________,停止加热,得到无水CoCl2。(实验中须使用的试剂:SOCl2、2 mol·L-1盐酸、1 mol·L-1NaOH溶液)
(4)钴(Ⅲ)可形成CoCl3·xNH3(x=3,4,5,6)等一系列配位数为6的配合物。现取10.00 mL 0.100 0 mol·L-1某钴(Ⅲ)配合物的水溶液,向其中滴加50.00 mL 0.200 0 mol·L-1 AgNO3溶液,立即产生白色沉淀0.143 5 g,过滤,充分加热滤液,将氨气全部逸出,又生成一定量的白色沉淀。通过计算求出该配合物的化学式(写出计算过程)。
强化练三 综合实验探究
1.(1)①使NO(或NO2)充分转化为NO,提高氮元素的利用率 ②b ③3MnO+4H++5NO===3Mn2++5NO+2H2O (2)金属铝、铁表面有氧化膜,阻碍了NO的脱除反应;铝铁合金中,铁和铝可以构成原电池,加快化学反应速率 (3)缓慢通入60 L 0.008 g·L-1O3充分反应,再分批加入80 g KCl固体充分反应 将滤液浓缩蒸发水量25% 将滤液冷却到10 ℃结晶
解析 工业废气通过A装置时其中的二氧化氮与水反应生成硝酸,在硫酸存在条件下,氢离子、硝酸根离子与铜反应生成一氧化氮,废气中的二氧化碳可通过装置B吸收,所以装置B盛放的试剂可能是碱石灰,吸收二氧化碳的同时吸收水分,干燥的一氧化氮与过氧化钠反应生成亚硝酸钠,D装置是尾气吸收装置。
(1)②P2O5、无水CaCl2、无水硫酸铜只能吸收水不能吸收二氧化碳,a、c、d错误;碱石灰既能吸收水也能吸收二氧化碳,b正确。③由题意知酸性条件下,NO能与MnO反应生成NO和Mn2+,所以装置D中发生反应的离子方程式为3MnO+4H++5NO===3Mn2++5NO+2H2O。
2.(1)sp3 (2)硫粉微溶于乙醇,在乙醇中有一定的溶解度,从而增大反应物的接触面积,加快反应速率 (3)①4SO2+2Na2S+Na2CO3===3Na2S2O3+CO2 ②Na2CO3溶液呈碱性,可以抑制Na2S水解,防止产生H2S气体 ③若SO2过量,溶液显酸性,产物分解 (4)向其中加入过量KI溶液,充分振荡,以淀粉溶液为指示剂,用0.100 0 mol·L-1Na2S2O3标准溶液滴定至终点,加入稀硫酸调节溶液pH=3,再以淀粉溶液为指示剂,用0.100 0 mol·L-1Na2S2O3标准溶液滴定至终点,记录第二次滴定消耗Na2S2O3溶液的体积
(5)K2Cr2O7溶液加入H2SO4和KI溶液使铬元素完全转化为Cr3+,离子方程式为Cr2O+6I-+14H+===2Cr3++3I2+7H2O,再根据反应I2+2S2O===S4O+2I-,可以得到关系式6S2O~Cr2O,n(K2Cr2O7)===0.001 mol,所以Na2S2O3·5H2O的质量为6×0.001×248×5 g=7.44 g,所以Na2S2O3·5H2O的纯度×100%=93%
3.(1)1s22s22p63s23p63d8(或[Ar]3d8)
(2)2WS2+7O22WO3+4SO2
(3)Al(OH)3
(4)①防止倒吸 ②NH3·H2O+HPO+Mg2+===NH4MgPO4↓+H2O ③避免生成MgHPO4沉淀,提高NH4MgPO4产率和纯度
(5)向浸渣中加入稍过量的2 mol·L-1H2SO4溶液中,充分搅拌至固体不再溶解;边搅拌边滴加0.1 mol·L-1NaOH溶液,调节溶液的pH为5.0~6.0,过滤;将滤液加热浓缩、冷却结晶、过滤得到NiSO4·6H2O
4.(1)Co2O3+SO2+2H+===2Co2++SO+H2O
(2)Al(OH)3 5.2≤pH<7.6 (3)边搅拌边向2 mol·L-1盐酸中分批加入CoCO3,至无气泡产生,蒸发浓缩至溶液表面有晶膜出现,冷却结晶,过滤 向其中加入适量SOCl2,加热,并将气体产物通入1 mol·L-1 NaOH溶液中,至红色固体完全变为蓝色
(4)反应生成沉淀分两步进行,说明氯离子存在两种形式,则该配合物的物质的量n(配合物)=×0.100 0 mol·L-1=1.000×10-3mol,外界Cl-的物质的量n(外界Cl-)=n(AgCl)==1.000×10-3mol,则内界Cl-的物质的量n(内界Cl-)=3×1.000×10-3mol-1.000×10-3 mol=2.000×10-3 mol,内、外界Cl-的个数之比(2.000×10-3mol)∶(1.000×
10-3 mol)=2∶1,所以该配合物的化学式为[Co(NH3)4Cl2]Cl
解析 以钴液(主要成分是CoO、Co2O3,含少量Ni、Al2O3等杂质)为原料制备无水氯化钴(CoCl2),硫酸酸浸后Al2O3转化为Al3+,Co2O3转化为Co3+,CoO转化为Co2+,Ni转化为Ni2+,通入SO2的目的是将Co3+还原为Co2+;加入碳酸钠固体将铝离子转化为Al(OH)3沉淀,加入萃取剂HX除去Ni2+,镍最终转化为NiSO4·7H2O,加入碳酸钠沉钴得到碳酸钴,加入盐酸酸溶后经过一系列操作得到CoCl2,以此解答。
(1)由分析可知,“酸浸”中SO2的作用是将Co2O3还原为Co2+,该反应中SO2中S元素化合价由+4价升高到+6价,根据得失电子守恒和原子守恒配平方程式为Co2O3+SO2+2H+===2Co2++SO+H2O。
(2)由分析可知,加入碳酸钠固体发生相互促进的水解反应得到Al(OH)3沉淀,由表格可知该步调节pH的范围为5.2≤pH<7.6。
同课章节目录
