高中化学必修第二册《第二节 乙烯与有机高分子材料》教学课件(共21张PPT)
文档属性
| 名称 | 高中化学必修第二册《第二节 乙烯与有机高分子材料》教学课件(共21张PPT) |  | |
| 格式 | ppt | ||
| 文件大小 | 5.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-17 18:50:49 | ||
图片预览







文档简介
(共21张PPT)
第七章 第二节 乙烯与有机高分子材料
1.掌握乙烯的组成及结构特点,体会结构决定性质的观念,增强“宏观辨
识与微观探析”的能力。
2.掌握乙烯的化学性质,认识加成反应的特点,培养“证据推理与模型认
知”能力。
3.了解乙烯在生产及生活中的应用,培养“科学态度与社会责任”。
核心素养发展目标
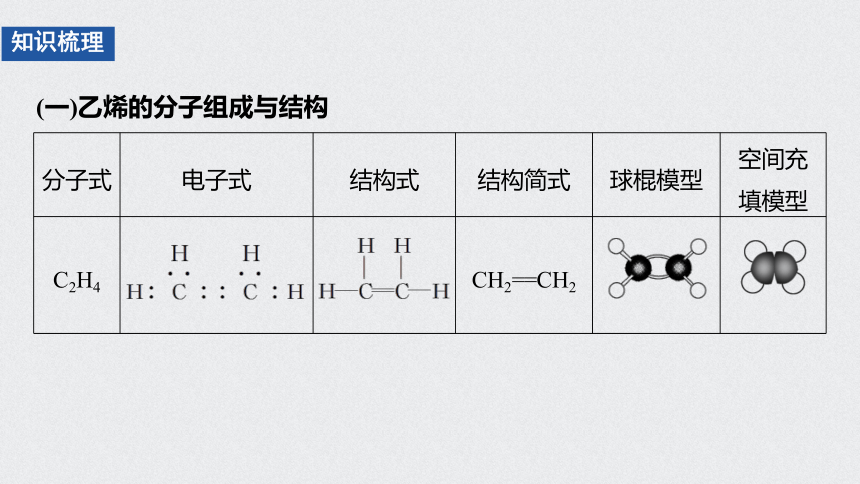
(一)乙烯的分子组成与结构
知识梳理
分子式 电子式 结构式 结构简式 球棍模型 空间充
填模型
C2H4 CH2==CH2
(二)乙烯的性质
1.乙烯的物理性质
颜色 状态 气味 水溶性 密度
无色 气体 稍有气味 溶于水 比空气_____
难
略小
2.乙烯的化学性质
(1)氧化反应
①燃烧:现象:火焰 ,伴有 。
化学方程式:C2H4+3O2 2CO2+2H2O。
②和酸性KMnO4溶液反应
现象:酸性KMnO4溶液褪色。
结论:乙烯能被酸性KMnO4溶液 。
明亮
黑烟
氧化
(2)加成反应
①将乙烯通入溴的四氯化碳溶液中
现象:溴的四氯化碳溶液 。
化学方程式: 。
②加成反应定义:有机物分子中的 与其他 直接结合生成新的化合物的反应。
褪色
不饱和碳原子
原子或原子团
书写下列加成反应的化学方程式:
CH3—CH3
CH3—CH2—OH
(3)聚合反应
①定义:由相对分子质量小的化合物分子互相结合成相对分子质量大的聚合物的反应。
②乙烯自身加成生成聚乙烯的方程式:
该反应是聚合反应,同时也是加成反应,这样的反应又被称为加成聚合反应,简称 。其中,—CH2—CH2—称为 ,n称为 ,小分子乙烯称为聚乙烯的 。
加聚反应
链节
聚合度
单体
(三)乙烯的用途
1.乙烯是重要的化工原料,在一定条件下用来制聚乙烯塑料、聚乙烯纤维、乙醇等。 的产量可以用来衡量一个国家的石油化工发展水平。
2.在农业生产中用作 。
乙烯
植物生长调节剂
(1)乙烯的结构简式可书写为CH2CH2( )
×
判断正误
提示 乙烯分子中含有 ,在书写时,官能团 不能省略,应为CH2==CH2。
提示 乙烯是一种稍有气味,难溶于水的气体。
(2)乙烯是一种无色无味,易溶于水的气体( )
×
√
(3)乙烯的化学性质比乙烷活泼( )
(4)乙烯能使酸性KMnO4溶液和溴水褪色,反应原理相同( )
×
提示 乙烯使酸性KMnO4溶液褪色发生的是氧化反应,乙烯使溴水褪色发生的为加成反应。
(5)乙烯聚合生成聚乙烯,本质是每个乙烯分子中的碳碳双键的一个键断裂,相互结合生成聚乙烯,因此也称为加聚反应( )
√
1.已知乙烯分子中两个碳原子和四个氢原子同在一个平面内,推测丙烯(CH2==CH—CH3)分子中最多有几个原子共面?
提示 丙烯可以认为乙烯分子中的一个氢原子被—CH3取代,且碳碳单键可以旋转,故可以将甲基上的一个H原子旋入面内,故丙烯分子中最多有7个原子共面。
深度思考
2.体育比赛中当运动员肌肉挫伤或扭伤时,队医随时对准运动员受伤部位喷射药剂氯乙烷(CH3CH2Cl)(沸点为12.27 ℃)进行局部冷却麻醉应急处理,工业上制取氯乙烷有两种方案:
a.CH3CH3+Cl2 CH3CH2Cl+HCl
b.CH2==CH2+HCl CH3—CH2Cl
你认为制备氯乙烷的最好方案为________(填“a”或“b”),并说出选择该方案及不选择另一方案的理由。
提示 最好方案为b。
理由:a方案中CH3CH3和Cl2在光照条件下发生取代反应,反应产物中除CH3CH2Cl和HCl外,还有很多副产物(如CH3CHCl2、 、CHCl2CH2Cl、
CHCl2CHCl2、CHCl2CCl3、CCl3—CCl3等),产物不纯,产率低。
b方案中CH2==CH2和HCl在一定条件下发生加成反应,产物中只有CH3CH2Cl,产品纯度高、产率高。
3.某化工厂厂房有两罐失去标识的气体,分别是乙烷和乙烯,怎么用化学方法鉴别哪一罐是乙烷气体或乙烯气体?请设计出实验方案。
提示 方案一,将两气体分别通入到溴水中,溴水褪色的为乙烯,则不褪色的为乙烷。
方案二,将两气体分别通入到酸性KMnO4溶液,紫红色褪色的为乙烯,不褪色的为乙烷。
方案三,将两气体分别在空气中燃烧,火焰明亮,且伴有黑烟的为乙烯,无黑烟的为乙烷。
4.含有碳碳双键的有机物很多,其性质和乙烯相似,写出下列要求的方程式。
(1)丙烯与溴水反应: 。
(2)丙烯在一定条件下加聚生成聚丙烯:_______________________________
。
CH3—CH==CH2+Br2―→
nCH3—CH==CH2
归纳总结
乙烷与乙烯的分子结构和化学性质对比
分
子
结
构 分子式 C2H6 C2H4
结构式
碳碳键类别 碳碳单键 碳碳双键
分子内原子
的相对位置 C、H不全在一个平面内 6个原子都在同一平面内
化
学
性
质 燃烧 2C2H6+7O2 4CO2+6H2O C2H4+3O2 2CO2+2H2O
特征反应 C2H6+Cl2 C2H5Cl+HCl CH2==CH2+Br2
―→CH2BrCH2Br
与酸性高锰
酸钾溶液 不反应 因发生氧化反应而使其褪色
1.长途运输水果时,常常将浸泡有高锰酸钾溶液的硅土放置在盛放水果的容器中,其目的是
A.利用高锰酸钾溶液杀死水果周围的细菌,防止水果霉变
B.利用高锰酸钾溶液吸收水果周围的氧气,防止水果腐烂
C.利用高锰酸钾溶液吸收水果产生的乙烯,防止水果早熟
D.利用高锰酸钾溶液的氧化性,催熟水果
跟踪强化
1
2
3
4
√
解析 水果释放出的乙烯是催熟剂,用KMnO4溶液来吸收乙烯,防止水果早熟。
2.(2019·自贡高一检测)能证明乙烯分子中含有一个碳碳双键的事实是
A.乙烯分子中碳、氢原子的个数比为1∶2
B.乙烯完全燃烧生成的CO2和H2O的物质的量相等
C.乙烯易与溴水发生加成反应,且1 mol乙烯完全加成需消耗1 mol溴单质
D.乙烯能使酸性KMnO4溶液褪色
解析 分子中的碳氢原子个数比只能说明烃的组成,不能说明其结构特点;燃烧产物的物质的量相等和被酸性KMnO4溶液氧化,不能说明乙烯分子中含有一个碳碳双键;1 mol乙烯只能与1 mol溴单质加成,说明乙烯分子中含有一个碳碳双键。
1
2
3
4
√
3.(2019·武汉高一期中)①②是两种常见烃的球棍模型,则下列叙述正确的是
A.都能在空气中燃烧
B.都能使酸性高锰酸钾溶液褪色
C.都能发生加成反应
D.等质量的①②完全燃烧时,产生CO2的量相同
解析 由题图可知,①为乙烷,②为乙烯。乙烷不能使酸性高锰酸钾溶液褪色,而乙烯能,B项错误;
乙烷不能发生加成反应,而乙烯能,C项错误;
乙烷和乙烯的摩尔质量不同,等质量时二者的物质的量不同,产生CO2的量也不同,D项错误。
1
3
4
2
√
4.下列物质不可能是乙烯加成产物的是
A.CH3CH3 B.CH3CHCl2
B.CH3CH2OH D.CH3CH2Br
1
3
4
2
√
解析 A项CH2==CH2和H2加成可生成CH3CH3;
C项CH2==CH2和H2O加成可生成CH3CH2OH;
D项CH2==CH2和HBr加成可生成CH3CH2Br;
C项中两个氯原子在同一个碳上,CH2==CH2和任何含氯物质加成都不能生成,故选B。
第七章 第二节 乙烯与有机高分子材料
1.掌握乙烯的组成及结构特点,体会结构决定性质的观念,增强“宏观辨
识与微观探析”的能力。
2.掌握乙烯的化学性质,认识加成反应的特点,培养“证据推理与模型认
知”能力。
3.了解乙烯在生产及生活中的应用,培养“科学态度与社会责任”。
核心素养发展目标
(一)乙烯的分子组成与结构
知识梳理
分子式 电子式 结构式 结构简式 球棍模型 空间充
填模型
C2H4 CH2==CH2
(二)乙烯的性质
1.乙烯的物理性质
颜色 状态 气味 水溶性 密度
无色 气体 稍有气味 溶于水 比空气_____
难
略小
2.乙烯的化学性质
(1)氧化反应
①燃烧:现象:火焰 ,伴有 。
化学方程式:C2H4+3O2 2CO2+2H2O。
②和酸性KMnO4溶液反应
现象:酸性KMnO4溶液褪色。
结论:乙烯能被酸性KMnO4溶液 。
明亮
黑烟
氧化
(2)加成反应
①将乙烯通入溴的四氯化碳溶液中
现象:溴的四氯化碳溶液 。
化学方程式: 。
②加成反应定义:有机物分子中的 与其他 直接结合生成新的化合物的反应。
褪色
不饱和碳原子
原子或原子团
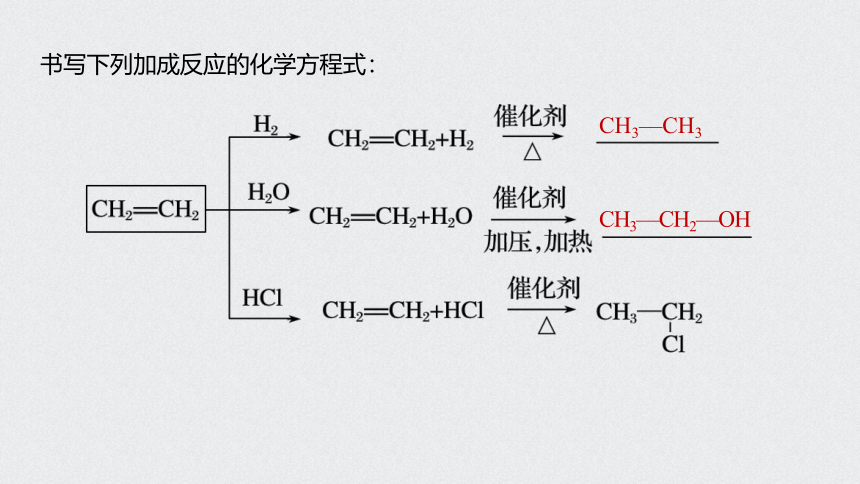
书写下列加成反应的化学方程式:
CH3—CH3
CH3—CH2—OH
(3)聚合反应
①定义:由相对分子质量小的化合物分子互相结合成相对分子质量大的聚合物的反应。
②乙烯自身加成生成聚乙烯的方程式:
该反应是聚合反应,同时也是加成反应,这样的反应又被称为加成聚合反应,简称 。其中,—CH2—CH2—称为 ,n称为 ,小分子乙烯称为聚乙烯的 。
加聚反应
链节
聚合度
单体
(三)乙烯的用途
1.乙烯是重要的化工原料,在一定条件下用来制聚乙烯塑料、聚乙烯纤维、乙醇等。 的产量可以用来衡量一个国家的石油化工发展水平。
2.在农业生产中用作 。
乙烯
植物生长调节剂
(1)乙烯的结构简式可书写为CH2CH2( )
×
判断正误
提示 乙烯分子中含有 ,在书写时,官能团 不能省略,应为CH2==CH2。
提示 乙烯是一种稍有气味,难溶于水的气体。
(2)乙烯是一种无色无味,易溶于水的气体( )
×
√
(3)乙烯的化学性质比乙烷活泼( )
(4)乙烯能使酸性KMnO4溶液和溴水褪色,反应原理相同( )
×
提示 乙烯使酸性KMnO4溶液褪色发生的是氧化反应,乙烯使溴水褪色发生的为加成反应。
(5)乙烯聚合生成聚乙烯,本质是每个乙烯分子中的碳碳双键的一个键断裂,相互结合生成聚乙烯,因此也称为加聚反应( )
√
1.已知乙烯分子中两个碳原子和四个氢原子同在一个平面内,推测丙烯(CH2==CH—CH3)分子中最多有几个原子共面?
提示 丙烯可以认为乙烯分子中的一个氢原子被—CH3取代,且碳碳单键可以旋转,故可以将甲基上的一个H原子旋入面内,故丙烯分子中最多有7个原子共面。
深度思考
2.体育比赛中当运动员肌肉挫伤或扭伤时,队医随时对准运动员受伤部位喷射药剂氯乙烷(CH3CH2Cl)(沸点为12.27 ℃)进行局部冷却麻醉应急处理,工业上制取氯乙烷有两种方案:
a.CH3CH3+Cl2 CH3CH2Cl+HCl
b.CH2==CH2+HCl CH3—CH2Cl
你认为制备氯乙烷的最好方案为________(填“a”或“b”),并说出选择该方案及不选择另一方案的理由。
提示 最好方案为b。
理由:a方案中CH3CH3和Cl2在光照条件下发生取代反应,反应产物中除CH3CH2Cl和HCl外,还有很多副产物(如CH3CHCl2、 、CHCl2CH2Cl、
CHCl2CHCl2、CHCl2CCl3、CCl3—CCl3等),产物不纯,产率低。
b方案中CH2==CH2和HCl在一定条件下发生加成反应,产物中只有CH3CH2Cl,产品纯度高、产率高。
3.某化工厂厂房有两罐失去标识的气体,分别是乙烷和乙烯,怎么用化学方法鉴别哪一罐是乙烷气体或乙烯气体?请设计出实验方案。
提示 方案一,将两气体分别通入到溴水中,溴水褪色的为乙烯,则不褪色的为乙烷。
方案二,将两气体分别通入到酸性KMnO4溶液,紫红色褪色的为乙烯,不褪色的为乙烷。
方案三,将两气体分别在空气中燃烧,火焰明亮,且伴有黑烟的为乙烯,无黑烟的为乙烷。
4.含有碳碳双键的有机物很多,其性质和乙烯相似,写出下列要求的方程式。
(1)丙烯与溴水反应: 。
(2)丙烯在一定条件下加聚生成聚丙烯:_______________________________
。
CH3—CH==CH2+Br2―→
nCH3—CH==CH2
归纳总结
乙烷与乙烯的分子结构和化学性质对比
分
子
结
构 分子式 C2H6 C2H4
结构式
碳碳键类别 碳碳单键 碳碳双键
分子内原子
的相对位置 C、H不全在一个平面内 6个原子都在同一平面内
化
学
性
质 燃烧 2C2H6+7O2 4CO2+6H2O C2H4+3O2 2CO2+2H2O
特征反应 C2H6+Cl2 C2H5Cl+HCl CH2==CH2+Br2
―→CH2BrCH2Br
与酸性高锰
酸钾溶液 不反应 因发生氧化反应而使其褪色
1.长途运输水果时,常常将浸泡有高锰酸钾溶液的硅土放置在盛放水果的容器中,其目的是
A.利用高锰酸钾溶液杀死水果周围的细菌,防止水果霉变
B.利用高锰酸钾溶液吸收水果周围的氧气,防止水果腐烂
C.利用高锰酸钾溶液吸收水果产生的乙烯,防止水果早熟
D.利用高锰酸钾溶液的氧化性,催熟水果
跟踪强化
1
2
3
4
√
解析 水果释放出的乙烯是催熟剂,用KMnO4溶液来吸收乙烯,防止水果早熟。
2.(2019·自贡高一检测)能证明乙烯分子中含有一个碳碳双键的事实是
A.乙烯分子中碳、氢原子的个数比为1∶2
B.乙烯完全燃烧生成的CO2和H2O的物质的量相等
C.乙烯易与溴水发生加成反应,且1 mol乙烯完全加成需消耗1 mol溴单质
D.乙烯能使酸性KMnO4溶液褪色
解析 分子中的碳氢原子个数比只能说明烃的组成,不能说明其结构特点;燃烧产物的物质的量相等和被酸性KMnO4溶液氧化,不能说明乙烯分子中含有一个碳碳双键;1 mol乙烯只能与1 mol溴单质加成,说明乙烯分子中含有一个碳碳双键。
1
2
3
4
√
3.(2019·武汉高一期中)①②是两种常见烃的球棍模型,则下列叙述正确的是
A.都能在空气中燃烧
B.都能使酸性高锰酸钾溶液褪色
C.都能发生加成反应
D.等质量的①②完全燃烧时,产生CO2的量相同
解析 由题图可知,①为乙烷,②为乙烯。乙烷不能使酸性高锰酸钾溶液褪色,而乙烯能,B项错误;
乙烷不能发生加成反应,而乙烯能,C项错误;
乙烷和乙烯的摩尔质量不同,等质量时二者的物质的量不同,产生CO2的量也不同,D项错误。
1
3
4
2
√
4.下列物质不可能是乙烯加成产物的是
A.CH3CH3 B.CH3CHCl2
B.CH3CH2OH D.CH3CH2Br
1
3
4
2
√
解析 A项CH2==CH2和H2加成可生成CH3CH3;
C项CH2==CH2和H2O加成可生成CH3CH2OH;
D项CH2==CH2和HBr加成可生成CH3CH2Br;
C项中两个氯原子在同一个碳上,CH2==CH2和任何含氯物质加成都不能生成,故选B。
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
