专题1 化学反应与能量变化 专题检测(含解析) 2023-2024学年高二上学期化学苏教版(2019)选择性必修1
文档属性
| 名称 | 专题1 化学反应与能量变化 专题检测(含解析) 2023-2024学年高二上学期化学苏教版(2019)选择性必修1 |  | |
| 格式 | docx | ||
| 文件大小 | 384.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-17 19:32:43 | ||
图片预览


文档简介
专题1 化学反应与能量变化 专题检测 2023-2024学年高二上学期化学苏教版(2019)选择性必修1
一、单选题
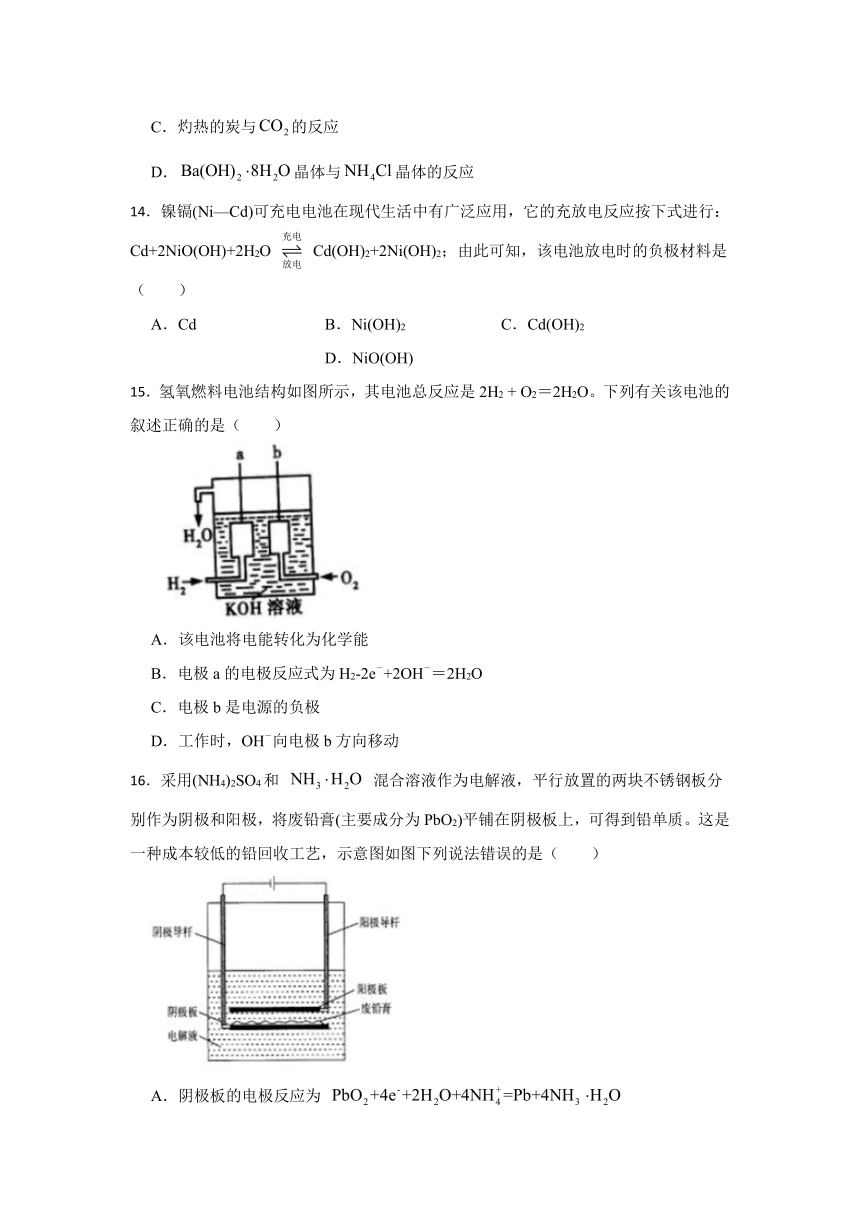
1.下列过程发生放热反应的是( )
A.固体NaOH溶于乙醇中 B.固体NH4Cl与Ba(OH)2混合
C.浓H2SO4加人水中 D.生石灰加入水中
2.下列变化属于吸热的化学反应的是( )
A.碘的升华
B.生石灰溶于水
C.酸碱中和
D.Ba(OH)2 8H2O与NH4Cl晶体混合
3.已知反应X+Y=M+N为放热反应,对该反应的下列说法中正确的( )
A.X的能量一定低于M
B.Y的能量一定高于N
C.1molX和1molY的总能量一定高于1molM和1molN的总能量
D.因该反应为放热反应,故不必加热就可发生
4.某兴趣小组设计的水果电池装置如图所示。该电池工作时,下列说法正确的是 ( )
A.铜片作负极 B.锌片发生还原反应
C.将电能转化为化学能 D.电子由锌片经导线流向铜片
5.下列反应中既是氧化还原反应,能量变化情况又符合如图的是( )
A.氢氧化钠与稀盐酸的反应 B.碳和水蒸气的反应
C.和的反应 D.氢气的燃烧反应
6.属于氧化还原反应且反应过程中能量变化符合如图所示的是( )
A. B.
C. D.
7.下列变化中,属于吸热反应的是( )
A.过氧化钠和水的反应 B.干冰升华
C.盐酸和氢氧化钠的反应 D.灼热的木炭与CO2的反应
8.化学反应A2+B2 = 2AB的能量变化如图所示,则下列说法正确的是( )
A.该反应是吸热反应
B.断裂 1molA-A 键和 1molB-B 键能放出xkJ 的能量
C.2mol AB 的总能量高于1mol A2和1mol B2和的总能量
D.断裂 2mol A-B 键需要吸收ykJ 的能量
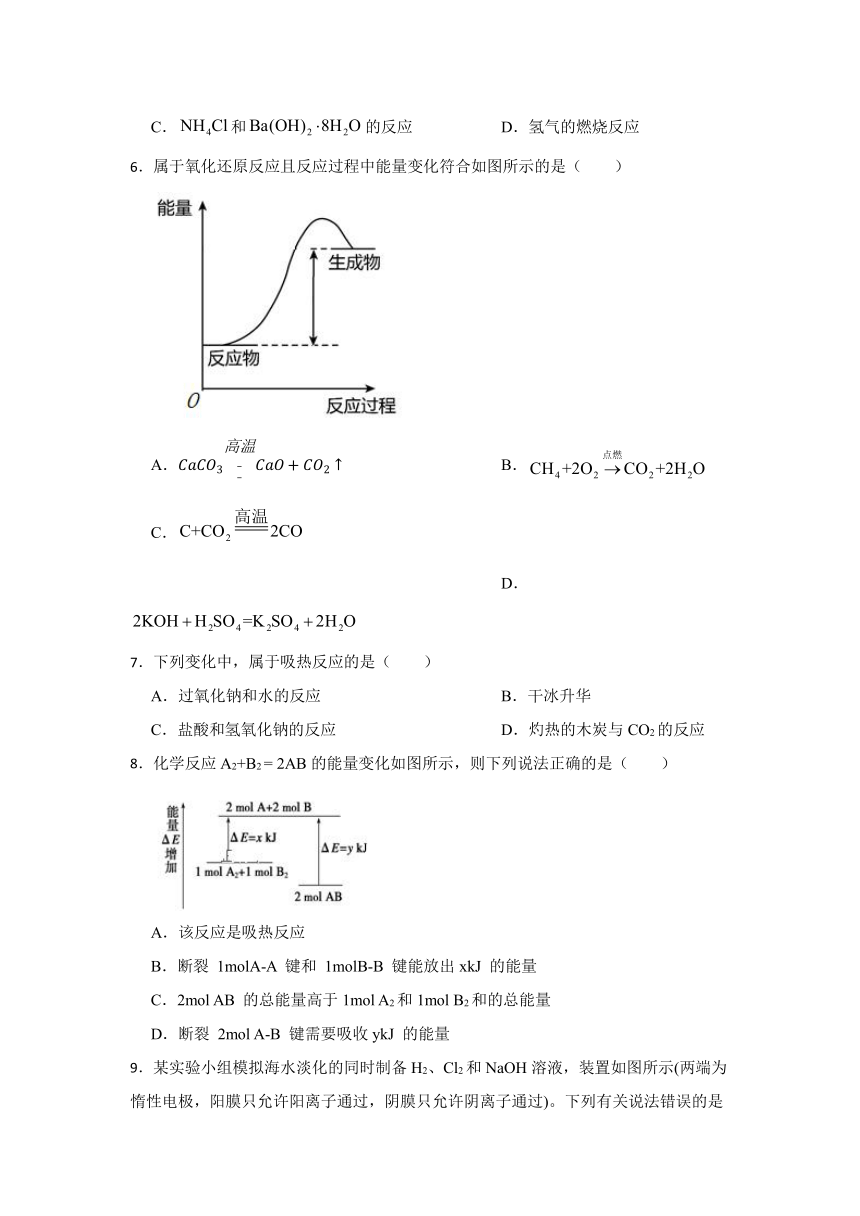
9.某实验小组模拟海水淡化的同时制备H2、Cl2和NaOH溶液,装置如图所示(两端为惰性电极,阳膜只允许阳离子通过,阴膜只允许阴离子通过)。下列有关说法错误的是( )
A.甲室产生的气体能使湿润的淀粉—KI试纸变蓝
B.膜①是阴离子交换膜
C.淡水的出口只有c
D.随着电解的进行,戊室溶液的pH不断增大
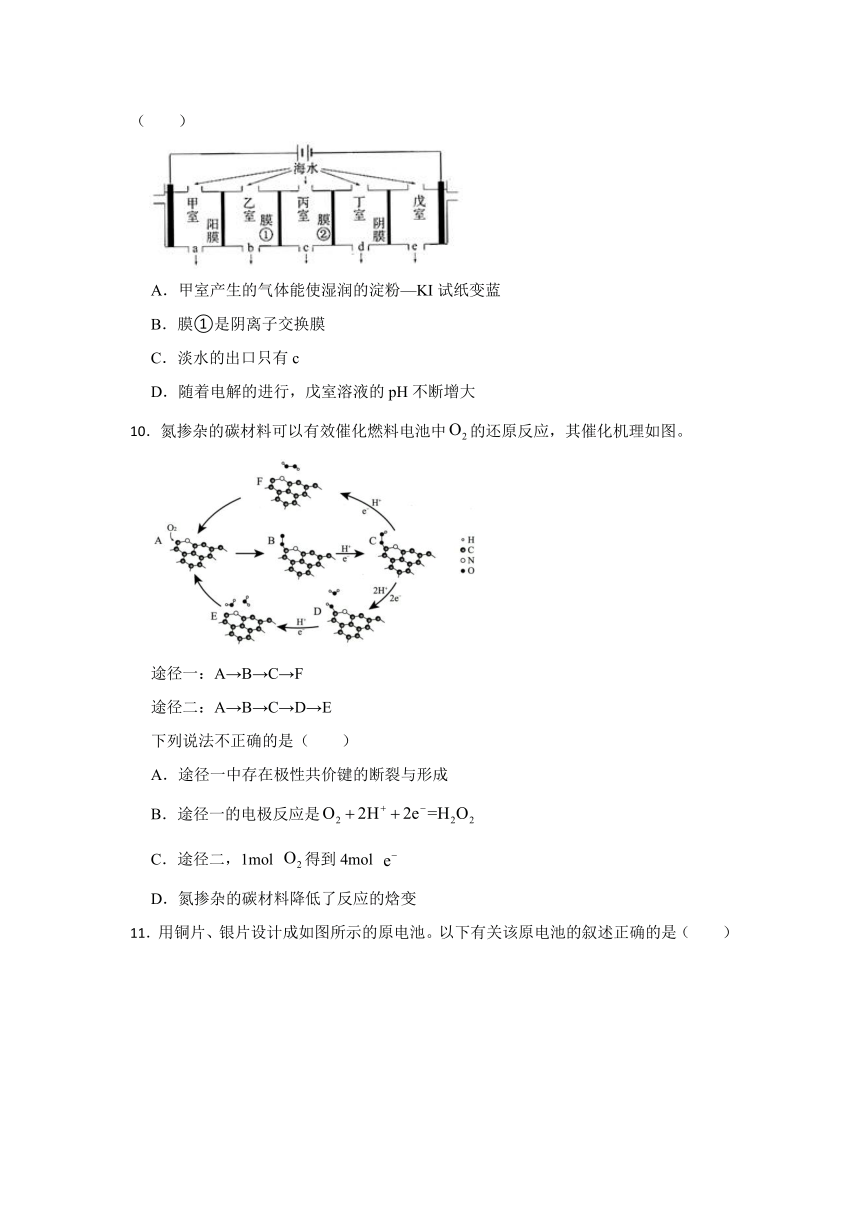
10.氮掺杂的碳材料可以有效催化燃料电池中的还原反应,其催化机理如图。
途径一:A→B→C→F
途径二:A→B→C→D→E
下列说法不正确的是( )
A.途径一中存在极性共价键的断裂与形成
B.途径一的电极反应是
C.途径二,1mol 得到4mol
D.氮掺杂的碳材料降低了反应的焓变
11.用铜片、银片设计成如图所示的原电池。以下有关该原电池的叙述正确的是( )
A.电子通过盐桥从乙池流向甲池
B.盐桥中的阳离子向甲池移动
C.开始时,银片上发生的反应是:
D.将铜片浸入 溶液中发生的化学反应与该原电池总反应相同
12.下列说法正确的是( )
A.25℃时,向含有AgCl固体的AgCl饱和溶液中加入少量稀盐酸,AgCl的溶解度增大
B.若 ; ,则
C.用pH计测得“84消毒液的pH为12.2
D.在的溶液中:、、、一定能大量共存
13.下列反应属于非氧化还原反应,且能量变化与图示相符合的是
A.镁与盐酸的反应
B.铁与氯气的化合
C.灼热的炭与的反应
D.晶体与晶体的反应
14.镍镉(Ni—Cd)可充电电池在现代生活中有广泛应用,它的充放电反应按下式进行:Cd+2NiO(OH)+2H2O Cd(OH)2+2Ni(OH)2;由此可知,该电池放电时的负极材料是( )
A.Cd B.Ni(OH)2 C.Cd(OH)2 D.NiO(OH)
15.氢氧燃料电池结构如图所示,其电池总反应是2H2 + O2=2H2O。下列有关该电池的叙述正确的是( )
A.该电池将电能转化为化学能
B.电极a的电极反应式为H2-2e-+2OH-=2H2O
C.电极b是电源的负极
D.工作时,OH-向电极b方向移动
16.采用(NH4)2SO4和 混合溶液作为电解液,平行放置的两块不锈钢板分别作为阴极和阳极,将废铅膏(主要成分为PbO2)平铺在阴极板上,可得到铅单质。这是一种成本较低的铅回收工艺,示意图如图下列说法错误的是( )
A.阴极板的电极反应为
B.电子由阳极板沿阳极导杆移向外接电源正极
C.电解过程中,OH-向阴极板迁移
D.标准状况下,外电路中每转移4mol电子,阳极板产生22.4LO2
二、综合题
17.如图中,甲是电解饱和食盐水,乙是铜的电解精炼,丙是电镀,回答:
(1)b极上的电极反应式为 ,甲电池的总反应化学方程式是 。
(2)在粗铜的电解过程中,图中c电极的材料是 (填“粗铜板”或“纯铜板”);在d电极上发生的电极反应为 ;若粗铜中还含有Au、Ag、Fe等杂质,则沉积在电解槽底部(阳极泥)的杂质是 ,电解一段时间后,电解液中的金属离子有 。
(3)如果要在铁制品上镀镍(二价金属),则e电极的材料是 (填“铁制品”或“镍块”,下同),f电极的材料是 。
(4)若e电极的质量变化118 g,则a电极上产生的气体在标准状况下的体积为 。
18.如下图所示装置,C、D、E、F、X、Y都是惰性电极,甲、乙中溶液的体积和浓度都相同(假设通电前后溶液体积不变),A、B为外接直流电源的两极。将直流电源接通后,E极附近溶液呈红色。请回答:
(1)B极是电源的 极。C电极上的电极反应式: 。
(2)若甲、乙装置中的C、D、E、F电极均只有一种单质生成时,对应单质的物质的量之比为 。
19.工业食盐中含Ca2+、Mg2+等杂质,某厂电解饱和食盐水制取NaOH溶液的工艺流程如图所示,回答下列问题:
(1)“精制”过程中发生反应的离子方程式为
(2)若粗盐中SO42﹣含量也较高,沉淀剂可以是 (填字母)且要在试剂Na2CO3之 加入(填“前”或“后”)。
a.Ba(OH)2
b.Ba(NO3)2
c.BaCl2
(3)在电解过程中,产生H2的电极与外接电源的 极相连;溶液pH增大的区域是 (填“阳极区”或“阴极区”)。
(4)烧碱和氯气是电解饱和食盐水时按照固定的比率k(质量比)生成的产品。理论上k= (填写计算表达式和结果且结果保留两位小数)。
20.依据氧化还原反应Zn(s)+Cu2+(aq)=Zn2+(aq)+Cu(s)设计的原电池如下图所示。
请回答下列问题:
(1)电极X的材料是 ;电解质溶液Y是 。
(2)铜电极为电池的 极,发生的电极反应为 X极上发生的电极反应为 。
(3)外电路中的电子是从 极流向 极(填名称)。
(4)盐桥中的Cl-向 极移动,如将盐桥撤掉,电流计的指针将 偏转。
21.氢气是一种理想的绿色能源。
(1)在101KP下,1g氢气完全燃烧生成液态水放出142.9kJ的热量,请回答下列问题:
①氢气的燃烧热为
②该反应的热化学方程式为
(2)氢能的存储是氢能利用的前提,科学家研究出一种储氢合金Mg2Ni,已知:Mg(s)+H2(g)=MgH2(s)ΔH1=-74.5kJ·mol-1,Mg2Ni(s)+2H2(g)=Mg2NiH4(s)ΔH2,Mg2Ni(s)+2MgH2(s)=2Mg(s)+Mg2NiH4(s) ΔH3=+84.6kJ·mol-1,则ΔH2= kJ·mol-1。
答案解析部分
1.【答案】D
【解析】【解答】A.固体NaOH不溶于乙醇中, 过程没有热量放出,不属于放热反应,A不符合题意;
B.固体NH4Cl和Ba(OH)2混合后,发生反应,同时吸收大量热,属于吸热反应,B不符合题意;
C.浓硫酸加入水中,放出大量热,但不是化学反应,故不属于放热反应,C不符合题意;
D.CaO与H2O反应生成Ca(OH)2,过程中放出大量热,属于放热反应,D符合题意;
故答案为:D
【分析】根据反应过程中的热效应分析,即可得出答案。
2.【答案】D
【解析】【解答】A.碘的升华属于物理变化,不是化学反应,故A不符合题意;
B.生石灰溶于水,与水反应生成氢氧化钙,为放热反应,故B不符合题意;
C.酸碱中和属于放热反应,故C不符合题意;
D.Ba(OH)2 8H2O与NH4Cl晶体混合,属于吸热反应,反应生成氯化钡和氨气,故D符合题意;
故答案为:D。
【分析】化学变化都伴随着能量的变化,有的化学变化吸热,有的则放热。
3.【答案】C
【解析】【解答】A.X的能量不一定低于M的能量,A不符合题意;
B.Y的能量不一定高于N的能量,B不符合题意;
C.由于该反应为放热反应,则1molX和1molY的总能量一定高于1molM和1molN的总能量,C符合题意;
D.该反应为放热反应,但与是否加热无关,某些放热反应也需要在加热条件下才能发生,D不符合题意;
故答案为:C
【分析】该反应为放热反应,则反应物的总能量高于生成物的总能量,据此结合选项分析。
4.【答案】D
【解析】【解答】A、锌作负极,铜为正极,选项A不符合题意;
B、锌作负极,负极上锌失电子发生氧化反应,选项B不符合题意;
C、该装置是原电池,将化学能转化为电能,选项C不符合题意;
D、电子从负极锌沿导线流向正极铜,选项D符合题意;
故答案为:D。
【分析】原电池的角度进行分析,活泼金属作为负极,负极质量减少,正极质量增加或者生产气体,电子由负极经过导线流向正极,电流由正极经过导线流向负极。
5.【答案】B
【解析】【解答】题中图像,反应物总能量低于生成物总能量,为吸热反应;
A.酸碱中和为放热反应;
B.碳,一氧化碳参与的还原反应都为吸热反应;
C.为吸热反应,但反应前后化合价未发生改变,所以不是氧化还原反应;
D.所有放入燃烧反应皆为放热反应。
故答案为:B.
【分析】化学反应前后化合价发生改变的为氧化还原反应,掌握常见的吸热放热反应。
A.酸碱中和反应为放热反应;
B.碳,一氧化碳参与的还原反应都为吸热反应;
C. 和 为典型的吸热反应;
D.所有放入燃烧反应都是放热反应。
6.【答案】C
【解析】【解答】A.反应为非氧化还原反应,故A不符合题意;
B.反应为放热反应,故B不符合题意;
C.反应为吸热的氧化还原反应,故C符合题意;
D.反应为非氧化还原反应,故D不符合题意;
故答案为:C。
【分析】化合价发生变化的反应为氧化还原反应,由图像可知此反应为吸热反应。
7.【答案】D
【解析】【解答】A. 过氧化钠和水的反应为放热反应,故A不符而;
B.干冰升华吸热,但是为物理过程,吸热反应为化学反应,故B不符合;
C. 盐酸和氢氧化钠的酸碱中和反应为放热反应,故C不符合;
D. 灼热的木炭与CO2的反应为吸热反应,故D符合;
故答案为:D。
【分析】A.过氧化钠和水反应放热;
B.干冰升华不是化学变化;
C.中和反应为放热反应。
8.【答案】D
【解析】【解答】A.由图可知,1molA2和1molB2的总能量高于2molAB的总能量,该反应是放热反应,故A不符合题意;
B.旧键的断裂需要吸收能量,而不是释放能量,故B不符合题意;
C.由图可知,1molA2和1molB2的总能量高于2molAB的总能量,故C不符合题意;
D.旧键的断裂吸收能量,由图可知断裂2molA-B键需要吸收ykJ能量,故D符合题意;
故答案为:D。
【分析】A.根据能量图中反应物和生成物能量的大小进行判断反应类型;
B.根据破坏化学键需要吸收能量进行判断;
C.根据能量图像中能量大小进行判断;
D.断裂化学需要吸收能量根据能量图中化学键的变化进行判断。
9.【答案】C
【解析】【解答】A.甲室为阳极室,电极反应式为 , 能使湿润的淀粉 试纸变蓝,A不符合题意;
B.反应过程中丙室中 通过膜②到丁室, 通过膜①到乙室;膜①是阴离子交换膜,膜②是阳离子交换膜,B不符合题意;
C.淡水的出口为a和c,C符合题意;
D.戊室的电极反应式为 ,随电解的进行,溶液的pH不断增大,D不符合题意。
故答案为:C。
【分析】该反应甲室连接电源正极为阳极室,戊室连接电源负极为阴极室;阳极电极反应式为 ,阴极电极反应式为 ;反应过程中丙室中 通过膜②到丁室,戊室中生成的OH-通过阴膜到达丁室, 通过膜①到乙室;膜①是阴离子交换膜,膜②是阳离子交换膜,淡水的出口为a和c,d中生成 NaOH ,以此分析。
10.【答案】D
【解析】【解答】A.由图中信息可知,途径一中有C-O键、O-H键的形成,也有C-O键的断裂,选项A不符合题意;
B.途径一的过程中有O2的参与和二次增加H+、e-,最后从催化剂中放出H2O2,其电极反应是,选项B不符合题意;
C.途径二中,有O2参与,途中二次增加H+、e-和一次增加2H+、2e-,故1mol 得到4mol ,选项C不符合题意;
D.氮掺杂的碳材料降低了反应的活化能,但不能改变焓变,选项D符合题意;
故答案为:D。
【分析】A.依据同种原子之间的共价键为非极性键;不同种原子之间的共价键为极性键;
B.途径一的过程中有O2的参与和二次增加H+、e-,最后从催化剂中放出H2O2;
C.注意途径二中电子转移的数目;
D.催化剂不能改变焓变。
11.【答案】D
【解析】【解答】A.电子不能通过电解质溶液,电解质溶液通过离子的定向移动形成电流,故A不符合题意;
B.盐桥中的阳离子向正极移动,银为正极,所以阳离子向乙池移动,故B不符合题意;
C.铜片是负极,银片是正极,在银片上发生的电极反应是 ,故C不符合题意;
D.该原电池的总反应为Cu+2Ag+=Cu2++2Ag,将铜片浸入AgNO3溶液中发生的化学反应也是Cu+2Ag+=Cu2++2Ag,故D符合题意;
故答案为:D。
【分析】 原电池中,较活泼的金属作负极,负极上金属失去电子发生氧化反应,较不活泼的金属作正极,正极上得电子发生还原反应,外电路上,电子从负极沿导线流向正极。
12.【答案】C
【解析】【解答】A.25℃时,向含有AgCl固体的AgCl饱和溶液中存在沉淀溶解平衡:,加入少量稀盐酸,氯离子浓度增大,平衡左移,AgCl的溶解度减小,A不符合题意;
B.硫呈气态时的能量比固态时要高,等量的硫蒸气充分燃烧放出的热量比固态硫燃烧放出的热量更高,焓变更小。若 ; ,则,B不符合题意;
C.pH计可用于准确测量溶液的pH,用pH计测得“84消毒液的pH为12.2,C符合题意;
D. 在的溶液中:铝离子和因双水解一定不能大量共存,D不符合题意;
故答案为:C。
【分析】A.温度不变,溶解度不变
B.根据固体到气体吸收能量
C.pH可以测定出pH可以是小数
D.碳酸根水解呈碱性,铝离子水解酸性可以双水解
13.【答案】D
【解析】【解答】A.镁与盐酸反应,发生了化合价的变化,是氧化还原反应,且为放热反应,不满足条件,故A项不符合题意;
B.铁与氯气的化合是氧化还原反应,且为放热反应,不满足条件,故B项不符合题意;
C.灼热的炭与CO2的反应是吸热反应,但发生了化合价的变化,是氧化还原反应,不满足条件,故C项不符合题意;
D.Ba(OH)2 8H2O晶体与NH4Cl晶体的反应是复分解反应,属于非氧化还原反应,且为吸热反应,满足条件,故D项符合题意;
故答案为:D。
【分析】AB.化合价发生变化,且为放热反应;
C.化合价发生变化,且为吸热反应;
D.化合价没有发生变化,且为吸热反应。
14.【答案】A
【解析】【解答】从总反应式Cd+2NiO(OH)+2H2O Cd(OH)2+2Ni(OH)2可以看出,放电时,Cd由0价升高到+2价,Ni由+3价降低到+2价,所以负极材料是Cd,
故答案为:A。
【分析】此题考查二次电池的判断,根据元素化合价的升降进行判断,根据化合价的升高判断得失电子,根据负极化合价升高失去电子可以判断。
15.【答案】B
【解析】【解答】A.该电池是将化学能转化为电能的装置,故A不符合题意;
B.电池工作时,通入氢气的a极为电池的负极,碱性条件下,氢气a极上失电子发生氧化反应生成水,电极反应式为H2-2e-+2OH-=2H2O,故B符合题意;
C.通入氧气的b极为电池的正极,氧气在b极上得电子发生还原反应,故C不符合题意;
D.电池工作时,阴离子向负极移动,则OH-向电极a方向移动,故D不符合题意。
故答案为:B。
【分析】A.燃料电池是将化学能转化为电能;
B.碱性环境中负极发生氧化反应生成水;
C.通入氧气的一极发生还原反应是正极;
D.原电池中阴离子向负极方向移动。
16.【答案】C
【解析】【解答】A.题干交待“将废铅膏(主要成分为PbO2)平铺在阴极板上,可得到铅单质”,则阴极板发生PbO2得电子生成Pb的反应,这也是电解回收铅的目的,电极反应为: ,故A不符合题意;
B.电子由阳极流入正极,再由负极流向阴极,故B不符合题意;
C.电解池中阴离子向阳极迁移,故C符合题意;
D.阳极发生反应 ,每转移4mol电子,阳极板产生1molO2,即22.4LO2(标准状况),故D不符合题意;
故答案为:C。
【分析】考查的是电解池的原理,阳极聚集大量的氢氧根离子和硫酸根离子,氢氧根失去电子,发生氧化反应,阴极聚集大量的铵根离子,二氧化铅得到电子,发生还原反应,得到铅单质。根据阴极的电极式即可计算出生成氧气的量
17.【答案】(1)2H++2e﹣=H2↑;2NaCl+2H2O 2NaOH+Cl2↑+H2↑
(2)粗铜板;Cu2++2e﹣=Cu;Au、Ag;Cu2+、Fe2+
(3)镍块;铁制品
(4)44.8L
【解析】【解答】(1)甲是电解饱和食盐水,M为正极,则a为阳极发生氧化反应,b为阴极发生还原反应,电极反应式为2H++2e-=H2↑,电解饱和食盐水生成氢气、氯气和氢氧化钠,总反应化学方程式为2NaCl+2H2O 2NaOH+Cl2↑+H2↑,故答案为:2H++2e-=H2↑;2NaCl+2H2O 2NaOH+Cl2↑+H2↑;
(2)用电解法进行粗铜提纯时,粗铜应作阳极,精铜作阴极,该装置中M为原电池的正极,N为原电池的负极,所以c为电解池的阳极,d为电解池的阴极,电解时,以硫酸铜溶液为电解液,溶液中的Cu2+得到电子在阴极上发生还原反应,即Cu2++2e-=Cu;作阳极的粗铜中的铜以及比铜活泼的金属失去电子进入溶液,所以Fe发生Fe-2e-═Fe2+反应,以Fe2+的形式进入溶液中;比铜不活泼的金属Au、Ag不会失去电子,以单质的形成沉入电解槽形成“阳极泥”,则沉积在电解槽底部(阳极泥)的杂质是Au、Ag,电解一段时间后,电解液中的金属离子有Cu2+、Fe2+ , 故答案为:粗铜板;Cu2++2e-=Cu;Au、Ag;Cu2+、Fe2+;
(3)要在铁制品上镀镍(二价金属),则铁作阴极与电源负极N相连即f极,镍为阳极与电源正极M相连即e极,故答案为:镍块;铁制品
(4)若e电极的质量变化118g,根据转移电子数相等,Ni~2e-~Cl2 , 则a电极上产生的气体在标准状况下的体积为 ×22.4L/mol=44.8L,故答案为:44.8L。
【分析】(1)依据电解饱和食盐水中M为正极,则a为阳极发生氧化反应,b为阴极发生还原反应分析;
(2)依据用电解法进行粗铜提纯时,粗铜应作阳极,精铜作阴极分析;
(3)依据电镀的相关知识分析;
(4)依据电子的转移数目相等分析解答。
18.【答案】(1)正;Cu2++2e-=Cu
(2)2:1:2:2
【解析】【解答】将直流电源接通后,E极附近呈红色,说明E极显碱性,H+在该电极放电,所以E极是阴极,可得出D、F、H、Y均为阳极,C、G、X均为阴极,A是电源的负极,B是正极;(1)B电极是电源的正极,C电极与负极相连为阴极,在阴极C电极上Cu2+得到电子,发生还原反应,电极反应式为:Cu2++2e-=Cu;(2)C、D、E、F电极发生的电极反应分别为:Cu2++2e-=Cu、4OH- -4e-=O2↑+2H2O;2H++2e-=H2↑、2Cl--2e-=Cl2↑,当各电极转移电子均为1 mol时,生成单质的量分别为:0.5 mol、0.25 mol、0.5 mol、0.5 mol,所以单质的物质的量之比为2:1: 2:2。
【分析】(1)将直流电源接通后,E极附近呈红色,可知E极上H+在该电极放电,所以E电极是阴极,并得到其他各个电极的名称,阳极上阴离子放电;(2)C、D、E、F电极转移的电子数目相等,根据转移电子数可计算生成的单质的量。
19.【答案】(1)Ca2++CO32﹣═CaCO3↓、Mg2++2OH﹣═Mg(OH)2↓
(2)ac;前
(3)负;阴极区
(4)1.13
【解析】【解答】(1)“精制”过程中加入NaOH和Na2CO3,为了除去溶液中的Ca2+和Mg2+, Ca2+以碳酸钙的形式除去,Mg2+以Mg(OH)2的形式除去,根据电荷守恒可以写出方程式,答案为Ca2++CO32﹣═CaCO3↓、Mg2++2OH﹣═Mg(OH)2↓;(2)SO42﹣可以用Ba2+除去,但是不能引入新的杂志,阴离子可以选择OH﹣和Cl-,不能选NO3-,除杂过程中,试剂要加过量,Ba2+过量后是新的杂质,所以也要除去,恰好使用Na2CO3将其除去,因此要在Na2CO3之前加Ba2+;答案为ac前;(3)水得到电子,生成氢气,剩下了OH-,电极方程式2H2O+2e-=H2↑+2OH-,得电子的一极为阴极,与外电源的负极相连,阴极区pH变大;答案为负阴极区(4)电解饱和食盐水的反应方程式 ,根据方程式,生成2molNaOH 80g,生成1molCl2 71g,则 ,取两位小数,答案为1.13。
【分析】(1)离子方程式,即用实际参加反应的离子符号表示离子反应的式子。是指可溶性物质可拆的反应。多种离子能否大量共存于同一溶液中,归纳起来就是:一色,二性,三特殊,四反应;
(2)为了不引入新的杂质,应该选择氢氧化钡溶液出去硫酸根,但是氢氧化钡应该加在碳酸钠之前,因为碳酸钠也可以将过来的氢氧化钡除去;
(3)氢气是氢离子得电子生成的,因此产生氢气的一极是阴极;
(4)根据比率的定义以及电解方程式可以求出烧碱和氯气的质量比。
20.【答案】(1)Zn;CuSO4溶液或CuCl2溶液
(2)正极;Cu2+ + 2e- =Cu;Zn -2e- =Zn2+
(3)锌;铜
(4)锌;不
【解析】【解答】(1)由Zn(s)+Cu2+(aq)=Zn2+(aq)+Cu(s)反应可知,锌的化合价升高,被氧化,作负极,铜为正极,则电解质溶液为氯化铜或硫酸铜;(2)铜为正极,是溶液中的铜离子得到电子,电极反应为:Cu2++2e-=Cu,锌为负极,失去电子生成锌离子,电极反应为Zn-2e-=Zn2+;(3)原电池工作时,电子从负极经过导线流向正极,所以从Zn流向Cu;(4)原电池工作时,阴离子向负极移动,即向Zn极移动,若将盐桥撤掉,则不能形成闭合回路,电流计的指针不能偏转。
【分析】还原性的物质失去电子做负极,锌做负极发生氧化反应失去电子,形成带量锌离子吸引氯离子,Cu做正极,故Y为含有铜离子的电解质溶液,在正极聚集大量电子吸引铜离子放电,电子由锌电极流向铜电极,将盐桥撤掉,没有电子的移动不会偏转
21.【答案】(1)-285.8 kJ·mol-1;2H2(g)+ O2(g)= 2H2O(l)ΔH=-571.6kJ·mol-1
(2)-64.4kJ·mol-1
【解析】【解答】(1)①实验测得,1g氢气燃烧生成液态水放出142.9kJ热量,1mol氢气(即2g)完全反应生成液态水放热为285.5kJ,则氢气的燃烧热285.5kJ/mol;正确答案: 285.5kJ/mol。
②则表示氢气燃烧的热化学方程式为:H2(g)+ O2(g)=H2O(l)△H=-285.8kJ/mol或2H2(g)+ O2(g)= 2H2O(l) ΔH=-571.6kJ/mol;正确答案: H2(g)+ O2(g)=H2O(l)△H=-285.8KJ/mol或2H2(g)+ O2(g)= 2H2O(l) ΔH=-571.6kJ/mol;(2)①Mg(s)+H2(g)=MgH2(s)ΔH1=-74.5kJ·mol-1;②Mg2Ni(s)+2MgH2(s)=2Mg(s)+Mg2NiH4(s) ΔH3=+84.6kJ·mol-1, 由盖斯定律2×①+②得到Mg2Ni(s)+2H2(g)═Mg2NiH4(s) △H2=(-74.5kJ/mol)×2+(84.6kJ/mol)=-64.4kJ/mol,则△H2=-64.4kJ/mol;正确答案:-64.4kJ·mol-1 。
【分析】(1)①燃烧热1mol物质完全燃烧生成稳定的氧化物所放出的热量
(2)根据盖斯定律可求
一、单选题
1.下列过程发生放热反应的是( )
A.固体NaOH溶于乙醇中 B.固体NH4Cl与Ba(OH)2混合
C.浓H2SO4加人水中 D.生石灰加入水中
2.下列变化属于吸热的化学反应的是( )
A.碘的升华
B.生石灰溶于水
C.酸碱中和
D.Ba(OH)2 8H2O与NH4Cl晶体混合
3.已知反应X+Y=M+N为放热反应,对该反应的下列说法中正确的( )
A.X的能量一定低于M
B.Y的能量一定高于N
C.1molX和1molY的总能量一定高于1molM和1molN的总能量
D.因该反应为放热反应,故不必加热就可发生
4.某兴趣小组设计的水果电池装置如图所示。该电池工作时,下列说法正确的是 ( )
A.铜片作负极 B.锌片发生还原反应
C.将电能转化为化学能 D.电子由锌片经导线流向铜片
5.下列反应中既是氧化还原反应,能量变化情况又符合如图的是( )
A.氢氧化钠与稀盐酸的反应 B.碳和水蒸气的反应
C.和的反应 D.氢气的燃烧反应
6.属于氧化还原反应且反应过程中能量变化符合如图所示的是( )
A. B.
C. D.
7.下列变化中,属于吸热反应的是( )
A.过氧化钠和水的反应 B.干冰升华
C.盐酸和氢氧化钠的反应 D.灼热的木炭与CO2的反应
8.化学反应A2+B2 = 2AB的能量变化如图所示,则下列说法正确的是( )
A.该反应是吸热反应
B.断裂 1molA-A 键和 1molB-B 键能放出xkJ 的能量
C.2mol AB 的总能量高于1mol A2和1mol B2和的总能量
D.断裂 2mol A-B 键需要吸收ykJ 的能量
9.某实验小组模拟海水淡化的同时制备H2、Cl2和NaOH溶液,装置如图所示(两端为惰性电极,阳膜只允许阳离子通过,阴膜只允许阴离子通过)。下列有关说法错误的是( )
A.甲室产生的气体能使湿润的淀粉—KI试纸变蓝
B.膜①是阴离子交换膜
C.淡水的出口只有c
D.随着电解的进行,戊室溶液的pH不断增大
10.氮掺杂的碳材料可以有效催化燃料电池中的还原反应,其催化机理如图。
途径一:A→B→C→F
途径二:A→B→C→D→E
下列说法不正确的是( )
A.途径一中存在极性共价键的断裂与形成
B.途径一的电极反应是
C.途径二,1mol 得到4mol
D.氮掺杂的碳材料降低了反应的焓变
11.用铜片、银片设计成如图所示的原电池。以下有关该原电池的叙述正确的是( )
A.电子通过盐桥从乙池流向甲池
B.盐桥中的阳离子向甲池移动
C.开始时,银片上发生的反应是:
D.将铜片浸入 溶液中发生的化学反应与该原电池总反应相同
12.下列说法正确的是( )
A.25℃时,向含有AgCl固体的AgCl饱和溶液中加入少量稀盐酸,AgCl的溶解度增大
B.若 ; ,则
C.用pH计测得“84消毒液的pH为12.2
D.在的溶液中:、、、一定能大量共存
13.下列反应属于非氧化还原反应,且能量变化与图示相符合的是
A.镁与盐酸的反应
B.铁与氯气的化合
C.灼热的炭与的反应
D.晶体与晶体的反应
14.镍镉(Ni—Cd)可充电电池在现代生活中有广泛应用,它的充放电反应按下式进行:Cd+2NiO(OH)+2H2O Cd(OH)2+2Ni(OH)2;由此可知,该电池放电时的负极材料是( )
A.Cd B.Ni(OH)2 C.Cd(OH)2 D.NiO(OH)
15.氢氧燃料电池结构如图所示,其电池总反应是2H2 + O2=2H2O。下列有关该电池的叙述正确的是( )
A.该电池将电能转化为化学能
B.电极a的电极反应式为H2-2e-+2OH-=2H2O
C.电极b是电源的负极
D.工作时,OH-向电极b方向移动
16.采用(NH4)2SO4和 混合溶液作为电解液,平行放置的两块不锈钢板分别作为阴极和阳极,将废铅膏(主要成分为PbO2)平铺在阴极板上,可得到铅单质。这是一种成本较低的铅回收工艺,示意图如图下列说法错误的是( )
A.阴极板的电极反应为
B.电子由阳极板沿阳极导杆移向外接电源正极
C.电解过程中,OH-向阴极板迁移
D.标准状况下,外电路中每转移4mol电子,阳极板产生22.4LO2
二、综合题
17.如图中,甲是电解饱和食盐水,乙是铜的电解精炼,丙是电镀,回答:
(1)b极上的电极反应式为 ,甲电池的总反应化学方程式是 。
(2)在粗铜的电解过程中,图中c电极的材料是 (填“粗铜板”或“纯铜板”);在d电极上发生的电极反应为 ;若粗铜中还含有Au、Ag、Fe等杂质,则沉积在电解槽底部(阳极泥)的杂质是 ,电解一段时间后,电解液中的金属离子有 。
(3)如果要在铁制品上镀镍(二价金属),则e电极的材料是 (填“铁制品”或“镍块”,下同),f电极的材料是 。
(4)若e电极的质量变化118 g,则a电极上产生的气体在标准状况下的体积为 。
18.如下图所示装置,C、D、E、F、X、Y都是惰性电极,甲、乙中溶液的体积和浓度都相同(假设通电前后溶液体积不变),A、B为外接直流电源的两极。将直流电源接通后,E极附近溶液呈红色。请回答:
(1)B极是电源的 极。C电极上的电极反应式: 。
(2)若甲、乙装置中的C、D、E、F电极均只有一种单质生成时,对应单质的物质的量之比为 。
19.工业食盐中含Ca2+、Mg2+等杂质,某厂电解饱和食盐水制取NaOH溶液的工艺流程如图所示,回答下列问题:
(1)“精制”过程中发生反应的离子方程式为
(2)若粗盐中SO42﹣含量也较高,沉淀剂可以是 (填字母)且要在试剂Na2CO3之 加入(填“前”或“后”)。
a.Ba(OH)2
b.Ba(NO3)2
c.BaCl2
(3)在电解过程中,产生H2的电极与外接电源的 极相连;溶液pH增大的区域是 (填“阳极区”或“阴极区”)。
(4)烧碱和氯气是电解饱和食盐水时按照固定的比率k(质量比)生成的产品。理论上k= (填写计算表达式和结果且结果保留两位小数)。
20.依据氧化还原反应Zn(s)+Cu2+(aq)=Zn2+(aq)+Cu(s)设计的原电池如下图所示。
请回答下列问题:
(1)电极X的材料是 ;电解质溶液Y是 。
(2)铜电极为电池的 极,发生的电极反应为 X极上发生的电极反应为 。
(3)外电路中的电子是从 极流向 极(填名称)。
(4)盐桥中的Cl-向 极移动,如将盐桥撤掉,电流计的指针将 偏转。
21.氢气是一种理想的绿色能源。
(1)在101KP下,1g氢气完全燃烧生成液态水放出142.9kJ的热量,请回答下列问题:
①氢气的燃烧热为
②该反应的热化学方程式为
(2)氢能的存储是氢能利用的前提,科学家研究出一种储氢合金Mg2Ni,已知:Mg(s)+H2(g)=MgH2(s)ΔH1=-74.5kJ·mol-1,Mg2Ni(s)+2H2(g)=Mg2NiH4(s)ΔH2,Mg2Ni(s)+2MgH2(s)=2Mg(s)+Mg2NiH4(s) ΔH3=+84.6kJ·mol-1,则ΔH2= kJ·mol-1。
答案解析部分
1.【答案】D
【解析】【解答】A.固体NaOH不溶于乙醇中, 过程没有热量放出,不属于放热反应,A不符合题意;
B.固体NH4Cl和Ba(OH)2混合后,发生反应,同时吸收大量热,属于吸热反应,B不符合题意;
C.浓硫酸加入水中,放出大量热,但不是化学反应,故不属于放热反应,C不符合题意;
D.CaO与H2O反应生成Ca(OH)2,过程中放出大量热,属于放热反应,D符合题意;
故答案为:D
【分析】根据反应过程中的热效应分析,即可得出答案。
2.【答案】D
【解析】【解答】A.碘的升华属于物理变化,不是化学反应,故A不符合题意;
B.生石灰溶于水,与水反应生成氢氧化钙,为放热反应,故B不符合题意;
C.酸碱中和属于放热反应,故C不符合题意;
D.Ba(OH)2 8H2O与NH4Cl晶体混合,属于吸热反应,反应生成氯化钡和氨气,故D符合题意;
故答案为:D。
【分析】化学变化都伴随着能量的变化,有的化学变化吸热,有的则放热。
3.【答案】C
【解析】【解答】A.X的能量不一定低于M的能量,A不符合题意;
B.Y的能量不一定高于N的能量,B不符合题意;
C.由于该反应为放热反应,则1molX和1molY的总能量一定高于1molM和1molN的总能量,C符合题意;
D.该反应为放热反应,但与是否加热无关,某些放热反应也需要在加热条件下才能发生,D不符合题意;
故答案为:C
【分析】该反应为放热反应,则反应物的总能量高于生成物的总能量,据此结合选项分析。
4.【答案】D
【解析】【解答】A、锌作负极,铜为正极,选项A不符合题意;
B、锌作负极,负极上锌失电子发生氧化反应,选项B不符合题意;
C、该装置是原电池,将化学能转化为电能,选项C不符合题意;
D、电子从负极锌沿导线流向正极铜,选项D符合题意;
故答案为:D。
【分析】原电池的角度进行分析,活泼金属作为负极,负极质量减少,正极质量增加或者生产气体,电子由负极经过导线流向正极,电流由正极经过导线流向负极。
5.【答案】B
【解析】【解答】题中图像,反应物总能量低于生成物总能量,为吸热反应;
A.酸碱中和为放热反应;
B.碳,一氧化碳参与的还原反应都为吸热反应;
C.为吸热反应,但反应前后化合价未发生改变,所以不是氧化还原反应;
D.所有放入燃烧反应皆为放热反应。
故答案为:B.
【分析】化学反应前后化合价发生改变的为氧化还原反应,掌握常见的吸热放热反应。
A.酸碱中和反应为放热反应;
B.碳,一氧化碳参与的还原反应都为吸热反应;
C. 和 为典型的吸热反应;
D.所有放入燃烧反应都是放热反应。
6.【答案】C
【解析】【解答】A.反应为非氧化还原反应,故A不符合题意;
B.反应为放热反应,故B不符合题意;
C.反应为吸热的氧化还原反应,故C符合题意;
D.反应为非氧化还原反应,故D不符合题意;
故答案为:C。
【分析】化合价发生变化的反应为氧化还原反应,由图像可知此反应为吸热反应。
7.【答案】D
【解析】【解答】A. 过氧化钠和水的反应为放热反应,故A不符而;
B.干冰升华吸热,但是为物理过程,吸热反应为化学反应,故B不符合;
C. 盐酸和氢氧化钠的酸碱中和反应为放热反应,故C不符合;
D. 灼热的木炭与CO2的反应为吸热反应,故D符合;
故答案为:D。
【分析】A.过氧化钠和水反应放热;
B.干冰升华不是化学变化;
C.中和反应为放热反应。
8.【答案】D
【解析】【解答】A.由图可知,1molA2和1molB2的总能量高于2molAB的总能量,该反应是放热反应,故A不符合题意;
B.旧键的断裂需要吸收能量,而不是释放能量,故B不符合题意;
C.由图可知,1molA2和1molB2的总能量高于2molAB的总能量,故C不符合题意;
D.旧键的断裂吸收能量,由图可知断裂2molA-B键需要吸收ykJ能量,故D符合题意;
故答案为:D。
【分析】A.根据能量图中反应物和生成物能量的大小进行判断反应类型;
B.根据破坏化学键需要吸收能量进行判断;
C.根据能量图像中能量大小进行判断;
D.断裂化学需要吸收能量根据能量图中化学键的变化进行判断。
9.【答案】C
【解析】【解答】A.甲室为阳极室,电极反应式为 , 能使湿润的淀粉 试纸变蓝,A不符合题意;
B.反应过程中丙室中 通过膜②到丁室, 通过膜①到乙室;膜①是阴离子交换膜,膜②是阳离子交换膜,B不符合题意;
C.淡水的出口为a和c,C符合题意;
D.戊室的电极反应式为 ,随电解的进行,溶液的pH不断增大,D不符合题意。
故答案为:C。
【分析】该反应甲室连接电源正极为阳极室,戊室连接电源负极为阴极室;阳极电极反应式为 ,阴极电极反应式为 ;反应过程中丙室中 通过膜②到丁室,戊室中生成的OH-通过阴膜到达丁室, 通过膜①到乙室;膜①是阴离子交换膜,膜②是阳离子交换膜,淡水的出口为a和c,d中生成 NaOH ,以此分析。
10.【答案】D
【解析】【解答】A.由图中信息可知,途径一中有C-O键、O-H键的形成,也有C-O键的断裂,选项A不符合题意;
B.途径一的过程中有O2的参与和二次增加H+、e-,最后从催化剂中放出H2O2,其电极反应是,选项B不符合题意;
C.途径二中,有O2参与,途中二次增加H+、e-和一次增加2H+、2e-,故1mol 得到4mol ,选项C不符合题意;
D.氮掺杂的碳材料降低了反应的活化能,但不能改变焓变,选项D符合题意;
故答案为:D。
【分析】A.依据同种原子之间的共价键为非极性键;不同种原子之间的共价键为极性键;
B.途径一的过程中有O2的参与和二次增加H+、e-,最后从催化剂中放出H2O2;
C.注意途径二中电子转移的数目;
D.催化剂不能改变焓变。
11.【答案】D
【解析】【解答】A.电子不能通过电解质溶液,电解质溶液通过离子的定向移动形成电流,故A不符合题意;
B.盐桥中的阳离子向正极移动,银为正极,所以阳离子向乙池移动,故B不符合题意;
C.铜片是负极,银片是正极,在银片上发生的电极反应是 ,故C不符合题意;
D.该原电池的总反应为Cu+2Ag+=Cu2++2Ag,将铜片浸入AgNO3溶液中发生的化学反应也是Cu+2Ag+=Cu2++2Ag,故D符合题意;
故答案为:D。
【分析】 原电池中,较活泼的金属作负极,负极上金属失去电子发生氧化反应,较不活泼的金属作正极,正极上得电子发生还原反应,外电路上,电子从负极沿导线流向正极。
12.【答案】C
【解析】【解答】A.25℃时,向含有AgCl固体的AgCl饱和溶液中存在沉淀溶解平衡:,加入少量稀盐酸,氯离子浓度增大,平衡左移,AgCl的溶解度减小,A不符合题意;
B.硫呈气态时的能量比固态时要高,等量的硫蒸气充分燃烧放出的热量比固态硫燃烧放出的热量更高,焓变更小。若 ; ,则,B不符合题意;
C.pH计可用于准确测量溶液的pH,用pH计测得“84消毒液的pH为12.2,C符合题意;
D. 在的溶液中:铝离子和因双水解一定不能大量共存,D不符合题意;
故答案为:C。
【分析】A.温度不变,溶解度不变
B.根据固体到气体吸收能量
C.pH可以测定出pH可以是小数
D.碳酸根水解呈碱性,铝离子水解酸性可以双水解
13.【答案】D
【解析】【解答】A.镁与盐酸反应,发生了化合价的变化,是氧化还原反应,且为放热反应,不满足条件,故A项不符合题意;
B.铁与氯气的化合是氧化还原反应,且为放热反应,不满足条件,故B项不符合题意;
C.灼热的炭与CO2的反应是吸热反应,但发生了化合价的变化,是氧化还原反应,不满足条件,故C项不符合题意;
D.Ba(OH)2 8H2O晶体与NH4Cl晶体的反应是复分解反应,属于非氧化还原反应,且为吸热反应,满足条件,故D项符合题意;
故答案为:D。
【分析】AB.化合价发生变化,且为放热反应;
C.化合价发生变化,且为吸热反应;
D.化合价没有发生变化,且为吸热反应。
14.【答案】A
【解析】【解答】从总反应式Cd+2NiO(OH)+2H2O Cd(OH)2+2Ni(OH)2可以看出,放电时,Cd由0价升高到+2价,Ni由+3价降低到+2价,所以负极材料是Cd,
故答案为:A。
【分析】此题考查二次电池的判断,根据元素化合价的升降进行判断,根据化合价的升高判断得失电子,根据负极化合价升高失去电子可以判断。
15.【答案】B
【解析】【解答】A.该电池是将化学能转化为电能的装置,故A不符合题意;
B.电池工作时,通入氢气的a极为电池的负极,碱性条件下,氢气a极上失电子发生氧化反应生成水,电极反应式为H2-2e-+2OH-=2H2O,故B符合题意;
C.通入氧气的b极为电池的正极,氧气在b极上得电子发生还原反应,故C不符合题意;
D.电池工作时,阴离子向负极移动,则OH-向电极a方向移动,故D不符合题意。
故答案为:B。
【分析】A.燃料电池是将化学能转化为电能;
B.碱性环境中负极发生氧化反应生成水;
C.通入氧气的一极发生还原反应是正极;
D.原电池中阴离子向负极方向移动。
16.【答案】C
【解析】【解答】A.题干交待“将废铅膏(主要成分为PbO2)平铺在阴极板上,可得到铅单质”,则阴极板发生PbO2得电子生成Pb的反应,这也是电解回收铅的目的,电极反应为: ,故A不符合题意;
B.电子由阳极流入正极,再由负极流向阴极,故B不符合题意;
C.电解池中阴离子向阳极迁移,故C符合题意;
D.阳极发生反应 ,每转移4mol电子,阳极板产生1molO2,即22.4LO2(标准状况),故D不符合题意;
故答案为:C。
【分析】考查的是电解池的原理,阳极聚集大量的氢氧根离子和硫酸根离子,氢氧根失去电子,发生氧化反应,阴极聚集大量的铵根离子,二氧化铅得到电子,发生还原反应,得到铅单质。根据阴极的电极式即可计算出生成氧气的量
17.【答案】(1)2H++2e﹣=H2↑;2NaCl+2H2O 2NaOH+Cl2↑+H2↑
(2)粗铜板;Cu2++2e﹣=Cu;Au、Ag;Cu2+、Fe2+
(3)镍块;铁制品
(4)44.8L
【解析】【解答】(1)甲是电解饱和食盐水,M为正极,则a为阳极发生氧化反应,b为阴极发生还原反应,电极反应式为2H++2e-=H2↑,电解饱和食盐水生成氢气、氯气和氢氧化钠,总反应化学方程式为2NaCl+2H2O 2NaOH+Cl2↑+H2↑,故答案为:2H++2e-=H2↑;2NaCl+2H2O 2NaOH+Cl2↑+H2↑;
(2)用电解法进行粗铜提纯时,粗铜应作阳极,精铜作阴极,该装置中M为原电池的正极,N为原电池的负极,所以c为电解池的阳极,d为电解池的阴极,电解时,以硫酸铜溶液为电解液,溶液中的Cu2+得到电子在阴极上发生还原反应,即Cu2++2e-=Cu;作阳极的粗铜中的铜以及比铜活泼的金属失去电子进入溶液,所以Fe发生Fe-2e-═Fe2+反应,以Fe2+的形式进入溶液中;比铜不活泼的金属Au、Ag不会失去电子,以单质的形成沉入电解槽形成“阳极泥”,则沉积在电解槽底部(阳极泥)的杂质是Au、Ag,电解一段时间后,电解液中的金属离子有Cu2+、Fe2+ , 故答案为:粗铜板;Cu2++2e-=Cu;Au、Ag;Cu2+、Fe2+;
(3)要在铁制品上镀镍(二价金属),则铁作阴极与电源负极N相连即f极,镍为阳极与电源正极M相连即e极,故答案为:镍块;铁制品
(4)若e电极的质量变化118g,根据转移电子数相等,Ni~2e-~Cl2 , 则a电极上产生的气体在标准状况下的体积为 ×22.4L/mol=44.8L,故答案为:44.8L。
【分析】(1)依据电解饱和食盐水中M为正极,则a为阳极发生氧化反应,b为阴极发生还原反应分析;
(2)依据用电解法进行粗铜提纯时,粗铜应作阳极,精铜作阴极分析;
(3)依据电镀的相关知识分析;
(4)依据电子的转移数目相等分析解答。
18.【答案】(1)正;Cu2++2e-=Cu
(2)2:1:2:2
【解析】【解答】将直流电源接通后,E极附近呈红色,说明E极显碱性,H+在该电极放电,所以E极是阴极,可得出D、F、H、Y均为阳极,C、G、X均为阴极,A是电源的负极,B是正极;(1)B电极是电源的正极,C电极与负极相连为阴极,在阴极C电极上Cu2+得到电子,发生还原反应,电极反应式为:Cu2++2e-=Cu;(2)C、D、E、F电极发生的电极反应分别为:Cu2++2e-=Cu、4OH- -4e-=O2↑+2H2O;2H++2e-=H2↑、2Cl--2e-=Cl2↑,当各电极转移电子均为1 mol时,生成单质的量分别为:0.5 mol、0.25 mol、0.5 mol、0.5 mol,所以单质的物质的量之比为2:1: 2:2。
【分析】(1)将直流电源接通后,E极附近呈红色,可知E极上H+在该电极放电,所以E电极是阴极,并得到其他各个电极的名称,阳极上阴离子放电;(2)C、D、E、F电极转移的电子数目相等,根据转移电子数可计算生成的单质的量。
19.【答案】(1)Ca2++CO32﹣═CaCO3↓、Mg2++2OH﹣═Mg(OH)2↓
(2)ac;前
(3)负;阴极区
(4)1.13
【解析】【解答】(1)“精制”过程中加入NaOH和Na2CO3,为了除去溶液中的Ca2+和Mg2+, Ca2+以碳酸钙的形式除去,Mg2+以Mg(OH)2的形式除去,根据电荷守恒可以写出方程式,答案为Ca2++CO32﹣═CaCO3↓、Mg2++2OH﹣═Mg(OH)2↓;(2)SO42﹣可以用Ba2+除去,但是不能引入新的杂志,阴离子可以选择OH﹣和Cl-,不能选NO3-,除杂过程中,试剂要加过量,Ba2+过量后是新的杂质,所以也要除去,恰好使用Na2CO3将其除去,因此要在Na2CO3之前加Ba2+;答案为ac前;(3)水得到电子,生成氢气,剩下了OH-,电极方程式2H2O+2e-=H2↑+2OH-,得电子的一极为阴极,与外电源的负极相连,阴极区pH变大;答案为负阴极区(4)电解饱和食盐水的反应方程式 ,根据方程式,生成2molNaOH 80g,生成1molCl2 71g,则 ,取两位小数,答案为1.13。
【分析】(1)离子方程式,即用实际参加反应的离子符号表示离子反应的式子。是指可溶性物质可拆的反应。多种离子能否大量共存于同一溶液中,归纳起来就是:一色,二性,三特殊,四反应;
(2)为了不引入新的杂质,应该选择氢氧化钡溶液出去硫酸根,但是氢氧化钡应该加在碳酸钠之前,因为碳酸钠也可以将过来的氢氧化钡除去;
(3)氢气是氢离子得电子生成的,因此产生氢气的一极是阴极;
(4)根据比率的定义以及电解方程式可以求出烧碱和氯气的质量比。
20.【答案】(1)Zn;CuSO4溶液或CuCl2溶液
(2)正极;Cu2+ + 2e- =Cu;Zn -2e- =Zn2+
(3)锌;铜
(4)锌;不
【解析】【解答】(1)由Zn(s)+Cu2+(aq)=Zn2+(aq)+Cu(s)反应可知,锌的化合价升高,被氧化,作负极,铜为正极,则电解质溶液为氯化铜或硫酸铜;(2)铜为正极,是溶液中的铜离子得到电子,电极反应为:Cu2++2e-=Cu,锌为负极,失去电子生成锌离子,电极反应为Zn-2e-=Zn2+;(3)原电池工作时,电子从负极经过导线流向正极,所以从Zn流向Cu;(4)原电池工作时,阴离子向负极移动,即向Zn极移动,若将盐桥撤掉,则不能形成闭合回路,电流计的指针不能偏转。
【分析】还原性的物质失去电子做负极,锌做负极发生氧化反应失去电子,形成带量锌离子吸引氯离子,Cu做正极,故Y为含有铜离子的电解质溶液,在正极聚集大量电子吸引铜离子放电,电子由锌电极流向铜电极,将盐桥撤掉,没有电子的移动不会偏转
21.【答案】(1)-285.8 kJ·mol-1;2H2(g)+ O2(g)= 2H2O(l)ΔH=-571.6kJ·mol-1
(2)-64.4kJ·mol-1
【解析】【解答】(1)①实验测得,1g氢气燃烧生成液态水放出142.9kJ热量,1mol氢气(即2g)完全反应生成液态水放热为285.5kJ,则氢气的燃烧热285.5kJ/mol;正确答案: 285.5kJ/mol。
②则表示氢气燃烧的热化学方程式为:H2(g)+ O2(g)=H2O(l)△H=-285.8kJ/mol或2H2(g)+ O2(g)= 2H2O(l) ΔH=-571.6kJ/mol;正确答案: H2(g)+ O2(g)=H2O(l)△H=-285.8KJ/mol或2H2(g)+ O2(g)= 2H2O(l) ΔH=-571.6kJ/mol;(2)①Mg(s)+H2(g)=MgH2(s)ΔH1=-74.5kJ·mol-1;②Mg2Ni(s)+2MgH2(s)=2Mg(s)+Mg2NiH4(s) ΔH3=+84.6kJ·mol-1, 由盖斯定律2×①+②得到Mg2Ni(s)+2H2(g)═Mg2NiH4(s) △H2=(-74.5kJ/mol)×2+(84.6kJ/mol)=-64.4kJ/mol,则△H2=-64.4kJ/mol;正确答案:-64.4kJ·mol-1 。
【分析】(1)①燃烧热1mol物质完全燃烧生成稳定的氧化物所放出的热量
(2)根据盖斯定律可求
