【全国百强校】江西省临川区第二中学2014-2015学年高中化学同步课件:选修5 第三章 第三节 羧酸 酯——乙酸(一)[新课](共28张PPT)
文档属性
| 名称 | 【全国百强校】江西省临川区第二中学2014-2015学年高中化学同步课件:选修5 第三章 第三节 羧酸 酯——乙酸(一)[新课](共28张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 1.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2015-05-13 00:00:00 | ||
图片预览







文档简介
课件28张PPT。1.知识与技能
(1)掌握乙酸的分子组成的结构,了解乙酸的物理性质。
(2)掌握乙酸的酸性和酯化反应
(3)理解酯化反应的概念及实质
2.过程与方法
(1)采用复习回忆法及实验验证法学习乙酸的酸性,培养学生的归纳思维能力
(2)利用实验探究、设疑、启发、诱导、讲述等方法学习乙酸的酯化反应,培养学生观察实验能力和分析思维能力
3.情感态度与价值观
(1)学习兴趣的培养,化学美育的教育
(2)探索问题,创新意识的培养
(3)“本质决定现象”,“由个别到一般”的辩证唯物主义思维方法的训练。
教学重点:乙酸的酸性、酯化反应
教学难点:酯化反应的概念、特点及本质三维目标 民间有句传说“杜康造酒儿造醋”,杜康是酒的创始人,他儿子黑塔跟父亲也学会了酿酒技术。后来,黑塔率族从山西迁到现江苏省镇江。黑塔觉得酿酒后把酒糟(zāo) 扔掉可惜,他就把酒糟浸泡在水缸里。到了第二十一日的酉(yǒu)时,一开缸,一股浓郁的香气扑鼻而来。黑塔忍不住尝了一口,酸酸的,味道很美。烧菜时放了一些,味道特别鲜美,便贮藏着作为“调味酱”。这种调味酱叫什么名字呢?黑塔把“二十一日”加“酉”字来命名这种酸水。据说,直到今天,镇江恒顺酱醋厂酿制的一批醋的期限还是二十一天。一日酉廿含量
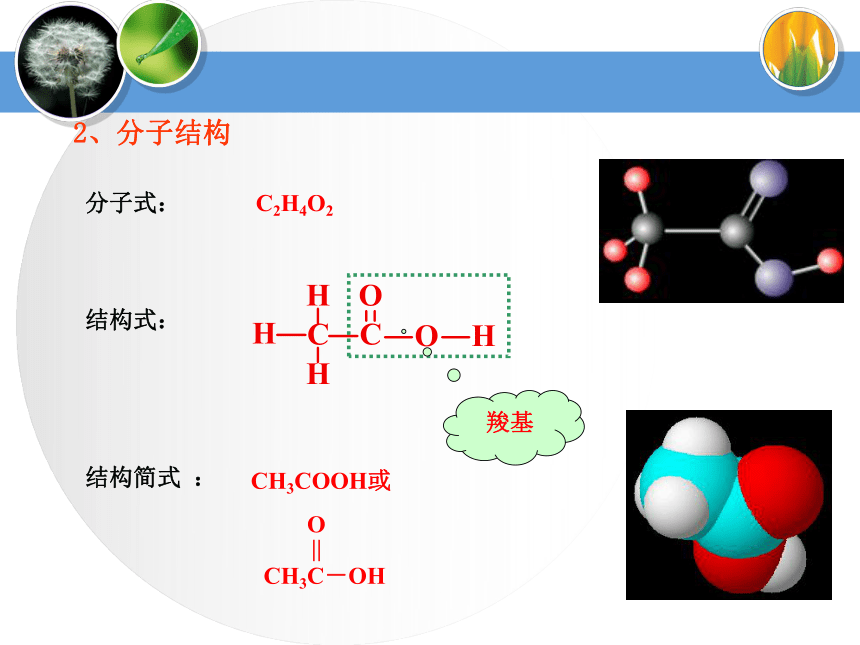
3%-5%乙酸1、乙酸的物理性质颜色、状态:无色液体气味:有强烈刺激性气味挥发性:易挥发(沸点: 117.9℃ )熔点:低(16.6℃)(低于式变成冰状晶体,无水乙酸又称为冰醋酸)溶解性:易溶于水[思考]如何分离乙酸和乙醇?2、分子结构分子式: C2H4O2结构式:结构简式 :CH3COOH或羧基 O
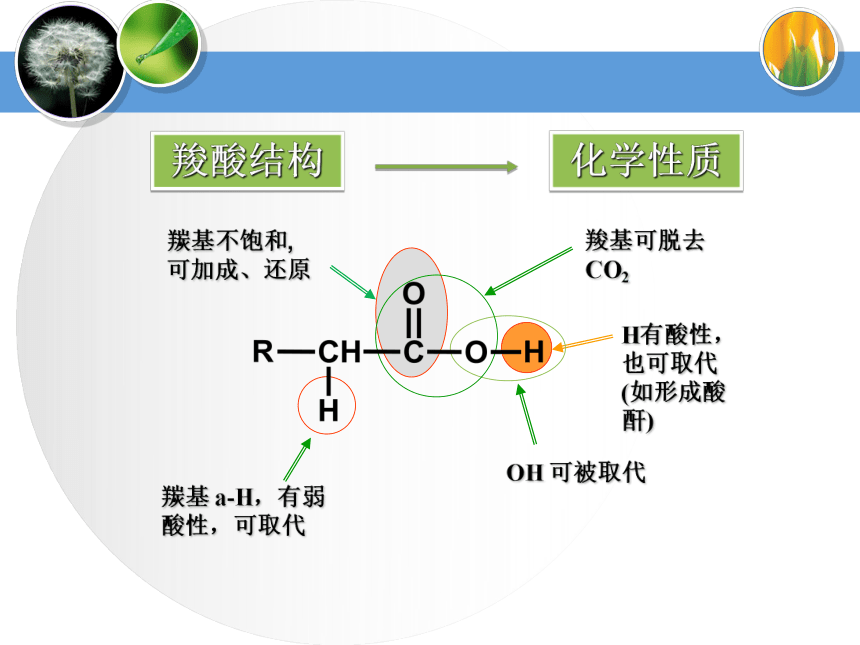
||
CH3C-OH羧酸结构H有酸性,也可取代(如形成酸酐)羰基不饱和,
可加成、还原化学性质药品:镁条、Na2CO3、乙酸
溶液、酚酞、NaOH溶液、石蕊试液。利用下列药品设计实验方案证明乙酸的确有酸性。 可行方案现象反应方程式试液变红镁条溶解产
生无色气体产生无色气体乙酸溶液
加入镁条乙酸具有酸性CH3COOH + NaOH →(CH3COO)2Mg +H2 ↑2CH3COOH + Na2CO3 →
2CH3COONa +H2O+CO2↑乙酸溶液
中加石蕊Na2CO3粉末中
加入乙酸溶液CH3COOH + NaOH →
CH3COONa+H2O往加入酚酞的NaOH
溶液中滴加乙酸溶液红色溶液
逐渐变浅测pH值结论:问题探究:乙酸为什么具有酸性? O
||
CH3—C—O—H显酸性断键取代结论:活泼性-COOH中-OH 醇中-OH3、化学性质(1)、弱酸性,具有酸的通性。酸性:CH3COOH>H2CO3CH3COOHCH3COO- + H+①使紫色石蕊试液变____色红(CH3COO)2 Zn + H2↑(CH3COO) 2 Cu + H2O(CH3COO)2 Cu + H2O(CH3COO)2 Ca + H2O + CO2↑CH3COOHNa2CO3苯酚钠溶液对比分析CH3COOH苯酚钠溶液饱和NaHCO3Na2CO3比较装置的优缺点、并写出反应的化学方程式。结论:
酸性:CH3COOH>H2CO3>C6H5OH>HCO3-乙酸乙挥发,挥发出来的乙酸也可使苯酚钠转化为苯酚而使溶液浑浊。1、今有化合物A,如下图所示,可溶于水,为了证明该有机物的结构和性质,你认为:
(1)应先检验_______(填名称),所选试剂是
_________________________________________;
(2)接着检验_______(填名称),所选试剂是
_________________________________________;
(3)然后检验_______(填名称),所选试剂是
_________________________________________;
(4)最后检验____________(填名称),所选试剂是
_________________________________________;
羧基 NaHCO3或紫色石蕊 酚羟基 FeCl3溶液 醛基 银氨溶液 碳碳双键溴水说明(1)羧基,酚羟基一定得在醛基前面检验(醛基需在碱性条件下发生银镜反应),两者顺序可以调换;
(2)若用溴的CCl4溶液,碳碳双键的检验可在任意一个位置醇、酚、羧酸中羟基的比较比碳酸弱比碳酸强能能能能能不能不能不能能,不
产生CO2不能能能增 强中性 烧鱼时常加醋并加点酒,这样鱼的味道就变得无腥、香醇。我国是一个酒的国度,五粮液享誉海内外,国酒茅台香飘万里。“酒是越陈越香”。你们知道是什么原因吗??几种物质的物理性质(1)实验步骤:
①向一支试管中加入几粒碎瓷片,然后加入3mL纯乙醇
②边振荡试管边慢慢加入2mL浓硫酸和2mL纯乙酸。按下图所示连接好装置,用酒精灯缓慢加热,将产生的蒸汽经长导管通入饱和Na2CO3溶液的液面上,观察实验现象。
(2)实验现象:
饱和Na2CO3溶液的液面上
有透明的油状液体产生,
并可闻到香味。实验原理实验装置反应条件除杂方法安全措施实验现象浓H2SO4,加热
浓H2SO4作用:催化剂、吸水剂
加热:减少生成物的浓度,平衡向右移动①加沸石:防暴沸
②试剂先后顺序:乙醇 → 浓硫酸 → 乙酸
③导管不能深入溶液中:防倒吸
④缓慢加热:防止反应物挥发严重,及发生副反应饱和Na2CO3溶液:
① 中和乙酸,消除乙酸气味的气味.
② 溶解挥发出来的乙醇。
③ 冷凝酯蒸气、减小酯在水中的溶解度,有利于分层液面上方有无色油状液体产生,并有香味1818同位素示踪法酯化反应实质:酸脱羟基醇脱羟基上的氢原子。有机羧酸和无机含氧酸(如 H2SO4、HNO3等)、苯酚[思考] : 1、写出乙醇、乙二醇、丙三醇与HNO3发生酯化反应的方程式二硝酸乙二酯三硝酸丙三酯(硝化甘油)烈性炸药[思考] : 1、若乙酸分子中的氧都是18O,乙醇分子中的氧都是16O,二者在浓H2SO4作用下发生反应,一段时间后,分子中含有18O的物质有( )生成物中水的相对分子质量为 。
A. 1种 B.2种 C.3 种 D.4种C20(3)乙酸乙酯①物理性质:
无色透明的油状有香味的液体,密度比水小,不溶于水,易溶有机溶剂,可作溶剂。②化学性质:水解反应(1)酯为什么在中性条件下难水解,而在酸、碱性条件下易水解?
酯的水解反应在酸性条件好,还是碱性条件好?
(2)酯化反应稀H2SO4和NaOH溶液哪种作催化剂好?为什么?(用浓H2SO4 ? )
设计实验,探讨乙酸乙酯在中性、酸性和碱性溶中,以及不同温度下的水解速率。 无变化无明显变化层厚
减小
较慢层厚
减小
较快完全
消失
较快完全
消失
快1、酯在碱性条件下水解速率最快,其次是酸性条件,中性条件下几乎不水解; 在强碱的溶液中酯水解趋于完全。2、温度越高,酯水解程度越大。(水解反应是吸热反应)科学探究(化学平衡移动)取代反应酯 + 水酸 + 醇酯 + 水酸 + 醇②碱性条件下水解是不可逆的看成先与H2O反应,然后看是否继续反应①酸性条件下水解是可逆的酯水解的规律:酯化反应与水解反应联系:形成的是哪个键,断裂的是哪个键思考:酸性条件下,乙酸乙酯在D2O中水解,则含有D元素以哪些形式存在?3、化学性质(3)、α—H被取代的反应可以合成卤代酸,进而制得氨基酸、羟基酸(4)、还原反应有机合成中可用此反应实现羧酸向醇的转化(5)、脱羧反应有机合成中可用此反应减少一个碳原子举例:
甲烷的制备
苯的制备
乙酸变为甲酸?(6)、形成酸酐4、乙酸的制法(1)、发酵法:制食用醋(2)、乙烯氧化法:5、乙酸的用途 重要化工原料,生产醋酸纤维、合成纤维、喷漆溶剂、香料、染料、医药、农药等。催化剂催化剂小 结一.乙酸的物理性质
二.乙酸的分子结构
结构简式: 官能团:
三.乙酸的化学性质
1.乙酸的酸性
乙酸是一种一元弱酸,其酸性大于碳酸
2.乙酸的酯化反应 CH3COOH—COOH(羧基)酸和醇作用生成酯和水的反应
浓硫酸、加热
酸脱羟基醇脱氢概念
条件
规律
(1)掌握乙酸的分子组成的结构,了解乙酸的物理性质。
(2)掌握乙酸的酸性和酯化反应
(3)理解酯化反应的概念及实质
2.过程与方法
(1)采用复习回忆法及实验验证法学习乙酸的酸性,培养学生的归纳思维能力
(2)利用实验探究、设疑、启发、诱导、讲述等方法学习乙酸的酯化反应,培养学生观察实验能力和分析思维能力
3.情感态度与价值观
(1)学习兴趣的培养,化学美育的教育
(2)探索问题,创新意识的培养
(3)“本质决定现象”,“由个别到一般”的辩证唯物主义思维方法的训练。
教学重点:乙酸的酸性、酯化反应
教学难点:酯化反应的概念、特点及本质三维目标 民间有句传说“杜康造酒儿造醋”,杜康是酒的创始人,他儿子黑塔跟父亲也学会了酿酒技术。后来,黑塔率族从山西迁到现江苏省镇江。黑塔觉得酿酒后把酒糟(zāo) 扔掉可惜,他就把酒糟浸泡在水缸里。到了第二十一日的酉(yǒu)时,一开缸,一股浓郁的香气扑鼻而来。黑塔忍不住尝了一口,酸酸的,味道很美。烧菜时放了一些,味道特别鲜美,便贮藏着作为“调味酱”。这种调味酱叫什么名字呢?黑塔把“二十一日”加“酉”字来命名这种酸水。据说,直到今天,镇江恒顺酱醋厂酿制的一批醋的期限还是二十一天。一日酉廿含量
3%-5%乙酸1、乙酸的物理性质颜色、状态:无色液体气味:有强烈刺激性气味挥发性:易挥发(沸点: 117.9℃ )熔点:低(16.6℃)(低于式变成冰状晶体,无水乙酸又称为冰醋酸)溶解性:易溶于水[思考]如何分离乙酸和乙醇?2、分子结构分子式: C2H4O2结构式:结构简式 :CH3COOH或羧基 O
||
CH3C-OH羧酸结构H有酸性,也可取代(如形成酸酐)羰基不饱和,
可加成、还原化学性质药品:镁条、Na2CO3、乙酸
溶液、酚酞、NaOH溶液、石蕊试液。利用下列药品设计实验方案证明乙酸的确有酸性。 可行方案现象反应方程式试液变红镁条溶解产
生无色气体产生无色气体乙酸溶液
加入镁条乙酸具有酸性CH3COOH + NaOH →(CH3COO)2Mg +H2 ↑2CH3COOH + Na2CO3 →
2CH3COONa +H2O+CO2↑乙酸溶液
中加石蕊Na2CO3粉末中
加入乙酸溶液CH3COOH + NaOH →
CH3COONa+H2O往加入酚酞的NaOH
溶液中滴加乙酸溶液红色溶液
逐渐变浅测pH值结论:问题探究:乙酸为什么具有酸性? O
||
CH3—C—O—H显酸性断键取代结论:活泼性-COOH中-OH 醇中-OH3、化学性质(1)、弱酸性,具有酸的通性。酸性:CH3COOH>H2CO3CH3COOHCH3COO- + H+①使紫色石蕊试液变____色红(CH3COO)2 Zn + H2↑(CH3COO) 2 Cu + H2O(CH3COO)2 Cu + H2O(CH3COO)2 Ca + H2O + CO2↑CH3COOHNa2CO3苯酚钠溶液对比分析CH3COOH苯酚钠溶液饱和NaHCO3Na2CO3比较装置的优缺点、并写出反应的化学方程式。结论:
酸性:CH3COOH>H2CO3>C6H5OH>HCO3-乙酸乙挥发,挥发出来的乙酸也可使苯酚钠转化为苯酚而使溶液浑浊。1、今有化合物A,如下图所示,可溶于水,为了证明该有机物的结构和性质,你认为:
(1)应先检验_______(填名称),所选试剂是
_________________________________________;
(2)接着检验_______(填名称),所选试剂是
_________________________________________;
(3)然后检验_______(填名称),所选试剂是
_________________________________________;
(4)最后检验____________(填名称),所选试剂是
_________________________________________;
羧基 NaHCO3或紫色石蕊 酚羟基 FeCl3溶液 醛基 银氨溶液 碳碳双键溴水说明(1)羧基,酚羟基一定得在醛基前面检验(醛基需在碱性条件下发生银镜反应),两者顺序可以调换;
(2)若用溴的CCl4溶液,碳碳双键的检验可在任意一个位置醇、酚、羧酸中羟基的比较比碳酸弱比碳酸强能能能能能不能不能不能能,不
产生CO2不能能能增 强中性 烧鱼时常加醋并加点酒,这样鱼的味道就变得无腥、香醇。我国是一个酒的国度,五粮液享誉海内外,国酒茅台香飘万里。“酒是越陈越香”。你们知道是什么原因吗??几种物质的物理性质(1)实验步骤:
①向一支试管中加入几粒碎瓷片,然后加入3mL纯乙醇
②边振荡试管边慢慢加入2mL浓硫酸和2mL纯乙酸。按下图所示连接好装置,用酒精灯缓慢加热,将产生的蒸汽经长导管通入饱和Na2CO3溶液的液面上,观察实验现象。
(2)实验现象:
饱和Na2CO3溶液的液面上
有透明的油状液体产生,
并可闻到香味。实验原理实验装置反应条件除杂方法安全措施实验现象浓H2SO4,加热
浓H2SO4作用:催化剂、吸水剂
加热:减少生成物的浓度,平衡向右移动①加沸石:防暴沸
②试剂先后顺序:乙醇 → 浓硫酸 → 乙酸
③导管不能深入溶液中:防倒吸
④缓慢加热:防止反应物挥发严重,及发生副反应饱和Na2CO3溶液:
① 中和乙酸,消除乙酸气味的气味.
② 溶解挥发出来的乙醇。
③ 冷凝酯蒸气、减小酯在水中的溶解度,有利于分层液面上方有无色油状液体产生,并有香味1818同位素示踪法酯化反应实质:酸脱羟基醇脱羟基上的氢原子。有机羧酸和无机含氧酸(如 H2SO4、HNO3等)、苯酚[思考] : 1、写出乙醇、乙二醇、丙三醇与HNO3发生酯化反应的方程式二硝酸乙二酯三硝酸丙三酯(硝化甘油)烈性炸药[思考] : 1、若乙酸分子中的氧都是18O,乙醇分子中的氧都是16O,二者在浓H2SO4作用下发生反应,一段时间后,分子中含有18O的物质有( )生成物中水的相对分子质量为 。
A. 1种 B.2种 C.3 种 D.4种C20(3)乙酸乙酯①物理性质:
无色透明的油状有香味的液体,密度比水小,不溶于水,易溶有机溶剂,可作溶剂。②化学性质:水解反应(1)酯为什么在中性条件下难水解,而在酸、碱性条件下易水解?
酯的水解反应在酸性条件好,还是碱性条件好?
(2)酯化反应稀H2SO4和NaOH溶液哪种作催化剂好?为什么?(用浓H2SO4 ? )
设计实验,探讨乙酸乙酯在中性、酸性和碱性溶中,以及不同温度下的水解速率。 无变化无明显变化层厚
减小
较慢层厚
减小
较快完全
消失
较快完全
消失
快1、酯在碱性条件下水解速率最快,其次是酸性条件,中性条件下几乎不水解; 在强碱的溶液中酯水解趋于完全。2、温度越高,酯水解程度越大。(水解反应是吸热反应)科学探究(化学平衡移动)取代反应酯 + 水酸 + 醇酯 + 水酸 + 醇②碱性条件下水解是不可逆的看成先与H2O反应,然后看是否继续反应①酸性条件下水解是可逆的酯水解的规律:酯化反应与水解反应联系:形成的是哪个键,断裂的是哪个键思考:酸性条件下,乙酸乙酯在D2O中水解,则含有D元素以哪些形式存在?3、化学性质(3)、α—H被取代的反应可以合成卤代酸,进而制得氨基酸、羟基酸(4)、还原反应有机合成中可用此反应实现羧酸向醇的转化(5)、脱羧反应有机合成中可用此反应减少一个碳原子举例:
甲烷的制备
苯的制备
乙酸变为甲酸?(6)、形成酸酐4、乙酸的制法(1)、发酵法:制食用醋(2)、乙烯氧化法:5、乙酸的用途 重要化工原料,生产醋酸纤维、合成纤维、喷漆溶剂、香料、染料、医药、农药等。催化剂催化剂小 结一.乙酸的物理性质
二.乙酸的分子结构
结构简式: 官能团:
三.乙酸的化学性质
1.乙酸的酸性
乙酸是一种一元弱酸,其酸性大于碳酸
2.乙酸的酯化反应 CH3COOH—COOH(羧基)酸和醇作用生成酯和水的反应
浓硫酸、加热
酸脱羟基醇脱氢概念
条件
规律
