【全国百强校】江西省临川区第二中学2014-2015学年高中化学同步课件:选修5 第三章 第一节 醇 酚——醇类(二)[新课](共37张PPT)
文档属性
| 名称 | 【全国百强校】江西省临川区第二中学2014-2015学年高中化学同步课件:选修5 第三章 第一节 醇 酚——醇类(二)[新课](共37张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 1.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2015-05-13 00:00:00 | ||
图片预览




文档简介
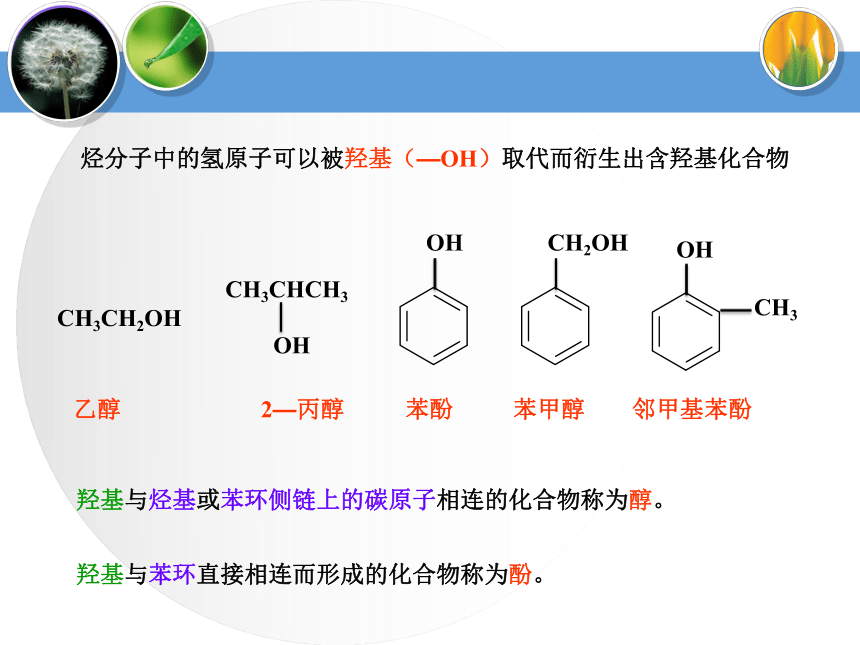
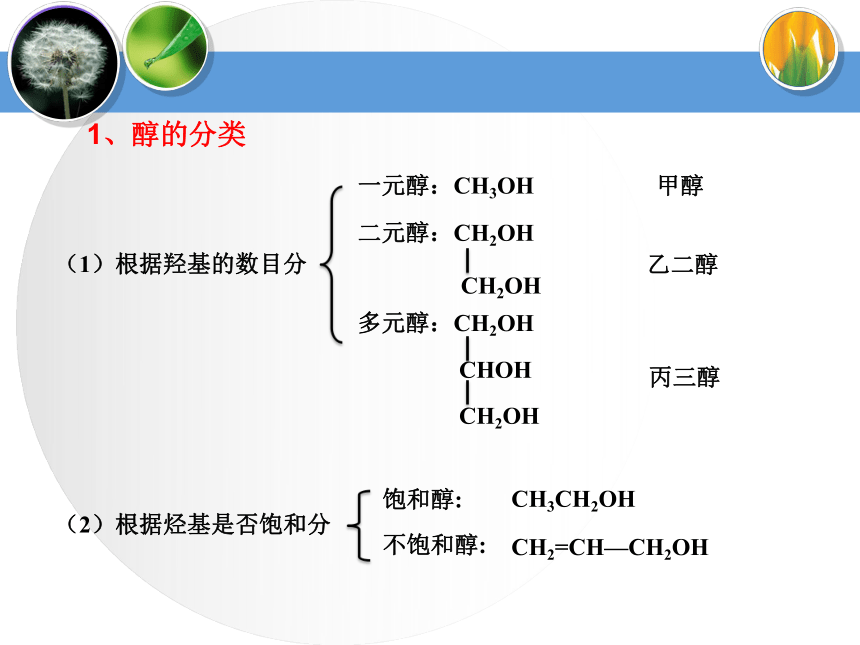
课件37张PPT。醇类烃分子中的氢原子可以被羟基(—OH)取代而衍生出含羟基化合物羟基与烃基或苯环侧链上的碳原子相连的化合物称为醇。CH3CH2OH乙醇2—丙醇苯酚邻甲基苯酚羟基与苯环直接相连而形成的化合物称为酚。苯甲醇1、醇的分类(1)根据羟基的数目分一元醇:CH3OH甲醇(2)根据烃基是否饱和分饱和醇:
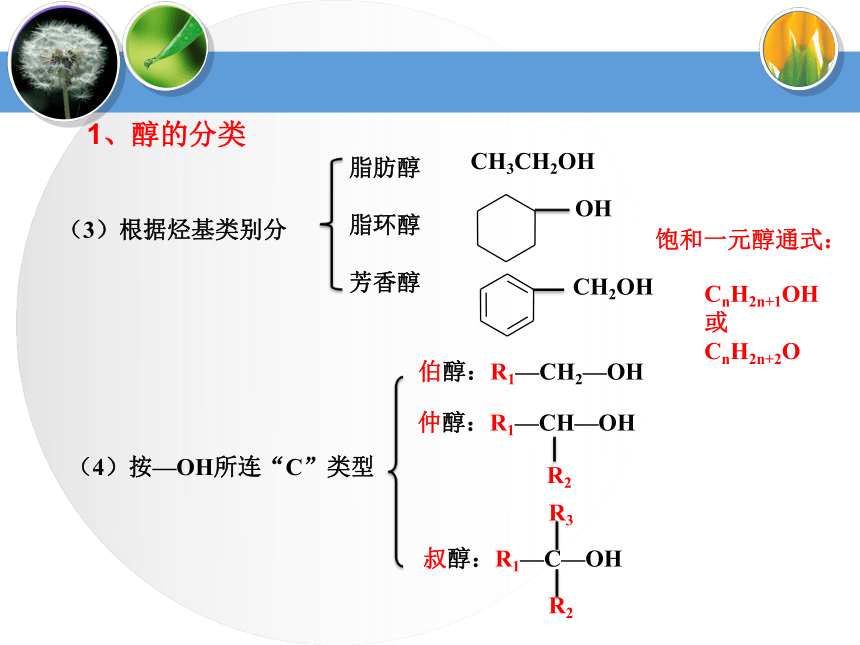
不饱和醇:CH2=CH—CH2OHCH3CH2OH(3)根据烃基类别分脂肪醇
脂环醇
芳香醇饱和一元醇通式:CnH2n+1OH
或
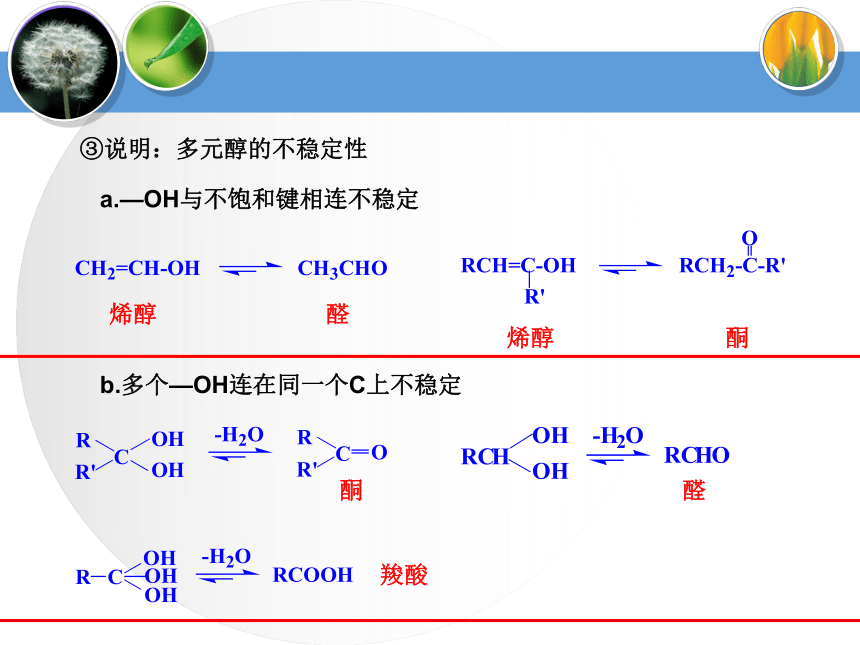
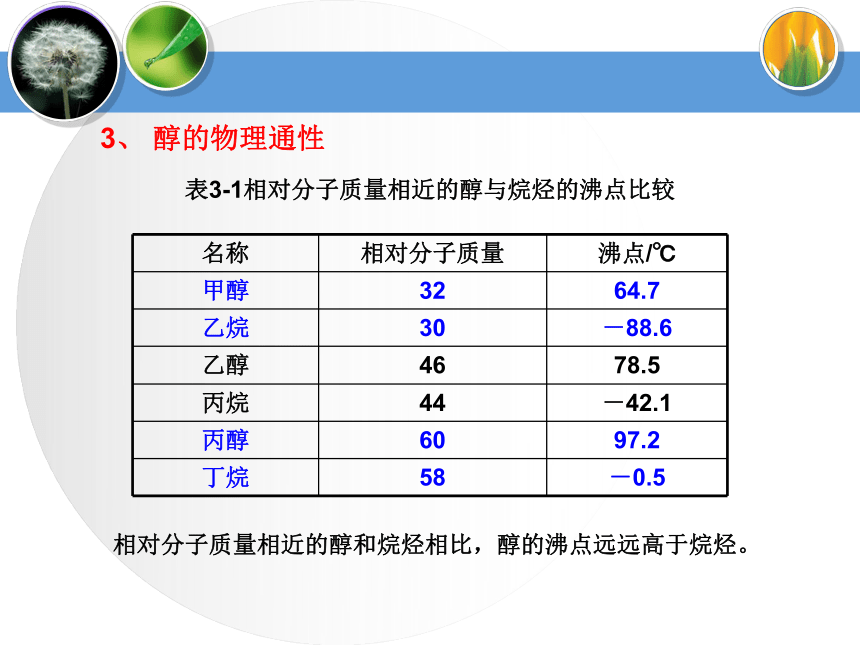
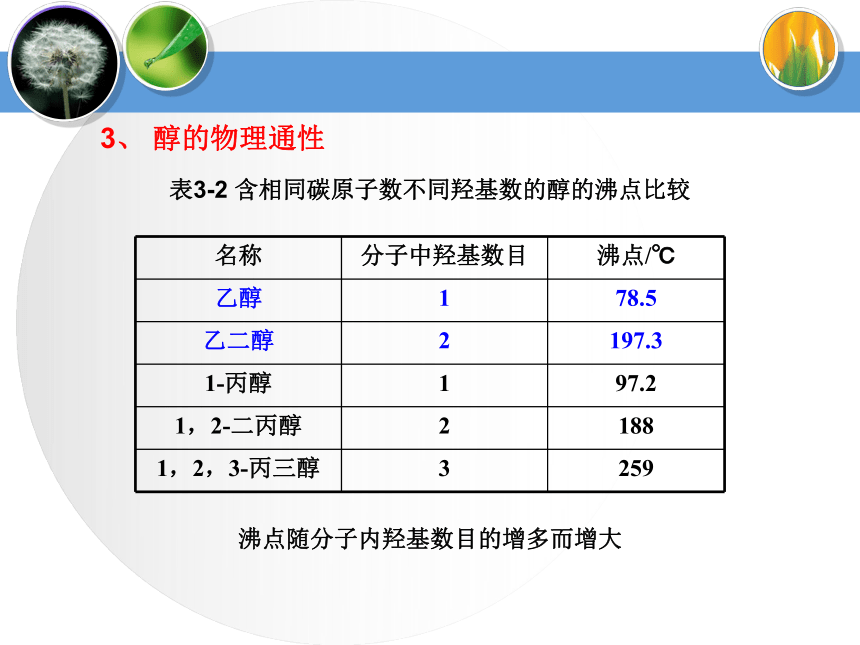
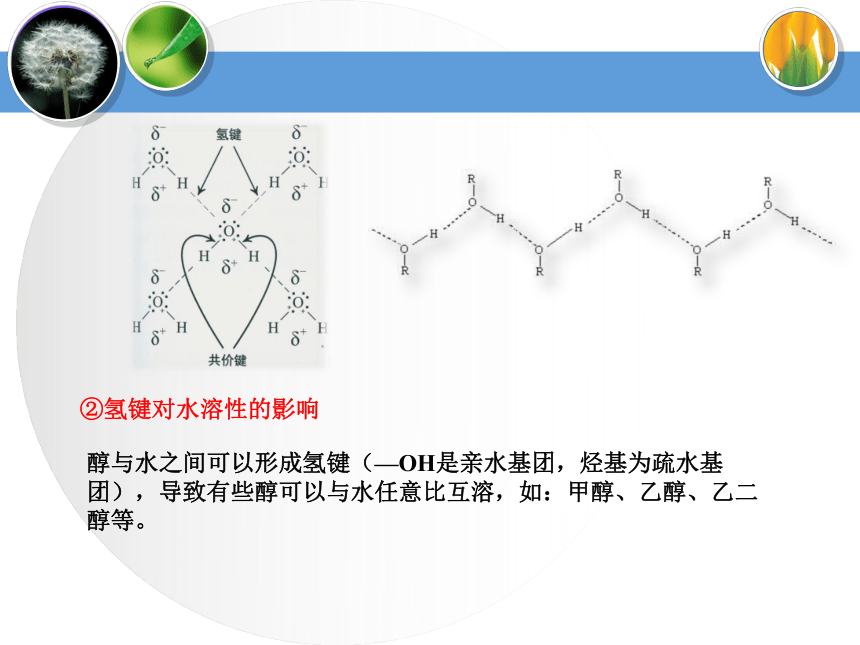
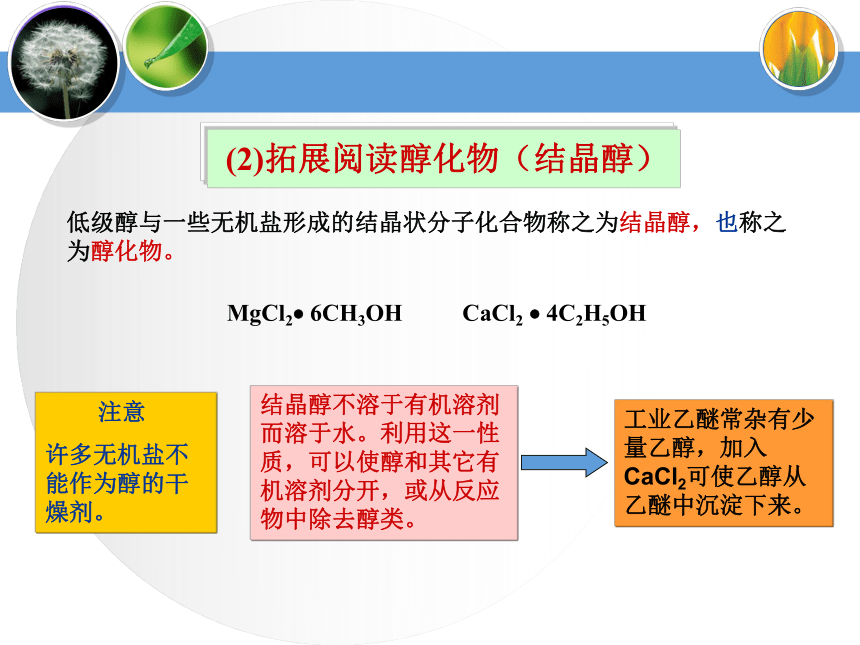
CnH2n+2OCH3CH2OH1、醇的分类(4)按—OH所连“C”类型伯醇:R1—CH2—OH烯醇烯醇酮醛羧酸醛酮a.—OH与不饱和键相连不稳定b.多个—OH连在同一个C上不稳定③说明:多元醇的不稳定性蒸馏蒸馏Mg粉CaO⑴甲醇(3)乙二醇(4)丙三醇无色液体,有酒味,有毒,人饮用10ml就能使眼睛失明,再多则能致死。可作车用燃料,是新的可再生能源。无色、黏稠有甜味的液体,易溶于水和乙醇。俗称甘油,是无色、黏稠有甜味的液体,吸湿性强,具有护肤作用。能跟水、酒精以任意比混溶。无色透明液体,具有特殊香味的液体,密度为0.789g/cm3,沸点78.5℃,易挥发,能与水以任意比互溶,能够溶解多种无机物和有机物,是一种良好的有机溶剂.⑵乙醇工业酒精(96%)无水酒精(99.5%)绝对酒精(100%)酒精中是否含水的验证:用无水硫酸铜是否变蓝。2、常见醇表3-1相对分子质量相近的醇与烷烃的沸点比较3、 醇的物理通性相对分子质量相近的醇和烷烃相比,醇的沸点远远高于烷烃。表3-2 含相同碳原子数不同羟基数的醇的沸点比较3、 醇的物理通性沸点随分子内羟基数目的增多而增大由于醇分子中羟基的氧原子与另一醇分子羟基的氢原子间存在着相互吸引作用,这种吸引作用叫氢键。a.相对分子质量相近的醇和烷烃相比,醇的沸点远远高于烷烃。①氢键对醇沸点的影响b.醇分子中羟基个数越多,沸点越高。(1)—OH对物理性质的影响——氢键②氢键对水溶性的影响醇与水之间可以形成氢键(—OH是亲水基团,烃基为疏水基团),导致有些醇可以与水任意比互溶,如:甲醇、乙醇、乙二醇等。 (2)拓展阅读醇化物(结晶醇)低级醇与一些无机盐形成的结晶状分子化合物称之为结晶醇,也称之为醇化物。MgCl2? 6CH3OH CaCl2 ? 4C2H5OH 注意
许多无机盐不能作为醇的干燥剂。结晶醇不溶于有机溶剂而溶于水。利用这一性质,可以使醇和其它有机溶剂分开,或从反应物中除去醇类。工业乙醚常杂有少量乙醇,加入CaCl2可使乙醇从乙醚中沉淀下来。学习各类重要的有机化合物,必须紧紧抓住物质的结构特征,特别是官能团的结构。从官能团着手,理解物质的性质。4、醇类化学性质:请写出甲醇、乙二醇、 2-丙醇、丙三醇分别与钠反应的化学方程式(1)、与钠反应乙醇钠 呈强碱性结论:2-OH——H2可用于快速确定醇中羟基数目拓展练习:—OH数目与H2量的关系1.等物质的量的甲醇?乙二醇?丙三醇中分别加入足量的金属钠,则产生的氢气(标况)体积之比为( );若将一定量的甲醇、乙二醇、丙三醇与足量的金属钠反应,产生的氢气(标况)体积相同,则三种醇的物质的量之比是( ) A.2∶3∶6 B.1∶2∶3 C.4∶3∶1 D.6∶3∶2D2.22g某醇与足量的金属钠反应收集到标况下的气体336ml,则该醇是( )
A.甲醇 B.异丙醇 C.2-甲基-2-丙醇CB(2)、消去反应 (分子内脱水) H H
| |
H-C-C-H CH2=CH2↑ + H2O
| |
H OH浓硫酸
170 ℃催化剂和脱水剂条件:醇分子结构中含有β-H规则:扎依采夫规则判断下列醇反应能否发生消去反应,若能请写出产物。(2)(3)(1)消去产物种类及主要产物和次要产物扎依采夫规则NaOH的乙醇溶液、加热?C—Br、?C—H?C—O、?C—HC=CCH2=CH2、HBrCH2=CH2、H2O浓硫酸、加热到170℃ 卤代烃与醇都能发生消去反应,它们有什么异同?分子结构中都必须含有β-H(3)、取代反应乙酸乙酯溴乙烷乙醚② 、与HX反应③ 、酯化反应①、分子间脱水2、写出乙酸分别与2-丙醇、乙二醇、丙三醇酯化的化学方程式3、写出浓氢溴酸分别与2-丙醇、乙二醇、丙三醇取代的化学方程式1、写出乙醇与2-丙醇分子间脱水的化学方程式4、 CH4O和C3H8O在浓硫酸加热的条件下可以得到的产物有多少种?(3)、取代反应分子间脱水(取代反应),消去反应,共7种(4)、氧化反应规律:
可看成1个C原子先与2个O原子结合,2个H原子与1个O原子结合,将剩余的C,H按照烃类燃烧规律消耗氧气。① 、燃烧②催化氧化2R—CH2—OH + O2a、伯醇——α—C原子上连有2个H原子,氧化为醛。b 、仲醇——α—C原子上连有1个H原子,氧化为酮。c 、仲醇——α—C原子上没有H原子,不能发生催化氧化规律:氧化反应(失H或得O) :有机物分子中失去氢原子或加入氧原子的反应还原反应(得H或失O) :有机物分子中加入氢原子或失去氧原子的反应从电子对偏向或偏移分析;
加2个H和1个O(一个水分子),如乙烯水化。R—CH2—OHa、伯醇——α—C原子上连有2个H原子,氧化为羧酸。b 、仲醇——α—C原子上连有1个H原子,氧化为酮。c 、仲醇——α—C原子上没有H原子,不能被强氧化剂氧化③ 、被强氧化剂[KMnO4(H+)、K2Cr2O7(H+)]氧化R—COOH可使KMnO4(H+)褪色(5)、多元醇性质 ②分子间脱水③催化氧化浓硫酸①分子内脱水烯醇烯醇酮醛羧酸醛酮a.—OH与不饱和键相连不稳定b.多个—OH连在同一个C上不稳定④说明:多元醇的不稳定性5、醇的命名(1)、普通命名法烃基的习惯名称 + 醇CH3CH2CH2OH正丙醇异丙醇正丁醇异丁醇仲丁醇叔丁醇CH3CH2CH2CH2OH1-丙醇1-丁醇2-甲基-1-丙醇2-甲基-2-丙醇2-丁醇2-丙醇烯丙醇炔丙醇 环己醇苯甲醇2-丙烯-1-醇2-丙炔-1-醇5、醇的命名②编号位①选主链③写名称选含—OH的最长碳链为主链从离—OH最近的一端起编号取代基位置号— 取代基名称 — 羟基位置号— 母体名称苯甲醇1,2,3—丙三醇(或甘油、丙三醇)2—丙醇(2)、系统命名法②③1、写出下列醇的名称①2—甲基—1—丙醇2—丁醇2,3—二甲基—3—戊醇6、醇的同分异构体醇类的同分异构体可有:
(1)碳链异构
(2)官能团(羟基)位置异构(取代法)
(3)官能团异构:醇和醚(插入法)写出C4H10O的同分异构体写出 C5H12O 属于醇的同分异构体烯醇烯醇酮醛羧酸醛酮a.—OH与不饱和键相连不稳定b.多个—OH连在同一个C上不稳定③说明:多元醇的不稳定性6、醇的同分异构体醇类的同分异构体可有:
(1)碳链异构
(2)官能团(羟基)位置异构(取代法)
(3)官能团异构:醇和醚(插入法)写出 C5H12O2属于二醇的同分异构体1、[2013·大纲版]某单官能团有机化合物,只含碳、氢、氧三种 元素,相对分子质量为58,完全燃烧时产生等物质的量的CO2和H2O。它可能的结构共有(不考虑立体异构)( )
A.4种 B.5种 C.6种 D.7种B (1)烯烃在H+催化下与H2O的水合反应催化剂:强酸
H2SO4, H3PO4, HBF4(氟硼酸),TsOH(对甲苯磺酸)等
反应特点:马氏规则催化剂7、醇的制备(2) 由卤代烃制备醇 (碳原子数不变)用NaOH水解H2C=CHCH2ClH2C=CHCH2OHNaOH-H2O△ △ △ NaOH - H2ONaOH - H2O七、醇的制备3-戊烯-1-醇5,5-二甲基-2-己醇3-羟甲基-1,7-庚二醇5-羟基己醛3-羟基-4-氯环己甲酸几个实例
不饱和醇:CH2=CH—CH2OHCH3CH2OH(3)根据烃基类别分脂肪醇
脂环醇
芳香醇饱和一元醇通式:CnH2n+1OH
或
CnH2n+2OCH3CH2OH1、醇的分类(4)按—OH所连“C”类型伯醇:R1—CH2—OH烯醇烯醇酮醛羧酸醛酮a.—OH与不饱和键相连不稳定b.多个—OH连在同一个C上不稳定③说明:多元醇的不稳定性蒸馏蒸馏Mg粉CaO⑴甲醇(3)乙二醇(4)丙三醇无色液体,有酒味,有毒,人饮用10ml就能使眼睛失明,再多则能致死。可作车用燃料,是新的可再生能源。无色、黏稠有甜味的液体,易溶于水和乙醇。俗称甘油,是无色、黏稠有甜味的液体,吸湿性强,具有护肤作用。能跟水、酒精以任意比混溶。无色透明液体,具有特殊香味的液体,密度为0.789g/cm3,沸点78.5℃,易挥发,能与水以任意比互溶,能够溶解多种无机物和有机物,是一种良好的有机溶剂.⑵乙醇工业酒精(96%)无水酒精(99.5%)绝对酒精(100%)酒精中是否含水的验证:用无水硫酸铜是否变蓝。2、常见醇表3-1相对分子质量相近的醇与烷烃的沸点比较3、 醇的物理通性相对分子质量相近的醇和烷烃相比,醇的沸点远远高于烷烃。表3-2 含相同碳原子数不同羟基数的醇的沸点比较3、 醇的物理通性沸点随分子内羟基数目的增多而增大由于醇分子中羟基的氧原子与另一醇分子羟基的氢原子间存在着相互吸引作用,这种吸引作用叫氢键。a.相对分子质量相近的醇和烷烃相比,醇的沸点远远高于烷烃。①氢键对醇沸点的影响b.醇分子中羟基个数越多,沸点越高。(1)—OH对物理性质的影响——氢键②氢键对水溶性的影响醇与水之间可以形成氢键(—OH是亲水基团,烃基为疏水基团),导致有些醇可以与水任意比互溶,如:甲醇、乙醇、乙二醇等。 (2)拓展阅读醇化物(结晶醇)低级醇与一些无机盐形成的结晶状分子化合物称之为结晶醇,也称之为醇化物。MgCl2? 6CH3OH CaCl2 ? 4C2H5OH 注意
许多无机盐不能作为醇的干燥剂。结晶醇不溶于有机溶剂而溶于水。利用这一性质,可以使醇和其它有机溶剂分开,或从反应物中除去醇类。工业乙醚常杂有少量乙醇,加入CaCl2可使乙醇从乙醚中沉淀下来。学习各类重要的有机化合物,必须紧紧抓住物质的结构特征,特别是官能团的结构。从官能团着手,理解物质的性质。4、醇类化学性质:请写出甲醇、乙二醇、 2-丙醇、丙三醇分别与钠反应的化学方程式(1)、与钠反应乙醇钠 呈强碱性结论:2-OH——H2可用于快速确定醇中羟基数目拓展练习:—OH数目与H2量的关系1.等物质的量的甲醇?乙二醇?丙三醇中分别加入足量的金属钠,则产生的氢气(标况)体积之比为( );若将一定量的甲醇、乙二醇、丙三醇与足量的金属钠反应,产生的氢气(标况)体积相同,则三种醇的物质的量之比是( ) A.2∶3∶6 B.1∶2∶3 C.4∶3∶1 D.6∶3∶2D2.22g某醇与足量的金属钠反应收集到标况下的气体336ml,则该醇是( )
A.甲醇 B.异丙醇 C.2-甲基-2-丙醇CB(2)、消去反应 (分子内脱水) H H
| |
H-C-C-H CH2=CH2↑ + H2O
| |
H OH浓硫酸
170 ℃催化剂和脱水剂条件:醇分子结构中含有β-H规则:扎依采夫规则判断下列醇反应能否发生消去反应,若能请写出产物。(2)(3)(1)消去产物种类及主要产物和次要产物扎依采夫规则NaOH的乙醇溶液、加热?C—Br、?C—H?C—O、?C—HC=CCH2=CH2、HBrCH2=CH2、H2O浓硫酸、加热到170℃ 卤代烃与醇都能发生消去反应,它们有什么异同?分子结构中都必须含有β-H(3)、取代反应乙酸乙酯溴乙烷乙醚② 、与HX反应③ 、酯化反应①、分子间脱水2、写出乙酸分别与2-丙醇、乙二醇、丙三醇酯化的化学方程式3、写出浓氢溴酸分别与2-丙醇、乙二醇、丙三醇取代的化学方程式1、写出乙醇与2-丙醇分子间脱水的化学方程式4、 CH4O和C3H8O在浓硫酸加热的条件下可以得到的产物有多少种?(3)、取代反应分子间脱水(取代反应),消去反应,共7种(4)、氧化反应规律:
可看成1个C原子先与2个O原子结合,2个H原子与1个O原子结合,将剩余的C,H按照烃类燃烧规律消耗氧气。① 、燃烧②催化氧化2R—CH2—OH + O2a、伯醇——α—C原子上连有2个H原子,氧化为醛。b 、仲醇——α—C原子上连有1个H原子,氧化为酮。c 、仲醇——α—C原子上没有H原子,不能发生催化氧化规律:氧化反应(失H或得O) :有机物分子中失去氢原子或加入氧原子的反应还原反应(得H或失O) :有机物分子中加入氢原子或失去氧原子的反应从电子对偏向或偏移分析;
加2个H和1个O(一个水分子),如乙烯水化。R—CH2—OHa、伯醇——α—C原子上连有2个H原子,氧化为羧酸。b 、仲醇——α—C原子上连有1个H原子,氧化为酮。c 、仲醇——α—C原子上没有H原子,不能被强氧化剂氧化③ 、被强氧化剂[KMnO4(H+)、K2Cr2O7(H+)]氧化R—COOH可使KMnO4(H+)褪色(5)、多元醇性质 ②分子间脱水③催化氧化浓硫酸①分子内脱水烯醇烯醇酮醛羧酸醛酮a.—OH与不饱和键相连不稳定b.多个—OH连在同一个C上不稳定④说明:多元醇的不稳定性5、醇的命名(1)、普通命名法烃基的习惯名称 + 醇CH3CH2CH2OH正丙醇异丙醇正丁醇异丁醇仲丁醇叔丁醇CH3CH2CH2CH2OH1-丙醇1-丁醇2-甲基-1-丙醇2-甲基-2-丙醇2-丁醇2-丙醇烯丙醇炔丙醇 环己醇苯甲醇2-丙烯-1-醇2-丙炔-1-醇5、醇的命名②编号位①选主链③写名称选含—OH的最长碳链为主链从离—OH最近的一端起编号取代基位置号— 取代基名称 — 羟基位置号— 母体名称苯甲醇1,2,3—丙三醇(或甘油、丙三醇)2—丙醇(2)、系统命名法②③1、写出下列醇的名称①2—甲基—1—丙醇2—丁醇2,3—二甲基—3—戊醇6、醇的同分异构体醇类的同分异构体可有:
(1)碳链异构
(2)官能团(羟基)位置异构(取代法)
(3)官能团异构:醇和醚(插入法)写出C4H10O的同分异构体写出 C5H12O 属于醇的同分异构体烯醇烯醇酮醛羧酸醛酮a.—OH与不饱和键相连不稳定b.多个—OH连在同一个C上不稳定③说明:多元醇的不稳定性6、醇的同分异构体醇类的同分异构体可有:
(1)碳链异构
(2)官能团(羟基)位置异构(取代法)
(3)官能团异构:醇和醚(插入法)写出 C5H12O2属于二醇的同分异构体1、[2013·大纲版]某单官能团有机化合物,只含碳、氢、氧三种 元素,相对分子质量为58,完全燃烧时产生等物质的量的CO2和H2O。它可能的结构共有(不考虑立体异构)( )
A.4种 B.5种 C.6种 D.7种B (1)烯烃在H+催化下与H2O的水合反应催化剂:强酸
H2SO4, H3PO4, HBF4(氟硼酸),TsOH(对甲苯磺酸)等
反应特点:马氏规则催化剂7、醇的制备(2) 由卤代烃制备醇 (碳原子数不变)用NaOH水解H2C=CHCH2ClH2C=CHCH2OHNaOH-H2O△ △ △ NaOH - H2ONaOH - H2O七、醇的制备3-戊烯-1-醇5,5-二甲基-2-己醇3-羟甲基-1,7-庚二醇5-羟基己醛3-羟基-4-氯环己甲酸几个实例
