3.1 电离平衡 课件(共51张PPT)
文档属性
| 名称 | 3.1 电离平衡 课件(共51张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 363.6KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-20 10:08:20 | ||
图片预览











文档简介
(共51张PPT)
电离平衡(第二课时)
高中化学
在实验室中,经常将酸进行稀释,需要知 道稀释后酸的浓度和氢离子浓度。
实验情景质疑
高中化学
分别取1 mL 2 mol/L 盐酸和1 mL 2 mol/L 醋酸, 均加水稀释到10 mL,请问稀释后的溶液,酸的浓度和 氢离子浓度分别为多少?
在实验室中,经常将酸进行稀释,需要知 道稀释后酸的浓度和氢离子浓度。
实验情景质疑
高中化学
问题分析:
HCl H+ + Cl-
稀释前 2 mol/L
稀释后 0.2 mol/L 0.2 mol/L 酸的浓度与氢离子浓度相等
HCl完全电离
高中化学
问题分析:
HCl H+ + Cl-
稀释前 2 mol/L
稀释后 0.2 mol/L 0.2 mol/L 酸的浓度与氢离子浓度相等
稀释前
稀释后
高中化学
CH3COOH部分电离
酸的浓度与氢离子浓度不相等
CH3COOH
2 mol/L
0.2 mol/L
H+ + CH3COO-
HCl完全电离
研究如何定量表示弱电解质电离程 度的大小。
任务一
高中化学
【写一写】
写出醋酸的电离方程式,并写出该电离方程 式的平衡常数表达式。
高中化学
CH3COOH 、 H+ + CH3COO-
c(CH3COO-)·c(H+)
K=
c(CH3COOH)
这个常数叫做电离平衡常数,简称电离常数。
【写一写】
写出醋酸的电离方程式,并写出该电离方程 式的平衡常数表达式。
高中化学
通常用Ka 、Kb分别表示弱酸、弱碱的电离常数。
CH3COOH H+ + CH3COO- NH3 ·H2O NH + OH-
4
+
c(NH )·c(OH-)
Kb =
c(NH3 ·H2O)
一水合氨的电离常数表达式
4
+
c(CH3COO-)·c(H+) Ka =
c(CH3COOH)
醋酸的电离常数表达式
高中化学
【练一练】
在某温度时,溶质的物质的量浓度为 0.2 mol·L-1的 氨水中,达到电离平衡时,已电离的NH3 ·H2O为1.7×10-3 mol·L-1 ,试计算该温度下NH3 ·H2O的电离常数(Kb)。
高中化学
起始浓度/(mol ·L-1)
变化浓度/(mol ·L-1)
平衡浓度/(mol ·L-1)
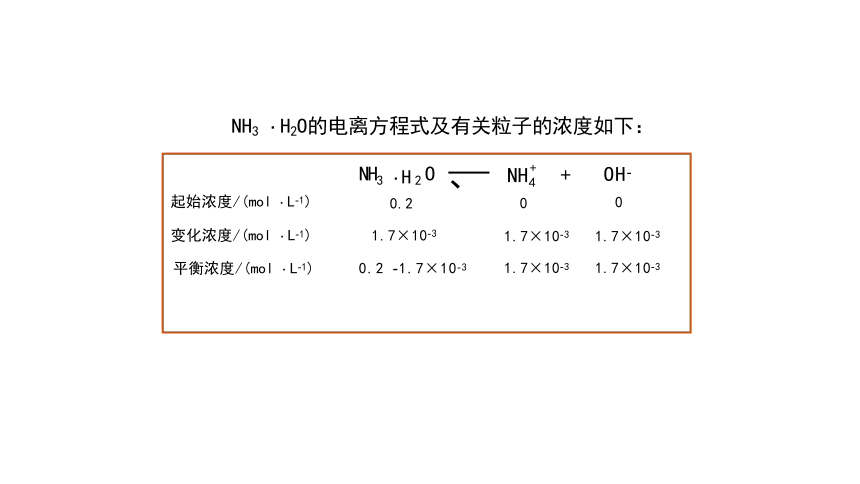
NH3 ·H2O的电离方程式及有关粒子的浓度如下:
NH3 ·H2O
0.2
+ NH
0
高中化学
OH-
0
+
4
NH3 ·H2O 、 NH +
OH-
起始浓度/(mol ·L-1) 0.2 0
0
变化浓度/(mol ·L-1) 1.7×10-3 1.7×10-3
1.7×10-3
平衡浓度/(mol ·L-1) 0.2 -1.7×10-3 1.7×10-3
1.7×10-3
4
+
NH3 ·H2O的电离方程式及有关粒子的浓度如下:
高中化学
NH +
起始浓度/(mol ·L-1)
变化浓度/(mol ·L-1)
平衡浓度/(mol ·L-1)
c(NH3·H2O)= (0.2-1.7×10-3) mol ·L-1 ≈ 0.2 mol ·L-1
4
+
NH3 ·H2O的电离方程式及有关粒子的浓度如下:
OH-
0
1.7×10-3
1.7×10-3
NH3 ·H2O 、
0.2
1.7×10-3
0.2 -1.7×10-3
0
1.7×10-3
1.7×10-3
高中化学
NH +
起始浓度/(mol ·L-1)
变化浓度/(mol ·L-1)
平衡浓度/(mol ·L-1)
c(NH3·H2O)= (0.2-1.7×10-3) mol ·L-1 ≈ 0.2 mol ·L-1
4
+
c(NH )·c(OH-)
Kb = c(NH3 ·H2O)
高中化学
4
+
= (1.7×10-3) · (1.7×10-3) 0.2
≈ 1.4×10-5
NH3 ·H2O的电离方程式及有关粒子的浓度如下:
OH-
0
1.7×10-3
1.7×10-3
NH3 ·H2O 、
0.2
1.7×10-3
0.2 -1.7×10-3
0
1.7×10-3
1.7×10-3
该温度下电离程度小
1.7×10-3 ×V(溶液)
=
0.2×V(溶液)
= 0.85%
该温度下电离程度小
进一步计算该温度下,有多少比例的NH3 ·H2O发生了电离:
已电离弱电解质分子数
原弱电解质分子数
×100%
高中化学
×100%
研究影响电离常数大小的因素。
任务二
高中化学
类比化学平衡常数,对于给定的化学反应, 化学平衡常数大小通常与温度相关。
推测
电离常数大小受温度影响
高中化学
升高温度电离平衡正向移动
c(CH3COO-)·c(H+) 分子变大
c(CH3COOH) 分母变小
pH计测定不同温度下0.05 mol/L 醋酸的pH,实验结 果如下表所示:
温度 20 ℃
24 ℃
pH 3.05
3.03
Ka =
高中化学
证实
电离常数大小受温度影响
高中化学
升高温度电离平衡正向移动
c(CH3COO-)·c(H+) 分子变大
c(CH3COOH) 分母变小
pH计测定不同温度下0.05 mol/L 醋酸的pH,实验结 果如下表所示:
温度 20 ℃
24 ℃
pH 3.05
3.03
Ka =
【想一想】
已知25 ℃时,相同浓度的CH3COOH溶液与HCN溶液相 比较,CH3COOH溶液酸性相对更强。
你能比较该温度下CH3COOH、HCN电离常数的大小吗?
高中化学
Ka (CH3COOH) > Ka (HCN)
电离常数由物质本性决定
高中化学
c(CH3COO-)·c(H+)
Ka =
c(CN-)·c(H+)
Ka =
CH3COOH H+ + CH3COO-
酸性: CH3COOH > HCN
HCN H+ +CN-
c(CH3COOH)
c(HCN)
表达式
电离常数 {
(1)内因:由物质本性决定
(2)外因:同一弱电解质的稀溶液, 只受温度影响
如CH3COOH在25 ℃时Ka为1.75×10-5 ,0 ℃时Ka为1.65×10-5
室温时可以不考虑,温度对电离常数的影响。
高中化学
【小结】 电离常数
影响因素
讨论电离常数有哪些具体应用。
任务三
高中化学
酸性: CH3COOH > HCN
高中化学
相同温度下,直接比较弱电解质的相对强弱
c(CH3COO-)·c(H+)
Ka =
c(CN-)·c(H+)
Ka =
CH3COOH的电离常数(25 ℃)
HCN的电离常数(25 ℃)
= 1.75×10-5
=6.2×10-10
c(CH3COOH)
c(HCN)
HClO
HF
HNO2
【查一查】
教科书附录II
某些弱电解质的电离常数(25 ℃)
高中化学
【查一查】
教科书附录II
某些弱电解质的电离常数(25 ℃)
酸性:HF>HNO2>HClO
高中化学
4.0×10-8
6.3×10-4
5.6×10-4
HClO
HF
HNO2
【想一想】
若将0.1 mol/L 醋酸加水稀释,使其溶质的浓度变为原
来的-,你能判断醋酸电离平衡移动的方向吗?
2
1
高中化学
【想一想】
若将0.1 mol/L 醋酸加水稀释,使其溶质的浓度变为原 来的 ,你能判断醋酸电离平衡移动的方向吗?
判断依据1
对于同一弱电解质,通常溶液中弱电解质的浓度 越小,离子间结合成分子的机会越少,电离程度越大。
稀释后,醋酸电离程度变大,平衡正向移动。
高中化学
CH3COOH CH3COO- + H+ Ka = c(C O· (H )
+
H)
c
CH3CO
COO-)
c
H
2 2 Ka
Q = = < Ka
c(CH3COOH) 2
2
加水稀释,电离平衡向电离的方向移动
判断依据2 借助电离常数进行判断
c(H+) c(CH3COO-)
高中化学
查阅教科书附录II
CH3COOH电离常数 Ka =1.75×10-5(25 ℃)
CH3COOH部分电离
酸的浓度与氢离子浓度不相等
CH3COOH 、 H+ + CH3COO-
2 mol/L
0.2 mol/L
稀释前
稀释后
【想一想】
高中化学
计算过程如下:
假设25 ℃ , 0.2 mol/L醋酸溶液中,c(H+)=x mol/L
CH3COOH 、 H+ + CH3COO-
起始浓度/(mol ·L-1) 0.2 0 0
变化浓度/(mol · L-1) x x x
平衡浓度/(mol ·L-1) 0.2 - x x x
c(CH3COOH)= (0.2-x) mol ·L-1 ≈ 0.2 mol ·L-1
高中化学
Ka = = ≈ 1.75×10-5
c(H+)= x = 0.001 87 mol/L
高中化学
起始浓度/(mol ·L-1)
变化浓度/(mol ·L-1) 平衡浓度/(mol ·L-1)
c(CH3COOH)= (0.2-x) mol ·L-1 ≈ 0.2 mol ·L-1
CH3COOH 、 H+ + CH3COO-
0.2
x
0.2 - x
0
x
x
0
x
x
进一步分析:
CH3COOH 、 H+ + CH3COO-
稀释前 2 mol/L
稀释后 0.2 mol/L
91 mol/L─
87 mol/L
类比上述计算方法
0.005
0.001
高中化学
进一步分析:
CH3COOH 、 H+ + CH3COO-
稀释前 2 mol/L 0.005 91 mol/L── 类比上述计算方法
稀释后 0.2 mol/L 0.001 87 mol/L
稀释10倍后,c(CH3COOH)降为之前浓度的
稀释10倍后,c(H+)降为之前浓度的
高中化学
进一步分析:
CH3COOH 、 H+ + CH3COO-
稀释前 2 mol/L 0.00 591 mol/L── 类比上述计算方法
稀释后 0.2 mol/L 0.001 87 mol/L
稀释10倍后,c(CH3COOH)降为之前浓度的
稀释10倍后,c(H+)降为之前浓度的
稀释过程中,醋酸电离平衡正向移动
平衡移动只能削弱反应条件的影响
高中化学
表达式
影响因素
作用意义
(1)比较弱电解质的相对强弱
(2)借助 Q 与 K 的关系,判断电离平衡移动方向
(3)计算相关粒子的浓度
【小结】 电离常数
电离常数
高中化学
小孩大哭过后,容易出现抽抽搭搭,停不下来、喘 不上气,或者手脚僵硬的情况。
CO2 、H2CO3?
高中化学
1.多元弱酸或多元弱碱在水中的电离是分步的。
H2CO3是二元弱酸,H2CO3的电离方程式为:
多元弱酸、多元弱碱的电离
H+ + HCO
H+ + CO -
3
2
3
-
H2CO3
-
HCO 3
高中化学
2.多元弱酸或多元弱碱每一步都有电离常数, 通常用Ka1、Ka2 或Kb1、Kb2加以区分。
c(H+)·c(CO - )
Ka2 = c(HCO )
3
-
3
2
c(H+)·c(HCO ) Ka1 = c(H2CO3)
3
-
H+ + HCO
H+ + CO -
3
2
3
-
25 ℃时,H2CO3的两步电离常数表达式为:
高中化学
-
HCO 3
H2CO3
比较多元弱酸的各步电离常数可以发现,Ka1 >Ka2 >Ka3 ……当 Ka 1>>Ka2 时,计算多元弱酸中的c(H+),或比较多元弱酸酸性的相 对强弱时,通常只考虑第一步电离。
多元弱碱的情况与多元弱酸类似。
高中化学
Ka1 = c(H ( O ) =4.4×10-7
3
-
)
C
H2CO3
·c(H
c
+)
c(H+)·c(CO - )
Ka2 = c(HCO )
3
-
3
2
25 ℃时,H2CO3的两步电离常数分别为:
=4.7×10-11
【想一想】
已知人体血液中存在如下平衡:
H2O + CO2 、 H2CO3 、 H+ + HCO
人体血液的pH需维持在7.35~7.45。当pH<7.35会导 致酸中毒,pH大于7.45会导致碱中毒。
3
-
高中化学
H2O + CO2 、 H2CO3 、 H+ + HCO
人体血液的pH需维持在7.35~7.45。当pH<7.35会导 致酸中毒,pH大于7.45会导致碱中毒。
3
-
【想一想】
已知人体血液中存在如下平衡:
小孩大哭后出现的生理症状,与上述平衡相关,是随着 哭泣,呼出大量CO2 ,平衡状态改变后,发生了轻微碱中毒。
高中化学
【想一想】
已知人体血液中存在如下平衡:
H2O + CO2 、 H2CO3 、 H+ + HCO
人体血液的pH需维持在7.35~7.45。当pH<7.35会导 致酸中毒,pH大于7.45会导致碱中毒。
3
-
出现轻微碱中毒后,如何缓解中毒症状呢?
高中化学
H2O + CO2 、 H2CO3 、 H+ + HCO 需要控制条件,使上述平衡正向移动 直接吸入大量CO2合理吗?
3
-
分析问题的化学本质
高中化学
H2O + CO2 、 H2CO3 、 H+ + HCO
需要控制条件,使上述平衡正向移动
可用纸袋,罩于鼻、口上再呼吸,增加动脉血CO2浓度。
及时就医。
3
-
分析问题的化学本质
高中化学
【实验】
向盛有2 mL 0.1 mol/L 醋酸的试管中加入等浓度 Na2CO3溶液,观察现象。
高中化学
【想一想】
根据试管中产生大量气泡的现象,能否推测出 CH3COOH的Ka和H2CO3的Ka1 的大小?
高中化学
【想一想】
根据试管中产生大量气泡的现象,能否推测出 CH3COOH的Ka和H2CO3的Ka1 的大小?
反应本质: 2CH3COOH + Na2CO3 2CH3COONa + H2O + CO2 ↑
实验结论: 酸性:CH3COOH > H2CO3
Ka (CH3COOH) > Ka1(H2CO3)
查阅教科书附录II CH3COOH Ka =1.75×10-5(25 ℃)
H2CO3 Ka 4.5×10-7(25 ℃)
1
=
高中化学
进一步分析: 为什么通常需要相对强酸提供H+?
CH3COOH + CO - 、 HCO + CH3COO-
3
-
3
2
高中化学
进一步分析: 为什么通常需要相对强酸提供H+?
CH3COOH + CO - 、 HCO + CH3COO-
c(HCO )·c(CH3COO-)
K=
c(CO - )·c(CH3COOH)
c(HCO )·c(CH3COO-)·c(H+) K(CH3COOH)
K= =
c(CO - )·c(CH3COOH)·c(H+) Ka2(H2CO3)
外加酸酸性越强,K越大,反应越有利
高中化学
3
2
3
-
3
2
3
-
3
-
3
2
粒子间的 相互作用
弱电解质的生成 可使体系中离子 浓度减小
【总结】 认识电离平衡的基本角度
粒子的种类 粒子的数量
粒子间存在 平衡及移动
反应
平衡
物质
定性
定量 K
微观层面
宏观层面
电离 平衡
高中化学
电离平衡(第二课时)
高中化学
在实验室中,经常将酸进行稀释,需要知 道稀释后酸的浓度和氢离子浓度。
实验情景质疑
高中化学
分别取1 mL 2 mol/L 盐酸和1 mL 2 mol/L 醋酸, 均加水稀释到10 mL,请问稀释后的溶液,酸的浓度和 氢离子浓度分别为多少?
在实验室中,经常将酸进行稀释,需要知 道稀释后酸的浓度和氢离子浓度。
实验情景质疑
高中化学
问题分析:
HCl H+ + Cl-
稀释前 2 mol/L
稀释后 0.2 mol/L 0.2 mol/L 酸的浓度与氢离子浓度相等
HCl完全电离
高中化学
问题分析:
HCl H+ + Cl-
稀释前 2 mol/L
稀释后 0.2 mol/L 0.2 mol/L 酸的浓度与氢离子浓度相等
稀释前
稀释后
高中化学
CH3COOH部分电离
酸的浓度与氢离子浓度不相等
CH3COOH
2 mol/L
0.2 mol/L
H+ + CH3COO-
HCl完全电离
研究如何定量表示弱电解质电离程 度的大小。
任务一
高中化学
【写一写】
写出醋酸的电离方程式,并写出该电离方程 式的平衡常数表达式。
高中化学
CH3COOH 、 H+ + CH3COO-
c(CH3COO-)·c(H+)
K=
c(CH3COOH)
这个常数叫做电离平衡常数,简称电离常数。
【写一写】
写出醋酸的电离方程式,并写出该电离方程 式的平衡常数表达式。
高中化学
通常用Ka 、Kb分别表示弱酸、弱碱的电离常数。
CH3COOH H+ + CH3COO- NH3 ·H2O NH + OH-
4
+
c(NH )·c(OH-)
Kb =
c(NH3 ·H2O)
一水合氨的电离常数表达式
4
+
c(CH3COO-)·c(H+) Ka =
c(CH3COOH)
醋酸的电离常数表达式
高中化学
【练一练】
在某温度时,溶质的物质的量浓度为 0.2 mol·L-1的 氨水中,达到电离平衡时,已电离的NH3 ·H2O为1.7×10-3 mol·L-1 ,试计算该温度下NH3 ·H2O的电离常数(Kb)。
高中化学
起始浓度/(mol ·L-1)
变化浓度/(mol ·L-1)
平衡浓度/(mol ·L-1)
NH3 ·H2O的电离方程式及有关粒子的浓度如下:
NH3 ·H2O
0.2
+ NH
0
高中化学
OH-
0
+
4
NH3 ·H2O 、 NH +
OH-
起始浓度/(mol ·L-1) 0.2 0
0
变化浓度/(mol ·L-1) 1.7×10-3 1.7×10-3
1.7×10-3
平衡浓度/(mol ·L-1) 0.2 -1.7×10-3 1.7×10-3
1.7×10-3
4
+
NH3 ·H2O的电离方程式及有关粒子的浓度如下:
高中化学
NH +
起始浓度/(mol ·L-1)
变化浓度/(mol ·L-1)
平衡浓度/(mol ·L-1)
c(NH3·H2O)= (0.2-1.7×10-3) mol ·L-1 ≈ 0.2 mol ·L-1
4
+
NH3 ·H2O的电离方程式及有关粒子的浓度如下:
OH-
0
1.7×10-3
1.7×10-3
NH3 ·H2O 、
0.2
1.7×10-3
0.2 -1.7×10-3
0
1.7×10-3
1.7×10-3
高中化学
NH +
起始浓度/(mol ·L-1)
变化浓度/(mol ·L-1)
平衡浓度/(mol ·L-1)
c(NH3·H2O)= (0.2-1.7×10-3) mol ·L-1 ≈ 0.2 mol ·L-1
4
+
c(NH )·c(OH-)
Kb = c(NH3 ·H2O)
高中化学
4
+
= (1.7×10-3) · (1.7×10-3) 0.2
≈ 1.4×10-5
NH3 ·H2O的电离方程式及有关粒子的浓度如下:
OH-
0
1.7×10-3
1.7×10-3
NH3 ·H2O 、
0.2
1.7×10-3
0.2 -1.7×10-3
0
1.7×10-3
1.7×10-3
该温度下电离程度小
1.7×10-3 ×V(溶液)
=
0.2×V(溶液)
= 0.85%
该温度下电离程度小
进一步计算该温度下,有多少比例的NH3 ·H2O发生了电离:
已电离弱电解质分子数
原弱电解质分子数
×100%
高中化学
×100%
研究影响电离常数大小的因素。
任务二
高中化学
类比化学平衡常数,对于给定的化学反应, 化学平衡常数大小通常与温度相关。
推测
电离常数大小受温度影响
高中化学
升高温度电离平衡正向移动
c(CH3COO-)·c(H+) 分子变大
c(CH3COOH) 分母变小
pH计测定不同温度下0.05 mol/L 醋酸的pH,实验结 果如下表所示:
温度 20 ℃
24 ℃
pH 3.05
3.03
Ka =
高中化学
证实
电离常数大小受温度影响
高中化学
升高温度电离平衡正向移动
c(CH3COO-)·c(H+) 分子变大
c(CH3COOH) 分母变小
pH计测定不同温度下0.05 mol/L 醋酸的pH,实验结 果如下表所示:
温度 20 ℃
24 ℃
pH 3.05
3.03
Ka =
【想一想】
已知25 ℃时,相同浓度的CH3COOH溶液与HCN溶液相 比较,CH3COOH溶液酸性相对更强。
你能比较该温度下CH3COOH、HCN电离常数的大小吗?
高中化学
Ka (CH3COOH) > Ka (HCN)
电离常数由物质本性决定
高中化学
c(CH3COO-)·c(H+)
Ka =
c(CN-)·c(H+)
Ka =
CH3COOH H+ + CH3COO-
酸性: CH3COOH > HCN
HCN H+ +CN-
c(CH3COOH)
c(HCN)
表达式
电离常数 {
(1)内因:由物质本性决定
(2)外因:同一弱电解质的稀溶液, 只受温度影响
如CH3COOH在25 ℃时Ka为1.75×10-5 ,0 ℃时Ka为1.65×10-5
室温时可以不考虑,温度对电离常数的影响。
高中化学
【小结】 电离常数
影响因素
讨论电离常数有哪些具体应用。
任务三
高中化学
酸性: CH3COOH > HCN
高中化学
相同温度下,直接比较弱电解质的相对强弱
c(CH3COO-)·c(H+)
Ka =
c(CN-)·c(H+)
Ka =
CH3COOH的电离常数(25 ℃)
HCN的电离常数(25 ℃)
= 1.75×10-5
=6.2×10-10
c(CH3COOH)
c(HCN)
HClO
HF
HNO2
【查一查】
教科书附录II
某些弱电解质的电离常数(25 ℃)
高中化学
【查一查】
教科书附录II
某些弱电解质的电离常数(25 ℃)
酸性:HF>HNO2>HClO
高中化学
4.0×10-8
6.3×10-4
5.6×10-4
HClO
HF
HNO2
【想一想】
若将0.1 mol/L 醋酸加水稀释,使其溶质的浓度变为原
来的-,你能判断醋酸电离平衡移动的方向吗?
2
1
高中化学
【想一想】
若将0.1 mol/L 醋酸加水稀释,使其溶质的浓度变为原 来的 ,你能判断醋酸电离平衡移动的方向吗?
判断依据1
对于同一弱电解质,通常溶液中弱电解质的浓度 越小,离子间结合成分子的机会越少,电离程度越大。
稀释后,醋酸电离程度变大,平衡正向移动。
高中化学
CH3COOH CH3COO- + H+ Ka = c(C O· (H )
+
H)
c
CH3CO
COO-)
c
H
2 2 Ka
Q = = < Ka
c(CH3COOH) 2
2
加水稀释,电离平衡向电离的方向移动
判断依据2 借助电离常数进行判断
c(H+) c(CH3COO-)
高中化学
查阅教科书附录II
CH3COOH电离常数 Ka =1.75×10-5(25 ℃)
CH3COOH部分电离
酸的浓度与氢离子浓度不相等
CH3COOH 、 H+ + CH3COO-
2 mol/L
0.2 mol/L
稀释前
稀释后
【想一想】
高中化学
计算过程如下:
假设25 ℃ , 0.2 mol/L醋酸溶液中,c(H+)=x mol/L
CH3COOH 、 H+ + CH3COO-
起始浓度/(mol ·L-1) 0.2 0 0
变化浓度/(mol · L-1) x x x
平衡浓度/(mol ·L-1) 0.2 - x x x
c(CH3COOH)= (0.2-x) mol ·L-1 ≈ 0.2 mol ·L-1
高中化学
Ka = = ≈ 1.75×10-5
c(H+)= x = 0.001 87 mol/L
高中化学
起始浓度/(mol ·L-1)
变化浓度/(mol ·L-1) 平衡浓度/(mol ·L-1)
c(CH3COOH)= (0.2-x) mol ·L-1 ≈ 0.2 mol ·L-1
CH3COOH 、 H+ + CH3COO-
0.2
x
0.2 - x
0
x
x
0
x
x
进一步分析:
CH3COOH 、 H+ + CH3COO-
稀释前 2 mol/L
稀释后 0.2 mol/L
91 mol/L─
87 mol/L
类比上述计算方法
0.005
0.001
高中化学
进一步分析:
CH3COOH 、 H+ + CH3COO-
稀释前 2 mol/L 0.005 91 mol/L── 类比上述计算方法
稀释后 0.2 mol/L 0.001 87 mol/L
稀释10倍后,c(CH3COOH)降为之前浓度的
稀释10倍后,c(H+)降为之前浓度的
高中化学
进一步分析:
CH3COOH 、 H+ + CH3COO-
稀释前 2 mol/L 0.00 591 mol/L── 类比上述计算方法
稀释后 0.2 mol/L 0.001 87 mol/L
稀释10倍后,c(CH3COOH)降为之前浓度的
稀释10倍后,c(H+)降为之前浓度的
稀释过程中,醋酸电离平衡正向移动
平衡移动只能削弱反应条件的影响
高中化学
表达式
影响因素
作用意义
(1)比较弱电解质的相对强弱
(2)借助 Q 与 K 的关系,判断电离平衡移动方向
(3)计算相关粒子的浓度
【小结】 电离常数
电离常数
高中化学
小孩大哭过后,容易出现抽抽搭搭,停不下来、喘 不上气,或者手脚僵硬的情况。
CO2 、H2CO3?
高中化学
1.多元弱酸或多元弱碱在水中的电离是分步的。
H2CO3是二元弱酸,H2CO3的电离方程式为:
多元弱酸、多元弱碱的电离
H+ + HCO
H+ + CO -
3
2
3
-
H2CO3
-
HCO 3
高中化学
2.多元弱酸或多元弱碱每一步都有电离常数, 通常用Ka1、Ka2 或Kb1、Kb2加以区分。
c(H+)·c(CO - )
Ka2 = c(HCO )
3
-
3
2
c(H+)·c(HCO ) Ka1 = c(H2CO3)
3
-
H+ + HCO
H+ + CO -
3
2
3
-
25 ℃时,H2CO3的两步电离常数表达式为:
高中化学
-
HCO 3
H2CO3
比较多元弱酸的各步电离常数可以发现,Ka1 >Ka2 >Ka3 ……当 Ka 1>>Ka2 时,计算多元弱酸中的c(H+),或比较多元弱酸酸性的相 对强弱时,通常只考虑第一步电离。
多元弱碱的情况与多元弱酸类似。
高中化学
Ka1 = c(H ( O ) =4.4×10-7
3
-
)
C
H2CO3
·c(H
c
+)
c(H+)·c(CO - )
Ka2 = c(HCO )
3
-
3
2
25 ℃时,H2CO3的两步电离常数分别为:
=4.7×10-11
【想一想】
已知人体血液中存在如下平衡:
H2O + CO2 、 H2CO3 、 H+ + HCO
人体血液的pH需维持在7.35~7.45。当pH<7.35会导 致酸中毒,pH大于7.45会导致碱中毒。
3
-
高中化学
H2O + CO2 、 H2CO3 、 H+ + HCO
人体血液的pH需维持在7.35~7.45。当pH<7.35会导 致酸中毒,pH大于7.45会导致碱中毒。
3
-
【想一想】
已知人体血液中存在如下平衡:
小孩大哭后出现的生理症状,与上述平衡相关,是随着 哭泣,呼出大量CO2 ,平衡状态改变后,发生了轻微碱中毒。
高中化学
【想一想】
已知人体血液中存在如下平衡:
H2O + CO2 、 H2CO3 、 H+ + HCO
人体血液的pH需维持在7.35~7.45。当pH<7.35会导 致酸中毒,pH大于7.45会导致碱中毒。
3
-
出现轻微碱中毒后,如何缓解中毒症状呢?
高中化学
H2O + CO2 、 H2CO3 、 H+ + HCO 需要控制条件,使上述平衡正向移动 直接吸入大量CO2合理吗?
3
-
分析问题的化学本质
高中化学
H2O + CO2 、 H2CO3 、 H+ + HCO
需要控制条件,使上述平衡正向移动
可用纸袋,罩于鼻、口上再呼吸,增加动脉血CO2浓度。
及时就医。
3
-
分析问题的化学本质
高中化学
【实验】
向盛有2 mL 0.1 mol/L 醋酸的试管中加入等浓度 Na2CO3溶液,观察现象。
高中化学
【想一想】
根据试管中产生大量气泡的现象,能否推测出 CH3COOH的Ka和H2CO3的Ka1 的大小?
高中化学
【想一想】
根据试管中产生大量气泡的现象,能否推测出 CH3COOH的Ka和H2CO3的Ka1 的大小?
反应本质: 2CH3COOH + Na2CO3 2CH3COONa + H2O + CO2 ↑
实验结论: 酸性:CH3COOH > H2CO3
Ka (CH3COOH) > Ka1(H2CO3)
查阅教科书附录II CH3COOH Ka =1.75×10-5(25 ℃)
H2CO3 Ka 4.5×10-7(25 ℃)
1
=
高中化学
进一步分析: 为什么通常需要相对强酸提供H+?
CH3COOH + CO - 、 HCO + CH3COO-
3
-
3
2
高中化学
进一步分析: 为什么通常需要相对强酸提供H+?
CH3COOH + CO - 、 HCO + CH3COO-
c(HCO )·c(CH3COO-)
K=
c(CO - )·c(CH3COOH)
c(HCO )·c(CH3COO-)·c(H+) K(CH3COOH)
K= =
c(CO - )·c(CH3COOH)·c(H+) Ka2(H2CO3)
外加酸酸性越强,K越大,反应越有利
高中化学
3
2
3
-
3
2
3
-
3
-
3
2
粒子间的 相互作用
弱电解质的生成 可使体系中离子 浓度减小
【总结】 认识电离平衡的基本角度
粒子的种类 粒子的数量
粒子间存在 平衡及移动
反应
平衡
物质
定性
定量 K
微观层面
宏观层面
电离 平衡
高中化学
