第一单元金属和金属材料复习题2023-2024学年人教版(五四学制)九年级化学全一册(含解析)
文档属性
| 名称 | 第一单元金属和金属材料复习题2023-2024学年人教版(五四学制)九年级化学全一册(含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 321.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(五四学制) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-18 07:04:11 | ||
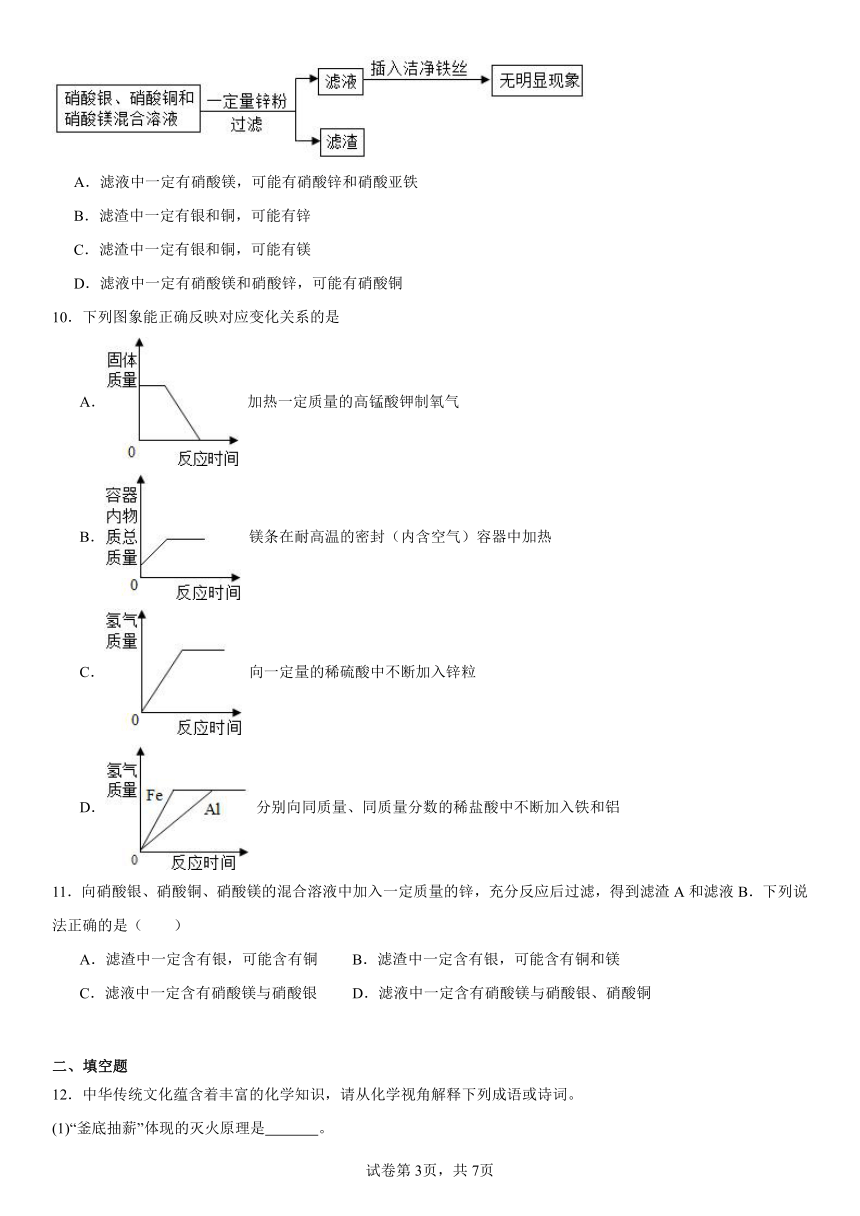
图片预览




文档简介
第一单元 金属和金属材料 复习题
一、单选题
1.“物质性质决定用途”是重要的化学观点之一,下列关于“物质一性质一用途”的说法有误的是
A.钛合金——与人体有很好的“相容性”——制造人造骨
B.石墨——可导电——作电极
C.活性炭——有吸附性——可去除冰箱里的异味
D.一氧化碳——可燃烧——冶炼钢铁
2.在探究铁的性质时,小明同学将一根洁净的铁钉放入稀硫酸中,经观察分析他获得了下列结论,你认为其中正确的是
①铁钉表面产生气泡 ②铁钉的质量减轻
③溶液的质量减轻 ④溶液由无色逐渐变为浅绿色
A.①③④ B.①②③ C.②③④ D.①②④
3.科学家研制出一种新型催化剂,可用于去除装修残留的甲醛(化学式为CH2O),该反应过程的微观示意图如下图。下列说法正确的是
A.该反应属于置换反应 B.参加反应的甲、乙两物质质量比为1:1
C.该反应前后分子数目和原子种类都没改变 D.该反应前后氧元素的化合价没有改变
4.分别将不同质量的锌粉加入到一定量的Fe(NO3)2、Cu(NO3)2和AgNO3混合溶液中,充分反应后过滤,在不同情况下对滤渣或滤液成分的说法,错误的是
A.若滤液中只含一种溶质,滤渣一定含有Ag、Cu、Fe,可能含有Zn
B.当滤液含两种溶质时,滤渣一定含有Ag、Cu,可能含有Fe,一定不含Zn
C.向所得滤渣中滴加稀盐酸无气泡生成,滤渣一定含Ag,可能含Cu,一定不含Fe和Zn
D.若滤渣中有红色固体,滤液一定含有Zn(NO3)2、Fe(NO3)2,一定不含AgNO3、Cu(NO3)2
5.向100gCuSO4溶液中先逐渐加入一定量锌粉,再逐渐加入铁粉,测得剩余固体质量与加入金属质量关系如图。下列说法正确的是
A.a点对应的溶液为蓝色
B.n=6.5,m=9.6
C.b点对应的固体中加稀盐酸,有气泡产生
D.100gCuSO4溶液中CuSO4的质量为24g
6.为预防金属制品锈蚀,下列措施或做法不当的是
A.用钢丝球清除铝锅内的氧化层
B.在铁制门窗表面喷涂油漆
C.在铁制水管表面镀一层锌
D.将使用后的菜刀洗净擦干
7.下列关于资源、能源、环保方面的叙述不正确的是( )
A.由于全球气候变暖,所以要减少二氧化碳对空气的污染
B.地球表面约71%被水覆盖,但人们可直接利用的淡水资源不到水储量的1%
C.地球上的金属资源广泛地存在于地壳和海洋中,地壳中含量最多的金属元素是铝元素
D.节约用水和防治水体污染是保护水资源的有效途径
8.等质量的铁和锌两种金属,分别与相同浓度的足量稀盐酸反应,生成氢气的质量和反应时间的关系如图所示,则下列说法中不正确的是( )
A.M、N中较活泼的金属是N B.N表示金属铁
C.M、N中产生氢气较多的是M D.N表示金属锌
9.根据下图实验流程,下列分析正确的是
A.滤液中一定有硝酸镁,可能有硝酸锌和硝酸亚铁
B.滤渣中一定有银和铜,可能有锌
C.滤渣中一定有银和铜,可能有镁
D.滤液中一定有硝酸镁和硝酸锌,可能有硝酸铜
10.下列图象能正确反映对应变化关系的是
A. 加热一定质量的高锰酸钾制氧气
B. 镁条在耐高温的密封(内含空气)容器中加热
C. 向一定量的稀硫酸中不断加入锌粒
D. 分别向同质量、同质量分数的稀盐酸中不断加入铁和铝
11.向硝酸银、硝酸铜、硝酸镁的混合溶液中加入一定质量的锌,充分反应后过滤,得到滤渣A和滤液B.下列说法正确的是( )
A.滤渣中一定含有银,可能含有铜 B.滤渣中一定含有银,可能含有铜和镁
C.滤液中一定含有硝酸镁与硝酸银 D.滤液中一定含有硝酸镁与硝酸银、硝酸铜
二、填空题
12.中华传统文化蕴含着丰富的化学知识,请从化学视角解释下列成语或诗词。
(1)“釜底抽薪”体现的灭火原理是 。
(2)“一叶春非绿,十里稻花香”说明分子的性质是 。
(3)“熬胆矾(硫酸铜)铁斧、久之亦化为铜”,发生反应的化学方程式为 。
13.金属材料的研发将大大提升我们的生活水平,促进社会的发展。
(1)物理性质:下列金属制品中,主要利用金属导热性的是 (填序号)。
A.金银首饰 B.铝合金门窗 C.铁炒锅 D.铜导线
(2)金属冶炼:炼铁的原理是利用一氧化碳的性质,请写出一氧化碳与氧化铁反应的化学方程式为 ;
(3)化学性质:西汉时期的《淮南万毕术》记载了“曾青得铁则化为铜”的工艺。化学兴趣小组的同学模拟了该“炼铜”方法。
①将铁粉加入适量硫酸铜溶液中,实验过程中发生的化学方程式为 ,由此可知金属活动性:铁 铜(填“大于”或“小于”);
②另取8.4g铁粉加入一定量的硫酸铜溶液中,可观察有红色固体产生,溶液变为浅绿色,充分反应后过滤、洗涤、干燥,得到9.2g固体。为进一步定量探究9.2g固体中各成分的质量情况,请设计实验验证。
实验操作 实验现象及数据分析 结论
9.2g的固体中铁粉的质量和铜粉的质量分别是 。
14.2022年北京冬奥会火种灯采用双层玻璃结构,在低温、严寒、大风等环境下不会熄灭。其创意源自于青铜器精品“中华第一灯”一一西汉长信宫灯。
(1)我国铜冶炼技术具有悠久的历史。《格致粗谈》记载“赤铜入炉甘石炼为黄铜,其色如金”,把赤铜(Cu2O)和炉甘石、木炭粉混合高温制得黄铜: 。则炉甘石主要成分X的化学式为 ,反应中体现还原性的物质是 (填化学式),根据反应产物可知黄铜中含有的金属有 (填化学式)。湿法炼铜的原理是: ,该反应中保持不变的原子团化学符号是 。
(2)学以致用,运用金属知识,用黄铜片(铜锌合金)做一幅北京冬奥会会徽的金属蚀刻画。
①采用什么溶液做反应蚀刻剂呢?
甲:硫酸铝溶液 乙:盐酸 丙:硝酸银溶液
你认为甲 (填能、不能)用做反应蚀刻剂
②用硝酸银溶液做蚀刻剂,写出发生反应的化学方程式 ;反应的基本类型是 反应。按照流程打磨--制模--蚀刻--清洗--抛光上色-涂膜完成。请画出蚀刻后废液中的粒子示意图 (水不需要表示出来,粒子数量比例不需要表现)
③蚀刻面完成以后,剩余一些黄铜废料,废物利用,测定黄铜中铜的含量。称取废黄铜片20.0g放入到200g质量分数为4.9%稀硫酸中两者恰好充分反应。计算该黄铜样品中铜的质量分数为 。
15.铁制品锈蚀的过程,实际上是铁与空气中的 和 等发生 反应.
16.将镁、锌、铁、铜四种金属放入等体积、同浓度的稀盐酸中,能观察到有气泡生成的是 ,其剧烈程度由强到弱的顺序是 ,不能观察到有气泡生成的是 ,有关化学方程式为 、 、 。由此可知,这四种金属的活动性由强到弱的顺序是 。
17.化学与人类生活息息相关,请应用所学的化学知识回答下列问题:
(1)每年的3月22日是“世界水日”,水与人类的生活和生产密切相关。
①生活中存在硬水和软水,可以用 区分硬水和软水;
②硬水给生活和生产带来很大的不利,生活中通过 来降低水的硬度,上图是小芳同学自制的简易净水装置,其中石英砂的作用是 。
(2)铁是应用最广泛的金属。
①生活中用铁作炊具,主要利用了铁的延展性和 性。
②铁制品锈蚀的过程,实际上是铁跟空气中的 等发生了化学反应。为防止铁锅生锈,通常采取的措施是 (写一条)。
③在AgNO3、Cu(NO3)2的混合溶液中加入一定量的锌粉,充分反应后过滤,得到滤渣和滤液,若滤液呈无色,则滤渣中一定含有的物质是 (填化学式)。
三、实验题
18.原煤在氧气中不完全燃烧会生成CO、CO2的混合气体。同学们在实验室欲用下图所示的装置检验生成的气体,准备了如下图所示的装置(其他仪器用品略)。
(1)装置A的作用是 。
(2)装置C中发生反应的化学方程式为 ;装置D中发生反应的化学方程式为 。
(3)上述装置组合后还有明显不足之处,你认为不足之处是 。
(4)为达到实验目的,将上述装置组合后进行实验,其接口顺序为:混合气体→ 。 (填“a~h”接口序号,装置可重复使用)]
19.早在春秋战国时期,我国就开始生产和使用铁器.工业上炼铁的原理是利用一氧化碳和氧化铁的反应.某化学兴趣小组利用如图装置进行实验探究,请按要求填空:
(1)A中观察到的现象是 ;
(2)实验结束后,应 (填序号)
①先熄灭酒精喷灯,继续通一氧化碳
②先停止通一氧化碳,再熄灭酒精喷灯
(3)写出试管B中发生反应的方程式 。
四、计算题
20.为测定某铜、锌合金中铜的质量分数,兴趣小组同学称取10g合金于烧杯中,将40g稀盐酸分四次加入,充分反应,测得实验数据如下表所示:
第一次 第二次 第三次 第四次
加入稀盐酸的质量(g) 10 10 10 10
烧杯中剩余物的质量(g) 19.96 29.92 39.90 49.90
(1)充分反应后产生气体的总质量 g。
(2)该铜、锌合金中铜的质量分数为多少?(写出计算过程)
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.D
【详解】A、钛合金与人体有很好的“相容性”,可制造人造骨,“物质一性质一用途”的说法正确;
B、石墨具有导电性,可用作电机,“物质一性质一用途”的说法正确;
C、活性炭具有疏松多孔的结构,有良好的吸附性,可除去冰箱里的异味,“物质一性质一用途”的说法正确;
D、一氧化碳具有可燃性,可用作燃料,“物质一性质一用途”的说法错误;
答案:D。
2.D
【详解】试题分析:在金属活动顺序表中,铁在氢的前边,所以铁能与稀硫酸反应,生成硫酸亚铁和氢气;所以铁钉表面产生气泡、铁钉的质量减轻;稀硫酸通过反应变成硫酸亚铁溶液,溶液的质量增加;稀硫酸为无色溶液,硫酸亚铁溶液为浅绿色,故溶液由无色逐渐变为浅绿色
考点:铁与酸的反应
3.C
【分析】由微观示意图可知,甲醇和氧气生成二氧化碳和水,化学方程式。
【详解】A、该反应中,生成物是两种化合物,不属于置换反应,不符合题意;
B、该反应消耗物质甲和乙的质量比为:30:32=15:16,不符合题意;
C、由化学方程式可知,该反应前后,分子的数目没有改变,原子种类没有改变,符合题意;
D、氧气中氧元素0价,反应后氧元素-2价,化合价发生改变,不符合题意。
故选:C。
4.D
【分析】由于金属活动顺序是:Zn>Fe>Cu>Ag,将不同质量的锌粉加入到一定量的Fe(NO3)2、Cu(NO3)2和AgNO3混合溶液中,锌先与硝酸银反应生成了银和硝酸锌,当硝酸银完全反应后,锌再与硝酸铜反应生成了硝酸锌和铜,当硝酸铜完全反应后锌再与硝酸亚铁反应生成了硝酸锌和铁。
【详解】A、若滤液中只含一种溶质,就是硝酸锌,滤渣一定含有Ag、Cu、Fe,可能含有Zn,故正确;
B、当滤液含两种溶质时,溶质是硝酸锌和硝酸亚铁,滤渣一定含有Ag、Cu,可能含有Fe,一定不含Zn,故正确;
C、若向所得滤渣中滴加稀盐酸无气泡生成,滤渣一定含有Ag,可能含Cu,一定不含Fe和Zn,故正确;
D、若滤渣中有红色固体,红色固体是铜,滤液一定含有Zn(NO3)2,一定不含AgNO3、可能含有Cu(NO3)2和Fe(NO3)2,故错误。
故选D。
5.A
【详解】A、向硫酸铜中加一定量的锌粉,锌和硫酸铜反应生成硫酸锌和铜,再加入铁粉,铁和硫酸锌不反应,铁和硫酸铜反应生成硫酸亚铁和铜,图中出现3个转折点,0a段表示锌和硫酸铜反应,a点表示锌刚好消耗,ab表示铁和硫酸铜反应,b点表示硫酸铜刚好消耗,故a点含有硫酸铜,对应的溶液为蓝色,选项说法正确;
B、a点时,剩余固体为反应生成的铜,此时铜的质量为6.4g,锌和硫酸铜反应生成硫酸锌和铜,设锌的质量为x,
即n=6.5;
ab表示铁和硫酸铜反应,b点表示硫酸铜刚好消耗,设铁和硫酸铜反应生成的铜的质量为y,
m=9.6g +6.4g=16g,选项说法不正确;
C、b点硫酸铜和锌和铁恰好完全反应,对应的固体中只有铜,加稀盐酸,不反应,无气体生成,选项说法错误;
D、生成的铜的质量为16g,铜元素来自硫酸铜,故硫酸铜的质量为16g÷(×100%)=40g,故原溶液中CuSO4的质量40g,选项说法错误。
故选:A。
6.A
【详解】A、铝制品表面有一层氧化膜,对铝锅起保护作用,阻止铝被进一步氧化,所以擦去表面的氧化层是错误的做法,故A符合题意;
B、在铁制门窗表面喷涂油漆,使铁与氧气和水隔绝,有利于防锈,故B不符合题意;
C、在铁制水管表面镀一层锌,使铁与氧气和水隔绝,有利于防锈,故D不符合题意;
D、使用后的菜刀洗净擦干有利于防锈,故D不符合题意。
故应选A。
7.A
【详解】A、二氧化碳不是空气中的有害气体不会造成空气污染,A错;
B、地球表面约71%被水覆盖,但人们可直接利用的淡水资源不到水储量的1%,B正确;
C、地球上的金属资源广泛地存在于地壳和海洋中,地壳中含量最多的金属元素是铝元素,C正确;
D、节约用水和防治水体污染是保护水资源的有效途径,D正确;
故选:A。
8.B
【详解】A、由图像可知,N的斜率大,N比M更活泼;故选项正确,但不符合题意。
B、由图像可知,N的斜率大,N比M更活泼;N表示锌,M表示铁;故选项错误,但符合题意。
C、由图像可知,M产生的氢气多,N产生的氢气少;故选项正确,但不符合题意。
D、由图像可知,N的斜率大,N比M更活泼;N表示锌,M表示铁;故选项正确,但不符合题意。
故选B。
9.B
【详解】根据金属活动性顺序的应用:位于前面的金属能把位于后面的金属从化合物的溶液中置换出来。向硝酸银、硝酸铜、硝酸镁的混合溶液中加入一定量的锌粉,锌先与硝酸银发生置换反应,再与硝酸铜反应,锌不能与硝酸镁反应。反应后向滤液中加入铁丝无明显现象,说明滤液中没有硝酸银和硝酸铜,即加入的锌已经将硝酸银和硝酸铜完全置换出来了且锌粉可能过量。即滤液中一定含有硝酸镁和硝酸锌,滤渣中一定含有铜和银,可含有锌。故选B。
10.C
【分析】解答图像类的题目抓住“三点一走势”,即首先看清楚横、纵坐标各表示的量,然后从起始点、转折点、终点还有量的变化趋势来进行分析解答
【详解】A、加热一定质量的高锰酸钾制氧气,还得到固体锰酸钾和二氧化锰,故当反应结束时,剩余的固体质量不会为0,错误;
B、根据质量守恒定律,镁条在耐高温的密封(内含空气)容器中加热,那么容器内物质的总质量不变,错误;
C、向一定量的稀硫酸中不断加入锌粒,生成的氢气质量随着反应时间不断增大,直至反应结束后不变,正确;
D、根据金属的活动性,Al的活动性大于Fe,故反应速率Al应更快,反应所需时间也更短,错误;
故选C。
11.A
【分析】锌的金属活动性比银、铜强,比镁弱;向硝酸银、硝酸铜、硝酸镁的混合溶液中加入一定质量的锌,不能与硝酸镁溶液反应;锌先与硝酸银溶液反应生成硝酸锌溶液和银,硝酸银反应完,若还有锌粉,锌才能与硝酸铜溶液反应生成硝酸锌溶液和铜。
【详解】A、滤渣中一定含有银,可能含有铜,故选项说法正确。
B、滤渣中一定含有银,可能含有铜,不可能含有镁,故选项说法错误。
C、滤液中一定含有硝酸镁,不一定含有硝酸银,故选项说法错误。
D、滤液中一定含有硝酸镁,不一定含有硝酸银、硝酸铜,故选项说法错误。
故选A。
12.(1)隔绝可燃物
(2)分子在做无规则的运动
(3)
【详解】(1)“釜底抽薪”就是将柴火移走,所以体现的灭火原理是隔绝可燃物。
(2)能够闻到花香,说明分子在做无规则的运动。
(3)“熬胆矾(硫酸铜)铁斧、久之亦化为铜”,发生反应为铁和硫酸铜反应生成硫酸亚铁和铜,对应的化学方程式为。
13.(1)C
(2)Fe2O3+3CO2Fe+3CO2
(3) Fe+CuSO4=FeSO4+Cu 大于 取固体,加入过量的稀盐酸 固体部分溶解,且有气泡产生;生成氢气0.1g 铁2.8g、铜6.4g
【详解】(1)A、金银具有良好的延展性,则可以加工成各种首饰,该性质与导热性无关;
B、铝合金密度小硬度大,则适合用于加工成门窗,该性质与导热性无关;
C、铁具有良好的导热性,则可以加工制成砂锅;
D、铜具有良好的导电性,则可以加工制成导线,该性质与导热性无关;
故选C;
(2)一氧化碳与氧化铁在高温下反应生成铁与二氧化碳,化学反应方程式为:Fe2O3+3CO2Fe+3CO2;
(3)①铁能与硫酸铜反应生成硫酸亚铁与铜,化学反应方程式为:Fe+CuSO4=FeSO4+Cu;铁能置换出硫酸铜中的铜,则金属活动性铁大于铜;
②5.6g铁粉反应后固体增加的质量为9.2g-8.4g=0.8g
根据化学反应方程式分析可知
则反应后Fe剩余质量为8.4g-5.6g=2.8g,生成的铜的质量为6.4g;
设2.8gFe与稀盐酸完全反应后产生氢气的质量为x
x=0.1g
Fe能与稀盐酸反应生成氯化亚铁与氢气;则可以设计实验:取固体,加入过量的稀盐酸,观察到固体部分溶解,且有气泡产生;
根据上述分析可知生成氢气0.1g;9.2g的固体中铁粉的质量和铜粉的质量分别是铁2.8g、铜6.4g。
14.(1) ZnCO3 C Zn、Cu
(2) 不能 Zn+2AgNO3=Zn(NO3)2+2Ag 置换 解:设黄铜样品中锌的质量为x
x=6.5g
则该黄铜样品中铜的质量分数为:
答:该黄铜样品中铜的质量分数为67.5%
【详解】(1)根据质量守恒定律,化学反应前后,原子的种类和数目不变,反应物中含Cu、Zn、C、O的个数分别是2、0、1、1,生成物中含Cu、Zn、C、O的个数分别是2、1、2、4,故反应物中还应含1个Zn、1个C、3个O,故X的化学式为:ZnCO3;
在该反应中,碳得到氧,体现了还原性,故填:C;
反应产物中含Zn、Cu两种金属,故黄铜中含有的金属有Cu、Zn;
由化学方程式可知,该反应的实质是铁原子和铜离子反应生成亚铁离子和铜原子,硫酸根离子保持不变,故填:;
(2)①铝比铜、锌活泼,铜、锌与硫酸铝均不反应,故甲不能用作反应蚀刻剂;
②用硝酸银溶液做蚀刻剂,锌与硝酸银反应生成硝酸锌和银,该反应的化学方程式为:,铜和硝酸银反应生成硝酸铜和银,该反应的化学方程式为:,这两个反应均符合“两种化合物互相交换成分生成另外两种化合物”的反应,属于置换反应;
锌和硝酸银反应生成硝酸锌和银,铜和硝酸银反应生成硝酸铜和银,故蚀刻后废液中一定含铜离子、锌离子、硝酸根离子,故填: ;
③见答案。
15.①氧气
②水
③化学
【详解】铁制品锈蚀,实际上是铁与空气中的氧气、水等发生化学反应,生成氧化铁,
故答案为氧气;水;化学。
16. 镁、锌、铁 镁、锌、铁 铜 Mg+2HCl=MgCl2+H2↑ Zn+2HCl=ZnCl2+H2↑ Fe+2HCl=FeCl2+H2↑ 镁>锌>铁>铜
【详解】金属活动性顺序中,排在氢前面的金属能与稀盐酸反应,金属活动性越强,反应越剧烈。
将镁、锌、铁、铜四种金属放入等体积、同浓度的稀盐酸中,能观察到有气泡生成的是镁、锌、铁,其剧烈程度由强到弱的顺序是:镁、锌、铁,不能观察到有气泡生成的是铜,有关化学方程式为:Mg+2HCl=MgCl2+H2↑、Zn+2HCl=ZnCl2+H2↑、Fe+2HCl=FeCl2+H2↑ 。
由此可知,这四种金属的活动性由强到弱的顺序是:镁>锌>铁>铜。
17.(1) 肥皂水 煮沸 过滤
(2) 导热 氧气和水 保持铁锅表面清洁、干燥 Ag和Cu
【详解】(1)①通常用肥皂水来区分硬水和软水,肥皂水在硬水中易起浮渣,在软水中泡沫较多;
②可溶性钙、镁化合物在加热时,能形成沉淀,故生活中常用煮沸的方法降低水的硬度;
简易净水器中,石英砂的作用是:过滤,除去难溶性杂质;
(2)①生活中用铁作炊具,主要利用了铁的延展性和导热性;
②铁制品锈蚀的过程,实际上是铁跟空气中的氧气和水等发生了化学反应;
防止铁锅生锈,可以隔绝氧气和水,如保持铁锅表面清洁、干燥;
③金属活动性:Zn>Cu>Ag,在硝酸银、硝酸铜的混合溶液中加入一定量的锌粉,锌先与硝酸银反应生成硝酸锌和银,待硝酸银完全反应后,锌和硝酸铜反应生成硝酸锌和铜,充分反应后过滤,得到滤渣和滤液,若滤液呈无色,说明硝酸铜已经完全反应,则滤渣中一定含铜和银,可能含锌,故填:Cu、Ag。
18. 除水蒸气
没有进行尾气处理 ef→cd→ef→ba→gh→ef
【详解】(1)A中的浓硫酸可以吸收水分,故答案为:除水蒸气;
(2)C中的石灰水能用于检验二氧化碳的存在,化学反应方程式是:,D用于一氧化碳的检验
(3)因CO有毒,排放后会污染空气,但装置中没有进行尾气处理;
(4)将混合气体先通过ef检验二氧化碳的存在,再通过cd使二氧化碳被NaOH溶液完全吸收,再次通过ef看是否还有二氧化碳,再通过ba吸收可能存在的水分,再将剩余的CO通过gh,最后再次用ef检验是否有二氧化碳生成。
故答案为:ef→cd→ef→ba→gh→ef。
19.(1)红棕色粉末逐渐变黑
(2)①
(3)CO2+Ca(OH)2═CaCO3↓+H2O
【分析】(1)
一氧化碳和氧化铁高温生成铁和二氧化碳,现象为红棕色粉末逐渐变黑,故填:红棕色粉末逐渐变黑。
(2)
实验结束后,应先熄灭酒精喷灯,继续通一氧化碳,防止铁在高温下和氧气发生氧化,故选:①。
(3)
二氧化碳和氢氧化钙生成碳酸钙和水,澄清石灰水变浑浊,故填:CO2+Ca(OH)2═CaCO3↓+H2O。
20.(1)0.10
(2)解:设10克铜锌合金中锌的质量为x
x=3.25g
答:铜锌合金中铜的质量分数为67.5%。
【详解】(1)第一次生成气体的质量为20g-19.96g=0.04g;第二次生成气体的质量为30g-29.92g=0.08g;第三次生成气体的质量为40-39.9g=0.1g;第四次生成气体的质量为50g-49.9g=0.1g,说明第三次实验锌就已经反应完了。
(2)详解见答案
答案第1页,共2页
答案第1页,共2页
一、单选题
1.“物质性质决定用途”是重要的化学观点之一,下列关于“物质一性质一用途”的说法有误的是
A.钛合金——与人体有很好的“相容性”——制造人造骨
B.石墨——可导电——作电极
C.活性炭——有吸附性——可去除冰箱里的异味
D.一氧化碳——可燃烧——冶炼钢铁
2.在探究铁的性质时,小明同学将一根洁净的铁钉放入稀硫酸中,经观察分析他获得了下列结论,你认为其中正确的是
①铁钉表面产生气泡 ②铁钉的质量减轻
③溶液的质量减轻 ④溶液由无色逐渐变为浅绿色
A.①③④ B.①②③ C.②③④ D.①②④
3.科学家研制出一种新型催化剂,可用于去除装修残留的甲醛(化学式为CH2O),该反应过程的微观示意图如下图。下列说法正确的是
A.该反应属于置换反应 B.参加反应的甲、乙两物质质量比为1:1
C.该反应前后分子数目和原子种类都没改变 D.该反应前后氧元素的化合价没有改变
4.分别将不同质量的锌粉加入到一定量的Fe(NO3)2、Cu(NO3)2和AgNO3混合溶液中,充分反应后过滤,在不同情况下对滤渣或滤液成分的说法,错误的是
A.若滤液中只含一种溶质,滤渣一定含有Ag、Cu、Fe,可能含有Zn
B.当滤液含两种溶质时,滤渣一定含有Ag、Cu,可能含有Fe,一定不含Zn
C.向所得滤渣中滴加稀盐酸无气泡生成,滤渣一定含Ag,可能含Cu,一定不含Fe和Zn
D.若滤渣中有红色固体,滤液一定含有Zn(NO3)2、Fe(NO3)2,一定不含AgNO3、Cu(NO3)2
5.向100gCuSO4溶液中先逐渐加入一定量锌粉,再逐渐加入铁粉,测得剩余固体质量与加入金属质量关系如图。下列说法正确的是
A.a点对应的溶液为蓝色
B.n=6.5,m=9.6
C.b点对应的固体中加稀盐酸,有气泡产生
D.100gCuSO4溶液中CuSO4的质量为24g
6.为预防金属制品锈蚀,下列措施或做法不当的是
A.用钢丝球清除铝锅内的氧化层
B.在铁制门窗表面喷涂油漆
C.在铁制水管表面镀一层锌
D.将使用后的菜刀洗净擦干
7.下列关于资源、能源、环保方面的叙述不正确的是( )
A.由于全球气候变暖,所以要减少二氧化碳对空气的污染
B.地球表面约71%被水覆盖,但人们可直接利用的淡水资源不到水储量的1%
C.地球上的金属资源广泛地存在于地壳和海洋中,地壳中含量最多的金属元素是铝元素
D.节约用水和防治水体污染是保护水资源的有效途径
8.等质量的铁和锌两种金属,分别与相同浓度的足量稀盐酸反应,生成氢气的质量和反应时间的关系如图所示,则下列说法中不正确的是( )
A.M、N中较活泼的金属是N B.N表示金属铁
C.M、N中产生氢气较多的是M D.N表示金属锌
9.根据下图实验流程,下列分析正确的是
A.滤液中一定有硝酸镁,可能有硝酸锌和硝酸亚铁
B.滤渣中一定有银和铜,可能有锌
C.滤渣中一定有银和铜,可能有镁
D.滤液中一定有硝酸镁和硝酸锌,可能有硝酸铜
10.下列图象能正确反映对应变化关系的是
A. 加热一定质量的高锰酸钾制氧气
B. 镁条在耐高温的密封(内含空气)容器中加热
C. 向一定量的稀硫酸中不断加入锌粒
D. 分别向同质量、同质量分数的稀盐酸中不断加入铁和铝
11.向硝酸银、硝酸铜、硝酸镁的混合溶液中加入一定质量的锌,充分反应后过滤,得到滤渣A和滤液B.下列说法正确的是( )
A.滤渣中一定含有银,可能含有铜 B.滤渣中一定含有银,可能含有铜和镁
C.滤液中一定含有硝酸镁与硝酸银 D.滤液中一定含有硝酸镁与硝酸银、硝酸铜
二、填空题
12.中华传统文化蕴含着丰富的化学知识,请从化学视角解释下列成语或诗词。
(1)“釜底抽薪”体现的灭火原理是 。
(2)“一叶春非绿,十里稻花香”说明分子的性质是 。
(3)“熬胆矾(硫酸铜)铁斧、久之亦化为铜”,发生反应的化学方程式为 。
13.金属材料的研发将大大提升我们的生活水平,促进社会的发展。
(1)物理性质:下列金属制品中,主要利用金属导热性的是 (填序号)。
A.金银首饰 B.铝合金门窗 C.铁炒锅 D.铜导线
(2)金属冶炼:炼铁的原理是利用一氧化碳的性质,请写出一氧化碳与氧化铁反应的化学方程式为 ;
(3)化学性质:西汉时期的《淮南万毕术》记载了“曾青得铁则化为铜”的工艺。化学兴趣小组的同学模拟了该“炼铜”方法。
①将铁粉加入适量硫酸铜溶液中,实验过程中发生的化学方程式为 ,由此可知金属活动性:铁 铜(填“大于”或“小于”);
②另取8.4g铁粉加入一定量的硫酸铜溶液中,可观察有红色固体产生,溶液变为浅绿色,充分反应后过滤、洗涤、干燥,得到9.2g固体。为进一步定量探究9.2g固体中各成分的质量情况,请设计实验验证。
实验操作 实验现象及数据分析 结论
9.2g的固体中铁粉的质量和铜粉的质量分别是 。
14.2022年北京冬奥会火种灯采用双层玻璃结构,在低温、严寒、大风等环境下不会熄灭。其创意源自于青铜器精品“中华第一灯”一一西汉长信宫灯。
(1)我国铜冶炼技术具有悠久的历史。《格致粗谈》记载“赤铜入炉甘石炼为黄铜,其色如金”,把赤铜(Cu2O)和炉甘石、木炭粉混合高温制得黄铜: 。则炉甘石主要成分X的化学式为 ,反应中体现还原性的物质是 (填化学式),根据反应产物可知黄铜中含有的金属有 (填化学式)。湿法炼铜的原理是: ,该反应中保持不变的原子团化学符号是 。
(2)学以致用,运用金属知识,用黄铜片(铜锌合金)做一幅北京冬奥会会徽的金属蚀刻画。
①采用什么溶液做反应蚀刻剂呢?
甲:硫酸铝溶液 乙:盐酸 丙:硝酸银溶液
你认为甲 (填能、不能)用做反应蚀刻剂
②用硝酸银溶液做蚀刻剂,写出发生反应的化学方程式 ;反应的基本类型是 反应。按照流程打磨--制模--蚀刻--清洗--抛光上色-涂膜完成。请画出蚀刻后废液中的粒子示意图 (水不需要表示出来,粒子数量比例不需要表现)
③蚀刻面完成以后,剩余一些黄铜废料,废物利用,测定黄铜中铜的含量。称取废黄铜片20.0g放入到200g质量分数为4.9%稀硫酸中两者恰好充分反应。计算该黄铜样品中铜的质量分数为 。
15.铁制品锈蚀的过程,实际上是铁与空气中的 和 等发生 反应.
16.将镁、锌、铁、铜四种金属放入等体积、同浓度的稀盐酸中,能观察到有气泡生成的是 ,其剧烈程度由强到弱的顺序是 ,不能观察到有气泡生成的是 ,有关化学方程式为 、 、 。由此可知,这四种金属的活动性由强到弱的顺序是 。
17.化学与人类生活息息相关,请应用所学的化学知识回答下列问题:
(1)每年的3月22日是“世界水日”,水与人类的生活和生产密切相关。
①生活中存在硬水和软水,可以用 区分硬水和软水;
②硬水给生活和生产带来很大的不利,生活中通过 来降低水的硬度,上图是小芳同学自制的简易净水装置,其中石英砂的作用是 。
(2)铁是应用最广泛的金属。
①生活中用铁作炊具,主要利用了铁的延展性和 性。
②铁制品锈蚀的过程,实际上是铁跟空气中的 等发生了化学反应。为防止铁锅生锈,通常采取的措施是 (写一条)。
③在AgNO3、Cu(NO3)2的混合溶液中加入一定量的锌粉,充分反应后过滤,得到滤渣和滤液,若滤液呈无色,则滤渣中一定含有的物质是 (填化学式)。
三、实验题
18.原煤在氧气中不完全燃烧会生成CO、CO2的混合气体。同学们在实验室欲用下图所示的装置检验生成的气体,准备了如下图所示的装置(其他仪器用品略)。
(1)装置A的作用是 。
(2)装置C中发生反应的化学方程式为 ;装置D中发生反应的化学方程式为 。
(3)上述装置组合后还有明显不足之处,你认为不足之处是 。
(4)为达到实验目的,将上述装置组合后进行实验,其接口顺序为:混合气体→ 。 (填“a~h”接口序号,装置可重复使用)]
19.早在春秋战国时期,我国就开始生产和使用铁器.工业上炼铁的原理是利用一氧化碳和氧化铁的反应.某化学兴趣小组利用如图装置进行实验探究,请按要求填空:
(1)A中观察到的现象是 ;
(2)实验结束后,应 (填序号)
①先熄灭酒精喷灯,继续通一氧化碳
②先停止通一氧化碳,再熄灭酒精喷灯
(3)写出试管B中发生反应的方程式 。
四、计算题
20.为测定某铜、锌合金中铜的质量分数,兴趣小组同学称取10g合金于烧杯中,将40g稀盐酸分四次加入,充分反应,测得实验数据如下表所示:
第一次 第二次 第三次 第四次
加入稀盐酸的质量(g) 10 10 10 10
烧杯中剩余物的质量(g) 19.96 29.92 39.90 49.90
(1)充分反应后产生气体的总质量 g。
(2)该铜、锌合金中铜的质量分数为多少?(写出计算过程)
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.D
【详解】A、钛合金与人体有很好的“相容性”,可制造人造骨,“物质一性质一用途”的说法正确;
B、石墨具有导电性,可用作电机,“物质一性质一用途”的说法正确;
C、活性炭具有疏松多孔的结构,有良好的吸附性,可除去冰箱里的异味,“物质一性质一用途”的说法正确;
D、一氧化碳具有可燃性,可用作燃料,“物质一性质一用途”的说法错误;
答案:D。
2.D
【详解】试题分析:在金属活动顺序表中,铁在氢的前边,所以铁能与稀硫酸反应,生成硫酸亚铁和氢气;所以铁钉表面产生气泡、铁钉的质量减轻;稀硫酸通过反应变成硫酸亚铁溶液,溶液的质量增加;稀硫酸为无色溶液,硫酸亚铁溶液为浅绿色,故溶液由无色逐渐变为浅绿色
考点:铁与酸的反应
3.C
【分析】由微观示意图可知,甲醇和氧气生成二氧化碳和水,化学方程式。
【详解】A、该反应中,生成物是两种化合物,不属于置换反应,不符合题意;
B、该反应消耗物质甲和乙的质量比为:30:32=15:16,不符合题意;
C、由化学方程式可知,该反应前后,分子的数目没有改变,原子种类没有改变,符合题意;
D、氧气中氧元素0价,反应后氧元素-2价,化合价发生改变,不符合题意。
故选:C。
4.D
【分析】由于金属活动顺序是:Zn>Fe>Cu>Ag,将不同质量的锌粉加入到一定量的Fe(NO3)2、Cu(NO3)2和AgNO3混合溶液中,锌先与硝酸银反应生成了银和硝酸锌,当硝酸银完全反应后,锌再与硝酸铜反应生成了硝酸锌和铜,当硝酸铜完全反应后锌再与硝酸亚铁反应生成了硝酸锌和铁。
【详解】A、若滤液中只含一种溶质,就是硝酸锌,滤渣一定含有Ag、Cu、Fe,可能含有Zn,故正确;
B、当滤液含两种溶质时,溶质是硝酸锌和硝酸亚铁,滤渣一定含有Ag、Cu,可能含有Fe,一定不含Zn,故正确;
C、若向所得滤渣中滴加稀盐酸无气泡生成,滤渣一定含有Ag,可能含Cu,一定不含Fe和Zn,故正确;
D、若滤渣中有红色固体,红色固体是铜,滤液一定含有Zn(NO3)2,一定不含AgNO3、可能含有Cu(NO3)2和Fe(NO3)2,故错误。
故选D。
5.A
【详解】A、向硫酸铜中加一定量的锌粉,锌和硫酸铜反应生成硫酸锌和铜,再加入铁粉,铁和硫酸锌不反应,铁和硫酸铜反应生成硫酸亚铁和铜,图中出现3个转折点,0a段表示锌和硫酸铜反应,a点表示锌刚好消耗,ab表示铁和硫酸铜反应,b点表示硫酸铜刚好消耗,故a点含有硫酸铜,对应的溶液为蓝色,选项说法正确;
B、a点时,剩余固体为反应生成的铜,此时铜的质量为6.4g,锌和硫酸铜反应生成硫酸锌和铜,设锌的质量为x,
即n=6.5;
ab表示铁和硫酸铜反应,b点表示硫酸铜刚好消耗,设铁和硫酸铜反应生成的铜的质量为y,
m=9.6g +6.4g=16g,选项说法不正确;
C、b点硫酸铜和锌和铁恰好完全反应,对应的固体中只有铜,加稀盐酸,不反应,无气体生成,选项说法错误;
D、生成的铜的质量为16g,铜元素来自硫酸铜,故硫酸铜的质量为16g÷(×100%)=40g,故原溶液中CuSO4的质量40g,选项说法错误。
故选:A。
6.A
【详解】A、铝制品表面有一层氧化膜,对铝锅起保护作用,阻止铝被进一步氧化,所以擦去表面的氧化层是错误的做法,故A符合题意;
B、在铁制门窗表面喷涂油漆,使铁与氧气和水隔绝,有利于防锈,故B不符合题意;
C、在铁制水管表面镀一层锌,使铁与氧气和水隔绝,有利于防锈,故D不符合题意;
D、使用后的菜刀洗净擦干有利于防锈,故D不符合题意。
故应选A。
7.A
【详解】A、二氧化碳不是空气中的有害气体不会造成空气污染,A错;
B、地球表面约71%被水覆盖,但人们可直接利用的淡水资源不到水储量的1%,B正确;
C、地球上的金属资源广泛地存在于地壳和海洋中,地壳中含量最多的金属元素是铝元素,C正确;
D、节约用水和防治水体污染是保护水资源的有效途径,D正确;
故选:A。
8.B
【详解】A、由图像可知,N的斜率大,N比M更活泼;故选项正确,但不符合题意。
B、由图像可知,N的斜率大,N比M更活泼;N表示锌,M表示铁;故选项错误,但符合题意。
C、由图像可知,M产生的氢气多,N产生的氢气少;故选项正确,但不符合题意。
D、由图像可知,N的斜率大,N比M更活泼;N表示锌,M表示铁;故选项正确,但不符合题意。
故选B。
9.B
【详解】根据金属活动性顺序的应用:位于前面的金属能把位于后面的金属从化合物的溶液中置换出来。向硝酸银、硝酸铜、硝酸镁的混合溶液中加入一定量的锌粉,锌先与硝酸银发生置换反应,再与硝酸铜反应,锌不能与硝酸镁反应。反应后向滤液中加入铁丝无明显现象,说明滤液中没有硝酸银和硝酸铜,即加入的锌已经将硝酸银和硝酸铜完全置换出来了且锌粉可能过量。即滤液中一定含有硝酸镁和硝酸锌,滤渣中一定含有铜和银,可含有锌。故选B。
10.C
【分析】解答图像类的题目抓住“三点一走势”,即首先看清楚横、纵坐标各表示的量,然后从起始点、转折点、终点还有量的变化趋势来进行分析解答
【详解】A、加热一定质量的高锰酸钾制氧气,还得到固体锰酸钾和二氧化锰,故当反应结束时,剩余的固体质量不会为0,错误;
B、根据质量守恒定律,镁条在耐高温的密封(内含空气)容器中加热,那么容器内物质的总质量不变,错误;
C、向一定量的稀硫酸中不断加入锌粒,生成的氢气质量随着反应时间不断增大,直至反应结束后不变,正确;
D、根据金属的活动性,Al的活动性大于Fe,故反应速率Al应更快,反应所需时间也更短,错误;
故选C。
11.A
【分析】锌的金属活动性比银、铜强,比镁弱;向硝酸银、硝酸铜、硝酸镁的混合溶液中加入一定质量的锌,不能与硝酸镁溶液反应;锌先与硝酸银溶液反应生成硝酸锌溶液和银,硝酸银反应完,若还有锌粉,锌才能与硝酸铜溶液反应生成硝酸锌溶液和铜。
【详解】A、滤渣中一定含有银,可能含有铜,故选项说法正确。
B、滤渣中一定含有银,可能含有铜,不可能含有镁,故选项说法错误。
C、滤液中一定含有硝酸镁,不一定含有硝酸银,故选项说法错误。
D、滤液中一定含有硝酸镁,不一定含有硝酸银、硝酸铜,故选项说法错误。
故选A。
12.(1)隔绝可燃物
(2)分子在做无规则的运动
(3)
【详解】(1)“釜底抽薪”就是将柴火移走,所以体现的灭火原理是隔绝可燃物。
(2)能够闻到花香,说明分子在做无规则的运动。
(3)“熬胆矾(硫酸铜)铁斧、久之亦化为铜”,发生反应为铁和硫酸铜反应生成硫酸亚铁和铜,对应的化学方程式为。
13.(1)C
(2)Fe2O3+3CO2Fe+3CO2
(3) Fe+CuSO4=FeSO4+Cu 大于 取固体,加入过量的稀盐酸 固体部分溶解,且有气泡产生;生成氢气0.1g 铁2.8g、铜6.4g
【详解】(1)A、金银具有良好的延展性,则可以加工成各种首饰,该性质与导热性无关;
B、铝合金密度小硬度大,则适合用于加工成门窗,该性质与导热性无关;
C、铁具有良好的导热性,则可以加工制成砂锅;
D、铜具有良好的导电性,则可以加工制成导线,该性质与导热性无关;
故选C;
(2)一氧化碳与氧化铁在高温下反应生成铁与二氧化碳,化学反应方程式为:Fe2O3+3CO2Fe+3CO2;
(3)①铁能与硫酸铜反应生成硫酸亚铁与铜,化学反应方程式为:Fe+CuSO4=FeSO4+Cu;铁能置换出硫酸铜中的铜,则金属活动性铁大于铜;
②5.6g铁粉反应后固体增加的质量为9.2g-8.4g=0.8g
根据化学反应方程式分析可知
则反应后Fe剩余质量为8.4g-5.6g=2.8g,生成的铜的质量为6.4g;
设2.8gFe与稀盐酸完全反应后产生氢气的质量为x
x=0.1g
Fe能与稀盐酸反应生成氯化亚铁与氢气;则可以设计实验:取固体,加入过量的稀盐酸,观察到固体部分溶解,且有气泡产生;
根据上述分析可知生成氢气0.1g;9.2g的固体中铁粉的质量和铜粉的质量分别是铁2.8g、铜6.4g。
14.(1) ZnCO3 C Zn、Cu
(2) 不能 Zn+2AgNO3=Zn(NO3)2+2Ag 置换 解:设黄铜样品中锌的质量为x
x=6.5g
则该黄铜样品中铜的质量分数为:
答:该黄铜样品中铜的质量分数为67.5%
【详解】(1)根据质量守恒定律,化学反应前后,原子的种类和数目不变,反应物中含Cu、Zn、C、O的个数分别是2、0、1、1,生成物中含Cu、Zn、C、O的个数分别是2、1、2、4,故反应物中还应含1个Zn、1个C、3个O,故X的化学式为:ZnCO3;
在该反应中,碳得到氧,体现了还原性,故填:C;
反应产物中含Zn、Cu两种金属,故黄铜中含有的金属有Cu、Zn;
由化学方程式可知,该反应的实质是铁原子和铜离子反应生成亚铁离子和铜原子,硫酸根离子保持不变,故填:;
(2)①铝比铜、锌活泼,铜、锌与硫酸铝均不反应,故甲不能用作反应蚀刻剂;
②用硝酸银溶液做蚀刻剂,锌与硝酸银反应生成硝酸锌和银,该反应的化学方程式为:,铜和硝酸银反应生成硝酸铜和银,该反应的化学方程式为:,这两个反应均符合“两种化合物互相交换成分生成另外两种化合物”的反应,属于置换反应;
锌和硝酸银反应生成硝酸锌和银,铜和硝酸银反应生成硝酸铜和银,故蚀刻后废液中一定含铜离子、锌离子、硝酸根离子,故填: ;
③见答案。
15.①氧气
②水
③化学
【详解】铁制品锈蚀,实际上是铁与空气中的氧气、水等发生化学反应,生成氧化铁,
故答案为氧气;水;化学。
16. 镁、锌、铁 镁、锌、铁 铜 Mg+2HCl=MgCl2+H2↑ Zn+2HCl=ZnCl2+H2↑ Fe+2HCl=FeCl2+H2↑ 镁>锌>铁>铜
【详解】金属活动性顺序中,排在氢前面的金属能与稀盐酸反应,金属活动性越强,反应越剧烈。
将镁、锌、铁、铜四种金属放入等体积、同浓度的稀盐酸中,能观察到有气泡生成的是镁、锌、铁,其剧烈程度由强到弱的顺序是:镁、锌、铁,不能观察到有气泡生成的是铜,有关化学方程式为:Mg+2HCl=MgCl2+H2↑、Zn+2HCl=ZnCl2+H2↑、Fe+2HCl=FeCl2+H2↑ 。
由此可知,这四种金属的活动性由强到弱的顺序是:镁>锌>铁>铜。
17.(1) 肥皂水 煮沸 过滤
(2) 导热 氧气和水 保持铁锅表面清洁、干燥 Ag和Cu
【详解】(1)①通常用肥皂水来区分硬水和软水,肥皂水在硬水中易起浮渣,在软水中泡沫较多;
②可溶性钙、镁化合物在加热时,能形成沉淀,故生活中常用煮沸的方法降低水的硬度;
简易净水器中,石英砂的作用是:过滤,除去难溶性杂质;
(2)①生活中用铁作炊具,主要利用了铁的延展性和导热性;
②铁制品锈蚀的过程,实际上是铁跟空气中的氧气和水等发生了化学反应;
防止铁锅生锈,可以隔绝氧气和水,如保持铁锅表面清洁、干燥;
③金属活动性:Zn>Cu>Ag,在硝酸银、硝酸铜的混合溶液中加入一定量的锌粉,锌先与硝酸银反应生成硝酸锌和银,待硝酸银完全反应后,锌和硝酸铜反应生成硝酸锌和铜,充分反应后过滤,得到滤渣和滤液,若滤液呈无色,说明硝酸铜已经完全反应,则滤渣中一定含铜和银,可能含锌,故填:Cu、Ag。
18. 除水蒸气
没有进行尾气处理 ef→cd→ef→ba→gh→ef
【详解】(1)A中的浓硫酸可以吸收水分,故答案为:除水蒸气;
(2)C中的石灰水能用于检验二氧化碳的存在,化学反应方程式是:,D用于一氧化碳的检验
(3)因CO有毒,排放后会污染空气,但装置中没有进行尾气处理;
(4)将混合气体先通过ef检验二氧化碳的存在,再通过cd使二氧化碳被NaOH溶液完全吸收,再次通过ef看是否还有二氧化碳,再通过ba吸收可能存在的水分,再将剩余的CO通过gh,最后再次用ef检验是否有二氧化碳生成。
故答案为:ef→cd→ef→ba→gh→ef。
19.(1)红棕色粉末逐渐变黑
(2)①
(3)CO2+Ca(OH)2═CaCO3↓+H2O
【分析】(1)
一氧化碳和氧化铁高温生成铁和二氧化碳,现象为红棕色粉末逐渐变黑,故填:红棕色粉末逐渐变黑。
(2)
实验结束后,应先熄灭酒精喷灯,继续通一氧化碳,防止铁在高温下和氧气发生氧化,故选:①。
(3)
二氧化碳和氢氧化钙生成碳酸钙和水,澄清石灰水变浑浊,故填:CO2+Ca(OH)2═CaCO3↓+H2O。
20.(1)0.10
(2)解:设10克铜锌合金中锌的质量为x
x=3.25g
答:铜锌合金中铜的质量分数为67.5%。
【详解】(1)第一次生成气体的质量为20g-19.96g=0.04g;第二次生成气体的质量为30g-29.92g=0.08g;第三次生成气体的质量为40-39.9g=0.1g;第四次生成气体的质量为50g-49.9g=0.1g,说明第三次实验锌就已经反应完了。
(2)详解见答案
答案第1页,共2页
答案第1页,共2页
同课章节目录
- 第一单元 金属和金属材料
- 课题1 金属材料
- 课题2 金属的化学性质
- 课题3 金属资源的利用和保护
- 实验活动1 金属的物理性质和某些化学性质
- 第二单元 溶液
- 课题1 溶液的形成
- 课题2 溶解度
- 课题3 溶液的浓度
- 实验活动2 一定溶质质量分数的氯化钠溶液的配制
- 第三单元 酸和碱
- 课题1 常见的酸和碱
- 课题2 酸和碱的中和反应
- 实验活动3 酸、碱的化学性质
- 实验活动4 溶液酸碱性的检验
- 第四单元 盐 化肥
- 课题1 生活中常见的盐
- 课题2 化学肥料
- 实验活动5 粗盐中难溶性杂志的去除
- 第五单元 化学与生活
- 课题1 人类重要的营养物质
- 课题2 化学元素与人体健康
- 课题3 有机合成材料
- 旧版目录
- 课题3 溶质的质量分数
- 课题2 酸和碱之间会发生什么反应
