第四章 化学反应与电能 复习课件(共37张PPT)
文档属性
| 名称 | 第四章 化学反应与电能 复习课件(共37张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 3.7MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-20 10:27:20 | ||
图片预览






文档简介
(共33张PPT)
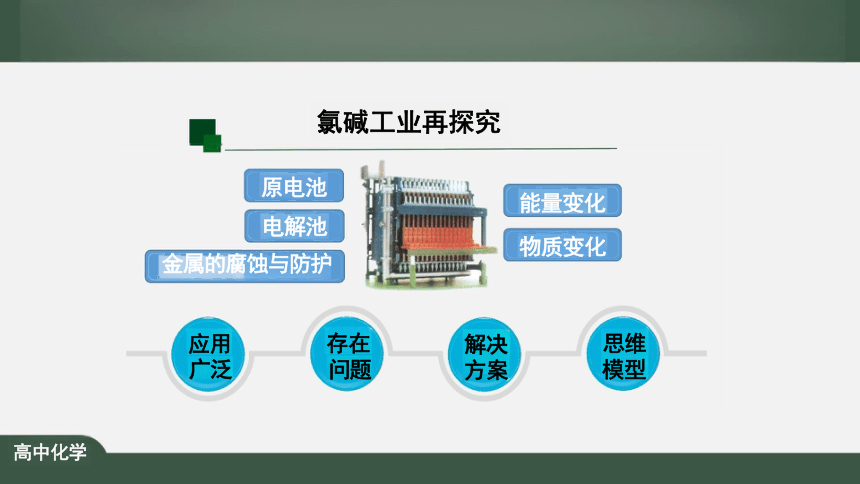
化学反应与电能复习
高中化学
原电池
电解池
金属的腐蚀与防护
能量变化
物质变化
氯碱工业再探究
存在 问题
思维 模型
解决 方案
应用 广泛
高中化学
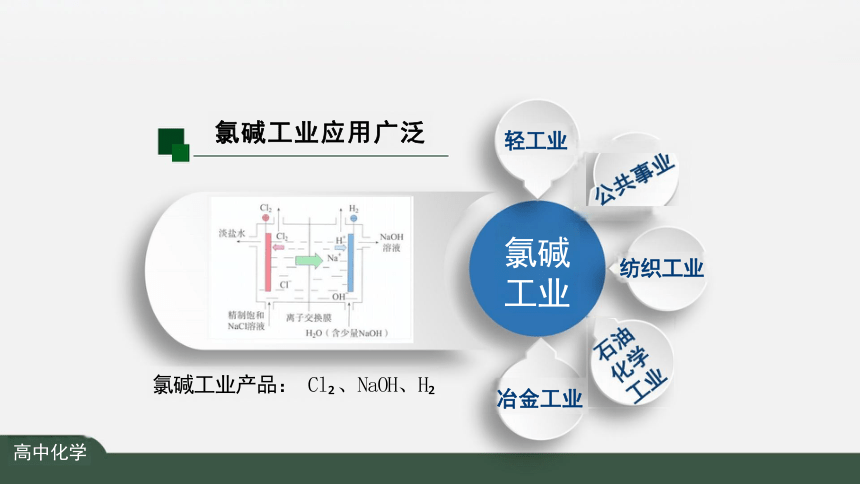
氯碱工业产品: Cl 、NaOH、H
高中化学
氯碱工业应用广泛
氯碱 工业
冶金工业
纺织工业
轻工业
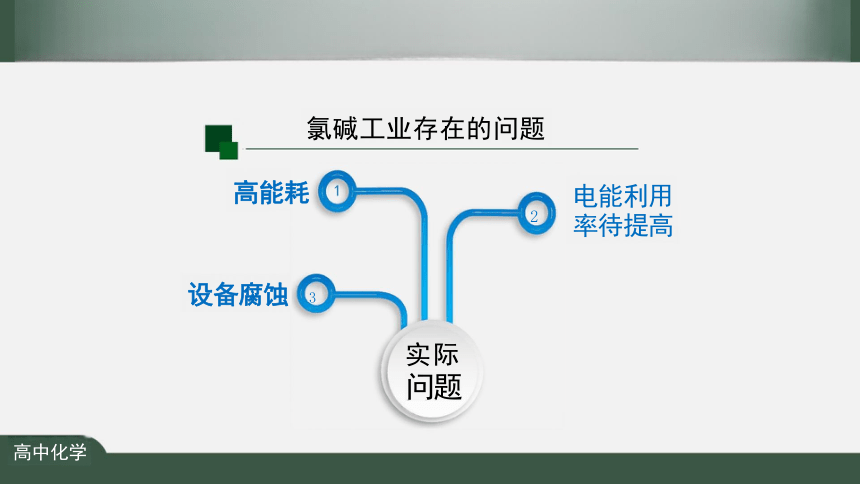
氯碱工业存在的问题
高能耗
2
设备腐蚀 3
实际 问题
高中化学
电能利用 率待提高
思考角度
能量 能量转化率低。
物质 用领域更广。
高中化学
传统供能方式为火力发电,
氯气和烧碱相对于氢气应
如何降低氯碱工业的能耗
问题的提出
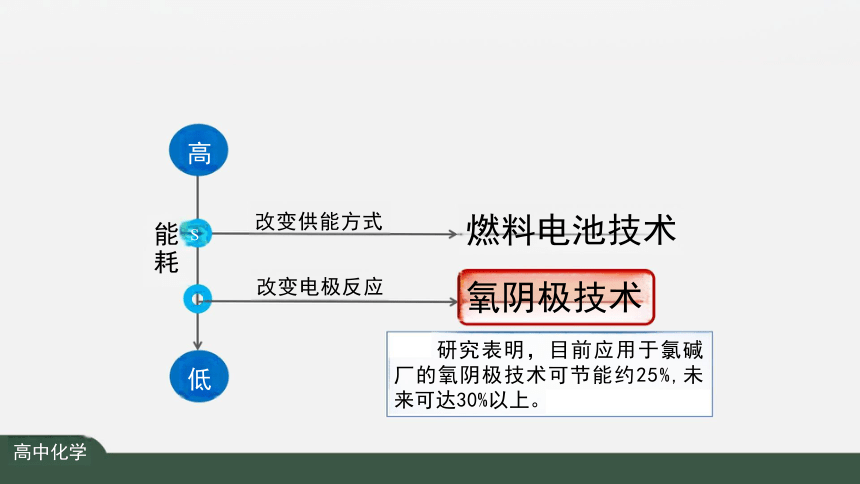
研究表明,应用于氯碱厂的 氢燃料电站可节能约30%(20%的 电能,10%的热能)。
燃料电池技术
氧阴极技术
研究表明,目前应用于氯碱 厂的氧阴极技术可节能约25%,未 来可达30%以上。
低
高中化学
改变供能方式
改变电极反应
能耗
高
任务一基于电化学原理设计装置
高中化学
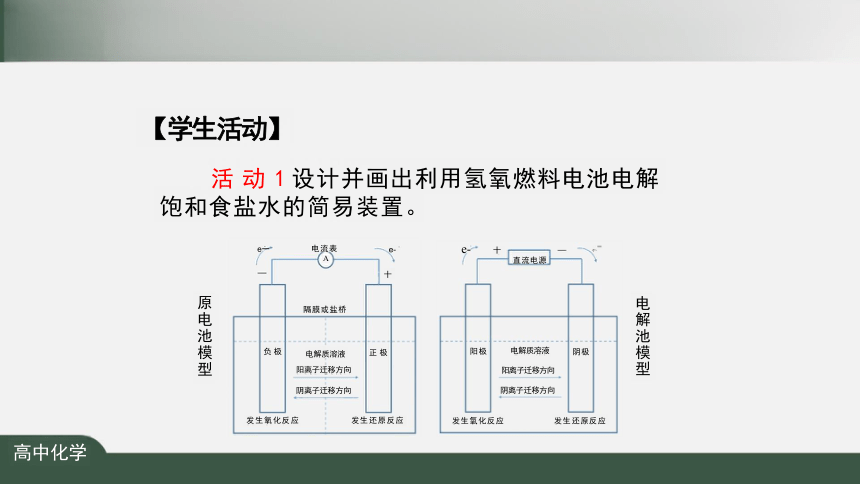
【学生活动】
活 动 1 设计并画出利用氢氧燃料电池电解 饱和食盐水的简易装置。
电流表
A
十
隔膜或盐桥
电解质溶液
阳离子迁移方向
阴离子迁移方向
发生氧化反应 发生还原反应
e- 十
直流电源
电解质溶液
阳离子迁移方向
阴离子迁移方向
发生氧化反应 发生还原反应
高中化学
原电池模型
电解池模型
正 极
负 极
阳极
阴极
e一
e-
e~
质子交换膜 精制饱和
H 空气 (O ) NaCl溶液 H O ( 含 少 量NaOH)
高中化学
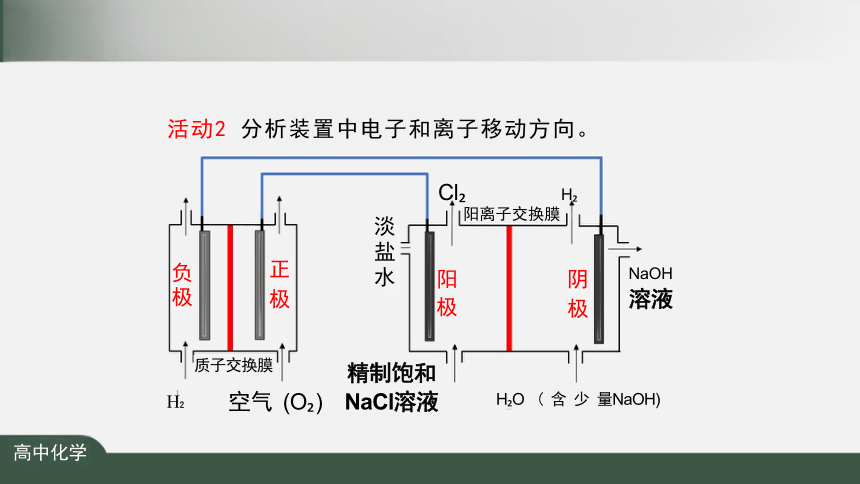
活动2 分析装置中电子和离子移动方向。
Cl H 阳离子交换膜
阳 极
淡盐水
NaOH
溶液
正 极
阴 极
负极
NaOH
主 Na+ 溶液
精制饱和
H 空气 (O ) NaCl溶液 H O ( 含 少 量NaOH)
负极: H -2e-=2H + 阳极: 2Cl--2e-=Cl ↑
正极: O +4e +4H+ =2H 0 阴极: 2H O+2e=H ↑+20H-
高中化学
e~
e Cl H
阳离子交换膜
阳 极
淡盐水
质子交换膜
负极
阴 极
正 极
【学生活动】
活动3 . 用化学用语回答下列问题。
1.燃料电池负极反应为H -2e-=2H-。
2. 若将燃料电池电解质溶液换成 KOH 溶液,则正极
反应方程式为 O +4e-+2H O =40H- o
3. 电解NaCl溶液总反应方程式为
2NaCI+2H 0 生解2NaOH+H ↑+Cl T
4. 若燃料电池有2mol氢气反应,理论上生成NaOH的 物质的量为4 mol。
高中化学
高
S
低
高中化学
研究表明,目前应用于氯碱 厂的氧阴极技术可节能约25%,未 来可达30%以上。
燃料电池技术
氧阴极技术
改变供能方式
改变电极反应
能耗
【资料】氧阴极技术与传统工艺相比不同
之处在于阴极结构,通过向阴极区供应纯氧, 避免H+直接得电子生成氢气。这样可降低电解 电压,电耗减少明显。
任务二分析氧阴极技术
高中化学
【学生活动】
活动1 写出阴极反应及总反应方程式。
阴极反应:
O +4e-+2H O =40H-
总反应:
4NaCl+2H O+O 电 2Cl +4NaOH
高中化学
【学生活动】
活动2 结合资料分析氧阴极技术的优缺点。
思考角度
能量 能耗降低 优点
物质 做原料 缺点
高中化学
氧
H
纯
物
要
产
需
了
极
少
阴
减
氯碱工业存在问题及解决方法
高能耗 电能利用
燃料电池技术 2 率待提高
氧阴极技术
设备腐蚀 3
实际
问题
高中化学
思考角度
能量 电能部分转化为热能。
电能转变为化学能过程中的
物质 物质不完全是目标产物。
高中化学
如何提高电能利用率
问题的提出
任务三探究降低阳极氧含量的方法
高中化学
【学生活动】
活动1 分析电解池阳极0 来源。
思考1 电解池阳极发生的反应。
2Cl--2e- =Cl ↑ 40H--4e-=0 ↑+2H O
0 来源:
实际电解生产中,离子膜的效率并不
是百分之百,阴极室的OH 会迁移至阳极室,
在阳极放电,产生0 。
高中化学
【学生活动】
活动2 分析并提出避免0H-在阳极放电的方法。
思考2 影响离子放电因素:
内因:离子本身性质
外因: 浓度、pH、温度、电极材料等。
高中化学
【学生活动】
活动2 分析并提出避免0H-在阳极放电的方法。
提高Cl-浓度
使 用精制饱和食盐水做原料
降低0H-浓度
更换离子交换膜
向阳极室加入盐酸调节pH
高中化学
浓度
1.Cl 中含氧量增加。 2. 生成具有腐蚀性 的次氯酸盐、氯酸盐 等。
1. 离子膜易被损伤。 2. 阳极钝化(形成 致密氧化膜),电解 槽电压上升。
加酸过量
加酸不足
高中化学
pH=
【学生活动】
活动2 分析并提出避免0H-在阳极放电的方法。
提高CI-浓度
使用精制饱和食盐水做原料
降低OH-浓度
改换离子交换膜
向阳极室加入盐酸调pH 3~4
高中化学
浓度
【学生活动】
活动2 分析并提出避免0H-在阳极放电的方法。
思考3 是否还有其他可行的方法
电子导体
电极材料
电极反应
离子导体
浓度
pH
高中化学
Cl-
OH-
【学生活动】
活动2 分析并提出避免0H-在阳极放电的方法。
【拓展】 石墨电极
高稳定性
高导电性
钛基氧化物涂层
高中化学
(TiO /RuO )电极 高催化活性
电极材料
高选择性
电能利用 2 率待提高
浓度、pH、
电极材料、
离子交换膜等
实际
问题
高能耗 1
燃料电池技术 氧阴极技术
设备腐蚀 3
氯碱工业存在问题及解决方法
高中化学
如何解决设备腐蚀问题
问题的提出
氯气
碱
酸
盐水
高中化学
任务四分析并提出防腐措施
【资料】 流动和搅拌的盐水 很容易带入 氧气,这使得输送盐水的碳钢管道非常容易 发生电化学腐蚀。腐蚀速度受氧含量和盐水 温度影响很大。
高中化学
【学生活动】
活动1 写出碳钢管发生电化学腐蚀的电极反应。
负极反应: Fe-2e-=-Fe +
正极反应: O +2H O+4e- =40H-
高中化学
【学生活动】
活动2 提出防腐措施。
4 改变金属材料组成
将碳钢管道替换成更耐腐蚀的钛合金管
防腐
措施 2 在金属表面覆盖保护层
在金属构件表面涂绝缘涂层
3 电化学保护法
高中化学
【学生活动】
活动2 提出防腐措施。
电化学保护法:牺牲阳极法
至氯气总管
牺牲电极
淡盐水来自电解槽 CPVC管
与进口牺牲电极处接地线相连
至阳极液槽
CPVC管 淡盐水来自电解槽
高中化学
牺牲电极
TA2
高能耗 1
燃料电池技术 氧阴极技术
设备腐蚀 3
钛合金管
涂绝缘层
牺牲阳极
高中化学
电能利用 2 率待提高
浓度、pH、
电极材料、
离子交换膜等
实际
问题
氯碱工业存在问题及解决方法
能量变化
化学反应
物质变化
高中化学
原电池
电极材料
电极反应
离子导体
电子导体
电解池
控制
浓度
温度
pH
电极材料
离子交换膜
■■■■■
装置
小结
化学反应与电能复习
高中化学
原电池
电解池
金属的腐蚀与防护
能量变化
物质变化
氯碱工业再探究
存在 问题
思维 模型
解决 方案
应用 广泛
高中化学
氯碱工业产品: Cl 、NaOH、H
高中化学
氯碱工业应用广泛
氯碱 工业
冶金工业
纺织工业
轻工业
氯碱工业存在的问题
高能耗
2
设备腐蚀 3
实际 问题
高中化学
电能利用 率待提高
思考角度
能量 能量转化率低。
物质 用领域更广。
高中化学
传统供能方式为火力发电,
氯气和烧碱相对于氢气应
如何降低氯碱工业的能耗
问题的提出
研究表明,应用于氯碱厂的 氢燃料电站可节能约30%(20%的 电能,10%的热能)。
燃料电池技术
氧阴极技术
研究表明,目前应用于氯碱 厂的氧阴极技术可节能约25%,未 来可达30%以上。
低
高中化学
改变供能方式
改变电极反应
能耗
高
任务一基于电化学原理设计装置
高中化学
【学生活动】
活 动 1 设计并画出利用氢氧燃料电池电解 饱和食盐水的简易装置。
电流表
A
十
隔膜或盐桥
电解质溶液
阳离子迁移方向
阴离子迁移方向
发生氧化反应 发生还原反应
e- 十
直流电源
电解质溶液
阳离子迁移方向
阴离子迁移方向
发生氧化反应 发生还原反应
高中化学
原电池模型
电解池模型
正 极
负 极
阳极
阴极
e一
e-
e~
质子交换膜 精制饱和
H 空气 (O ) NaCl溶液 H O ( 含 少 量NaOH)
高中化学
活动2 分析装置中电子和离子移动方向。
Cl H 阳离子交换膜
阳 极
淡盐水
NaOH
溶液
正 极
阴 极
负极
NaOH
主 Na+ 溶液
精制饱和
H 空气 (O ) NaCl溶液 H O ( 含 少 量NaOH)
负极: H -2e-=2H + 阳极: 2Cl--2e-=Cl ↑
正极: O +4e +4H+ =2H 0 阴极: 2H O+2e=H ↑+20H-
高中化学
e~
e Cl H
阳离子交换膜
阳 极
淡盐水
质子交换膜
负极
阴 极
正 极
【学生活动】
活动3 . 用化学用语回答下列问题。
1.燃料电池负极反应为H -2e-=2H-。
2. 若将燃料电池电解质溶液换成 KOH 溶液,则正极
反应方程式为 O +4e-+2H O =40H- o
3. 电解NaCl溶液总反应方程式为
2NaCI+2H 0 生解2NaOH+H ↑+Cl T
4. 若燃料电池有2mol氢气反应,理论上生成NaOH的 物质的量为4 mol。
高中化学
高
S
低
高中化学
研究表明,目前应用于氯碱 厂的氧阴极技术可节能约25%,未 来可达30%以上。
燃料电池技术
氧阴极技术
改变供能方式
改变电极反应
能耗
【资料】氧阴极技术与传统工艺相比不同
之处在于阴极结构,通过向阴极区供应纯氧, 避免H+直接得电子生成氢气。这样可降低电解 电压,电耗减少明显。
任务二分析氧阴极技术
高中化学
【学生活动】
活动1 写出阴极反应及总反应方程式。
阴极反应:
O +4e-+2H O =40H-
总反应:
4NaCl+2H O+O 电 2Cl +4NaOH
高中化学
【学生活动】
活动2 结合资料分析氧阴极技术的优缺点。
思考角度
能量 能耗降低 优点
物质 做原料 缺点
高中化学
氧
H
纯
物
要
产
需
了
极
少
阴
减
氯碱工业存在问题及解决方法
高能耗 电能利用
燃料电池技术 2 率待提高
氧阴极技术
设备腐蚀 3
实际
问题
高中化学
思考角度
能量 电能部分转化为热能。
电能转变为化学能过程中的
物质 物质不完全是目标产物。
高中化学
如何提高电能利用率
问题的提出
任务三探究降低阳极氧含量的方法
高中化学
【学生活动】
活动1 分析电解池阳极0 来源。
思考1 电解池阳极发生的反应。
2Cl--2e- =Cl ↑ 40H--4e-=0 ↑+2H O
0 来源:
实际电解生产中,离子膜的效率并不
是百分之百,阴极室的OH 会迁移至阳极室,
在阳极放电,产生0 。
高中化学
【学生活动】
活动2 分析并提出避免0H-在阳极放电的方法。
思考2 影响离子放电因素:
内因:离子本身性质
外因: 浓度、pH、温度、电极材料等。
高中化学
【学生活动】
活动2 分析并提出避免0H-在阳极放电的方法。
提高Cl-浓度
使 用精制饱和食盐水做原料
降低0H-浓度
更换离子交换膜
向阳极室加入盐酸调节pH
高中化学
浓度
1.Cl 中含氧量增加。 2. 生成具有腐蚀性 的次氯酸盐、氯酸盐 等。
1. 离子膜易被损伤。 2. 阳极钝化(形成 致密氧化膜),电解 槽电压上升。
加酸过量
加酸不足
高中化学
pH=
【学生活动】
活动2 分析并提出避免0H-在阳极放电的方法。
提高CI-浓度
使用精制饱和食盐水做原料
降低OH-浓度
改换离子交换膜
向阳极室加入盐酸调pH 3~4
高中化学
浓度
【学生活动】
活动2 分析并提出避免0H-在阳极放电的方法。
思考3 是否还有其他可行的方法
电子导体
电极材料
电极反应
离子导体
浓度
pH
高中化学
Cl-
OH-
【学生活动】
活动2 分析并提出避免0H-在阳极放电的方法。
【拓展】 石墨电极
高稳定性
高导电性
钛基氧化物涂层
高中化学
(TiO /RuO )电极 高催化活性
电极材料
高选择性
电能利用 2 率待提高
浓度、pH、
电极材料、
离子交换膜等
实际
问题
高能耗 1
燃料电池技术 氧阴极技术
设备腐蚀 3
氯碱工业存在问题及解决方法
高中化学
如何解决设备腐蚀问题
问题的提出
氯气
碱
酸
盐水
高中化学
任务四分析并提出防腐措施
【资料】 流动和搅拌的盐水 很容易带入 氧气,这使得输送盐水的碳钢管道非常容易 发生电化学腐蚀。腐蚀速度受氧含量和盐水 温度影响很大。
高中化学
【学生活动】
活动1 写出碳钢管发生电化学腐蚀的电极反应。
负极反应: Fe-2e-=-Fe +
正极反应: O +2H O+4e- =40H-
高中化学
【学生活动】
活动2 提出防腐措施。
4 改变金属材料组成
将碳钢管道替换成更耐腐蚀的钛合金管
防腐
措施 2 在金属表面覆盖保护层
在金属构件表面涂绝缘涂层
3 电化学保护法
高中化学
【学生活动】
活动2 提出防腐措施。
电化学保护法:牺牲阳极法
至氯气总管
牺牲电极
淡盐水来自电解槽 CPVC管
与进口牺牲电极处接地线相连
至阳极液槽
CPVC管 淡盐水来自电解槽
高中化学
牺牲电极
TA2
高能耗 1
燃料电池技术 氧阴极技术
设备腐蚀 3
钛合金管
涂绝缘层
牺牲阳极
高中化学
电能利用 2 率待提高
浓度、pH、
电极材料、
离子交换膜等
实际
问题
氯碱工业存在问题及解决方法
能量变化
化学反应
物质变化
高中化学
原电池
电极材料
电极反应
离子导体
电子导体
电解池
控制
浓度
温度
pH
电极材料
离子交换膜
■■■■■
装置
小结
