2024届高三化学二轮复习专题突破练3:氧化还原反应、离子反应(含解析)
文档属性
| 名称 | 2024届高三化学二轮复习专题突破练3:氧化还原反应、离子反应(含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 213.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-18 00:38:40 | ||
图片预览




文档简介
专题突破练3 氧化还原反应、离子反应
一、基础练
1.(2023·衡水重点中学二模)下列颜色变化与氧化还原反应有关的是( )
A.硫酸铜溶液中滴加氨水,先得到蓝色沉淀,后沉淀溶解得到深蓝色溶液
B.黄色的K2CrO4溶液中滴加稀硫酸,溶液由黄色变为橙色
C.KI溶液滴入AgCl浊液中,沉淀由白色逐渐变为黄色
D.新切开的苹果在空气中颜色变暗淡
2.(2023·湖北冲刺模拟)常温下,下列各组离子在指定溶液中一定能大量共存的是( )
A.中性溶液中:Na+、SO、Fe3+、Cl-
B.c(H+)/c(OH-)=10-12的溶液中:[Ag(NH3)2]+、Ba2+、NO、Cl-
C.c(AlO)=0.1 mol/L的溶液中:Na+ 、K+、HCO、Cl-
D.遇甲基橙显红色的溶液中:K+、Ba2+、NO、I-
3.(2023·保定模拟)已知反应:XeF4+2CH3CH===CH2―→2CH3CH2CHF2+Xe,下列有关说法正确的是( )
A.该反应不属于氧化还原反应
B.XeF4既是氧化剂,又是还原剂
C.反应中电子由Xe转移到C
D.氧化剂与还原剂的物质的量之比为1∶2
4.(2023·重庆三次联诊)下列各组离子在指定溶液中一定能大量共存的是( )
A.氨水溶液中:K+、Cu2+、NO、SO
B.0.1 mol·L-1KI溶液中:Fe2+、NH、Cl-、SO
C.能使甲基橙变红的溶液中:Na+、NH、Cl-、S2O
D.0.1 mol·L-1 NaAlO2溶液中:Al3+、Na+、SO、NO
5.(2023·广州联考)关于反应5NaClO2+xHCl===yClO2+5NaCl+zH2O,下列说法不正确的是( )
A.x=4,y=4
B.该化学反应中HCl仅体现出了酸性
C.通过该反应可知氧化性:ClO2>NaClO2
D.该反应生成1 mol水,转移2NA个电子
6.(2023·浙江1月选考)下列反应的离子方程式不正确的是( )
A.Cl2通入氢氧化钠溶液:Cl2+2OH-===Cl-+ClO-+H2O
B.氧化铝溶于氢氧化钠溶液:Al2O3+2OH-===2AlO+H2O
C.过量CO2通入饱和碳酸钠溶液:2Na++CO+CO2+H2O===2NaHCO3↓
D.H2SO3溶液中滴入氯化钙溶液:SO+Ca2+===CaSO3↓
7.(2023·湖北名校联考)室温下,下列各组离子在指定溶液中能大量共存的是( )
A.滴入酚酞变红色的溶液:K+、Ca2+、HCO、CO
B.0.1 mol·L-1 Fe2(SO4)3溶液:Cu2+、NH、NO、SO
C.pH=1的溶液:Ba2+、K+、CH3COO-、NO
D.无色透明的溶液:Cu2+、Na+、SO、NO
8.(2023·河北部分学校冲刺练)实验室模拟工业处理含铬废水,操作及现象如图甲所示,反应过程中铬元素的化合价变化如图乙。已知:深蓝色溶液中生成了CrO5。
下列说法正确的是( )
A.0~5 s过程中,发生的离子反应为:Cr2O+H2O??2CrO+2H+
B.实验开始至30 s,溶液中发生的总反应离子方程式为Cr2O+3H2O2+8H+===Cr3++3O2↑+7H2O
C.30~80 s过程中,Cr元素被氧化,可能是溶解的氧气和剩余的H2O2所致
D.0~80 s时,溶液中含铬微粒依次发生氧化反应、还原反应和氧化反应
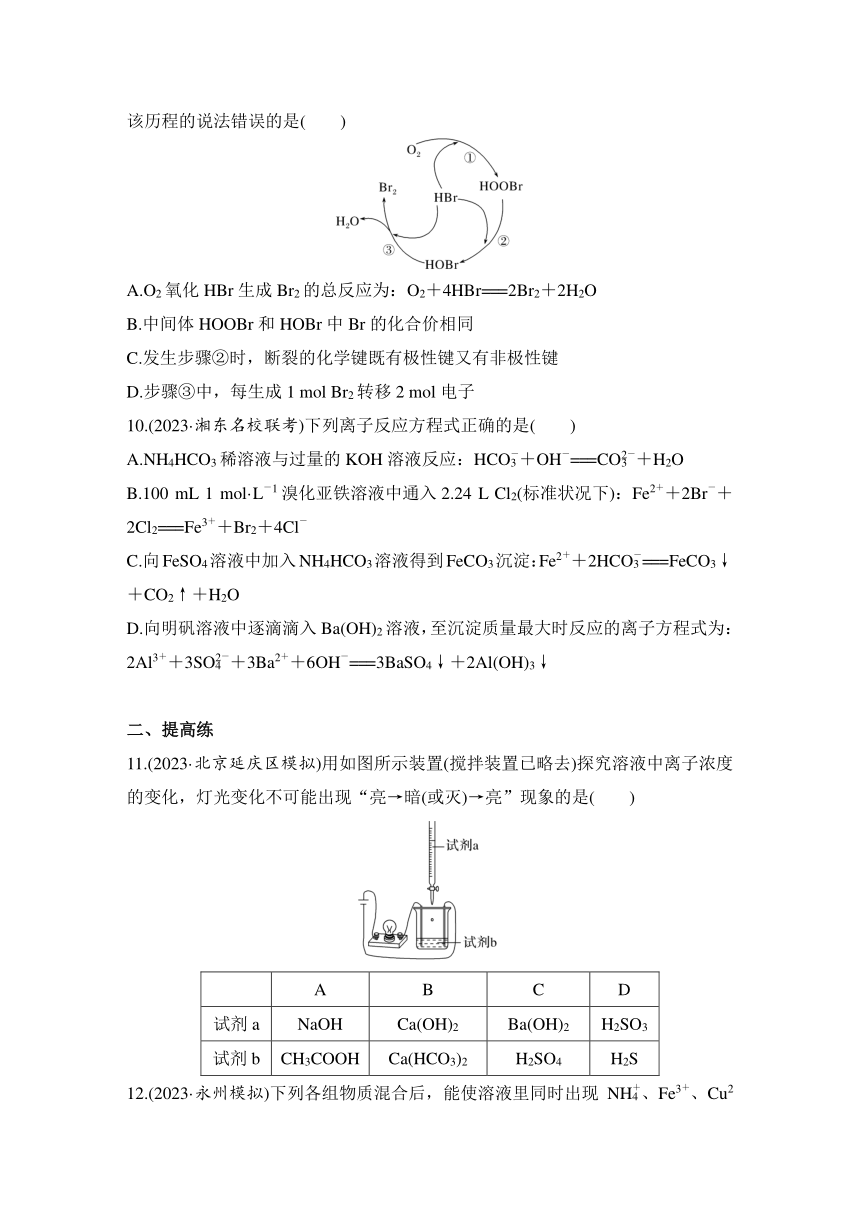
9.据文献报道,我国学者提出O2氧化HBr生成Br2反应历程如图所示。下列有关该历程的说法错误的是( )
A.O2氧化HBr生成Br2的总反应为:O2+4HBr===2Br2+2H2O
B.中间体HOOBr和HOBr中Br的化合价相同
C.发生步骤②时,断裂的化学键既有极性键又有非极性键
D.步骤③中,每生成1 mol Br2转移2 mol电子
10.(2023·湘东名校联考)下列离子反应方程式正确的是( )
A.NH4HCO3稀溶液与过量的KOH溶液反应:HCO+OH-===CO+H2O
B.100 mL 1 mol·L-1溴化亚铁溶液中通入2.24 L Cl2(标准状况下):Fe2++2Br-+2Cl2===Fe3++Br2+4Cl-
C.向FeSO4溶液中加入NH4HCO3溶液得到FeCO3沉淀:Fe2++2HCO===FeCO3↓+CO2↑+H2O
D.向明矾溶液中逐滴滴入Ba(OH)2溶液,至沉淀质量最大时反应的离子方程式为:2Al3++3SO+3Ba2++6OH-===3BaSO4↓+2Al(OH)3↓
二、提高练
11.(2023·北京延庆区模拟)用如图所示装置(搅拌装置已略去)探究溶液中离子浓度的变化,灯光变化不可能出现“亮→暗(或灭)→亮”现象的是( )
A B C D
试剂a NaOH Ca(OH)2 Ba(OH)2 H2SO3
试剂b CH3COOH Ca(HCO3)2 H2SO4 H2S
12.(2023·永州模拟)下列各组物质混合后,能使溶液里同时出现NH、Fe3+、Cu2+、Cl-和SO几种离子,且溶液不发生浑浊的一组是( )
A.CuCl2、NH4Cl、Fe2(SO4)3、NaNO3
B.(NH4)2SO4、CuSO4、Na2CO3、FeCl3
C.Cu(NO3)2、NH4NO3、FeCl3、H2S
D.BaCl2、Cu(NO3)2、(NH4)2SO4、Fe(NO3)3
13.(2023·永州适应性考试)下列离子方程式书写错误的是( )
A.向明矾溶液中加入少量氢氧化钡溶液:2Al3++3SO+3Ba2++6OH-===2Al(OH)3↓+3BaSO4↓
B.澄清石灰水中通入过量的二氧化碳:CO2+OH-===HCO
C.氢氧化镁固体溶解于氯化铵溶液:Mg(OH)2+2H+===Mg2++2H2O
D.SO2使酸性KMnO4溶液褪色:5SO2+2H2O+2MnO===5SO+4H++2Mn2+
14.(2023·洛阳一次联考)某溶液中可能含有K+、Na+、Mg2+、NH、Fe2+、Br-、CO、SO、SO中的若干种离子。某同学做了如下实验:①取少量溶液,滴加足量氯水,有气泡产生且溶液颜色变成黄色;②另取少量溶液,滴加盐酸酸化的氯化钡溶液,无沉淀生成;③蘸取原溶液,做焰色试验,透过蓝色钴玻璃观察到火焰呈紫色。为进一步确定该溶液的组成,无需进行的实验是( )
A.取少量溶液,滴加氯水和CCl4,振荡、静置
B.上述实验③不透过蓝色钴玻璃观察火焰颜色
C.取少量溶液,滴加适量的稀硫酸和品红溶液
D.取少量溶液,滴加适量浓NaOH溶液,加热,用湿润的红色石蕊试纸检验气体
15.(2023·聊城一模)向重铬酸盐酸性溶液中加入乙醚和H2O2,水层发生反应:Cr2O+4H2O2+2H+===2CrO5+5H2O(已知CrO5的结构为),乙醚层发生反应:CrO5+(C2H5)2O===CrO5·O(C2H5)2。反应上层出现蓝色,一段时间后溶液蓝色褪去,且水相变为绿色(Cr3+),下列说法正确的是( )
A.由水层反应可知,氧化性:Cr2O>CrO5
B.乙醚在检验过程中可用乙醇代替
C.CrO5·O(C2H5)2中不存在非极性键
D.水相变为绿色的离子反应为4CrO5+12H+===4Cr3++6H2O+7O2↑
16.(2023·郴州模拟)下列离子方程式错误的是( )
A.向NaClO溶液中通入少量SO2:2ClO-+SO2+H2O===2HClO+SO
B.高锰酸钾与浓盐酸反应制氯气:2MnO+10Cl-+16H+===2Mn2++5Cl2↑+8H2O
C.FeBr2通入少量的Cl2:2Fe2++Cl2===2Fe3++2Cl-
D.向Na2SO3的酸性溶液中加入Na2S:2S2-+SO+6H+===3S↓+3H2O
17.实验室中利用固体KMnO4进行如图实验,下列说法错误的是( )
A.G与H均为氧化产物
B.实验中KMnO4既是氧化剂又是还原剂
C.Mn元素至少参与了3个氧化还原反应
D.G与H的物质的量之和可能为0.25 mol
18.强酸性溶液X中可能含有Na+、K+、NH、Fe2+、Al3+、CO、SO、SO、Cl-中的若干种,某同学为了确认其成分,取X溶液进行连续实验,实验过程及产物如下:
下列结论正确的是( )
A.X中肯定存在Na+、Fe2+、Al3+、NH、SO
B.气体F经催化氧化可直接生成气体D
C.沉淀C一定是BaSO4、沉淀G一定是Fe(OH)3、沉淀I一定是Al(OH)3
D.X中不能确定的离子是Al3+、Na+、K+和Cl-
19.(2022·银川一中二模)下列离子方程式与实验对应不正确的是( )
选项 实验 离子方程式
A 向橙色K2Cr2O7溶液中加入NaOH溶液,溶液变黄色 Cr2O+2OH-===2CrO+H2O
B 向AgCl悬浊液中加Na2S溶液,有黑色难溶物生成 2AgCl+S2-===Ag2S+2Cl-
C 向NH4HCO3溶液中加入过量Ba(OH)2稀溶液,有白色沉淀产生 NH+HCO+Ba2++2OH-===BaCO3↓+NH3·H2O+H2O
D 向K2MnO4溶液(墨绿色)中加入适量醋酸,溶液变为紫色且有黑色沉淀生成 3MnO+4H+===2MnO+MnO2↓+2H2O
20.(2022·重庆八中模拟)一定量的FeS与足量的浓硝酸反应,反应后测得溶液中含有Fe3+和SO,同时生成NO2、NO的混合气体11.2 L(标准状况),这些气体与一定体积O2(标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸,若向溶液中加入足量的NaOH溶液,完全反应后,产生红褐色沉淀,过滤、洗涤、干燥沉淀,称重,质量为10.7 g,下列说法正确的是( )
A.参加反应的硝酸的物质的量为0.9 mol
B.混合气体中NO2与NO的体积之比是3∶2
C.此反应过程中转移的电子数为0.6NA
D.消耗的氧气体积为7.56 L(标况下)
参考答案
1.D [苹果中的有机物遇到空气被氧化变质,D项符合题意。]
2.B [A.Fe3+在pH为4左右沉淀完全,则中性溶液中不能大量存在Fe3+,故A项错误;B.该溶液呈碱性,[Ag(NH3)2]+、Ba2+、NO、Cl-、OH-之间不反应,能够大量共存,故B项正确;C.AlO与HCO能反应生成Al(OH)3和CO,不能大量共存,故C项错误;D.遇甲基橙显红色的溶液呈酸性,NO、I-在酸性溶液中发生氧化还原反应,不能大量共存,故D项错误。]
3.D [化合物间反应有单质生成的一定是氧化还原反应,A选项错误;F在化合物中的化合价只有-1价,因此XeF4中Xe为+4价,由此可确定XeF4为氧化剂,丙烯为还原剂,B选项错误;因为Xe的化合价降低了,所以电子应该从C转移到Xe,C选项错误;氧化剂是XeF4,还原剂是CH3CH===CH2,二者的物质的量之比为1∶2,D选项正确。]
4.B [Cu2+与氨水要反应,A不正确;在酸性条件下,S2O要与H+反应,C不正确;AlO与Al3+要发生双水解,D不正确。]
5.C [反应中NaClO2中氯元素化合价由+3价部分变为+4价、部分变为-1价,根据得失电子守恒、质量守恒配平可得:5NaClO2+4HCl===4ClO2+5NaCl+2H2O。A.由分析可知,x=4,y=4,A正确; B.该化学反应中HCl各元素化合价不变,仅体现出了酸性,B正确;C.氧化剂氧化性大于氧化产物,反应中NaClO2既是氧化剂又是还原剂,NaClO2中氯元素化合价由+3价部分变为+4价生成ClO2,故氧化性:NaClO2>ClO2,C错误; D.由化学方程式可知,电子转移情况为2H2O~4e-,该反应生成1 mol水,转移2NA个电子,D正确。]
6.D [A项,Cl2通入氢氧化钠溶液中反应的离子方程式为Cl2+2OH-===Cl-+ ClO-+H2O,A正确;B项,氧化铝溶于氢氧化钠溶液,反应的离子方程式为Al2O3+2OH-===2AlO+H2O,B正确;C项,过量CO2通入饱和碳酸钠溶液反应产生碳酸氢钠晶体,离子方程式为2Na++CO+CO2+H2O===2NaHCO3↓,C正确;D项,H2SO3溶液中滴入氯化钙溶液,因亚硫酸酸性弱于盐酸,不能发生反应,D不正确;故选D。]
7.B [A.滴入酚酞变红的溶液为碱性溶液,碳酸氢根不能存在,碳酸根和钙离子也不能共存,A错误;B.所给离子相互之间均不反应,可以共存,B正确;C.酸性溶液中醋酸根不能存在,C错误;D.铜离子为蓝色,无色溶液中不能存在,D错误。]
8.C [A.0~5 s过程中,溶液中Cr元素的化合价都呈+6价,发生的离子反应为:Cr2O+4H2O2+2H+===2CrO5+5H2O,A不正确;B.实验开始至30 s,溶液中Cr2O→CrO5→Cr3+,H2O2作还原剂,失电子生成O2等,发生的总反应离子方程式为Cr2O+3H2O2+8H+===2Cr3++3O2↑+7H2O,B不正确;C.30~80 s过程中,Cr元素由+3价升高到+6价,失电子被氧化,由Cr3+转化为CrO,可能是溶解的氧气和剩余的H2O2所致,C正确;D.0~80 s时,溶液中含铬微粒转化过程中Cr元素化合价变化为:+6→+6、+6→+3、+3→+6,依次发生非氧化还原反应、还原反应和氧化反应,D不正确。]
9.D [A.反应①为HBr+O2===HOOBr;反应②为HOOBr+HBr===2HOBr;反应③为HBr+HOBr===H2O+Br2,根据盖斯定律,将①+②+③×2,整理可得总反应方程式为:O2+4HBr===2Br2+2H2O,选项A正确;B.中间体HOOBr和HOBr中Br的化合价均为+1价,相同,选项B正确;C.步骤②反应为HOOBr+HBr===2HOBr,在该反应过程中有极性键H—Br、H—O、Br—O键的断裂,也有非极性键O—O的断裂,选项C正确;D.步骤③反应为HBr+HOBr===H2O+Br2,在该反应中Br元素化合价由HBr中的-1价,HOBr中的+1价变为反应后Br2的0价,每生成1 mol Br2转移1 mol电子,选项D错误。]
10.C [NH4HCO3电离产生的阳离子、阴离子都与KOH反应,该反应的离子方程式应该为:NH+HCO+2OH-===CO+H2O+NH3·H2O,A错误;2.24 L Cl2(标准状况下)的物质的量是0.1 mol。100 mL 1 mol·L-1FeBr2溶液中溶质的物质的量是0.1 mol,FeBr2的阳离子Fe2+、阴离子Br-都具有还原性,它们都可以与Cl2发生反应,由于还原性:Fe2+>Br-,所以Fe2+先发生反应,2Fe2++Cl2===2Fe3++2Cl-,0.1 mol Fe2+反应消耗0.05 mol Cl2,剩余0.05 mol Cl2再与Br-发生反应:2Br-+Cl2===Br2+2Cl-,0.05 mol Cl2反应消耗0.1 mol Br-,故反应的总离子方程式应该为:2Fe2++2Br-+2Cl2===2Fe3++Br2+4Cl-,B错误;向FeSO4溶液中加入NH4HCO3溶液,反应得到FeCO3沉淀、(NH4)2SO4、H2O、CO2气体,反应的离子方程式为:Fe2++2HCO===FeCO3↓+CO2↑+H2O,C正确;向明矾溶液中逐滴滴入Ba(OH)2溶液,至沉淀质量最大时,反应产生BaSO4、KAlO2、H2O,反应的离子方程式为:Al3++2SO+2Ba2++4OH-===AlO+2BaSO4↓+2H2O。]
11.A [A.醋酸为弱电解质,加入NaOH反应生成强电解质醋酸钠,所以不会出现变暗的过程,A符合题意;B.Ca(HCO3)2为强电解质,所以开始灯亮,加入氢氧化钙后二者反应生成碳酸钙沉淀和水,溶液中的离子浓度逐渐降低,直至接近于零,此时灯灭,之后又随着氢氧化钙的加入,溶液中的离子浓度增大,灯泡变亮,B不符合题意;C.硫酸为强电解质,开始灯亮,加入氢氧化钡后二者反应生成硫酸钡和水,溶液中的离子浓度逐渐降低,直至接近于零,此时灯灭,之后又随着氢氧化钡的加入,溶液中的离子浓度增大,灯泡变亮,C不符合题意;D.H2S为弱电解质,开始灯亮,加入亚硫酸后二者反应生成硫单质和水,硫难溶于水,溶液中的离子浓度逐渐降低,直至接近于零,此时灯灭,之后随着亚硫酸的加入,溶液中的离子浓度增大,灯泡变亮,D不符合题意。]
12.A [四种物质相互之间不反应,能使溶液里同时出现NH、Fe3+、Cu2+、Cl-和SO几种离子,A正确;Na2CO3、FeCl3发生相互促进水解反应生成氢氧化铁沉淀和二氧化碳气体,B错误;Cu(NO3)2、H2S会反应生成硫化铜沉淀,C错误;BaCl2、(NH4)2SO4会反应生成硫酸钡沉淀,D错误。]
13.C [向明矾溶液中加入少量氢氧化钡溶液,铝离子、硫酸根离子过量,钡离子、氢氧根离子完全反应生成氢氧化铝沉淀、硫酸钡沉淀:2Al3++3SO+3Ba2++6OH-===2Al(OH)3↓+3BaSO4↓,A正确;澄清石灰水中通入过量的二氧化碳生成可溶性碳酸氢钙溶液:CO2+OH-===HCO,B正确;氢氧化镁固体溶解于氯化铵溶液,是铵根离子水解生成的氢离子与氢氧化镁反应,故反应生成一水合氨:Mg(OH)2+2NH===Mg2++2NH3·H2O;C错误;SO2使酸性KMnO4溶液褪色是发生氧化还原反应生成硫酸根离子和锰离子:5SO2+2H2O+2MnO===5SO+4H++2Mn2+,D正确。]
14.A [由实验①可推出溶液中含有Br-、CO,由离子共存知,溶液中不含Mg2+、Fe2+;由实验②可推出溶液中不含SO;由实验③可推出溶液中含有K+,不能确定溶液中是否含有的离子为NH、Na+、SO。取少量溶液,滴加氯水和CCl4,是验证Br-的方法,无需进行该实验,A项符合题意;不透过蓝色钴玻璃观察火焰颜色,可验证Na+是否存在,B项不符合题意;加入适量稀硫酸和品红溶液可验证SO是否存在,C项不符合题意;取少量溶液,滴加适量浓NaOH溶液,加热,用湿润的红色石蕊试纸检验气体,可验证NH是否存在,D项不符合题意。]
15.D [由水层反应Cr2O+4H2O2+2H+===2CrO5+5H2O可知,反应前后元素化合价没有发生变化,是非氧化还原反应,故A错误;乙醚与CrO5形成配合物并使CrO5进入有机相,在检验过程中作稳定剂和萃取剂,而乙醇易溶于水,故不能用乙醇代替乙醚,故B错误;CrO5·O(C2H5)2中含O—O、C—C键为非极性键,故C错误;水相变为绿色生成了Cr3+,铬元素化合价降低,则氧元素化合价一定升高,应有氧气生成,反应的离子反应为4CrO5+12H+===4Cr3++6H2O+7O2↑,故D正确。]
16.A [向NaClO溶液中通入少量SO2,NaClO具有强氧化性,SO2有还原性,二者发生氧化还原反应,生成Cl-、SO,SO2是少量的,则NaClO是过量的,生成的H+结合过量的ClO-生成次氯酸,反应的离子方程式为:3ClO-+SO2+H2O===2HClO+SO+Cl-,故A错误;高锰酸钾与浓盐酸反应制氯气,MnO在酸性溶液中被还原为Mn2+,盐酸中的Cl-被氧化为氯气,离子方程式正确;Fe2+和Br-都有还原性,都能被氯气氧化,由于Fe2+的还原性强于Br-,当氯气少量时,只有Fe2+被氧化,故C正确;S2-和SO在酸性溶液中发生归中反应,生成单质硫,故D正确。]
17.D [KMnO4固体受热分解生成K2MnO4、MnO2、O2,K2MnO4、MnO2均具有氧化性,在加热条件下能与浓盐酸发生氧化还原反应,反应过程中Cl-被氧化为Cl2,K2MnO4、MnO2被还原为MnCl2,因此气体单质G为O2,气体单质H为Cl2。A.加热KMnO4固体的反应中,O元素化合价由-2升高至0,被氧化,加热K2MnO4、MnO2与浓盐酸的反应中,Cl元素化合价由-1升高至0,被氧化,因此O2和Cl2均为氧化产物,故A正确;B.KMnO4固体受热分解过程中,Mn元素化合价降低,被还原,部分O元素化合价升高,被氧化,因此KMnO4既是氧化剂又是还原剂,故B正确;C.含有Mn元素的物质在反应过程中的化合价变化为,Mn元素至少参与了3个氧化还原反应,故C正确;D.每生成1 mol O2转移4 mol电子,每生成1 mol Cl2转移2 mol电子,若KMnO4转化为MnCl2过程中得到的电子全部是Cl-生成Cl2所失去的,则气体的物质的量最大,由2KMnO4~5Cl2可知,n(气体)max=0.25 mol,但该气体中一定含有O2,因此最终所得气体的物质的量小于0.25 mol,故D错误。]
18.D [强酸性溶液中CO、SO不能存在;X溶液中加入过量Ba(NO3)2溶液生成沉淀C是BaSO4,说明有SO存在;硝酸被还原生成气体A为NO,说明有还原剂Fe2+存在(即3Fe2++4H++NO===3Fe3++NO↑+2H2O);溶液B加入过量NaOH溶液,生成的沉淀G为Fe(OH)3;生成的气体F为NH3,说明有NH存在;溶液H通入CO2生成沉淀I,由于前面加入过量的Ba(NO3)2溶液,引入了大量Ba2+,所以沉淀I中一定有BaCO3,又由于前面不能确定溶液X中是否存在Al3+,所以这里也不能确定沉淀I中有Al(OH)3;溶液J的焰色呈黄色,说明溶液J中有Na+,但由于前面加入过量NaOH溶液,引入了较多的Na+,因此不能确定溶液X中是否存在Na+;因为黄色焰色能掩盖紫色焰色,所以不能确定溶液X中是否有K+;另外,上述实验过程还不能确定溶液X中是否存在Cl-。X中肯定存在Fe2+、NH、SO,不能确定是否含有Na+、Al3+、K+、Cl-,故A错误;F是氨气、D是二氧化氮,根据4NH3+5O24NO+6H2O知氨气能被氧化生成NO而不是NO2,故B错误;沉淀I中一定有BaCO3,又由于前面不能确定溶液X中是否存在Al3+,所以这里也不能确定沉淀I中有Al(OH)3,故C错误;通过以上分析知,不能确定原来溶液中是否含有钠离子,故D正确。]
19.D [A.Cr2O溶液为橙色,CrO为黄色,故橙色K2Cr2O7溶液中加入NaOH溶液,溶液变黄色,发生的离子方程式为Cr2O+2OH-===2CrO+H2O,故A正确;B.硫化银比氯化银更难溶,因此氯化银可以转化成硫化银沉淀,离子方程式为2AgCl+S2-===Ag2S+2Cl-,故B正确;C.氢氧化钡过量,NH也会与OH-发生反应,离子方程式为NH+HCO+Ba2++2OH-===BaCO3↓+NH3·H2O+H2O,故C正确;D.醋酸为弱酸,不能写成离子,正确离子方程式为3MnO+4CH3COOH===2MnO+MnO2↓+2H2O+4CH3COO-,故D错误。]
20.B [根据加入足量的NaOH溶液,完全反应后,产生红褐色沉淀,过滤、洗涤、干燥沉淀,称重,质量为10.7 g,得出Fe(OH)3的物质的量为 mol=0.1 mol,则铁元素的物质的量为0.1 mol,根据原子守恒得n(FeS)=0.1 mol,根据化合价升高判断,二价铁变为三价铁,-2价的S2-升高到+6价的硫酸根离子,故失去的电子物质的量为:0.1×1+0.1×8=0.9 mol,则得到电子的物质的量也为0.9 mol,即n(NO2)×1+n(NO)×3=0.9,再根据题意中n(NO2)+n(NO)=11.2/22.4 mol=0.5 mol,则n(NO2)=0.3 mol,n(NO)=0.2 mol。A.由分析知0.1 mol FeS与足量的浓HNO3反应,生成 mol Fe2(SO4)3、 mol Fe(NO3)3、0.2 mol NO和0.3 mol NO2,根据氮元素守恒可知参加反应的硝酸的物质的量为×3 mol+0.2 mol+0.3 mol=0.6 mol,故A不正确;B.由分析知n(NO2)=0.3 mol,n(NO)=0.2 mol,故NO2与NO的体积之比是3∶2,故B正确;C.此反应过程中转移的电子数等于失去的电子数,根据分析得:失去的电子物质的量为:0.1×1+0.1×8=0.9 mol,故为0.9NA,故C不正确;D.根据电子守恒,n(O2)×4=n(NO2)×1+n(NO)×3=0.9,解得:n(O2)=0.225 mol,V=5.04 L,故D不正确
一、基础练
1.(2023·衡水重点中学二模)下列颜色变化与氧化还原反应有关的是( )
A.硫酸铜溶液中滴加氨水,先得到蓝色沉淀,后沉淀溶解得到深蓝色溶液
B.黄色的K2CrO4溶液中滴加稀硫酸,溶液由黄色变为橙色
C.KI溶液滴入AgCl浊液中,沉淀由白色逐渐变为黄色
D.新切开的苹果在空气中颜色变暗淡
2.(2023·湖北冲刺模拟)常温下,下列各组离子在指定溶液中一定能大量共存的是( )
A.中性溶液中:Na+、SO、Fe3+、Cl-
B.c(H+)/c(OH-)=10-12的溶液中:[Ag(NH3)2]+、Ba2+、NO、Cl-
C.c(AlO)=0.1 mol/L的溶液中:Na+ 、K+、HCO、Cl-
D.遇甲基橙显红色的溶液中:K+、Ba2+、NO、I-
3.(2023·保定模拟)已知反应:XeF4+2CH3CH===CH2―→2CH3CH2CHF2+Xe,下列有关说法正确的是( )
A.该反应不属于氧化还原反应
B.XeF4既是氧化剂,又是还原剂
C.反应中电子由Xe转移到C
D.氧化剂与还原剂的物质的量之比为1∶2
4.(2023·重庆三次联诊)下列各组离子在指定溶液中一定能大量共存的是( )
A.氨水溶液中:K+、Cu2+、NO、SO
B.0.1 mol·L-1KI溶液中:Fe2+、NH、Cl-、SO
C.能使甲基橙变红的溶液中:Na+、NH、Cl-、S2O
D.0.1 mol·L-1 NaAlO2溶液中:Al3+、Na+、SO、NO
5.(2023·广州联考)关于反应5NaClO2+xHCl===yClO2+5NaCl+zH2O,下列说法不正确的是( )
A.x=4,y=4
B.该化学反应中HCl仅体现出了酸性
C.通过该反应可知氧化性:ClO2>NaClO2
D.该反应生成1 mol水,转移2NA个电子
6.(2023·浙江1月选考)下列反应的离子方程式不正确的是( )
A.Cl2通入氢氧化钠溶液:Cl2+2OH-===Cl-+ClO-+H2O
B.氧化铝溶于氢氧化钠溶液:Al2O3+2OH-===2AlO+H2O
C.过量CO2通入饱和碳酸钠溶液:2Na++CO+CO2+H2O===2NaHCO3↓
D.H2SO3溶液中滴入氯化钙溶液:SO+Ca2+===CaSO3↓
7.(2023·湖北名校联考)室温下,下列各组离子在指定溶液中能大量共存的是( )
A.滴入酚酞变红色的溶液:K+、Ca2+、HCO、CO
B.0.1 mol·L-1 Fe2(SO4)3溶液:Cu2+、NH、NO、SO
C.pH=1的溶液:Ba2+、K+、CH3COO-、NO
D.无色透明的溶液:Cu2+、Na+、SO、NO
8.(2023·河北部分学校冲刺练)实验室模拟工业处理含铬废水,操作及现象如图甲所示,反应过程中铬元素的化合价变化如图乙。已知:深蓝色溶液中生成了CrO5。
下列说法正确的是( )
A.0~5 s过程中,发生的离子反应为:Cr2O+H2O??2CrO+2H+
B.实验开始至30 s,溶液中发生的总反应离子方程式为Cr2O+3H2O2+8H+===Cr3++3O2↑+7H2O
C.30~80 s过程中,Cr元素被氧化,可能是溶解的氧气和剩余的H2O2所致
D.0~80 s时,溶液中含铬微粒依次发生氧化反应、还原反应和氧化反应
9.据文献报道,我国学者提出O2氧化HBr生成Br2反应历程如图所示。下列有关该历程的说法错误的是( )
A.O2氧化HBr生成Br2的总反应为:O2+4HBr===2Br2+2H2O
B.中间体HOOBr和HOBr中Br的化合价相同
C.发生步骤②时,断裂的化学键既有极性键又有非极性键
D.步骤③中,每生成1 mol Br2转移2 mol电子
10.(2023·湘东名校联考)下列离子反应方程式正确的是( )
A.NH4HCO3稀溶液与过量的KOH溶液反应:HCO+OH-===CO+H2O
B.100 mL 1 mol·L-1溴化亚铁溶液中通入2.24 L Cl2(标准状况下):Fe2++2Br-+2Cl2===Fe3++Br2+4Cl-
C.向FeSO4溶液中加入NH4HCO3溶液得到FeCO3沉淀:Fe2++2HCO===FeCO3↓+CO2↑+H2O
D.向明矾溶液中逐滴滴入Ba(OH)2溶液,至沉淀质量最大时反应的离子方程式为:2Al3++3SO+3Ba2++6OH-===3BaSO4↓+2Al(OH)3↓
二、提高练
11.(2023·北京延庆区模拟)用如图所示装置(搅拌装置已略去)探究溶液中离子浓度的变化,灯光变化不可能出现“亮→暗(或灭)→亮”现象的是( )
A B C D
试剂a NaOH Ca(OH)2 Ba(OH)2 H2SO3
试剂b CH3COOH Ca(HCO3)2 H2SO4 H2S
12.(2023·永州模拟)下列各组物质混合后,能使溶液里同时出现NH、Fe3+、Cu2+、Cl-和SO几种离子,且溶液不发生浑浊的一组是( )
A.CuCl2、NH4Cl、Fe2(SO4)3、NaNO3
B.(NH4)2SO4、CuSO4、Na2CO3、FeCl3
C.Cu(NO3)2、NH4NO3、FeCl3、H2S
D.BaCl2、Cu(NO3)2、(NH4)2SO4、Fe(NO3)3
13.(2023·永州适应性考试)下列离子方程式书写错误的是( )
A.向明矾溶液中加入少量氢氧化钡溶液:2Al3++3SO+3Ba2++6OH-===2Al(OH)3↓+3BaSO4↓
B.澄清石灰水中通入过量的二氧化碳:CO2+OH-===HCO
C.氢氧化镁固体溶解于氯化铵溶液:Mg(OH)2+2H+===Mg2++2H2O
D.SO2使酸性KMnO4溶液褪色:5SO2+2H2O+2MnO===5SO+4H++2Mn2+
14.(2023·洛阳一次联考)某溶液中可能含有K+、Na+、Mg2+、NH、Fe2+、Br-、CO、SO、SO中的若干种离子。某同学做了如下实验:①取少量溶液,滴加足量氯水,有气泡产生且溶液颜色变成黄色;②另取少量溶液,滴加盐酸酸化的氯化钡溶液,无沉淀生成;③蘸取原溶液,做焰色试验,透过蓝色钴玻璃观察到火焰呈紫色。为进一步确定该溶液的组成,无需进行的实验是( )
A.取少量溶液,滴加氯水和CCl4,振荡、静置
B.上述实验③不透过蓝色钴玻璃观察火焰颜色
C.取少量溶液,滴加适量的稀硫酸和品红溶液
D.取少量溶液,滴加适量浓NaOH溶液,加热,用湿润的红色石蕊试纸检验气体
15.(2023·聊城一模)向重铬酸盐酸性溶液中加入乙醚和H2O2,水层发生反应:Cr2O+4H2O2+2H+===2CrO5+5H2O(已知CrO5的结构为),乙醚层发生反应:CrO5+(C2H5)2O===CrO5·O(C2H5)2。反应上层出现蓝色,一段时间后溶液蓝色褪去,且水相变为绿色(Cr3+),下列说法正确的是( )
A.由水层反应可知,氧化性:Cr2O>CrO5
B.乙醚在检验过程中可用乙醇代替
C.CrO5·O(C2H5)2中不存在非极性键
D.水相变为绿色的离子反应为4CrO5+12H+===4Cr3++6H2O+7O2↑
16.(2023·郴州模拟)下列离子方程式错误的是( )
A.向NaClO溶液中通入少量SO2:2ClO-+SO2+H2O===2HClO+SO
B.高锰酸钾与浓盐酸反应制氯气:2MnO+10Cl-+16H+===2Mn2++5Cl2↑+8H2O
C.FeBr2通入少量的Cl2:2Fe2++Cl2===2Fe3++2Cl-
D.向Na2SO3的酸性溶液中加入Na2S:2S2-+SO+6H+===3S↓+3H2O
17.实验室中利用固体KMnO4进行如图实验,下列说法错误的是( )
A.G与H均为氧化产物
B.实验中KMnO4既是氧化剂又是还原剂
C.Mn元素至少参与了3个氧化还原反应
D.G与H的物质的量之和可能为0.25 mol
18.强酸性溶液X中可能含有Na+、K+、NH、Fe2+、Al3+、CO、SO、SO、Cl-中的若干种,某同学为了确认其成分,取X溶液进行连续实验,实验过程及产物如下:
下列结论正确的是( )
A.X中肯定存在Na+、Fe2+、Al3+、NH、SO
B.气体F经催化氧化可直接生成气体D
C.沉淀C一定是BaSO4、沉淀G一定是Fe(OH)3、沉淀I一定是Al(OH)3
D.X中不能确定的离子是Al3+、Na+、K+和Cl-
19.(2022·银川一中二模)下列离子方程式与实验对应不正确的是( )
选项 实验 离子方程式
A 向橙色K2Cr2O7溶液中加入NaOH溶液,溶液变黄色 Cr2O+2OH-===2CrO+H2O
B 向AgCl悬浊液中加Na2S溶液,有黑色难溶物生成 2AgCl+S2-===Ag2S+2Cl-
C 向NH4HCO3溶液中加入过量Ba(OH)2稀溶液,有白色沉淀产生 NH+HCO+Ba2++2OH-===BaCO3↓+NH3·H2O+H2O
D 向K2MnO4溶液(墨绿色)中加入适量醋酸,溶液变为紫色且有黑色沉淀生成 3MnO+4H+===2MnO+MnO2↓+2H2O
20.(2022·重庆八中模拟)一定量的FeS与足量的浓硝酸反应,反应后测得溶液中含有Fe3+和SO,同时生成NO2、NO的混合气体11.2 L(标准状况),这些气体与一定体积O2(标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸,若向溶液中加入足量的NaOH溶液,完全反应后,产生红褐色沉淀,过滤、洗涤、干燥沉淀,称重,质量为10.7 g,下列说法正确的是( )
A.参加反应的硝酸的物质的量为0.9 mol
B.混合气体中NO2与NO的体积之比是3∶2
C.此反应过程中转移的电子数为0.6NA
D.消耗的氧气体积为7.56 L(标况下)
参考答案
1.D [苹果中的有机物遇到空气被氧化变质,D项符合题意。]
2.B [A.Fe3+在pH为4左右沉淀完全,则中性溶液中不能大量存在Fe3+,故A项错误;B.该溶液呈碱性,[Ag(NH3)2]+、Ba2+、NO、Cl-、OH-之间不反应,能够大量共存,故B项正确;C.AlO与HCO能反应生成Al(OH)3和CO,不能大量共存,故C项错误;D.遇甲基橙显红色的溶液呈酸性,NO、I-在酸性溶液中发生氧化还原反应,不能大量共存,故D项错误。]
3.D [化合物间反应有单质生成的一定是氧化还原反应,A选项错误;F在化合物中的化合价只有-1价,因此XeF4中Xe为+4价,由此可确定XeF4为氧化剂,丙烯为还原剂,B选项错误;因为Xe的化合价降低了,所以电子应该从C转移到Xe,C选项错误;氧化剂是XeF4,还原剂是CH3CH===CH2,二者的物质的量之比为1∶2,D选项正确。]
4.B [Cu2+与氨水要反应,A不正确;在酸性条件下,S2O要与H+反应,C不正确;AlO与Al3+要发生双水解,D不正确。]
5.C [反应中NaClO2中氯元素化合价由+3价部分变为+4价、部分变为-1价,根据得失电子守恒、质量守恒配平可得:5NaClO2+4HCl===4ClO2+5NaCl+2H2O。A.由分析可知,x=4,y=4,A正确; B.该化学反应中HCl各元素化合价不变,仅体现出了酸性,B正确;C.氧化剂氧化性大于氧化产物,反应中NaClO2既是氧化剂又是还原剂,NaClO2中氯元素化合价由+3价部分变为+4价生成ClO2,故氧化性:NaClO2>ClO2,C错误; D.由化学方程式可知,电子转移情况为2H2O~4e-,该反应生成1 mol水,转移2NA个电子,D正确。]
6.D [A项,Cl2通入氢氧化钠溶液中反应的离子方程式为Cl2+2OH-===Cl-+ ClO-+H2O,A正确;B项,氧化铝溶于氢氧化钠溶液,反应的离子方程式为Al2O3+2OH-===2AlO+H2O,B正确;C项,过量CO2通入饱和碳酸钠溶液反应产生碳酸氢钠晶体,离子方程式为2Na++CO+CO2+H2O===2NaHCO3↓,C正确;D项,H2SO3溶液中滴入氯化钙溶液,因亚硫酸酸性弱于盐酸,不能发生反应,D不正确;故选D。]
7.B [A.滴入酚酞变红的溶液为碱性溶液,碳酸氢根不能存在,碳酸根和钙离子也不能共存,A错误;B.所给离子相互之间均不反应,可以共存,B正确;C.酸性溶液中醋酸根不能存在,C错误;D.铜离子为蓝色,无色溶液中不能存在,D错误。]
8.C [A.0~5 s过程中,溶液中Cr元素的化合价都呈+6价,发生的离子反应为:Cr2O+4H2O2+2H+===2CrO5+5H2O,A不正确;B.实验开始至30 s,溶液中Cr2O→CrO5→Cr3+,H2O2作还原剂,失电子生成O2等,发生的总反应离子方程式为Cr2O+3H2O2+8H+===2Cr3++3O2↑+7H2O,B不正确;C.30~80 s过程中,Cr元素由+3价升高到+6价,失电子被氧化,由Cr3+转化为CrO,可能是溶解的氧气和剩余的H2O2所致,C正确;D.0~80 s时,溶液中含铬微粒转化过程中Cr元素化合价变化为:+6→+6、+6→+3、+3→+6,依次发生非氧化还原反应、还原反应和氧化反应,D不正确。]
9.D [A.反应①为HBr+O2===HOOBr;反应②为HOOBr+HBr===2HOBr;反应③为HBr+HOBr===H2O+Br2,根据盖斯定律,将①+②+③×2,整理可得总反应方程式为:O2+4HBr===2Br2+2H2O,选项A正确;B.中间体HOOBr和HOBr中Br的化合价均为+1价,相同,选项B正确;C.步骤②反应为HOOBr+HBr===2HOBr,在该反应过程中有极性键H—Br、H—O、Br—O键的断裂,也有非极性键O—O的断裂,选项C正确;D.步骤③反应为HBr+HOBr===H2O+Br2,在该反应中Br元素化合价由HBr中的-1价,HOBr中的+1价变为反应后Br2的0价,每生成1 mol Br2转移1 mol电子,选项D错误。]
10.C [NH4HCO3电离产生的阳离子、阴离子都与KOH反应,该反应的离子方程式应该为:NH+HCO+2OH-===CO+H2O+NH3·H2O,A错误;2.24 L Cl2(标准状况下)的物质的量是0.1 mol。100 mL 1 mol·L-1FeBr2溶液中溶质的物质的量是0.1 mol,FeBr2的阳离子Fe2+、阴离子Br-都具有还原性,它们都可以与Cl2发生反应,由于还原性:Fe2+>Br-,所以Fe2+先发生反应,2Fe2++Cl2===2Fe3++2Cl-,0.1 mol Fe2+反应消耗0.05 mol Cl2,剩余0.05 mol Cl2再与Br-发生反应:2Br-+Cl2===Br2+2Cl-,0.05 mol Cl2反应消耗0.1 mol Br-,故反应的总离子方程式应该为:2Fe2++2Br-+2Cl2===2Fe3++Br2+4Cl-,B错误;向FeSO4溶液中加入NH4HCO3溶液,反应得到FeCO3沉淀、(NH4)2SO4、H2O、CO2气体,反应的离子方程式为:Fe2++2HCO===FeCO3↓+CO2↑+H2O,C正确;向明矾溶液中逐滴滴入Ba(OH)2溶液,至沉淀质量最大时,反应产生BaSO4、KAlO2、H2O,反应的离子方程式为:Al3++2SO+2Ba2++4OH-===AlO+2BaSO4↓+2H2O。]
11.A [A.醋酸为弱电解质,加入NaOH反应生成强电解质醋酸钠,所以不会出现变暗的过程,A符合题意;B.Ca(HCO3)2为强电解质,所以开始灯亮,加入氢氧化钙后二者反应生成碳酸钙沉淀和水,溶液中的离子浓度逐渐降低,直至接近于零,此时灯灭,之后又随着氢氧化钙的加入,溶液中的离子浓度增大,灯泡变亮,B不符合题意;C.硫酸为强电解质,开始灯亮,加入氢氧化钡后二者反应生成硫酸钡和水,溶液中的离子浓度逐渐降低,直至接近于零,此时灯灭,之后又随着氢氧化钡的加入,溶液中的离子浓度增大,灯泡变亮,C不符合题意;D.H2S为弱电解质,开始灯亮,加入亚硫酸后二者反应生成硫单质和水,硫难溶于水,溶液中的离子浓度逐渐降低,直至接近于零,此时灯灭,之后随着亚硫酸的加入,溶液中的离子浓度增大,灯泡变亮,D不符合题意。]
12.A [四种物质相互之间不反应,能使溶液里同时出现NH、Fe3+、Cu2+、Cl-和SO几种离子,A正确;Na2CO3、FeCl3发生相互促进水解反应生成氢氧化铁沉淀和二氧化碳气体,B错误;Cu(NO3)2、H2S会反应生成硫化铜沉淀,C错误;BaCl2、(NH4)2SO4会反应生成硫酸钡沉淀,D错误。]
13.C [向明矾溶液中加入少量氢氧化钡溶液,铝离子、硫酸根离子过量,钡离子、氢氧根离子完全反应生成氢氧化铝沉淀、硫酸钡沉淀:2Al3++3SO+3Ba2++6OH-===2Al(OH)3↓+3BaSO4↓,A正确;澄清石灰水中通入过量的二氧化碳生成可溶性碳酸氢钙溶液:CO2+OH-===HCO,B正确;氢氧化镁固体溶解于氯化铵溶液,是铵根离子水解生成的氢离子与氢氧化镁反应,故反应生成一水合氨:Mg(OH)2+2NH===Mg2++2NH3·H2O;C错误;SO2使酸性KMnO4溶液褪色是发生氧化还原反应生成硫酸根离子和锰离子:5SO2+2H2O+2MnO===5SO+4H++2Mn2+,D正确。]
14.A [由实验①可推出溶液中含有Br-、CO,由离子共存知,溶液中不含Mg2+、Fe2+;由实验②可推出溶液中不含SO;由实验③可推出溶液中含有K+,不能确定溶液中是否含有的离子为NH、Na+、SO。取少量溶液,滴加氯水和CCl4,是验证Br-的方法,无需进行该实验,A项符合题意;不透过蓝色钴玻璃观察火焰颜色,可验证Na+是否存在,B项不符合题意;加入适量稀硫酸和品红溶液可验证SO是否存在,C项不符合题意;取少量溶液,滴加适量浓NaOH溶液,加热,用湿润的红色石蕊试纸检验气体,可验证NH是否存在,D项不符合题意。]
15.D [由水层反应Cr2O+4H2O2+2H+===2CrO5+5H2O可知,反应前后元素化合价没有发生变化,是非氧化还原反应,故A错误;乙醚与CrO5形成配合物并使CrO5进入有机相,在检验过程中作稳定剂和萃取剂,而乙醇易溶于水,故不能用乙醇代替乙醚,故B错误;CrO5·O(C2H5)2中含O—O、C—C键为非极性键,故C错误;水相变为绿色生成了Cr3+,铬元素化合价降低,则氧元素化合价一定升高,应有氧气生成,反应的离子反应为4CrO5+12H+===4Cr3++6H2O+7O2↑,故D正确。]
16.A [向NaClO溶液中通入少量SO2,NaClO具有强氧化性,SO2有还原性,二者发生氧化还原反应,生成Cl-、SO,SO2是少量的,则NaClO是过量的,生成的H+结合过量的ClO-生成次氯酸,反应的离子方程式为:3ClO-+SO2+H2O===2HClO+SO+Cl-,故A错误;高锰酸钾与浓盐酸反应制氯气,MnO在酸性溶液中被还原为Mn2+,盐酸中的Cl-被氧化为氯气,离子方程式正确;Fe2+和Br-都有还原性,都能被氯气氧化,由于Fe2+的还原性强于Br-,当氯气少量时,只有Fe2+被氧化,故C正确;S2-和SO在酸性溶液中发生归中反应,生成单质硫,故D正确。]
17.D [KMnO4固体受热分解生成K2MnO4、MnO2、O2,K2MnO4、MnO2均具有氧化性,在加热条件下能与浓盐酸发生氧化还原反应,反应过程中Cl-被氧化为Cl2,K2MnO4、MnO2被还原为MnCl2,因此气体单质G为O2,气体单质H为Cl2。A.加热KMnO4固体的反应中,O元素化合价由-2升高至0,被氧化,加热K2MnO4、MnO2与浓盐酸的反应中,Cl元素化合价由-1升高至0,被氧化,因此O2和Cl2均为氧化产物,故A正确;B.KMnO4固体受热分解过程中,Mn元素化合价降低,被还原,部分O元素化合价升高,被氧化,因此KMnO4既是氧化剂又是还原剂,故B正确;C.含有Mn元素的物质在反应过程中的化合价变化为,Mn元素至少参与了3个氧化还原反应,故C正确;D.每生成1 mol O2转移4 mol电子,每生成1 mol Cl2转移2 mol电子,若KMnO4转化为MnCl2过程中得到的电子全部是Cl-生成Cl2所失去的,则气体的物质的量最大,由2KMnO4~5Cl2可知,n(气体)max=0.25 mol,但该气体中一定含有O2,因此最终所得气体的物质的量小于0.25 mol,故D错误。]
18.D [强酸性溶液中CO、SO不能存在;X溶液中加入过量Ba(NO3)2溶液生成沉淀C是BaSO4,说明有SO存在;硝酸被还原生成气体A为NO,说明有还原剂Fe2+存在(即3Fe2++4H++NO===3Fe3++NO↑+2H2O);溶液B加入过量NaOH溶液,生成的沉淀G为Fe(OH)3;生成的气体F为NH3,说明有NH存在;溶液H通入CO2生成沉淀I,由于前面加入过量的Ba(NO3)2溶液,引入了大量Ba2+,所以沉淀I中一定有BaCO3,又由于前面不能确定溶液X中是否存在Al3+,所以这里也不能确定沉淀I中有Al(OH)3;溶液J的焰色呈黄色,说明溶液J中有Na+,但由于前面加入过量NaOH溶液,引入了较多的Na+,因此不能确定溶液X中是否存在Na+;因为黄色焰色能掩盖紫色焰色,所以不能确定溶液X中是否有K+;另外,上述实验过程还不能确定溶液X中是否存在Cl-。X中肯定存在Fe2+、NH、SO,不能确定是否含有Na+、Al3+、K+、Cl-,故A错误;F是氨气、D是二氧化氮,根据4NH3+5O24NO+6H2O知氨气能被氧化生成NO而不是NO2,故B错误;沉淀I中一定有BaCO3,又由于前面不能确定溶液X中是否存在Al3+,所以这里也不能确定沉淀I中有Al(OH)3,故C错误;通过以上分析知,不能确定原来溶液中是否含有钠离子,故D正确。]
19.D [A.Cr2O溶液为橙色,CrO为黄色,故橙色K2Cr2O7溶液中加入NaOH溶液,溶液变黄色,发生的离子方程式为Cr2O+2OH-===2CrO+H2O,故A正确;B.硫化银比氯化银更难溶,因此氯化银可以转化成硫化银沉淀,离子方程式为2AgCl+S2-===Ag2S+2Cl-,故B正确;C.氢氧化钡过量,NH也会与OH-发生反应,离子方程式为NH+HCO+Ba2++2OH-===BaCO3↓+NH3·H2O+H2O,故C正确;D.醋酸为弱酸,不能写成离子,正确离子方程式为3MnO+4CH3COOH===2MnO+MnO2↓+2H2O+4CH3COO-,故D错误。]
20.B [根据加入足量的NaOH溶液,完全反应后,产生红褐色沉淀,过滤、洗涤、干燥沉淀,称重,质量为10.7 g,得出Fe(OH)3的物质的量为 mol=0.1 mol,则铁元素的物质的量为0.1 mol,根据原子守恒得n(FeS)=0.1 mol,根据化合价升高判断,二价铁变为三价铁,-2价的S2-升高到+6价的硫酸根离子,故失去的电子物质的量为:0.1×1+0.1×8=0.9 mol,则得到电子的物质的量也为0.9 mol,即n(NO2)×1+n(NO)×3=0.9,再根据题意中n(NO2)+n(NO)=11.2/22.4 mol=0.5 mol,则n(NO2)=0.3 mol,n(NO)=0.2 mol。A.由分析知0.1 mol FeS与足量的浓HNO3反应,生成 mol Fe2(SO4)3、 mol Fe(NO3)3、0.2 mol NO和0.3 mol NO2,根据氮元素守恒可知参加反应的硝酸的物质的量为×3 mol+0.2 mol+0.3 mol=0.6 mol,故A不正确;B.由分析知n(NO2)=0.3 mol,n(NO)=0.2 mol,故NO2与NO的体积之比是3∶2,故B正确;C.此反应过程中转移的电子数等于失去的电子数,根据分析得:失去的电子物质的量为:0.1×1+0.1×8=0.9 mol,故为0.9NA,故C不正确;D.根据电子守恒,n(O2)×4=n(NO2)×1+n(NO)×3=0.9,解得:n(O2)=0.225 mol,V=5.04 L,故D不正确
同课章节目录
