2024届高三化学二轮复习 新题速递之硫及其化合物专题训练(含解析)
文档属性
| 名称 | 2024届高三化学二轮复习 新题速递之硫及其化合物专题训练(含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 556.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-18 00:42:28 | ||
图片预览



文档简介
2024年高考化学复习新题速递之硫及其化合物
一.选择题(共25小题)
1.(2023秋 道里区校级月考)利用空气催化氧化法除掉电石渣浆(含CaO)上清液中的S2﹣,制取石膏(CaSO4 2H2O)的过程如图。下列说法正确的是 ( )
A.过程Ⅰ中锰元素被氧化
B.过程Ⅰ后溶液pH增大
C.过程Ⅱ中反应的离子方程式为2S2﹣+4+10H+═4Mn(OH)2+S2+H2O
D.将10L上清液中的S2﹣(S2﹣浓度为480mg/L)转化为,理论上共需要0.03molO2
2.(2023秋 渝北区校级月考)下列有关说法正确的是( )
A.工业硝酸的质量分数约为69%,常因溶有少量Fe3+而呈现黄色
B.浓硫酸可于干燥CO和H2
C.向Cu与浓硫酸反应后的溶液中加入水,可观察到溶液变蓝
D.pH小于7的降水为酸雨,主要由SO2和氮氧化物的排放引起
3.(2023秋 南海区月考)探究蔗糖与浓硫酸反应及气体产物的性质,设计如图所示实验,下列说法正确的是( )
A.蔗糖变为黑色,说明浓硫酸有强氧化性
B.品红和酸性KMnO4溶液褪色原理相同
C.石蕊变红,说明气体产物溶于水有酸性
D.澄清石灰水变浑浊,气体产物一定含SO2
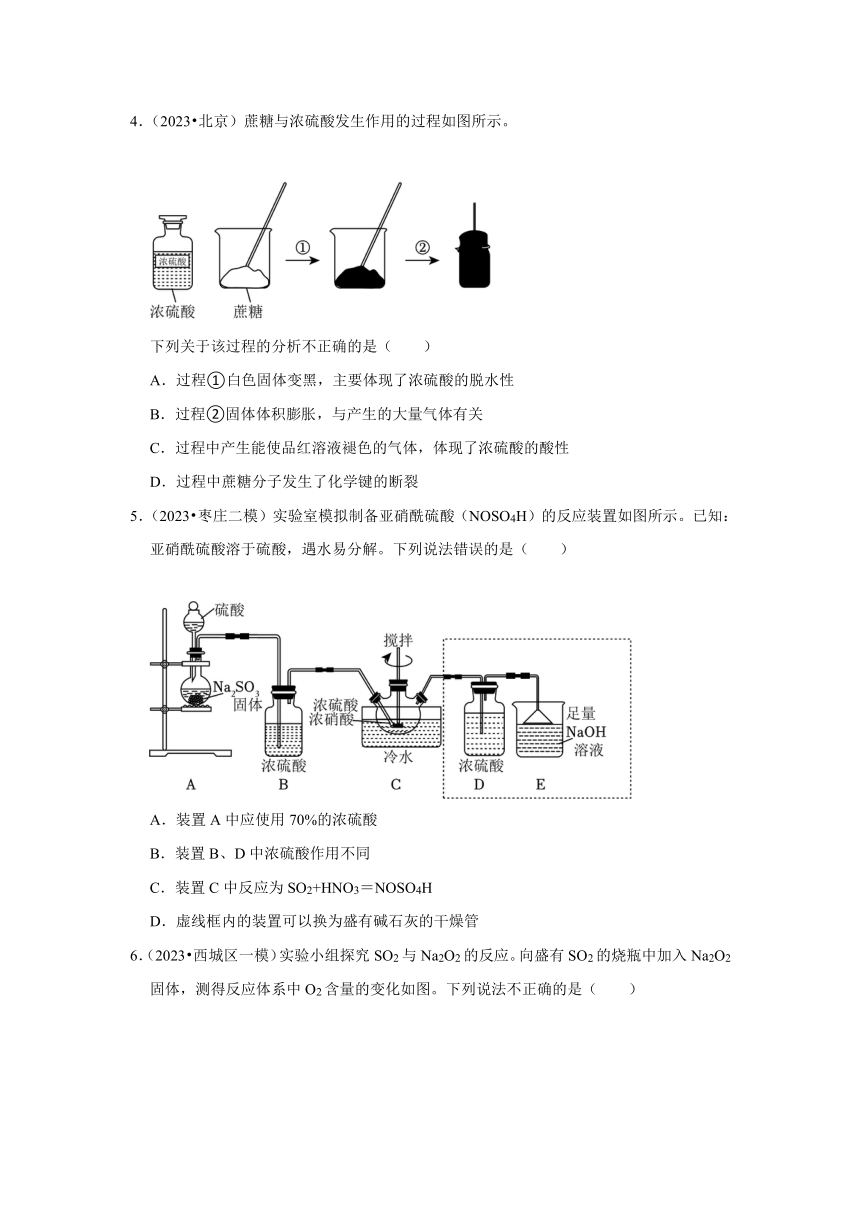
4.(2023 北京)蔗糖与浓硫酸发生作用的过程如图所示。
下列关于该过程的分析不正确的是( )
A.过程①白色固体变黑,主要体现了浓硫酸的脱水性
B.过程②固体体积膨胀,与产生的大量气体有关
C.过程中产生能使品红溶液褪色的气体,体现了浓硫酸的酸性
D.过程中蔗糖分子发生了化学键的断裂
5.(2023 枣庄二模)实验室模拟制备亚硝酰硫酸(NOSO4H)的反应装置如图所示。已知:亚硝酰硫酸溶于硫酸,遇水易分解。下列说法错误的是( )
A.装置A中应使用70%的浓硫酸
B.装置B、D中浓硫酸作用不同
C.装置C中反应为SO2+HNO3=NOSO4H
D.虚线框内的装置可以换为盛有碱石灰的干燥管
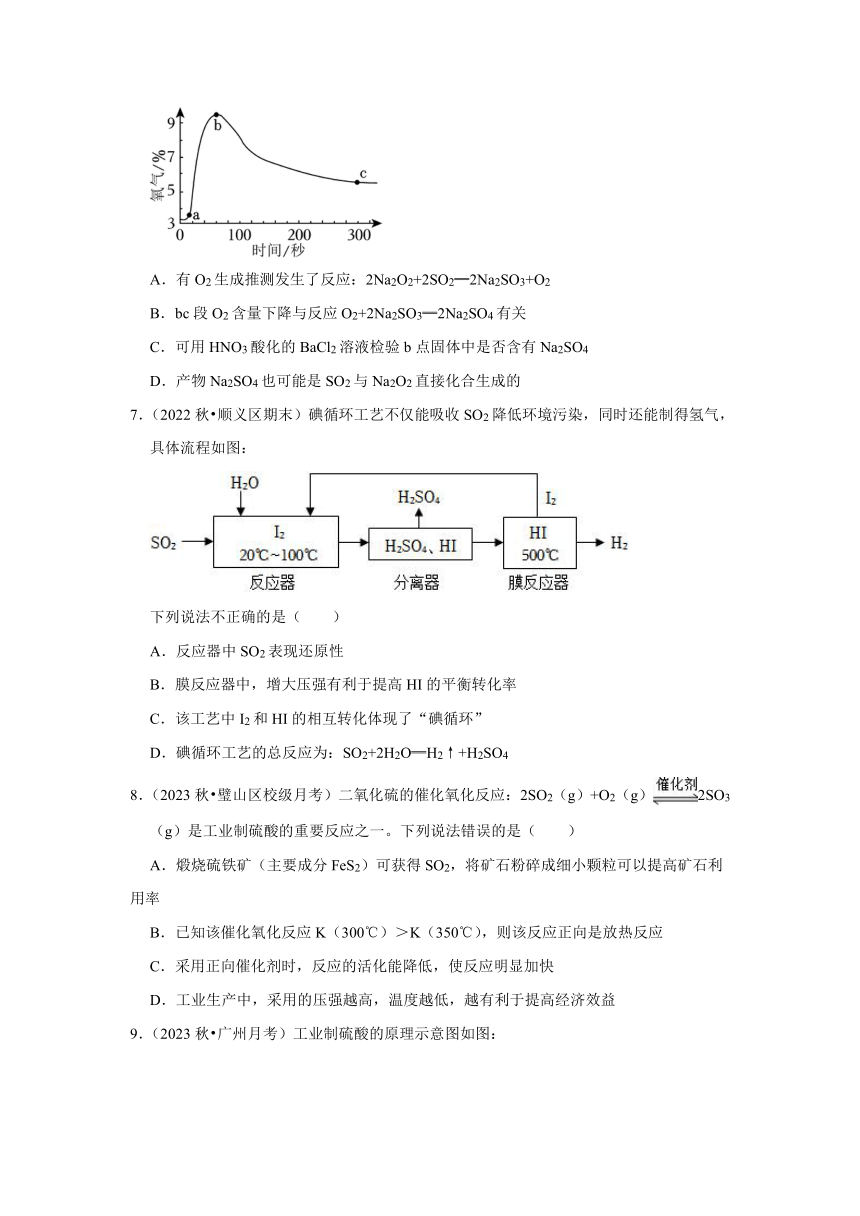
6.(2023 西城区一模)实验小组探究SO2与Na2O2的反应。向盛有SO2的烧瓶中加入Na2O2固体,测得反应体系中O2含量的变化如图。下列说法不正确的是( )
A.有O2生成推测发生了反应:2Na2O2+2SO2═2Na2SO3+O2
B.bc段O2含量下降与反应O2+2Na2SO3═2Na2SO4有关
C.可用HNO3酸化的BaCl2溶液检验b点固体中是否含有Na2SO4
D.产物Na2SO4也可能是SO2与Na2O2直接化合生成的
7.(2022秋 顺义区期末)碘循环工艺不仅能吸收SO2降低环境污染,同时还能制得氢气,具体流程如图:
下列说法不正确的是( )
A.反应器中SO2表现还原性
B.膜反应器中,增大压强有利于提高HI的平衡转化率
C.该工艺中I2和HI的相互转化体现了“碘循环”
D.碘循环工艺的总反应为:SO2+2H2O═H2↑+H2SO4
8.(2023秋 璧山区校级月考)二氧化硫的催化氧化反应:2SO2(g)+O2(g)2SO3(g)是工业制硫酸的重要反应之一。下列说法错误的是( )
A.煅烧硫铁矿(主要成分FeS2)可获得SO2,将矿石粉碎成细小颗粒可以提高矿石利用率
B.已知该催化氧化反应K(300℃)>K(350℃),则该反应正向是放热反应
C.采用正向催化剂时,反应的活化能降低,使反应明显加快
D.工业生产中,采用的压强越高,温度越低,越有利于提高经济效益
9.(2023秋 广州月考)工业制硫酸的原理示意图如图:
下列说法不正确的是( )
A.燃烧的化学方程式为4FeS2+11O22Fe2O3+8SO2
B.1mol SO2和足量O2充分反应转移2mol电子
C.用98.3%的浓硫酸吸收三氧化硫可避免形成酸雾
D.可用浓氨水吸收生产过程中的尾气并转化为铵盐
10.(2022秋 徐汇区期末)下列物质不能用于吸收H2S的是( )
A.FeSO4溶液 B.NaOH溶液
C.CuSO4溶液 D.酸性KMnO4溶液
11.(2022秋 徐汇区期末)不符合硫酸工业生产实际的是( )
A.沸腾炉中加入碾碎的硫铁矿
B.接触室中的反应条件为高温高压
C.催化氧化时通过热交换器充分利用能量
D.吸收塔中用98.3%的浓硫酸吸收SO3
12.(2022秋 徐汇区期末)将SO2分别通入下列溶液中,对现象的分析正确的是( )
选项 溶液 现象 分析
A 含酚酞的NaOH溶液 红色消失 SO2是酸性氧化物
B 溴水 橙色消失 SO2具有漂白性
C FeCl3溶液 变为浅绿色溶液 SO2+Fe3++H2O=Fe2++SO42﹣+2H+
D Na2S溶液 产生淡黄色浑浊 SO2+2S2﹣+H2O=3S↓+2OH﹣
A.A B.B C.C D.D
13.(2023春 天山区校级期中)下列说法正确的是( )
A.可用澄清石灰水鉴别CO2与SO2
B.SO2能使溴水、酸性高锰酸钾溶液褪色,因其有漂白性
C.SO2能使紫色石蕊溶液先变红后褪色
D.SO2的漂白性与氯水漂白原理不同
14.(2023春 西宁期末)对于下列事实的解释正确的是( )
A.金属钠放入无水乙醇中产生大量气体,说明乙醇是一种酸
B.在蔗糖中加入浓硫酸后出现发黑现象,说明浓硫酸具有吸水性
C.向某溶液中插入铜丝,在试管口观察到红棕色气体,说明该溶液一定是浓硝酸
D.向某溶液中加入浓NaOH溶液,加热,产生能使湿润的红色石蕊试纸变蓝的气体,说明溶液中一定含有NH4+
15.(2023秋 南关区校级月考)利用空气催化氧化法除掉电石渣浆(含CaO)上层清液中的S2﹣并制取石膏(CaSO4 2H2O)的过程如图:
下列说法错误的是( )
A.CaSO4 2H2O属于盐类和纯净物
B.过程Ⅰ中氧化剂与还原剂的物质的量之比为1:2
C.过程Ⅱ中,反应的离子方程式为+2S2﹣+9H2O=S2+4Mn(OH)2↓+10OH﹣
D.将10L上层清液中的S2﹣(S2﹣浓度为480mg L﹣1)转化为,理论上共需要0.15molO2
16.(2023春 仁寿县期中)如图所示是一系列含硫化合物的转化关系(反应中生成的水已略去),其中说法正确的是( )
A.反应①说明SO2具有漂白性,反应②说明SO2具有酸性
B.反应②中生成物n(Na2SO3):n(NaHSO3)=1:1时,则反应物n(SO2):n(NaOH)=1:2
C.反应⑤中消耗的Zn和生成Na2S2O4的物质的量之比为1:2
D.工业上可利用反应②和反应④回收SO2
17.(2023春 成华区校级月考)下列说法正确的是( )
A.酸雨是指pH<7的雨水,酸雨长时间放置,酸性变强
B.用排空气法收集NO
C.SO2、Na2O2都能使品红溶液褪色,原理相同
D.陶和瓷属于硅酸盐材料,耐酸碱腐蚀
18.(2023 南海区校级开学)部分氮或硫元素化合物的价﹣类关系如图所示。下列叙述正确的是( )
A.a和b可能发生氧化还原反应
B.d的溶液一定具有强氧化性和脱水性
C.c的浓溶液通常保存于带橡胶塞的试剂瓶中
D.若用某种盐和d反应可制备c,则说明d酸性比c强
19.(2023 成都开学)下列有关硫及其化合物的说法错误的是( )
A.二氧化硫和三氧化硫均可由单质直接化合而成
B.硫原子最外层有6个电子,易得到2个电子形成﹣2 价的含硫化合物
C.浓硫酸与蔗糖反应体现了浓硫酸的脱水性和强氧化性
D.SO2能使滴有酚酞的NaOH溶液和品红褪色,两者褪色原理不相同
20.(2023春 朝阳区校级期末)下列说法正确的是( )
A.为增强高锰酸钾溶液的氧化能力,通常在其中加入适量的盐酸
B.同温同压下,两份相同质量的铁粉,分别与足量的稀硫酸和稀硝酸反应,产生气体的体积不相等
C.少量NO2和足量SO2混合气体通入BaCl2溶液中,产生的沉淀只有BaSO4
D.Na2O2和SO2均有漂白性,将二者分别加入紫色石蕊溶液中,最后均变为无色
21.(2023春 海淀区校级期末)向0.01mol/LAgNO3溶液中通入过量SO2过程和现象如图。经检验,白色沉淀为Ag2SO3;灰色固体中含有Ag,下列说法正确的是( )
A.①中生成白色沉淀的离子方程式为2Ag++SO2+H2O═Ag2SO3↓+2H+
B.取①中白色沉淀,加入足量盐酸,可观察到沉淀溶解
C.该实验证明酸性H2SO3大于HNO3
D.该实验条件下,SO2与AgNO3反应生成AgSO3的速率小于生成Ag的速率
22.(2023 浦东新区校级模拟)若将铜丝插入热浓硫酸中进行如图(a~d均为浸有相应试液的棉花)所示的探究实验,下列分析正确的是( )
A.Cu与浓硫酸反应,只体现H2SO4的酸性
B.a处变红,说明SO2是酸性氧化物
C.b或c处褪色,均说明SO2具有漂白性
D.试管底部出现白色固体,说明反应中无H2O生成
23.(2023春 武侯区校级期中)某同学按如图所示实验装置探究铜与浓硫酸的反应,记录实验现象如表。
试管 实验现象
① 白雾、白色固体产生
② 大量白色沉淀
③ 少量白色沉淀
④ 品红溶液褪色
下列说法不正确的是( )
A.①中玻璃管有平衡气压的作用
B.②③中的白色沉淀成分相同
C.为了确定①中白色固体是否为硫酸铜,可将试管内的物质缓慢注入水中,振荡观察
D.实验时若先往装置内通入足量N2,再加热试管①,实验现象不变
24.(2023春 武侯区校级期中)SO2属于严重的大气污染物,可用H2与SO2高温反应消除SO2的污染,其反应原理可分为两步,过程如图所示。下列说法正确的是( )
A.X中S元素的化合价为﹣2价
B.大气中的SO2必须氧化成SO3才能形成酸雨
C.在100~200℃温度时发生的是置换反应
D.工业上可用浓硝酸处理工业尾气中的SO2
25.(2023 江汉区开学)按如图装置进行实验,将稀硫酸全部加入Ⅰ中的试管,关闭活塞。下列说法正确的是( )
A.Ⅰ中试管内出现浑浊,体现H+的氧化性
B.Ⅱ和Ⅳ中溶液褪色,均体现SO2的漂白性
C.Ⅲ中出现了浑浊现象,体现了SO2的氧化性
D.撤掉水浴,重做实验,Ⅳ中红色更快褪去
2024年高考化学复习新题速递之硫及其化合物(2023年10月)
参考答案与试题解析
一.选择题(共25小题)
1.(2023秋 道里区校级月考)利用空气催化氧化法除掉电石渣浆(含CaO)上清液中的S2﹣,制取石膏(CaSO4 2H2O)的过程如图。下列说法正确的是 ( )
A.过程Ⅰ中锰元素被氧化
B.过程Ⅰ后溶液pH增大
C.过程Ⅱ中反应的离子方程式为2S2﹣+4+10H+═4Mn(OH)2+S2+H2O
D.将10L上清液中的S2﹣(S2﹣浓度为480mg/L)转化为,理论上共需要0.03molO2
【考点】含硫物质的性质及综合应用;氧化还原反应的基本规律及应用.版权所有
【专题】离子反应专题;制备实验综合.
【答案】A
【分析】由流程可知,CaO与硫酸锰反应生成Mn(OH)2,通入氧气生成,涉及反应为2Mn(OH)2+O2+4OH﹣=2+4H2O,与S2﹣反应生成S2,进而与氧气反应生成,可用于制备CaSO4 2H2O,以此解答该题。
【解答】解:A.过程Ⅰ为2Mn(OH)2+O2+4OH﹣=2+4H2O,Mn元素化合价升高,被氧化,故A正确;
B.过程Ⅰ为2Mn(OH)2+O2+4OH﹣=2+4H2O,消耗氢氧根离子溶液pH减小,故B错误;
C.过程Ⅱ中应当是碱性环境不应当出现氢离子,反应的离子方程式为2S2﹣+4+10H2O═4Mn(OH)2+S2S2+10OH﹣,故C错误;
D.将10L上清液中的S2﹣转化为(S2﹣浓度为480mg L﹣1),质量为480mg L﹣1×10L=4800mg=4.8g,物质的量为=0.15mol,根据得失电子守恒0.15mol×8=n(O2)×4,n(O2)=0.3mol,理论上共需要0.3mol的O2,故D错误;
故选:A。
【点评】本题考查物质的制备,为高频考点,把握物质的性质、电子守恒计算为解答的关键,侧重分析与实验、计算能力的考查,注意控制变量法及守恒法的应用,题目难度不大。
2.(2023秋 渝北区校级月考)下列有关说法正确的是( )
A.工业硝酸的质量分数约为69%,常因溶有少量Fe3+而呈现黄色
B.浓硫酸可于干燥CO和H2
C.向Cu与浓硫酸反应后的溶液中加入水,可观察到溶液变蓝
D.pH小于7的降水为酸雨,主要由SO2和氮氧化物的排放引起
【考点】浓硫酸的特性.版权所有
【专题】氧族元素;氮族元素.
【答案】B
【分析】A.工业硝酸中因为含有NO2而使溶液呈黄色;
B.和浓硫酸不反应的气体可以用浓硫酸干燥;
C.应该将反应后的溶液倒入水中;
D.酸雨的pH值小于5.6。
【解答】解:A.工业硝酸中因为含有NO2而使溶液呈黄色,浓盐酸溶液中因为含有Fe3+而使溶液呈黄色,故A错误;
B.CO、H2和浓硫酸不反应,所以可以用浓硫酸干燥,故B正确;
C.反应后的溶液中含有大量浓硫酸,所以应将反应后混合物注入水中,溶液变蓝,操作不合理,故C错误;
D.正常雨水的pH为5.6,酸雨的pH值小于5.6,酸雨主要由SO2和氮氧化物的排放引起,故D错误;
故选:B。
【点评】本题考查元素化合物的性质,侧重考查分析、判断及知识综合运用能力,明确元素化合物的性质、实验操作规范性是解本题关键,注意:正常雨水的pH不是7。
3.(2023秋 南海区月考)探究蔗糖与浓硫酸反应及气体产物的性质,设计如图所示实验,下列说法正确的是( )
A.蔗糖变为黑色,说明浓硫酸有强氧化性
B.品红和酸性KMnO4溶液褪色原理相同
C.石蕊变红,说明气体产物溶于水有酸性
D.澄清石灰水变浑浊,气体产物一定含SO2
【考点】浓硫酸的特性.版权所有
【专题】物质的性质和变化专题.
【答案】C
【分析】浓硫酸与润湿的蔗糖作用时,浓硫酸会将蔗糖中的H、O按水的组成比脱去使蔗糖变黑;浓硫酸具有强氧化性,浓硫酸与C受热时反应生成CO2、SO2和H2O,据此进行解答。
【解答】解:A.蔗糖变为黑色,说明浓硫酸有脱水性,故A错误;
B.品红溶液褪色是因为SO2具有漂白性、与品红生成不稳定的无色物质,酸性KMnO4溶液褪色是因为SO2具有还原性,发生反应5SO2+2KMnO4+2H2O=K2SO4+2MnSO4+2H2SO4,原理不相同,故B错误;
C.气体产物CO2、SO2的水溶液都呈酸性,能使石蕊变红,故C正确;
D.气体产物中的CO2也能使澄清石灰水变浑浊,故D错误;
故选:C。
【点评】本题考查浓硫酸的性质,注意掌握浓硫酸的性质是解题的关键,侧重于考查学生的分析能力和实验探究能力。
4.(2023 北京)蔗糖与浓硫酸发生作用的过程如图所示。
下列关于该过程的分析不正确的是( )
A.过程①白色固体变黑,主要体现了浓硫酸的脱水性
B.过程②固体体积膨胀,与产生的大量气体有关
C.过程中产生能使品红溶液褪色的气体,体现了浓硫酸的酸性
D.过程中蔗糖分子发生了化学键的断裂
【考点】浓硫酸的特性.版权所有
【专题】氧族元素.
【答案】C
【分析】A.浓硫酸将蔗糖中H原子、O原子按2:1比例以H2O的形成脱除;
B.浓硫酸与碳反应生成二氧化硫、二氧化碳使固体体积膨胀;
C.生成的二氧化硫使品红溶液褪色,浓硫酸发生还原反应生成二氧化硫;
D.蔗糖发生化学反应,一定有化学键的断裂。
【解答】解:A.浓硫酸将蔗糖中H原子、O原子按2:1比例以H2O的形成脱除,白色固体变黑,体现浓硫酸的脱水性,故A正确;
B.浓硫酸脱水过程中产生大量的热,会发生反应:C+2H2SO4(浓)CO2↑+2SO2↑+2H2O,产生的大量气体,使固体体积膨胀,故B正确;
C.浓硫酸脱水过程中生成的SO2使品红溶液褪色,浓硫酸发生还原反应生成二氧化硫,体现了浓硫酸的强氧化性,故C错误;
D.蔗糖发生化学反应,发生了化学键的断裂,故D正确;
故选:C。
【点评】本题考查浓硫酸性质实验,掌握浓硫酸的特性,题目难度不大,旨在考查学生对基础知识的掌握情况。
5.(2023 枣庄二模)实验室模拟制备亚硝酰硫酸(NOSO4H)的反应装置如图所示。已知:亚硝酰硫酸溶于硫酸,遇水易分解。下列说法错误的是( )
A.装置A中应使用70%的浓硫酸
B.装置B、D中浓硫酸作用不同
C.装置C中反应为SO2+HNO3=NOSO4H
D.虚线框内的装置可以换为盛有碱石灰的干燥管
【考点】工业制取硫酸.版权所有
【专题】氧族元素.
【答案】B
【分析】利用亚硫酸钠固体和硫酸反应制备二氧化硫气体,为防止亚硝酰硫酸遇水分解,故在干燥的条件下制备亚硝酰硫酸,最后尾气吸收过量二氧化硫,防止污染空气。
【解答】解:A.利用亚硫酸钠固体和硫酸反应制备二氧化硫气体,98%的浓硫酸的很难电离出H+,故一般选用70%的硫酸,故A正确;
B.亚硝酰硫酸遇水易分解,装置B中的浓硫酸的作用是干燥SO2气体,防止水蒸气进入装置C中,装置D中的浓硫酸的作用是防止装置E中的水蒸气进入装置C中,故B错误;
C.装置C中反应为SO2+HNO3=NOSO4H,故C正确;
D.虚线框内的装置可以换为盛有碱石灰的干燥管,既可以吸收尾气又可以防止空气中的水蒸气进入装置C,故D正确;
故选:B。
【点评】本题考查亚硝酰硫酸的制备,侧重考查学生含硫物质性质的掌握情况,试题难度中等。
6.(2023 西城区一模)实验小组探究SO2与Na2O2的反应。向盛有SO2的烧瓶中加入Na2O2固体,测得反应体系中O2含量的变化如图。下列说法不正确的是( )
A.有O2生成推测发生了反应:2Na2O2+2SO2═2Na2SO3+O2
B.bc段O2含量下降与反应O2+2Na2SO3═2Na2SO4有关
C.可用HNO3酸化的BaCl2溶液检验b点固体中是否含有Na2SO4
D.产物Na2SO4也可能是SO2与Na2O2直接化合生成的
【考点】二氧化硫的性质;过氧化钠的性质与用途.版权所有
【专题】氧族元素.
【答案】C
【分析】A.有O2生成,可能是Na2O2和SO2反应生成O2;
B.O2具有氧化性,能氧化还原性物质Na2SO3;
C.硝酸具有氧化性,能氧化Na2SO3生成Na2SO4;
D.SO2具有还原性、Na2O2具有氧化性,二者能发生氧化还原反应。
【解答】解:A.有O2生成,可能是Na2O2和SO2反应生成O2,反应方程式为2Na2O2+2SO2═2Na2SO3+O2,故A正确;
B.O2具有氧化性,能氧化还原性物质Na2SO3生成Na2SO4,bc段O2含量下降与反应O2+2Na2SO3═2Na2SO4有关,故B正确;
C.硝酸具有氧化性,能氧化Na2SO3生成Na2SO4,干扰Na2SO4的检验,应该用盐酸酸化的BaCl2检验,故C错误;
D.SO2具有还原性、Na2O2具有氧化性,二者能发生氧化还原反应,所以产物Na2SO4也可能是SO2与Na2O2直接化合生成的,故D正确;
故选:C。
【点评】本题考查元素化合物的性质,侧重考查图象分析判断及知识综合运用能力,明确图中曲线变化特点及元素化合物的性质、物质之间的转化关系是解本题关键,题目难度不大。
7.(2022秋 顺义区期末)碘循环工艺不仅能吸收SO2降低环境污染,同时还能制得氢气,具体流程如图:
下列说法不正确的是( )
A.反应器中SO2表现还原性
B.膜反应器中,增大压强有利于提高HI的平衡转化率
C.该工艺中I2和HI的相互转化体现了“碘循环”
D.碘循环工艺的总反应为:SO2+2H2O═H2↑+H2SO4
【考点】二氧化硫的性质.版权所有
【专题】氧族元素.
【答案】B
【分析】A.根据图知,反应器中反应方程式为SO2+I2+2H2OH2SO4+2HI,反应中S元素化合价由+4价变为+6价,则SO2作还原剂;
B.膜反应器中发生反应为2HI I2+H2,压强不影响平衡移动;
C.反应器中消耗的碘的量等于膜反应器中生成的碘的量;
D.在反应器中发生反应:SO2+I2+2H2O=2HI+H2SO4,在膜反应器中的反应为:2HI I2+H2,将两个方程式相加得总反应。
【解答】解:A.根据图知,反应器中反应方程式为SO2+I2+2H2OH2SO4+2HI,反应中S元素化合价由+4价变为+6价,则SO2作还原剂,SO2表现还原性,故A正确;
B.膜反应器中发生反应为2HI I2+H2,反应前后气体总物质的量不变,则压强不影响平衡移动,所以增大压强不影响HI的转化率,故B错误;
C.反应器中消耗的碘的量等于膜反应器中生成的碘的量,所以该工艺中I2和HI的相互转化体现了“碘循环”,故C正确;
D.在反应器中发生反应:SO2+I2+2H2O=2HI+H2SO4,在膜反应器中的反应为:2HI I2+H2,将两个方程式相加得:SO2+2H2O=H2SO4+H2,故D正确;
故选:B。
【点评】本题主要考查了碘循环工艺、根据题干信息掌握碘循环工艺反应原理,注意据流程分析问题是解答关键,题目难度中等。
8.(2023秋 璧山区校级月考)二氧化硫的催化氧化反应:2SO2(g)+O2(g)2SO3(g)是工业制硫酸的重要反应之一。下列说法错误的是( )
A.煅烧硫铁矿(主要成分FeS2)可获得SO2,将矿石粉碎成细小颗粒可以提高矿石利用率
B.已知该催化氧化反应K(300℃)>K(350℃),则该反应正向是放热反应
C.采用正向催化剂时,反应的活化能降低,使反应明显加快
D.工业生产中,采用的压强越高,温度越低,越有利于提高经济效益
【考点】工业制取硫酸;化学平衡的影响因素.版权所有
【专题】化学平衡专题.
【答案】D
【分析】A.将矿石粉碎成细小颗粒可以增大与反应物的接触面积;
B.升高温度,平衡常数减小,说明平衡逆向移动;
C.催化剂能降低反应的活化能;
D.压强越高,对动力装置及设备的要求越高,温度低,催化剂的活性低,反应速率慢。
【解答】解:A.煅烧硫铁矿(主要成分FeS2)可获得SO2,将矿石粉碎成细小颗粒可以增大与反应物的接触面积,使燃烧更充分,提高矿石利用率,故A正确;
B.升高温度,平衡常数减小,说明平衡逆向移动,逆向为吸热反应,正向为放热反应,故B正确;
C.催化剂能降低反应的活化能,使活化分子的百分数增大,有效碰撞几率增大,反应速率加快,故C正确;
D.压强越高,对动力装置及设备的要求越高,温度低,催化剂的活性低,反应速率慢,产量降低,所以不利于提高经济效益,故D错误;
故选:D。
【点评】本题考查化学平衡移动,为高频考点,侧重分析与应用能力的考查,注意把握反应的特征以及外界体积对平衡移动的影响,题目难度不大。
9.(2023秋 广州月考)工业制硫酸的原理示意图如图:
下列说法不正确的是( )
A.燃烧的化学方程式为4FeS2+11O22Fe2O3+8SO2
B.1mol SO2和足量O2充分反应转移2mol电子
C.用98.3%的浓硫酸吸收三氧化硫可避免形成酸雾
D.可用浓氨水吸收生产过程中的尾气并转化为铵盐
【考点】工业制取硫酸.版权所有
【专题】氧族元素.
【答案】B
【分析】A.FeS2燃烧生成氧化铁和二氧化硫;
B.2SO2+O2 2SO3 反应可逆;
C.用98.3%的浓硫酸吸收三氧化硫可避免形成酸雾;
D.浓氨水与二氧化硫反应生成亚硫酸铵。
【解答】解:A.FeS2燃烧生成氧化铁和二氧化硫,反应的化学方程式为4FeS2+11O22Fe2O3+8SO2,故A正确;
B.2SO2+O2 2SO3 反应可逆,1mol SO2和足量O2充分反应转移电子的物质的量小于2mol,故B错误;
C.用98.3%的浓硫酸吸收三氧化硫可避免形成酸雾,故C正确;
D.浓氨水与二氧化硫反应生成亚硫酸铵,用浓氨水吸收生产过程中的尾气二氧化硫生成亚硫酸铵,故D正确;
故选:B。
【点评】本题考查硫酸工业,侧重考查学生含硫物质性质的掌握情况,试题难度中等。
10.(2022秋 徐汇区期末)下列物质不能用于吸收H2S的是( )
A.FeSO4溶液 B.NaOH溶液
C.CuSO4溶液 D.酸性KMnO4溶液
【考点】硫化氢.版权所有
【专题】物质的性质和变化专题.
【答案】A
【分析】A.H2S的酸性小于硫酸;
B.H2S属于弱酸,能与NaOH溶液反应;
C.H2S与CuSO4溶液反应生成更难溶的CuS沉淀;
D.H2S具有还原性,能被酸性KMnO4溶液氧化。
【解答】解:A.氢硫酸的酸性弱于硫酸,氢硫酸不能与硫酸亚铁溶液反应,所以硫酸亚铁溶液不能用于吸收硫化氢气体,故A正确;
B.氢氧化钠溶液与硫化氢生成硫化钠和水,则氢氧化钠溶液能用于吸收硫化氢气体,故B错误;
C.硫酸铜溶液与硫化氢反应生成硫化铜沉淀和硫酸,则硫酸铜溶液能用于吸收硫化氢气体,故C错误;
D.酸性高锰酸钾溶液与硫化氢反应生成硫酸钾、硫酸锰、硫和水,则酸性高锰酸钾溶液能用于吸收硫化氢气体,故D错误;
故选:A。
【点评】本题考查H2S的性质,题目难度不大,注意H2S能与铜离子形成更难溶的CuS沉淀,学习中注意相关基础知识的积累。
11.(2022秋 徐汇区期末)不符合硫酸工业生产实际的是( )
A.沸腾炉中加入碾碎的硫铁矿
B.接触室中的反应条件为高温高压
C.催化氧化时通过热交换器充分利用能量
D.吸收塔中用98.3%的浓硫酸吸收SO3
【考点】工业制取硫酸;硫酸的性质.版权所有
【专题】卤族元素;化学应用.
【答案】B
【分析】A.增大反应物的接触面积,可以使反应更加充分;
B.接触室中的反应条件为高温常压;
C.催化氧化时通过热交换器可以预热反应物,同时降低容器中的温度,有利于平衡向正反应方向移动,提高二氧化硫的转化率;
D.吸收塔中用98.3%的浓硫酸吸收SO3,可以防止吸收过程中形成酸雾,提高SO3的吸收效率。
【解答】解:A.沸腾炉中加入碾碎的硫铁矿可以增大固体的表面积,是反应物的接触面积增大,反应更加充分,故A正确;
B.接触室中二氧化硫的催化氧化反应在常压下转化率已经很高,加压对转化率影响不大,但对设备材料要求较高,会导致成本增大,故接触室中的反应条件为高温常压,故B错误;
C.二氧化硫在接触室内催化氧化生成三氧化硫的反应为放热反应,催化氧化时通过热交换器可以预热反应物,同时降低容器中的温度,有利于平衡向正反应方向移动,提高二氧化硫的转化率,故C正确;
D.SO3溶解于水放热易形成酸雾,导致吸收效率低,若吸收塔中用98.3%的浓硫酸吸收SO3,可以防止吸收过程中形成酸雾,提高SO3的吸收效率,故D正确;
故选:B。
【点评】本题考查了元素化合物知识,侧重考查物质的制备,性质决定用途,熟悉硫酸制备过程是解题关键,题目难度不大。
12.(2022秋 徐汇区期末)将SO2分别通入下列溶液中,对现象的分析正确的是( )
选项 溶液 现象 分析
A 含酚酞的NaOH溶液 红色消失 SO2是酸性氧化物
B 溴水 橙色消失 SO2具有漂白性
C FeCl3溶液 变为浅绿色溶液 SO2+Fe3++H2O=Fe2++SO42﹣+2H+
D Na2S溶液 产生淡黄色浑浊 SO2+2S2﹣+H2O=3S↓+2OH﹣
A.A B.B C.C D.D
【考点】二氧化硫的性质.版权所有
【专题】氧族元素.
【答案】A
【分析】A.二氧化硫为酸性氧化物,能够与氢氧化钠溶液反应;
B.依据二氧化硫的还原性解答;
C.二氧化硫具有还原性,能够被氯化铁氧化;
D.依据二氧化硫的氧化性解答。
【解答】解:A.二氧化硫为酸性氧化物,能够与氢氧化钠溶液反应,所以能使含酚酞的NaOH溶液红色消失,故A正确;
B.二氧化硫使溴水褪色是因为其具有还原性,故B错误;
C.二氧化硫具有还原性,能够被氯化铁氧化,离子方程式为:SO2+2Fe3++2H2O=2Fe2++SO42﹣+4H+,故C错误;
D.二氧化硫具有氧化性,能氧化硫离子生成硫单质,离子方程式为:SO2+2S2﹣+2H2O=3S↓+4OH﹣,故D错误;
故选:A。
【点评】本题考查了元素化合物知识,熟悉二氧化硫性质是解题关键,题目难度不大。
13.(2023春 天山区校级期中)下列说法正确的是( )
A.可用澄清石灰水鉴别CO2与SO2
B.SO2能使溴水、酸性高锰酸钾溶液褪色,因其有漂白性
C.SO2能使紫色石蕊溶液先变红后褪色
D.SO2的漂白性与氯水漂白原理不同
【考点】二氧化硫的性质.版权所有
【专题】物质的性质和变化专题.
【答案】D
【分析】A.CO2与SO2都能使澄清石灰水变浑浊;
B.SO2能使溴水、酸性高锰酸钾溶液褪色,体现了二氧化硫的还原性;
C.SO2属于酸性氧化物,溶于水显酸性;
D.SO2体现漂白性时发生非氧化还原反应,氯水体现漂白时发生氧化还原反应。
【解答】解:A.CO2与SO2都能使澄清石灰水变浑浊,所以不可用澄清石灰水鉴别CO2与SO2,故A错误;
B.SO2能使溴水、酸性高锰酸钾溶液褪色,体现的不是漂白性,而是还原性,故B错误;
C.SO2属于酸性氧化物,只能使紫色石蕊溶液变红,但不能褪色,故C错误;
D.SO2体现漂白性时发生非氧化还原反应,氯水体现漂白时发生氧化还原反应,漂白原理不同,故D正确;
故选:D。
【点评】本题考查了含硫物质的性质,侧重二氧化硫性质、浓硫酸的性质的考查,注意性质与现象、用途的关系即可解答,注重基础知识的训练,题目难度不大。
14.(2023春 西宁期末)对于下列事实的解释正确的是( )
A.金属钠放入无水乙醇中产生大量气体,说明乙醇是一种酸
B.在蔗糖中加入浓硫酸后出现发黑现象,说明浓硫酸具有吸水性
C.向某溶液中插入铜丝,在试管口观察到红棕色气体,说明该溶液一定是浓硝酸
D.向某溶液中加入浓NaOH溶液,加热,产生能使湿润的红色石蕊试纸变蓝的气体,说明溶液中一定含有NH4+
【考点】浓硫酸的特性;乙醇的化学性质;常见阳离子的检验;硝酸的化学性质.版权所有
【专题】物质的性质和变化专题.
【答案】D
【分析】A.乙醇含﹣OH,与Na反应生成氢气;
B.依据浓硫酸的脱水性解答;
C.铜与稀硝酸反应生成一氧化氮,一氧化氮与氧气反应生成二氧化氮;
D.氨气可使湿润的红色石蕊试纸变蓝。
【解答】解:A.乙醇含﹣OH,与Na反应生成氢气,而乙醇为中性,故A错误;
B.在蔗糖中加入浓硫酸后出现发黑现象,说明浓硫酸具有脱水性,故B错误;
C.该溶液可能是稀硝酸,铜与稀硝酸反应生成一氧化氮,一氧化氮与氧气反应生成二氧化氮,在试管口观察到红棕色气体,故C错误;
D.氨气可使湿润的红色石蕊试纸变蓝,由操作和现象可知,原溶液中一定含有NH4+,故D正确;
故选:D。
【点评】本题考查化学实验方案的评价,为高频考点,把握物质的性质、反应与现象、实验技能为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析,题目难度不大。
15.(2023秋 南关区校级月考)利用空气催化氧化法除掉电石渣浆(含CaO)上层清液中的S2﹣并制取石膏(CaSO4 2H2O)的过程如图:
下列说法错误的是( )
A.CaSO4 2H2O属于盐类和纯净物
B.过程Ⅰ中氧化剂与还原剂的物质的量之比为1:2
C.过程Ⅱ中,反应的离子方程式为+2S2﹣+9H2O=S2+4Mn(OH)2↓+10OH﹣
D.将10L上层清液中的S2﹣(S2﹣浓度为480mg L﹣1)转化为,理论上共需要0.15molO2
【考点】含硫物质的性质及综合应用.版权所有
【专题】氧族元素.
【答案】D
【分析】CaO和MnSO4溶液反应生成Mn(OH)2,反应方程式为CaO+H2O+MnSO4=Mn(OH)2↓+CaSO4,Mn(OH)2、OH﹣、O2反应生成和H2O,离子方程式为:2Mn(OH)2+4OH﹣+O2=2+4H2O;过程ⅡS2﹣和反应生成S2和Mn(OH)2,离子反应方程式为4+2S2﹣+9H2O=S2+4Mn(OH)2↓+10OH﹣,S2被氧气氧化生成,和钙离子、H2O反应生成CaSO4 2H2O;
A.纯净物只有一种物质组成;由铵根离子和酸根离子或金属阳离子和酸根离子构成的纯净物为盐;
B.过程Ⅰ中氧化剂为氧气,变成水,1个氧气分子转移4个电子,还原剂为Mn(OH)2转化为,转移2个电子,发生反应时电子守恒;
C.过程Ⅱ中是碱性环境,、S2﹣、H2O反应生成S2、Mn(OH)2、OH﹣;
D.将10L上清液中的S2﹣转化为(S2﹣浓度为480mg L﹣1),质量为480mg L﹣1×10L=4800mg=4.8g,n(S2﹣)==0.15mol,根据得失电子守恒0.15mol×8=n(O2)×4,据此计算n(O2)。
【解答】解:A.CaSO4 2H2O是带有结晶水的盐,只有一种物质组成,则属于盐类和纯净物,故A正确;
B.过程Ⅰ中氧化剂为氧气,变成水,1个氧气分子转移4个电子,还原剂为Mn(OH)2转化为,转移2个电子,发生反应时电子守恒,所以氧化剂与还原剂的物质的量之比为1:2,故B正确;
C.过程Ⅱ中是碱性环境,反应的离子方程式为4+2S2﹣+9H2O═S2+4Mn(OH)2↓+10OH﹣,故C正确;
D.将10L上清液中的S2﹣转化为(S2﹣浓度为480mg L﹣1),质量为480mg L﹣1×10L=4800mg=4.8g,n(S2﹣)==0.15mol,根据得失电子守恒0.15mol×8=n(O2)×4,n(O2)=0.3mol,理论上共需要0.3mol的O2,故D错误;
故选:D。
【点评】本题考查物质的制备,为高频考点,把握物质的性质、电子守恒计算为解答的关键,侧重分析与实验、计算能力的考查,注意控制变量法及守恒法的应用,题目难度不大。
16.(2023春 仁寿县期中)如图所示是一系列含硫化合物的转化关系(反应中生成的水已略去),其中说法正确的是( )
A.反应①说明SO2具有漂白性,反应②说明SO2具有酸性
B.反应②中生成物n(Na2SO3):n(NaHSO3)=1:1时,则反应物n(SO2):n(NaOH)=1:2
C.反应⑤中消耗的Zn和生成Na2S2O4的物质的量之比为1:2
D.工业上可利用反应②和反应④回收SO2
【考点】含硫物质的性质及综合应用.版权所有
【专题】氧族元素.
【答案】D
【分析】反应①中先变蓝后褪色显然是因为KIO3被氧化成碘单质然后生成碘离子;二氧化硫和氢氧化钠反应体现了其酸性氧化物的性质。
【解答】解:A.反应①中先变蓝后褪色显然是因为KIO3在反应中先是生成I2后转化为I﹣,体现了SO2具有还原性,反应②属于酸性氧化物和碱的反应,体现了SO2具有酸性氧化物的性质,故A错误;
B.根据元素守恒,当n(Na2SO3):n(NaHSO3)=1:1时,n(SO2):n(NaOH)=2:3,故B错误;
C.反应⑤中锌化合价由0变为+2、硫化合价由+4变为+3,根据电子守恒可知,消耗的Zn和生成Na2S2O4的物质的量之比为1:1,故C错误;
D.反应②吸收了二氧化硫,反应④放出了SO2,可以通过2个反应回收二氧化硫,故D正确;
故选:D。
【点评】本题考查氧化还原反应和酸碱反应的相关知识,旨在考查考生分析问题和解决问题的能力,题目难度中等,注意把握氧化还原反应的原理和原子守恒的应用。
17.(2023春 成华区校级月考)下列说法正确的是( )
A.酸雨是指pH<7的雨水,酸雨长时间放置,酸性变强
B.用排空气法收集NO
C.SO2、Na2O2都能使品红溶液褪色,原理相同
D.陶和瓷属于硅酸盐材料,耐酸碱腐蚀
【考点】二氧化硫的性质.版权所有
【专题】氧族元素.
【答案】D
【分析】酸雨是指pH<5.6的雨水,NO易被氧化,SO2、Na2O2的性质不同,陶和瓷属于硅酸盐材料,耐酸碱腐蚀,以此做题。
【解答】解:A.酸雨是指pH<5.6的雨水,故A错误;
B.NO易被氧气氧化为NO2,不能用排空气法收集,故B错误;
C.SO2、Na2O2都能使品红溶液褪色,原理不同,前者是化合作用,后者是氧化作用,故C错误;
D.陶和瓷属于硅酸盐材料,耐酸碱腐蚀,故D正确;
故选:D。
【点评】本题主要考查二氧化硫的性质,难度中等。
18.(2023 南海区校级开学)部分氮或硫元素化合物的价﹣类关系如图所示。下列叙述正确的是( )
A.a和b可能发生氧化还原反应
B.d的溶液一定具有强氧化性和脱水性
C.c的浓溶液通常保存于带橡胶塞的试剂瓶中
D.若用某种盐和d反应可制备c,则说明d酸性比c强
【考点】含硫物质的性质及综合应用.版权所有
【专题】氧族元素;氮族元素.
【答案】A
【分析】由题意可知,a为H2S或N2H4;b为SO2或NO2;c为HNO3;d为H2SO4;据此分析。
【解答】 解:A.H2S和SO2反应生成S和H2O,N2H4和NO2反应生成N2和H2O均为氧化还原反应,故A正确;
B.浓硫酸具有强氧化性和脱水性,但稀硫酸没有强氧化性和脱水性,故B错误;
C.浓硝酸具有强氧化性,会腐蚀橡胶塞,故浓硝酸不能保存于带橡胶塞的试剂瓶中,故C错误;
D.硝酸钠与浓硫酸反应生成硝酸,利用高沸点酸制备低沸点酸,与酸性强弱无关,故D错误;
故选:A。
【点评】本题考查含氮、含硫物质的性质,为高频考点,把握物质的性质、发生的反应为解答的关键,侧重分析与应用能力的考查,注意元素化合物知识的应用,题目难度不大。
19.(2023 成都开学)下列有关硫及其化合物的说法错误的是( )
A.二氧化硫和三氧化硫均可由单质直接化合而成
B.硫原子最外层有6个电子,易得到2个电子形成﹣2 价的含硫化合物
C.浓硫酸与蔗糖反应体现了浓硫酸的脱水性和强氧化性
D.SO2能使滴有酚酞的NaOH溶液和品红褪色,两者褪色原理不相同
【考点】含硫物质的性质及综合应用.版权所有
【专题】氧族元素.
【答案】A
【分析】硫在氧气中燃烧只能生成二氧化硫,浓硫酸具有脱水性,SO2 能使滴有酚酞的NaOH溶液褪色是 SO2 作为酸性氧化物与碱反应后碱性减弱造成褪色,以此做题。
【解答】解:A.硫在氧气中燃烧只能生成二氧化硫,故A错误;
B.硫原子最外层有6个电子,易得到2个电子达到8电子稳定结构,得到﹣2 价的含硫化合物,故B正确;
C.浓硫酸与蔗糖反应实验中,浓硫酸的脱水性使蔗糖脱水碳化,碳被浓硫酸氧化成二氧化碳,故C正确;
D.SO2 能使滴有酚酞的NaOH溶液褪色是 SO2 作为酸性氧化物与碱反应后碱性减弱造成褪色,使品红褪色是 SO2 与品红结合生成不稳定的无色物质,两者褪色原理不相同,故D正确;
故选:A。
【点评】本题主要考查含硫物质的性质与综合应用,侧重考查对知识的理解,难度不大。
20.(2023春 朝阳区校级期末)下列说法正确的是( )
A.为增强高锰酸钾溶液的氧化能力,通常在其中加入适量的盐酸
B.同温同压下,两份相同质量的铁粉,分别与足量的稀硫酸和稀硝酸反应,产生气体的体积不相等
C.少量NO2和足量SO2混合气体通入BaCl2溶液中,产生的沉淀只有BaSO4
D.Na2O2和SO2均有漂白性,将二者分别加入紫色石蕊溶液中,最后均变为无色
【考点】二氧化硫的性质.版权所有
【专题】氧族元素;氮族元素.
【答案】C
【分析】A.稀盐酸与高锰酸钾溶液发生氧化还原反应;
B.足量的稀硫酸和稀硝酸反应,与Fe发生的反应不同,Fe~H2SO4~H2↑、Fe~4HNO3~NO↑;
C.二氧化氮可以将二氧化硫在溶液中氧化为硫酸根离子;
D.二氧化硫不能漂白指示剂。
【解答】解:A.稀盐酸与高锰酸钾溶液发生氧化还原反应,则为了增强高锰酸钾溶液的氧化能力,用稀硫酸将高锰酸钾溶液进行酸化,故A错误;
B.足量的稀硫酸和稀硝酸反应,与Fe发生的反应不同,由Fe~H2SO4~H2↑、Fe~4HNO3~NO↑可知,等量的Fe反应产生气体的体积相等,故B错误;
C.二氧化氮可以将二氧化硫在溶液中氧化为硫酸根离子,少量的NO2和足量SO2混合气体通入BaCl2溶液中,产生的沉淀只有BaSO4,故C正确;
D.二氧化硫不能漂白指示剂,二氧化硫加入紫色石蕊溶液中,最后为红色,故D错误;
故选:C。
【点评】本题考查化学实验方案的评价,把握物质的性质、反应原理及实验技能为解答的关键,侧重分析与实验能力的考查,题目难度不大。
21.(2023春 海淀区校级期末)向0.01mol/LAgNO3溶液中通入过量SO2过程和现象如图。经检验,白色沉淀为Ag2SO3;灰色固体中含有Ag,下列说法正确的是( )
A.①中生成白色沉淀的离子方程式为2Ag++SO2+H2O═Ag2SO3↓+2H+
B.取①中白色沉淀,加入足量盐酸,可观察到沉淀溶解
C.该实验证明酸性H2SO3大于HNO3
D.该实验条件下,SO2与AgNO3反应生成AgSO3的速率小于生成Ag的速率
【考点】二氧化硫的性质;性质实验方案的设计.版权所有
【专题】氧族元素.
【答案】A
【分析】向AgNO3溶液中通入过量SO2,经检验白色沉淀为Ag2SO3,灰色固体中含有Ag,说明开始生成Ag2SO3,一段时间后转化为银单质。
【解答】解:A.向AgNO3溶液中通入过量SO2,经检验白色沉淀为Ag2SO3,则反应为2Ag++SO2+H2O═Ag2SO3↓+2H+,故A正确;
B.取①中白色沉淀,加入足量盐酸,Ag2SO3沉淀转化为AgCl沉淀,沉淀不会溶解,故B错误;
C.HNO3的酸性大于H2SO3,该实验能够发生是由于生成了难溶物Ag2SO3,故C错误;
D.该实验条件下,SO2与AgNO3反应开始生成Ag2SO3,一段时间后转化为银单质,说明实验中生成Ag2SO3的速率大于生成Ag的速率,故D错误;
故选:A。
【点评】本题考查含硫物质的性质,侧重考查学生物质之间的反应和氧化还原知识的掌握情况,试题难度中等。
22.(2023 浦东新区校级模拟)若将铜丝插入热浓硫酸中进行如图(a~d均为浸有相应试液的棉花)所示的探究实验,下列分析正确的是( )
A.Cu与浓硫酸反应,只体现H2SO4的酸性
B.a处变红,说明SO2是酸性氧化物
C.b或c处褪色,均说明SO2具有漂白性
D.试管底部出现白色固体,说明反应中无H2O生成
【考点】浓硫酸的性质实验.版权所有
【专题】氧族元素.
【答案】B
【分析】A.铜和浓硫酸反应生成SO2,体现浓硫酸的强氧化性;
B.SO2溶于水生成了酸,可说明SO2是酸性氧化物;
C.SO2具有漂白性,只能使品红溶液褪色;
D.浓硫酸具有吸水性,将反应生成的H2O吸收。
【解答】解:A.铜和浓硫酸反应过程中,生成CuSO4体现出浓硫酸的酸性,生成SO2体现出浓硫酸的强氧化性,故A错误;
B.a处的紫色石蕊溶液变红,其原因是SO2溶于水生成了酸,可说明SO2是酸性氧化物,故B正确;
C.b处品红溶液褪色,其原因是SO2具有漂白性,而c处酸性高锰酸钾溶液褪色,其原因是SO2和KMnO4发生氧化还原反应,SO2体现出还原性,故C错误;
D.实验过程中试管底部出现白色固体,其成分为无水CuSO4,而非蓝色的CuSO4 5H2O,其原因是浓硫酸体现出吸水性,将反应生成的H2O吸收,故D错误;
故选:B。
【点评】本题考查浓硫酸的性质,侧重考查学生硫及其化合物性质的掌握情况,试题难度中等。
23.(2023春 武侯区校级期中)某同学按如图所示实验装置探究铜与浓硫酸的反应,记录实验现象如表。
试管 实验现象
① 白雾、白色固体产生
② 大量白色沉淀
③ 少量白色沉淀
④ 品红溶液褪色
下列说法不正确的是( )
A.①中玻璃管有平衡气压的作用
B.②③中的白色沉淀成分相同
C.为了确定①中白色固体是否为硫酸铜,可将试管内的物质缓慢注入水中,振荡观察
D.实验时若先往装置内通入足量N2,再加热试管①,实验现象不变
【考点】浓硫酸的性质实验.版权所有
【专题】氧族元素.
【答案】D
【分析】浓硫酸与铜反应生成硫酸铜和二氧化硫,二氧化硫不能与氯化钡反应,②③中有白色沉淀硫酸钡生成,则证明二氧化硫反应生成了三氧化硫,④中品红溶液褪色,证明有二氧化硫。
【解答】解:A.①中玻璃管与大气连通,能够平衡气压,故A正确;
B.②③中白色沉淀均为硫酸钡,成分相同,故B正确;
C.硫酸铜溶液为蓝色,向试管中注水,若白色固体溶解,溶液变蓝,则证明白色固体为硫酸铜,故C正确;
D.二氧化硫不能与氯化钡反应,若实验时先通氮气排出空气,无三氧化硫生成,则②③中均无沉淀生成,故D错误;
故选:D。
【点评】本题考查含硫物质的性质,侧重考查学生基础知识的掌握情况,试题难度中等。
24.(2023春 武侯区校级期中)SO2属于严重的大气污染物,可用H2与SO2高温反应消除SO2的污染,其反应原理可分为两步,过程如图所示。下列说法正确的是( )
A.X中S元素的化合价为﹣2价
B.大气中的SO2必须氧化成SO3才能形成酸雨
C.在100~200℃温度时发生的是置换反应
D.工业上可用浓硝酸处理工业尾气中的SO2
【考点】二氧化硫的性质.版权所有
【专题】氧族元素.
【答案】A
【分析】根据反应原理,300℃时H2和SO2反应生成X为H2S,H2S在100~200℃和SO2反应生成S,据此解答。
【解答】解:A.根据分析,则X为H2S,S化合价为﹣2价,故A正确;
B.SO2可以和水反应生成H2SO3,H2SO3可以被氧气氧化为H2SO4,故B错误;
C.在100~200℃温度时SO2化合价降低,X化合价升高,反应为2H2S+SO2=3S↓+2H2O,不属于置换反应,故C错误;
D.浓硝酸处理工业尾气中的SO2会生成氮氧化物,污染环境,故D错误;
故选:A。
【点评】本题考查元素化合物知识,掌握氮、硫及其化合物的性质是解答关键,题目难度不大。
25.(2023 江汉区开学)按如图装置进行实验,将稀硫酸全部加入Ⅰ中的试管,关闭活塞。下列说法正确的是( )
A.Ⅰ中试管内出现浑浊,体现H+的氧化性
B.Ⅱ和Ⅳ中溶液褪色,均体现SO2的漂白性
C.Ⅲ中出现了浑浊现象,体现了SO2的氧化性
D.撤掉水浴,重做实验,Ⅳ中红色更快褪去
【考点】二氧化硫的性质.版权所有
【专题】氧族元素.
【答案】C
【分析】I中发生反应:Na2S2O3+H2SO4=Na2SO4+S↓+SO2↑+H2O,SO2具有漂白性,Ⅱ中品红溶液褪色,Ⅲ中会发生反应:SO2+2Na2S+2H2O═3S↓+4NaHSO3,溶液会变浑浊,Ⅳ证明SO2是酸性氧化物,同时可以吸收SO2,防止污染空气。
【解答】解:A.I中发生反应:Na2S2O3+H2SO4=Na2SO4+S↓+SO2↑+H2O,S2体现氧化性、还原性,而H+只表现酸性,故A错误;
B.Ⅱ中品红溶液褪色,体现SO2的漂白性,故B错误;
C.Ⅲ中会发生反应:SO2+2Na2S+2H2O═3S↓+4NaHSO3,SO2中硫元素化合价降低,体现了SO2的氧化性,故C正确;
D.撤掉水浴,重做实验,I中反应速率减慢,即生成SO2的速率减慢,则Ⅳ中红色褪去时间变长了,故D错误;
故选:C。
【点评】本题考查实验分析与评价,关键是明确实验原理,熟练掌握SO2的性质,题目难度不大。
考点卡片
1.氧化还原反应的基本规律及应用
0
2.化学平衡的影响因素
【知识点的认识】
1、化学平衡的影响因素(v﹣t图象):
(1)浓度:
a、增大反应物浓度,平衡正向移动;减小反应物浓度,平衡逆向移动
增大反应物浓度,平衡正向移动 减小反应物浓度,平衡逆向移动
b、增大生成物浓度,平衡逆向移动;减小生成物浓度,平衡正向移动
减小生成物浓度,平衡正向移动 增大生成物浓度,平衡逆向移动
(2)温度:
①升高温度,平衡向吸热反应方向移动:
②降低温度,平衡向放热反应方向移动:
(3)压强:
①增大压强,反应朝着气体体积减小的方向进行;
②减小压强,反应朝着气体体积增大的方向进行.
③对于气体体积不变的反应,压强改变平衡不移动.
(4)催化剂:催化剂同倍数增大反应物浓度,平衡不移动.
2、化学平衡移动原理(勒夏特列原理):
改变影响平衡的一个条件(如浓度、压强、温度),平衡就向能够减弱这种改变的方向移动,这就是勒夏特列原理.
概念的理解:
①影响平衡的因素只有浓度、压强、温度三种;
②原理的适用范围是只有一项条件变化的情况,当多项条件同时发生变化时,情况比较复杂;
③定性角度:平衡移动的方向为减弱外界改变的方向;
定量角度:平衡移动的结果只能减弱(不可能抵消)外界条件的变化.
【命题方向】
题型一:化学平衡的影响因素
典例1:(2014 安徽模拟)COCl2(g) CO(g)+Cl2(g);△H>0.当反应达到平衡时,下列措施:①升温 ②恒容通入惰性气体 ③增加CO浓度 ④减压 ⑤加催化剂 ⑥恒压通入惰性气体,能提高COCl2转化率的是( )
A.①②④B.①④⑥C.②③⑤D.③⑤⑥
分析:化学反应COCl2(g) CO(g)+Cl2(g)△H>0,正反应是气体体积增大的吸热反应,
①升温平衡向吸热反应方向移动;
②恒容通入惰性气体,总压增大,分压不变,平衡不动;
③增加CO的浓度,平衡逆向进行;
④减压平衡向气体体积增大的方向进行;
⑤加催化剂,改变速率不改变平衡;
⑥恒压通入惰性气体,压强增大,为保持恒压,体积增大压强减小,平衡正向进行.
解答:化学反应COCl2(g) CO(g)+Cl2(g)△H>0,正反应是气体体积增大的吸热反应,
①升温平衡向正反应移动,COCl2转化率增大,故①符合;
②恒容通入惰性气体,总压增大,反应混合物各组分的浓度不变,平衡不移动,COCl2转化率不变,故②不符合;
③增加CO的浓度,平衡向逆反应方向移动,COCl2转化率减小故③不符合;
④减压平衡向正反应方向移动,COCl2转化率增大,故④符合;
⑤加催化剂,改变速率不改变平衡,COCl2转化率不变,故⑤不符合;
⑥恒压通入惰性气体,压强增大,为保持恒压,体积增大压强减小,平衡正向进行,COCl2转化率增大,故⑥符合,
故选:B.
点评:本题考查了化学平衡的影响因素,注意理解通入惰性气体对平衡移动影响,题目难度中等.
题型二:图象题分析
典例2:对于可逆反应:A2(g)+3B2(g) 2AB3(g);△H<0下列图象中正确的是( )
A. B. C. D.
分析:对于可逆反应A2(g)+3B2(g) 2AB3(g)△H<0,正反应放热,升高温度正逆反应速率都增大,化学向逆反应方向移动,增大压强,平衡向正反应方向移动,结合图象分析解答.
解答:A.升高温度,正逆反应速率都增大,平衡向逆反应方向移动,交叉点后,逆反应速率应该大于正反应速率,故A正确;
B.该反应是气体体积减小的可逆反应,增大压强,平衡向正反应方向移动,所以A的含量是减小,压强一定升高温度,平衡向逆反应方向移动,A的含量增大,故B正确;
C.该反应是放热反应,先拐先平,温度高,故C错误;
D.压强越大,反应速率越大,正逆反应速率都增大,故D错误;
故选AB.
点评:本题考查化学平衡的图象,明确外界条件对化学平衡的影响及图象中纵横坐标的含义、“定一议二”“先拐先平”即可解答,难度不大.
【解题方法点拨】外界条件对化学反应速率和化学平衡影响对比分析:
条件变化 反应特征 化学反应速率 v正与v逆的关系 平衡移动方向
增大c(A) 可逆反应 加快 加快 v正>v逆 正反应方向
增大c(C) 加快 加快 v正<v逆 逆反应方向
减小c(A) 减慢 减慢 v正<v逆 逆反应方向
减小c(C) 减慢 减慢 v正>v逆 正反应方向
增大压强 m+n>p+q 加快 加快 v正>v逆 正反应方向
m+n=p+q 加快 加快 v正=v逆 平衡不移动
m+n<p+q 加快 加快 v正<v逆 逆反应方向
减小压强 m+n>p+q 减慢 减慢 v正<v逆 逆反应方向
m+n=p+q 减慢 减慢 v正=v逆 平衡不移动
m+n<p+q 减慢 减慢 v正>v逆 正反应方向
升高温度 Q<0 加快 加快 v正<v逆 逆反应方向
Q>0 加快 加快 v正>v逆 正反应方向
降低温度 Q<0 减慢 减慢 v正>v逆 正反应方向
Q>0 减慢 减慢 v正<v逆 逆反应方向
注意:
①升高温度和增大压强,正逆反应速率都加快,只是增加幅度不同,因此平衡发生移动;
②降低温度和减小压强,正逆反应速率都减慢.
3.硝酸的化学性质
【知识点的知识】
1)强酸性:HNO3=H++NO3﹣;硝酸是一元强酸,具有酸的通性.
2)不稳定性:4HNO3(浓)4NO2↑+O2↑+2H2O
注意:①浓度越大,越易分解;久置硝酸呈黄色的原因的分解的NO2溶于溶液,使得溶液变黄;
②硝酸应保存在玻璃塞(HNO3腐蚀橡胶)棕色细口瓶中,放于阴凉处.
3)强氧化性:
①与金属反应:除Pt、Au外的金属均能与HNO3反应.
Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O(实验室制NO2)
3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O(实验室制NO,常温下缓慢反应,加热反应较剧烈)
注意:a.常温下,浓HNO3使Fe、Al等金属钝化;
b.金属与硝酸反应不产生H2.
3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O
Fe+4HNO3=Fe(NO3)3+NO↑+2H2O
3Zn+8HNO3=3Zn(NO3)2+2NO↑+4H2O
4Zn+10HNO3=4Zn(NO3)2+N2O+5H2O
4Zn+10HNO3=4Zn(NO3)2+NH4NO3+3H2O
金属与硝酸反应规律:
硝酸同金属的反应比较复杂,因为(a)硝酸的浓度;(b)金属的活泼性;(c)反应的温度等不同,所生成的产物亦不同,并且所生成的产物往往是混合物.但是就其主要产物而言,可以概括出以下几点.
(1)在金属活动性顺序表中,位于“H”以后的金属如Cu、Ag、Hg等与浓HNO3反应主要得到NO2,与稀HNO3反应主要得到NO.
(2)活泼性适中的金属如:Fe、Co、Ni、Cr、Ca、Al等金属,在一般情况下与浓HNO3不反应.这是由于“钝化”作用,使金属表面覆盖了一层致密的氧化膜,阻止了内层金属进一步与浓硝酸反应.这些金属与稀HNO3作用主要生成N2O或者NO,这是由于它们的还原性较强,能将硝酸还原到较低的价态.若与更稀的硝酸反应,则可以生成NH3.
(3)活泼性的金属如Mg、Zn等与不同浓度的稀HNO3作用能得到不同低价态的还原产物.
(4)Au、Pt、Rh、Ti、Ta等贵金属和硝酸不发生反应.因为它们特别稳定,不易被氧化.
(5)Sn、Pb、As、W等金属与HNO3作用得到的是金属氧化物或其水合物而不是硝酸盐.因为这些金属氧化物不溶于硝酸.
对于同一种金属来说,酸越稀则硝酸本身被还原的程度越大.镁与不同浓度硝酸反应的方程式是:
Mg+4HNO3(浓 )=Mg(NO3)2+2NO2↑+2H2O
3Mg+8HNO3(8M)=3Mg(NO3)2+2NO↑+4H2O
4Mg+10HNO3(2M)=4Mg(NO3)2+N2O↑+5H2O
4Mg+10HNO3(lM)=4Mg(NO3)2+NH4NO3+3H2O
Mg+2HNO3(极稀)=Mg(NO3)2+H2↑
②与非金属反应:能氧化C、S、P等非金属.
C+4HNO3(浓)=CO2↑+4NO2↑+H2O
S+6HNO3(浓)=H2SO4+6NO2↑+2H2O
③与H2S、HBr、HI、SO2、KI、Na2SO3等物质反应.
6KI+8HNO3=6KNO3+3I2+2NO+4H2O
3H2S+2HNO3(稀)=3S↓+2NO+4H2O
3Na2S+8HNO3(稀)=6NaNO3+2NO↑+3S↓+4H2O
3Na2SO3+2HNO3(稀)=3Na2SO4+2NO↑+H2O
说明:a.氧化性:浓硝酸>稀硝酸;
b.一般情况下:浓硝酸的还原产物是NO2;稀硝酸的还原产物是NO
c.王水:浓硝酸和浓盐酸按体积比1:3混合而成.王水有很强的氧化性,能溶解Pt、Au等金属.
4.二氧化硫的性质
0
5.硫酸的性质
0
6.浓硫酸的特性
一.选择题(共25小题)
1.(2023秋 道里区校级月考)利用空气催化氧化法除掉电石渣浆(含CaO)上清液中的S2﹣,制取石膏(CaSO4 2H2O)的过程如图。下列说法正确的是 ( )
A.过程Ⅰ中锰元素被氧化
B.过程Ⅰ后溶液pH增大
C.过程Ⅱ中反应的离子方程式为2S2﹣+4+10H+═4Mn(OH)2+S2+H2O
D.将10L上清液中的S2﹣(S2﹣浓度为480mg/L)转化为,理论上共需要0.03molO2
2.(2023秋 渝北区校级月考)下列有关说法正确的是( )
A.工业硝酸的质量分数约为69%,常因溶有少量Fe3+而呈现黄色
B.浓硫酸可于干燥CO和H2
C.向Cu与浓硫酸反应后的溶液中加入水,可观察到溶液变蓝
D.pH小于7的降水为酸雨,主要由SO2和氮氧化物的排放引起
3.(2023秋 南海区月考)探究蔗糖与浓硫酸反应及气体产物的性质,设计如图所示实验,下列说法正确的是( )
A.蔗糖变为黑色,说明浓硫酸有强氧化性
B.品红和酸性KMnO4溶液褪色原理相同
C.石蕊变红,说明气体产物溶于水有酸性
D.澄清石灰水变浑浊,气体产物一定含SO2
4.(2023 北京)蔗糖与浓硫酸发生作用的过程如图所示。
下列关于该过程的分析不正确的是( )
A.过程①白色固体变黑,主要体现了浓硫酸的脱水性
B.过程②固体体积膨胀,与产生的大量气体有关
C.过程中产生能使品红溶液褪色的气体,体现了浓硫酸的酸性
D.过程中蔗糖分子发生了化学键的断裂
5.(2023 枣庄二模)实验室模拟制备亚硝酰硫酸(NOSO4H)的反应装置如图所示。已知:亚硝酰硫酸溶于硫酸,遇水易分解。下列说法错误的是( )
A.装置A中应使用70%的浓硫酸
B.装置B、D中浓硫酸作用不同
C.装置C中反应为SO2+HNO3=NOSO4H
D.虚线框内的装置可以换为盛有碱石灰的干燥管
6.(2023 西城区一模)实验小组探究SO2与Na2O2的反应。向盛有SO2的烧瓶中加入Na2O2固体,测得反应体系中O2含量的变化如图。下列说法不正确的是( )
A.有O2生成推测发生了反应:2Na2O2+2SO2═2Na2SO3+O2
B.bc段O2含量下降与反应O2+2Na2SO3═2Na2SO4有关
C.可用HNO3酸化的BaCl2溶液检验b点固体中是否含有Na2SO4
D.产物Na2SO4也可能是SO2与Na2O2直接化合生成的
7.(2022秋 顺义区期末)碘循环工艺不仅能吸收SO2降低环境污染,同时还能制得氢气,具体流程如图:
下列说法不正确的是( )
A.反应器中SO2表现还原性
B.膜反应器中,增大压强有利于提高HI的平衡转化率
C.该工艺中I2和HI的相互转化体现了“碘循环”
D.碘循环工艺的总反应为:SO2+2H2O═H2↑+H2SO4
8.(2023秋 璧山区校级月考)二氧化硫的催化氧化反应:2SO2(g)+O2(g)2SO3(g)是工业制硫酸的重要反应之一。下列说法错误的是( )
A.煅烧硫铁矿(主要成分FeS2)可获得SO2,将矿石粉碎成细小颗粒可以提高矿石利用率
B.已知该催化氧化反应K(300℃)>K(350℃),则该反应正向是放热反应
C.采用正向催化剂时,反应的活化能降低,使反应明显加快
D.工业生产中,采用的压强越高,温度越低,越有利于提高经济效益
9.(2023秋 广州月考)工业制硫酸的原理示意图如图:
下列说法不正确的是( )
A.燃烧的化学方程式为4FeS2+11O22Fe2O3+8SO2
B.1mol SO2和足量O2充分反应转移2mol电子
C.用98.3%的浓硫酸吸收三氧化硫可避免形成酸雾
D.可用浓氨水吸收生产过程中的尾气并转化为铵盐
10.(2022秋 徐汇区期末)下列物质不能用于吸收H2S的是( )
A.FeSO4溶液 B.NaOH溶液
C.CuSO4溶液 D.酸性KMnO4溶液
11.(2022秋 徐汇区期末)不符合硫酸工业生产实际的是( )
A.沸腾炉中加入碾碎的硫铁矿
B.接触室中的反应条件为高温高压
C.催化氧化时通过热交换器充分利用能量
D.吸收塔中用98.3%的浓硫酸吸收SO3
12.(2022秋 徐汇区期末)将SO2分别通入下列溶液中,对现象的分析正确的是( )
选项 溶液 现象 分析
A 含酚酞的NaOH溶液 红色消失 SO2是酸性氧化物
B 溴水 橙色消失 SO2具有漂白性
C FeCl3溶液 变为浅绿色溶液 SO2+Fe3++H2O=Fe2++SO42﹣+2H+
D Na2S溶液 产生淡黄色浑浊 SO2+2S2﹣+H2O=3S↓+2OH﹣
A.A B.B C.C D.D
13.(2023春 天山区校级期中)下列说法正确的是( )
A.可用澄清石灰水鉴别CO2与SO2
B.SO2能使溴水、酸性高锰酸钾溶液褪色,因其有漂白性
C.SO2能使紫色石蕊溶液先变红后褪色
D.SO2的漂白性与氯水漂白原理不同
14.(2023春 西宁期末)对于下列事实的解释正确的是( )
A.金属钠放入无水乙醇中产生大量气体,说明乙醇是一种酸
B.在蔗糖中加入浓硫酸后出现发黑现象,说明浓硫酸具有吸水性
C.向某溶液中插入铜丝,在试管口观察到红棕色气体,说明该溶液一定是浓硝酸
D.向某溶液中加入浓NaOH溶液,加热,产生能使湿润的红色石蕊试纸变蓝的气体,说明溶液中一定含有NH4+
15.(2023秋 南关区校级月考)利用空气催化氧化法除掉电石渣浆(含CaO)上层清液中的S2﹣并制取石膏(CaSO4 2H2O)的过程如图:
下列说法错误的是( )
A.CaSO4 2H2O属于盐类和纯净物
B.过程Ⅰ中氧化剂与还原剂的物质的量之比为1:2
C.过程Ⅱ中,反应的离子方程式为+2S2﹣+9H2O=S2+4Mn(OH)2↓+10OH﹣
D.将10L上层清液中的S2﹣(S2﹣浓度为480mg L﹣1)转化为,理论上共需要0.15molO2
16.(2023春 仁寿县期中)如图所示是一系列含硫化合物的转化关系(反应中生成的水已略去),其中说法正确的是( )
A.反应①说明SO2具有漂白性,反应②说明SO2具有酸性
B.反应②中生成物n(Na2SO3):n(NaHSO3)=1:1时,则反应物n(SO2):n(NaOH)=1:2
C.反应⑤中消耗的Zn和生成Na2S2O4的物质的量之比为1:2
D.工业上可利用反应②和反应④回收SO2
17.(2023春 成华区校级月考)下列说法正确的是( )
A.酸雨是指pH<7的雨水,酸雨长时间放置,酸性变强
B.用排空气法收集NO
C.SO2、Na2O2都能使品红溶液褪色,原理相同
D.陶和瓷属于硅酸盐材料,耐酸碱腐蚀
18.(2023 南海区校级开学)部分氮或硫元素化合物的价﹣类关系如图所示。下列叙述正确的是( )
A.a和b可能发生氧化还原反应
B.d的溶液一定具有强氧化性和脱水性
C.c的浓溶液通常保存于带橡胶塞的试剂瓶中
D.若用某种盐和d反应可制备c,则说明d酸性比c强
19.(2023 成都开学)下列有关硫及其化合物的说法错误的是( )
A.二氧化硫和三氧化硫均可由单质直接化合而成
B.硫原子最外层有6个电子,易得到2个电子形成﹣2 价的含硫化合物
C.浓硫酸与蔗糖反应体现了浓硫酸的脱水性和强氧化性
D.SO2能使滴有酚酞的NaOH溶液和品红褪色,两者褪色原理不相同
20.(2023春 朝阳区校级期末)下列说法正确的是( )
A.为增强高锰酸钾溶液的氧化能力,通常在其中加入适量的盐酸
B.同温同压下,两份相同质量的铁粉,分别与足量的稀硫酸和稀硝酸反应,产生气体的体积不相等
C.少量NO2和足量SO2混合气体通入BaCl2溶液中,产生的沉淀只有BaSO4
D.Na2O2和SO2均有漂白性,将二者分别加入紫色石蕊溶液中,最后均变为无色
21.(2023春 海淀区校级期末)向0.01mol/LAgNO3溶液中通入过量SO2过程和现象如图。经检验,白色沉淀为Ag2SO3;灰色固体中含有Ag,下列说法正确的是( )
A.①中生成白色沉淀的离子方程式为2Ag++SO2+H2O═Ag2SO3↓+2H+
B.取①中白色沉淀,加入足量盐酸,可观察到沉淀溶解
C.该实验证明酸性H2SO3大于HNO3
D.该实验条件下,SO2与AgNO3反应生成AgSO3的速率小于生成Ag的速率
22.(2023 浦东新区校级模拟)若将铜丝插入热浓硫酸中进行如图(a~d均为浸有相应试液的棉花)所示的探究实验,下列分析正确的是( )
A.Cu与浓硫酸反应,只体现H2SO4的酸性
B.a处变红,说明SO2是酸性氧化物
C.b或c处褪色,均说明SO2具有漂白性
D.试管底部出现白色固体,说明反应中无H2O生成
23.(2023春 武侯区校级期中)某同学按如图所示实验装置探究铜与浓硫酸的反应,记录实验现象如表。
试管 实验现象
① 白雾、白色固体产生
② 大量白色沉淀
③ 少量白色沉淀
④ 品红溶液褪色
下列说法不正确的是( )
A.①中玻璃管有平衡气压的作用
B.②③中的白色沉淀成分相同
C.为了确定①中白色固体是否为硫酸铜,可将试管内的物质缓慢注入水中,振荡观察
D.实验时若先往装置内通入足量N2,再加热试管①,实验现象不变
24.(2023春 武侯区校级期中)SO2属于严重的大气污染物,可用H2与SO2高温反应消除SO2的污染,其反应原理可分为两步,过程如图所示。下列说法正确的是( )
A.X中S元素的化合价为﹣2价
B.大气中的SO2必须氧化成SO3才能形成酸雨
C.在100~200℃温度时发生的是置换反应
D.工业上可用浓硝酸处理工业尾气中的SO2
25.(2023 江汉区开学)按如图装置进行实验,将稀硫酸全部加入Ⅰ中的试管,关闭活塞。下列说法正确的是( )
A.Ⅰ中试管内出现浑浊,体现H+的氧化性
B.Ⅱ和Ⅳ中溶液褪色,均体现SO2的漂白性
C.Ⅲ中出现了浑浊现象,体现了SO2的氧化性
D.撤掉水浴,重做实验,Ⅳ中红色更快褪去
2024年高考化学复习新题速递之硫及其化合物(2023年10月)
参考答案与试题解析
一.选择题(共25小题)
1.(2023秋 道里区校级月考)利用空气催化氧化法除掉电石渣浆(含CaO)上清液中的S2﹣,制取石膏(CaSO4 2H2O)的过程如图。下列说法正确的是 ( )
A.过程Ⅰ中锰元素被氧化
B.过程Ⅰ后溶液pH增大
C.过程Ⅱ中反应的离子方程式为2S2﹣+4+10H+═4Mn(OH)2+S2+H2O
D.将10L上清液中的S2﹣(S2﹣浓度为480mg/L)转化为,理论上共需要0.03molO2
【考点】含硫物质的性质及综合应用;氧化还原反应的基本规律及应用.版权所有
【专题】离子反应专题;制备实验综合.
【答案】A
【分析】由流程可知,CaO与硫酸锰反应生成Mn(OH)2,通入氧气生成,涉及反应为2Mn(OH)2+O2+4OH﹣=2+4H2O,与S2﹣反应生成S2,进而与氧气反应生成,可用于制备CaSO4 2H2O,以此解答该题。
【解答】解:A.过程Ⅰ为2Mn(OH)2+O2+4OH﹣=2+4H2O,Mn元素化合价升高,被氧化,故A正确;
B.过程Ⅰ为2Mn(OH)2+O2+4OH﹣=2+4H2O,消耗氢氧根离子溶液pH减小,故B错误;
C.过程Ⅱ中应当是碱性环境不应当出现氢离子,反应的离子方程式为2S2﹣+4+10H2O═4Mn(OH)2+S2S2+10OH﹣,故C错误;
D.将10L上清液中的S2﹣转化为(S2﹣浓度为480mg L﹣1),质量为480mg L﹣1×10L=4800mg=4.8g,物质的量为=0.15mol,根据得失电子守恒0.15mol×8=n(O2)×4,n(O2)=0.3mol,理论上共需要0.3mol的O2,故D错误;
故选:A。
【点评】本题考查物质的制备,为高频考点,把握物质的性质、电子守恒计算为解答的关键,侧重分析与实验、计算能力的考查,注意控制变量法及守恒法的应用,题目难度不大。
2.(2023秋 渝北区校级月考)下列有关说法正确的是( )
A.工业硝酸的质量分数约为69%,常因溶有少量Fe3+而呈现黄色
B.浓硫酸可于干燥CO和H2
C.向Cu与浓硫酸反应后的溶液中加入水,可观察到溶液变蓝
D.pH小于7的降水为酸雨,主要由SO2和氮氧化物的排放引起
【考点】浓硫酸的特性.版权所有
【专题】氧族元素;氮族元素.
【答案】B
【分析】A.工业硝酸中因为含有NO2而使溶液呈黄色;
B.和浓硫酸不反应的气体可以用浓硫酸干燥;
C.应该将反应后的溶液倒入水中;
D.酸雨的pH值小于5.6。
【解答】解:A.工业硝酸中因为含有NO2而使溶液呈黄色,浓盐酸溶液中因为含有Fe3+而使溶液呈黄色,故A错误;
B.CO、H2和浓硫酸不反应,所以可以用浓硫酸干燥,故B正确;
C.反应后的溶液中含有大量浓硫酸,所以应将反应后混合物注入水中,溶液变蓝,操作不合理,故C错误;
D.正常雨水的pH为5.6,酸雨的pH值小于5.6,酸雨主要由SO2和氮氧化物的排放引起,故D错误;
故选:B。
【点评】本题考查元素化合物的性质,侧重考查分析、判断及知识综合运用能力,明确元素化合物的性质、实验操作规范性是解本题关键,注意:正常雨水的pH不是7。
3.(2023秋 南海区月考)探究蔗糖与浓硫酸反应及气体产物的性质,设计如图所示实验,下列说法正确的是( )
A.蔗糖变为黑色,说明浓硫酸有强氧化性
B.品红和酸性KMnO4溶液褪色原理相同
C.石蕊变红,说明气体产物溶于水有酸性
D.澄清石灰水变浑浊,气体产物一定含SO2
【考点】浓硫酸的特性.版权所有
【专题】物质的性质和变化专题.
【答案】C
【分析】浓硫酸与润湿的蔗糖作用时,浓硫酸会将蔗糖中的H、O按水的组成比脱去使蔗糖变黑;浓硫酸具有强氧化性,浓硫酸与C受热时反应生成CO2、SO2和H2O,据此进行解答。
【解答】解:A.蔗糖变为黑色,说明浓硫酸有脱水性,故A错误;
B.品红溶液褪色是因为SO2具有漂白性、与品红生成不稳定的无色物质,酸性KMnO4溶液褪色是因为SO2具有还原性,发生反应5SO2+2KMnO4+2H2O=K2SO4+2MnSO4+2H2SO4,原理不相同,故B错误;
C.气体产物CO2、SO2的水溶液都呈酸性,能使石蕊变红,故C正确;
D.气体产物中的CO2也能使澄清石灰水变浑浊,故D错误;
故选:C。
【点评】本题考查浓硫酸的性质,注意掌握浓硫酸的性质是解题的关键,侧重于考查学生的分析能力和实验探究能力。
4.(2023 北京)蔗糖与浓硫酸发生作用的过程如图所示。
下列关于该过程的分析不正确的是( )
A.过程①白色固体变黑,主要体现了浓硫酸的脱水性
B.过程②固体体积膨胀,与产生的大量气体有关
C.过程中产生能使品红溶液褪色的气体,体现了浓硫酸的酸性
D.过程中蔗糖分子发生了化学键的断裂
【考点】浓硫酸的特性.版权所有
【专题】氧族元素.
【答案】C
【分析】A.浓硫酸将蔗糖中H原子、O原子按2:1比例以H2O的形成脱除;
B.浓硫酸与碳反应生成二氧化硫、二氧化碳使固体体积膨胀;
C.生成的二氧化硫使品红溶液褪色,浓硫酸发生还原反应生成二氧化硫;
D.蔗糖发生化学反应,一定有化学键的断裂。
【解答】解:A.浓硫酸将蔗糖中H原子、O原子按2:1比例以H2O的形成脱除,白色固体变黑,体现浓硫酸的脱水性,故A正确;
B.浓硫酸脱水过程中产生大量的热,会发生反应:C+2H2SO4(浓)CO2↑+2SO2↑+2H2O,产生的大量气体,使固体体积膨胀,故B正确;
C.浓硫酸脱水过程中生成的SO2使品红溶液褪色,浓硫酸发生还原反应生成二氧化硫,体现了浓硫酸的强氧化性,故C错误;
D.蔗糖发生化学反应,发生了化学键的断裂,故D正确;
故选:C。
【点评】本题考查浓硫酸性质实验,掌握浓硫酸的特性,题目难度不大,旨在考查学生对基础知识的掌握情况。
5.(2023 枣庄二模)实验室模拟制备亚硝酰硫酸(NOSO4H)的反应装置如图所示。已知:亚硝酰硫酸溶于硫酸,遇水易分解。下列说法错误的是( )
A.装置A中应使用70%的浓硫酸
B.装置B、D中浓硫酸作用不同
C.装置C中反应为SO2+HNO3=NOSO4H
D.虚线框内的装置可以换为盛有碱石灰的干燥管
【考点】工业制取硫酸.版权所有
【专题】氧族元素.
【答案】B
【分析】利用亚硫酸钠固体和硫酸反应制备二氧化硫气体,为防止亚硝酰硫酸遇水分解,故在干燥的条件下制备亚硝酰硫酸,最后尾气吸收过量二氧化硫,防止污染空气。
【解答】解:A.利用亚硫酸钠固体和硫酸反应制备二氧化硫气体,98%的浓硫酸的很难电离出H+,故一般选用70%的硫酸,故A正确;
B.亚硝酰硫酸遇水易分解,装置B中的浓硫酸的作用是干燥SO2气体,防止水蒸气进入装置C中,装置D中的浓硫酸的作用是防止装置E中的水蒸气进入装置C中,故B错误;
C.装置C中反应为SO2+HNO3=NOSO4H,故C正确;
D.虚线框内的装置可以换为盛有碱石灰的干燥管,既可以吸收尾气又可以防止空气中的水蒸气进入装置C,故D正确;
故选:B。
【点评】本题考查亚硝酰硫酸的制备,侧重考查学生含硫物质性质的掌握情况,试题难度中等。
6.(2023 西城区一模)实验小组探究SO2与Na2O2的反应。向盛有SO2的烧瓶中加入Na2O2固体,测得反应体系中O2含量的变化如图。下列说法不正确的是( )
A.有O2生成推测发生了反应:2Na2O2+2SO2═2Na2SO3+O2
B.bc段O2含量下降与反应O2+2Na2SO3═2Na2SO4有关
C.可用HNO3酸化的BaCl2溶液检验b点固体中是否含有Na2SO4
D.产物Na2SO4也可能是SO2与Na2O2直接化合生成的
【考点】二氧化硫的性质;过氧化钠的性质与用途.版权所有
【专题】氧族元素.
【答案】C
【分析】A.有O2生成,可能是Na2O2和SO2反应生成O2;
B.O2具有氧化性,能氧化还原性物质Na2SO3;
C.硝酸具有氧化性,能氧化Na2SO3生成Na2SO4;
D.SO2具有还原性、Na2O2具有氧化性,二者能发生氧化还原反应。
【解答】解:A.有O2生成,可能是Na2O2和SO2反应生成O2,反应方程式为2Na2O2+2SO2═2Na2SO3+O2,故A正确;
B.O2具有氧化性,能氧化还原性物质Na2SO3生成Na2SO4,bc段O2含量下降与反应O2+2Na2SO3═2Na2SO4有关,故B正确;
C.硝酸具有氧化性,能氧化Na2SO3生成Na2SO4,干扰Na2SO4的检验,应该用盐酸酸化的BaCl2检验,故C错误;
D.SO2具有还原性、Na2O2具有氧化性,二者能发生氧化还原反应,所以产物Na2SO4也可能是SO2与Na2O2直接化合生成的,故D正确;
故选:C。
【点评】本题考查元素化合物的性质,侧重考查图象分析判断及知识综合运用能力,明确图中曲线变化特点及元素化合物的性质、物质之间的转化关系是解本题关键,题目难度不大。
7.(2022秋 顺义区期末)碘循环工艺不仅能吸收SO2降低环境污染,同时还能制得氢气,具体流程如图:
下列说法不正确的是( )
A.反应器中SO2表现还原性
B.膜反应器中,增大压强有利于提高HI的平衡转化率
C.该工艺中I2和HI的相互转化体现了“碘循环”
D.碘循环工艺的总反应为:SO2+2H2O═H2↑+H2SO4
【考点】二氧化硫的性质.版权所有
【专题】氧族元素.
【答案】B
【分析】A.根据图知,反应器中反应方程式为SO2+I2+2H2OH2SO4+2HI,反应中S元素化合价由+4价变为+6价,则SO2作还原剂;
B.膜反应器中发生反应为2HI I2+H2,压强不影响平衡移动;
C.反应器中消耗的碘的量等于膜反应器中生成的碘的量;
D.在反应器中发生反应:SO2+I2+2H2O=2HI+H2SO4,在膜反应器中的反应为:2HI I2+H2,将两个方程式相加得总反应。
【解答】解:A.根据图知,反应器中反应方程式为SO2+I2+2H2OH2SO4+2HI,反应中S元素化合价由+4价变为+6价,则SO2作还原剂,SO2表现还原性,故A正确;
B.膜反应器中发生反应为2HI I2+H2,反应前后气体总物质的量不变,则压强不影响平衡移动,所以增大压强不影响HI的转化率,故B错误;
C.反应器中消耗的碘的量等于膜反应器中生成的碘的量,所以该工艺中I2和HI的相互转化体现了“碘循环”,故C正确;
D.在反应器中发生反应:SO2+I2+2H2O=2HI+H2SO4,在膜反应器中的反应为:2HI I2+H2,将两个方程式相加得:SO2+2H2O=H2SO4+H2,故D正确;
故选:B。
【点评】本题主要考查了碘循环工艺、根据题干信息掌握碘循环工艺反应原理,注意据流程分析问题是解答关键,题目难度中等。
8.(2023秋 璧山区校级月考)二氧化硫的催化氧化反应:2SO2(g)+O2(g)2SO3(g)是工业制硫酸的重要反应之一。下列说法错误的是( )
A.煅烧硫铁矿(主要成分FeS2)可获得SO2,将矿石粉碎成细小颗粒可以提高矿石利用率
B.已知该催化氧化反应K(300℃)>K(350℃),则该反应正向是放热反应
C.采用正向催化剂时,反应的活化能降低,使反应明显加快
D.工业生产中,采用的压强越高,温度越低,越有利于提高经济效益
【考点】工业制取硫酸;化学平衡的影响因素.版权所有
【专题】化学平衡专题.
【答案】D
【分析】A.将矿石粉碎成细小颗粒可以增大与反应物的接触面积;
B.升高温度,平衡常数减小,说明平衡逆向移动;
C.催化剂能降低反应的活化能;
D.压强越高,对动力装置及设备的要求越高,温度低,催化剂的活性低,反应速率慢。
【解答】解:A.煅烧硫铁矿(主要成分FeS2)可获得SO2,将矿石粉碎成细小颗粒可以增大与反应物的接触面积,使燃烧更充分,提高矿石利用率,故A正确;
B.升高温度,平衡常数减小,说明平衡逆向移动,逆向为吸热反应,正向为放热反应,故B正确;
C.催化剂能降低反应的活化能,使活化分子的百分数增大,有效碰撞几率增大,反应速率加快,故C正确;
D.压强越高,对动力装置及设备的要求越高,温度低,催化剂的活性低,反应速率慢,产量降低,所以不利于提高经济效益,故D错误;
故选:D。
【点评】本题考查化学平衡移动,为高频考点,侧重分析与应用能力的考查,注意把握反应的特征以及外界体积对平衡移动的影响,题目难度不大。
9.(2023秋 广州月考)工业制硫酸的原理示意图如图:
下列说法不正确的是( )
A.燃烧的化学方程式为4FeS2+11O22Fe2O3+8SO2
B.1mol SO2和足量O2充分反应转移2mol电子
C.用98.3%的浓硫酸吸收三氧化硫可避免形成酸雾
D.可用浓氨水吸收生产过程中的尾气并转化为铵盐
【考点】工业制取硫酸.版权所有
【专题】氧族元素.
【答案】B
【分析】A.FeS2燃烧生成氧化铁和二氧化硫;
B.2SO2+O2 2SO3 反应可逆;
C.用98.3%的浓硫酸吸收三氧化硫可避免形成酸雾;
D.浓氨水与二氧化硫反应生成亚硫酸铵。
【解答】解:A.FeS2燃烧生成氧化铁和二氧化硫,反应的化学方程式为4FeS2+11O22Fe2O3+8SO2,故A正确;
B.2SO2+O2 2SO3 反应可逆,1mol SO2和足量O2充分反应转移电子的物质的量小于2mol,故B错误;
C.用98.3%的浓硫酸吸收三氧化硫可避免形成酸雾,故C正确;
D.浓氨水与二氧化硫反应生成亚硫酸铵,用浓氨水吸收生产过程中的尾气二氧化硫生成亚硫酸铵,故D正确;
故选:B。
【点评】本题考查硫酸工业,侧重考查学生含硫物质性质的掌握情况,试题难度中等。
10.(2022秋 徐汇区期末)下列物质不能用于吸收H2S的是( )
A.FeSO4溶液 B.NaOH溶液
C.CuSO4溶液 D.酸性KMnO4溶液
【考点】硫化氢.版权所有
【专题】物质的性质和变化专题.
【答案】A
【分析】A.H2S的酸性小于硫酸;
B.H2S属于弱酸,能与NaOH溶液反应;
C.H2S与CuSO4溶液反应生成更难溶的CuS沉淀;
D.H2S具有还原性,能被酸性KMnO4溶液氧化。
【解答】解:A.氢硫酸的酸性弱于硫酸,氢硫酸不能与硫酸亚铁溶液反应,所以硫酸亚铁溶液不能用于吸收硫化氢气体,故A正确;
B.氢氧化钠溶液与硫化氢生成硫化钠和水,则氢氧化钠溶液能用于吸收硫化氢气体,故B错误;
C.硫酸铜溶液与硫化氢反应生成硫化铜沉淀和硫酸,则硫酸铜溶液能用于吸收硫化氢气体,故C错误;
D.酸性高锰酸钾溶液与硫化氢反应生成硫酸钾、硫酸锰、硫和水,则酸性高锰酸钾溶液能用于吸收硫化氢气体,故D错误;
故选:A。
【点评】本题考查H2S的性质,题目难度不大,注意H2S能与铜离子形成更难溶的CuS沉淀,学习中注意相关基础知识的积累。
11.(2022秋 徐汇区期末)不符合硫酸工业生产实际的是( )
A.沸腾炉中加入碾碎的硫铁矿
B.接触室中的反应条件为高温高压
C.催化氧化时通过热交换器充分利用能量
D.吸收塔中用98.3%的浓硫酸吸收SO3
【考点】工业制取硫酸;硫酸的性质.版权所有
【专题】卤族元素;化学应用.
【答案】B
【分析】A.增大反应物的接触面积,可以使反应更加充分;
B.接触室中的反应条件为高温常压;
C.催化氧化时通过热交换器可以预热反应物,同时降低容器中的温度,有利于平衡向正反应方向移动,提高二氧化硫的转化率;
D.吸收塔中用98.3%的浓硫酸吸收SO3,可以防止吸收过程中形成酸雾,提高SO3的吸收效率。
【解答】解:A.沸腾炉中加入碾碎的硫铁矿可以增大固体的表面积,是反应物的接触面积增大,反应更加充分,故A正确;
B.接触室中二氧化硫的催化氧化反应在常压下转化率已经很高,加压对转化率影响不大,但对设备材料要求较高,会导致成本增大,故接触室中的反应条件为高温常压,故B错误;
C.二氧化硫在接触室内催化氧化生成三氧化硫的反应为放热反应,催化氧化时通过热交换器可以预热反应物,同时降低容器中的温度,有利于平衡向正反应方向移动,提高二氧化硫的转化率,故C正确;
D.SO3溶解于水放热易形成酸雾,导致吸收效率低,若吸收塔中用98.3%的浓硫酸吸收SO3,可以防止吸收过程中形成酸雾,提高SO3的吸收效率,故D正确;
故选:B。
【点评】本题考查了元素化合物知识,侧重考查物质的制备,性质决定用途,熟悉硫酸制备过程是解题关键,题目难度不大。
12.(2022秋 徐汇区期末)将SO2分别通入下列溶液中,对现象的分析正确的是( )
选项 溶液 现象 分析
A 含酚酞的NaOH溶液 红色消失 SO2是酸性氧化物
B 溴水 橙色消失 SO2具有漂白性
C FeCl3溶液 变为浅绿色溶液 SO2+Fe3++H2O=Fe2++SO42﹣+2H+
D Na2S溶液 产生淡黄色浑浊 SO2+2S2﹣+H2O=3S↓+2OH﹣
A.A B.B C.C D.D
【考点】二氧化硫的性质.版权所有
【专题】氧族元素.
【答案】A
【分析】A.二氧化硫为酸性氧化物,能够与氢氧化钠溶液反应;
B.依据二氧化硫的还原性解答;
C.二氧化硫具有还原性,能够被氯化铁氧化;
D.依据二氧化硫的氧化性解答。
【解答】解:A.二氧化硫为酸性氧化物,能够与氢氧化钠溶液反应,所以能使含酚酞的NaOH溶液红色消失,故A正确;
B.二氧化硫使溴水褪色是因为其具有还原性,故B错误;
C.二氧化硫具有还原性,能够被氯化铁氧化,离子方程式为:SO2+2Fe3++2H2O=2Fe2++SO42﹣+4H+,故C错误;
D.二氧化硫具有氧化性,能氧化硫离子生成硫单质,离子方程式为:SO2+2S2﹣+2H2O=3S↓+4OH﹣,故D错误;
故选:A。
【点评】本题考查了元素化合物知识,熟悉二氧化硫性质是解题关键,题目难度不大。
13.(2023春 天山区校级期中)下列说法正确的是( )
A.可用澄清石灰水鉴别CO2与SO2
B.SO2能使溴水、酸性高锰酸钾溶液褪色,因其有漂白性
C.SO2能使紫色石蕊溶液先变红后褪色
D.SO2的漂白性与氯水漂白原理不同
【考点】二氧化硫的性质.版权所有
【专题】物质的性质和变化专题.
【答案】D
【分析】A.CO2与SO2都能使澄清石灰水变浑浊;
B.SO2能使溴水、酸性高锰酸钾溶液褪色,体现了二氧化硫的还原性;
C.SO2属于酸性氧化物,溶于水显酸性;
D.SO2体现漂白性时发生非氧化还原反应,氯水体现漂白时发生氧化还原反应。
【解答】解:A.CO2与SO2都能使澄清石灰水变浑浊,所以不可用澄清石灰水鉴别CO2与SO2,故A错误;
B.SO2能使溴水、酸性高锰酸钾溶液褪色,体现的不是漂白性,而是还原性,故B错误;
C.SO2属于酸性氧化物,只能使紫色石蕊溶液变红,但不能褪色,故C错误;
D.SO2体现漂白性时发生非氧化还原反应,氯水体现漂白时发生氧化还原反应,漂白原理不同,故D正确;
故选:D。
【点评】本题考查了含硫物质的性质,侧重二氧化硫性质、浓硫酸的性质的考查,注意性质与现象、用途的关系即可解答,注重基础知识的训练,题目难度不大。
14.(2023春 西宁期末)对于下列事实的解释正确的是( )
A.金属钠放入无水乙醇中产生大量气体,说明乙醇是一种酸
B.在蔗糖中加入浓硫酸后出现发黑现象,说明浓硫酸具有吸水性
C.向某溶液中插入铜丝,在试管口观察到红棕色气体,说明该溶液一定是浓硝酸
D.向某溶液中加入浓NaOH溶液,加热,产生能使湿润的红色石蕊试纸变蓝的气体,说明溶液中一定含有NH4+
【考点】浓硫酸的特性;乙醇的化学性质;常见阳离子的检验;硝酸的化学性质.版权所有
【专题】物质的性质和变化专题.
【答案】D
【分析】A.乙醇含﹣OH,与Na反应生成氢气;
B.依据浓硫酸的脱水性解答;
C.铜与稀硝酸反应生成一氧化氮,一氧化氮与氧气反应生成二氧化氮;
D.氨气可使湿润的红色石蕊试纸变蓝。
【解答】解:A.乙醇含﹣OH,与Na反应生成氢气,而乙醇为中性,故A错误;
B.在蔗糖中加入浓硫酸后出现发黑现象,说明浓硫酸具有脱水性,故B错误;
C.该溶液可能是稀硝酸,铜与稀硝酸反应生成一氧化氮,一氧化氮与氧气反应生成二氧化氮,在试管口观察到红棕色气体,故C错误;
D.氨气可使湿润的红色石蕊试纸变蓝,由操作和现象可知,原溶液中一定含有NH4+,故D正确;
故选:D。
【点评】本题考查化学实验方案的评价,为高频考点,把握物质的性质、反应与现象、实验技能为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析,题目难度不大。
15.(2023秋 南关区校级月考)利用空气催化氧化法除掉电石渣浆(含CaO)上层清液中的S2﹣并制取石膏(CaSO4 2H2O)的过程如图:
下列说法错误的是( )
A.CaSO4 2H2O属于盐类和纯净物
B.过程Ⅰ中氧化剂与还原剂的物质的量之比为1:2
C.过程Ⅱ中,反应的离子方程式为+2S2﹣+9H2O=S2+4Mn(OH)2↓+10OH﹣
D.将10L上层清液中的S2﹣(S2﹣浓度为480mg L﹣1)转化为,理论上共需要0.15molO2
【考点】含硫物质的性质及综合应用.版权所有
【专题】氧族元素.
【答案】D
【分析】CaO和MnSO4溶液反应生成Mn(OH)2,反应方程式为CaO+H2O+MnSO4=Mn(OH)2↓+CaSO4,Mn(OH)2、OH﹣、O2反应生成和H2O,离子方程式为:2Mn(OH)2+4OH﹣+O2=2+4H2O;过程ⅡS2﹣和反应生成S2和Mn(OH)2,离子反应方程式为4+2S2﹣+9H2O=S2+4Mn(OH)2↓+10OH﹣,S2被氧气氧化生成,和钙离子、H2O反应生成CaSO4 2H2O;
A.纯净物只有一种物质组成;由铵根离子和酸根离子或金属阳离子和酸根离子构成的纯净物为盐;
B.过程Ⅰ中氧化剂为氧气,变成水,1个氧气分子转移4个电子,还原剂为Mn(OH)2转化为,转移2个电子,发生反应时电子守恒;
C.过程Ⅱ中是碱性环境,、S2﹣、H2O反应生成S2、Mn(OH)2、OH﹣;
D.将10L上清液中的S2﹣转化为(S2﹣浓度为480mg L﹣1),质量为480mg L﹣1×10L=4800mg=4.8g,n(S2﹣)==0.15mol,根据得失电子守恒0.15mol×8=n(O2)×4,据此计算n(O2)。
【解答】解:A.CaSO4 2H2O是带有结晶水的盐,只有一种物质组成,则属于盐类和纯净物,故A正确;
B.过程Ⅰ中氧化剂为氧气,变成水,1个氧气分子转移4个电子,还原剂为Mn(OH)2转化为,转移2个电子,发生反应时电子守恒,所以氧化剂与还原剂的物质的量之比为1:2,故B正确;
C.过程Ⅱ中是碱性环境,反应的离子方程式为4+2S2﹣+9H2O═S2+4Mn(OH)2↓+10OH﹣,故C正确;
D.将10L上清液中的S2﹣转化为(S2﹣浓度为480mg L﹣1),质量为480mg L﹣1×10L=4800mg=4.8g,n(S2﹣)==0.15mol,根据得失电子守恒0.15mol×8=n(O2)×4,n(O2)=0.3mol,理论上共需要0.3mol的O2,故D错误;
故选:D。
【点评】本题考查物质的制备,为高频考点,把握物质的性质、电子守恒计算为解答的关键,侧重分析与实验、计算能力的考查,注意控制变量法及守恒法的应用,题目难度不大。
16.(2023春 仁寿县期中)如图所示是一系列含硫化合物的转化关系(反应中生成的水已略去),其中说法正确的是( )
A.反应①说明SO2具有漂白性,反应②说明SO2具有酸性
B.反应②中生成物n(Na2SO3):n(NaHSO3)=1:1时,则反应物n(SO2):n(NaOH)=1:2
C.反应⑤中消耗的Zn和生成Na2S2O4的物质的量之比为1:2
D.工业上可利用反应②和反应④回收SO2
【考点】含硫物质的性质及综合应用.版权所有
【专题】氧族元素.
【答案】D
【分析】反应①中先变蓝后褪色显然是因为KIO3被氧化成碘单质然后生成碘离子;二氧化硫和氢氧化钠反应体现了其酸性氧化物的性质。
【解答】解:A.反应①中先变蓝后褪色显然是因为KIO3在反应中先是生成I2后转化为I﹣,体现了SO2具有还原性,反应②属于酸性氧化物和碱的反应,体现了SO2具有酸性氧化物的性质,故A错误;
B.根据元素守恒,当n(Na2SO3):n(NaHSO3)=1:1时,n(SO2):n(NaOH)=2:3,故B错误;
C.反应⑤中锌化合价由0变为+2、硫化合价由+4变为+3,根据电子守恒可知,消耗的Zn和生成Na2S2O4的物质的量之比为1:1,故C错误;
D.反应②吸收了二氧化硫,反应④放出了SO2,可以通过2个反应回收二氧化硫,故D正确;
故选:D。
【点评】本题考查氧化还原反应和酸碱反应的相关知识,旨在考查考生分析问题和解决问题的能力,题目难度中等,注意把握氧化还原反应的原理和原子守恒的应用。
17.(2023春 成华区校级月考)下列说法正确的是( )
A.酸雨是指pH<7的雨水,酸雨长时间放置,酸性变强
B.用排空气法收集NO
C.SO2、Na2O2都能使品红溶液褪色,原理相同
D.陶和瓷属于硅酸盐材料,耐酸碱腐蚀
【考点】二氧化硫的性质.版权所有
【专题】氧族元素.
【答案】D
【分析】酸雨是指pH<5.6的雨水,NO易被氧化,SO2、Na2O2的性质不同,陶和瓷属于硅酸盐材料,耐酸碱腐蚀,以此做题。
【解答】解:A.酸雨是指pH<5.6的雨水,故A错误;
B.NO易被氧气氧化为NO2,不能用排空气法收集,故B错误;
C.SO2、Na2O2都能使品红溶液褪色,原理不同,前者是化合作用,后者是氧化作用,故C错误;
D.陶和瓷属于硅酸盐材料,耐酸碱腐蚀,故D正确;
故选:D。
【点评】本题主要考查二氧化硫的性质,难度中等。
18.(2023 南海区校级开学)部分氮或硫元素化合物的价﹣类关系如图所示。下列叙述正确的是( )
A.a和b可能发生氧化还原反应
B.d的溶液一定具有强氧化性和脱水性
C.c的浓溶液通常保存于带橡胶塞的试剂瓶中
D.若用某种盐和d反应可制备c,则说明d酸性比c强
【考点】含硫物质的性质及综合应用.版权所有
【专题】氧族元素;氮族元素.
【答案】A
【分析】由题意可知,a为H2S或N2H4;b为SO2或NO2;c为HNO3;d为H2SO4;据此分析。
【解答】 解:A.H2S和SO2反应生成S和H2O,N2H4和NO2反应生成N2和H2O均为氧化还原反应,故A正确;
B.浓硫酸具有强氧化性和脱水性,但稀硫酸没有强氧化性和脱水性,故B错误;
C.浓硝酸具有强氧化性,会腐蚀橡胶塞,故浓硝酸不能保存于带橡胶塞的试剂瓶中,故C错误;
D.硝酸钠与浓硫酸反应生成硝酸,利用高沸点酸制备低沸点酸,与酸性强弱无关,故D错误;
故选:A。
【点评】本题考查含氮、含硫物质的性质,为高频考点,把握物质的性质、发生的反应为解答的关键,侧重分析与应用能力的考查,注意元素化合物知识的应用,题目难度不大。
19.(2023 成都开学)下列有关硫及其化合物的说法错误的是( )
A.二氧化硫和三氧化硫均可由单质直接化合而成
B.硫原子最外层有6个电子,易得到2个电子形成﹣2 价的含硫化合物
C.浓硫酸与蔗糖反应体现了浓硫酸的脱水性和强氧化性
D.SO2能使滴有酚酞的NaOH溶液和品红褪色,两者褪色原理不相同
【考点】含硫物质的性质及综合应用.版权所有
【专题】氧族元素.
【答案】A
【分析】硫在氧气中燃烧只能生成二氧化硫,浓硫酸具有脱水性,SO2 能使滴有酚酞的NaOH溶液褪色是 SO2 作为酸性氧化物与碱反应后碱性减弱造成褪色,以此做题。
【解答】解:A.硫在氧气中燃烧只能生成二氧化硫,故A错误;
B.硫原子最外层有6个电子,易得到2个电子达到8电子稳定结构,得到﹣2 价的含硫化合物,故B正确;
C.浓硫酸与蔗糖反应实验中,浓硫酸的脱水性使蔗糖脱水碳化,碳被浓硫酸氧化成二氧化碳,故C正确;
D.SO2 能使滴有酚酞的NaOH溶液褪色是 SO2 作为酸性氧化物与碱反应后碱性减弱造成褪色,使品红褪色是 SO2 与品红结合生成不稳定的无色物质,两者褪色原理不相同,故D正确;
故选:A。
【点评】本题主要考查含硫物质的性质与综合应用,侧重考查对知识的理解,难度不大。
20.(2023春 朝阳区校级期末)下列说法正确的是( )
A.为增强高锰酸钾溶液的氧化能力,通常在其中加入适量的盐酸
B.同温同压下,两份相同质量的铁粉,分别与足量的稀硫酸和稀硝酸反应,产生气体的体积不相等
C.少量NO2和足量SO2混合气体通入BaCl2溶液中,产生的沉淀只有BaSO4
D.Na2O2和SO2均有漂白性,将二者分别加入紫色石蕊溶液中,最后均变为无色
【考点】二氧化硫的性质.版权所有
【专题】氧族元素;氮族元素.
【答案】C
【分析】A.稀盐酸与高锰酸钾溶液发生氧化还原反应;
B.足量的稀硫酸和稀硝酸反应,与Fe发生的反应不同,Fe~H2SO4~H2↑、Fe~4HNO3~NO↑;
C.二氧化氮可以将二氧化硫在溶液中氧化为硫酸根离子;
D.二氧化硫不能漂白指示剂。
【解答】解:A.稀盐酸与高锰酸钾溶液发生氧化还原反应,则为了增强高锰酸钾溶液的氧化能力,用稀硫酸将高锰酸钾溶液进行酸化,故A错误;
B.足量的稀硫酸和稀硝酸反应,与Fe发生的反应不同,由Fe~H2SO4~H2↑、Fe~4HNO3~NO↑可知,等量的Fe反应产生气体的体积相等,故B错误;
C.二氧化氮可以将二氧化硫在溶液中氧化为硫酸根离子,少量的NO2和足量SO2混合气体通入BaCl2溶液中,产生的沉淀只有BaSO4,故C正确;
D.二氧化硫不能漂白指示剂,二氧化硫加入紫色石蕊溶液中,最后为红色,故D错误;
故选:C。
【点评】本题考查化学实验方案的评价,把握物质的性质、反应原理及实验技能为解答的关键,侧重分析与实验能力的考查,题目难度不大。
21.(2023春 海淀区校级期末)向0.01mol/LAgNO3溶液中通入过量SO2过程和现象如图。经检验,白色沉淀为Ag2SO3;灰色固体中含有Ag,下列说法正确的是( )
A.①中生成白色沉淀的离子方程式为2Ag++SO2+H2O═Ag2SO3↓+2H+
B.取①中白色沉淀,加入足量盐酸,可观察到沉淀溶解
C.该实验证明酸性H2SO3大于HNO3
D.该实验条件下,SO2与AgNO3反应生成AgSO3的速率小于生成Ag的速率
【考点】二氧化硫的性质;性质实验方案的设计.版权所有
【专题】氧族元素.
【答案】A
【分析】向AgNO3溶液中通入过量SO2,经检验白色沉淀为Ag2SO3,灰色固体中含有Ag,说明开始生成Ag2SO3,一段时间后转化为银单质。
【解答】解:A.向AgNO3溶液中通入过量SO2,经检验白色沉淀为Ag2SO3,则反应为2Ag++SO2+H2O═Ag2SO3↓+2H+,故A正确;
B.取①中白色沉淀,加入足量盐酸,Ag2SO3沉淀转化为AgCl沉淀,沉淀不会溶解,故B错误;
C.HNO3的酸性大于H2SO3,该实验能够发生是由于生成了难溶物Ag2SO3,故C错误;
D.该实验条件下,SO2与AgNO3反应开始生成Ag2SO3,一段时间后转化为银单质,说明实验中生成Ag2SO3的速率大于生成Ag的速率,故D错误;
故选:A。
【点评】本题考查含硫物质的性质,侧重考查学生物质之间的反应和氧化还原知识的掌握情况,试题难度中等。
22.(2023 浦东新区校级模拟)若将铜丝插入热浓硫酸中进行如图(a~d均为浸有相应试液的棉花)所示的探究实验,下列分析正确的是( )
A.Cu与浓硫酸反应,只体现H2SO4的酸性
B.a处变红,说明SO2是酸性氧化物
C.b或c处褪色,均说明SO2具有漂白性
D.试管底部出现白色固体,说明反应中无H2O生成
【考点】浓硫酸的性质实验.版权所有
【专题】氧族元素.
【答案】B
【分析】A.铜和浓硫酸反应生成SO2,体现浓硫酸的强氧化性;
B.SO2溶于水生成了酸,可说明SO2是酸性氧化物;
C.SO2具有漂白性,只能使品红溶液褪色;
D.浓硫酸具有吸水性,将反应生成的H2O吸收。
【解答】解:A.铜和浓硫酸反应过程中,生成CuSO4体现出浓硫酸的酸性,生成SO2体现出浓硫酸的强氧化性,故A错误;
B.a处的紫色石蕊溶液变红,其原因是SO2溶于水生成了酸,可说明SO2是酸性氧化物,故B正确;
C.b处品红溶液褪色,其原因是SO2具有漂白性,而c处酸性高锰酸钾溶液褪色,其原因是SO2和KMnO4发生氧化还原反应,SO2体现出还原性,故C错误;
D.实验过程中试管底部出现白色固体,其成分为无水CuSO4,而非蓝色的CuSO4 5H2O,其原因是浓硫酸体现出吸水性,将反应生成的H2O吸收,故D错误;
故选:B。
【点评】本题考查浓硫酸的性质,侧重考查学生硫及其化合物性质的掌握情况,试题难度中等。
23.(2023春 武侯区校级期中)某同学按如图所示实验装置探究铜与浓硫酸的反应,记录实验现象如表。
试管 实验现象
① 白雾、白色固体产生
② 大量白色沉淀
③ 少量白色沉淀
④ 品红溶液褪色
下列说法不正确的是( )
A.①中玻璃管有平衡气压的作用
B.②③中的白色沉淀成分相同
C.为了确定①中白色固体是否为硫酸铜,可将试管内的物质缓慢注入水中,振荡观察
D.实验时若先往装置内通入足量N2,再加热试管①,实验现象不变
【考点】浓硫酸的性质实验.版权所有
【专题】氧族元素.
【答案】D
【分析】浓硫酸与铜反应生成硫酸铜和二氧化硫,二氧化硫不能与氯化钡反应,②③中有白色沉淀硫酸钡生成,则证明二氧化硫反应生成了三氧化硫,④中品红溶液褪色,证明有二氧化硫。
【解答】解:A.①中玻璃管与大气连通,能够平衡气压,故A正确;
B.②③中白色沉淀均为硫酸钡,成分相同,故B正确;
C.硫酸铜溶液为蓝色,向试管中注水,若白色固体溶解,溶液变蓝,则证明白色固体为硫酸铜,故C正确;
D.二氧化硫不能与氯化钡反应,若实验时先通氮气排出空气,无三氧化硫生成,则②③中均无沉淀生成,故D错误;
故选:D。
【点评】本题考查含硫物质的性质,侧重考查学生基础知识的掌握情况,试题难度中等。
24.(2023春 武侯区校级期中)SO2属于严重的大气污染物,可用H2与SO2高温反应消除SO2的污染,其反应原理可分为两步,过程如图所示。下列说法正确的是( )
A.X中S元素的化合价为﹣2价
B.大气中的SO2必须氧化成SO3才能形成酸雨
C.在100~200℃温度时发生的是置换反应
D.工业上可用浓硝酸处理工业尾气中的SO2
【考点】二氧化硫的性质.版权所有
【专题】氧族元素.
【答案】A
【分析】根据反应原理,300℃时H2和SO2反应生成X为H2S,H2S在100~200℃和SO2反应生成S,据此解答。
【解答】解:A.根据分析,则X为H2S,S化合价为﹣2价,故A正确;
B.SO2可以和水反应生成H2SO3,H2SO3可以被氧气氧化为H2SO4,故B错误;
C.在100~200℃温度时SO2化合价降低,X化合价升高,反应为2H2S+SO2=3S↓+2H2O,不属于置换反应,故C错误;
D.浓硝酸处理工业尾气中的SO2会生成氮氧化物,污染环境,故D错误;
故选:A。
【点评】本题考查元素化合物知识,掌握氮、硫及其化合物的性质是解答关键,题目难度不大。
25.(2023 江汉区开学)按如图装置进行实验,将稀硫酸全部加入Ⅰ中的试管,关闭活塞。下列说法正确的是( )
A.Ⅰ中试管内出现浑浊,体现H+的氧化性
B.Ⅱ和Ⅳ中溶液褪色,均体现SO2的漂白性
C.Ⅲ中出现了浑浊现象,体现了SO2的氧化性
D.撤掉水浴,重做实验,Ⅳ中红色更快褪去
【考点】二氧化硫的性质.版权所有
【专题】氧族元素.
【答案】C
【分析】I中发生反应:Na2S2O3+H2SO4=Na2SO4+S↓+SO2↑+H2O,SO2具有漂白性,Ⅱ中品红溶液褪色,Ⅲ中会发生反应:SO2+2Na2S+2H2O═3S↓+4NaHSO3,溶液会变浑浊,Ⅳ证明SO2是酸性氧化物,同时可以吸收SO2,防止污染空气。
【解答】解:A.I中发生反应:Na2S2O3+H2SO4=Na2SO4+S↓+SO2↑+H2O,S2体现氧化性、还原性,而H+只表现酸性,故A错误;
B.Ⅱ中品红溶液褪色,体现SO2的漂白性,故B错误;
C.Ⅲ中会发生反应:SO2+2Na2S+2H2O═3S↓+4NaHSO3,SO2中硫元素化合价降低,体现了SO2的氧化性,故C正确;
D.撤掉水浴,重做实验,I中反应速率减慢,即生成SO2的速率减慢,则Ⅳ中红色褪去时间变长了,故D错误;
故选:C。
【点评】本题考查实验分析与评价,关键是明确实验原理,熟练掌握SO2的性质,题目难度不大。
考点卡片
1.氧化还原反应的基本规律及应用
0
2.化学平衡的影响因素
【知识点的认识】
1、化学平衡的影响因素(v﹣t图象):
(1)浓度:
a、增大反应物浓度,平衡正向移动;减小反应物浓度,平衡逆向移动
增大反应物浓度,平衡正向移动 减小反应物浓度,平衡逆向移动
b、增大生成物浓度,平衡逆向移动;减小生成物浓度,平衡正向移动
减小生成物浓度,平衡正向移动 增大生成物浓度,平衡逆向移动
(2)温度:
①升高温度,平衡向吸热反应方向移动:
②降低温度,平衡向放热反应方向移动:
(3)压强:
①增大压强,反应朝着气体体积减小的方向进行;
②减小压强,反应朝着气体体积增大的方向进行.
③对于气体体积不变的反应,压强改变平衡不移动.
(4)催化剂:催化剂同倍数增大反应物浓度,平衡不移动.
2、化学平衡移动原理(勒夏特列原理):
改变影响平衡的一个条件(如浓度、压强、温度),平衡就向能够减弱这种改变的方向移动,这就是勒夏特列原理.
概念的理解:
①影响平衡的因素只有浓度、压强、温度三种;
②原理的适用范围是只有一项条件变化的情况,当多项条件同时发生变化时,情况比较复杂;
③定性角度:平衡移动的方向为减弱外界改变的方向;
定量角度:平衡移动的结果只能减弱(不可能抵消)外界条件的变化.
【命题方向】
题型一:化学平衡的影响因素
典例1:(2014 安徽模拟)COCl2(g) CO(g)+Cl2(g);△H>0.当反应达到平衡时,下列措施:①升温 ②恒容通入惰性气体 ③增加CO浓度 ④减压 ⑤加催化剂 ⑥恒压通入惰性气体,能提高COCl2转化率的是( )
A.①②④B.①④⑥C.②③⑤D.③⑤⑥
分析:化学反应COCl2(g) CO(g)+Cl2(g)△H>0,正反应是气体体积增大的吸热反应,
①升温平衡向吸热反应方向移动;
②恒容通入惰性气体,总压增大,分压不变,平衡不动;
③增加CO的浓度,平衡逆向进行;
④减压平衡向气体体积增大的方向进行;
⑤加催化剂,改变速率不改变平衡;
⑥恒压通入惰性气体,压强增大,为保持恒压,体积增大压强减小,平衡正向进行.
解答:化学反应COCl2(g) CO(g)+Cl2(g)△H>0,正反应是气体体积增大的吸热反应,
①升温平衡向正反应移动,COCl2转化率增大,故①符合;
②恒容通入惰性气体,总压增大,反应混合物各组分的浓度不变,平衡不移动,COCl2转化率不变,故②不符合;
③增加CO的浓度,平衡向逆反应方向移动,COCl2转化率减小故③不符合;
④减压平衡向正反应方向移动,COCl2转化率增大,故④符合;
⑤加催化剂,改变速率不改变平衡,COCl2转化率不变,故⑤不符合;
⑥恒压通入惰性气体,压强增大,为保持恒压,体积增大压强减小,平衡正向进行,COCl2转化率增大,故⑥符合,
故选:B.
点评:本题考查了化学平衡的影响因素,注意理解通入惰性气体对平衡移动影响,题目难度中等.
题型二:图象题分析
典例2:对于可逆反应:A2(g)+3B2(g) 2AB3(g);△H<0下列图象中正确的是( )
A. B. C. D.
分析:对于可逆反应A2(g)+3B2(g) 2AB3(g)△H<0,正反应放热,升高温度正逆反应速率都增大,化学向逆反应方向移动,增大压强,平衡向正反应方向移动,结合图象分析解答.
解答:A.升高温度,正逆反应速率都增大,平衡向逆反应方向移动,交叉点后,逆反应速率应该大于正反应速率,故A正确;
B.该反应是气体体积减小的可逆反应,增大压强,平衡向正反应方向移动,所以A的含量是减小,压强一定升高温度,平衡向逆反应方向移动,A的含量增大,故B正确;
C.该反应是放热反应,先拐先平,温度高,故C错误;
D.压强越大,反应速率越大,正逆反应速率都增大,故D错误;
故选AB.
点评:本题考查化学平衡的图象,明确外界条件对化学平衡的影响及图象中纵横坐标的含义、“定一议二”“先拐先平”即可解答,难度不大.
【解题方法点拨】外界条件对化学反应速率和化学平衡影响对比分析:
条件变化 反应特征 化学反应速率 v正与v逆的关系 平衡移动方向
增大c(A) 可逆反应 加快 加快 v正>v逆 正反应方向
增大c(C) 加快 加快 v正<v逆 逆反应方向
减小c(A) 减慢 减慢 v正<v逆 逆反应方向
减小c(C) 减慢 减慢 v正>v逆 正反应方向
增大压强 m+n>p+q 加快 加快 v正>v逆 正反应方向
m+n=p+q 加快 加快 v正=v逆 平衡不移动
m+n<p+q 加快 加快 v正<v逆 逆反应方向
减小压强 m+n>p+q 减慢 减慢 v正<v逆 逆反应方向
m+n=p+q 减慢 减慢 v正=v逆 平衡不移动
m+n<p+q 减慢 减慢 v正>v逆 正反应方向
升高温度 Q<0 加快 加快 v正<v逆 逆反应方向
Q>0 加快 加快 v正>v逆 正反应方向
降低温度 Q<0 减慢 减慢 v正>v逆 正反应方向
Q>0 减慢 减慢 v正<v逆 逆反应方向
注意:
①升高温度和增大压强,正逆反应速率都加快,只是增加幅度不同,因此平衡发生移动;
②降低温度和减小压强,正逆反应速率都减慢.
3.硝酸的化学性质
【知识点的知识】
1)强酸性:HNO3=H++NO3﹣;硝酸是一元强酸,具有酸的通性.
2)不稳定性:4HNO3(浓)4NO2↑+O2↑+2H2O
注意:①浓度越大,越易分解;久置硝酸呈黄色的原因的分解的NO2溶于溶液,使得溶液变黄;
②硝酸应保存在玻璃塞(HNO3腐蚀橡胶)棕色细口瓶中,放于阴凉处.
3)强氧化性:
①与金属反应:除Pt、Au外的金属均能与HNO3反应.
Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O(实验室制NO2)
3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O(实验室制NO,常温下缓慢反应,加热反应较剧烈)
注意:a.常温下,浓HNO3使Fe、Al等金属钝化;
b.金属与硝酸反应不产生H2.
3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O
Fe+4HNO3=Fe(NO3)3+NO↑+2H2O
3Zn+8HNO3=3Zn(NO3)2+2NO↑+4H2O
4Zn+10HNO3=4Zn(NO3)2+N2O+5H2O
4Zn+10HNO3=4Zn(NO3)2+NH4NO3+3H2O
金属与硝酸反应规律:
硝酸同金属的反应比较复杂,因为(a)硝酸的浓度;(b)金属的活泼性;(c)反应的温度等不同,所生成的产物亦不同,并且所生成的产物往往是混合物.但是就其主要产物而言,可以概括出以下几点.
(1)在金属活动性顺序表中,位于“H”以后的金属如Cu、Ag、Hg等与浓HNO3反应主要得到NO2,与稀HNO3反应主要得到NO.
(2)活泼性适中的金属如:Fe、Co、Ni、Cr、Ca、Al等金属,在一般情况下与浓HNO3不反应.这是由于“钝化”作用,使金属表面覆盖了一层致密的氧化膜,阻止了内层金属进一步与浓硝酸反应.这些金属与稀HNO3作用主要生成N2O或者NO,这是由于它们的还原性较强,能将硝酸还原到较低的价态.若与更稀的硝酸反应,则可以生成NH3.
(3)活泼性的金属如Mg、Zn等与不同浓度的稀HNO3作用能得到不同低价态的还原产物.
(4)Au、Pt、Rh、Ti、Ta等贵金属和硝酸不发生反应.因为它们特别稳定,不易被氧化.
(5)Sn、Pb、As、W等金属与HNO3作用得到的是金属氧化物或其水合物而不是硝酸盐.因为这些金属氧化物不溶于硝酸.
对于同一种金属来说,酸越稀则硝酸本身被还原的程度越大.镁与不同浓度硝酸反应的方程式是:
Mg+4HNO3(浓 )=Mg(NO3)2+2NO2↑+2H2O
3Mg+8HNO3(8M)=3Mg(NO3)2+2NO↑+4H2O
4Mg+10HNO3(2M)=4Mg(NO3)2+N2O↑+5H2O
4Mg+10HNO3(lM)=4Mg(NO3)2+NH4NO3+3H2O
Mg+2HNO3(极稀)=Mg(NO3)2+H2↑
②与非金属反应:能氧化C、S、P等非金属.
C+4HNO3(浓)=CO2↑+4NO2↑+H2O
S+6HNO3(浓)=H2SO4+6NO2↑+2H2O
③与H2S、HBr、HI、SO2、KI、Na2SO3等物质反应.
6KI+8HNO3=6KNO3+3I2+2NO+4H2O
3H2S+2HNO3(稀)=3S↓+2NO+4H2O
3Na2S+8HNO3(稀)=6NaNO3+2NO↑+3S↓+4H2O
3Na2SO3+2HNO3(稀)=3Na2SO4+2NO↑+H2O
说明:a.氧化性:浓硝酸>稀硝酸;
b.一般情况下:浓硝酸的还原产物是NO2;稀硝酸的还原产物是NO
c.王水:浓硝酸和浓盐酸按体积比1:3混合而成.王水有很强的氧化性,能溶解Pt、Au等金属.
4.二氧化硫的性质
0
5.硫酸的性质
0
6.浓硫酸的特性
同课章节目录
