2024届高三高考化学二轮复习专题突破练习:元素及其化合物(含答案)
文档属性
| 名称 | 2024届高三高考化学二轮复习专题突破练习:元素及其化合物(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 312.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-18 00:57:28 | ||
图片预览


文档简介
元素及其化合物
一、选择题
1.(2023·广东韶关二模)化学创造美好生活。下列生产活动中,没有运用相应化学原理的是( )
选项 生产活动 化学原理
A 环保工程师用熟石灰处理酸性废水 熟石灰具有碱性
B 利用便携式电池为手机提供能量 原电池将化学能转化为电能
C 利用黄铁矿制备硫酸 黄铁矿中硫元素可被氧化
D 利用焦炭和石英砂制取粗硅 二氧化硅具有很好的光学性能
2.(2023·广东肇庆二模)对下列事实的解释正确的是 ( )
A.二氧化硫气体能用浓硫酸干燥,是因为二氧化硫无还原性
B.医疗上可用硫酸钡作钡餐,是因为硫酸钡可以阻挡X射线通过且不溶于强酸
C.向50 mL 18 mol·L-1的H2SO4溶液中加入足量的铜片加热充分反应后,被还原的H2SO4的物质的量等于0.45 mol
D.常温下,浓硫酸可以用铝制容器贮存,说明铝与浓硫酸不反应
3.(2023·辽宁丹东一模)自然界中氮循环过程如图所示,下列说法错误的是( )
A.反硝化过程中,含氮物质被还原
B.氨氧化过程中,N与N理论物质的量之比为1∶1
C.N2→N属于氮的固定,N2发生还原反应
D.土壤中Fe2+有利于除去水体中的铵态氮
4.(2023·广东汕头二模)类推的思维方式在化学研究中发挥着重要作用。下列有关类推的结论正确的是( )
A.Al能与NaOH溶液反应,则Mg也可以
B.工业上用电解熔融MgCl2的方法冶炼Mg,故也可用电解熔融CaCl2的方法冶炼Ca
C.S与Fe反应生成FeS,故S与Cu反应也生成CuS
D.CO2和SiO2化学式相似,故CO2与SiO2的物理性质也相似
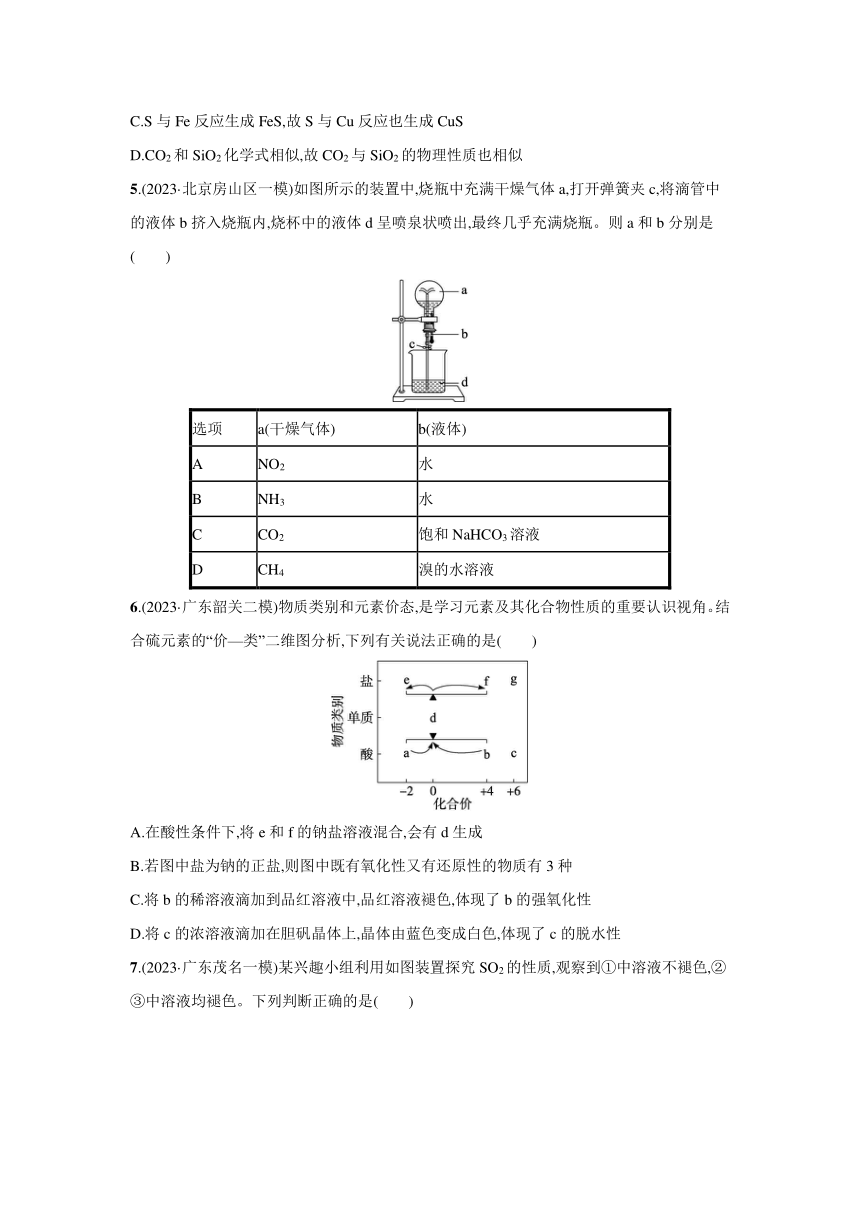
5.(2023·北京房山区一模)如图所示的装置中,烧瓶中充满干燥气体a,打开弹簧夹c,将滴管中的液体b挤入烧瓶内,烧杯中的液体d呈喷泉状喷出,最终几乎充满烧瓶。则a和b分别是( )
选项 a(干燥气体) b(液体)
A NO2 水
B NH3 水
C CO2 饱和NaHCO3溶液
D CH4 溴的水溶液
6.(2023·广东韶关二模)物质类别和元素价态,是学习元素及其化合物性质的重要认识视角。结合硫元素的“价—类”二维图分析,下列有关说法正确的是( )
A.在酸性条件下,将e和f的钠盐溶液混合,会有d生成
B.若图中盐为钠的正盐,则图中既有氧化性又有还原性的物质有3种
C.将b的稀溶液滴加到品红溶液中,品红溶液褪色,体现了b的强氧化性
D.将c的浓溶液滴加在胆矾晶体上,晶体由蓝色变成白色,体现了c的脱水性
7.(2023·广东茂名一模)某兴趣小组利用如图装置探究SO2的性质,观察到①中溶液不褪色,②③中溶液均褪色。下列判断正确的是( )
A.②③均体现SO2的漂白性
B.SO2与品红分子直接反应使其褪色
C.②中存在S、HS
D.③中c(S)增大,说明SO2具有氧化性
8.(2023·河北衡水中学一调)甲、乙、丙、丁为中学化学常见的物质,其相互转化关系如图(水作为溶剂的未在图上标出),下列组合不符合题意的是( )
选项 甲 乙 丙
A CO2 NaHCO3 Na2CO3
B Fe FeCl2 FeCl3
C H2S S SO2
D AlCl3 Al(OH)3 NaAlO2
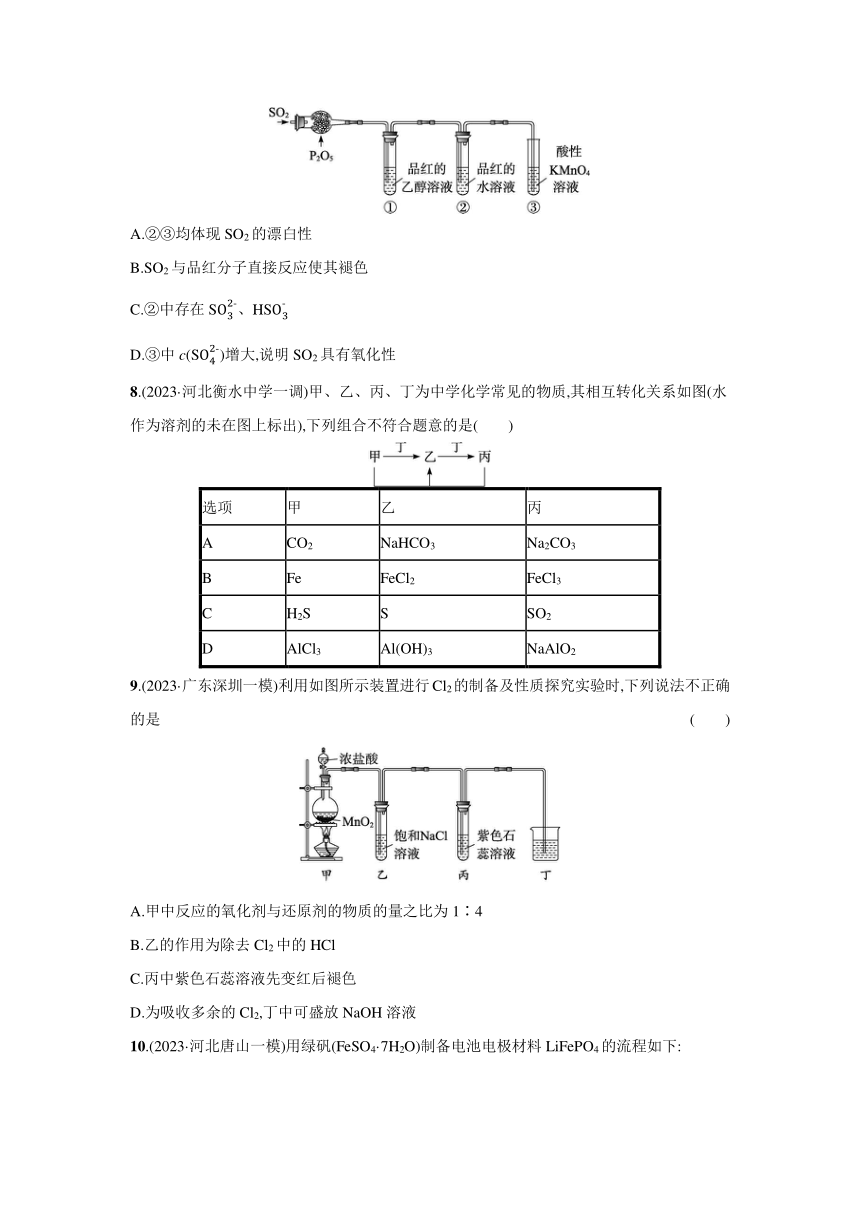
9.(2023·广东深圳一模)利用如图所示装置进行Cl2的制备及性质探究实验时,下列说法不正确的是 ( )
A.甲中反应的氧化剂与还原剂的物质的量之比为1∶4
B.乙的作用为除去Cl2中的HCl
C.丙中紫色石蕊溶液先变红后褪色
D.为吸收多余的Cl2,丁中可盛放NaOH溶液
10.(2023·河北唐山一模)用绿矾(FeSO4·7H2O)制备电池电极材料LiFePO4的流程如下:
下列说法正确的是( )
A.溶解过程中H3PO4可抑制Fe2+的水解
B.可用酸性KMnO4溶液检验反应1中Fe2+是否完全反应
C.洗涤沉淀时可用玻璃棒搅拌
D.反应2中氧化剂与还原剂的物质的量之比为1∶2
11.(2023·辽宁鞍山一模)室温下,下列实验探究方案及现象能达到探究目的的是( )
选项 探究方案及现象 探究目的
A 用pH计测量醋酸、盐酸的pH,比较溶液pH大小 醋酸是弱电解质
B 向久置的Na2SO3溶液中加入足量BaCl2溶液,出现白色沉淀;再加入足量稀盐酸,部分沉淀溶解 Na2SO3不能被空气氧化
C 向NaBr溶液中滴加过量氯水,溶液变橙色,再加入淀粉KI溶液,溶液变蓝色 氧化性: Cl2>Br2>I2
D 向盛有FeSO4溶液的试管中滴加几滴KSCN溶液,无明显现象,振荡,再滴加几滴新制氯水,溶液变红 Fe2+具有还原性
12.(2023·山东淄博一模)利用下图装置制备ClO2,并以ClO2为原料制备NaClO2。已知:高于60 ℃时,NaClO2分解生成NaClO3和NaCl。下列说法错误的是( )
A.Na2SO3和H2O2均作还原剂
B.装置②④的作用分别是防倒吸、吸收未反应的污染气体
C.从装置③反应后的溶液中获得晶体,可采用常压蒸发结晶
D.反应结束时,通氮气的目的是将仪器中残留的气体排入④中
二、非选择题
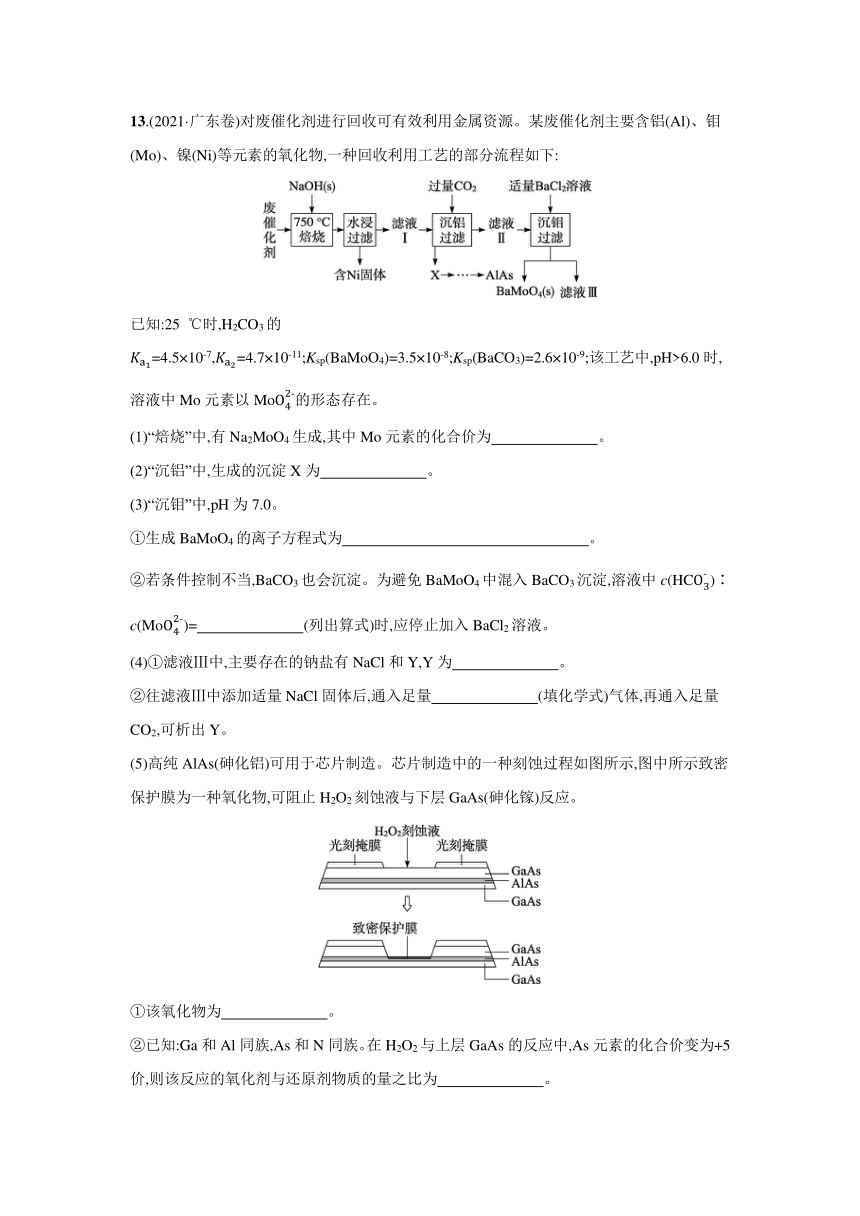
13.(2021·广东卷)对废催化剂进行回收可有效利用金属资源。某废催化剂主要含铝(Al)、钼(Mo)、镍(Ni)等元素的氧化物,一种回收利用工艺的部分流程如下:
已知:25 ℃时,H2CO3的=4.5×10-7,=4.7×10-11;Ksp(BaMoO4)=3.5×10-8;Ksp(BaCO3)=2.6×10-9;该工艺中,pH>6.0时,溶液中Mo元素以Mo的形态存在。
(1)“焙烧”中,有Na2MoO4生成,其中Mo元素的化合价为 。
(2)“沉铝”中,生成的沉淀X为 。
(3)“沉钼”中,pH为7.0。
①生成BaMoO4的离子方程式为 。
②若条件控制不当,BaCO3也会沉淀。为避免BaMoO4中混入BaCO3沉淀,溶液中c(HC)∶c(Mo)= (列出算式)时,应停止加入BaCl2溶液。
(4)①滤液Ⅲ中,主要存在的钠盐有NaCl和Y,Y为 。
②往滤液Ⅲ中添加适量NaCl固体后,通入足量 (填化学式)气体,再通入足量CO2,可析出Y。
(5)高纯AlAs(砷化铝)可用于芯片制造。芯片制造中的一种刻蚀过程如图所示,图中所示致密保护膜为一种氧化物,可阻止H2O2刻蚀液与下层GaAs(砷化镓)反应。
①该氧化物为 。
②已知:Ga和Al同族,As和N同族。在H2O2与上层GaAs的反应中,As元素的化合价变为+5价,则该反应的氧化剂与还原剂物质的量之比为 。
14.(2023·广东梅州第二次质检)铈(Ce)是人类发现的第二种稀土元素,铈的氧化物在半导体材料、高级颜料及汽车尾气的净化器方面有广泛应用。以氟碳铈矿(主要含CeFCO3)为原料制备CeO2的工艺流程如下:
已知:①铈的常见化合价为+3、+4价。四价铈不易进入溶液,而三价铈易进入溶液。
②Ce4+能与S结合成[CeSO4]2+,Ce4+能被萃取剂[(HA)2]萃取。
(1)“焙烧”后铈元素转化成CeO2和CeF4,“焙烧”氟碳铈矿的目的是 。
(2)“酸浸Ⅱ”过程中CeO2转化为Ce3+,且产生黄绿色气体,用稀硫酸和H2O2替换HCl就不会造成环境污染。则稀硫酸、H2O2与CeO2反应的离子方程式为 。
(3)“操作Ⅰ”的名称是 。
(4)“浸出液”中含有少量Ce4+及其他稀土元素的离子,可以通过“萃取”与“反萃取”操作进一步分离、富集各离子。“萃取”时Ce4+与萃取剂[(HA)2]存在反应:Ce4++n(HA)2Ce(H2n-4A2n)+4H+。用D表示Ce4+分别在有机层中与水层中存在形式的浓度之比:D=,其他条件不变,在“浸出液”中加入不同量的Na2SO4,以改变水层中的c(S),D随“浸出液”中c(S)增大而减小的原因是 。
(5)取5.000 g上述流程中得到的Ce(OH)4,加酸溶解后,向其中加入含0.033 00 mol FeSO4的硫酸亚铁溶液使Ce4+全部被还原成Ce3+,再用0.100 0 mol·L-1的酸性KMnO4标准溶液滴定至终点时,消耗20.00 mL标准溶液。则Ce(OH)4的质量分数为 [已知氧化性:Ce4+>KMnO4;Ce(OH)4的相对分子质量为208]。
(6)科研人员提出CeO2催化CO2合成碳酸二甲酯(DMC),从而实现CO2的综合利用。CeO2晶胞结构如图所示。
①在该晶体中,铈离子的配位数为 。
②设阿伏加德罗常数的值为NA,CeO2相对分子质量为M,晶体密度为ρ g·cm-3,其晶胞边长a的计量表达式为 nm。
1.D 利用焦炭和石英砂制取粗硅与二氧化硅具有很好的光学性能无关,D错误。
2.B 二氧化硫具有还原性,但不能被浓硫酸氧化,A错误;随着反应的进行,硫酸的浓度降低,稀硫酸不能与铜反应,因此被还原的H2SO4的物质的量小于0.45 mol,C错误;常温下浓硫酸使铝钝化(化学变化),形成致密的氧化膜阻碍了反应的继续进行,D错误。
3.D 由转化图可知,Fe2+与水体中的N反应,可以除去水体中的硝态氮,D错误。
4.B Mg不能与NaOH发生反应,A错误;Mg、Ca均为活泼金属,均可采用电解熔融氯化物的方法冶炼,B正确;S与Cu反应生成Cu2S,C错误;SiO2为共价晶体、CO2为分子晶体,二者物理性质差异较大,D错误。
5.B NO2与水反应的化学方程式为3NO2+H2O2HNO3+NO,NO难溶于水,液体不可能充满烧瓶,A错误;NH3极易溶于水,造成烧瓶中压强变小,形成喷泉,且最终液体几乎充满烧瓶,B正确;CO2难溶于饱和NaHCO3溶液,烧瓶内不可能形成喷泉,C错误;CH4难溶于水,且不与溴单质反应,烧瓶内不可能形成喷泉,D错误。
6.A e和f的钠盐分别是Na2S、Na2SO3,在酸性条件下,将Na2S、Na2SO3溶液混合发生归中反应:2S2-+S+6H+3S↓+3H2O,A正确。若图中盐为钠的正盐,图中S、Na2SO3、H2SO3中的S元素化合价既有升高的趋势又有降低的趋势,S、Na2SO3、H2SO3既有氧化性又有还原性;H2S中+1价的H具有弱氧化性、-2价的S具有还原性,H2S既有氧化性又有还原性,B错误。b是H2SO3,将H2SO3的稀溶液滴加到品红溶液中,品红溶液褪色,体现了H2SO3的漂白性,C错误。c是硫酸,将浓硫酸滴加在胆矾晶体上,晶体由蓝色变成白色,体现了浓硫酸的吸水性,D错误。
7.C ②中的品红褪色体现了SO2的漂白性,③中的酸性KMnO4溶液褪色体现了SO2的还原性,A错误;SO2与水反应生成的H2SO3能与品红分子结合,使品红溶液褪色,无水存在时,SO2分子不能使其褪色,B错误;SO2与水反应生成H2SO3:H2SO3H++HS,HSH++S,C正确;SO2在溶液中生成S,说明SO2具有还原性,D错误。
8.B 足量CO2和氢氧化钠反应生成NaHCO3,NaHCO3和氢氧化钠反应生成Na2CO3,Na2CO3溶液和CO2反应生成NaHCO3,A正确。若丁是氯气,Fe和氯气反应生成FeCl3;若丁是盐酸,Fe和盐酸反应生成FeCl2,FeCl2和盐酸不反应,B错误。H2S在氧气不足的条件下燃烧生成S和水,S和氧气点燃生成SO2,SO2和H2S反应生成S和水,C正确。AlCl3和少量氢氧化钠反应生成Al(OH)3,Al(OH)3和氢氧化钠反应生成NaAlO2,NaAlO2溶液和AlCl3溶液混合生成Al(OH)3,D正确。
9.A 装置甲中二氧化锰和浓盐酸在加热的条件下发生反应:MnO2+4HCl(浓)MnCl2+2H2O+Cl2↑,氧化剂是MnO2,还原剂是HCl,其物质的量之比为1∶2,A错误;装置甲中制备的氯气中混有HCl气体,乙中饱和NaCl溶液的作用是除去Cl2中的HCl,B正确;Cl2与水反应生成HCl、HClO,溶液显酸性,且HClO具有漂白性,则Cl2通入紫色石蕊溶液先变红后褪色,C正确;Cl2与NaOH溶液反应生成NaCl和NaClO,可用NaOH溶液吸收多余的Cl2,丁中可盛放NaOH溶液,D正确。
10.A Fe2+能发生水解:Fe2++2H2OFe(OH)2+2H+,加入磷酸溶解过程中可以抑制Fe2+水解,A正确;反应1中NaClO作氧化剂,将Fe2+氧化成Fe3+,本身被还原成NaCl,酸性高锰酸钾溶液能氧化Cl-而褪色,故不能用酸性高锰酸钾溶液检验反应1中Fe2+是否完全反应,B错误;洗涤沉淀时,不能用玻璃棒搅拌,防止弄破滤纸,C错误;草酸为还原剂,FePO4为氧化剂,根据得失电子守恒可得,FePO4与草酸的物质的量之比为2∶1,D错误。
11.D 未指明醋酸和盐酸的浓度,只比较pH大小,无法判断醋酸是强电解质还是弱电解质,A错误;加入足量盐酸后部分沉淀溶解,则说明沉淀中有BaSO4,同时也说明Na2SO3能被空气中的O2氧化为Na2SO4,B错误;氯水过量,溶液变为蓝色,有可能是过量氯水将KI氧化成了碘单质,无法比较出溴单质和碘单质的氧化性强弱,C错误;KSCN溶液可用于检验Fe3+,滴加氯水后,溶液变红,则说明Fe2+被氧化成Fe3+,可以证明Fe2+具有还原性,D正确。
12.C ①中发生反应2NaClO3+Na2SO3+H2SO42ClO2↑+2Na2SO4+H2O,S的化合价升高,Na2SO3为还原剂;2ClO2+2NaOH+H2O22NaClO2+2H2O+O2中O元素化合价也升高,H2O2为还原剂,A正确。装置②④的作用分别是防倒吸、吸收生成的ClO2,B正确。由于温度高于60 ℃时,NaClO2会发生分解,所以可采取冷却结晶的方法获得晶体,C错误。反应结束时,通氮气的目的是将仪器中残留的气体排入④中,排除污染气体,保证实验结束安全,D正确。
13.答案 (1)+6价
(2)Al(OH)3
(3)①Mo+Ba2+BaMoO4↓ ②
(4)①NaHCO3 ②NH3
(5)①Al2O3 ②4∶1
解析 (1)“焙烧”中,有Na2MoO4生成,其中Na和O元素的化合价分别为+1价和-2价,根据化合物中元素化合价的代数和为0可知,Mo元素的化合价为+6价。
(2)“沉铝”中,偏铝酸钠转化为氢氧化铝,因此,生成的沉淀X为Al(OH)3。
(3)①滤液Ⅱ中含有钼酸钠(Na2MoO4),加入氯化钡溶液后生成BaMoO4沉淀,该反应的离子方程式为Mo+Ba2+BaMoO4↓。
②若开始生成BaCO3沉淀,则体系中恰好建立如下平衡:HC+BaMoO4BaCO3+Mo+H+,该反应的化学平衡常数K==
=
。为避免BaMoO4中混入BaCO3沉淀,必须满足,即,由于“沉钼”中pH为7.0,c(H+)=1×10-7 mol·L-1,所以溶液中时,应停止加入BaCl2溶液。
(4)①滤液Ⅰ中通入过量的二氧化碳,偏铝酸钠转化为氢氧化铝沉淀,同时生成碳酸氢钠,过滤得到的滤液Ⅱ中含有碳酸氢钠和钼酸钠。滤液Ⅱ中加入适量的氯化钡溶液沉钼后,过滤,得到的滤液Ⅲ中主要存在的钠盐有NaCl和NaHCO3,故Y为NaHCO3。
②根据侯氏制碱法的原理可知,往滤液Ⅲ中添加适量NaCl固体后,通入足量NH3,再通入足量CO2,可析出NaHCO3。
(5)①由题中信息可知,致密的保护膜为一种氧化物,是由H2O2与AlAs反应生成的,联想到金属铝表面容易形成致密的氧化膜,可知该氧化物为Al2O3。
②由Ga和Al同族、As和N同族可知,GaAs中Ga显+3价(其最高价)、As显-3价。在H2O2与上层GaAs的反应中,As元素的化合价由-3价变为+5价,As元素被氧化,则该反应的氧化剂为H2O2,还原剂为GaAs。H2O2中的O元素的化合价为-1价,其作为氧化剂时,O元素要被还原到-2价,根据得失电子守恒可知,该反应的氧化剂与还原剂物质的量之比为8∶2=4∶1。
14.答案 (1)将三价铈转化为四价铈,且将碳酸盐转化为二氧化碳,实现铈的富集
(2)6H++2CeO2+H2O24H2O+2Ce3++O2↑
(3)过滤
(4)“浸出液”中加入的S浓度增大,c([CeSO4]2+)增大,而D=减小
(5)95.68%
(6)①8 ②×107
解析 (1)根据题意,四价铈不易进入溶液,而三价铈易进入溶液。故“焙烧”氟碳铈矿的目的是将三价铈转化为四价铈,且将碳酸盐转化为二氧化碳,实现铈的富集。
(5)根据氧化还原反应得失电子守恒推知,n(Ce4+)×1+n(KMnO4)×5=n(Fe2+)×1,解得n(Ce4+)=0.023 00 mol,故Ce(OH)4的质量分数w[Ce(OH)4]=×100%=95.68%。
(6)②在CeO2晶胞中,N(Ce4+)=8×+6×=4,N(O2-)=8×1=8,故每个晶胞中相当于有4个CeO2,V= cm3,故a=×107 nm
一、选择题
1.(2023·广东韶关二模)化学创造美好生活。下列生产活动中,没有运用相应化学原理的是( )
选项 生产活动 化学原理
A 环保工程师用熟石灰处理酸性废水 熟石灰具有碱性
B 利用便携式电池为手机提供能量 原电池将化学能转化为电能
C 利用黄铁矿制备硫酸 黄铁矿中硫元素可被氧化
D 利用焦炭和石英砂制取粗硅 二氧化硅具有很好的光学性能
2.(2023·广东肇庆二模)对下列事实的解释正确的是 ( )
A.二氧化硫气体能用浓硫酸干燥,是因为二氧化硫无还原性
B.医疗上可用硫酸钡作钡餐,是因为硫酸钡可以阻挡X射线通过且不溶于强酸
C.向50 mL 18 mol·L-1的H2SO4溶液中加入足量的铜片加热充分反应后,被还原的H2SO4的物质的量等于0.45 mol
D.常温下,浓硫酸可以用铝制容器贮存,说明铝与浓硫酸不反应
3.(2023·辽宁丹东一模)自然界中氮循环过程如图所示,下列说法错误的是( )
A.反硝化过程中,含氮物质被还原
B.氨氧化过程中,N与N理论物质的量之比为1∶1
C.N2→N属于氮的固定,N2发生还原反应
D.土壤中Fe2+有利于除去水体中的铵态氮
4.(2023·广东汕头二模)类推的思维方式在化学研究中发挥着重要作用。下列有关类推的结论正确的是( )
A.Al能与NaOH溶液反应,则Mg也可以
B.工业上用电解熔融MgCl2的方法冶炼Mg,故也可用电解熔融CaCl2的方法冶炼Ca
C.S与Fe反应生成FeS,故S与Cu反应也生成CuS
D.CO2和SiO2化学式相似,故CO2与SiO2的物理性质也相似
5.(2023·北京房山区一模)如图所示的装置中,烧瓶中充满干燥气体a,打开弹簧夹c,将滴管中的液体b挤入烧瓶内,烧杯中的液体d呈喷泉状喷出,最终几乎充满烧瓶。则a和b分别是( )
选项 a(干燥气体) b(液体)
A NO2 水
B NH3 水
C CO2 饱和NaHCO3溶液
D CH4 溴的水溶液
6.(2023·广东韶关二模)物质类别和元素价态,是学习元素及其化合物性质的重要认识视角。结合硫元素的“价—类”二维图分析,下列有关说法正确的是( )
A.在酸性条件下,将e和f的钠盐溶液混合,会有d生成
B.若图中盐为钠的正盐,则图中既有氧化性又有还原性的物质有3种
C.将b的稀溶液滴加到品红溶液中,品红溶液褪色,体现了b的强氧化性
D.将c的浓溶液滴加在胆矾晶体上,晶体由蓝色变成白色,体现了c的脱水性
7.(2023·广东茂名一模)某兴趣小组利用如图装置探究SO2的性质,观察到①中溶液不褪色,②③中溶液均褪色。下列判断正确的是( )
A.②③均体现SO2的漂白性
B.SO2与品红分子直接反应使其褪色
C.②中存在S、HS
D.③中c(S)增大,说明SO2具有氧化性
8.(2023·河北衡水中学一调)甲、乙、丙、丁为中学化学常见的物质,其相互转化关系如图(水作为溶剂的未在图上标出),下列组合不符合题意的是( )
选项 甲 乙 丙
A CO2 NaHCO3 Na2CO3
B Fe FeCl2 FeCl3
C H2S S SO2
D AlCl3 Al(OH)3 NaAlO2
9.(2023·广东深圳一模)利用如图所示装置进行Cl2的制备及性质探究实验时,下列说法不正确的是 ( )
A.甲中反应的氧化剂与还原剂的物质的量之比为1∶4
B.乙的作用为除去Cl2中的HCl
C.丙中紫色石蕊溶液先变红后褪色
D.为吸收多余的Cl2,丁中可盛放NaOH溶液
10.(2023·河北唐山一模)用绿矾(FeSO4·7H2O)制备电池电极材料LiFePO4的流程如下:
下列说法正确的是( )
A.溶解过程中H3PO4可抑制Fe2+的水解
B.可用酸性KMnO4溶液检验反应1中Fe2+是否完全反应
C.洗涤沉淀时可用玻璃棒搅拌
D.反应2中氧化剂与还原剂的物质的量之比为1∶2
11.(2023·辽宁鞍山一模)室温下,下列实验探究方案及现象能达到探究目的的是( )
选项 探究方案及现象 探究目的
A 用pH计测量醋酸、盐酸的pH,比较溶液pH大小 醋酸是弱电解质
B 向久置的Na2SO3溶液中加入足量BaCl2溶液,出现白色沉淀;再加入足量稀盐酸,部分沉淀溶解 Na2SO3不能被空气氧化
C 向NaBr溶液中滴加过量氯水,溶液变橙色,再加入淀粉KI溶液,溶液变蓝色 氧化性: Cl2>Br2>I2
D 向盛有FeSO4溶液的试管中滴加几滴KSCN溶液,无明显现象,振荡,再滴加几滴新制氯水,溶液变红 Fe2+具有还原性
12.(2023·山东淄博一模)利用下图装置制备ClO2,并以ClO2为原料制备NaClO2。已知:高于60 ℃时,NaClO2分解生成NaClO3和NaCl。下列说法错误的是( )
A.Na2SO3和H2O2均作还原剂
B.装置②④的作用分别是防倒吸、吸收未反应的污染气体
C.从装置③反应后的溶液中获得晶体,可采用常压蒸发结晶
D.反应结束时,通氮气的目的是将仪器中残留的气体排入④中
二、非选择题
13.(2021·广东卷)对废催化剂进行回收可有效利用金属资源。某废催化剂主要含铝(Al)、钼(Mo)、镍(Ni)等元素的氧化物,一种回收利用工艺的部分流程如下:
已知:25 ℃时,H2CO3的=4.5×10-7,=4.7×10-11;Ksp(BaMoO4)=3.5×10-8;Ksp(BaCO3)=2.6×10-9;该工艺中,pH>6.0时,溶液中Mo元素以Mo的形态存在。
(1)“焙烧”中,有Na2MoO4生成,其中Mo元素的化合价为 。
(2)“沉铝”中,生成的沉淀X为 。
(3)“沉钼”中,pH为7.0。
①生成BaMoO4的离子方程式为 。
②若条件控制不当,BaCO3也会沉淀。为避免BaMoO4中混入BaCO3沉淀,溶液中c(HC)∶c(Mo)= (列出算式)时,应停止加入BaCl2溶液。
(4)①滤液Ⅲ中,主要存在的钠盐有NaCl和Y,Y为 。
②往滤液Ⅲ中添加适量NaCl固体后,通入足量 (填化学式)气体,再通入足量CO2,可析出Y。
(5)高纯AlAs(砷化铝)可用于芯片制造。芯片制造中的一种刻蚀过程如图所示,图中所示致密保护膜为一种氧化物,可阻止H2O2刻蚀液与下层GaAs(砷化镓)反应。
①该氧化物为 。
②已知:Ga和Al同族,As和N同族。在H2O2与上层GaAs的反应中,As元素的化合价变为+5价,则该反应的氧化剂与还原剂物质的量之比为 。
14.(2023·广东梅州第二次质检)铈(Ce)是人类发现的第二种稀土元素,铈的氧化物在半导体材料、高级颜料及汽车尾气的净化器方面有广泛应用。以氟碳铈矿(主要含CeFCO3)为原料制备CeO2的工艺流程如下:
已知:①铈的常见化合价为+3、+4价。四价铈不易进入溶液,而三价铈易进入溶液。
②Ce4+能与S结合成[CeSO4]2+,Ce4+能被萃取剂[(HA)2]萃取。
(1)“焙烧”后铈元素转化成CeO2和CeF4,“焙烧”氟碳铈矿的目的是 。
(2)“酸浸Ⅱ”过程中CeO2转化为Ce3+,且产生黄绿色气体,用稀硫酸和H2O2替换HCl就不会造成环境污染。则稀硫酸、H2O2与CeO2反应的离子方程式为 。
(3)“操作Ⅰ”的名称是 。
(4)“浸出液”中含有少量Ce4+及其他稀土元素的离子,可以通过“萃取”与“反萃取”操作进一步分离、富集各离子。“萃取”时Ce4+与萃取剂[(HA)2]存在反应:Ce4++n(HA)2Ce(H2n-4A2n)+4H+。用D表示Ce4+分别在有机层中与水层中存在形式的浓度之比:D=,其他条件不变,在“浸出液”中加入不同量的Na2SO4,以改变水层中的c(S),D随“浸出液”中c(S)增大而减小的原因是 。
(5)取5.000 g上述流程中得到的Ce(OH)4,加酸溶解后,向其中加入含0.033 00 mol FeSO4的硫酸亚铁溶液使Ce4+全部被还原成Ce3+,再用0.100 0 mol·L-1的酸性KMnO4标准溶液滴定至终点时,消耗20.00 mL标准溶液。则Ce(OH)4的质量分数为 [已知氧化性:Ce4+>KMnO4;Ce(OH)4的相对分子质量为208]。
(6)科研人员提出CeO2催化CO2合成碳酸二甲酯(DMC),从而实现CO2的综合利用。CeO2晶胞结构如图所示。
①在该晶体中,铈离子的配位数为 。
②设阿伏加德罗常数的值为NA,CeO2相对分子质量为M,晶体密度为ρ g·cm-3,其晶胞边长a的计量表达式为 nm。
1.D 利用焦炭和石英砂制取粗硅与二氧化硅具有很好的光学性能无关,D错误。
2.B 二氧化硫具有还原性,但不能被浓硫酸氧化,A错误;随着反应的进行,硫酸的浓度降低,稀硫酸不能与铜反应,因此被还原的H2SO4的物质的量小于0.45 mol,C错误;常温下浓硫酸使铝钝化(化学变化),形成致密的氧化膜阻碍了反应的继续进行,D错误。
3.D 由转化图可知,Fe2+与水体中的N反应,可以除去水体中的硝态氮,D错误。
4.B Mg不能与NaOH发生反应,A错误;Mg、Ca均为活泼金属,均可采用电解熔融氯化物的方法冶炼,B正确;S与Cu反应生成Cu2S,C错误;SiO2为共价晶体、CO2为分子晶体,二者物理性质差异较大,D错误。
5.B NO2与水反应的化学方程式为3NO2+H2O2HNO3+NO,NO难溶于水,液体不可能充满烧瓶,A错误;NH3极易溶于水,造成烧瓶中压强变小,形成喷泉,且最终液体几乎充满烧瓶,B正确;CO2难溶于饱和NaHCO3溶液,烧瓶内不可能形成喷泉,C错误;CH4难溶于水,且不与溴单质反应,烧瓶内不可能形成喷泉,D错误。
6.A e和f的钠盐分别是Na2S、Na2SO3,在酸性条件下,将Na2S、Na2SO3溶液混合发生归中反应:2S2-+S+6H+3S↓+3H2O,A正确。若图中盐为钠的正盐,图中S、Na2SO3、H2SO3中的S元素化合价既有升高的趋势又有降低的趋势,S、Na2SO3、H2SO3既有氧化性又有还原性;H2S中+1价的H具有弱氧化性、-2价的S具有还原性,H2S既有氧化性又有还原性,B错误。b是H2SO3,将H2SO3的稀溶液滴加到品红溶液中,品红溶液褪色,体现了H2SO3的漂白性,C错误。c是硫酸,将浓硫酸滴加在胆矾晶体上,晶体由蓝色变成白色,体现了浓硫酸的吸水性,D错误。
7.C ②中的品红褪色体现了SO2的漂白性,③中的酸性KMnO4溶液褪色体现了SO2的还原性,A错误;SO2与水反应生成的H2SO3能与品红分子结合,使品红溶液褪色,无水存在时,SO2分子不能使其褪色,B错误;SO2与水反应生成H2SO3:H2SO3H++HS,HSH++S,C正确;SO2在溶液中生成S,说明SO2具有还原性,D错误。
8.B 足量CO2和氢氧化钠反应生成NaHCO3,NaHCO3和氢氧化钠反应生成Na2CO3,Na2CO3溶液和CO2反应生成NaHCO3,A正确。若丁是氯气,Fe和氯气反应生成FeCl3;若丁是盐酸,Fe和盐酸反应生成FeCl2,FeCl2和盐酸不反应,B错误。H2S在氧气不足的条件下燃烧生成S和水,S和氧气点燃生成SO2,SO2和H2S反应生成S和水,C正确。AlCl3和少量氢氧化钠反应生成Al(OH)3,Al(OH)3和氢氧化钠反应生成NaAlO2,NaAlO2溶液和AlCl3溶液混合生成Al(OH)3,D正确。
9.A 装置甲中二氧化锰和浓盐酸在加热的条件下发生反应:MnO2+4HCl(浓)MnCl2+2H2O+Cl2↑,氧化剂是MnO2,还原剂是HCl,其物质的量之比为1∶2,A错误;装置甲中制备的氯气中混有HCl气体,乙中饱和NaCl溶液的作用是除去Cl2中的HCl,B正确;Cl2与水反应生成HCl、HClO,溶液显酸性,且HClO具有漂白性,则Cl2通入紫色石蕊溶液先变红后褪色,C正确;Cl2与NaOH溶液反应生成NaCl和NaClO,可用NaOH溶液吸收多余的Cl2,丁中可盛放NaOH溶液,D正确。
10.A Fe2+能发生水解:Fe2++2H2OFe(OH)2+2H+,加入磷酸溶解过程中可以抑制Fe2+水解,A正确;反应1中NaClO作氧化剂,将Fe2+氧化成Fe3+,本身被还原成NaCl,酸性高锰酸钾溶液能氧化Cl-而褪色,故不能用酸性高锰酸钾溶液检验反应1中Fe2+是否完全反应,B错误;洗涤沉淀时,不能用玻璃棒搅拌,防止弄破滤纸,C错误;草酸为还原剂,FePO4为氧化剂,根据得失电子守恒可得,FePO4与草酸的物质的量之比为2∶1,D错误。
11.D 未指明醋酸和盐酸的浓度,只比较pH大小,无法判断醋酸是强电解质还是弱电解质,A错误;加入足量盐酸后部分沉淀溶解,则说明沉淀中有BaSO4,同时也说明Na2SO3能被空气中的O2氧化为Na2SO4,B错误;氯水过量,溶液变为蓝色,有可能是过量氯水将KI氧化成了碘单质,无法比较出溴单质和碘单质的氧化性强弱,C错误;KSCN溶液可用于检验Fe3+,滴加氯水后,溶液变红,则说明Fe2+被氧化成Fe3+,可以证明Fe2+具有还原性,D正确。
12.C ①中发生反应2NaClO3+Na2SO3+H2SO42ClO2↑+2Na2SO4+H2O,S的化合价升高,Na2SO3为还原剂;2ClO2+2NaOH+H2O22NaClO2+2H2O+O2中O元素化合价也升高,H2O2为还原剂,A正确。装置②④的作用分别是防倒吸、吸收生成的ClO2,B正确。由于温度高于60 ℃时,NaClO2会发生分解,所以可采取冷却结晶的方法获得晶体,C错误。反应结束时,通氮气的目的是将仪器中残留的气体排入④中,排除污染气体,保证实验结束安全,D正确。
13.答案 (1)+6价
(2)Al(OH)3
(3)①Mo+Ba2+BaMoO4↓ ②
(4)①NaHCO3 ②NH3
(5)①Al2O3 ②4∶1
解析 (1)“焙烧”中,有Na2MoO4生成,其中Na和O元素的化合价分别为+1价和-2价,根据化合物中元素化合价的代数和为0可知,Mo元素的化合价为+6价。
(2)“沉铝”中,偏铝酸钠转化为氢氧化铝,因此,生成的沉淀X为Al(OH)3。
(3)①滤液Ⅱ中含有钼酸钠(Na2MoO4),加入氯化钡溶液后生成BaMoO4沉淀,该反应的离子方程式为Mo+Ba2+BaMoO4↓。
②若开始生成BaCO3沉淀,则体系中恰好建立如下平衡:HC+BaMoO4BaCO3+Mo+H+,该反应的化学平衡常数K==
=
。为避免BaMoO4中混入BaCO3沉淀,必须满足,即,由于“沉钼”中pH为7.0,c(H+)=1×10-7 mol·L-1,所以溶液中时,应停止加入BaCl2溶液。
(4)①滤液Ⅰ中通入过量的二氧化碳,偏铝酸钠转化为氢氧化铝沉淀,同时生成碳酸氢钠,过滤得到的滤液Ⅱ中含有碳酸氢钠和钼酸钠。滤液Ⅱ中加入适量的氯化钡溶液沉钼后,过滤,得到的滤液Ⅲ中主要存在的钠盐有NaCl和NaHCO3,故Y为NaHCO3。
②根据侯氏制碱法的原理可知,往滤液Ⅲ中添加适量NaCl固体后,通入足量NH3,再通入足量CO2,可析出NaHCO3。
(5)①由题中信息可知,致密的保护膜为一种氧化物,是由H2O2与AlAs反应生成的,联想到金属铝表面容易形成致密的氧化膜,可知该氧化物为Al2O3。
②由Ga和Al同族、As和N同族可知,GaAs中Ga显+3价(其最高价)、As显-3价。在H2O2与上层GaAs的反应中,As元素的化合价由-3价变为+5价,As元素被氧化,则该反应的氧化剂为H2O2,还原剂为GaAs。H2O2中的O元素的化合价为-1价,其作为氧化剂时,O元素要被还原到-2价,根据得失电子守恒可知,该反应的氧化剂与还原剂物质的量之比为8∶2=4∶1。
14.答案 (1)将三价铈转化为四价铈,且将碳酸盐转化为二氧化碳,实现铈的富集
(2)6H++2CeO2+H2O24H2O+2Ce3++O2↑
(3)过滤
(4)“浸出液”中加入的S浓度增大,c([CeSO4]2+)增大,而D=减小
(5)95.68%
(6)①8 ②×107
解析 (1)根据题意,四价铈不易进入溶液,而三价铈易进入溶液。故“焙烧”氟碳铈矿的目的是将三价铈转化为四价铈,且将碳酸盐转化为二氧化碳,实现铈的富集。
(5)根据氧化还原反应得失电子守恒推知,n(Ce4+)×1+n(KMnO4)×5=n(Fe2+)×1,解得n(Ce4+)=0.023 00 mol,故Ce(OH)4的质量分数w[Ce(OH)4]=×100%=95.68%。
(6)②在CeO2晶胞中,N(Ce4+)=8×+6×=4,N(O2-)=8×1=8,故每个晶胞中相当于有4个CeO2,V= cm3,故a=×107 nm
同课章节目录
