2024届高考化学二轮专题练习——卤素及其化合物(含解析)
文档属性
| 名称 | 2024届高考化学二轮专题练习——卤素及其化合物(含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 274.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-18 01:10:10 | ||
图片预览




文档简介
2024届高考化学二轮专题练习——卤素及其化合物
一、单选题
1.化学为世界添加了五彩缤纷的颜色,下列关于颜色的说法中正确的是
A.用铂丝蘸取某溶液进行焰色反应,火焰呈黄色,该溶液中一定含有钠盐
B.向氯化铁溶液中滴加硫氰化钾溶液可生成血红色沉淀
C.红热的铜丝在盛满氯气的集气瓶中燃烧时有棕黄色的烟产生
D.“炉火照天地,红星乱紫烟”描述的是碘升华时的颜色变化
2.下列气体是黄绿色的是
A.CO2 B.Cl2 C.NH3 D.NO
3.自来水生产时,用适量的氯气来杀菌消毒。市场上有些不法商贩为牟取暴利,用自来水冒充纯净水出售。为辨别真假,可用下列一种化学试剂来鉴别,该试剂是
A.硝酸银试液 B.稀盐酸
C.氢氧化钠试液 D.酚酞试液
4.下列化学反应对应的离子方程式错误的是
A.向溶液中通入少量:
B.过量的溶液与溶液反应:
C.向溶液中通入少量:
D.时:
5.能正确表示下列反应离子方程式的是
A.向NaAlO2溶液中通入过量CO2制Al(OH)3:CO2+AlO2-+2H2O=Al(OH)3↓+HCO3-
B.NaHCO3溶液中加入HCl:CO32-+2H+=CO2↑+H2O
C.将磁性氧化铁溶于盐酸:Fe3O4+8H+=3Fe3++4H2O
D.“84消毒液”和“洁厕灵”(主要成分为盐酸)混合使用会产生有毒气体:ClO3-+5Cl-+6H+=3Cl2↑+3H2O
6.将氯水逐滴滴入淀粉 KI溶液中至过量,溶液由无色变为蓝色又逐渐变为无色,由此能得出的结论是
A.I- 被氧化为I2 B.I2被氧化为
C.氯水有漂白性 D.HClO氧化I2为
7.下列有关叙述不正确的是
A.化学科研工作者可从事特定功能新分子合成、节能环保物质转化工艺的研发等
B.工业上制取NaOH一般不采用Na2O和H2O的反应,而主要采用电解饱和食盐水的方法
C.Ca(ClO)2用作游泳池消毒剂,Fe2O3用作油漆红色颜料
D.欲除去粗盐水中的Mg2+、Ca2+、得到精盐,所添加试剂的顺序为:NaOH溶液,Na2CO3溶液,BaCl2溶液、盐酸
8.下列说法正确的是
A.和都能使石蕊试液褪色
B.、都可用于漂白物质,将等物质的量的两种气体同时作用于潮湿的有色物质时,可增强漂白效果
C.活性炭使有色物质褪色是利用了碳单质的还原性,使有色物质发生了还原反应
D.使品红溶液褪色后,将褪色后的溶液加热,溶液重新变为红色
9.某混合气体中可能含有Cl2、O2、SO2、NO、NO2中的两种或多种气体。现将此无色透明的混合气体通过品红溶液后,品红溶液褪色,把剩余气体排入空气中,很快变为红棕色。对于原混合气体成分的判断中正确的是( )
A.肯定有SO2和NO
B.肯定没有Cl2和NO2,一定有O2
C.可能有Cl2和O2
D.肯定只有NO
10.在盛有溴化钾溶液的试管中加入足量的氯水,再加少量的CCl4,充分振荡静置后( )
A.溶液分层,下层红棕色 B.溶液分层,上层红棕色
C.溶液分层,下层紫红色 D.溶液分层,上层紫红色
11.下列实验操作、现象,以及得出的结论,正确的是
选项 实验操作 实验现象 结论
A 向含有酚酞的稀氢氧化钠溶液中滴加稀盐酸 溶液由无色变为红色 氢氧化钠与盐酸发生了中和反应
B 用洁净铂丝蘸取某溶液,在酒精灯外焰上灼烧 火焰呈黄色 溶液中一定存在,不存在
C 将红色鲜花放入盛有干燥氯气的集气瓶中,盖上玻璃片 鲜花红色褪去 氯气具有漂白性
D 在溶液中加入溴水 溶液由无色变为棕褐色 的氧化性比的强
A.A B.B C.C D.D
12.元素溴是1826年一位法国科学家发现的,它在研究海水制盐时,往剩余的副产物苦卤中通入氯气后发现溶液颜色变深,进一步提取,得到一种红棕色、有刺鼻臭味的液体,这种液体就是溴单质。只用溴水就可将下列各种溶液鉴别出来的是
A.水、汽油、酒精 B.AgNO3、NaOH、KI
C.NaCl、NaBr、NaI D.汽油、酒精、NaCl
13.以海水等为原料,可以制备一系列物质,如图所示。下列说法错误的是
A.Cl2、漂白粉和SO2均可以漂白有色物质,且其漂白原理不同
B.粗盐中含有Ca2+、Mg2+、等杂质离子,精制时依次加入试剂为Na2CO3、NaOH、BaCl2溶液
C.电解海水提取的盐还可冶炼钠、钾、镁等金属
D.步骤①中已经获得Br2,步骤②中又将获得的Br2还原为Br-,其目的是富集Br2,提高Br2的浓度
二、非选择题
14.按要求写出下列化学方程式:
(1)实验室可以用KClO3和浓盐酸反应制取氯气,写出发生反应的化学方程式并用双线桥表示电子转移方向和数目 。
(2)二氧化氯(ClO2)作为一种高效强氧化剂,可用KClO3和草酸(H2C2O4),稀硫酸,水浴加热制备。反应后产物中有ClO2、CO2和一种酸式盐,该反应的化学方程式为 。
(3)写出工业上制备漂白粉的化学方程式 。
15.洪灾过后,饮用水的消毒杀菌成为抑制大规模传染性疾病爆发的有效方法之一,漂白粉是常用的消毒剂。
(1) 工业上将氯气通入石灰乳[Ca(OH)2]制取漂白粉,化学反应方程式为 。
(2)漂白粉的有效成分是(填化学式) 。
(3)漂白粉溶于水后,受空气中的CO2作用,即产生有漂白、杀菌作用的次氯酸,化学反应方程式为 。
(4)过氧化钠是 的固体,它与水和二氧化碳反应的化学方程式依次为 ; 因此,过氧化钠可作为 和 里氧气的来源(各1分)
2 )用20g烧碱配制成500mL溶液,其物质的量浓度,为 mol/L;从中取出1mL,其物质的量浓度为 mol/L;若将这1mL溶液用水稀释到100mL,所得溶液中溶质的物质的量浓度为 mol/L。
16.工业上用铬铁矿()生产重铬酸钾()。实验流程如下,
步骤1:铬铁矿与固体NaOH混合在空气中高温氧化制得
步骤2:将高温氧化所得固体溶于水过滤,向滤液中再加入盐酸酸化,得溶液
步骤3:由溶液经系列操作制备晶体
(1)步骤1中高温氧化时,同时有生成,写出该反应的化学方程式: 。
(2)步骤2中酸化时盐酸不宜过量太多的原因是 。
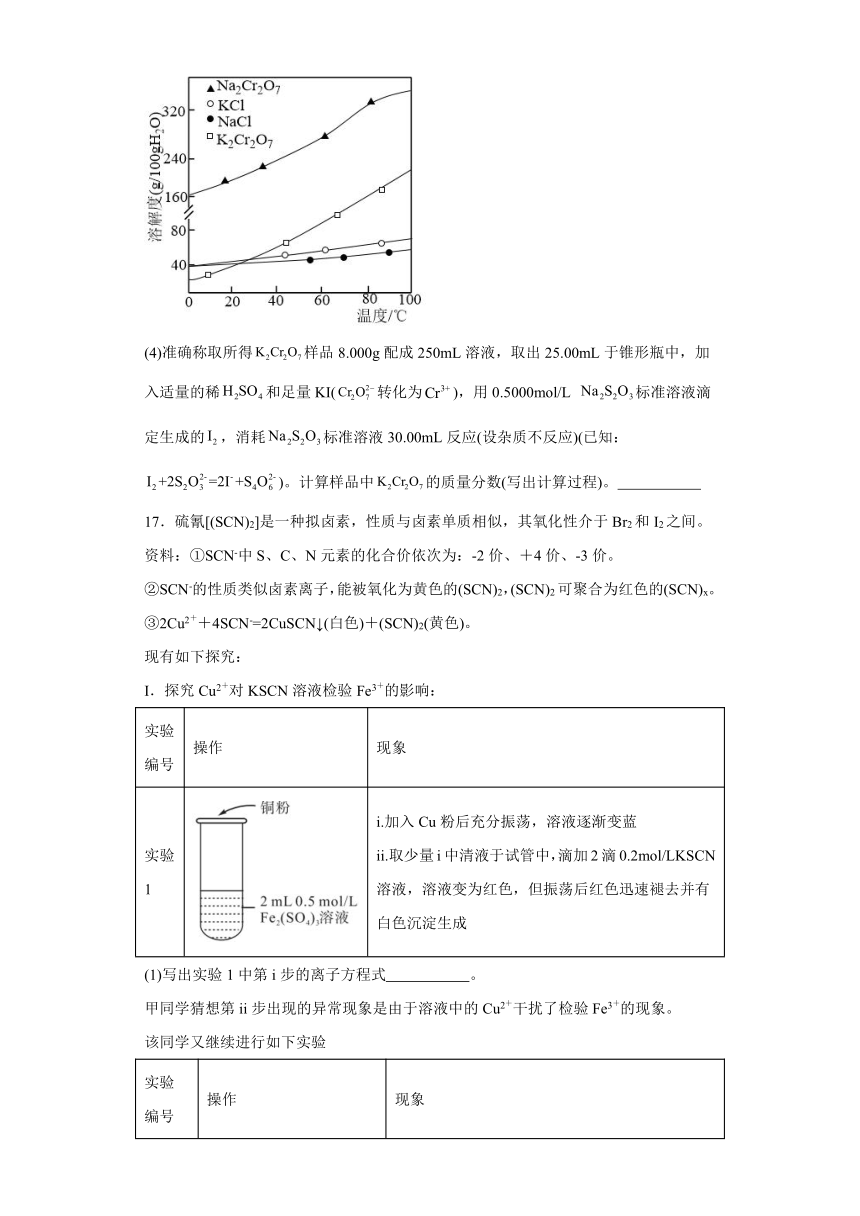
(3)步骤3中制备晶体的实验方案是:将“溶液”加热浓缩, ,低温干燥,得晶体。(部分物质的溶解度曲线如图所示:晶体需“洗涤完全”)
(4)准确称取所得样品8.000g配成250mL溶液,取出25.00mL于锥形瓶中,加入适量的稀和足量KI(转化为),用0.5000mol/L 标准溶液滴定生成的,消耗标准溶液30.00mL反应(设杂质不反应)(已知:)。计算样品中的质量分数(写出计算过程)。
17.硫氰[(SCN)2]是一种拟卤素,性质与卤素单质相似,其氧化性介于Br2和I2之间。
资料:①SCN-中S、C、N元素的化合价依次为:-2价、+4价、-3价。
②SCN-的性质类似卤素离子,能被氧化为黄色的(SCN)2,(SCN)2可聚合为红色的(SCN)x。
③2Cu2++4SCN-=2CuSCN↓(白色)+(SCN)2(黄色)。
现有如下探究:
I.探究Cu2+对KSCN溶液检验Fe3+的影响:
实验编号 操作 现象
实验1 i.加入Cu粉后充分振荡,溶液逐渐变蓝 ii.取少量i中清液于试管中,滴加2滴0.2mol/LKSCN溶液,溶液变为红色,但振荡后红色迅速褪去并有白色沉淀生成
(1)写出实验1中第i步的离子方程式 。
甲同学猜想第ii步出现的异常现象是由于溶液中的Cu2+干扰了检验Fe3+的现象。
该同学又继续进行如下实验
实验编号 操作 现象
实验2 开始时溶液呈绿色,一段时间后开始出现白色沉淀,上层溶液变为黄色
实验3 无色溶液立即变红,同时生成白色沉淀
(2)经检测,实验2反应后的溶液pH值减小,可能的原因是 。
(3)由实验2、3可知,实验3中溶液变红的原因是 。
II.探究浓硝酸与KSCN溶液的反应
[实验一]浓硝酸与KSCN溶液反应
(4)向浓硝酸中滴加KSCN溶液,溶液立即变红是因为生成了 (填化学式)。
[实验二]浓硝酸与KSCN溶液反应产物
a.将实验一iii中的气体通入Ba(OH)2和NaOH的混合溶液中,有白色沉淀生成。
b.过滤、洗涤白色沉淀,取少量于试管中,加入过量的稀硝酸,沉淀完全溶解,再滴加少量KMnO4溶液,不褪色。
c.另取少量实验一iii中试管内的溶液加入BaCl2溶液,产生大量白色沉淀。
(5)a中,气体通入Ba(OH)2溶液开始出现白色沉淀,随后白色沉淀溶解,原因是 。
(6)通过b证实了红棕色气体中不含SO2,证据是 ,由上述实验现象可知:SCN-转化的最终产物中一定有 。
参考答案:
1.C
【详解】A.焰色为黄色说明溶液中含有含钠元素的化合物,可以是NaOH,A项错误;
B.FeCl3遇KSCN溶液可生成血红色络合物,B项错误;
C.Cu在Cl2中燃烧的实验现象为产生棕黄色的烟,C项正确;
D.“炉火照天地,红星乱紫烟”描述的是冶炼金属的场景,D项错误;
故选:C。
2.B
【详解】A. CO2是无色气体,A错误;B. Cl2是黄绿色气体,B正确;C. NH3是无色气体,C错误;D. NO是无色气体,D错误,答案选B。
3.A
【详解】自来水中含有较多的Cl-,纯净水含很少的Cl-,鉴别Cl-用的试剂是硝酸银试液,选A。
4.B
【详解】A.次氯酸钙溶液与少量二氧化硫反应生成氯化钙、次氯酸钙沉淀和次氯酸,反应的离子方程式为,故A正确;
B.过量的碳酸氢钠溶液与氢氧化钙溶液反应生成碳酸钙沉淀、碳酸钠和水,反应的离子方程式为,故B错误;
C.偏铝酸钠溶液与少量二氧化碳反应生成氢氧化铝沉淀和碳酸钠,反应的离子方程式为,故C正确;
D.碘离子的还原性强于亚铁离子,碘化亚铁溶液与氯气反应时,碘离子优先反应,当碘化亚铁与氯气以3:4的物质的量比反应时,反应生成氯化铁、氯化亚铁和碘,反应的离子方程式为,故D正确;
故选B。
5.A
【详解】A.向NaAlO2溶液中通入过量CO2制Al(OH)3的离子反应为:CO2+AlO2﹣+2H2O═Al(OH)3↓+HCO3﹣,故A正确;
B.NaHCO3溶液中加入HCl反应的离子方程式为:HCO3-+H+=CO2↑+H2O ,故B错误;
C.将磁性氧化铁溶于盐酸反应的离子方程式为:Fe3O4+8H+=2Fe3++4H2O+ Fe2+,故C错误;
D.“84消毒液”和“洁厕灵”(主要成分为盐酸)混合使用会产生有毒气体反应的离子方程式为:ClO-+Cl-+2H+=Cl2↑+H2O,故D错误;
本题答案为A。
6.A
【详解】A.氯水逐滴滴入淀粉 KI溶液中,溶液变蓝色,则表明有I2生成,从而表明I- 被Cl2氧化为I2,A正确;
B.溶液由蓝色变为无色,则表明I2被氧化,应生成,B不正确;
C.氯水使I2的淀粉溶液的蓝色褪去,表明氯水有强氧化性,而不是漂白性,C不正确;
D.溶液的蓝色褪去,应为氯水中的Cl2氧化I2为,D不正确;
故选A。
7.D
【详解】A.特定功能新分子合成、节能环保物质转化工艺的研发都属于化学前沿科学,化学科研工作者可从事特定功能新分子合成、节能环保物质转化工艺的研发等,故A正确;
B.氧化钠到性质不稳定、来源少,用氧化钠与水反应制备氢氧化钠成本高,不适用于批量生产氢氧化钠,所以工业上采用电解饱和食盐水的方法制取氢氧化钠,故B正确;
C.次氯酸钙具有强氧化性,能起到杀菌消毒的作用,常用于作游泳池消毒剂,氧化铁是红棕色粉末,常用作油漆红色颜料,故C正确;
D.除去粗盐水中的硫酸根离子需进入过量的氯化钡溶液,除去过量的钡离子应加入碳酸钠溶液,所以除去粗盐中的杂质离子得到精盐时,碳酸钠溶液应在氯化钡溶液之后加入,故D错误;
故选D。
8.D
【详解】A.不能使指示剂褪色,能使石蕊试液变红而不是褪色,选项A错误;
B.当与按物质的量之比为1∶1作用于潮湿的有色物质时,发生反应:,失去了漂白性,选项B错误;
C.活性炭使有色物质褪色是利用了活性炭的吸附性,选项C错误;
D.由于与品红化合后生成的无色物质不稳定,受热时又分解生成了品红,故溶液又重新变为红色,选项D正确。
答案选D。
【点睛】常见的漂白原理有三种类型:氧化型、化合型、吸附型,考生常因不清楚漂白剂的具体性质,不能将物质褪色的原因与漂白原理建立正确的关系而出错。另外,对于使物质褪色,还需注意:①使品红溶液褪色,表现了的漂白性,但不能漂白酸碱指示剂。②并非所有与,反应的物质褪色都体现了的漂白性,如能使滴有酚酞的溶液褪色体现了是酸性氧化物的性质;能使溴水和酸性溶液褪色体现了的还原性。
9.A
【详解】该气体无色,排除了Cl2、NO2气体。该气体能使品红溶液褪色,则一定含有SO2气体。将剩余气体排放到空气中,气体迅速变为红棕色,判断一定含有NO气体,故一定无O2,所以选A。
10.A
【详解】氯水与KBr反应生成KCl和溴单质,溴更易溶于四氯化碳,且四氯化碳的密度比水的密度大,四氯化碳与水会分层,则振荡静置后可观察到的现象是溶液分两层、下层呈红棕色,A项正确;
答案选A。
11.D
【详解】A.向含有酚酞的稀氢氧化钠溶液中滴加稀盐酸,溶液由红色变为无色,说明盐酸和氢氧化钠反应了,故A错误;
B.用洁净铂丝蘸取某溶液,在酒精灯外焰上灼烧,火焰呈黄色,溶液中一定存在,可能存在,故B错误;
C.将红色鲜花放入盛有干燥氯气的集气瓶中,盖上玻璃片,鲜花红色褪去,是因为氯气和鲜花中的水反应生成HClO,HClO漂白鲜花,不能说氯气有漂白性,故C错误;
D.在溶液中加入溴水,溶液由无色变为棕褐色,说明生成了单质碘,即说明的氧化性比的强,故D正确。
综上所述,答案为D。
12.B
【详解】试题分析:A、D选项,只能通过分层检验出汽油。B选项中,溴水与AgNO 3 作用,生成淡黄色的AgBr沉淀;与NaOH溶液反应,生成无色的溴化钠、次溴酸钠和水,会观察到溴水褪色;与KI反应,置换出I 2 ,溶液颜色加深,所以B选项可以鉴别。C选项只能鉴别出NaI。 答案:B
考点:溶液的鉴别
13.B
【详解】A.Cl2、漂白粉具有强氧化性,能将有色物质氧化,从而使其褪色,SO2与某些有色物质结合生成无色化合物,发生非氧化还原反应,其漂白原理不同,A正确;
B.除去粗盐中含有的Ca2+、Mg2+、离子时,BaCl2溶液一定要放在Na2CO3的前面,否则无法除去过量的Ba2+,B不正确;
C.电解从海水中提取的NaCl、KCl、MgCl2等熔融盐,可冶炼钠、钾、镁等金属,C正确;
D.步骤①中获得的Br2浓度很小,提取出来比较困难,步骤②中将获得的Br2还原为Br-,可控制溶液浓度,最终获得浓度较大的Br2,从而实现Br2的富集,D正确;
故选B。
14. 2KClO3+H2C2O4+2H2SO4 2ClO2↑+2CO2↑+2KHSO4+2H2O 2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O
【分析】(1)氯酸钾与浓盐酸反应生成氯化钾、水和氯气,反应中只有Cl元素化合价发生变化,当有3mol Cl2生成时,转移5mol电子,据此分析解答;
(2)依据题意可知:KClO3和草酸(H2C2O4)在酸性条件下反应生成ClO2、CO2和KHSO4,据此书写反应的化学方程式;
(3)工业上用氯气与石灰乳反应制备漂白粉。
【详解】(1)氯酸钾与浓盐酸反应生成氯化钾、水和氯气,反应的化学方程式:KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O,反应中只有Cl元素化合价发生变化,当有3mol Cl2生成时,转移5mol电子,则电子转移的方向和数目用双线桥表示为,故答案为:;
(2)依据题意可知:KClO3和草酸(H2C2O4)在酸性条件下反应生成ClO2、CO2和KHSO4,发生氧化还原反应,反应的化学方程式:2KClO3+H2C2O4+2H2SO4 2ClO2↑+2CO2↑+2KHSO4+2H2O,故答案为:2KClO3+H2C2O4+2H2SO4 2ClO2↑+2CO2↑+2KHSO4+2H2O;
(3)工业上氯气与石灰乳制备漂白粉,反应生成氯化钙、次氯酸钙和水,反应的化学方程式:2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O,故答案为:2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O。
15. 2Cl2 + 2 Ca(OH)2 == Ca(ClO)2 + CaCl2 + 2H2O Ca(ClO)2 Ca(ClO)2 + CO2 + H2O =CaCO3↓+ 2 HClO 淡黄色 2Na2O2 + 2 H2O = 4NaOH + O2↑ 2Na2O2 + 2 CO2 =2Na2CO3 + O2 呼吸面具 潜水艇 1 1 0.01
【分析】(1)根据氯气与Ca(OH)2反应生成CaCl2、Ca(ClO)2和水书写;
(2)漂白粉主要成分为氯化钙和次氯酸钙,有效成分为次氯酸钙 ;
(3)次氯酸酸性比碳酸弱,Ca(ClO)2与空气中的CO2反应生成HClO和CaCO3;
(4)过氧化钠是淡黄色的固体,它与水反应生成氢氧化钠和氧气,与二氧化碳反应生成碳酸钠和氧气,以此常用作呼吸面具和潜水艇中氧气来源。
(5)根据c=n/v计算浓度;根据稀释前后溶质的量不变计算稀释后浓度。
【详解】(1)氯气通入石灰乳[Ca(OH)2 ]制取漂白粉,反应生成CaCl 2 、Ca(ClO)2 、H 2 O,该反应为2Ca(OH)2 +2Cl 2 ═CaCl 2 +Ca(ClO)2 +2H2O;
答案:2Ca(OH)2+2Cl 2 ═CaCl 2 +Ca(ClO)2 +2H2O
(2)漂白粉主要成分为氯化钙和次氯酸钙,有效成分为次氯酸钙,化学式为Ca(ClO)2 ;
答案:Ca(ClO)2
(3)次氯酸酸性比碳酸弱,Ca(ClO)2 与空气中的CO2反应生成HClO和CaCO3沉淀,
反应的方程式为Ca(ClO)2 +CO2+H2O=CaCO3↓+2HClO;
答案:Ca(ClO)2 +CO2+H2O=CaCO3↓+2HClO
(4)过氧化钠是淡黄色的固体,它与水反应生成氢氧化钠和氧气,方程式为2Na2O2 + 2 H2O = 4NaOH + O2↑,与二氧化碳反应生成碳酸钠和氧气,方程式为2Na2O2 + 2 CO2 =2Na2CO3 + O2,因此常用作呼吸面具和潜水艇中氧气来源。
答案:淡黄色 2Na2O2 + 2H2O = 4NaOH + O2↑ 2Na2O2 + 2CO2 =2Na2CO3 + O2 呼吸面具潜水艇
(5)根据c=n/V==1mol/L;从中取出1mL,浓度不变仍为1mol/L;若将这1mL溶液用水稀释到100mL,因为稀释前后溶质的量不变相当于浓度变为原来的1/100,所得溶液中溶质的物质的量浓度为0.01mol/L;
答案:1 1 0.01
16.(1)4+16NaOH+7O28Na2CrO4+2Fe2O3+8H2O
(2)由于Na2Cr2O7具有强氧化性,能够将浓盐酸氧化为Cl2,Cl2有毒而污染环境
(3)加入一定量的KCl,至析出大量的晶体,40℃以上趁热过滤,洗涤完全
(4)91.875%
【分析】本题是工业上利用铬铁矿()来制备K2Cr2O7的工业流程题,步骤1为高温氧化时,同时有生成,即铬铁矿()与固体NaOH混合在空气中高温氧化制得和H2O,故该反应的化学方程式:4+16NaOH+7O28Na2CrO4+2Fe2O3+8H2O,步骤2为酸化Na2CrO4溶液制得Na2Cr2O7,反应原理为:2Na2CrO4+2HCl=Na2Cr2O7+2NaCl+H2O,步骤3为将“溶液”加热浓缩,加入一定量的KCl,至析出大量的晶体,40℃以上趁热过滤,洗涤完全,低温干燥,得晶体,(4)根据得失电子总数相等即可求解,据此分析解题。
(1)
步骤1中高温氧化时,同时有Fe2O3生成,即铬铁矿(FeO Cr2O3)与固体NaOH混合在空气中高温氧化制得Na2CrO4和H2O,故该反应的化学方程式为4+16NaOH+7O28Na2CrO4+2Fe2O3+8H2O;
(2)
由于Na2Cr2O7具有强氧化性,能够将浓盐酸氧化为Cl2,Cl2有毒而污染环境,反应原理为:Na2Cr2O7+16HCl=2NaCl+2CrCl3+3Cl2↑+7H2O,故步骤2中酸化时盐酸不宜过量太多,故答案为:由于Na2Cr2O7具有强氧化性,能够将浓盐酸氧化为Cl2,Cl2有毒而污染环境;
(3)
由溶解度曲线图可知,在40℃以上K2Cr2O7的溶解度比KCl、NaCl的大,比Na2Cr2O7的小,故步骤3中制备晶体的实验方案是:将“溶液”加热浓缩,加入一定量的KCl,至析出大量的晶体,40℃以上趁热过滤,洗涤完全,低温干燥,得晶体。(部分物质的溶解度曲线如图所示:晶体需“洗涤完全”),故答案为:加入一定量的KCl,至析出大量的晶体,40℃以上趁热过滤,洗涤完全;
(4)
根据得失电子总数相等,可找到关系式为:K2Cr2O7~3I2~6Na2S2O3,故有:n(K2Cr2O7)=n()=×0.5000mol/L×30.00×10-3L=2.5×10-3mol,则250mL溶液中含有的K2Cr2O7的物质的量为:2.5×10-3mol×=2.5×10-2mol,故样品中的质量分数为:=91.875%。
17. Cu+2Fe3+=2Fe2++Cu2+ 部分(SCN)2与水反应生成酸 Cu2+与SCN-产生白色CuSCN的同时生成(SCN)2,Fe2+被(SCN)2氧化为Fe3+,Fe3++3SCN-Fe(SCN)3,所以溶液变红 (SCN)x 混合气体中有大量的NO2使溶液呈酸性,开始产生的白色BaCO3沉淀溶解 向洗净的白色沉淀中加入过量的稀硝酸,沉淀完全溶解,再滴加少量KMnO4溶液,不褪色 CO2、SO
【分析】I.Fe2(SO4)3溶液因含Fe3+呈黄色,加入铜粉后发生Cu+2Fe3+= 2Fe2++Cu2+,溶液逐渐变为蓝色;取少量i中清液于试管中,滴加2滴0.2mol/LKSCN溶液,发生了2Cu2++4SCN-=2CuSCN↓(白色)+(SCN)2(黄色),(SCN)2将亚铁离子氧化为铁离子,发生Fe3++3SCN-Fe(SCN)3,所以溶液变红,振荡后SCN-和Cu2+充分接触,又发生2Cu2++4SCN-=2CuSCN↓(白色)+(SCN)2(黄色),产生白色沉淀,同时由于SCN-被消耗,Fe3++3SCN-Fe(SCN)3逆向移动,红色消失;
由实验2可知发生了铜离子和硫氰酸根离子发生了2Cu2++4SCN-=2CuSCN↓(白色)+(SCN)2(黄色),(SCN)2溶于水导致上层溶液呈黄色;
通过实验3,验证了实验1中的ii的结论;
II.浓硝酸有强氧化性,浓硝酸中加入KSCN后,SCN-被浓硝酸氧化为(SCN)2,(SCN)2聚合为红色的(SCN)x,溶液迅速变红;静置一段时间后剧烈反应,红色迅速褪去可能是浓硝酸氧化了(SCN)x所致。
【详解】(1)加入Cu粉后溶液逐渐变蓝,说明生成了铜盐,因此发生Cu+2Fe3+= 2Fe2++Cu2+;
(2)根据实验2的现象,开始时溶液呈绿色,一段时间后开始出现白色沉淀,上层溶液变为黄色,说明发生了2Cu2++4SCN-=2CuSCN↓(白色)+(SCN)2(黄色),(SCN)2性质与卤素单质相似,部分(SCN)2与水反应生成酸,溶液pH值减小;
(3)由分析可知Cu2+与SCN-产生白色CuSCN的同时生成(SCN)2,Fe2+被(SCN)2氧化为Fe3+,Fe3++3SCN-Fe(SCN)3,所以溶液变红;
(4)由分析可知浓硝酸中滴加KSCN溶液,溶液立即变红是因为SCN-被氧化为黄色的(SCN)2,(SCN)2聚合为红色的(SCN)x;
(5)实验一中产生红棕色气体,因此混合气体中有大量的NO2使溶液呈酸性,开始产生的白色BaCO3沉淀溶解;
(6)二氧化硫与亚硫酸根均为较强还原性,向洗净的白色沉淀中加入过量的稀硝酸,沉淀完全溶解,再滴加少量KMnO4溶液,不褪色,说明白色沉淀中不含有还原性的,可作为红棕色气体中不含SO2的证据;结合以上分析,a中产生的白色沉淀为碳酸钡,则SCN-被氧化后产物中含二氧化碳,由b可知SCN-被氧化后产物中不含二氧化硫,由c可知SCN-被氧化后产物中含硫酸根离子,综上所述:SCN-在被氧化的最终产物中一定有CO2、SO
一、单选题
1.化学为世界添加了五彩缤纷的颜色,下列关于颜色的说法中正确的是
A.用铂丝蘸取某溶液进行焰色反应,火焰呈黄色,该溶液中一定含有钠盐
B.向氯化铁溶液中滴加硫氰化钾溶液可生成血红色沉淀
C.红热的铜丝在盛满氯气的集气瓶中燃烧时有棕黄色的烟产生
D.“炉火照天地,红星乱紫烟”描述的是碘升华时的颜色变化
2.下列气体是黄绿色的是
A.CO2 B.Cl2 C.NH3 D.NO
3.自来水生产时,用适量的氯气来杀菌消毒。市场上有些不法商贩为牟取暴利,用自来水冒充纯净水出售。为辨别真假,可用下列一种化学试剂来鉴别,该试剂是
A.硝酸银试液 B.稀盐酸
C.氢氧化钠试液 D.酚酞试液
4.下列化学反应对应的离子方程式错误的是
A.向溶液中通入少量:
B.过量的溶液与溶液反应:
C.向溶液中通入少量:
D.时:
5.能正确表示下列反应离子方程式的是
A.向NaAlO2溶液中通入过量CO2制Al(OH)3:CO2+AlO2-+2H2O=Al(OH)3↓+HCO3-
B.NaHCO3溶液中加入HCl:CO32-+2H+=CO2↑+H2O
C.将磁性氧化铁溶于盐酸:Fe3O4+8H+=3Fe3++4H2O
D.“84消毒液”和“洁厕灵”(主要成分为盐酸)混合使用会产生有毒气体:ClO3-+5Cl-+6H+=3Cl2↑+3H2O
6.将氯水逐滴滴入淀粉 KI溶液中至过量,溶液由无色变为蓝色又逐渐变为无色,由此能得出的结论是
A.I- 被氧化为I2 B.I2被氧化为
C.氯水有漂白性 D.HClO氧化I2为
7.下列有关叙述不正确的是
A.化学科研工作者可从事特定功能新分子合成、节能环保物质转化工艺的研发等
B.工业上制取NaOH一般不采用Na2O和H2O的反应,而主要采用电解饱和食盐水的方法
C.Ca(ClO)2用作游泳池消毒剂,Fe2O3用作油漆红色颜料
D.欲除去粗盐水中的Mg2+、Ca2+、得到精盐,所添加试剂的顺序为:NaOH溶液,Na2CO3溶液,BaCl2溶液、盐酸
8.下列说法正确的是
A.和都能使石蕊试液褪色
B.、都可用于漂白物质,将等物质的量的两种气体同时作用于潮湿的有色物质时,可增强漂白效果
C.活性炭使有色物质褪色是利用了碳单质的还原性,使有色物质发生了还原反应
D.使品红溶液褪色后,将褪色后的溶液加热,溶液重新变为红色
9.某混合气体中可能含有Cl2、O2、SO2、NO、NO2中的两种或多种气体。现将此无色透明的混合气体通过品红溶液后,品红溶液褪色,把剩余气体排入空气中,很快变为红棕色。对于原混合气体成分的判断中正确的是( )
A.肯定有SO2和NO
B.肯定没有Cl2和NO2,一定有O2
C.可能有Cl2和O2
D.肯定只有NO
10.在盛有溴化钾溶液的试管中加入足量的氯水,再加少量的CCl4,充分振荡静置后( )
A.溶液分层,下层红棕色 B.溶液分层,上层红棕色
C.溶液分层,下层紫红色 D.溶液分层,上层紫红色
11.下列实验操作、现象,以及得出的结论,正确的是
选项 实验操作 实验现象 结论
A 向含有酚酞的稀氢氧化钠溶液中滴加稀盐酸 溶液由无色变为红色 氢氧化钠与盐酸发生了中和反应
B 用洁净铂丝蘸取某溶液,在酒精灯外焰上灼烧 火焰呈黄色 溶液中一定存在,不存在
C 将红色鲜花放入盛有干燥氯气的集气瓶中,盖上玻璃片 鲜花红色褪去 氯气具有漂白性
D 在溶液中加入溴水 溶液由无色变为棕褐色 的氧化性比的强
A.A B.B C.C D.D
12.元素溴是1826年一位法国科学家发现的,它在研究海水制盐时,往剩余的副产物苦卤中通入氯气后发现溶液颜色变深,进一步提取,得到一种红棕色、有刺鼻臭味的液体,这种液体就是溴单质。只用溴水就可将下列各种溶液鉴别出来的是
A.水、汽油、酒精 B.AgNO3、NaOH、KI
C.NaCl、NaBr、NaI D.汽油、酒精、NaCl
13.以海水等为原料,可以制备一系列物质,如图所示。下列说法错误的是
A.Cl2、漂白粉和SO2均可以漂白有色物质,且其漂白原理不同
B.粗盐中含有Ca2+、Mg2+、等杂质离子,精制时依次加入试剂为Na2CO3、NaOH、BaCl2溶液
C.电解海水提取的盐还可冶炼钠、钾、镁等金属
D.步骤①中已经获得Br2,步骤②中又将获得的Br2还原为Br-,其目的是富集Br2,提高Br2的浓度
二、非选择题
14.按要求写出下列化学方程式:
(1)实验室可以用KClO3和浓盐酸反应制取氯气,写出发生反应的化学方程式并用双线桥表示电子转移方向和数目 。
(2)二氧化氯(ClO2)作为一种高效强氧化剂,可用KClO3和草酸(H2C2O4),稀硫酸,水浴加热制备。反应后产物中有ClO2、CO2和一种酸式盐,该反应的化学方程式为 。
(3)写出工业上制备漂白粉的化学方程式 。
15.洪灾过后,饮用水的消毒杀菌成为抑制大规模传染性疾病爆发的有效方法之一,漂白粉是常用的消毒剂。
(1) 工业上将氯气通入石灰乳[Ca(OH)2]制取漂白粉,化学反应方程式为 。
(2)漂白粉的有效成分是(填化学式) 。
(3)漂白粉溶于水后,受空气中的CO2作用,即产生有漂白、杀菌作用的次氯酸,化学反应方程式为 。
(4)过氧化钠是 的固体,它与水和二氧化碳反应的化学方程式依次为 ; 因此,过氧化钠可作为 和 里氧气的来源(各1分)
2 )用20g烧碱配制成500mL溶液,其物质的量浓度,为 mol/L;从中取出1mL,其物质的量浓度为 mol/L;若将这1mL溶液用水稀释到100mL,所得溶液中溶质的物质的量浓度为 mol/L。
16.工业上用铬铁矿()生产重铬酸钾()。实验流程如下,
步骤1:铬铁矿与固体NaOH混合在空气中高温氧化制得
步骤2:将高温氧化所得固体溶于水过滤,向滤液中再加入盐酸酸化,得溶液
步骤3:由溶液经系列操作制备晶体
(1)步骤1中高温氧化时,同时有生成,写出该反应的化学方程式: 。
(2)步骤2中酸化时盐酸不宜过量太多的原因是 。
(3)步骤3中制备晶体的实验方案是:将“溶液”加热浓缩, ,低温干燥,得晶体。(部分物质的溶解度曲线如图所示:晶体需“洗涤完全”)
(4)准确称取所得样品8.000g配成250mL溶液,取出25.00mL于锥形瓶中,加入适量的稀和足量KI(转化为),用0.5000mol/L 标准溶液滴定生成的,消耗标准溶液30.00mL反应(设杂质不反应)(已知:)。计算样品中的质量分数(写出计算过程)。
17.硫氰[(SCN)2]是一种拟卤素,性质与卤素单质相似,其氧化性介于Br2和I2之间。
资料:①SCN-中S、C、N元素的化合价依次为:-2价、+4价、-3价。
②SCN-的性质类似卤素离子,能被氧化为黄色的(SCN)2,(SCN)2可聚合为红色的(SCN)x。
③2Cu2++4SCN-=2CuSCN↓(白色)+(SCN)2(黄色)。
现有如下探究:
I.探究Cu2+对KSCN溶液检验Fe3+的影响:
实验编号 操作 现象
实验1 i.加入Cu粉后充分振荡,溶液逐渐变蓝 ii.取少量i中清液于试管中,滴加2滴0.2mol/LKSCN溶液,溶液变为红色,但振荡后红色迅速褪去并有白色沉淀生成
(1)写出实验1中第i步的离子方程式 。
甲同学猜想第ii步出现的异常现象是由于溶液中的Cu2+干扰了检验Fe3+的现象。
该同学又继续进行如下实验
实验编号 操作 现象
实验2 开始时溶液呈绿色,一段时间后开始出现白色沉淀,上层溶液变为黄色
实验3 无色溶液立即变红,同时生成白色沉淀
(2)经检测,实验2反应后的溶液pH值减小,可能的原因是 。
(3)由实验2、3可知,实验3中溶液变红的原因是 。
II.探究浓硝酸与KSCN溶液的反应
[实验一]浓硝酸与KSCN溶液反应
(4)向浓硝酸中滴加KSCN溶液,溶液立即变红是因为生成了 (填化学式)。
[实验二]浓硝酸与KSCN溶液反应产物
a.将实验一iii中的气体通入Ba(OH)2和NaOH的混合溶液中,有白色沉淀生成。
b.过滤、洗涤白色沉淀,取少量于试管中,加入过量的稀硝酸,沉淀完全溶解,再滴加少量KMnO4溶液,不褪色。
c.另取少量实验一iii中试管内的溶液加入BaCl2溶液,产生大量白色沉淀。
(5)a中,气体通入Ba(OH)2溶液开始出现白色沉淀,随后白色沉淀溶解,原因是 。
(6)通过b证实了红棕色气体中不含SO2,证据是 ,由上述实验现象可知:SCN-转化的最终产物中一定有 。
参考答案:
1.C
【详解】A.焰色为黄色说明溶液中含有含钠元素的化合物,可以是NaOH,A项错误;
B.FeCl3遇KSCN溶液可生成血红色络合物,B项错误;
C.Cu在Cl2中燃烧的实验现象为产生棕黄色的烟,C项正确;
D.“炉火照天地,红星乱紫烟”描述的是冶炼金属的场景,D项错误;
故选:C。
2.B
【详解】A. CO2是无色气体,A错误;B. Cl2是黄绿色气体,B正确;C. NH3是无色气体,C错误;D. NO是无色气体,D错误,答案选B。
3.A
【详解】自来水中含有较多的Cl-,纯净水含很少的Cl-,鉴别Cl-用的试剂是硝酸银试液,选A。
4.B
【详解】A.次氯酸钙溶液与少量二氧化硫反应生成氯化钙、次氯酸钙沉淀和次氯酸,反应的离子方程式为,故A正确;
B.过量的碳酸氢钠溶液与氢氧化钙溶液反应生成碳酸钙沉淀、碳酸钠和水,反应的离子方程式为,故B错误;
C.偏铝酸钠溶液与少量二氧化碳反应生成氢氧化铝沉淀和碳酸钠,反应的离子方程式为,故C正确;
D.碘离子的还原性强于亚铁离子,碘化亚铁溶液与氯气反应时,碘离子优先反应,当碘化亚铁与氯气以3:4的物质的量比反应时,反应生成氯化铁、氯化亚铁和碘,反应的离子方程式为,故D正确;
故选B。
5.A
【详解】A.向NaAlO2溶液中通入过量CO2制Al(OH)3的离子反应为:CO2+AlO2﹣+2H2O═Al(OH)3↓+HCO3﹣,故A正确;
B.NaHCO3溶液中加入HCl反应的离子方程式为:HCO3-+H+=CO2↑+H2O ,故B错误;
C.将磁性氧化铁溶于盐酸反应的离子方程式为:Fe3O4+8H+=2Fe3++4H2O+ Fe2+,故C错误;
D.“84消毒液”和“洁厕灵”(主要成分为盐酸)混合使用会产生有毒气体反应的离子方程式为:ClO-+Cl-+2H+=Cl2↑+H2O,故D错误;
本题答案为A。
6.A
【详解】A.氯水逐滴滴入淀粉 KI溶液中,溶液变蓝色,则表明有I2生成,从而表明I- 被Cl2氧化为I2,A正确;
B.溶液由蓝色变为无色,则表明I2被氧化,应生成,B不正确;
C.氯水使I2的淀粉溶液的蓝色褪去,表明氯水有强氧化性,而不是漂白性,C不正确;
D.溶液的蓝色褪去,应为氯水中的Cl2氧化I2为,D不正确;
故选A。
7.D
【详解】A.特定功能新分子合成、节能环保物质转化工艺的研发都属于化学前沿科学,化学科研工作者可从事特定功能新分子合成、节能环保物质转化工艺的研发等,故A正确;
B.氧化钠到性质不稳定、来源少,用氧化钠与水反应制备氢氧化钠成本高,不适用于批量生产氢氧化钠,所以工业上采用电解饱和食盐水的方法制取氢氧化钠,故B正确;
C.次氯酸钙具有强氧化性,能起到杀菌消毒的作用,常用于作游泳池消毒剂,氧化铁是红棕色粉末,常用作油漆红色颜料,故C正确;
D.除去粗盐水中的硫酸根离子需进入过量的氯化钡溶液,除去过量的钡离子应加入碳酸钠溶液,所以除去粗盐中的杂质离子得到精盐时,碳酸钠溶液应在氯化钡溶液之后加入,故D错误;
故选D。
8.D
【详解】A.不能使指示剂褪色,能使石蕊试液变红而不是褪色,选项A错误;
B.当与按物质的量之比为1∶1作用于潮湿的有色物质时,发生反应:,失去了漂白性,选项B错误;
C.活性炭使有色物质褪色是利用了活性炭的吸附性,选项C错误;
D.由于与品红化合后生成的无色物质不稳定,受热时又分解生成了品红,故溶液又重新变为红色,选项D正确。
答案选D。
【点睛】常见的漂白原理有三种类型:氧化型、化合型、吸附型,考生常因不清楚漂白剂的具体性质,不能将物质褪色的原因与漂白原理建立正确的关系而出错。另外,对于使物质褪色,还需注意:①使品红溶液褪色,表现了的漂白性,但不能漂白酸碱指示剂。②并非所有与,反应的物质褪色都体现了的漂白性,如能使滴有酚酞的溶液褪色体现了是酸性氧化物的性质;能使溴水和酸性溶液褪色体现了的还原性。
9.A
【详解】该气体无色,排除了Cl2、NO2气体。该气体能使品红溶液褪色,则一定含有SO2气体。将剩余气体排放到空气中,气体迅速变为红棕色,判断一定含有NO气体,故一定无O2,所以选A。
10.A
【详解】氯水与KBr反应生成KCl和溴单质,溴更易溶于四氯化碳,且四氯化碳的密度比水的密度大,四氯化碳与水会分层,则振荡静置后可观察到的现象是溶液分两层、下层呈红棕色,A项正确;
答案选A。
11.D
【详解】A.向含有酚酞的稀氢氧化钠溶液中滴加稀盐酸,溶液由红色变为无色,说明盐酸和氢氧化钠反应了,故A错误;
B.用洁净铂丝蘸取某溶液,在酒精灯外焰上灼烧,火焰呈黄色,溶液中一定存在,可能存在,故B错误;
C.将红色鲜花放入盛有干燥氯气的集气瓶中,盖上玻璃片,鲜花红色褪去,是因为氯气和鲜花中的水反应生成HClO,HClO漂白鲜花,不能说氯气有漂白性,故C错误;
D.在溶液中加入溴水,溶液由无色变为棕褐色,说明生成了单质碘,即说明的氧化性比的强,故D正确。
综上所述,答案为D。
12.B
【详解】试题分析:A、D选项,只能通过分层检验出汽油。B选项中,溴水与AgNO 3 作用,生成淡黄色的AgBr沉淀;与NaOH溶液反应,生成无色的溴化钠、次溴酸钠和水,会观察到溴水褪色;与KI反应,置换出I 2 ,溶液颜色加深,所以B选项可以鉴别。C选项只能鉴别出NaI。 答案:B
考点:溶液的鉴别
13.B
【详解】A.Cl2、漂白粉具有强氧化性,能将有色物质氧化,从而使其褪色,SO2与某些有色物质结合生成无色化合物,发生非氧化还原反应,其漂白原理不同,A正确;
B.除去粗盐中含有的Ca2+、Mg2+、离子时,BaCl2溶液一定要放在Na2CO3的前面,否则无法除去过量的Ba2+,B不正确;
C.电解从海水中提取的NaCl、KCl、MgCl2等熔融盐,可冶炼钠、钾、镁等金属,C正确;
D.步骤①中获得的Br2浓度很小,提取出来比较困难,步骤②中将获得的Br2还原为Br-,可控制溶液浓度,最终获得浓度较大的Br2,从而实现Br2的富集,D正确;
故选B。
14. 2KClO3+H2C2O4+2H2SO4 2ClO2↑+2CO2↑+2KHSO4+2H2O 2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O
【分析】(1)氯酸钾与浓盐酸反应生成氯化钾、水和氯气,反应中只有Cl元素化合价发生变化,当有3mol Cl2生成时,转移5mol电子,据此分析解答;
(2)依据题意可知:KClO3和草酸(H2C2O4)在酸性条件下反应生成ClO2、CO2和KHSO4,据此书写反应的化学方程式;
(3)工业上用氯气与石灰乳反应制备漂白粉。
【详解】(1)氯酸钾与浓盐酸反应生成氯化钾、水和氯气,反应的化学方程式:KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O,反应中只有Cl元素化合价发生变化,当有3mol Cl2生成时,转移5mol电子,则电子转移的方向和数目用双线桥表示为,故答案为:;
(2)依据题意可知:KClO3和草酸(H2C2O4)在酸性条件下反应生成ClO2、CO2和KHSO4,发生氧化还原反应,反应的化学方程式:2KClO3+H2C2O4+2H2SO4 2ClO2↑+2CO2↑+2KHSO4+2H2O,故答案为:2KClO3+H2C2O4+2H2SO4 2ClO2↑+2CO2↑+2KHSO4+2H2O;
(3)工业上氯气与石灰乳制备漂白粉,反应生成氯化钙、次氯酸钙和水,反应的化学方程式:2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O,故答案为:2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O。
15. 2Cl2 + 2 Ca(OH)2 == Ca(ClO)2 + CaCl2 + 2H2O Ca(ClO)2 Ca(ClO)2 + CO2 + H2O =CaCO3↓+ 2 HClO 淡黄色 2Na2O2 + 2 H2O = 4NaOH + O2↑ 2Na2O2 + 2 CO2 =2Na2CO3 + O2 呼吸面具 潜水艇 1 1 0.01
【分析】(1)根据氯气与Ca(OH)2反应生成CaCl2、Ca(ClO)2和水书写;
(2)漂白粉主要成分为氯化钙和次氯酸钙,有效成分为次氯酸钙 ;
(3)次氯酸酸性比碳酸弱,Ca(ClO)2与空气中的CO2反应生成HClO和CaCO3;
(4)过氧化钠是淡黄色的固体,它与水反应生成氢氧化钠和氧气,与二氧化碳反应生成碳酸钠和氧气,以此常用作呼吸面具和潜水艇中氧气来源。
(5)根据c=n/v计算浓度;根据稀释前后溶质的量不变计算稀释后浓度。
【详解】(1)氯气通入石灰乳[Ca(OH)2 ]制取漂白粉,反应生成CaCl 2 、Ca(ClO)2 、H 2 O,该反应为2Ca(OH)2 +2Cl 2 ═CaCl 2 +Ca(ClO)2 +2H2O;
答案:2Ca(OH)2+2Cl 2 ═CaCl 2 +Ca(ClO)2 +2H2O
(2)漂白粉主要成分为氯化钙和次氯酸钙,有效成分为次氯酸钙,化学式为Ca(ClO)2 ;
答案:Ca(ClO)2
(3)次氯酸酸性比碳酸弱,Ca(ClO)2 与空气中的CO2反应生成HClO和CaCO3沉淀,
反应的方程式为Ca(ClO)2 +CO2+H2O=CaCO3↓+2HClO;
答案:Ca(ClO)2 +CO2+H2O=CaCO3↓+2HClO
(4)过氧化钠是淡黄色的固体,它与水反应生成氢氧化钠和氧气,方程式为2Na2O2 + 2 H2O = 4NaOH + O2↑,与二氧化碳反应生成碳酸钠和氧气,方程式为2Na2O2 + 2 CO2 =2Na2CO3 + O2,因此常用作呼吸面具和潜水艇中氧气来源。
答案:淡黄色 2Na2O2 + 2H2O = 4NaOH + O2↑ 2Na2O2 + 2CO2 =2Na2CO3 + O2 呼吸面具潜水艇
(5)根据c=n/V==1mol/L;从中取出1mL,浓度不变仍为1mol/L;若将这1mL溶液用水稀释到100mL,因为稀释前后溶质的量不变相当于浓度变为原来的1/100,所得溶液中溶质的物质的量浓度为0.01mol/L;
答案:1 1 0.01
16.(1)4+16NaOH+7O28Na2CrO4+2Fe2O3+8H2O
(2)由于Na2Cr2O7具有强氧化性,能够将浓盐酸氧化为Cl2,Cl2有毒而污染环境
(3)加入一定量的KCl,至析出大量的晶体,40℃以上趁热过滤,洗涤完全
(4)91.875%
【分析】本题是工业上利用铬铁矿()来制备K2Cr2O7的工业流程题,步骤1为高温氧化时,同时有生成,即铬铁矿()与固体NaOH混合在空气中高温氧化制得和H2O,故该反应的化学方程式:4+16NaOH+7O28Na2CrO4+2Fe2O3+8H2O,步骤2为酸化Na2CrO4溶液制得Na2Cr2O7,反应原理为:2Na2CrO4+2HCl=Na2Cr2O7+2NaCl+H2O,步骤3为将“溶液”加热浓缩,加入一定量的KCl,至析出大量的晶体,40℃以上趁热过滤,洗涤完全,低温干燥,得晶体,(4)根据得失电子总数相等即可求解,据此分析解题。
(1)
步骤1中高温氧化时,同时有Fe2O3生成,即铬铁矿(FeO Cr2O3)与固体NaOH混合在空气中高温氧化制得Na2CrO4和H2O,故该反应的化学方程式为4+16NaOH+7O28Na2CrO4+2Fe2O3+8H2O;
(2)
由于Na2Cr2O7具有强氧化性,能够将浓盐酸氧化为Cl2,Cl2有毒而污染环境,反应原理为:Na2Cr2O7+16HCl=2NaCl+2CrCl3+3Cl2↑+7H2O,故步骤2中酸化时盐酸不宜过量太多,故答案为:由于Na2Cr2O7具有强氧化性,能够将浓盐酸氧化为Cl2,Cl2有毒而污染环境;
(3)
由溶解度曲线图可知,在40℃以上K2Cr2O7的溶解度比KCl、NaCl的大,比Na2Cr2O7的小,故步骤3中制备晶体的实验方案是:将“溶液”加热浓缩,加入一定量的KCl,至析出大量的晶体,40℃以上趁热过滤,洗涤完全,低温干燥,得晶体。(部分物质的溶解度曲线如图所示:晶体需“洗涤完全”),故答案为:加入一定量的KCl,至析出大量的晶体,40℃以上趁热过滤,洗涤完全;
(4)
根据得失电子总数相等,可找到关系式为:K2Cr2O7~3I2~6Na2S2O3,故有:n(K2Cr2O7)=n()=×0.5000mol/L×30.00×10-3L=2.5×10-3mol,则250mL溶液中含有的K2Cr2O7的物质的量为:2.5×10-3mol×=2.5×10-2mol,故样品中的质量分数为:=91.875%。
17. Cu+2Fe3+=2Fe2++Cu2+ 部分(SCN)2与水反应生成酸 Cu2+与SCN-产生白色CuSCN的同时生成(SCN)2,Fe2+被(SCN)2氧化为Fe3+,Fe3++3SCN-Fe(SCN)3,所以溶液变红 (SCN)x 混合气体中有大量的NO2使溶液呈酸性,开始产生的白色BaCO3沉淀溶解 向洗净的白色沉淀中加入过量的稀硝酸,沉淀完全溶解,再滴加少量KMnO4溶液,不褪色 CO2、SO
【分析】I.Fe2(SO4)3溶液因含Fe3+呈黄色,加入铜粉后发生Cu+2Fe3+= 2Fe2++Cu2+,溶液逐渐变为蓝色;取少量i中清液于试管中,滴加2滴0.2mol/LKSCN溶液,发生了2Cu2++4SCN-=2CuSCN↓(白色)+(SCN)2(黄色),(SCN)2将亚铁离子氧化为铁离子,发生Fe3++3SCN-Fe(SCN)3,所以溶液变红,振荡后SCN-和Cu2+充分接触,又发生2Cu2++4SCN-=2CuSCN↓(白色)+(SCN)2(黄色),产生白色沉淀,同时由于SCN-被消耗,Fe3++3SCN-Fe(SCN)3逆向移动,红色消失;
由实验2可知发生了铜离子和硫氰酸根离子发生了2Cu2++4SCN-=2CuSCN↓(白色)+(SCN)2(黄色),(SCN)2溶于水导致上层溶液呈黄色;
通过实验3,验证了实验1中的ii的结论;
II.浓硝酸有强氧化性,浓硝酸中加入KSCN后,SCN-被浓硝酸氧化为(SCN)2,(SCN)2聚合为红色的(SCN)x,溶液迅速变红;静置一段时间后剧烈反应,红色迅速褪去可能是浓硝酸氧化了(SCN)x所致。
【详解】(1)加入Cu粉后溶液逐渐变蓝,说明生成了铜盐,因此发生Cu+2Fe3+= 2Fe2++Cu2+;
(2)根据实验2的现象,开始时溶液呈绿色,一段时间后开始出现白色沉淀,上层溶液变为黄色,说明发生了2Cu2++4SCN-=2CuSCN↓(白色)+(SCN)2(黄色),(SCN)2性质与卤素单质相似,部分(SCN)2与水反应生成酸,溶液pH值减小;
(3)由分析可知Cu2+与SCN-产生白色CuSCN的同时生成(SCN)2,Fe2+被(SCN)2氧化为Fe3+,Fe3++3SCN-Fe(SCN)3,所以溶液变红;
(4)由分析可知浓硝酸中滴加KSCN溶液,溶液立即变红是因为SCN-被氧化为黄色的(SCN)2,(SCN)2聚合为红色的(SCN)x;
(5)实验一中产生红棕色气体,因此混合气体中有大量的NO2使溶液呈酸性,开始产生的白色BaCO3沉淀溶解;
(6)二氧化硫与亚硫酸根均为较强还原性,向洗净的白色沉淀中加入过量的稀硝酸,沉淀完全溶解,再滴加少量KMnO4溶液,不褪色,说明白色沉淀中不含有还原性的,可作为红棕色气体中不含SO2的证据;结合以上分析,a中产生的白色沉淀为碳酸钡,则SCN-被氧化后产物中含二氧化碳,由b可知SCN-被氧化后产物中不含二氧化硫,由c可知SCN-被氧化后产物中含硫酸根离子,综上所述:SCN-在被氧化的最终产物中一定有CO2、SO
同课章节目录
