黑龙江省哈尔滨市宾县第二中学2023-2024学年高二上学期第三次月考化学试题(含答案)
文档属性
| 名称 | 黑龙江省哈尔滨市宾县第二中学2023-2024学年高二上学期第三次月考化学试题(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 549.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-18 08:07:27 | ||
图片预览

文档简介
宾县二中2023-2024学年度上学期第三次考试
高二化学试卷
考试时间:75分钟 总分:100分
注意事项:
1.答题前填写好自己的姓名、班级、考号等信息
2.请将答案正确填写在答题卡上
可能用到的相对原子质量:
H:1 C:12 N:14 O:16 Na:23 Mg:24 Cl:35.5 K:39 Fe:56 Cu:64
一、(每题只有一个正确选项,每题3分,共45分)
1.燃料电池能量转化效率高、环境污染少,运行质量高。下列物质均可用作燃料电池的燃料,其中能实现碳中和目标的是
A.甲醇 B.天然气 C.氢气 D.一氧化碳
2.下列现象与电子的跃迁没有直接关联的是
A.林间的丁达尔效应 B.碱金属的焰色试验
C.闪烁的荧光棒 D.夜景LED灯光秀
3.某元素基态原子的价电子排布式为,该元素在周期表中的位置是
A.第三周期第ⅡB族,d区 B.第四周期第ⅡB族,ds区
C.第三周期第ⅦA族,d区 D.第四周期第ⅤB族,d区
4.下列原子外围电子层的电子排布图正确的是
A.
B.
C.
D.
5.四种元素基态原子的电子排布式如下:
①1s22s22p63s23p4 ②1s22s22p63s23p3 ③1s22s22p5 ④1s22s22p3
则下列有关比较中正确的是
A.第一电离能:④>③>②>① B.电负性:③>④>①>②
C.简单离子半径:②>①>③>④ D.最高正化合价:③>④=②>①
6.化学与生活密切相关。下列说法错误的是
A.絮凝剂有助于去除生活废水中的悬浮物,,均可作为絮凝剂
B.可以通过勒夏特列原理解释夏天打开啤酒盖,喷出大量泡沫的现象
C.食品放入冰箱中,因为温度低,变质速率低所以食品能够保存较长时间
D.需要加热才能进行的化学反应不一定是吸热反应
7.下列有关工业生产的叙述正确的是
A.钢管被原油中的含硫化合物腐蚀是电化学腐蚀
B.粗锌与稀硫酸反应制氢气比纯锌快,是因为粗锌比纯锌还原性强
C.铁板镀锡属于电化学防护
D.生铁浸泡在食盐水中发生吸氧腐蚀
8.下列说法正确的是
A.用电解法精炼铜时,若电路中转移2mol电子,阳极质量减轻64g
B.常温下,1L0.5mol L-1的FeCl3溶液中,含有Fe3+数目为0.5NA
C.向1L1mol L-1的NH4Cl溶液中加氨水至中性,此时溶液含数目为NA
D.工业上电解氯化铝的熔融态获得金属铝
9.短周期常见元素X、Y、W、Z原子半径及主要化合价如图所示,下列叙述正确的是
A.最高价氧化物的水化物的碱性X小于Y
B.简单氢化物的热稳定性以及沸点均为W大于Z
C.常温下,Y的单质能溶于Z最高价氧化物的水化物的浓溶液
D.与Y同周期且第一电离能小于Y的元素有两种
10.一种用作锂离子电池电解液的锂盐结构如图所示,X、Y、Z、W为原子序数依次增大的短周期主族元素,W的最外层电子数等于其内层电子数之和的一半。下列说法正确的是
A.简单离子半径: B.X的含氧酸盐水溶液均显碱性
C.简单氢化物的沸点: D.X、Y、Z、W均为8电子稳定结构
11.部分弱电解质的电离常数如下表:
弱电解质
电离常数()
下列说法错误的是
A.根据电离常数,可判断酸性
B.中和等体积、等的和消耗的量前者小于后者
C.
D.时,反应的化学平衡常数为
12.如图所示的各容器中盛有海水,铁在其中被腐蚀速率由大到小的顺序为
A.④②①③ B.③①②④ C.①③④② D.①④②③
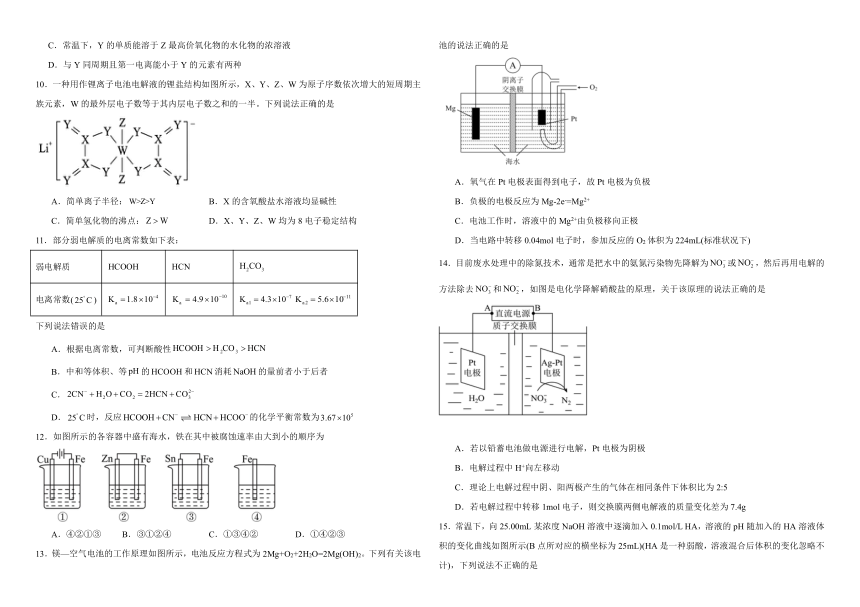
13.镁—空气电池的工作原理如图所示,电池反应方程式为2Mg+O2+2H2O=2Mg(OH)2。下列有关该电池的说法正确的是
A.氧气在Pt电极表面得到电子,故Pt电极为负极
B.负极的电极反应为Mg-2e-=Mg2+
C.电池工作时,溶液中的Mg2+由负极移向正极
D.当电路中转移0.04mol电子时,参加反应的O2体积为224mL(标准状况下)
14.目前废水处理中的除氮技术,通常是把水中的氨氮污染物先降解为或,然后再用电解的方法除去和,如图是电化学降解硝酸盐的原理,关于该原理的说法正确的是
A.若以铅蓄电池做电源进行电解,Pt电极为阴极
B.电解过程中H+向左移动
C.理论上电解过程中阴、阳两极产生的气体在相同条件下体积比为2:5
D.若电解过程中转移1mol电子,则交换膜两侧电解液的质量变化差为7.4g
15.常温下,向25.00mL某浓度NaOH溶液中逐滴加入0.1mol/L HA,溶液的pH随加入的HA溶液体积的变化曲线如图所示(B点所对应的横坐标为25mL)(HA是一种弱酸,溶液混合后体积的变化忽略不计),下列说法不正确的是
A.NaOH溶液浓度为0.1mol/L
B.溶液中存在:c(H+)+c(Na+) =c(OH-)+c(A-)
C.从A到C,都存在:c(A-)>c(OH-)
D.在D点:溶质主要是NaA和HA
二、非选择题:(共55分)
16.如图是s轨道和p轨道的原子轨道图,试回答问题:
(1)s电子的原子轨道呈 形,每个s轨道有 个原子轨道;p电子的原子轨道呈 形,每个p轨道有 个原子轨道。
(2)元素X的原子最外层电子排布式为nsnnpn+1,原子中能量最高的是 电子,其电子云在空间有 个伸展方向;元素X的名称是 ,它的氢化物的化学式是 。若元素X的原子最外层电子排布式为nsn 1npn+1,那么X的元素符号应为 ,原子的轨道表示式为 。
17.依据原子结构知识回答下列问题。
(1)基态硅原子的电子排布式是 ;基态硫原子的价电子排布式是 。
(2)基态的铁原子有 个未成对电子,基态的价电子排布图为 。
(3)、、O、F四种元素中第一电离能最小的是 ,电负性最大的是 。
(4)下列有关微粒性质的排列顺序错误的是_______。
A.元素的电负性:PB.元素的第一电离能:CC.离子半径:
D.原子的未成对电子数:
(5)下列基态原子或离子的电子排布式或排布图正确的是 (填序号,下同),违反能量最低原理的是 ;违反洪特规则的是 ;违反泡利原理的是 。
① ② ③
④ ⑤ ⑥
(6)下列硼原子电子排布图表示的状态中,能量最低和最高的分别为 、 (填选项字母)。
A.B.
C. D.
18.电化学技术在处理污染气体领域的应用广泛。
(1)利用反应构成电池的方法,既能实现有效消除氮氧化物的排放,又能提供电能,装置如图所示。
①A电极的电极反应式为 。
②下列关于该电池的说法正确的是 。
A.电子从右侧电极经过负载后流向左侧电极
B.为使电池持续放电,离子交换膜需选用阴离子交换膜
C.电池工作一段时间,溶液的不变
D.当有被处理时,转移电子物质的量为
(2)以含废气为原料,用电化学方法制取硫酸。装置如图。
写出负极电极反应式 。
(3)一种乙醇燃料电池,使用的电解质溶液是2mol·L-1的KOH溶液。请写出负极的电极反式 ;每消耗4.6g乙醇转移的电子数为 。
(4)以Al和NiO(OH)为电极,NaOH溶液为电解液组成一种新型电池,放电时NiO(OH)转化为Ni(OH)2,该电池总反应的离子方程式是 。
19.降低能耗是氯碱工业发展的重要方向。我国利用氯碱厂生产的H2作为电池燃料,再将电池应用于氯碱工业,原理如图,a、b、c、d均为石墨电极。
(1)a极为 (填“正”或“负”)极,c 极为 (填“阴”或“阳”)极。
(2)乙装置中电解饱和NaCl溶液的化学方程式为 ;反应一段时间后,d极产生1mol气体时,乙装置中转移电子 mol。
(3)下列说法正确的是 (填字母序号)。
A.甲装置可实现化学能向电能的转化
B.甲装置中Na+透过阳离子交换膜向a极移动
C.乙装置中c极一侧流出的是浓盐水
(4)实际生产中,阳离子交换膜的损伤会造成OH- 迁移至阳极区,从而在电解池阳极能检测到O2,产生O2的电极反应式为 。
参考答案
1.C 2.A 3.D 4.B 5.B
6.A 7.D 8.C 9.B 10.C
11.C 12.C 13.D 14.C 15.C
16.(1) 球 1 纺锤 3
(2) 2p 3 氮 NH3 S
17.(1)
(2) 4
(3) K F
(4) B
(5) ①⑤ ② ③ ⑥
(6) B D
18.(1) 2NH3-6e-+6OH-=N2+6H2O B
(2) SO2-2e-+2H2O=SO+4H+
(3) 1.2NA
(4) Al+3NiO(OH)+NaOH+H2O=3Ni(OH)2+NaAlO2
19.(1) 负 阳
(2) 2NaCl+2H2O2NaOH+H2↑+Cl2↑ 2
(3) A
(4) 4OH-﹣4e-=O2↑+2H2O
答案第2页,共4页
高二化学试卷
考试时间:75分钟 总分:100分
注意事项:
1.答题前填写好自己的姓名、班级、考号等信息
2.请将答案正确填写在答题卡上
可能用到的相对原子质量:
H:1 C:12 N:14 O:16 Na:23 Mg:24 Cl:35.5 K:39 Fe:56 Cu:64
一、(每题只有一个正确选项,每题3分,共45分)
1.燃料电池能量转化效率高、环境污染少,运行质量高。下列物质均可用作燃料电池的燃料,其中能实现碳中和目标的是
A.甲醇 B.天然气 C.氢气 D.一氧化碳
2.下列现象与电子的跃迁没有直接关联的是
A.林间的丁达尔效应 B.碱金属的焰色试验
C.闪烁的荧光棒 D.夜景LED灯光秀
3.某元素基态原子的价电子排布式为,该元素在周期表中的位置是
A.第三周期第ⅡB族,d区 B.第四周期第ⅡB族,ds区
C.第三周期第ⅦA族,d区 D.第四周期第ⅤB族,d区
4.下列原子外围电子层的电子排布图正确的是
A.
B.
C.
D.
5.四种元素基态原子的电子排布式如下:
①1s22s22p63s23p4 ②1s22s22p63s23p3 ③1s22s22p5 ④1s22s22p3
则下列有关比较中正确的是
A.第一电离能:④>③>②>① B.电负性:③>④>①>②
C.简单离子半径:②>①>③>④ D.最高正化合价:③>④=②>①
6.化学与生活密切相关。下列说法错误的是
A.絮凝剂有助于去除生活废水中的悬浮物,,均可作为絮凝剂
B.可以通过勒夏特列原理解释夏天打开啤酒盖,喷出大量泡沫的现象
C.食品放入冰箱中,因为温度低,变质速率低所以食品能够保存较长时间
D.需要加热才能进行的化学反应不一定是吸热反应
7.下列有关工业生产的叙述正确的是
A.钢管被原油中的含硫化合物腐蚀是电化学腐蚀
B.粗锌与稀硫酸反应制氢气比纯锌快,是因为粗锌比纯锌还原性强
C.铁板镀锡属于电化学防护
D.生铁浸泡在食盐水中发生吸氧腐蚀
8.下列说法正确的是
A.用电解法精炼铜时,若电路中转移2mol电子,阳极质量减轻64g
B.常温下,1L0.5mol L-1的FeCl3溶液中,含有Fe3+数目为0.5NA
C.向1L1mol L-1的NH4Cl溶液中加氨水至中性,此时溶液含数目为NA
D.工业上电解氯化铝的熔融态获得金属铝
9.短周期常见元素X、Y、W、Z原子半径及主要化合价如图所示,下列叙述正确的是
A.最高价氧化物的水化物的碱性X小于Y
B.简单氢化物的热稳定性以及沸点均为W大于Z
C.常温下,Y的单质能溶于Z最高价氧化物的水化物的浓溶液
D.与Y同周期且第一电离能小于Y的元素有两种
10.一种用作锂离子电池电解液的锂盐结构如图所示,X、Y、Z、W为原子序数依次增大的短周期主族元素,W的最外层电子数等于其内层电子数之和的一半。下列说法正确的是
A.简单离子半径: B.X的含氧酸盐水溶液均显碱性
C.简单氢化物的沸点: D.X、Y、Z、W均为8电子稳定结构
11.部分弱电解质的电离常数如下表:
弱电解质
电离常数()
下列说法错误的是
A.根据电离常数,可判断酸性
B.中和等体积、等的和消耗的量前者小于后者
C.
D.时,反应的化学平衡常数为
12.如图所示的各容器中盛有海水,铁在其中被腐蚀速率由大到小的顺序为
A.④②①③ B.③①②④ C.①③④② D.①④②③
13.镁—空气电池的工作原理如图所示,电池反应方程式为2Mg+O2+2H2O=2Mg(OH)2。下列有关该电池的说法正确的是
A.氧气在Pt电极表面得到电子,故Pt电极为负极
B.负极的电极反应为Mg-2e-=Mg2+
C.电池工作时,溶液中的Mg2+由负极移向正极
D.当电路中转移0.04mol电子时,参加反应的O2体积为224mL(标准状况下)
14.目前废水处理中的除氮技术,通常是把水中的氨氮污染物先降解为或,然后再用电解的方法除去和,如图是电化学降解硝酸盐的原理,关于该原理的说法正确的是
A.若以铅蓄电池做电源进行电解,Pt电极为阴极
B.电解过程中H+向左移动
C.理论上电解过程中阴、阳两极产生的气体在相同条件下体积比为2:5
D.若电解过程中转移1mol电子,则交换膜两侧电解液的质量变化差为7.4g
15.常温下,向25.00mL某浓度NaOH溶液中逐滴加入0.1mol/L HA,溶液的pH随加入的HA溶液体积的变化曲线如图所示(B点所对应的横坐标为25mL)(HA是一种弱酸,溶液混合后体积的变化忽略不计),下列说法不正确的是
A.NaOH溶液浓度为0.1mol/L
B.溶液中存在:c(H+)+c(Na+) =c(OH-)+c(A-)
C.从A到C,都存在:c(A-)>c(OH-)
D.在D点:溶质主要是NaA和HA
二、非选择题:(共55分)
16.如图是s轨道和p轨道的原子轨道图,试回答问题:
(1)s电子的原子轨道呈 形,每个s轨道有 个原子轨道;p电子的原子轨道呈 形,每个p轨道有 个原子轨道。
(2)元素X的原子最外层电子排布式为nsnnpn+1,原子中能量最高的是 电子,其电子云在空间有 个伸展方向;元素X的名称是 ,它的氢化物的化学式是 。若元素X的原子最外层电子排布式为nsn 1npn+1,那么X的元素符号应为 ,原子的轨道表示式为 。
17.依据原子结构知识回答下列问题。
(1)基态硅原子的电子排布式是 ;基态硫原子的价电子排布式是 。
(2)基态的铁原子有 个未成对电子,基态的价电子排布图为 。
(3)、、O、F四种元素中第一电离能最小的是 ,电负性最大的是 。
(4)下列有关微粒性质的排列顺序错误的是_______。
A.元素的电负性:P
D.原子的未成对电子数:
(5)下列基态原子或离子的电子排布式或排布图正确的是 (填序号,下同),违反能量最低原理的是 ;违反洪特规则的是 ;违反泡利原理的是 。
① ② ③
④ ⑤ ⑥
(6)下列硼原子电子排布图表示的状态中,能量最低和最高的分别为 、 (填选项字母)。
A.B.
C. D.
18.电化学技术在处理污染气体领域的应用广泛。
(1)利用反应构成电池的方法,既能实现有效消除氮氧化物的排放,又能提供电能,装置如图所示。
①A电极的电极反应式为 。
②下列关于该电池的说法正确的是 。
A.电子从右侧电极经过负载后流向左侧电极
B.为使电池持续放电,离子交换膜需选用阴离子交换膜
C.电池工作一段时间,溶液的不变
D.当有被处理时,转移电子物质的量为
(2)以含废气为原料,用电化学方法制取硫酸。装置如图。
写出负极电极反应式 。
(3)一种乙醇燃料电池,使用的电解质溶液是2mol·L-1的KOH溶液。请写出负极的电极反式 ;每消耗4.6g乙醇转移的电子数为 。
(4)以Al和NiO(OH)为电极,NaOH溶液为电解液组成一种新型电池,放电时NiO(OH)转化为Ni(OH)2,该电池总反应的离子方程式是 。
19.降低能耗是氯碱工业发展的重要方向。我国利用氯碱厂生产的H2作为电池燃料,再将电池应用于氯碱工业,原理如图,a、b、c、d均为石墨电极。
(1)a极为 (填“正”或“负”)极,c 极为 (填“阴”或“阳”)极。
(2)乙装置中电解饱和NaCl溶液的化学方程式为 ;反应一段时间后,d极产生1mol气体时,乙装置中转移电子 mol。
(3)下列说法正确的是 (填字母序号)。
A.甲装置可实现化学能向电能的转化
B.甲装置中Na+透过阳离子交换膜向a极移动
C.乙装置中c极一侧流出的是浓盐水
(4)实际生产中,阳离子交换膜的损伤会造成OH- 迁移至阳极区,从而在电解池阳极能检测到O2,产生O2的电极反应式为 。
参考答案
1.C 2.A 3.D 4.B 5.B
6.A 7.D 8.C 9.B 10.C
11.C 12.C 13.D 14.C 15.C
16.(1) 球 1 纺锤 3
(2) 2p 3 氮 NH3 S
17.(1)
(2) 4
(3) K F
(4) B
(5) ①⑤ ② ③ ⑥
(6) B D
18.(1) 2NH3-6e-+6OH-=N2+6H2O B
(2) SO2-2e-+2H2O=SO+4H+
(3) 1.2NA
(4) Al+3NiO(OH)+NaOH+H2O=3Ni(OH)2+NaAlO2
19.(1) 负 阳
(2) 2NaCl+2H2O2NaOH+H2↑+Cl2↑ 2
(3) A
(4) 4OH-﹣4e-=O2↑+2H2O
答案第2页,共4页
同课章节目录
