第四章《物质结构元素周期律》检测题(含解析)—2023---2024学年上学期高一化学人教版(2019)必修第一册
文档属性
| 名称 | 第四章《物质结构元素周期律》检测题(含解析)—2023---2024学年上学期高一化学人教版(2019)必修第一册 |

|
|
| 格式 | docx | ||
| 文件大小 | 655.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-18 08:51:04 | ||
图片预览



文档简介
第四章《物质结构 元素周期律》检测题
一、单选题(共13题)
1.下列实验方案的设计能达到相应实验目的的是( )
选项 实验目的 实验方案
A 验证的氧化性强于 向溶液中通入少量
B 比较HF与的酸性强弱 常温下,用pH试纸分别测定浓度均为的溶液和溶液的pH
C 验证与KI的反应是可逆反应 向溶液中滴加溶液,充分反应后,取少许混合液滴加KSCN溶液
D 比较Fe与Cu的金属活动性 常温下,将Fe、Cu与浓硝酸组成原电池
A.A B.B C.C D.D
2.臭氧化钾()常用作氧气源。利用干燥的固体氢氧化钾与臭氧反应制取臭氧化钾,以及作氧气源产生氧气的有关反应如下:
下列说法错误的是
A.和属于同素异形体
B.KOHI和都是纯净物
C.是一种碳酸盐,可与碱反应
D.与水生成KOH,说明是碱性氧化物
3.下列说法不正确的是( )
A.“溴”被称为“海洋元素”
B.氯离子的结构示意图:
C.1H、35C1、37C1表示3种核素
D.汤姆生根据a粒子散射现象提出了“葡萄干面包式”的原子结构模型
4.W、X、Y、Z四种短周期元素在元素周期表中的相对位置如图所示,且四种元素的最外层电子数之和为24。下列说法错误的是
W X
Y Z
A.W元素的简单氢化物可用作制冷剂
B.单核阴离子的还原性Y强于X
C.Y元素最高正价和最低负价的代数和为4
D.Z分别与钠、镁、铝元素形成的化合物都属于离子化合物
5.科学家用钙离子撞击锎(Cf)靶,产生了一种超重元素—Og,其反应可表示为:Cf+Ca→Og+3n,下列说法正确的是
A.Cf原子核内有98个质子,249个中子
B.Ca与Ca互为同素异形体
C.Og是一种性质活泼的非金属元素
D.根据元素周期律推测Ca(OH)2的碱性比Mg(OH)2强
6.科学研究人员在金星大气中探测到了只属于的光谱特征,据此推断金星大气层或存在生命。已知与足量的溶液发生反应可制备。已知分子呈正四面体型( ),代表阿伏加德罗常数。下列说法不正确的是
A.1mol中含6mol非极性键
B.每产生标准状况下22.4L时,该反应转移的电子数为
C.为酸式盐
D.通过X射线衍射法可测定的分子结构
7.下列化学用语表示正确的是
A.乙醇的结构简式:CH3OCH3
B.氢分子的电子式:H:H
C.氧原子的结构示意图:
D.硝酸钾的电离方程式: KNO3= K++ N3+ 3O2-
8.原子核的人工转变是利用粒子(即氦核)撞击原子核,使原子核转变为另一种原子核的过程。1919年,卢瑟福利用粒子轰击短周期非金属原子,发现了质子,使人类对原子核的认识更进一步,其核反应原理为,其中元素X的最高价氧化物对应的水化物能与其气态氢化物反应生成盐,下列说法正确的是
A.X、Y均可形成既含极性键又含非极性键的化合物
B.的中子数为8
C.原子半径:XD.X的简单气态氢化物的热稳定性比Y的强
9.已知几种短周期元素的原子半径、常见的最高价和最低价如下表,下列说法中不正确的是
元素性质 元素编号
① ② ③ ④ ⑤ ⑥ ⑦
原子半径(nm) 0.073 0.075 0.037 0.110 0.099 0.186 0.143
最高正化合价 无 +5 +1 +5 +7 +1 +3
最低负化合价 -2 -3 -1 -3 -1 无 无
A.⑦的简单离子是同周期元素离子半径最小的
B.②的气态氢化物浓溶液可用于检验氯气管道的泄漏
C.气态氢化物的稳定性①﹤②
D.最高价氧化物的水化物的酸性④﹤⑤
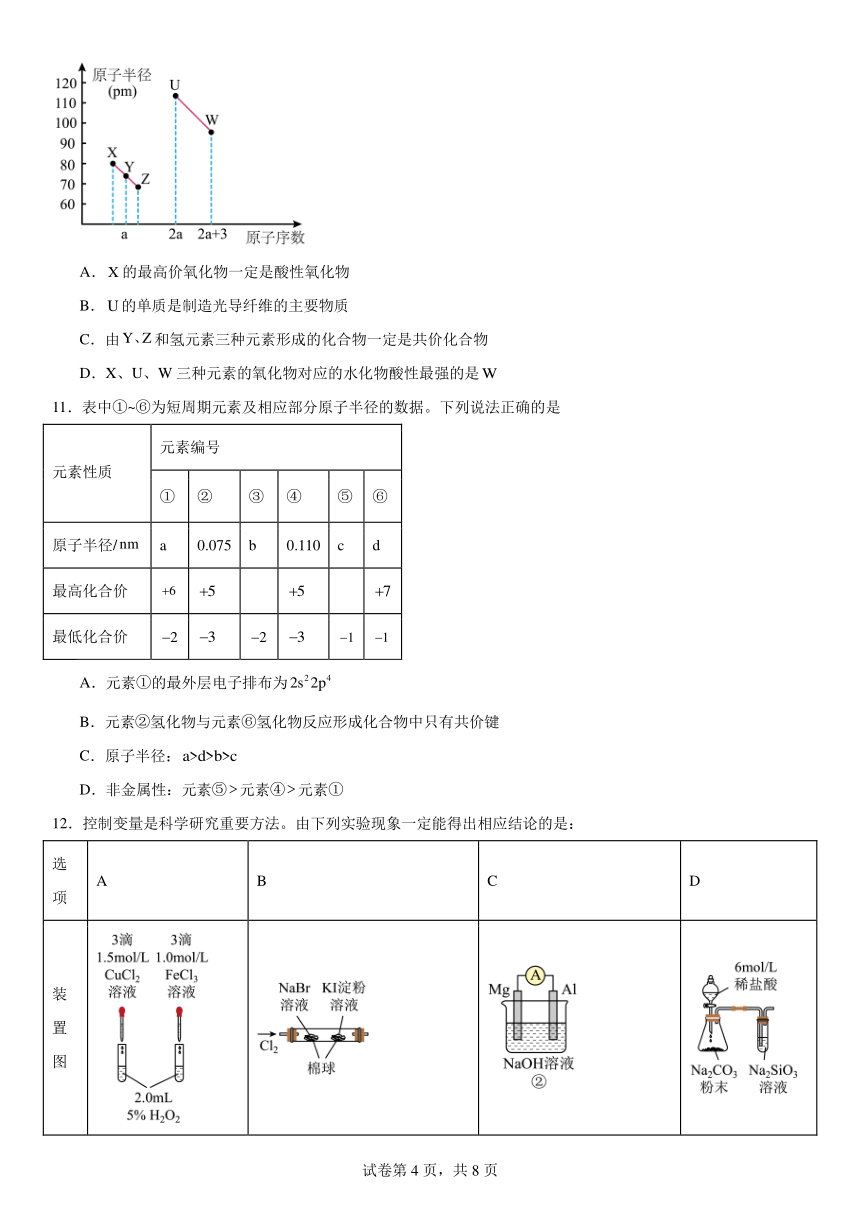
10.X、Y、Z、U、W五种短周期非金属元素,它们的原子半径与原子序数有如图关系,的最高正价与最低负价的代数和为2,下列说法正确的是( )
A.的最高价氧化物一定是酸性氧化物
B.的单质是制造光导纤维的主要物质
C.由和氢元素三种元素形成的化合物一定是共价化合物
D.X、U、W三种元素的氧化物对应的水化物酸性最强的是
11.表中①~⑥为短周期元素及相应部分原子半径的数据。下列说法正确的是
元素性质 元素编号
① ② ③ ④ ⑤ ⑥
原子半径/ a 0.075 b 0.110 c d
最高化合价
最低化合价
A.元素①的最外层电子排布为
B.元素②氢化物与元素⑥氢化物反应形成化合物中只有共价键
C.原子半径:
D.非金属性:元素⑤元素④元素①
12.控制变量是科学研究重要方法。由下列实验现象一定能得出相应结论的是:
选项 A B C D
装 置 图
现 象 右边试管产生气泡较快 左边棉球变棕黄色,右边棉球变蓝色 镁电极上有气泡冒出,铝极溶解 试管中液体变浑浊
结论 催化活性:Fe3+>Cu2+ 氧化性:Br2>I2 金属性:Al>Mg 非金属性:C>Si
A.A B.B C.C D.D
二、填空题(共8题)
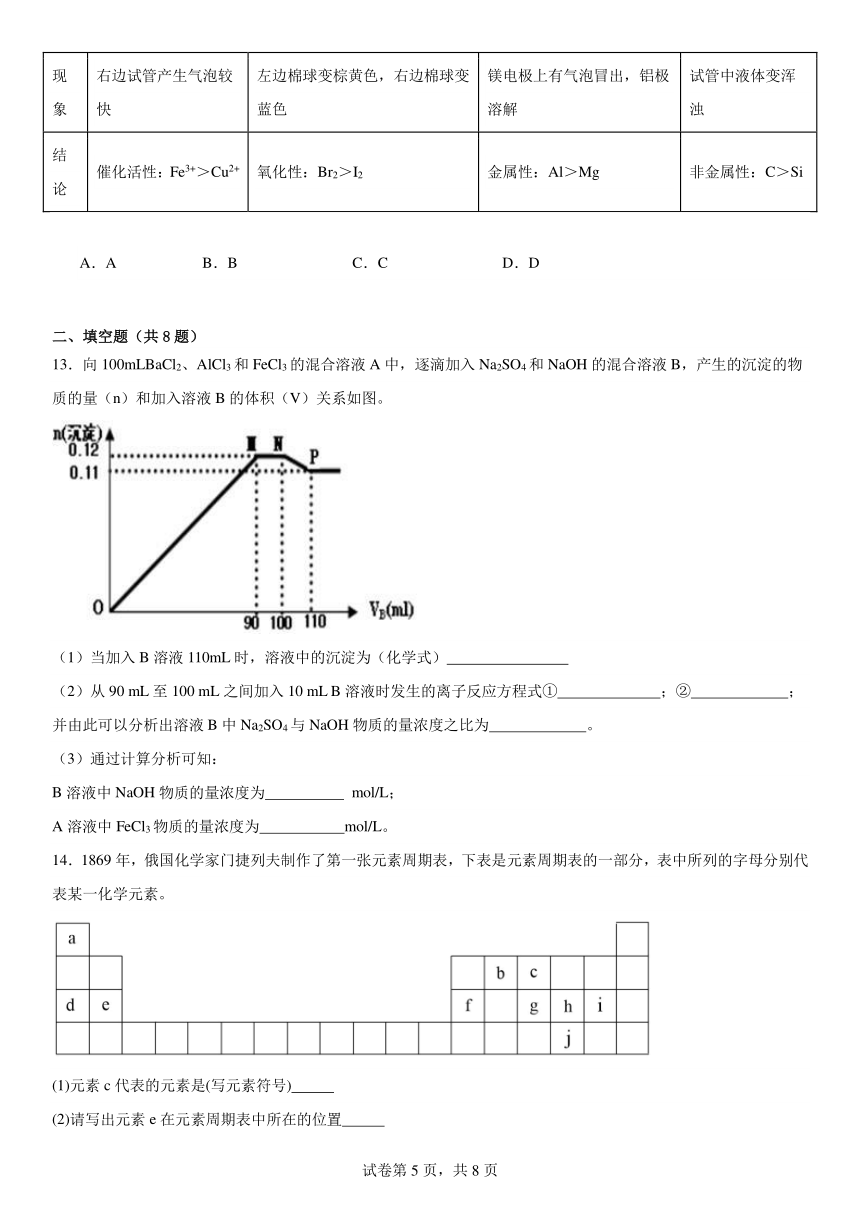
13.向100mLBaCl2、AlCl3和FeCl3的混合溶液A中,逐滴加入Na2SO4和NaOH的混合溶液B,产生的沉淀的物质的量(n)和加入溶液B的体积(V)关系如图。
(1)当加入B溶液110mL时,溶液中的沉淀为(化学式)
(2)从90 mL至100 mL之间加入10 mL B溶液时发生的离子反应方程式① ;② ;并由此可以分析出溶液B中Na2SO4与NaOH物质的量浓度之比为 。
(3)通过计算分析可知:
B溶液中NaOH物质的量浓度为 mol/L;
A溶液中FeCl3物质的量浓度为 mol/L。
14.1869年,俄国化学家门捷列夫制作了第一张元素周期表,下表是元素周期表的一部分,表中所列的字母分别代表某一化学元素。
(1)元素c代表的元素是(写元素符号)
(2)请写出元素e在元素周期表中所在的位置
(3)请画出元素f的简单离子结构示意图 。请写出单质f与d的最高价氧化物对应水化物的离子反应方程式 。
(4)元素a和b能构成最简单的有机化合物(用结构式表示) 。请写出元素a和b构成的最简单有机化合物与i单质发生的第一步化学反应方程式 。
(5)元素h的最高价氧化物对应的水化物呈 (酸性、中性或碱性);请写出元素h的最高价氧化物对应的水化物与单质b的化学反应方程式 。
15.碘是生命体中的必需元素,请根据如下有关碘及其化合物的性质,回答下列问题:
(1)实验室中制取少量碘可采用如下方法:KI + CuSO4 → A (白色)↓+ K2SO4 + I2。
16.0 g CuSO4与过量KI反应后可得19.1 g 的A,写出A的化学式: 。
工业生产中,可用智利硝石(含有NaIO3)为原料,与NaHSO3溶液反应后生成碘,写出此反应的离子方程式: 。
(2)单质碘与氟气反应可制得IF5,实验表明液态IF5具有一定的导电性,研究人员发现产生这一现象的可能原因在于IF5的自偶电离(如:2H2OH3O++OH-),生成的阳离子为IF4+,则阴离子为 。
(3)将单质碘与铝屑置于管式电炉中,隔绝空气加热至500℃得到棕色片状固体(AlI3),此固体溶于Na2CO3溶液可产生白色沉淀和气体。请写出AlI3和Na2CO3溶液反应的离子方程式: 。
(4)设计以下实验方案判断加碘食盐中碘的存在形式为I-、IO3-,或两者同时存在。请对以下试验方案进行预测和分析。
首先取试样加水溶解,分成三份试样:
①第一份试样加酸酸化,如果加淀粉溶液后试样溶液变蓝,说明试样中同时存在I-和IO3-,该过程反应的离子方程式为 。
②第二份试样酸化后加 溶液,如果加入淀粉溶液后试样溶液变蓝,说明试样中存在I-。
③第三份试样酸化后,如果直接使 试纸变蓝,说明试样存在IO3-离子。
16.下表为元素周期表的一部分,请参照元素①-⑧在表中的位置,用化学用语回答下列问题:
IA 0
1 ① ⅡA ⅢA ⅣA ⅤA ⅥA ⅦA
2 ② ③ ④
3 ⑤ ⑥ ⑦ ⑧
(1)④、⑤、⑥的原子半径由大到小的顺序为 (填元素符号);
②、③、⑦的最高价含氧酸的酸性由强到弱的顺序是 (填化学式)。
(2)①、④、⑤、⑧四种元素中,某些元素间可形成既含离子键又含极性共价键的化合物,写出其中一种化合物的电子式: 。
(3)由表中两种元素的原子按1:1组成的常见液态化合物的稀溶液易被催化分解,可使用的催化剂为(填序号) 。
a.MnO2 b.FeCl3 c.Na2SO3 d.CaCO3
(4)由表中元素形成的物质X、Y、Z、M、N可发生以下反应:
X溶液与Y溶液反应的离子方程式为 。
17.19世纪初,许多新的元素被相继发现,化学家开始关注这些元素在化学性质和物理性质上的相似性和递变性。1869年,俄国化学家门捷列夫编制了一份元素周期表,是化学发展史上的一个里程碑。
(1)下列关于元素周期表的认识,错误的是
A.元素周期表有7个周期 B.前4周期叫短周期
C.元素周期表有18个族 D.第15族也叫第VA族
(2)某一周期第IIA族元素的原子序数为x,则同周期的第IIIA族元素的原子序数不可能是
A.x+1 B.x+8 C.x+11 D.x+25
(3)有人认为位于元素周期表第IA族的氢元素,也可以放在第VIIA族,下列物质能支持这种观点的是
A.HF B.H3O+ C.NaH D.H2O2
18.下图是元素周期表的一部分。
族 周期 ⅠA ⅡA ⅢA ⅣA VA ⅥA ⅦA 0
2 ① ② ③ ④ ⑤
3 ⑥ ⑦ ⑧ ⑨ ⑩
(1)①-⑩元素中最稳定的原子是 (填元素符号);形成的气态氢化物稳定性最强的是 (填氢化物的化学式)。
(2)②的最高价氧化物的电子式为 ;用电子式表示⑤和⑥形成化合物的过程: 。
(3)①和⑦金属性相似,①的最高价氧化物对应的水化物与KOH溶液反应的离子方程式为 。
(4)某同学设计了如下实验证明非金属性③>②>⑧。已知是不溶于水的白色胶状沉淀,易挥发。
该同学打开分液漏斗活塞,观察到A中产生气泡,B中出现白色胶状沉淀即认为非金属性③>②>⑧。请问该同学的结论合理吗 (答“合理”或“不合理”),原因是 。
19.《石雅》云:“青金石色相如天,或复金屑散乱,光辉灿烂,若众星丽于天也”。青金石的化学组成可表示为。回答下列问题:
(1)硅在元素周期表中的位置是 ;铝离子的结构示意图为 。
(2)的电子式为 ,的结构式为 。写出一种由青金石中非金属元素组成的既含有极性键又含有非极性键的物质的分子式 。
(3)青金石所含的短周期元素中,金属性最强的是 ,非金属元素原子半径由大到小的顺序为 。
(4)Be与Al的化学性质相似,则Be与NaOH溶液反应的化学方程式是 。
(5)下列不能说明氯元素的非金属性比硫元素强的是_______(填字母)。
A.氯、硫的最低负价分别为-1、-2
B.硫化氢在300℃时开始分解,HCl在1500℃时开始缓慢分解
C.的酸性比的强
D.向水溶液中通入有淡黄色沉淀生成
20.如表为元素周期表的一部分,请参照元素①~⑩在表中的位置,回答下列问题:
(1)元素⑩在周期表中的位置是 ,⑦的原子结构示意图为 。
(2)④、⑤、⑥的简单离子半径由大到小的顺序为 (用离子符号和“>”表示)。
(3)④⑧⑨的气态氢化物中,最稳定的是 (用化学式表示),最高价氧化物对应水化物中,酸性最强的是 (用化学式表示)。
(4)⑤的最高价氧化物对应的水化物与⑦的最高价氧化物对应的水化物发生反应的离子方程式 。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.C
【详解】A.由于还原性Fe2+>Br-,则向FeBr2溶液中通入少量Cl2,可能只有Fe2+被氧化,不能得出Cl2的氧化性强于Br2,A选项错误;
B.NaClO溶液具有漂白性,不能用pH试纸测定其pH从而判断酸性强弱,B选项错误;
C.向1mL0.1mol·L-1FeCl3溶液中滴加5mL0.1mol·L-1KI溶液,KI过量,若充分反应后加入KSCN溶液变成红色,证明有三价铁离子存在,可说明反应是可逆反应,C选项正确;
D.常温下,将Fe、Cu与浓硝酸组成原电池,Fe和浓硝酸发生钝化现象,Cu与浓硝酸能自发的发生氧化还原反应,所以Cu作负极,Fe做正极,不能判断Fe的金属活动性大于Cu,D选项错误;
答案选C。
2.D
【详解】A.和都是O元素形成的单质,二者互为同素异形体,A项正确;
B.KOHI和都是纯净物,B项正确;
C.是碳酸盐,能和反应生成BaCO3沉淀和KOH,C项正确;
D.碱性氧化物和水反应只生成碱,而与水生成KOH和,故不是碱性氧化物,D项错误;
答案选D。
3.D
【详解】A. 溴元素主要分布在海水中,且在海水中的储量较为丰富,故其被称为“海洋元素”,A说法正确;
B. 氯离子的核电荷数为17,核外有18个电子,其结构示意图为 ,B说法正确;
C. 1H、35C1、37C1是3种不同的原子,故其表示3种核素,C说法正确;
D. 汤姆生在研究阴极射线管实验时发现了电子,在此基础上,他提出了“葡萄干面包式”的原子结构模型,D说法不正确;
综上所述,相关说法不正确的是D,故选D。
4.D
【详解】X、Y、Z、W四种短周期元素,结合位置可知,W、X为第二周期元素,Y、Z为第三周期,设X的最外层电子数为x,则W的最外层电子数为x-1,Y的最外层电子数为x,Z的最外层电子数为x+1,则x+x-1+x+x+1=24,解得x=6,则W为N,X为O,Y为S,Z为Cl。
A.W元素的简单氢化物NH3易液化,可用作制冷剂,选项A正确;
B.同主族从上到下阴离子还原性依次增强,所以S2-的还原性比O2-强,选项B正确;
C.Y元素最高正价+6和最低负价-2的代数和为4,选项C正确;
D.Z分别与钠、镁、铝元素形成的化合物NaCl、MgCl2都属于离子化合物,但AlCl3是共价化合物,选项D错误;
答案选D。
5.D
【详解】A.原子符号左下角为质子数,左上角为质量数,质量数等于质子数与中子数的和,Cf原子核内有98个质子,中子数为249-98=151个,A错误;
B.Ca与Ca质子数相同,中子数不同,二者互为同位素,B错误;
C.Og是第七周期0族元素,不容易失去电子,也不容易获得电子,因此是一种性质不活泼的非金属元素,C错误;
D.Ca、Mg是同一主族元素,由于从上到下原子半径逐渐增大,原子失去电子的能力逐渐增强,因此Ca的金属性比Mg强,元素的金属性越强,其最高价氧化物对应的水化物的碱性就越强,则根据元素周期律推测Ca(OH)2的碱性比Mg(OH)2强,D正确;
故合理选项是D。
6.C
【详解】A.的正四面体结构为 ,1mol中含6mol非极性键,选项A正确;
B.由方程式可知,每产生标准状况下22.4L时,该反应转移的电子数为,选项B正确;
C.过量碱液与不反应,说明是一元酸,则为正盐,选项C错误;
D.通过X射线衍射法可测定分子结构,选项D正确;
答案选C。
7.B
【详解】A.乙醇的结构简式是CH3CH2OH,故A错误;
B.氢分子由两个氢原子共用一对电子形成,故B正确;
C.氧原子最外层只有六个电子,正确的结构示意图为,故C错误;
D.硝酸钾正确的电离方程式: ,故D错误;
答案选B。
8.A
【分析】元素X的最高价氧化物对应水化物与其气态氢化物反应生成盐,X是N元素,依据核聚变的质子守恒和质量数相等,可以推出Y是O元素,据此回答问题。
【详解】A.根据分析,X、Y分别为N、O元素,两种元素可形成N2H4和H2O2,这两种化合物既含极性键又含非极性键,A正确;
B.根据分析,X是N元素,根据质量数守恒,W=17+1-4=14,质子数Z=7,则的中子数为14-7=7,B错误;
C.同周期主族元素从左到右,原子半径逐渐减小,则原子半径:X(N)>Y(O),C错误;
D.同周期主族元素从左到右,非金属性逐渐增强,则非金属性:X(N)故选A。
9.C
【分析】由题意可知①号元素无最高正价,最低化合价为-2价,则①号元素为O;②④号元素的最高正价为+5价,最低正价为-3价,则②④为第VA族元素,又因④的原子半径大于②的原子半径,则②④分别为N、P;③的最高正价为+1价,最低负价位-1价,且原子半径比①号元素O小,则③号元素为H;⑤号元素最高正价为+7价,最低负价为-1,原子半径②<⑤<④,则⑤号为Cl元素;⑥最高正价为+1无最低负价,原子半径最大,则⑥为Na元素;⑦的最高正价为+3价,无最低负价,且原子半径仅次于⑥,则⑦号元素为Al。综上分析有①②③④⑤⑥⑦分别为:O、N、H、P、Cl、Na、Al,结合元素周期律分析可得;
【详解】A.电子层数越多离子半径越大,电子层数相同核电荷数越大离子半径越小,所以为同周期元素离子半径最小的离子,故A不选;
B.②号元素为N元素,其气态氢化物为,可与反应生成产生白烟,故可用②的气态氢化物浓溶液可用于检验氯气管道的泄漏,故B不选;
C.非金属性O>N,所以气态氢化物的稳定性①>②,故选C;
D.非金属性越强,最高价氧化物对应水化物的酸性越强,非金属性P答案选C
10.A
【分析】
X、Y、Z、U、W五种短周期非金属元素,的最高正价与最低负价的代数和为2,则Y为N元素,X半径大于Z,则X为C,Z为O,U的原子序数为N原子的2倍,则U为Si,W的原子序数比U大3,则W为17号元素,为Cl,据此分析解答。
【详解】
由图分析可知元素 X、Y、Z、U、W分别为C、N、O、Si、Cl,
A. X为C元素,C的最高价氧化物为CO2,是酸性氧化物,故A正确;
B.制造光导纤维的主要物质是SiO2,不是Si单质,故B错误;
C.N、O和H元素形成的化合物可以是NH4NO3,由铵根离子和硝酸根离子构成,是离子化合物,故C错误;
D.C、Si、Cl元素的氧化物对应的水化物中,HClO酸性比H2CO3弱,故D错误;
答案选A。
11.C
【解析】为短周期元素,①的最高价为价、最低价为价,则①为S元素;③只有最低价价,则③为O元素;②④的最高价都是价,最低价都是价,结合原子半径大小可知,②为N元素、④为P元素;⑥有最高价价、最低价价,则⑥为元素;⑤只有最低价价,则⑤为F元素;结合元素周期律分析解答。
【详解】A.①为S元素,为第三周期元素,最外层电子排布为,A错误;
B.元素②的氢化物为氨,元素⑥的氢化物为,氨与氯化氢反应生成氯化铵,氯化铵中含有离子键和极性共价键,B错误;
C.电子层数越多,原子半径越大,电子层数相同时,核电荷数越大,原子半径越小,则原子半径大小为,C正确;
D.同周期元素从左到右,非金属性逐渐增强;同主族元素从上到下,非金属性逐渐减弱,非金属性F最强,P最弱,即非金属性:元素⑤元素①元素④,D错误。
故选C。
12.A
【详解】A.氯离子浓度相同时,Fe3+浓度小,但产生气泡的速度快,说明催化活性:Fe3+>Cu2+,A项正确;
B.氯气过量条件下,也能与KI溶液反应,无法判断Br2能否与KI溶液反应,B项错误;
C.Al在强碱性溶液中比Mg更易失电子,铝作负极,Mg作正极,不能得出金属性:Al>Mg的结论,C项错误;
D.盐酸和Na2CO3反应生成CO2,CO2与水形成的碳酸能与Na2SiO3溶液反应生成硅酸,但在反应过程中,HCl有可能随着CO2进入试管中,试管中液体变浑浊也可能是盐酸与Na2SiO3溶液反应的结果,故不能得出非金属性:C>Si的结论,D项错误;
答案选A。
13. BaSO4、Fe(OH)3 Ba2++SO42-="=" BaSO4↓ Al(OH)3+ OH-="=" AlO2-+2H2O 1:1 c(NaOH)=" 1" mol/L c(FeCl3)= 0.1 mol/L
【详解】试题分析:溶液中只有Fe3+被完全沉淀以后,Al3+才开始沉淀.
(1)图中第一段曲线生成的沉淀为BaSO4、Fe(OH)3和Al(OH)3,且加入B溶液90mL时,Fe3+、Al3+恰好沉淀,当加入B溶液110mL时,溶液中的沉淀为BaSO4、Fe(OH)3
(2)图中第二段曲线为平行直线,沉淀总物质的量没有增减,故这段是由Al(OH)3的溶解和BaSO4的继续生成所引起,且溶解的Al(OH)3的物质的量和生成的BaSO4的物质的量相等,据Al(OH)3+OH-=AlO2-+2H2O,Ba2++SO42-=BaSO4↓,故加入的物质:n(NaOH)=n(Na2SO4),Na2SO4与NaOH物质的量浓度之比为1: 1;
(3)图中第三段曲线中,加入B溶液100mL时,Ba2+恰好沉淀完全,这段中Al(OH)3继续溶解,B为110mL时,沉淀中Al(OH)3已完全溶解,溶解了(0.12-0.11)mol=0.01mol,消耗了10mLB溶液,故c(NaOH)==1mol/L,则共加入Na2SO4为0.01mol,故c(Na2SO4)==1mol/L,而整个反应过程共生成BaSO4为0.1L×1mol/L=0.1(mol)故A溶液中c(Ba2+)=1mol/L.图中第四段曲线中,沉淀为Fe(OH)3、BaSO4共0.11mol,BaSO4为0.1mol,则Fe(OH)3为(0.11-0.1)mol=0.01mol,A中c(Fe3+)=0.1mol/L。
考点:本题考查铝的性质化学图象分析。
14.(1)N
(2)第三周期第ⅡA族
(3)
(4)
(5) 酸性
【分析】由元素在元素周期表中的位置可知,a为H,b为C,c为N,d为Na,e为Mg,f为Al,g为P,h为S,i为Cl,j为Se,并结合元素周期律以及物质的性质进行解答。
【详解】(1)元素c是N。
(2)元素Mg在元素周期表中所在的位置是第三周期第ⅡA族。
(3)元素Al的简单离子结构示意图为,Al与NaOH溶液反应的离子方程式为。
(4)元素H和C构成的最简单的有机化合物为甲烷,其结构式为,甲烷与氯气在光照条件下发生取代反应,方程式为。
(5)元素S的最高价氧化物对应的水化物为H2SO4,呈酸性;浓H2SO4与碳单质在加热条件下反应生成二氧化碳、二氧化硫和水,化学反应方程式。
15. CuI 2IO3-+ 5HSO3- = 3H + + 5SO42-+ I2 + H2O IF6- 2Al3++ 3CO32-+ 3H2O = 2Al(OH)3↓ + 3CO2↑ 5I-+ IO3-+ 6H+ = 3I2 + 3H2O FeCl3 (H2O2) 淀粉-KI
【详解】试题分析:(1)16.0 g CuSO4的物质的量是16.0g/160g/mol=0.1mol,与过量KI反应后可得19.1 g 的A,根据元素守恒,则A中含有Cu元素0.1mol,质量是6.4g,则阴离子只能是I-,所以I元素的质量是19.1g-6.4g=12.7g,所以碘离子的物质的量是12.7g/127g/mol=0.1mol,所以Cu与I的物质的量之比是1:1,所以A的化学式为CuI;NaIO3与NaHSO3溶液反应后生成碘,H元素的化合价降低,则S元素的化合价升高,所以产物中有硫酸根离子,结合元素守恒、电荷守恒,产物中还有氢离子、水,所以反应的离子方程式为2IO3-+ 5HSO3- = 3H + + 5SO42-+ I2 + H2O;
(2)结合水的电离可知2分子IF5的自偶电离除产生阳离子为IF4+外,还产生阴离子是IF6-;
(3)AlI3和Na2CO3溶液反应产生白色沉淀和气体,则铝离子与碳酸根离子发生双水解反应,所以该沉淀是氢氧化铝,气体应是二氧化碳,则离子方程式为2Al3++ 3CO32-+ 3H2O = 2Al(OH)3↓ + 3CO2↑;
(4)①第一份试样加酸酸化,如果加淀粉溶液后试样溶液变蓝,说明试样中同时存在I-和IO3-,二者在酸性条件下反应生成碘单质和水,离子方程式为5I-+ IO3-+ 6H+ = 3I2 + 3H2O;
②证明只含碘离子,则需要氧化剂氧化碘离子为碘单质,如过氧化氢或铁离子均可;
③证明只含IO3- ,则需要淀粉KI试纸,所以直接使淀粉KI试纸变蓝,说明含有IO3- 。
考点:考查化学式的计算,产物的分析,实验方案的设计
16. Na>Al>O HNO3>H2CO3> H2SiO3 ab Al3++3NH3 H2O==Al(OH)3↓+3NH4+
【详解】根据元素①-⑧在元素周期表中的位置,可以推出它们分别为H、C、N、Na、Al、Si、Cl等8种元素。
(1)④、⑤、⑥的原子半径由大到小的顺序为Na>Al>O;C、N、Si的非金属性从强到弱的顺序为N>C> Si,所以其最高价含氧酸的酸性由强到弱的顺序是HNO3>H2CO3> H2SiO3。
(2)①、④、⑤、⑧四种元素中,某些元素间可形成既含离子键又含极性共价键的化合物,如氢氧化钠或过氧化钠,其电子式为。
(3)由表中两种元素的原子按1:1组成的常见液态化合物的稀溶液易被催化分解,这种物质一定是双氧水,可使用的催化剂为a MnO2 或b FeCl3 。
(4)由表中元素形成的物质X、Y、Z、M、N可发生以下反应:
因为M为仅含非金属元素的盐,所以A一定是铵盐。⑥的单质是铝,铝是由氧化铝电解而得,所以N为氧化铝、Z为氢氧化铝,X和Y是铝盐和氨气(无法确定哪个是铝盐哪个是氨气,但不影响解题),X溶液与Y溶液反应的离子方程式为Al3++3NH3 H2O==Al(OH)3↓+3NH4+。
17.(1)BC
(2)B
(3)C
【详解】(1)元素周期表有7个横行,每个横行为一个周期,共有7个周期,前三个周期为短周期,后四个周期为长周期;元素周期表有18个纵行,除8、9、10三个纵行是第Ⅷ外,其余每个纵行为一个族,共有16个族,第15纵行是第ⅤA族;故选BC。
(2)元素周期表中,第二周期和第三周期的第IIA族和第IIIA族原子序数相差1,第四周期和第五周期由于有过渡元素,第IIA族和第IIIA族的原子序数相差11,第六周期和第七周期由于有镧系和锕系,第IIA族和第IIIA族原子序数相差25,若第IIA族元素的原子序数为x,则同周期的第IIIA族元素的原子序数可能为x+1,x+11,x+25,故选B。
(3)第VIIA族元素有-1价,能和金属形成卤化物,H也能和金属元素形成金属氢化物,所以氢元素也可以放在第VIIA族,故选C。
18.(1) Ar HF
(2)
(3)
(4) 不合理 易挥发,与反应生成白色沉淀的物质也可能是,不能证明H2CO3酸性比强
【分析】由各元素在周期表中的位置信息,可推得①Be,②C,③N,④O,⑤F,⑥Na,⑦Al,⑧Si,⑨Cl,⑩Ar。
【详解】(1)原子的核外电子最外层为2或8时最稳定,由原子的核外电子排布得最稳定的原子是Ar;由元素周期律,元素非金属性越强,其气太氢化物越稳定,F的非金属性最强,所以形成的气态氢化物稳定性最强的是HF;
(2)由分析知元素②为C,最高价氧化物是CO2,电子式为 ;⑤为F元素,⑥为Na元素,NaF形成过程为;
(3)①Be和⑦Al的金属性相似,则Be的最高价氧化物对应的水化物与KOH溶液的反应和Al(OH)3与KOH溶液的反应相似,离子方程式为;
(4)该实验是利用通过强酸制弱酸的原理比较最高价氧化物对应水化物的酸性强弱,从而证明元素的非金属性,但易挥发,与反应生成的物质可能是生成的CO2,也可能是挥发出的,所以该实验得出的结论不准确。
19.(1) 第三周期第IVA族
(2)
(3)
(4)
(5)AC
【详解】(1)硅是14号元素,在元素周期表中的位置是第三周期第IVA族;铝离子核外有10个电子,铝离子结构示意图为 ;
(2)由Na+、O构成,电子式为 ;根据价键规律,氯原子能形成1个共价键、氧原子形成2个共价键,的结构式为。青金石中非金属元素有H、O、Si、S、Cl,组成的既含有极性键又含有非极性键的物质的分子式。
(3)青金石所含的短周期元素包括H、O、Si、S、Cl、Na、Al,金属性最强的是Na;电子层数越多半径越大,电子层数相同,质子数越多半径越小,非金属元素原子半径由大到小的顺序为;
(4)Be与Al的化学性质相似,根据Al与氢氧化钠反应方程式,可知Be与NaOH溶液反应的化学方程式是;
(5)A.不能得电子多少判断元素非金属性,故选A;
B.元素非金属性越强,气态氢化物越稳定。硫化氢在300℃时开始分解,HCl在1500℃时开始缓慢分解,稳定性HCl>H2S,能说明氯元素的非金属性比硫元素强,故不选B;
C.最高价含氧酸的酸性越强,元素非金属性越强,不是S的最高价含氧酸,的酸性比的强,不能说明氯元素的非金属性比硫元素强,故选C;
D.向水溶液中通入有淡黄色沉淀生成,说明氯气的氧化性大于S,能说明氯元素的非金属性比硫元素强,故不选D;
选AC。
20. 第四周期第VA族 HF HClO4 Al(OH)3+OH-=[Al(OH)4]-或Al(OH)3+OH-=AlO +2H2O
【分析】根据各元素在周期表中的相对位置可知:①为H元素、②为C元素、③为N元素、④为F元素、⑤为Na元素、⑥为Mg元素、⑦为Al元素、⑧为S元素、⑨为Cl元素,⑩为As元素,据此结合元素周期律知识解答。
【详解】(1)⑩为As元素,在元素周期表的位置位于第四周期第VA族;⑦是Al元素,原子核外电子排布是2、8、3,所以Al的原子结构示意图为;
(2))④、⑤、⑥三种元素分别是F、Na、Mg,三种元素的简单离子都具有2、8的电子层结构,电子层结构相同。对于电子层结构相同的离子来说,核电荷数越大,离子半径越小,所以离子半径由大到小的顺序为 ;
(3)④⑧⑨分别是F、S、Cl,元素的非金属性越强,其相应的氢化物的稳定性就越强,由于元素的非金属性 ,所以三种元素的气态氢化物中,最稳定的是HF; F元素没有最高价的含氧酸,由于元素的非金属性 ,所以最高价氧化物对应水化物中,酸性最强的是HClO4;
(4)⑤是Na,⑦是Al,两种元素的最高价氧化物对应的水化物分别是NaOH、Al(OH)3,Al(OH)3是两性氢氧化物,可以与强碱NaOH发生反应产生四羟基合铝酸钠或偏铝酸钠和水,发生反应的离子方程式为:Al(OH)3+OH-=[Al(OH)4]-或者Al(OH)3+OH-=AlO+2H2O。
答案第1页,共2页
答案第1页,共2页
一、单选题(共13题)
1.下列实验方案的设计能达到相应实验目的的是( )
选项 实验目的 实验方案
A 验证的氧化性强于 向溶液中通入少量
B 比较HF与的酸性强弱 常温下,用pH试纸分别测定浓度均为的溶液和溶液的pH
C 验证与KI的反应是可逆反应 向溶液中滴加溶液,充分反应后,取少许混合液滴加KSCN溶液
D 比较Fe与Cu的金属活动性 常温下,将Fe、Cu与浓硝酸组成原电池
A.A B.B C.C D.D
2.臭氧化钾()常用作氧气源。利用干燥的固体氢氧化钾与臭氧反应制取臭氧化钾,以及作氧气源产生氧气的有关反应如下:
下列说法错误的是
A.和属于同素异形体
B.KOHI和都是纯净物
C.是一种碳酸盐,可与碱反应
D.与水生成KOH,说明是碱性氧化物
3.下列说法不正确的是( )
A.“溴”被称为“海洋元素”
B.氯离子的结构示意图:
C.1H、35C1、37C1表示3种核素
D.汤姆生根据a粒子散射现象提出了“葡萄干面包式”的原子结构模型
4.W、X、Y、Z四种短周期元素在元素周期表中的相对位置如图所示,且四种元素的最外层电子数之和为24。下列说法错误的是
W X
Y Z
A.W元素的简单氢化物可用作制冷剂
B.单核阴离子的还原性Y强于X
C.Y元素最高正价和最低负价的代数和为4
D.Z分别与钠、镁、铝元素形成的化合物都属于离子化合物
5.科学家用钙离子撞击锎(Cf)靶,产生了一种超重元素—Og,其反应可表示为:Cf+Ca→Og+3n,下列说法正确的是
A.Cf原子核内有98个质子,249个中子
B.Ca与Ca互为同素异形体
C.Og是一种性质活泼的非金属元素
D.根据元素周期律推测Ca(OH)2的碱性比Mg(OH)2强
6.科学研究人员在金星大气中探测到了只属于的光谱特征,据此推断金星大气层或存在生命。已知与足量的溶液发生反应可制备。已知分子呈正四面体型( ),代表阿伏加德罗常数。下列说法不正确的是
A.1mol中含6mol非极性键
B.每产生标准状况下22.4L时,该反应转移的电子数为
C.为酸式盐
D.通过X射线衍射法可测定的分子结构
7.下列化学用语表示正确的是
A.乙醇的结构简式:CH3OCH3
B.氢分子的电子式:H:H
C.氧原子的结构示意图:
D.硝酸钾的电离方程式: KNO3= K++ N3+ 3O2-
8.原子核的人工转变是利用粒子(即氦核)撞击原子核,使原子核转变为另一种原子核的过程。1919年,卢瑟福利用粒子轰击短周期非金属原子,发现了质子,使人类对原子核的认识更进一步,其核反应原理为,其中元素X的最高价氧化物对应的水化物能与其气态氢化物反应生成盐,下列说法正确的是
A.X、Y均可形成既含极性键又含非极性键的化合物
B.的中子数为8
C.原子半径:X
9.已知几种短周期元素的原子半径、常见的最高价和最低价如下表,下列说法中不正确的是
元素性质 元素编号
① ② ③ ④ ⑤ ⑥ ⑦
原子半径(nm) 0.073 0.075 0.037 0.110 0.099 0.186 0.143
最高正化合价 无 +5 +1 +5 +7 +1 +3
最低负化合价 -2 -3 -1 -3 -1 无 无
A.⑦的简单离子是同周期元素离子半径最小的
B.②的气态氢化物浓溶液可用于检验氯气管道的泄漏
C.气态氢化物的稳定性①﹤②
D.最高价氧化物的水化物的酸性④﹤⑤
10.X、Y、Z、U、W五种短周期非金属元素,它们的原子半径与原子序数有如图关系,的最高正价与最低负价的代数和为2,下列说法正确的是( )
A.的最高价氧化物一定是酸性氧化物
B.的单质是制造光导纤维的主要物质
C.由和氢元素三种元素形成的化合物一定是共价化合物
D.X、U、W三种元素的氧化物对应的水化物酸性最强的是
11.表中①~⑥为短周期元素及相应部分原子半径的数据。下列说法正确的是
元素性质 元素编号
① ② ③ ④ ⑤ ⑥
原子半径/ a 0.075 b 0.110 c d
最高化合价
最低化合价
A.元素①的最外层电子排布为
B.元素②氢化物与元素⑥氢化物反应形成化合物中只有共价键
C.原子半径:
D.非金属性:元素⑤元素④元素①
12.控制变量是科学研究重要方法。由下列实验现象一定能得出相应结论的是:
选项 A B C D
装 置 图
现 象 右边试管产生气泡较快 左边棉球变棕黄色,右边棉球变蓝色 镁电极上有气泡冒出,铝极溶解 试管中液体变浑浊
结论 催化活性:Fe3+>Cu2+ 氧化性:Br2>I2 金属性:Al>Mg 非金属性:C>Si
A.A B.B C.C D.D
二、填空题(共8题)
13.向100mLBaCl2、AlCl3和FeCl3的混合溶液A中,逐滴加入Na2SO4和NaOH的混合溶液B,产生的沉淀的物质的量(n)和加入溶液B的体积(V)关系如图。
(1)当加入B溶液110mL时,溶液中的沉淀为(化学式)
(2)从90 mL至100 mL之间加入10 mL B溶液时发生的离子反应方程式① ;② ;并由此可以分析出溶液B中Na2SO4与NaOH物质的量浓度之比为 。
(3)通过计算分析可知:
B溶液中NaOH物质的量浓度为 mol/L;
A溶液中FeCl3物质的量浓度为 mol/L。
14.1869年,俄国化学家门捷列夫制作了第一张元素周期表,下表是元素周期表的一部分,表中所列的字母分别代表某一化学元素。
(1)元素c代表的元素是(写元素符号)
(2)请写出元素e在元素周期表中所在的位置
(3)请画出元素f的简单离子结构示意图 。请写出单质f与d的最高价氧化物对应水化物的离子反应方程式 。
(4)元素a和b能构成最简单的有机化合物(用结构式表示) 。请写出元素a和b构成的最简单有机化合物与i单质发生的第一步化学反应方程式 。
(5)元素h的最高价氧化物对应的水化物呈 (酸性、中性或碱性);请写出元素h的最高价氧化物对应的水化物与单质b的化学反应方程式 。
15.碘是生命体中的必需元素,请根据如下有关碘及其化合物的性质,回答下列问题:
(1)实验室中制取少量碘可采用如下方法:KI + CuSO4 → A (白色)↓+ K2SO4 + I2。
16.0 g CuSO4与过量KI反应后可得19.1 g 的A,写出A的化学式: 。
工业生产中,可用智利硝石(含有NaIO3)为原料,与NaHSO3溶液反应后生成碘,写出此反应的离子方程式: 。
(2)单质碘与氟气反应可制得IF5,实验表明液态IF5具有一定的导电性,研究人员发现产生这一现象的可能原因在于IF5的自偶电离(如:2H2OH3O++OH-),生成的阳离子为IF4+,则阴离子为 。
(3)将单质碘与铝屑置于管式电炉中,隔绝空气加热至500℃得到棕色片状固体(AlI3),此固体溶于Na2CO3溶液可产生白色沉淀和气体。请写出AlI3和Na2CO3溶液反应的离子方程式: 。
(4)设计以下实验方案判断加碘食盐中碘的存在形式为I-、IO3-,或两者同时存在。请对以下试验方案进行预测和分析。
首先取试样加水溶解,分成三份试样:
①第一份试样加酸酸化,如果加淀粉溶液后试样溶液变蓝,说明试样中同时存在I-和IO3-,该过程反应的离子方程式为 。
②第二份试样酸化后加 溶液,如果加入淀粉溶液后试样溶液变蓝,说明试样中存在I-。
③第三份试样酸化后,如果直接使 试纸变蓝,说明试样存在IO3-离子。
16.下表为元素周期表的一部分,请参照元素①-⑧在表中的位置,用化学用语回答下列问题:
IA 0
1 ① ⅡA ⅢA ⅣA ⅤA ⅥA ⅦA
2 ② ③ ④
3 ⑤ ⑥ ⑦ ⑧
(1)④、⑤、⑥的原子半径由大到小的顺序为 (填元素符号);
②、③、⑦的最高价含氧酸的酸性由强到弱的顺序是 (填化学式)。
(2)①、④、⑤、⑧四种元素中,某些元素间可形成既含离子键又含极性共价键的化合物,写出其中一种化合物的电子式: 。
(3)由表中两种元素的原子按1:1组成的常见液态化合物的稀溶液易被催化分解,可使用的催化剂为(填序号) 。
a.MnO2 b.FeCl3 c.Na2SO3 d.CaCO3
(4)由表中元素形成的物质X、Y、Z、M、N可发生以下反应:
X溶液与Y溶液反应的离子方程式为 。
17.19世纪初,许多新的元素被相继发现,化学家开始关注这些元素在化学性质和物理性质上的相似性和递变性。1869年,俄国化学家门捷列夫编制了一份元素周期表,是化学发展史上的一个里程碑。
(1)下列关于元素周期表的认识,错误的是
A.元素周期表有7个周期 B.前4周期叫短周期
C.元素周期表有18个族 D.第15族也叫第VA族
(2)某一周期第IIA族元素的原子序数为x,则同周期的第IIIA族元素的原子序数不可能是
A.x+1 B.x+8 C.x+11 D.x+25
(3)有人认为位于元素周期表第IA族的氢元素,也可以放在第VIIA族,下列物质能支持这种观点的是
A.HF B.H3O+ C.NaH D.H2O2
18.下图是元素周期表的一部分。
族 周期 ⅠA ⅡA ⅢA ⅣA VA ⅥA ⅦA 0
2 ① ② ③ ④ ⑤
3 ⑥ ⑦ ⑧ ⑨ ⑩
(1)①-⑩元素中最稳定的原子是 (填元素符号);形成的气态氢化物稳定性最强的是 (填氢化物的化学式)。
(2)②的最高价氧化物的电子式为 ;用电子式表示⑤和⑥形成化合物的过程: 。
(3)①和⑦金属性相似,①的最高价氧化物对应的水化物与KOH溶液反应的离子方程式为 。
(4)某同学设计了如下实验证明非金属性③>②>⑧。已知是不溶于水的白色胶状沉淀,易挥发。
该同学打开分液漏斗活塞,观察到A中产生气泡,B中出现白色胶状沉淀即认为非金属性③>②>⑧。请问该同学的结论合理吗 (答“合理”或“不合理”),原因是 。
19.《石雅》云:“青金石色相如天,或复金屑散乱,光辉灿烂,若众星丽于天也”。青金石的化学组成可表示为。回答下列问题:
(1)硅在元素周期表中的位置是 ;铝离子的结构示意图为 。
(2)的电子式为 ,的结构式为 。写出一种由青金石中非金属元素组成的既含有极性键又含有非极性键的物质的分子式 。
(3)青金石所含的短周期元素中,金属性最强的是 ,非金属元素原子半径由大到小的顺序为 。
(4)Be与Al的化学性质相似,则Be与NaOH溶液反应的化学方程式是 。
(5)下列不能说明氯元素的非金属性比硫元素强的是_______(填字母)。
A.氯、硫的最低负价分别为-1、-2
B.硫化氢在300℃时开始分解,HCl在1500℃时开始缓慢分解
C.的酸性比的强
D.向水溶液中通入有淡黄色沉淀生成
20.如表为元素周期表的一部分,请参照元素①~⑩在表中的位置,回答下列问题:
(1)元素⑩在周期表中的位置是 ,⑦的原子结构示意图为 。
(2)④、⑤、⑥的简单离子半径由大到小的顺序为 (用离子符号和“>”表示)。
(3)④⑧⑨的气态氢化物中,最稳定的是 (用化学式表示),最高价氧化物对应水化物中,酸性最强的是 (用化学式表示)。
(4)⑤的最高价氧化物对应的水化物与⑦的最高价氧化物对应的水化物发生反应的离子方程式 。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.C
【详解】A.由于还原性Fe2+>Br-,则向FeBr2溶液中通入少量Cl2,可能只有Fe2+被氧化,不能得出Cl2的氧化性强于Br2,A选项错误;
B.NaClO溶液具有漂白性,不能用pH试纸测定其pH从而判断酸性强弱,B选项错误;
C.向1mL0.1mol·L-1FeCl3溶液中滴加5mL0.1mol·L-1KI溶液,KI过量,若充分反应后加入KSCN溶液变成红色,证明有三价铁离子存在,可说明反应是可逆反应,C选项正确;
D.常温下,将Fe、Cu与浓硝酸组成原电池,Fe和浓硝酸发生钝化现象,Cu与浓硝酸能自发的发生氧化还原反应,所以Cu作负极,Fe做正极,不能判断Fe的金属活动性大于Cu,D选项错误;
答案选C。
2.D
【详解】A.和都是O元素形成的单质,二者互为同素异形体,A项正确;
B.KOHI和都是纯净物,B项正确;
C.是碳酸盐,能和反应生成BaCO3沉淀和KOH,C项正确;
D.碱性氧化物和水反应只生成碱,而与水生成KOH和,故不是碱性氧化物,D项错误;
答案选D。
3.D
【详解】A. 溴元素主要分布在海水中,且在海水中的储量较为丰富,故其被称为“海洋元素”,A说法正确;
B. 氯离子的核电荷数为17,核外有18个电子,其结构示意图为 ,B说法正确;
C. 1H、35C1、37C1是3种不同的原子,故其表示3种核素,C说法正确;
D. 汤姆生在研究阴极射线管实验时发现了电子,在此基础上,他提出了“葡萄干面包式”的原子结构模型,D说法不正确;
综上所述,相关说法不正确的是D,故选D。
4.D
【详解】X、Y、Z、W四种短周期元素,结合位置可知,W、X为第二周期元素,Y、Z为第三周期,设X的最外层电子数为x,则W的最外层电子数为x-1,Y的最外层电子数为x,Z的最外层电子数为x+1,则x+x-1+x+x+1=24,解得x=6,则W为N,X为O,Y为S,Z为Cl。
A.W元素的简单氢化物NH3易液化,可用作制冷剂,选项A正确;
B.同主族从上到下阴离子还原性依次增强,所以S2-的还原性比O2-强,选项B正确;
C.Y元素最高正价+6和最低负价-2的代数和为4,选项C正确;
D.Z分别与钠、镁、铝元素形成的化合物NaCl、MgCl2都属于离子化合物,但AlCl3是共价化合物,选项D错误;
答案选D。
5.D
【详解】A.原子符号左下角为质子数,左上角为质量数,质量数等于质子数与中子数的和,Cf原子核内有98个质子,中子数为249-98=151个,A错误;
B.Ca与Ca质子数相同,中子数不同,二者互为同位素,B错误;
C.Og是第七周期0族元素,不容易失去电子,也不容易获得电子,因此是一种性质不活泼的非金属元素,C错误;
D.Ca、Mg是同一主族元素,由于从上到下原子半径逐渐增大,原子失去电子的能力逐渐增强,因此Ca的金属性比Mg强,元素的金属性越强,其最高价氧化物对应的水化物的碱性就越强,则根据元素周期律推测Ca(OH)2的碱性比Mg(OH)2强,D正确;
故合理选项是D。
6.C
【详解】A.的正四面体结构为 ,1mol中含6mol非极性键,选项A正确;
B.由方程式可知,每产生标准状况下22.4L时,该反应转移的电子数为,选项B正确;
C.过量碱液与不反应,说明是一元酸,则为正盐,选项C错误;
D.通过X射线衍射法可测定分子结构,选项D正确;
答案选C。
7.B
【详解】A.乙醇的结构简式是CH3CH2OH,故A错误;
B.氢分子由两个氢原子共用一对电子形成,故B正确;
C.氧原子最外层只有六个电子,正确的结构示意图为,故C错误;
D.硝酸钾正确的电离方程式: ,故D错误;
答案选B。
8.A
【分析】元素X的最高价氧化物对应水化物与其气态氢化物反应生成盐,X是N元素,依据核聚变的质子守恒和质量数相等,可以推出Y是O元素,据此回答问题。
【详解】A.根据分析,X、Y分别为N、O元素,两种元素可形成N2H4和H2O2,这两种化合物既含极性键又含非极性键,A正确;
B.根据分析,X是N元素,根据质量数守恒,W=17+1-4=14,质子数Z=7,则的中子数为14-7=7,B错误;
C.同周期主族元素从左到右,原子半径逐渐减小,则原子半径:X(N)>Y(O),C错误;
D.同周期主族元素从左到右,非金属性逐渐增强,则非金属性:X(N)
9.C
【分析】由题意可知①号元素无最高正价,最低化合价为-2价,则①号元素为O;②④号元素的最高正价为+5价,最低正价为-3价,则②④为第VA族元素,又因④的原子半径大于②的原子半径,则②④分别为N、P;③的最高正价为+1价,最低负价位-1价,且原子半径比①号元素O小,则③号元素为H;⑤号元素最高正价为+7价,最低负价为-1,原子半径②<⑤<④,则⑤号为Cl元素;⑥最高正价为+1无最低负价,原子半径最大,则⑥为Na元素;⑦的最高正价为+3价,无最低负价,且原子半径仅次于⑥,则⑦号元素为Al。综上分析有①②③④⑤⑥⑦分别为:O、N、H、P、Cl、Na、Al,结合元素周期律分析可得;
【详解】A.电子层数越多离子半径越大,电子层数相同核电荷数越大离子半径越小,所以为同周期元素离子半径最小的离子,故A不选;
B.②号元素为N元素,其气态氢化物为,可与反应生成产生白烟,故可用②的气态氢化物浓溶液可用于检验氯气管道的泄漏,故B不选;
C.非金属性O>N,所以气态氢化物的稳定性①>②,故选C;
D.非金属性越强,最高价氧化物对应水化物的酸性越强,非金属性P
10.A
【分析】
X、Y、Z、U、W五种短周期非金属元素,的最高正价与最低负价的代数和为2,则Y为N元素,X半径大于Z,则X为C,Z为O,U的原子序数为N原子的2倍,则U为Si,W的原子序数比U大3,则W为17号元素,为Cl,据此分析解答。
【详解】
由图分析可知元素 X、Y、Z、U、W分别为C、N、O、Si、Cl,
A. X为C元素,C的最高价氧化物为CO2,是酸性氧化物,故A正确;
B.制造光导纤维的主要物质是SiO2,不是Si单质,故B错误;
C.N、O和H元素形成的化合物可以是NH4NO3,由铵根离子和硝酸根离子构成,是离子化合物,故C错误;
D.C、Si、Cl元素的氧化物对应的水化物中,HClO酸性比H2CO3弱,故D错误;
答案选A。
11.C
【解析】为短周期元素,①的最高价为价、最低价为价,则①为S元素;③只有最低价价,则③为O元素;②④的最高价都是价,最低价都是价,结合原子半径大小可知,②为N元素、④为P元素;⑥有最高价价、最低价价,则⑥为元素;⑤只有最低价价,则⑤为F元素;结合元素周期律分析解答。
【详解】A.①为S元素,为第三周期元素,最外层电子排布为,A错误;
B.元素②的氢化物为氨,元素⑥的氢化物为,氨与氯化氢反应生成氯化铵,氯化铵中含有离子键和极性共价键,B错误;
C.电子层数越多,原子半径越大,电子层数相同时,核电荷数越大,原子半径越小,则原子半径大小为,C正确;
D.同周期元素从左到右,非金属性逐渐增强;同主族元素从上到下,非金属性逐渐减弱,非金属性F最强,P最弱,即非金属性:元素⑤元素①元素④,D错误。
故选C。
12.A
【详解】A.氯离子浓度相同时,Fe3+浓度小,但产生气泡的速度快,说明催化活性:Fe3+>Cu2+,A项正确;
B.氯气过量条件下,也能与KI溶液反应,无法判断Br2能否与KI溶液反应,B项错误;
C.Al在强碱性溶液中比Mg更易失电子,铝作负极,Mg作正极,不能得出金属性:Al>Mg的结论,C项错误;
D.盐酸和Na2CO3反应生成CO2,CO2与水形成的碳酸能与Na2SiO3溶液反应生成硅酸,但在反应过程中,HCl有可能随着CO2进入试管中,试管中液体变浑浊也可能是盐酸与Na2SiO3溶液反应的结果,故不能得出非金属性:C>Si的结论,D项错误;
答案选A。
13. BaSO4、Fe(OH)3 Ba2++SO42-="=" BaSO4↓ Al(OH)3+ OH-="=" AlO2-+2H2O 1:1 c(NaOH)=" 1" mol/L c(FeCl3)= 0.1 mol/L
【详解】试题分析:溶液中只有Fe3+被完全沉淀以后,Al3+才开始沉淀.
(1)图中第一段曲线生成的沉淀为BaSO4、Fe(OH)3和Al(OH)3,且加入B溶液90mL时,Fe3+、Al3+恰好沉淀,当加入B溶液110mL时,溶液中的沉淀为BaSO4、Fe(OH)3
(2)图中第二段曲线为平行直线,沉淀总物质的量没有增减,故这段是由Al(OH)3的溶解和BaSO4的继续生成所引起,且溶解的Al(OH)3的物质的量和生成的BaSO4的物质的量相等,据Al(OH)3+OH-=AlO2-+2H2O,Ba2++SO42-=BaSO4↓,故加入的物质:n(NaOH)=n(Na2SO4),Na2SO4与NaOH物质的量浓度之比为1: 1;
(3)图中第三段曲线中,加入B溶液100mL时,Ba2+恰好沉淀完全,这段中Al(OH)3继续溶解,B为110mL时,沉淀中Al(OH)3已完全溶解,溶解了(0.12-0.11)mol=0.01mol,消耗了10mLB溶液,故c(NaOH)==1mol/L,则共加入Na2SO4为0.01mol,故c(Na2SO4)==1mol/L,而整个反应过程共生成BaSO4为0.1L×1mol/L=0.1(mol)故A溶液中c(Ba2+)=1mol/L.图中第四段曲线中,沉淀为Fe(OH)3、BaSO4共0.11mol,BaSO4为0.1mol,则Fe(OH)3为(0.11-0.1)mol=0.01mol,A中c(Fe3+)=0.1mol/L。
考点:本题考查铝的性质化学图象分析。
14.(1)N
(2)第三周期第ⅡA族
(3)
(4)
(5) 酸性
【分析】由元素在元素周期表中的位置可知,a为H,b为C,c为N,d为Na,e为Mg,f为Al,g为P,h为S,i为Cl,j为Se,并结合元素周期律以及物质的性质进行解答。
【详解】(1)元素c是N。
(2)元素Mg在元素周期表中所在的位置是第三周期第ⅡA族。
(3)元素Al的简单离子结构示意图为,Al与NaOH溶液反应的离子方程式为。
(4)元素H和C构成的最简单的有机化合物为甲烷,其结构式为,甲烷与氯气在光照条件下发生取代反应,方程式为。
(5)元素S的最高价氧化物对应的水化物为H2SO4,呈酸性;浓H2SO4与碳单质在加热条件下反应生成二氧化碳、二氧化硫和水,化学反应方程式。
15. CuI 2IO3-+ 5HSO3- = 3H + + 5SO42-+ I2 + H2O IF6- 2Al3++ 3CO32-+ 3H2O = 2Al(OH)3↓ + 3CO2↑ 5I-+ IO3-+ 6H+ = 3I2 + 3H2O FeCl3 (H2O2) 淀粉-KI
【详解】试题分析:(1)16.0 g CuSO4的物质的量是16.0g/160g/mol=0.1mol,与过量KI反应后可得19.1 g 的A,根据元素守恒,则A中含有Cu元素0.1mol,质量是6.4g,则阴离子只能是I-,所以I元素的质量是19.1g-6.4g=12.7g,所以碘离子的物质的量是12.7g/127g/mol=0.1mol,所以Cu与I的物质的量之比是1:1,所以A的化学式为CuI;NaIO3与NaHSO3溶液反应后生成碘,H元素的化合价降低,则S元素的化合价升高,所以产物中有硫酸根离子,结合元素守恒、电荷守恒,产物中还有氢离子、水,所以反应的离子方程式为2IO3-+ 5HSO3- = 3H + + 5SO42-+ I2 + H2O;
(2)结合水的电离可知2分子IF5的自偶电离除产生阳离子为IF4+外,还产生阴离子是IF6-;
(3)AlI3和Na2CO3溶液反应产生白色沉淀和气体,则铝离子与碳酸根离子发生双水解反应,所以该沉淀是氢氧化铝,气体应是二氧化碳,则离子方程式为2Al3++ 3CO32-+ 3H2O = 2Al(OH)3↓ + 3CO2↑;
(4)①第一份试样加酸酸化,如果加淀粉溶液后试样溶液变蓝,说明试样中同时存在I-和IO3-,二者在酸性条件下反应生成碘单质和水,离子方程式为5I-+ IO3-+ 6H+ = 3I2 + 3H2O;
②证明只含碘离子,则需要氧化剂氧化碘离子为碘单质,如过氧化氢或铁离子均可;
③证明只含IO3- ,则需要淀粉KI试纸,所以直接使淀粉KI试纸变蓝,说明含有IO3- 。
考点:考查化学式的计算,产物的分析,实验方案的设计
16. Na>Al>O HNO3>H2CO3> H2SiO3 ab Al3++3NH3 H2O==Al(OH)3↓+3NH4+
【详解】根据元素①-⑧在元素周期表中的位置,可以推出它们分别为H、C、N、Na、Al、Si、Cl等8种元素。
(1)④、⑤、⑥的原子半径由大到小的顺序为Na>Al>O;C、N、Si的非金属性从强到弱的顺序为N>C> Si,所以其最高价含氧酸的酸性由强到弱的顺序是HNO3>H2CO3> H2SiO3。
(2)①、④、⑤、⑧四种元素中,某些元素间可形成既含离子键又含极性共价键的化合物,如氢氧化钠或过氧化钠,其电子式为。
(3)由表中两种元素的原子按1:1组成的常见液态化合物的稀溶液易被催化分解,这种物质一定是双氧水,可使用的催化剂为a MnO2 或b FeCl3 。
(4)由表中元素形成的物质X、Y、Z、M、N可发生以下反应:
因为M为仅含非金属元素的盐,所以A一定是铵盐。⑥的单质是铝,铝是由氧化铝电解而得,所以N为氧化铝、Z为氢氧化铝,X和Y是铝盐和氨气(无法确定哪个是铝盐哪个是氨气,但不影响解题),X溶液与Y溶液反应的离子方程式为Al3++3NH3 H2O==Al(OH)3↓+3NH4+。
17.(1)BC
(2)B
(3)C
【详解】(1)元素周期表有7个横行,每个横行为一个周期,共有7个周期,前三个周期为短周期,后四个周期为长周期;元素周期表有18个纵行,除8、9、10三个纵行是第Ⅷ外,其余每个纵行为一个族,共有16个族,第15纵行是第ⅤA族;故选BC。
(2)元素周期表中,第二周期和第三周期的第IIA族和第IIIA族原子序数相差1,第四周期和第五周期由于有过渡元素,第IIA族和第IIIA族的原子序数相差11,第六周期和第七周期由于有镧系和锕系,第IIA族和第IIIA族原子序数相差25,若第IIA族元素的原子序数为x,则同周期的第IIIA族元素的原子序数可能为x+1,x+11,x+25,故选B。
(3)第VIIA族元素有-1价,能和金属形成卤化物,H也能和金属元素形成金属氢化物,所以氢元素也可以放在第VIIA族,故选C。
18.(1) Ar HF
(2)
(3)
(4) 不合理 易挥发,与反应生成白色沉淀的物质也可能是,不能证明H2CO3酸性比强
【分析】由各元素在周期表中的位置信息,可推得①Be,②C,③N,④O,⑤F,⑥Na,⑦Al,⑧Si,⑨Cl,⑩Ar。
【详解】(1)原子的核外电子最外层为2或8时最稳定,由原子的核外电子排布得最稳定的原子是Ar;由元素周期律,元素非金属性越强,其气太氢化物越稳定,F的非金属性最强,所以形成的气态氢化物稳定性最强的是HF;
(2)由分析知元素②为C,最高价氧化物是CO2,电子式为 ;⑤为F元素,⑥为Na元素,NaF形成过程为;
(3)①Be和⑦Al的金属性相似,则Be的最高价氧化物对应的水化物与KOH溶液的反应和Al(OH)3与KOH溶液的反应相似,离子方程式为;
(4)该实验是利用通过强酸制弱酸的原理比较最高价氧化物对应水化物的酸性强弱,从而证明元素的非金属性,但易挥发,与反应生成的物质可能是生成的CO2,也可能是挥发出的,所以该实验得出的结论不准确。
19.(1) 第三周期第IVA族
(2)
(3)
(4)
(5)AC
【详解】(1)硅是14号元素,在元素周期表中的位置是第三周期第IVA族;铝离子核外有10个电子,铝离子结构示意图为 ;
(2)由Na+、O构成,电子式为 ;根据价键规律,氯原子能形成1个共价键、氧原子形成2个共价键,的结构式为。青金石中非金属元素有H、O、Si、S、Cl,组成的既含有极性键又含有非极性键的物质的分子式。
(3)青金石所含的短周期元素包括H、O、Si、S、Cl、Na、Al,金属性最强的是Na;电子层数越多半径越大,电子层数相同,质子数越多半径越小,非金属元素原子半径由大到小的顺序为;
(4)Be与Al的化学性质相似,根据Al与氢氧化钠反应方程式,可知Be与NaOH溶液反应的化学方程式是;
(5)A.不能得电子多少判断元素非金属性,故选A;
B.元素非金属性越强,气态氢化物越稳定。硫化氢在300℃时开始分解,HCl在1500℃时开始缓慢分解,稳定性HCl>H2S,能说明氯元素的非金属性比硫元素强,故不选B;
C.最高价含氧酸的酸性越强,元素非金属性越强,不是S的最高价含氧酸,的酸性比的强,不能说明氯元素的非金属性比硫元素强,故选C;
D.向水溶液中通入有淡黄色沉淀生成,说明氯气的氧化性大于S,能说明氯元素的非金属性比硫元素强,故不选D;
选AC。
20. 第四周期第VA族 HF HClO4 Al(OH)3+OH-=[Al(OH)4]-或Al(OH)3+OH-=AlO +2H2O
【分析】根据各元素在周期表中的相对位置可知:①为H元素、②为C元素、③为N元素、④为F元素、⑤为Na元素、⑥为Mg元素、⑦为Al元素、⑧为S元素、⑨为Cl元素,⑩为As元素,据此结合元素周期律知识解答。
【详解】(1)⑩为As元素,在元素周期表的位置位于第四周期第VA族;⑦是Al元素,原子核外电子排布是2、8、3,所以Al的原子结构示意图为;
(2))④、⑤、⑥三种元素分别是F、Na、Mg,三种元素的简单离子都具有2、8的电子层结构,电子层结构相同。对于电子层结构相同的离子来说,核电荷数越大,离子半径越小,所以离子半径由大到小的顺序为 ;
(3)④⑧⑨分别是F、S、Cl,元素的非金属性越强,其相应的氢化物的稳定性就越强,由于元素的非金属性 ,所以三种元素的气态氢化物中,最稳定的是HF; F元素没有最高价的含氧酸,由于元素的非金属性 ,所以最高价氧化物对应水化物中,酸性最强的是HClO4;
(4)⑤是Na,⑦是Al,两种元素的最高价氧化物对应的水化物分别是NaOH、Al(OH)3,Al(OH)3是两性氢氧化物,可以与强碱NaOH发生反应产生四羟基合铝酸钠或偏铝酸钠和水,发生反应的离子方程式为:Al(OH)3+OH-=[Al(OH)4]-或者Al(OH)3+OH-=AlO+2H2O。
答案第1页,共2页
答案第1页,共2页
