第四章《物质结构元素周期律》检测题(含解析)—2023--2024学年上学期高一化学人教版(2019)必修第一册
文档属性
| 名称 | 第四章《物质结构元素周期律》检测题(含解析)—2023--2024学年上学期高一化学人教版(2019)必修第一册 |  | |
| 格式 | docx | ||
| 文件大小 | 674.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-18 08:51:33 | ||
图片预览


文档简介
第四章《物质结构 元素周期律》检测题
一、单选题(共12题)
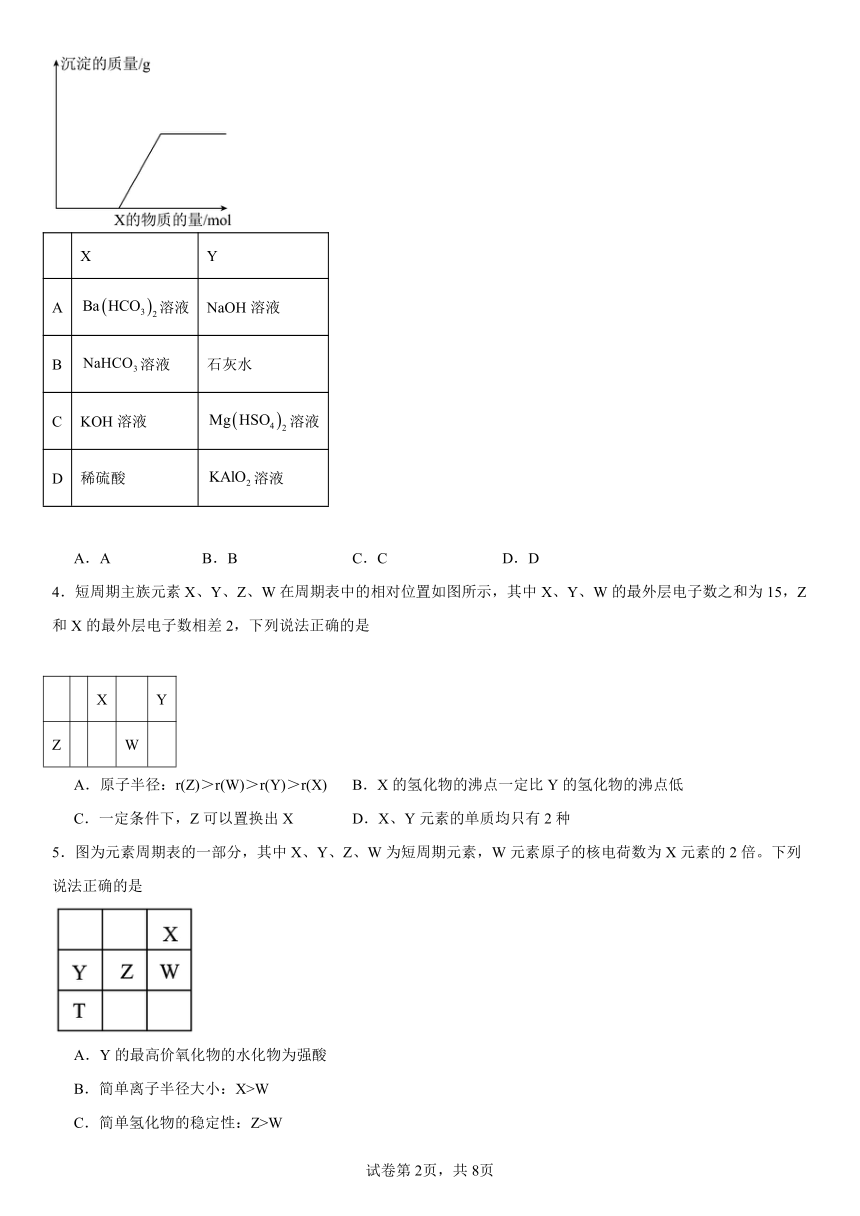
1.下列实验过程中曲线变化正确的是( )
A.表示Na2CO3溶液中滴入稀盐酸
B.表示溴水中滴入Na2SO3溶液
C. 表示AgNO3溶液中滴入氨水
D. 表示一定条件下2SO2+O2 2SO3达平衡后,升高温度
2.Q、W、X、Y、Z是原子序数依次增大的短周期元素,X的焰色反应呈黄色。Q元素的原子最外层电子数是其内层电子数的2倍。W、Z最外层电子数相同,Z的核电荷数是W的2倍。元素Y的合金是日常生活中常用的金属材料。下列说法正确的是
A.原子半径的大小顺序:X>Y>W>Q
B.元素Q和Z能形成QZ2型的离子化合物
C.Q、W的氢化物的稳定性一定W>Q
D.工业上常用电解的方法制备X、Y的单质
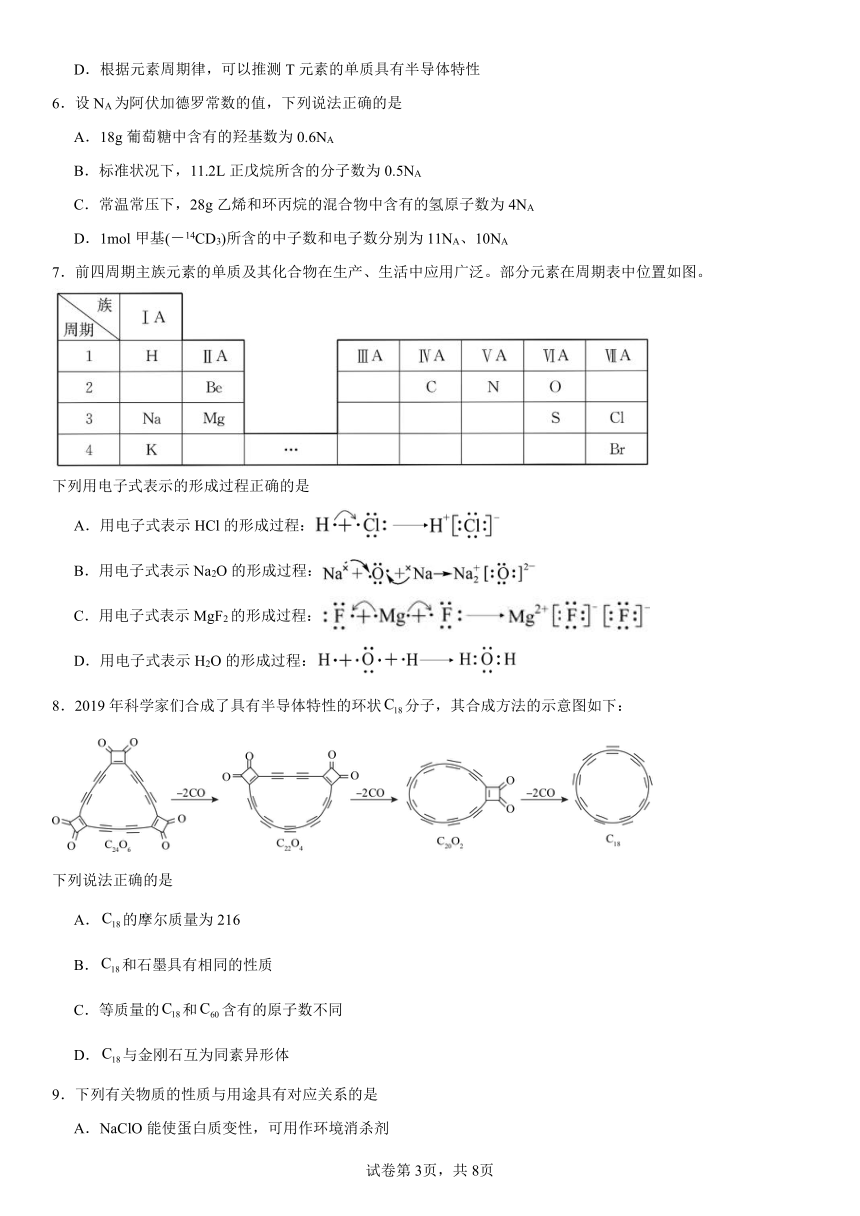
3.将溶液(或气体)X逐渐加入(或通入)到一定量Y溶液中,产生沉淀的质量与加入X的物质的量关系如图,符合图中情况的一组物质是
X Y
A 溶液 NaOH溶液
B 溶液 石灰水
C KOH溶液 溶液
D 稀硫酸 溶液
A.A B.B C.C D.D
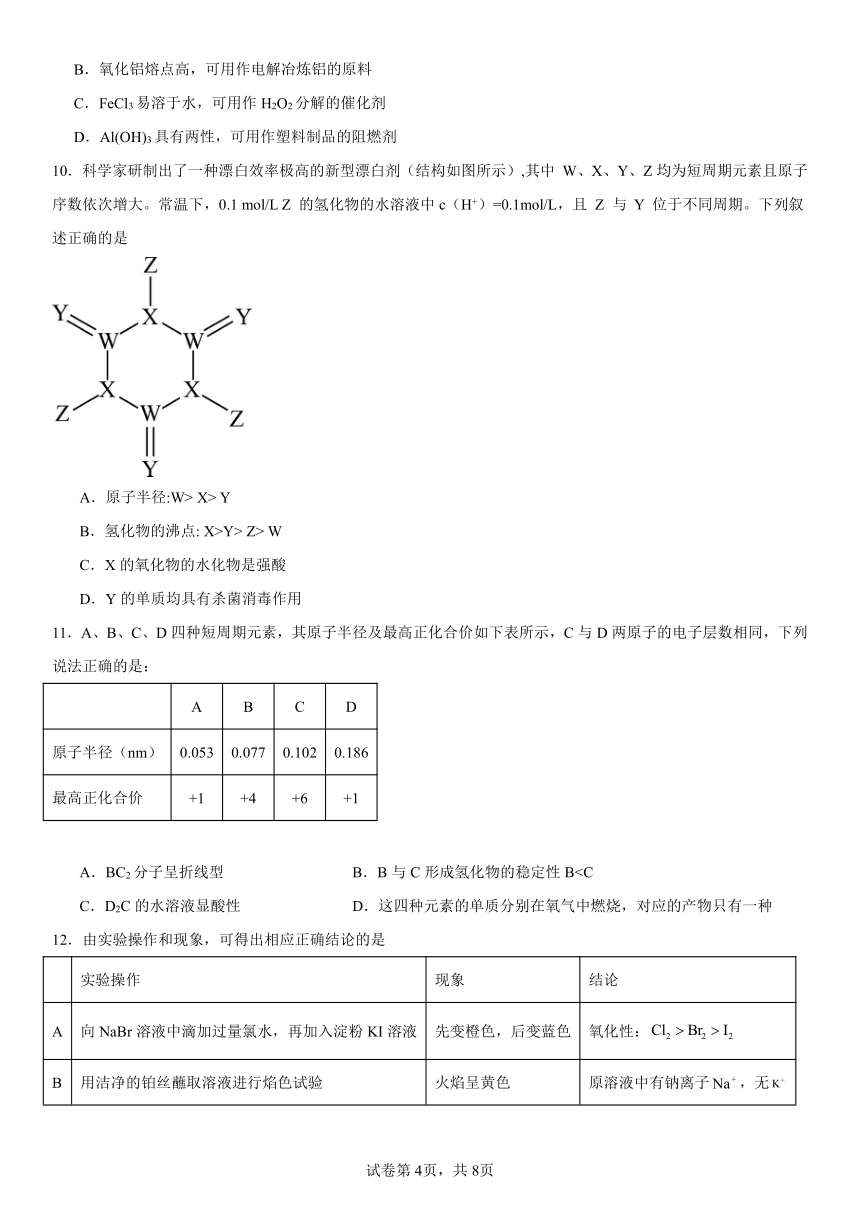
4.短周期主族元素X、Y、Z、W在周期表中的相对位置如图所示,其中X、Y、W的最外层电子数之和为15,Z和X的最外层电子数相差2,下列说法正确的是
X Y
Z W
A.原子半径:r(Z)>r(W)>r(Y)>r(X) B.X的氢化物的沸点一定比Y的氢化物的沸点低
C.一定条件下,Z可以置换出X D.X、Y元素的单质均只有2种
5.图为元素周期表的一部分,其中X、Y、Z、W为短周期元素,W元素原子的核电荷数为X元素的2倍。下列说法正确的是
A.Y的最高价氧化物的水化物为强酸
B.简单离子半径大小:X>W
C.简单氢化物的稳定性:Z>W
D.根据元素周期律,可以推测T元素的单质具有半导体特性
6.设NA为阿伏加德罗常数的值,下列说法正确的是
A.18g葡萄糖中含有的羟基数为0.6NA
B.标准状况下,11.2L正戊烷所含的分子数为0.5NA
C.常温常压下,28g乙烯和环丙烷的混合物中含有的氢原子数为4NA
D.1mol甲基(-14CD3)所含的中子数和电子数分别为11NA、10NA
7.前四周期主族元素的单质及其化合物在生产、生活中应用广泛。部分元素在周期表中位置如图。
下列用电子式表示的形成过程正确的是
A.用电子式表示HCl的形成过程:
B.用电子式表示Na2O的形成过程:
C.用电子式表示MgF2的形成过程:
D.用电子式表示H2O的形成过程:
8.2019年科学家们合成了具有半导体特性的环状分子,其合成方法的示意图如下:
下列说法正确的是
A.的摩尔质量为216
B.和石墨具有相同的性质
C.等质量的和含有的原子数不同
D.与金刚石互为同素异形体
9.下列有关物质的性质与用途具有对应关系的是
A.NaClO能使蛋白质变性,可用作环境消杀剂
B.氧化铝熔点高,可用作电解冶炼铝的原料
C.FeCl3易溶于水,可用作H2O2分解的催化剂
D.Al(OH)3具有两性,可用作塑料制品的阻燃剂
10.科学家研制出了一种漂白效率极高的新型漂白剂(结构如图所示),其中 W、X、Y、Z均为短周期元素且原子序数依次增大。常温下,0.1 mol/L Z 的氢化物的水溶液中c(H+)=0.1mol/L,且 Z 与 Y 位于不同周期。下列叙述正确的是
A.原子半径:W> X> Y
B.氢化物的沸点: X>Y> Z> W
C.X的氧化物的水化物是强酸
D.Y的单质均具有杀菌消毒作用
11.A、B、C、D四种短周期元素,其原子半径及最高正化合价如下表所示,C与D两原子的电子层数相同,下列说法正确的是:
A B C D
原子半径(nm) 0.053 0.077 0.102 0.186
最高正化合价 +1 +4 +6 +1
A.BC2分子呈折线型 B.B与C形成氢化物的稳定性BC.D2C的水溶液显酸性 D.这四种元素的单质分别在氧气中燃烧,对应的产物只有一种
12.由实验操作和现象,可得出相应正确结论的是
实验操作 现象 结论
A 向NaBr溶液中滴加过量氯水,再加入淀粉KI溶液 先变橙色,后变蓝色 氧化性:
B 用洁净的铂丝蘸取溶液进行焰色试验 火焰呈黄色 原溶液中有钠离子,无
C 取少许溶于水,加入几滴KSCN溶液 溶液变红色 全部被氧化
D 向无色溶液中滴加氯水和,振荡,静置 下层呈紫色 原溶液中有
A.A B.B C.C D.D
二、填空题(共8题)
13.金属铝质轻且有良好的防腐蚀性,在国防工业中有非常重要的应用。
完成下列填空:
(1)镓(Ga)与铝同主族,镓的氯化物与氨水反应的化学方程式: 。
(2)用铝和金属氧化物反应制备金属单质是工业上较常用的方法。如:2Al+4BaO3Ba↑+BaO·Al2O3
常温下Al的金属性比Ba的金属性 (填“强”或“弱”)。利用上述方法可制取Ba的主要原因是 。
a.高温时Al的活泼性大于Ba
b.高温有利于BaO分解
c.高温时BaO·Al2O3比Al2O3稳定
d.Ba的沸点比Al的低
14.元素周期表和元素周期律的应用
(1)根据同周期、同主族元素性质的递变规律判断元素性质的 。
(2)应用于 元素的相互推断。
(3)预测新元素
为新元素的发现及预测它们的 提供线索。
(4)寻找新物质
①在金属与非金属分界线附近寻找 。
②研究 附近元素,制造新农药。
③在 中寻找催化剂和耐高温、耐腐蚀的合金材料。
15.下表列出了a~m 13种元素在周期表(已省略了过渡元素)中的位置:
族 周期 ⅠA 0
1 ⅡA ⅢA ⅣA ⅤA ⅥA ⅦA a
2 b c d
3 e f g h i
4 j k l
5 m
(1)元素b为 (填名称);画出g的原子结构示意图 。
(2)元素f、i、j的原子半径从大到小的顺序是 (用元素符号表示);这三种原子分别形成简单离子后,离子半径从大到小的顺序是 (用离子符号表示)。
(3)h和k的原子序数相差 (填数字)。
(4)元素d和e形成的一种化合物为淡黄色固体,该化合物的电子式为 ,该化合物中化学键有 ,该化合物与c的最高价氧化物反应的化学方程式为 。
16.下图是元素周期表的一部分,请回答下列问题:
2 ... N O F Ne
3 ... P Z Cl Ar
(1)Z元素在元素周期表中位于第 族。
(2)Z的原子半径 (填“大于”“小于”或“等于”)Si的原子半径。
(3)Cl元素的非金属性比Z元素的 (填“强”或“弱”)。
(4)Z元素的气态氢化物的化学式为 。
(5)P(红磷)与P4(白磷)是由同种元素组成的不同种物质,二者互为 (填“同素异形体”“同分异构体”或“同位素”)。
17.X、Y和Z均为短周期元素,原子序数依次增大,X的单质为密度最小的气体,Y原子最外层电子数是其周期数的三倍,Z与X原子最外层电子数相同。回答下列问题:
(1)Z元素位于周期表第 周期,第 族。Z单质与水反应的离子方程式为 。
(2)由、X、Y、Z三种元素组成的化合物中,含有的化学键类型有 (填字母)
A.离子键 B.极性共价键 C.非极性共价键
(3)X和Y组成的化合物中,既含有极性共价键又含有非极性共价键的是 (填化学式),此化合物可将碱性工业废水中的CN-氧化为可溶性碳酸盐和氨,相应的离子方程式为 。
18.1913年,玻尔提出氢原子模型,电子在线性轨道上绕核运行,然而到了1926年,玻尔建立的线性轨道模型被量子力学推翻。量子力学指出,一定空间运动状态的电子并不在玻尔假定的线性轨道上运行,而在核外空间各处都可能出现,但出现的概率不同,即只能用统计的观点指出它在原子核外空间某处出现机会的多少。下图为多电子原子在核外空间出现的概率图:
问题:仔细观察图片,你有什么发现?
19.下表是元素周期表的一部分,除标出的元素外,表中的每个编号代表一种元素,请根据要求回答问题:
ⅠA 0
1 ⅡA ⅢA ⅣA ⅤA ⅥA ⅦA
2 B ① ② Ne
3 ③ ④ ⑤ Si ⑥
(1)①的元素符号是
(2)②和⑥两种元素的原子半径大小关系: (填“>”或“<”);
(3)③和⑤两种元素的金属性强弱关系: (填“>”或“<”);
(4)④的单质与⑥的最高价氧化物对应的水化物的稀溶液反应的离子方程式: 。
20.I.有以下物质:①石墨;②铝;③葡萄糖;④氨气;⑤二硫化碳;⑥硫酸铁固体;⑦氢氧化钡;⑧氯化氢气体;⑨K2CO3;⑩NaHSO4
(1)属于共价化合物的有 (填写编号,下同);属于离子化合物的有 。
(2)写出⑤的电子式: ;写出⑩在水中的电离方程式: 。
II.利用如图装置可验证非金属元素的非金属性的变化规律
(1)仪器A的名称为
(2)请选择合适药品设计实验验证Cl、C、Si的非金属性的变化规律;装置A、C中所装药品分别为 、 (填化学式)。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.B
【详解】A、碳酸钠和少量的盐酸之间反应生成氯化钠和碳酸氢钠,开始不会产生气体,故A错误;
B、溴单质具有氧化性,溴水中滴入溶液,溴水中的溴单质能将亚硫酸钠氧化为硫酸钠,并且会生成强酸HBr,所以酸性增强;随着溶液的滴入,当氧化性的溴单质消耗掉,到最后相当于将之稀释,酸性减弱,pH增大,故B正确;
C、硝酸银中加入少量氨水,生成氢氧化银白色沉淀,继续滴加,沉淀消失,得到银氨溶液,故C错误;
D、是放热的,升高温度,化学反应速率加快,平衡逆向移动,即逆反应速率大于正反应速率,故D错误;
故选:B。
2.D
【分析】Q、W、X、Y、Z是原子序数依次增大的短周期元素,X的焰色反应呈黄色,则X为Na元素;Q元素的原子最外层电子数是其内层电子数的2倍,Q元素原子有2个电子层,核外电子排布是2、4,Q原子的最外层电子数为4,故Q为C元素;W、Z最外层电子数相同,说明二者处于同一主族,Z的核电荷数是W的2倍,故W为O元素,Z为S元素;元素Y的合金是日常生活中使用最广泛的金属材料之一,则Y为Al元素,然后根据元素周期律及物质的性质分析解答。
【详解】根据上述分析可知:Q是C,W是O,X是Na,Y是Al,Z是S元素。
A.原子核外电子层数越多原子半径越大;同一周期元素的原子半径随原子序数的增大而减小,所以上述五种元素的原子半径大小关系为:X(Na)>Y(Al)>Q(C)>W(O),A错误;
B.Q是C,Z是S元素,C、S都是非金属元素,C原子与2个S原子形成四对共用电子对,原子之间以共价键结合,故二者形成的化合物CS2属于共价化合物,B错误;
C.Q是C,W是O,若二者形成的不是最简单的氢化物,则相应的氢化物的稳定性不一定是W>Q,如CH4比较稳定,受热不分解;而H2O2不稳定,加热分解产生H2O、O2,C错误;
D.X是Na,Y是Al,二者是活泼的金属元素,不能使用一般的还原剂将它们从化合物中还原出来,只能通过电解熔融的NaCl、Al2O3的方法制取相应的Na、Al等金属单质,D正确;
故合理选项是D。
3.C
【详解】A.溶液和NaOH溶液反应,开始就能生成碳酸钡沉淀,故不选A;
B.溶液中滴入石灰水,开始就生成碳酸钙沉淀,故不选B;
C.KOH溶液滴入溶液中,先发生酸碱中和,没有沉淀产生,后来才生成氢氧化镁沉淀,符合图像特征,故选C;
D.稀硫酸中滴入溶液,开始时,酸不足,立即生成了氢氧化铝沉淀,再滴稀硫酸,沉淀溶解,与图像不符,故不选D。
选C。
4.C
【分析】由“X、Y、W的最外层电子数之和为15”及图中相对位置,可确定X、W、Y的最外层电子数依次递增,则三者的最外层电子数分别为4、5、6,由此确定X为碳、W为磷、Y为氧,从而确定Z为镁。
【详解】A.同周期自左向右原子半径逐渐减小,同主族从上到下原子半径逐渐增大,则原子半径:r(Z)>r(W)>r(X)>r(Y),A不正确;
B.若X的氢化物为苯,沸点比Y的氢化物水的沸点高,B不正确;
C.高温条件下,Mg与CO2反应,可以置换出碳(C),C正确;
D.X元素的单质有金刚石、石墨、C60等,D不正确。
故选C。
5.D
【分析】X、Y、Z、W为短周期元素可知,其为二、三周期元素,X、W为同族元素,且W元素原子的核电荷数为X元素的2倍,则X为O,W为S,Y、Z分别为Si、P,T为Si的同族元素Ge,根据表格信息可推断X、Y、Z、W、T分别为O、Si、P、S、Ge;
【详解】A.Si的最高价氧化物的水化物为硅酸,是弱酸,A错误;
B.根据元素周期律,同主族从上到下离子半径依次增大,B错误;
C.元素的非金属性越强,氢化物越稳定,同周期从左到右,元素的非金属性增强,C错误;
D.T元素处于金属和非金属的分界线,具有半导体的特性,D正确;
故答案为:D。
6.C
【详解】A.一个葡萄糖分子中含有5个羟基,18g葡萄糖为0.1mol,含有羟基数为0.5mol,A错误;
B.标准状况下,正戊烷不是气体,11.2L正戊烷的物质的量远大于0.5mol,含有的分子数大于0.5mol,B错误;
C.乙烯和环丙烷的最简式都是CH2,28g两者的混合物含有2molCH2,含有的氢原子数为4mol,C正确;
D.一个-14CD3中含有11个中子和9个电子,1mol甲基(-14CD3)含有11mol中子和9mol电子,D错误;
故答案选C。
7.D
【详解】A.HCl属于共价化合物,用电子式表示HCl的形成过程为,A项错误;
B.Na2O属于离子化合物,电子式中两个Na+不能合并书写,用电子式表示Na2O的形成过程为,B项错误;
C.MgF2属于离子化合物,用电子式表示MgF2的形成过程为,C项错误;
D.H2O属于共价化合物,用电子式表示H2O的形成过程为,D项正确;
答案选D。
8.D
【详解】A.的摩尔质量为216g/mol,A错误;
B.和石墨互为同素异形体,是两种不同的单质,二者不可能具有相同的性质,B错误;
C.和均是碳原子组成的不同单质,等质量的和含有的原子数相同,C错误;
D.与金刚石均是碳元素形成的不同单质,二者互为同素异形体,D正确;
答案选D。
9.A
【详解】A.NaClO具有强氧化性,能使蛋白质变性,能杀菌消毒,常用作环境消杀剂,故A正确;
B.氧化铝熔点高,可用作耐火材料,氧化铝可用于电解冶炼铝与其熔点高无关,故B错误;
C.FeCl3能够加快过氧化氢分解速率,与其易溶于水无因果关系,故C错误;
D.Al(OH)3不能燃烧、分解吸热,并且生成的水和氧化铝可隔绝空气,所以Al(OH)3可用作塑料制品的阻燃剂,与其具有两性无关,故D错误;
故选A。
10.A
【分析】科学家研制出了一种漂白效率极高的新型漂白剂(结构如图所示),其中W、X、Y、Z均为短周期元素且原子序数依次增大。常温下,0.1mol/LZ的氢化物的水溶液pH=1,则Z为Cl元素;Y形成2个共价键,位于ⅥA族,且Z与Y位于不同周期,则Y为O;W形成4个共价键,其原子序数小于O,则W为C元素;X形成3个共价键,位于ⅤA族,其原子序数小于O,则X为N元素,据此解答。
【详解】根据分析可知,W为C,X为N,Y为O,Z为Cl元素;
A.同一周期从左向右原子半径逐渐减小,原子半径:W>X>Y,故A正确;
B.C的氢化物为烃,碳原子数较多的烃常温下为固态,其沸点大于氨气和水,故B错误;
C.N的氧化物的水化物有硝酸和亚硝酸,亚硝酸为弱酸,故C错误;
D.O元素的单质有氧气和臭氧,臭氧具有强氧化性,能够杀菌消毒,但氧气不具有杀菌消毒作用,故D错误;
故答案为A。
11.B
【分析】C最高价为+6,则C是S元素;D为+1价,半径大于S,所以D是Na元素;B为+4价,半径小于S,所以B是C元素;A是+1价,半径小于C,所以A是H元素。
【详解】A. CS2中C原子采用sp杂化,分子为直线型,故A错误;
B. C的非金属性小于S,所以氢化物的稳定性CH4C. Na2S是强碱弱酸盐,水溶液显碱性,故C错误;
D. 碳在氧气中燃烧可以生成CO或CO2,na在氧气中燃烧可以生成氧化钠害过氧化钠,故D错误;
选B。
12.D
【详解】A.氯水过量,溶液变蓝色可能是氯水将碘离子氧化为碘单质,所以不能证明氧化性,A错误;
B.用洁净的铂丝蘸取溶液进行焰色试验,火焰呈黄色,说明其中含有,但由于并没有通过蓝色钴玻璃进行观察,因此不能确定溶液中是否含有,B错误;
C.硫酸亚铁溶液中加KSCN溶液变红色,说明有铁离子存在,能说明亚铁离子被氧化,但不能说明亚铁离子完全被氧化,C错误;
D.被氯水氧化成I2,碘单质的,显紫色,D正确;
故选D。
13. GaCl3+3NH3·H2O=Ga(OH)3↓+3NH4Cl 弱 d
【分析】(1)由AlCl3与NH3·H2O的反应可推出化学方程式;
(2)依据元素周期律推理出Al和Ba的的金属性强弱;从化学平衡移动的观点分析此反应发生的原因;
【详解】(1)镓的氯化物与氨水反应生成氯化铵和氢氧化镓,化学方程式为GaCl3+3NH3·H2O=Ga(OH)3↓+3NH4Cl;
答案为:GaCl3+3NH3·H2O=Ga(OH)3↓+3NH4Cl;
(2) 依据元素周期律: Al的金属性弱于Mg,Mg的金属性弱于Ba,则Al的金属性比Ba的金属性弱;对反应2Al+4BaO3Ba↑+BaO·Al2O3,利用Ba的沸点比Al的低,Ba以气态方式离开反应体系,使化学平衡得以向正反应方向进行;
答案为:弱 ;d。
【点睛】有些很活泼的金属也可以用还原法来冶炼,如Na+KClK↑+NaCl;2RbCl+MgMgCl2+2Rb↑等,主要运用了化学平衡移动原理,利用K、Rb沸点低,使更活泼的金属离开反应体系,使化学反应得以向正反应方向进行。
14.(1)强弱(或大小)
(2)“位置—结构—性质”
(3)原子结构和性质
(4) 半导体材料 氟、氯、硫、磷 过渡元素
【详解】(1)根据同周期、同主族元素性质的递变规律判断元素性质的金属性(或非金属性)的强弱(或大小);
(2)应用于元素“结构——位置——性质”的相互推断;
(3)预测新元素:为新元素的发现及预测它们的原子结构和性质提供线索;
(4)①在金属与非金属分界线附近的元素既表现出一定的金属性,又表现出一定的非金属性,可以寻找半导体材料;
②通常制造的农药,所含有的氟、氯、硫、磷等在周期表中的位置靠近,则研究非金属附近元素,制造新农药;
③在过渡元素中寻找催化剂和耐高温、耐腐蚀的合金材料。
15. 硼 K>Mg>Cl Cl->K+>Mg2+ 18 离子键、(非极性)共价键 2Na2O2+2CO2=2Na2CO3+O2
【分析】由元素在周期表的位置可知,a~m 13种元素分别为He、B、C、O、Na、Mg、Si、P、Cl、K、As、Kr、Xe,结合原子结构和元素化合物的性质和元素周期律分析解答。
【详解】(1)b的名称为硼,g为Si,原子序数为14,其原子结构示意图为,故答案为:硼;;
(2)同一周期,从左到右,原子半径逐渐减小;同一主族,从上到下,原子半径逐渐增大,元素f、i、j的原子半径从大到小的顺序是K>Mg>Cl;一般而言,电子层数越多,半径越大,电子层数相同,原子序数越大,半径越小,三种原子分别形成简单离子后,离子半径从大到小的顺序是Cl->K+>Mg2+,故答案为:K>Mg>Cl;Cl->K+>Mg2+;
(3)h为P元素,是15号元素,k为As元素,原子序数为33,原子序数相差为33-15=18,故答案为:18;
(4)d为O元素,e为Na元素,二者形成的一种化合物为淡黄色固体为过氧化钠,其电子式为,含有的化学键为离子键、(非极性)共价键,c的最高价氧化物为CO2,过氧化钠与二氧化碳反应的化学方程式为2Na2O2+2CO2=2Na2CO3+O2,故答案为:;离子键、(非极性)共价键;2Na2O2+2CO2=2Na2CO3+O2。
【点睛】本题的易错点为(3),解答本小题也可以根据元素周期表的结构分析解答,元素周期表中第四周期有18种元素,因此h和k的原子序数相差18。
16.(1)VIA
(2)小于
(3)强
(4)H2S
(5)同素异形体
【解析】(1)
Z元素为S元素,其原子核外有3个电子层,最外层有6个电子,位于周期表ⅥA族;
(2)
S、Si原子核外均有3个电子层,S的核电荷数大于Si,故原子半径:S<Si,故此处填:小于;
(3)
Cl位于S右侧,得电子能力比S强,故非金属性:Cl>S,故此处填:强;
(4)
S元素最低价为-2价,故其气态氢化物为H2S;
(5)
红磷与白磷属于同种元素形成的不同单质,两者互为同素异形体关系。
17. 三 I A 2Na+2H2O=2Na++2OH-+H2↑ A、B H2O2 H2O2+CN-+OH-=CO32-+NH3
【详解】X、Y和Z均为短周期元素,原子序数依次增大,X的单质为密度最小的气体,则X是H元素;Y原子最外层电子数是其周期数的三倍,最外层电子数不超过8个,第一电子层为最外层不超过2个,则Y是O元素;Z与X原子最外层电子数相同,且原子序数大于Y,则Z为Na元素。
(1)根据上面的分析可知,Z为Na元素,位于周期表中第三周期第ⅠA族;钠与水反应生成氢氧化钠和氢气,反应的离子方程式为:2Na+2H2O=2Na++2OH-+H2↑;
(2)由H、O、Na三种元素组成的化合物为NaOH,氢氧化钠为离子化合物,NaOH既含有离子键,也含有极性共价键,则A、B正确;
(3)X和Y组成的化合物中,既含有极性共价键又含有非极性共价键的物质是过氧化氢,过氧化氢还可将碱性工业废水中的CN-氧化为可溶性碳酸盐和氨,根据电子守恒、电荷守恒及原子守恒,可得反应的离子方程式为:H2O2+ CN-+ OH-= CO32-+ NH3。
18.在含有多个电子的原子里,电子分别在能量不同的区域内运动,核外电子是分层排布的。
【详解】从图片可看出在含有多个电子的原子里,电子分别在能量不同的区域内运动,核外电子是分层排布的。
19. N ②<⑥ ③>⑤ Mg+2H+=H2↑+Mg2+
【详解】结合元素周期表的结构可知,①为氮元素、②为氧元素、③为钠元素、④为镁元素、⑤为铝元素、⑥为硫元素;
(1)①为氮元素,元素符号是N;
(2)②和⑥是同主族元素,核电荷数越大,原子半径越大,则两种元素的原子半径大小关系:②<⑥;
(3)③和⑤为同周期主族元素,随核电荷数的增大,元素金属性减弱,则两种元素的金属性强弱关系:③>⑤;
(4)④的单质为Mg,⑥的最高价氧化物对应的水化物为硫酸,则二者发生置换反应的离子方程式为Mg+2H+=H2↑+Mg2+。
20. ③④⑤⑧ ⑥⑦⑨⑩ 分液漏斗 HClO4 Na2SiO3
【详解】I.(1)共价化合物是指只含有共价键的化合物,离子化合物是指含有离子键的化合物,可能含有共价键,在①石墨;②铝;③葡萄糖;④氨气;⑤二硫化碳;⑥硫酸铁固体;⑦氢氧化钡;⑧氯化氢气体;⑨K2CO3;⑩NaHSO4中①②是单质,③④⑤⑧是共价化合物,⑥⑦⑨⑩是离子化合物,故答案为:③④⑤⑧;⑥⑦⑨⑩;
(2)⑤是二硫化碳,其电子式为;⑩是盐,是强电解质,在水中的电离方程式:,故答案为: V;;
Ⅱ.(1)仪器A是分液漏斗;故答案为:分液漏斗;
(2) 用如图设计实验验证Cl、C、Si的非金属性的变化规律,可以利用最高价氧化物对应水化物的酸性来判断HClO4>H2CO3>H2SiO3的酸性强弱顺序,从而得出非金属性强弱顺序为Cl>C>Si,所以A、B、C中所盛试剂分别为HClO4、Na2CO3、Na2SiO3,所以A、C中所装药品分别为HClO4、Na2SiO3,故答案为:HClO4、Na2SiO3。
【点睛】本题考查离子化合物,共价化合物等基本概念,考查非金属性比较的依据,知识较简单,考查学生对基础知识的掌握程度。
答案第1页,共2页
答案第1页,共2页
一、单选题(共12题)
1.下列实验过程中曲线变化正确的是( )
A.表示Na2CO3溶液中滴入稀盐酸
B.表示溴水中滴入Na2SO3溶液
C. 表示AgNO3溶液中滴入氨水
D. 表示一定条件下2SO2+O2 2SO3达平衡后,升高温度
2.Q、W、X、Y、Z是原子序数依次增大的短周期元素,X的焰色反应呈黄色。Q元素的原子最外层电子数是其内层电子数的2倍。W、Z最外层电子数相同,Z的核电荷数是W的2倍。元素Y的合金是日常生活中常用的金属材料。下列说法正确的是
A.原子半径的大小顺序:X>Y>W>Q
B.元素Q和Z能形成QZ2型的离子化合物
C.Q、W的氢化物的稳定性一定W>Q
D.工业上常用电解的方法制备X、Y的单质
3.将溶液(或气体)X逐渐加入(或通入)到一定量Y溶液中,产生沉淀的质量与加入X的物质的量关系如图,符合图中情况的一组物质是
X Y
A 溶液 NaOH溶液
B 溶液 石灰水
C KOH溶液 溶液
D 稀硫酸 溶液
A.A B.B C.C D.D
4.短周期主族元素X、Y、Z、W在周期表中的相对位置如图所示,其中X、Y、W的最外层电子数之和为15,Z和X的最外层电子数相差2,下列说法正确的是
X Y
Z W
A.原子半径:r(Z)>r(W)>r(Y)>r(X) B.X的氢化物的沸点一定比Y的氢化物的沸点低
C.一定条件下,Z可以置换出X D.X、Y元素的单质均只有2种
5.图为元素周期表的一部分,其中X、Y、Z、W为短周期元素,W元素原子的核电荷数为X元素的2倍。下列说法正确的是
A.Y的最高价氧化物的水化物为强酸
B.简单离子半径大小:X>W
C.简单氢化物的稳定性:Z>W
D.根据元素周期律,可以推测T元素的单质具有半导体特性
6.设NA为阿伏加德罗常数的值,下列说法正确的是
A.18g葡萄糖中含有的羟基数为0.6NA
B.标准状况下,11.2L正戊烷所含的分子数为0.5NA
C.常温常压下,28g乙烯和环丙烷的混合物中含有的氢原子数为4NA
D.1mol甲基(-14CD3)所含的中子数和电子数分别为11NA、10NA
7.前四周期主族元素的单质及其化合物在生产、生活中应用广泛。部分元素在周期表中位置如图。
下列用电子式表示的形成过程正确的是
A.用电子式表示HCl的形成过程:
B.用电子式表示Na2O的形成过程:
C.用电子式表示MgF2的形成过程:
D.用电子式表示H2O的形成过程:
8.2019年科学家们合成了具有半导体特性的环状分子,其合成方法的示意图如下:
下列说法正确的是
A.的摩尔质量为216
B.和石墨具有相同的性质
C.等质量的和含有的原子数不同
D.与金刚石互为同素异形体
9.下列有关物质的性质与用途具有对应关系的是
A.NaClO能使蛋白质变性,可用作环境消杀剂
B.氧化铝熔点高,可用作电解冶炼铝的原料
C.FeCl3易溶于水,可用作H2O2分解的催化剂
D.Al(OH)3具有两性,可用作塑料制品的阻燃剂
10.科学家研制出了一种漂白效率极高的新型漂白剂(结构如图所示),其中 W、X、Y、Z均为短周期元素且原子序数依次增大。常温下,0.1 mol/L Z 的氢化物的水溶液中c(H+)=0.1mol/L,且 Z 与 Y 位于不同周期。下列叙述正确的是
A.原子半径:W> X> Y
B.氢化物的沸点: X>Y> Z> W
C.X的氧化物的水化物是强酸
D.Y的单质均具有杀菌消毒作用
11.A、B、C、D四种短周期元素,其原子半径及最高正化合价如下表所示,C与D两原子的电子层数相同,下列说法正确的是:
A B C D
原子半径(nm) 0.053 0.077 0.102 0.186
最高正化合价 +1 +4 +6 +1
A.BC2分子呈折线型 B.B与C形成氢化物的稳定性B
12.由实验操作和现象,可得出相应正确结论的是
实验操作 现象 结论
A 向NaBr溶液中滴加过量氯水,再加入淀粉KI溶液 先变橙色,后变蓝色 氧化性:
B 用洁净的铂丝蘸取溶液进行焰色试验 火焰呈黄色 原溶液中有钠离子,无
C 取少许溶于水,加入几滴KSCN溶液 溶液变红色 全部被氧化
D 向无色溶液中滴加氯水和,振荡,静置 下层呈紫色 原溶液中有
A.A B.B C.C D.D
二、填空题(共8题)
13.金属铝质轻且有良好的防腐蚀性,在国防工业中有非常重要的应用。
完成下列填空:
(1)镓(Ga)与铝同主族,镓的氯化物与氨水反应的化学方程式: 。
(2)用铝和金属氧化物反应制备金属单质是工业上较常用的方法。如:2Al+4BaO3Ba↑+BaO·Al2O3
常温下Al的金属性比Ba的金属性 (填“强”或“弱”)。利用上述方法可制取Ba的主要原因是 。
a.高温时Al的活泼性大于Ba
b.高温有利于BaO分解
c.高温时BaO·Al2O3比Al2O3稳定
d.Ba的沸点比Al的低
14.元素周期表和元素周期律的应用
(1)根据同周期、同主族元素性质的递变规律判断元素性质的 。
(2)应用于 元素的相互推断。
(3)预测新元素
为新元素的发现及预测它们的 提供线索。
(4)寻找新物质
①在金属与非金属分界线附近寻找 。
②研究 附近元素,制造新农药。
③在 中寻找催化剂和耐高温、耐腐蚀的合金材料。
15.下表列出了a~m 13种元素在周期表(已省略了过渡元素)中的位置:
族 周期 ⅠA 0
1 ⅡA ⅢA ⅣA ⅤA ⅥA ⅦA a
2 b c d
3 e f g h i
4 j k l
5 m
(1)元素b为 (填名称);画出g的原子结构示意图 。
(2)元素f、i、j的原子半径从大到小的顺序是 (用元素符号表示);这三种原子分别形成简单离子后,离子半径从大到小的顺序是 (用离子符号表示)。
(3)h和k的原子序数相差 (填数字)。
(4)元素d和e形成的一种化合物为淡黄色固体,该化合物的电子式为 ,该化合物中化学键有 ,该化合物与c的最高价氧化物反应的化学方程式为 。
16.下图是元素周期表的一部分,请回答下列问题:
2 ... N O F Ne
3 ... P Z Cl Ar
(1)Z元素在元素周期表中位于第 族。
(2)Z的原子半径 (填“大于”“小于”或“等于”)Si的原子半径。
(3)Cl元素的非金属性比Z元素的 (填“强”或“弱”)。
(4)Z元素的气态氢化物的化学式为 。
(5)P(红磷)与P4(白磷)是由同种元素组成的不同种物质,二者互为 (填“同素异形体”“同分异构体”或“同位素”)。
17.X、Y和Z均为短周期元素,原子序数依次增大,X的单质为密度最小的气体,Y原子最外层电子数是其周期数的三倍,Z与X原子最外层电子数相同。回答下列问题:
(1)Z元素位于周期表第 周期,第 族。Z单质与水反应的离子方程式为 。
(2)由、X、Y、Z三种元素组成的化合物中,含有的化学键类型有 (填字母)
A.离子键 B.极性共价键 C.非极性共价键
(3)X和Y组成的化合物中,既含有极性共价键又含有非极性共价键的是 (填化学式),此化合物可将碱性工业废水中的CN-氧化为可溶性碳酸盐和氨,相应的离子方程式为 。
18.1913年,玻尔提出氢原子模型,电子在线性轨道上绕核运行,然而到了1926年,玻尔建立的线性轨道模型被量子力学推翻。量子力学指出,一定空间运动状态的电子并不在玻尔假定的线性轨道上运行,而在核外空间各处都可能出现,但出现的概率不同,即只能用统计的观点指出它在原子核外空间某处出现机会的多少。下图为多电子原子在核外空间出现的概率图:
问题:仔细观察图片,你有什么发现?
19.下表是元素周期表的一部分,除标出的元素外,表中的每个编号代表一种元素,请根据要求回答问题:
ⅠA 0
1 ⅡA ⅢA ⅣA ⅤA ⅥA ⅦA
2 B ① ② Ne
3 ③ ④ ⑤ Si ⑥
(1)①的元素符号是
(2)②和⑥两种元素的原子半径大小关系: (填“>”或“<”);
(3)③和⑤两种元素的金属性强弱关系: (填“>”或“<”);
(4)④的单质与⑥的最高价氧化物对应的水化物的稀溶液反应的离子方程式: 。
20.I.有以下物质:①石墨;②铝;③葡萄糖;④氨气;⑤二硫化碳;⑥硫酸铁固体;⑦氢氧化钡;⑧氯化氢气体;⑨K2CO3;⑩NaHSO4
(1)属于共价化合物的有 (填写编号,下同);属于离子化合物的有 。
(2)写出⑤的电子式: ;写出⑩在水中的电离方程式: 。
II.利用如图装置可验证非金属元素的非金属性的变化规律
(1)仪器A的名称为
(2)请选择合适药品设计实验验证Cl、C、Si的非金属性的变化规律;装置A、C中所装药品分别为 、 (填化学式)。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.B
【详解】A、碳酸钠和少量的盐酸之间反应生成氯化钠和碳酸氢钠,开始不会产生气体,故A错误;
B、溴单质具有氧化性,溴水中滴入溶液,溴水中的溴单质能将亚硫酸钠氧化为硫酸钠,并且会生成强酸HBr,所以酸性增强;随着溶液的滴入,当氧化性的溴单质消耗掉,到最后相当于将之稀释,酸性减弱,pH增大,故B正确;
C、硝酸银中加入少量氨水,生成氢氧化银白色沉淀,继续滴加,沉淀消失,得到银氨溶液,故C错误;
D、是放热的,升高温度,化学反应速率加快,平衡逆向移动,即逆反应速率大于正反应速率,故D错误;
故选:B。
2.D
【分析】Q、W、X、Y、Z是原子序数依次增大的短周期元素,X的焰色反应呈黄色,则X为Na元素;Q元素的原子最外层电子数是其内层电子数的2倍,Q元素原子有2个电子层,核外电子排布是2、4,Q原子的最外层电子数为4,故Q为C元素;W、Z最外层电子数相同,说明二者处于同一主族,Z的核电荷数是W的2倍,故W为O元素,Z为S元素;元素Y的合金是日常生活中使用最广泛的金属材料之一,则Y为Al元素,然后根据元素周期律及物质的性质分析解答。
【详解】根据上述分析可知:Q是C,W是O,X是Na,Y是Al,Z是S元素。
A.原子核外电子层数越多原子半径越大;同一周期元素的原子半径随原子序数的增大而减小,所以上述五种元素的原子半径大小关系为:X(Na)>Y(Al)>Q(C)>W(O),A错误;
B.Q是C,Z是S元素,C、S都是非金属元素,C原子与2个S原子形成四对共用电子对,原子之间以共价键结合,故二者形成的化合物CS2属于共价化合物,B错误;
C.Q是C,W是O,若二者形成的不是最简单的氢化物,则相应的氢化物的稳定性不一定是W>Q,如CH4比较稳定,受热不分解;而H2O2不稳定,加热分解产生H2O、O2,C错误;
D.X是Na,Y是Al,二者是活泼的金属元素,不能使用一般的还原剂将它们从化合物中还原出来,只能通过电解熔融的NaCl、Al2O3的方法制取相应的Na、Al等金属单质,D正确;
故合理选项是D。
3.C
【详解】A.溶液和NaOH溶液反应,开始就能生成碳酸钡沉淀,故不选A;
B.溶液中滴入石灰水,开始就生成碳酸钙沉淀,故不选B;
C.KOH溶液滴入溶液中,先发生酸碱中和,没有沉淀产生,后来才生成氢氧化镁沉淀,符合图像特征,故选C;
D.稀硫酸中滴入溶液,开始时,酸不足,立即生成了氢氧化铝沉淀,再滴稀硫酸,沉淀溶解,与图像不符,故不选D。
选C。
4.C
【分析】由“X、Y、W的最外层电子数之和为15”及图中相对位置,可确定X、W、Y的最外层电子数依次递增,则三者的最外层电子数分别为4、5、6,由此确定X为碳、W为磷、Y为氧,从而确定Z为镁。
【详解】A.同周期自左向右原子半径逐渐减小,同主族从上到下原子半径逐渐增大,则原子半径:r(Z)>r(W)>r(X)>r(Y),A不正确;
B.若X的氢化物为苯,沸点比Y的氢化物水的沸点高,B不正确;
C.高温条件下,Mg与CO2反应,可以置换出碳(C),C正确;
D.X元素的单质有金刚石、石墨、C60等,D不正确。
故选C。
5.D
【分析】X、Y、Z、W为短周期元素可知,其为二、三周期元素,X、W为同族元素,且W元素原子的核电荷数为X元素的2倍,则X为O,W为S,Y、Z分别为Si、P,T为Si的同族元素Ge,根据表格信息可推断X、Y、Z、W、T分别为O、Si、P、S、Ge;
【详解】A.Si的最高价氧化物的水化物为硅酸,是弱酸,A错误;
B.根据元素周期律,同主族从上到下离子半径依次增大,B错误;
C.元素的非金属性越强,氢化物越稳定,同周期从左到右,元素的非金属性增强,C错误;
D.T元素处于金属和非金属的分界线,具有半导体的特性,D正确;
故答案为:D。
6.C
【详解】A.一个葡萄糖分子中含有5个羟基,18g葡萄糖为0.1mol,含有羟基数为0.5mol,A错误;
B.标准状况下,正戊烷不是气体,11.2L正戊烷的物质的量远大于0.5mol,含有的分子数大于0.5mol,B错误;
C.乙烯和环丙烷的最简式都是CH2,28g两者的混合物含有2molCH2,含有的氢原子数为4mol,C正确;
D.一个-14CD3中含有11个中子和9个电子,1mol甲基(-14CD3)含有11mol中子和9mol电子,D错误;
故答案选C。
7.D
【详解】A.HCl属于共价化合物,用电子式表示HCl的形成过程为,A项错误;
B.Na2O属于离子化合物,电子式中两个Na+不能合并书写,用电子式表示Na2O的形成过程为,B项错误;
C.MgF2属于离子化合物,用电子式表示MgF2的形成过程为,C项错误;
D.H2O属于共价化合物,用电子式表示H2O的形成过程为,D项正确;
答案选D。
8.D
【详解】A.的摩尔质量为216g/mol,A错误;
B.和石墨互为同素异形体,是两种不同的单质,二者不可能具有相同的性质,B错误;
C.和均是碳原子组成的不同单质,等质量的和含有的原子数相同,C错误;
D.与金刚石均是碳元素形成的不同单质,二者互为同素异形体,D正确;
答案选D。
9.A
【详解】A.NaClO具有强氧化性,能使蛋白质变性,能杀菌消毒,常用作环境消杀剂,故A正确;
B.氧化铝熔点高,可用作耐火材料,氧化铝可用于电解冶炼铝与其熔点高无关,故B错误;
C.FeCl3能够加快过氧化氢分解速率,与其易溶于水无因果关系,故C错误;
D.Al(OH)3不能燃烧、分解吸热,并且生成的水和氧化铝可隔绝空气,所以Al(OH)3可用作塑料制品的阻燃剂,与其具有两性无关,故D错误;
故选A。
10.A
【分析】科学家研制出了一种漂白效率极高的新型漂白剂(结构如图所示),其中W、X、Y、Z均为短周期元素且原子序数依次增大。常温下,0.1mol/LZ的氢化物的水溶液pH=1,则Z为Cl元素;Y形成2个共价键,位于ⅥA族,且Z与Y位于不同周期,则Y为O;W形成4个共价键,其原子序数小于O,则W为C元素;X形成3个共价键,位于ⅤA族,其原子序数小于O,则X为N元素,据此解答。
【详解】根据分析可知,W为C,X为N,Y为O,Z为Cl元素;
A.同一周期从左向右原子半径逐渐减小,原子半径:W>X>Y,故A正确;
B.C的氢化物为烃,碳原子数较多的烃常温下为固态,其沸点大于氨气和水,故B错误;
C.N的氧化物的水化物有硝酸和亚硝酸,亚硝酸为弱酸,故C错误;
D.O元素的单质有氧气和臭氧,臭氧具有强氧化性,能够杀菌消毒,但氧气不具有杀菌消毒作用,故D错误;
故答案为A。
11.B
【分析】C最高价为+6,则C是S元素;D为+1价,半径大于S,所以D是Na元素;B为+4价,半径小于S,所以B是C元素;A是+1价,半径小于C,所以A是H元素。
【详解】A. CS2中C原子采用sp杂化,分子为直线型,故A错误;
B. C的非金属性小于S,所以氢化物的稳定性CH4
D. 碳在氧气中燃烧可以生成CO或CO2,na在氧气中燃烧可以生成氧化钠害过氧化钠,故D错误;
选B。
12.D
【详解】A.氯水过量,溶液变蓝色可能是氯水将碘离子氧化为碘单质,所以不能证明氧化性,A错误;
B.用洁净的铂丝蘸取溶液进行焰色试验,火焰呈黄色,说明其中含有,但由于并没有通过蓝色钴玻璃进行观察,因此不能确定溶液中是否含有,B错误;
C.硫酸亚铁溶液中加KSCN溶液变红色,说明有铁离子存在,能说明亚铁离子被氧化,但不能说明亚铁离子完全被氧化,C错误;
D.被氯水氧化成I2,碘单质的,显紫色,D正确;
故选D。
13. GaCl3+3NH3·H2O=Ga(OH)3↓+3NH4Cl 弱 d
【分析】(1)由AlCl3与NH3·H2O的反应可推出化学方程式;
(2)依据元素周期律推理出Al和Ba的的金属性强弱;从化学平衡移动的观点分析此反应发生的原因;
【详解】(1)镓的氯化物与氨水反应生成氯化铵和氢氧化镓,化学方程式为GaCl3+3NH3·H2O=Ga(OH)3↓+3NH4Cl;
答案为:GaCl3+3NH3·H2O=Ga(OH)3↓+3NH4Cl;
(2) 依据元素周期律: Al的金属性弱于Mg,Mg的金属性弱于Ba,则Al的金属性比Ba的金属性弱;对反应2Al+4BaO3Ba↑+BaO·Al2O3,利用Ba的沸点比Al的低,Ba以气态方式离开反应体系,使化学平衡得以向正反应方向进行;
答案为:弱 ;d。
【点睛】有些很活泼的金属也可以用还原法来冶炼,如Na+KClK↑+NaCl;2RbCl+MgMgCl2+2Rb↑等,主要运用了化学平衡移动原理,利用K、Rb沸点低,使更活泼的金属离开反应体系,使化学反应得以向正反应方向进行。
14.(1)强弱(或大小)
(2)“位置—结构—性质”
(3)原子结构和性质
(4) 半导体材料 氟、氯、硫、磷 过渡元素
【详解】(1)根据同周期、同主族元素性质的递变规律判断元素性质的金属性(或非金属性)的强弱(或大小);
(2)应用于元素“结构——位置——性质”的相互推断;
(3)预测新元素:为新元素的发现及预测它们的原子结构和性质提供线索;
(4)①在金属与非金属分界线附近的元素既表现出一定的金属性,又表现出一定的非金属性,可以寻找半导体材料;
②通常制造的农药,所含有的氟、氯、硫、磷等在周期表中的位置靠近,则研究非金属附近元素,制造新农药;
③在过渡元素中寻找催化剂和耐高温、耐腐蚀的合金材料。
15. 硼 K>Mg>Cl Cl->K+>Mg2+ 18 离子键、(非极性)共价键 2Na2O2+2CO2=2Na2CO3+O2
【分析】由元素在周期表的位置可知,a~m 13种元素分别为He、B、C、O、Na、Mg、Si、P、Cl、K、As、Kr、Xe,结合原子结构和元素化合物的性质和元素周期律分析解答。
【详解】(1)b的名称为硼,g为Si,原子序数为14,其原子结构示意图为,故答案为:硼;;
(2)同一周期,从左到右,原子半径逐渐减小;同一主族,从上到下,原子半径逐渐增大,元素f、i、j的原子半径从大到小的顺序是K>Mg>Cl;一般而言,电子层数越多,半径越大,电子层数相同,原子序数越大,半径越小,三种原子分别形成简单离子后,离子半径从大到小的顺序是Cl->K+>Mg2+,故答案为:K>Mg>Cl;Cl->K+>Mg2+;
(3)h为P元素,是15号元素,k为As元素,原子序数为33,原子序数相差为33-15=18,故答案为:18;
(4)d为O元素,e为Na元素,二者形成的一种化合物为淡黄色固体为过氧化钠,其电子式为,含有的化学键为离子键、(非极性)共价键,c的最高价氧化物为CO2,过氧化钠与二氧化碳反应的化学方程式为2Na2O2+2CO2=2Na2CO3+O2,故答案为:;离子键、(非极性)共价键;2Na2O2+2CO2=2Na2CO3+O2。
【点睛】本题的易错点为(3),解答本小题也可以根据元素周期表的结构分析解答,元素周期表中第四周期有18种元素,因此h和k的原子序数相差18。
16.(1)VIA
(2)小于
(3)强
(4)H2S
(5)同素异形体
【解析】(1)
Z元素为S元素,其原子核外有3个电子层,最外层有6个电子,位于周期表ⅥA族;
(2)
S、Si原子核外均有3个电子层,S的核电荷数大于Si,故原子半径:S<Si,故此处填:小于;
(3)
Cl位于S右侧,得电子能力比S强,故非金属性:Cl>S,故此处填:强;
(4)
S元素最低价为-2价,故其气态氢化物为H2S;
(5)
红磷与白磷属于同种元素形成的不同单质,两者互为同素异形体关系。
17. 三 I A 2Na+2H2O=2Na++2OH-+H2↑ A、B H2O2 H2O2+CN-+OH-=CO32-+NH3
【详解】X、Y和Z均为短周期元素,原子序数依次增大,X的单质为密度最小的气体,则X是H元素;Y原子最外层电子数是其周期数的三倍,最外层电子数不超过8个,第一电子层为最外层不超过2个,则Y是O元素;Z与X原子最外层电子数相同,且原子序数大于Y,则Z为Na元素。
(1)根据上面的分析可知,Z为Na元素,位于周期表中第三周期第ⅠA族;钠与水反应生成氢氧化钠和氢气,反应的离子方程式为:2Na+2H2O=2Na++2OH-+H2↑;
(2)由H、O、Na三种元素组成的化合物为NaOH,氢氧化钠为离子化合物,NaOH既含有离子键,也含有极性共价键,则A、B正确;
(3)X和Y组成的化合物中,既含有极性共价键又含有非极性共价键的物质是过氧化氢,过氧化氢还可将碱性工业废水中的CN-氧化为可溶性碳酸盐和氨,根据电子守恒、电荷守恒及原子守恒,可得反应的离子方程式为:H2O2+ CN-+ OH-= CO32-+ NH3。
18.在含有多个电子的原子里,电子分别在能量不同的区域内运动,核外电子是分层排布的。
【详解】从图片可看出在含有多个电子的原子里,电子分别在能量不同的区域内运动,核外电子是分层排布的。
19. N ②<⑥ ③>⑤ Mg+2H+=H2↑+Mg2+
【详解】结合元素周期表的结构可知,①为氮元素、②为氧元素、③为钠元素、④为镁元素、⑤为铝元素、⑥为硫元素;
(1)①为氮元素,元素符号是N;
(2)②和⑥是同主族元素,核电荷数越大,原子半径越大,则两种元素的原子半径大小关系:②<⑥;
(3)③和⑤为同周期主族元素,随核电荷数的增大,元素金属性减弱,则两种元素的金属性强弱关系:③>⑤;
(4)④的单质为Mg,⑥的最高价氧化物对应的水化物为硫酸,则二者发生置换反应的离子方程式为Mg+2H+=H2↑+Mg2+。
20. ③④⑤⑧ ⑥⑦⑨⑩ 分液漏斗 HClO4 Na2SiO3
【详解】I.(1)共价化合物是指只含有共价键的化合物,离子化合物是指含有离子键的化合物,可能含有共价键,在①石墨;②铝;③葡萄糖;④氨气;⑤二硫化碳;⑥硫酸铁固体;⑦氢氧化钡;⑧氯化氢气体;⑨K2CO3;⑩NaHSO4中①②是单质,③④⑤⑧是共价化合物,⑥⑦⑨⑩是离子化合物,故答案为:③④⑤⑧;⑥⑦⑨⑩;
(2)⑤是二硫化碳,其电子式为;⑩是盐,是强电解质,在水中的电离方程式:,故答案为: V;;
Ⅱ.(1)仪器A是分液漏斗;故答案为:分液漏斗;
(2) 用如图设计实验验证Cl、C、Si的非金属性的变化规律,可以利用最高价氧化物对应水化物的酸性来判断HClO4>H2CO3>H2SiO3的酸性强弱顺序,从而得出非金属性强弱顺序为Cl>C>Si,所以A、B、C中所盛试剂分别为HClO4、Na2CO3、Na2SiO3,所以A、C中所装药品分别为HClO4、Na2SiO3,故答案为:HClO4、Na2SiO3。
【点睛】本题考查离子化合物,共价化合物等基本概念,考查非金属性比较的依据,知识较简单,考查学生对基础知识的掌握程度。
答案第1页,共2页
答案第1页,共2页
