化学人教版(2019)必修第一册4.2.2元素周期表和元素周期律的应用(共17张ppt)
文档属性
| 名称 | 化学人教版(2019)必修第一册4.2.2元素周期表和元素周期律的应用(共17张ppt) |

|
|
| 格式 | pptx | ||
| 文件大小 | 2.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-18 08:57:29 | ||
图片预览



文档简介
(共17张PPT)
第2节 元素周期律
第2课时 元素周期表和元素周期律
的应用
第四章
门捷列夫在他的第一张周期表 上留下的空位中的元素“类铝”于1875年由法国化学家布瓦博德朗发现,并命名为镓,而布瓦博德朗当时并未受到门捷列夫预言的启发。门捷列夫在得知这一发现后指出:他相信镓和“类铝”是同一种物质,并认为镓的密度应该是5.9~ 6.0 g/cm3,而不是布瓦博德朗发表的4.7 g/cm3。当时布瓦博德朗认为只有他本人才拥有镓,门捷列夫怎么会知道这种金属的密度呢 他没有固执已见,重新提纯了镓,最后测得的密度果然是5.94 g/cm3。这一发现使他大为惊讶,他在一篇论文中写道:“我以为没有必要再来说明]捷列夫这一-理论的巨 大意义了。”门捷列夫还预测在硅和锡之间存在一种元素——“类硅”,15年后该元素被德国化学家文克勒发现,为了纪念他的祖国,将其命名为“锗”。
【思考与讨论】教材P106
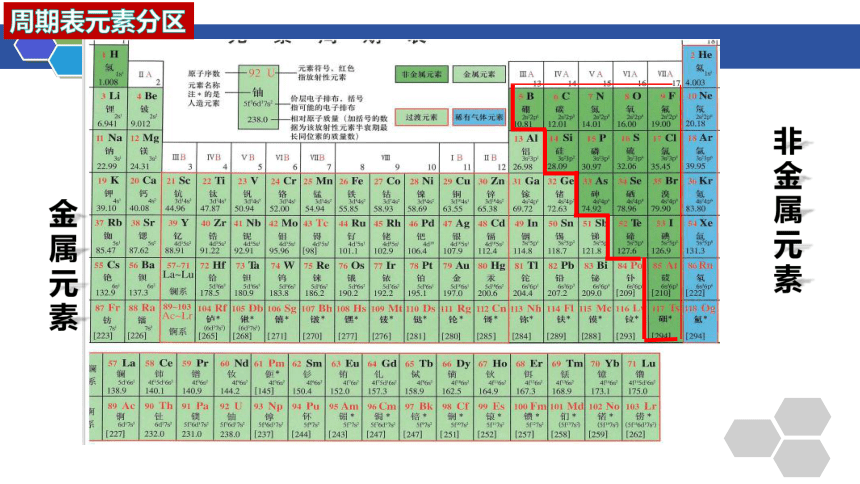
周期表元素分区
非金属元素
金属元素
1
B
Al
Si
Ge
As
Sb
Te
2
3
4
5
6
7
ⅠA
ⅡA
ⅢA
ⅣA
ⅤA
ⅥA
ⅦA
0
Po
At
非金属区
金属区
稀
有
气
体
元
素
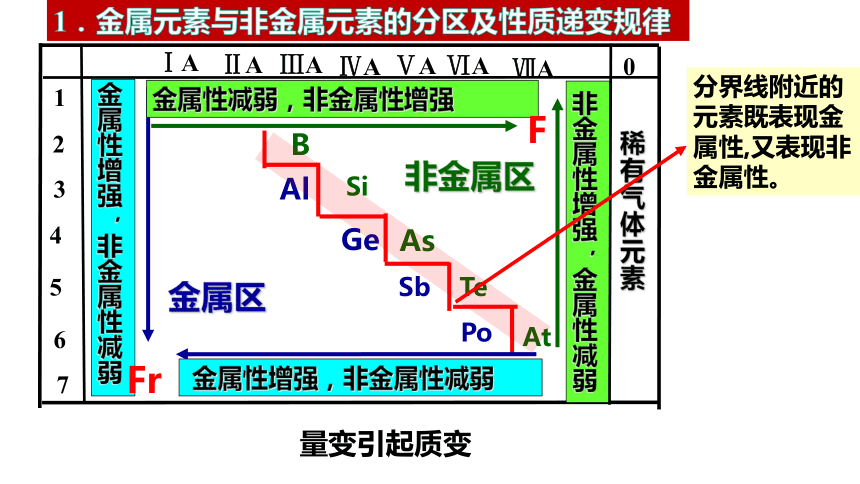
金属性增强,非金属性减弱
非金属性增强,金属性减弱
金属性减弱,非金属性增强
金属性增强,非金属性减弱
Fr
F
1.金属元素与非金属元素的分区及性质递变规律
分界线附近的元素既表现金属性,又表现非金属性。
量变引起质变
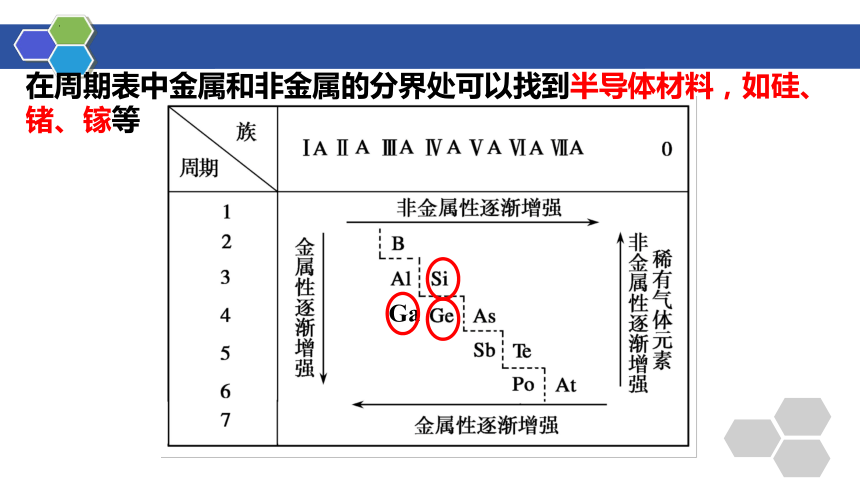
在周期表中金属和非金属的分界处可以找到半导体材料,如硅、锗、镓等
Ga
→
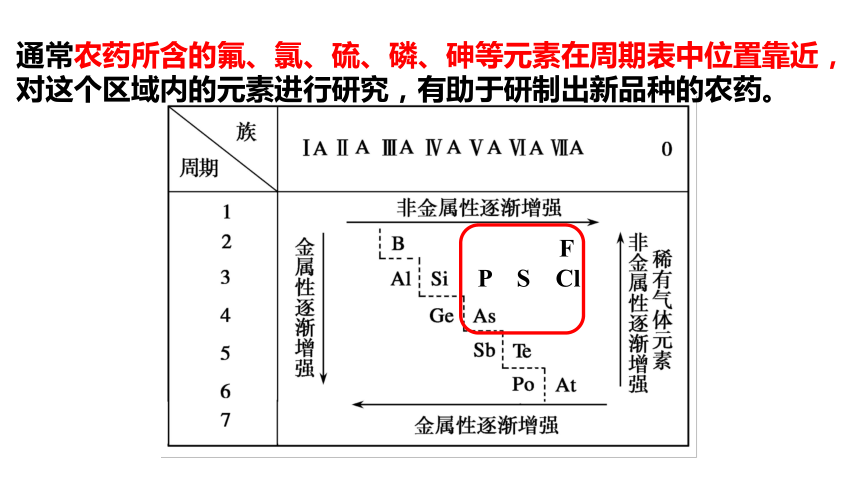
F
P S Cl
通常农药所含的氟、氯、硫、磷、砷等元素在周期表中位置靠近,对这个区域内的元素进行研究,有助于研制出新品种的农药。
科学家还在过渡元素中寻找耐高温、耐腐蚀的合金元素以及制造催化剂的元素。
P116[情境导入]
奥地利首都维也纳一家矿场监督缪勒是第一个提取出碲的人。1782年缪勒从一种被当地人称为“奇异金”的矿石中提取出碲。
(1)预测元素的性质
(1)Te与我们熟悉的O、S元素在元素周期表中的位置关系如何?
【答案】Te与O、S同属于第ⅥA族。
(2)碲单质是什么状态的物质?说明理由。
【答案】固态。同主族非金属单质从上到下的熔沸点升高,硫单质是固体,碲单质也是固体。
(3)碲的常见化合价有哪些?
【答案】-2、+4、+6。
(4)碲单质位于分界线,有可能是半导体吗?并说明理由。
【答案】可能是半导体。碲位于分界线附近,具有一定的金属性。
【练习】下列说法正确的是( )
A. C、N、O、F原子半径依次增大
B. NH3、H2O(g)、HF 稳定性依次增强
C. HClO比H2SO4酸性强。
D. 甲、乙两种非金属元素与金属钠反应时, 甲得电子的数目多, 故甲活泼。
B
(2)比较元素的性质
减小
元素非金属性越强,氢化物越稳定
HClO不是最高价氧化物的水化物
活泼性与得失电子数目无关,与得失电子的能力有关
P117[典例精练]
2019年是门捷列夫发现元素周期律150周年。下表是元素周期表的一部分,W、X、Y、Z为短周期主族元素,W与X的最高化合价之和为8。下列说法错误的是( )
A.原子半径:WB.常温常压下,Y单质为固态
C.气态氢化物热稳定性:ZD.X的最高价氧化物的水化物是强碱
D
W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数的变化如图。已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的非金属性在同周期元素中最强。下列说法不正确的是( )
A.对应的简单离子的半径:XB.对应的简单气态氢化物的稳定性:YC.元素X、Z和W能形成多种化合物
D.Y的最高价氧化物对应的水化物具有强酸性
D
P118页5.某短周期主族元素R的最高正价与最低负价的代数和为4,下列叙述中不正确的是( )
A.R是第ⅣA族元素
B.R的气态氢化物化学式为H2R
C.R能形成两种氧化物RO2和RO3
D.R的气态氢化物的水溶液显酸性
A
P174页6.根据下表(部分短周期元素的原子半径及主要化合价)信息,下列叙述正确的是( )
A.E2-与B3+的核外电子数不可能相等
B.离子半径:A+C.最高价氧化物对应水化物的碱性:AD.简单氢化物的稳定性:D>E
元素代号 A B C D E
原子半径/nm 0.186 0.143 0.089 0.104 0.074
主要化合价 +1 +3 +2 +6、-2 -2
均有-2价,O无正价
且原子半径:O硫元素 氧元素
钠元素 铝元素
C的半径比氧原子大,比硫原子小,应为第二周期
铍元素
B
下图是部分短周期元素化合价与原子序数的关系图,(1)X、Y、Z、W、R分别是什么元素?(5)X、Y、Z、W的离子半径大小顺序如何?(用离子符号表示)1.下图是部分短周期元素化合价与原子序数的关系图,(7)Y、Z、R的最高价氧化物的水化物可以两两反应,写出有关的离子方程式。一定含有Al元素,且有非金属元素和另一种强碱的金属元素3.有A、B、C、D、E五种原子序数小于18的元素,其特征信息如下表.
元素 编号 特征信息
A 有一种原子核内只有质子,没有中子
B L层电子数是K层的3倍
C 其阳离子与B的阴离子具有相同的电子层结构,且核电荷数与B相差3
D 最外层电子数等于电子层数,且是地壳中含量较多的元素之一
E 单质为黄绿色,可用于制造漂白粉
(1)A、B、C三种元素形成的化合物的化学式为 。
(2)由A、B、C元素中两两组合形成的化合物相互反应生成单质的化学方程式为 。
。
(3)D单质与A、E形成的化合物的水溶液反应的离子方程式为 。
(4)写出实验室制取E单质的化学方程式:
。
NaOH
2Na2O2+2H2O=4NaOH+O2↑
2Al+6H+=2Al3++3H2↑
MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O
谢谢观看
第2节 元素周期律
第2课时 元素周期表和元素周期律
的应用
第四章
门捷列夫在他的第一张周期表 上留下的空位中的元素“类铝”于1875年由法国化学家布瓦博德朗发现,并命名为镓,而布瓦博德朗当时并未受到门捷列夫预言的启发。门捷列夫在得知这一发现后指出:他相信镓和“类铝”是同一种物质,并认为镓的密度应该是5.9~ 6.0 g/cm3,而不是布瓦博德朗发表的4.7 g/cm3。当时布瓦博德朗认为只有他本人才拥有镓,门捷列夫怎么会知道这种金属的密度呢 他没有固执已见,重新提纯了镓,最后测得的密度果然是5.94 g/cm3。这一发现使他大为惊讶,他在一篇论文中写道:“我以为没有必要再来说明]捷列夫这一-理论的巨 大意义了。”门捷列夫还预测在硅和锡之间存在一种元素——“类硅”,15年后该元素被德国化学家文克勒发现,为了纪念他的祖国,将其命名为“锗”。
【思考与讨论】教材P106
周期表元素分区
非金属元素
金属元素
1
B
Al
Si
Ge
As
Sb
Te
2
3
4
5
6
7
ⅠA
ⅡA
ⅢA
ⅣA
ⅤA
ⅥA
ⅦA
0
Po
At
非金属区
金属区
稀
有
气
体
元
素
金属性增强,非金属性减弱
非金属性增强,金属性减弱
金属性减弱,非金属性增强
金属性增强,非金属性减弱
Fr
F
1.金属元素与非金属元素的分区及性质递变规律
分界线附近的元素既表现金属性,又表现非金属性。
量变引起质变
在周期表中金属和非金属的分界处可以找到半导体材料,如硅、锗、镓等
Ga
→
F
P S Cl
通常农药所含的氟、氯、硫、磷、砷等元素在周期表中位置靠近,对这个区域内的元素进行研究,有助于研制出新品种的农药。
科学家还在过渡元素中寻找耐高温、耐腐蚀的合金元素以及制造催化剂的元素。
P116[情境导入]
奥地利首都维也纳一家矿场监督缪勒是第一个提取出碲的人。1782年缪勒从一种被当地人称为“奇异金”的矿石中提取出碲。
(1)预测元素的性质
(1)Te与我们熟悉的O、S元素在元素周期表中的位置关系如何?
【答案】Te与O、S同属于第ⅥA族。
(2)碲单质是什么状态的物质?说明理由。
【答案】固态。同主族非金属单质从上到下的熔沸点升高,硫单质是固体,碲单质也是固体。
(3)碲的常见化合价有哪些?
【答案】-2、+4、+6。
(4)碲单质位于分界线,有可能是半导体吗?并说明理由。
【答案】可能是半导体。碲位于分界线附近,具有一定的金属性。
【练习】下列说法正确的是( )
A. C、N、O、F原子半径依次增大
B. NH3、H2O(g)、HF 稳定性依次增强
C. HClO比H2SO4酸性强。
D. 甲、乙两种非金属元素与金属钠反应时, 甲得电子的数目多, 故甲活泼。
B
(2)比较元素的性质
减小
元素非金属性越强,氢化物越稳定
HClO不是最高价氧化物的水化物
活泼性与得失电子数目无关,与得失电子的能力有关
P117[典例精练]
2019年是门捷列夫发现元素周期律150周年。下表是元素周期表的一部分,W、X、Y、Z为短周期主族元素,W与X的最高化合价之和为8。下列说法错误的是( )
A.原子半径:W
C.气态氢化物热稳定性:Z
D
W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数的变化如图。已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的非金属性在同周期元素中最强。下列说法不正确的是( )
A.对应的简单离子的半径:X
D.Y的最高价氧化物对应的水化物具有强酸性
D
P118页5.某短周期主族元素R的最高正价与最低负价的代数和为4,下列叙述中不正确的是( )
A.R是第ⅣA族元素
B.R的气态氢化物化学式为H2R
C.R能形成两种氧化物RO2和RO3
D.R的气态氢化物的水溶液显酸性
A
P174页6.根据下表(部分短周期元素的原子半径及主要化合价)信息,下列叙述正确的是( )
A.E2-与B3+的核外电子数不可能相等
B.离子半径:A+
元素代号 A B C D E
原子半径/nm 0.186 0.143 0.089 0.104 0.074
主要化合价 +1 +3 +2 +6、-2 -2
均有-2价,O无正价
且原子半径:O
钠元素 铝元素
C的半径比氧原子大,比硫原子小,应为第二周期
铍元素
B
下图是部分短周期元素化合价与原子序数的关系图,(1)X、Y、Z、W、R分别是什么元素?(5)X、Y、Z、W的离子半径大小顺序如何?(用离子符号表示)1.下图是部分短周期元素化合价与原子序数的关系图,(7)Y、Z、R的最高价氧化物的水化物可以两两反应,写出有关的离子方程式。一定含有Al元素,且有非金属元素和另一种强碱的金属元素3.有A、B、C、D、E五种原子序数小于18的元素,其特征信息如下表.
元素 编号 特征信息
A 有一种原子核内只有质子,没有中子
B L层电子数是K层的3倍
C 其阳离子与B的阴离子具有相同的电子层结构,且核电荷数与B相差3
D 最外层电子数等于电子层数,且是地壳中含量较多的元素之一
E 单质为黄绿色,可用于制造漂白粉
(1)A、B、C三种元素形成的化合物的化学式为 。
(2)由A、B、C元素中两两组合形成的化合物相互反应生成单质的化学方程式为 。
。
(3)D单质与A、E形成的化合物的水溶液反应的离子方程式为 。
(4)写出实验室制取E单质的化学方程式:
。
NaOH
2Na2O2+2H2O=4NaOH+O2↑
2Al+6H+=2Al3++3H2↑
MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O
谢谢观看
