高中化学必修第二册第五章《第一节 硫及其化合物》教学课件(共31张PPT)
文档属性
| 名称 | 高中化学必修第二册第五章《第一节 硫及其化合物》教学课件(共31张PPT) |  | |
| 格式 | ppt | ||
| 文件大小 | 951.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-18 09:05:40 | ||
图片预览











文档简介
(共31张PPT)
第五章第一节 硫及其化合物
(第一课时)
一、硫S
1.存在
(1)游离态(即单质):S
(2)化合态(即化合物):
硫铁矿(FeS2) 、黄铜矿(CuFeS2)、
石膏(或生石膏):CaSO4·2H2O、
熟石膏:2CaSO4·H2O、芒硝:Na2SO4·10H2O
说明:FeS 硫化亚铁(S -2价)
FeS2 二硫化亚铁(S -1价)
2.性质
(1)物理性质:俗称硫黄,黄色或淡黄色固体、质脆,易研成粉末。难溶于水、微溶于酒精、易溶于二硫化碳CS2 。
(2)化学性质
a.与非金属反应
b.与金属反应
c.与碱溶液反应
思考:能不能根据Fe、Cu与S、Cl2反应的产物判断S和Cl2的氧化性的强弱
说明:S2-与SO32-在碱性条件下可以共存,在酸性条件下不可以共存,生成硫单质
思考:如何洗涤附着在试管内壁上的硫?
用CS2或热NaOH溶液
硫黄主要用于制造硫酸、化肥、火柴及杀虫剂等,还用于制造黑火药、烟花爆竹等。
3.用途
二、二氧化硫SO2
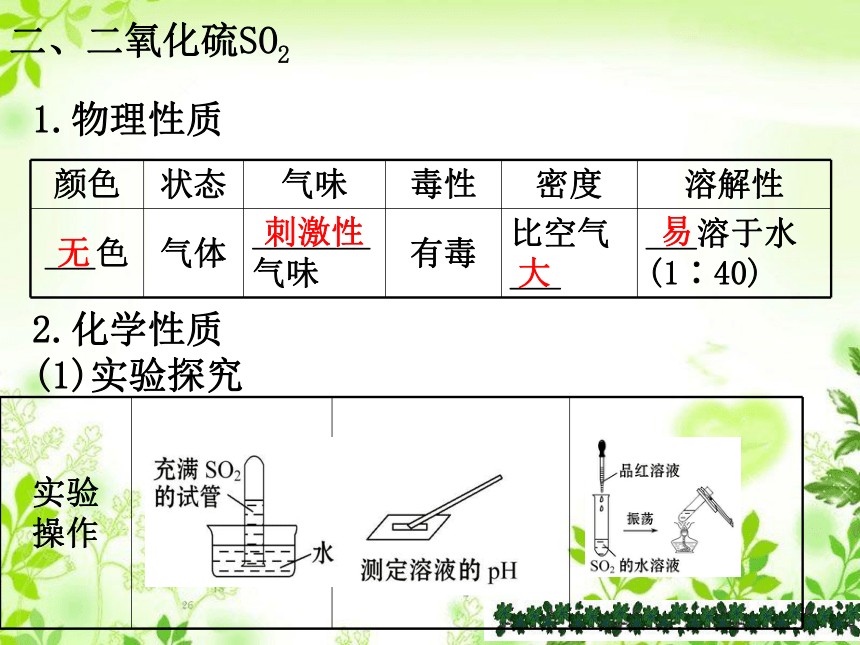
1.物理性质
颜色 状态 气味 毒性 密度 溶解性
___色 气体 _______
气味 有毒 比空气
___ ___溶于水
(1∶40)
无
刺激性
大
易
2.化学性质
(1)实验探究
实验
操作
(1) 酸性氧化物
2.化学性质
酸性氧化物、强还原性、弱氧化性和一定的漂白性
a. 与H2O反应:
【补充】可逆反应
①概念:在相同条件下,既能向正反应方向进行,
同时又能向逆反应方向进行的反应。
③特点:
a.条件相同
【思考】 氢气与氧气反应可以生成水,电解水可以得到氢气与氧气,该反应是可逆反应吗
b.同时进行(即反应物和生成物共存,各组分的浓度都大于0)
c.反应不能进行彻底
【相关习题】
2.在密闭容器中充入SO2和18O原子组成的氧气,在一定条
件下开始反应,在达到平衡前,18O存在于( )
A.只存在于氧气中 B.只存在于和SO3中
C.只存在于SO2和SO3中 D.SO2 、SO3 、O2中都有可能存在
b.与碱性氧化物反应
应用:燃煤中加石灰石CaCO3或生石灰CaO固硫。
c.与碱溶液反应
澄清石灰水:
现象:产生白色沉淀
NaOH溶液:
(类似于CO2与NaOH反应)
d. 与盐NaHCO3或Na2CO3溶液反应
思考:如何除去CO2 气体中混有的SO2气体?
饱和NaHCO3溶液,不可用Na2CO3溶液
(2)强还原性
①SO2气体通入氯水、溴水、碘水中
现象:溶液褪色
②SO2气体通入FeCl3溶液中
现象:溶液由黄色变为浅绿色
③SO2气体通入酸性KMnO4酸性溶液溶液中
现象:溶液褪色或溶液的紫红色褪去
2KMnO4+5SO2+2H2O
==K2SO4+2MnSO4+2H2SO4
④SO2气体与O2反应——SO3工业制法
⑤SO2气体通入H2O2 、Na2O2中
解题技巧:由反应推现象,答现象时涉及到气体或沉淀时一定要答出颜色的变化,对气体还应答出其气体的气味,对于有色离子参加或生成的反应,溶液的颜色也会变化,另外对于固体特别是金属参加的反应,固体会逐渐溶解)
已知铜与浓硫酸的反应为
则反应的现象应为:
铜片逐渐溶解并放出大量无色有刺激性气味的气
体,溶液由无色变为蓝色
(3)弱氧化性
SO2气体与H2S 气体混合
SO2气体通入H2S溶液(氢硫酸) 中
现象:无色溶液出现黄色沉淀或浑浊
思考:SO2气体通入Na2S溶液中是否反应?现象?
现象:无色溶液出现黄色沉淀或浑浊
(4)漂白性
SO2能使品红褪色,但受热后恢复原来的颜色
思考:某同学发现夏天爷爷买的白草帽,用了一段时间后变黄了,通过询问身边的人了解到草帽是用“硫黄熏”过的,你是否认可该说法 白草帽变黄的原因是什么
提示:“硫黄熏”这个说法不准确,漂白的原理是利用硫黄在加热条件下与氧气反应生成SO2,SO2具有漂白性,将草帽漂白,并非硫黄直接作用;SO2与有色物质结合生成无色物质,在受热(太阳光照射)等条件下分解放出SO2,又会恢复原色。
SO2的检验:
把气体通入品红溶液中,品红溶液褪色,加热后,溶液又恢复红色,说明该气体为SO2
漂白剂、漂白原理
1.氧化型
Cl2、HClO、NaClO、Ca(ClO)2、Na2O2、O3、
H2O2等物质具有强氧化性,将有色物质氧化成稳定
的无色物质,若漂白是彻底的,具有不可逆性,久
置不恢复原色。
2.加合型
SO2 与某些有色物质化合生成不稳定的无色物质,漂白不彻底,受热容易分解而使有色物质恢复原来的颜色。(具有可逆性)
说明:
①SO2使品红溶液褪色,加热后又恢复原来颜色
②SO2通入紫色石蕊试液中,溶液只变红色
(SO2不能漂白酸碱指示剂)
③SO2使氯水、溴水、酸性KMnO4溶液褪色是利用
SO2的还原性,而不是SO2的漂白性
④SO2可以使含有酚酞的氢氧化钠溶液褪色,是
因为SO2为酸性氧化物,而不是漂白性。
3.吸附型
活性炭、胶体等表面吸附有色物质,为物理变化
【思考】
1.将SO2气体和Cl2分别通入品红溶液中,再分别
加热的现象?
SO2气体通入品红溶液中,溶液褪色,再加热,
溶液恢复红色
Cl2通入品红溶液中,溶液褪色,再加热,溶液不显红色
2.等物质的量的SO2和Cl2混合后通入品红溶液中,
又会出现什么现象?
品红不褪色
3. 将SO2气体和Cl2分别通入紫色石蕊溶液的现象?
SO2气体通入紫色石蕊溶液中,溶液变红色
Cl2通入紫色石蕊溶液中,溶液先变红色后褪色
3.制备
(1)反应原理
说明:常用70%的硫酸,写离子方程式时可拆
(2)装置类型
固体+液体不需加热制气体
仪器名称:
分液漏斗 蒸馏烧瓶
(3)收集方法:
用向上排空气法收集
(4)尾气处理:
用NaOH溶液
NaOH溶液的作用:
吸收过量的二氧化硫或未反应的二氧化硫,防止污染空气
【思考】
若制取SO2过程中气体产生缓慢,实验现象不明显,但不是气密性问题,可能的原因有哪些?
①Na2SO3变质,被氧化成Na2SO4
②所用H2SO4不是浓H2SO4
4.用途
(1)制造硫酸
(2)漂白纸浆、毛、丝、草帽等
(3)杀菌消毒
(4)食品添加剂,作作食物和干果的防腐剂
【归纳总结】SO2、CO2的鉴别、检验
(1)共性:都能使澄清石灰水变浑浊
区别:SO2能使品红溶液褪色而CO2不能
(2)检验:
SO2气体用品红溶液,看能否使其褪色,必要时加热看能否再复原
CO2气体用澄清石灰水
(3)鉴别 当两瓶无色气体鉴别哪瓶是CO2气体或SO2气体
①物理方法:根据气味,有刺激性气味的气体是
SO2,无气味的气体是CO2
②用品红溶液鉴别:将两种气体分别通入品红溶液
中,能使品红溶液褪色的是SO2
③用溴水或酸性高锰酸钾溶液鉴别:将两种气体分
别通入溴水或酸性高锰酸钾溶液中,能使溴水或酸
性高锰酸钾溶液褪色的是SO2
④用H2S溶液鉴别:将两种气体分别通入H2S溶液中,
出现淡黄色浑浊的是SO2,无明显现象的是CO2
⑤用FeCl3溶液鉴别:颜色(棕黄色)变浅的是SO2,
无明显现象的是CO2
⑥用硝酸酸化的Ba(NO3)2溶液鉴别:产生白色沉淀
的是SO2,无明显现象的是CO2
说明:不可以用澄清石灰水(二者反应现象相同)、CaCl2溶液和BaCl2溶液(均不反应),但可以用Ba(NO3)2溶液鉴别。
原因:向CaCl2溶液和BaCl2溶液中通入CO2或SO2气体均不反应,但向Ba(NO3)2溶液中通入SO2气体会生成BaSO4沉淀
(4) SO2和CO2混合气体的检验
①当SO2中混有CO2气体时不影响SO2的鉴别,将混合
气体通入品红溶液中,若品红溶液褪色,则证明气
体中含有SO2。
②当CO2中混有SO2时会干扰CO2的鉴别,应先除去
SO2,方法是使气体先通过足量溴水或酸性KMnO4溶
液(除去气体中混有的SO2),再通过品红溶液
(检验SO2气体是否已被除尽),最后通入澄清
石灰水。
三、三氧化硫SO3
1.物理性质
熔点16.8℃,沸点44.8℃
所以常温常压下为无色液体,标准状况下,为无色固体。
2.化学性质——酸性氧化物
(1)与水反应
思考:将SO3加入BaCl2溶液中的现象?
(2)与碱性氧化物反应
(3)与碱溶液反应
四、硫化氢H2S
1.物理性质
无色、有臭鸡蛋气味的气体,有剧毒,是一种
大气污染物。能溶于水,其水溶液叫氢硫酸,是一
种二元弱酸。
2.化学性质
(1)与碱溶液反应
(2)具有强还原性
结论:Cl2 通入H2S水溶液后溶液酸性增强
(3)具有可燃性
作业布置:
1.对照知识点复习材料或课堂笔记认真复习记忆基础知识,特别要记忆涉及到的有关化学方程式。
3.预习必修2第五章第一节第2课时内容(硫酸
及粗盐提纯的问题)。
4.定时完成人教版地区期末试卷。
2.认真完成本节课课时训练试题。(与课件同时传到钉钉群)
第五章第一节 硫及其化合物
(第一课时)
一、硫S
1.存在
(1)游离态(即单质):S
(2)化合态(即化合物):
硫铁矿(FeS2) 、黄铜矿(CuFeS2)、
石膏(或生石膏):CaSO4·2H2O、
熟石膏:2CaSO4·H2O、芒硝:Na2SO4·10H2O
说明:FeS 硫化亚铁(S -2价)
FeS2 二硫化亚铁(S -1价)
2.性质
(1)物理性质:俗称硫黄,黄色或淡黄色固体、质脆,易研成粉末。难溶于水、微溶于酒精、易溶于二硫化碳CS2 。
(2)化学性质
a.与非金属反应
b.与金属反应
c.与碱溶液反应
思考:能不能根据Fe、Cu与S、Cl2反应的产物判断S和Cl2的氧化性的强弱
说明:S2-与SO32-在碱性条件下可以共存,在酸性条件下不可以共存,生成硫单质
思考:如何洗涤附着在试管内壁上的硫?
用CS2或热NaOH溶液
硫黄主要用于制造硫酸、化肥、火柴及杀虫剂等,还用于制造黑火药、烟花爆竹等。
3.用途
二、二氧化硫SO2
1.物理性质
颜色 状态 气味 毒性 密度 溶解性
___色 气体 _______
气味 有毒 比空气
___ ___溶于水
(1∶40)
无
刺激性
大
易
2.化学性质
(1)实验探究
实验
操作
(1) 酸性氧化物
2.化学性质
酸性氧化物、强还原性、弱氧化性和一定的漂白性
a. 与H2O反应:
【补充】可逆反应
①概念:在相同条件下,既能向正反应方向进行,
同时又能向逆反应方向进行的反应。
③特点:
a.条件相同
【思考】 氢气与氧气反应可以生成水,电解水可以得到氢气与氧气,该反应是可逆反应吗
b.同时进行(即反应物和生成物共存,各组分的浓度都大于0)
c.反应不能进行彻底
【相关习题】
2.在密闭容器中充入SO2和18O原子组成的氧气,在一定条
件下开始反应,在达到平衡前,18O存在于( )
A.只存在于氧气中 B.只存在于和SO3中
C.只存在于SO2和SO3中 D.SO2 、SO3 、O2中都有可能存在
b.与碱性氧化物反应
应用:燃煤中加石灰石CaCO3或生石灰CaO固硫。
c.与碱溶液反应
澄清石灰水:
现象:产生白色沉淀
NaOH溶液:
(类似于CO2与NaOH反应)
d. 与盐NaHCO3或Na2CO3溶液反应
思考:如何除去CO2 气体中混有的SO2气体?
饱和NaHCO3溶液,不可用Na2CO3溶液
(2)强还原性
①SO2气体通入氯水、溴水、碘水中
现象:溶液褪色
②SO2气体通入FeCl3溶液中
现象:溶液由黄色变为浅绿色
③SO2气体通入酸性KMnO4酸性溶液溶液中
现象:溶液褪色或溶液的紫红色褪去
2KMnO4+5SO2+2H2O
==K2SO4+2MnSO4+2H2SO4
④SO2气体与O2反应——SO3工业制法
⑤SO2气体通入H2O2 、Na2O2中
解题技巧:由反应推现象,答现象时涉及到气体或沉淀时一定要答出颜色的变化,对气体还应答出其气体的气味,对于有色离子参加或生成的反应,溶液的颜色也会变化,另外对于固体特别是金属参加的反应,固体会逐渐溶解)
已知铜与浓硫酸的反应为
则反应的现象应为:
铜片逐渐溶解并放出大量无色有刺激性气味的气
体,溶液由无色变为蓝色
(3)弱氧化性
SO2气体与H2S 气体混合
SO2气体通入H2S溶液(氢硫酸) 中
现象:无色溶液出现黄色沉淀或浑浊
思考:SO2气体通入Na2S溶液中是否反应?现象?
现象:无色溶液出现黄色沉淀或浑浊
(4)漂白性
SO2能使品红褪色,但受热后恢复原来的颜色
思考:某同学发现夏天爷爷买的白草帽,用了一段时间后变黄了,通过询问身边的人了解到草帽是用“硫黄熏”过的,你是否认可该说法 白草帽变黄的原因是什么
提示:“硫黄熏”这个说法不准确,漂白的原理是利用硫黄在加热条件下与氧气反应生成SO2,SO2具有漂白性,将草帽漂白,并非硫黄直接作用;SO2与有色物质结合生成无色物质,在受热(太阳光照射)等条件下分解放出SO2,又会恢复原色。
SO2的检验:
把气体通入品红溶液中,品红溶液褪色,加热后,溶液又恢复红色,说明该气体为SO2
漂白剂、漂白原理
1.氧化型
Cl2、HClO、NaClO、Ca(ClO)2、Na2O2、O3、
H2O2等物质具有强氧化性,将有色物质氧化成稳定
的无色物质,若漂白是彻底的,具有不可逆性,久
置不恢复原色。
2.加合型
SO2 与某些有色物质化合生成不稳定的无色物质,漂白不彻底,受热容易分解而使有色物质恢复原来的颜色。(具有可逆性)
说明:
①SO2使品红溶液褪色,加热后又恢复原来颜色
②SO2通入紫色石蕊试液中,溶液只变红色
(SO2不能漂白酸碱指示剂)
③SO2使氯水、溴水、酸性KMnO4溶液褪色是利用
SO2的还原性,而不是SO2的漂白性
④SO2可以使含有酚酞的氢氧化钠溶液褪色,是
因为SO2为酸性氧化物,而不是漂白性。
3.吸附型
活性炭、胶体等表面吸附有色物质,为物理变化
【思考】
1.将SO2气体和Cl2分别通入品红溶液中,再分别
加热的现象?
SO2气体通入品红溶液中,溶液褪色,再加热,
溶液恢复红色
Cl2通入品红溶液中,溶液褪色,再加热,溶液不显红色
2.等物质的量的SO2和Cl2混合后通入品红溶液中,
又会出现什么现象?
品红不褪色
3. 将SO2气体和Cl2分别通入紫色石蕊溶液的现象?
SO2气体通入紫色石蕊溶液中,溶液变红色
Cl2通入紫色石蕊溶液中,溶液先变红色后褪色
3.制备
(1)反应原理
说明:常用70%的硫酸,写离子方程式时可拆
(2)装置类型
固体+液体不需加热制气体
仪器名称:
分液漏斗 蒸馏烧瓶
(3)收集方法:
用向上排空气法收集
(4)尾气处理:
用NaOH溶液
NaOH溶液的作用:
吸收过量的二氧化硫或未反应的二氧化硫,防止污染空气
【思考】
若制取SO2过程中气体产生缓慢,实验现象不明显,但不是气密性问题,可能的原因有哪些?
①Na2SO3变质,被氧化成Na2SO4
②所用H2SO4不是浓H2SO4
4.用途
(1)制造硫酸
(2)漂白纸浆、毛、丝、草帽等
(3)杀菌消毒
(4)食品添加剂,作作食物和干果的防腐剂
【归纳总结】SO2、CO2的鉴别、检验
(1)共性:都能使澄清石灰水变浑浊
区别:SO2能使品红溶液褪色而CO2不能
(2)检验:
SO2气体用品红溶液,看能否使其褪色,必要时加热看能否再复原
CO2气体用澄清石灰水
(3)鉴别 当两瓶无色气体鉴别哪瓶是CO2气体或SO2气体
①物理方法:根据气味,有刺激性气味的气体是
SO2,无气味的气体是CO2
②用品红溶液鉴别:将两种气体分别通入品红溶液
中,能使品红溶液褪色的是SO2
③用溴水或酸性高锰酸钾溶液鉴别:将两种气体分
别通入溴水或酸性高锰酸钾溶液中,能使溴水或酸
性高锰酸钾溶液褪色的是SO2
④用H2S溶液鉴别:将两种气体分别通入H2S溶液中,
出现淡黄色浑浊的是SO2,无明显现象的是CO2
⑤用FeCl3溶液鉴别:颜色(棕黄色)变浅的是SO2,
无明显现象的是CO2
⑥用硝酸酸化的Ba(NO3)2溶液鉴别:产生白色沉淀
的是SO2,无明显现象的是CO2
说明:不可以用澄清石灰水(二者反应现象相同)、CaCl2溶液和BaCl2溶液(均不反应),但可以用Ba(NO3)2溶液鉴别。
原因:向CaCl2溶液和BaCl2溶液中通入CO2或SO2气体均不反应,但向Ba(NO3)2溶液中通入SO2气体会生成BaSO4沉淀
(4) SO2和CO2混合气体的检验
①当SO2中混有CO2气体时不影响SO2的鉴别,将混合
气体通入品红溶液中,若品红溶液褪色,则证明气
体中含有SO2。
②当CO2中混有SO2时会干扰CO2的鉴别,应先除去
SO2,方法是使气体先通过足量溴水或酸性KMnO4溶
液(除去气体中混有的SO2),再通过品红溶液
(检验SO2气体是否已被除尽),最后通入澄清
石灰水。
三、三氧化硫SO3
1.物理性质
熔点16.8℃,沸点44.8℃
所以常温常压下为无色液体,标准状况下,为无色固体。
2.化学性质——酸性氧化物
(1)与水反应
思考:将SO3加入BaCl2溶液中的现象?
(2)与碱性氧化物反应
(3)与碱溶液反应
四、硫化氢H2S
1.物理性质
无色、有臭鸡蛋气味的气体,有剧毒,是一种
大气污染物。能溶于水,其水溶液叫氢硫酸,是一
种二元弱酸。
2.化学性质
(1)与碱溶液反应
(2)具有强还原性
结论:Cl2 通入H2S水溶液后溶液酸性增强
(3)具有可燃性
作业布置:
1.对照知识点复习材料或课堂笔记认真复习记忆基础知识,特别要记忆涉及到的有关化学方程式。
3.预习必修2第五章第一节第2课时内容(硫酸
及粗盐提纯的问题)。
4.定时完成人教版地区期末试卷。
2.认真完成本节课课时训练试题。(与课件同时传到钉钉群)
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
