高中化学必修第二册第五章《第一节 硫及其化合物》ppt课件(共40张PPT)
文档属性
| 名称 | 高中化学必修第二册第五章《第一节 硫及其化合物》ppt课件(共40张PPT) |  | |
| 格式 | ppt | ||
| 文件大小 | 1.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-18 09:06:09 | ||
图片预览









文档简介
(共40张PPT)
第五章第一节 硫及其化合物
(第二课时)
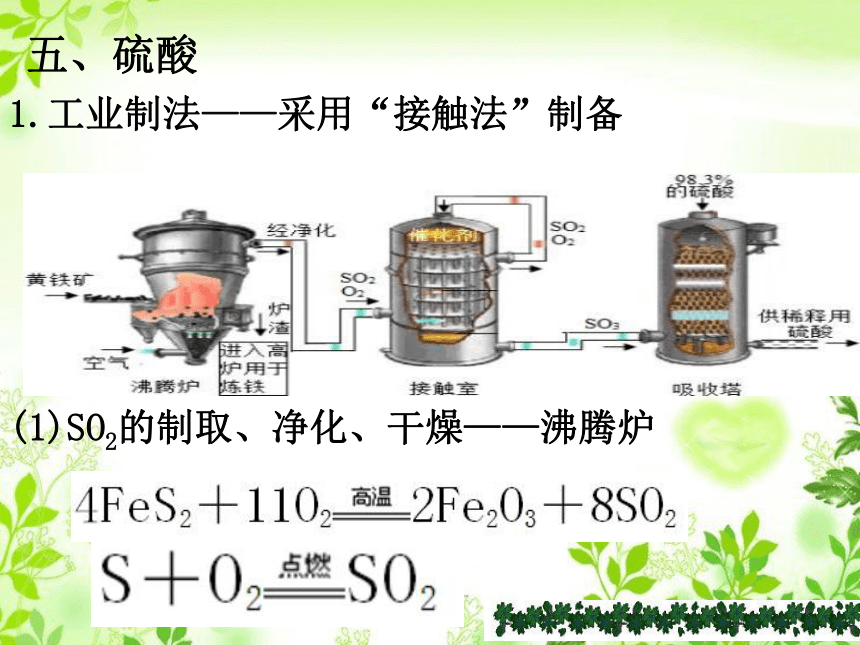
五、硫酸
1.工业制法——采用“接触法”制备
(1)SO2的制取、净化、干燥——沸腾炉
(2)SO2的催化氧化——接触室
(3)H2SO4的生成和SO3的吸收——吸收塔
说明:用98.3%的浓硫酸吸收生成的SO3以制得发
烟硫酸,然后根据需要用水进行稀释。
2.浓H2SO4的物理性质
高沸点(沸点为338℃),难挥发性的二元
强酸,无色黏稠油状液体,以任意比与水互溶,
溶解时放出大量的热。
说明:a.常见浓硫酸的质量分数为98%,密度为
1.84 g·cm-3,故浓H2SO4物质的量浓度c=
=18.4mol·L-1
(做题时18mol·L-1 的硫酸为浓硫酸 )
b.浓H2SO4的稀释方法:
酸入水,沿器壁,慢慢倒,不断搅
3.稀H2SO4的化学性质
(1)使指示剂变色
(2)与活泼金属如Na、Mg、Zn、Fe等反应
(3)与碱如NaOH、Ba(OH)2、Cu(OH)2等发生中和反应
(4)与金属氧化物如CuO、Fe2O3等反应
(5)与部分盐反应如Na2CO3、NaHCO3等
4.浓H2SO4的特性
(1)吸水性
能够吸收气体、液体中的水分子及固体中的结晶水的性质
可做干燥剂,可用来干燥中性气体(如H2、CO、O2、Cl2等)或酸性气体(如SO2、CO2、HCl等)。
不能用来干燥碱性气体(如NH3)和还原性气体(如H2S、HBr、HI等)
思考:
a.分别将一瓶浓H2SO4、浓HCl敞口放置在空气中,其溶液的物质的量浓度和溶液的质量会发生怎样变化?
b.浓硫酸加到胆矾上,蓝色晶体变成白色粉末,体现了浓硫酸的什么性质
(2)脱水性
“黑色面包”实验
实验操作:把浓硫酸加入蔗糖中
实验现象:
蔗糖变黑,体积膨胀,变成疏松多孔的海绵状,并放出刺激性气味的气体
解释或结论:
总结:将蔗糖、纸张、棉布和木材等有机物中的氢、氧元素按原子个数2:1的比例脱去的性质称为脱水性。
思考:乙醇和浓硫酸混合加热时生成乙烯
浓硫酸体现了什么性质?
浓硫酸体现了脱水性与氧化性
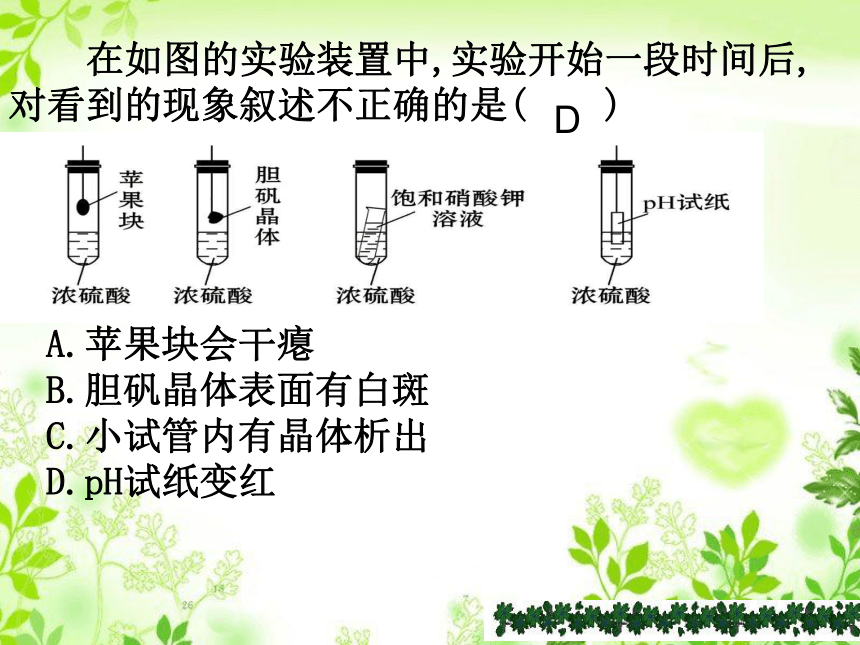
在如图的实验装置中,实验开始一段时间后,对看到的现象叙述不正确的是( )
A.苹果块会干瘪
B.胆矾晶体表面有白斑
C.小试管内有晶体析出
D.pH试纸变红
D
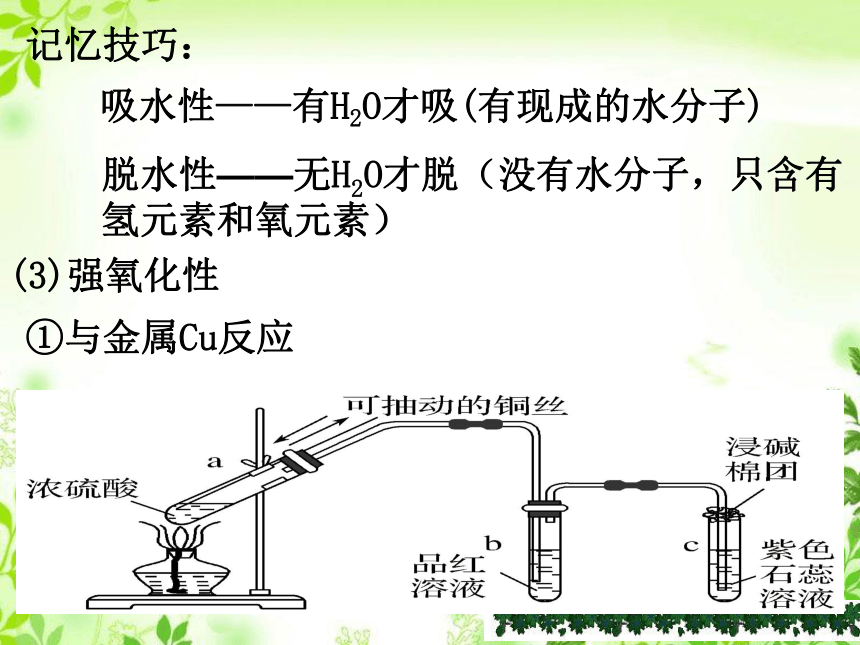
记忆技巧:
吸水性——有H2O才吸(有现成的水分子)
脱水性——无H2O才脱(没有水分子,只含有
氢元素和氧元素)
(3)强氧化性
①与金属Cu反应
实验现象:
a.试管中铜丝表面__________________________
b.试管中的溶液__________________________
c.试管中的________________________________
将a试管里的溶液慢慢倒入水中,_____________
逐渐变为无色
有气泡产生
紫色石蕊溶液逐渐变为红色
溶液显蓝色
实验结论:
说明:
a.Cu与浓H2SO4 反应时,浓H2SO4 显示酸性和强氧化性
b.足量的Cu与50ml 18mol·L-1的浓H2SO4充分反应生成的SO2的物质的量 0.45mol
小于
其原因为:随着反应的进行,浓H2SO4的浓度逐渐
变小,当成为稀H2SO4时,反应不再发生。
c.足量的Cu与浓H2SO4充分反应后应得到CuSO4和
H2SO4(未反应)的混合液,再加入H2O2溶液,可以
继续反应。
思考:足量的金属锌与浓硫酸反应时,所得气体产物有哪些?
刚开始时反应产生气体SO2,发生的反应为:
随着反应的进行,硫酸浓度变小成稀硫酸后,则继续反应产生气体H2
最后得到的还原产物为SO2和 H2的混合气体
②Fe、Al的钝化
常温下,当Fe、Al遇到浓HNO3、浓H2SO4会钝化
钝化:Fe、Al会与浓HNO3、浓H2SO4发生反应,在金属表面生成一层致密氧化物薄膜,可阻止内层金属继续反应
为化学变化
思考:在常温下能否用铁罐、铝罐盛装浓H2SO4、浓HNO3?
说明:在加热时, Fe、Al与浓H2SO4会反应但不产生H2,浓H2SO4产物为SO2气体
③与非金属反应
思考:如何设计实验检验碳C与浓H2SO4反应的产物?
检验是否H2O有生成:
1.选择合适的检验试剂
无水CuSO4粉末
检验是否有SO2生成:
品红溶液
检验是否有CO2气体生成:
澄清石灰水
2.考虑检验的顺序问题
(1)无水CuSO4粉末
目的:检验是否H2O有生成
(2)品红溶液
目的:检验是否有SO2生成
(3)酸性KMnO4溶液或溴水
目的:除去气体中的SO2
(4)品红溶液
目的:检验SO2气体是否除尽
(5)澄清石灰水
目的:检验是否有CO2气体生成
证明有CO2气体的现象:
(4)中品红溶液不褪色,澄清石灰水变浑浊
硫酸与金属或非金属反应情况分析
a.稀硫酸与位于金属活动性顺序中H之前的金属反
应生成H2,与位于金属活动性顺序中H之后的金属
不反应。
b.热的浓硫酸能与大多数金属(金、铂除外)反应
生成SO2气体,但分两种情况:
①浓硫酸与足量活泼金属如Zn、Mg等反应时,刚开
始时反应产生气体SO2,随着反应的进行,硫酸浓度
变小成稀硫酸后,则继续反应产生气体H2,最后得
到的还原产物为SO2和 H2的混合气体。
②浓硫酸与足量不活泼金属如Cu、Ag等反应时,刚
开始时反应产生气体SO2,硫酸溶度变小后,稀硫
酸不再反应,最后只得到SO2气体。
c.浓硫酸与金属反应时会表现强氧化性和酸性;与
非金属反应时只表现强氧化性。
1.下列关于硫酸性质的描述中,正确的是 ( )
A.浓硫酸有氧化性,稀硫酸无氧化性
B.由于浓硫酸具有吸水性,故可用来与蔗糖反应做“黑面
包”实验
C.稀硫酸与铁、铝反应,浓硫酸在常温下不与铁、铝反应
D.浓硫酸与Cu的反应中有少量黑色固体生成,可能是CuO
【相关习题】
2.向5mL 18mol L-1的硫酸中加入足量铜片并加热
使其充分反应。下列说法正确的是( )
A.有0.09mol的硫酸被还原
B.有0.045mol的硫酸被还原
C.充分反应后体系无硫酸剩余
D.消耗的铜的质量一定小于2.88g
④与还原性物质反应如H2S、HBr、HI
D
浓H2SO4不可干燥H2S、HBr、HI,但可干燥HCl、SO2
⑤难挥发性
浓硫酸为高沸点、难挥发性的酸,可用于制
取低沸点、易挥发性的酸如HCl、HNO3
向盐酸中加入浓硫酸时,会有白雾生成。下列
叙述不属于产生该现象的原因的是( )
A.浓硫酸具有脱水性
B.浓硫酸具有吸水性
C.盐酸具有挥发性
D.气态溶质的溶解度随温度升高而降低
【相关习题】
A
5.用途
(1)重要的化工原料,也是化学实验室中必备的
重要试剂。
(2)工业上用于制化肥、农药、炸药和燃料等。
(3)用于石油精炼、金属加工前的酸洗及制取各种
挥发性酸等。
【思考】浓硫酸与稀硫酸的鉴别方法
①稀释法:取少量蒸馏水,沿烧杯内壁慢慢加入少
量样品,稀释时放出大量热的是浓硫酸,反之则为
稀硫酸。
②密度法:分别称量相同体积的两种酸,质量大的
是浓硫酸。
③钝化法:分别取少许试液于试管中,加入铁丝或铝片,无明显现象的是浓硫酸,有气泡冒出的是稀硫酸。
④脱水法:分别用玻璃棒蘸取两种酸涂在纸上,变
黑者是浓硫酸。
⑤吸水法:分别取两支试管,加入胆矾
(CuSO4·5H2O)小许,再分别加入少许酸,蓝色晶
体变白者是浓硫酸。
⑥氧化法:分别取两支试管,加入铜片或木炭后,再分别加入酸,加热,溶液变蓝,有刺激性气味气体产生的是浓硫酸。
六、SO42-的检验及粗盐的提纯
1.检验 SO42―的操作方法
语言叙述:取少量溶液于试管中,先加入足量稀盐
酸,再加入适量BaCl2溶液,若有白色沉淀生成,
则证明原溶液中含有SO42- ,反之则证明原溶液中
无SO42-。
思考:如何设计实验检验Na2SO3溶液是否已被氧化?
取少量溶液置于洁净的试管中,向其中滴加稀
盐酸至不再产生气体,再向其中滴加BaCl2溶液,
若产生白色沉淀,则证明Na2SO3已被氧化。
若为Na2SO3固体如何检验是否已被氧化?
2.粗盐的提纯
(1)提纯步骤:溶解 过滤 蒸发
说明:固体溶解时玻璃棒的作用为搅拌,加速溶
解。只能除去粗盐中不溶性杂质。
(2)基本操作
过滤
a.条件:用于分离不溶性固体
和液体(H2O)的混合物
b.仪器:铁架台(带铁圈)、
烧杯、(普通)漏斗、玻璃棒
c.操作注意事项
漏斗下端尖嘴应紧靠烧杯内壁
说明:若溶液B经操作Ⅰ后得到固体物质和液体,则操作I一般为过滤
记忆口诀:斗架烧杯玻璃棒,滤纸漏斗角一样;
过滤之前要静置,三靠两低不要忘。
蒸发
a.条件:用于分离可溶性固体和液体的混合物。
b.仪器:铁架台(或三脚架)、
酒精灯、蒸发皿、玻璃棒
c.注意事项:
①加热过程中,用玻璃棒不断搅拌溶液,防止局部
温度过高,造成液体飞溅。
故玻璃棒的作用:搅拌,防止局部温度过高,造成
液体飞溅
②当蒸发皿中出现较多固体时,停止加热,利用余
热蒸干。
③取下未冷却的蒸发皿时,要放在石棉网上。
记忆口诀:皿架玻棒酒精灯,加热搅拌不放松;
析出固体不蒸干,熄灯以后余热干。
沉淀的洗涤、检验及判断的方法
以BaCl2溶液沉淀Na2SO4 溶液为例
a.判断SO42-离子是否已经完全沉淀或沉淀完全及
沉淀剂BaCl2是否过量的方法
①取少量静置后的上层清液于洁净的试管中,向其
中滴加BaCl2溶液,若有白色沉淀生成,说明SO42-
未沉淀完全(或沉淀剂BaCl2不足);反之,则SO42-
已沉淀完全(或BaCl2已过量)
②静置,向上层清液中继续滴加少量BaCl2溶液,
若有白色沉淀生成,说明SO42-未沉淀完全(或
BaCl2不足),反之,则SO42-已沉淀完全(或
BaCl2已过量)
说明:若需称量沉淀的质量而进行有关定量计算时
则只能选用法②
某校化学研究性学习小组设计如下实验方案,
测定放置已久的小苏打样品中纯碱的质量分数。称
取一定量样品,置于小烧杯中,加适量水溶解,向
小烧杯中加入足量氯化钡溶液,过滤洗涤,干燥沉
淀,称量固体质量,计算,实验中判断沉淀是否完
全的方法是 。
【相关习题】
b.沉淀洗涤的目的
除去沉淀表面吸附的可溶性杂质(NaCl)
c.沉淀洗涤的方法
沿玻璃棒向漏斗中加蒸馏水至浸没沉淀,等水自然流尽后,再重复操作2~~~~3次
d.判断沉淀是否已洗涤干净的方法(NaCl)
取最后一次洗涤液少许于试管中,加入适量
用稀HNO3酸化的AgNO3溶液,若有白色沉淀生成,
说明沉淀未洗涤干净,反之,则已洗涤干净。
(3)除去粗盐中可溶性杂质
【思考】如何除去NaCl溶液中含有的Na2SO4、MgCl2、CaCl2等杂质?
a.除杂的原则:不增:不能引入新杂质
不减:尽量不减少被提纯和分离的物质
易分:使被提纯或分离的物质与其他物质易分离
复原:被提纯物质要易被复原
b.除杂剂的选择原则:遵循易分的原则,将杂质转
化为易分离的物质,即沉淀、气体、H2O及物质本身。
c.多步除杂的原则:为了将杂质除净,先加入的除
杂剂通常都是过量的,这时又会引入新的杂质,但
必须保证后加入的除杂剂能把先前过量的除杂剂除
去,最后加酸或碱调节溶液的酸碱性。
常采用流程图来解
故加入试剂的先后顺序为:① BaCl2、Na2CO3、
NaOH(过滤)、HCl
②BaCl2、NaOH、Na2CO3(过滤)、HCl
③NaOH、BaCl2、Na2CO3(过滤)、HCl
七、不同价态含硫物质的转化
1.不同价态硫元素之间的相互转化主要是通过氧化
还原反应实现。当硫元素的化合价(-2 0 +4
+6)升高或降低时,一般遵循转化律(就近生成原
则),相邻价态的微粒之间不反应氧化还原反应,
如S和SO2、SO2和浓H2SO4之间不反应。
利用氧化剂,可将硫元素从低价态转化到高价
态;利用还原剂,可将硫元素从高价态转化到低
价态。
常见的氧化剂和还原剂
(1)常见的氧化剂:酸性高锰酸钾溶液、氯水、硝
酸、浓硫酸、氧气等。
(2)常见的还原剂:硫化氢、碘化钾、金属单质、
氢气等。
2.选择合适的试剂,设计合理的实验方案,实现不同含硫化合物之间的转化
(1) +4价至+6价,如SO2到H2SO4
选择试剂:SO2、氯水、BaCl2溶液
实验现象:SO2通入氯水中,氯水褪色;再滴入BaCl2溶液,生成白色沉淀
实验结论:SO2能被氯水氧化为H2SO4
(2) +6价至+4价,如H2SO4到SO2
选择试剂:浓H2SO4、Cu
实验现象:加热Cu与浓H2SO4的混合物,放出具有
刺激性气味的气体,反应后的溶液与水混合变蓝色
实验结论:
(3) +4价至0价 -2价至0价
选择试剂:SO2、H2S、H2O
实验现象:将SO2、H2S同时通入H2O中,生成淡黄色
沉淀
实验结论:
4. 实验方案的设计与评价
设计实验方案或对多种实验方案进行对比评
价或选择最佳实验方案时首先从绿色化学的角度考
虑是否产生污染物;其次是否节省原料;再次操作
是否简单,现象是否明显,原料是否易得,安全,
步骤是否较少;最后看产物是否纯净,在具体分析
问题时往往只需考虑以上的某一方面或某几方面。
某兴趣小组在实验室用铜和硫酸为原料采用多种方法制取硫酸铜,方案甲:铜与浓硫酸加热
【相关习题】
方案乙:
对比方案甲,则方案乙的优点是:
①不产生污染物SO2
②产生等量的CuSO4,乙消耗的硫酸更少
某课外活动小组的同学,在实验室做锌与浓硫酸反
应的实验时,有同学认为产生的气体除SO2外,还可
能产生氢气。该同学为了检验他的判断是否正确,
设计了如图所示的实验装置,其中,装置B中盛有
浓硫酸,装置C中放置黑色CuO粉末,装置D中放置的
是无水硫酸铜粉末(锌与浓硫酸共热时产生的气体
为X,且该装置略去)。试回答:
【典型例题】
(1)在安装好装置后,必须首先进行的一步操作
是 。
(2)A中加入的试剂可能是 ,作用是 ;
B 中试剂的作用是 ;
E中加入的试剂可能是 ,作用是
;
装置A、B之间的酸性高锰酸钾溶液的作用是
。
(3) 上述反应中生成二氧化硫的化学方程式为
(4)有同学认为还可能产生氢气的理由是 。
(5)如果去掉装置B,还能否根据D中的现象判断气
体X中有氢气? (填“能”或“不能”)
原因是 。
(6)可以证明气体X中含有氢气的实验现象是:
C中 ,
D中 。
作业布置:
1.对照知识点复习材料或课堂笔记认真复习记忆基础知识,特别要记忆涉及到的有关化学方程式。
3.预习必修2第五章第二节第1课时内容。
4.根据老师要求默写化学方程式,上传到班级群里。
2.认真完成本节课课时训练试题。(与课件同时传到钉钉群)
第五章第一节 硫及其化合物
(第二课时)
五、硫酸
1.工业制法——采用“接触法”制备
(1)SO2的制取、净化、干燥——沸腾炉
(2)SO2的催化氧化——接触室
(3)H2SO4的生成和SO3的吸收——吸收塔
说明:用98.3%的浓硫酸吸收生成的SO3以制得发
烟硫酸,然后根据需要用水进行稀释。
2.浓H2SO4的物理性质
高沸点(沸点为338℃),难挥发性的二元
强酸,无色黏稠油状液体,以任意比与水互溶,
溶解时放出大量的热。
说明:a.常见浓硫酸的质量分数为98%,密度为
1.84 g·cm-3,故浓H2SO4物质的量浓度c=
=18.4mol·L-1
(做题时18mol·L-1 的硫酸为浓硫酸 )
b.浓H2SO4的稀释方法:
酸入水,沿器壁,慢慢倒,不断搅
3.稀H2SO4的化学性质
(1)使指示剂变色
(2)与活泼金属如Na、Mg、Zn、Fe等反应
(3)与碱如NaOH、Ba(OH)2、Cu(OH)2等发生中和反应
(4)与金属氧化物如CuO、Fe2O3等反应
(5)与部分盐反应如Na2CO3、NaHCO3等
4.浓H2SO4的特性
(1)吸水性
能够吸收气体、液体中的水分子及固体中的结晶水的性质
可做干燥剂,可用来干燥中性气体(如H2、CO、O2、Cl2等)或酸性气体(如SO2、CO2、HCl等)。
不能用来干燥碱性气体(如NH3)和还原性气体(如H2S、HBr、HI等)
思考:
a.分别将一瓶浓H2SO4、浓HCl敞口放置在空气中,其溶液的物质的量浓度和溶液的质量会发生怎样变化?
b.浓硫酸加到胆矾上,蓝色晶体变成白色粉末,体现了浓硫酸的什么性质
(2)脱水性
“黑色面包”实验
实验操作:把浓硫酸加入蔗糖中
实验现象:
蔗糖变黑,体积膨胀,变成疏松多孔的海绵状,并放出刺激性气味的气体
解释或结论:
总结:将蔗糖、纸张、棉布和木材等有机物中的氢、氧元素按原子个数2:1的比例脱去的性质称为脱水性。
思考:乙醇和浓硫酸混合加热时生成乙烯
浓硫酸体现了什么性质?
浓硫酸体现了脱水性与氧化性
在如图的实验装置中,实验开始一段时间后,对看到的现象叙述不正确的是( )
A.苹果块会干瘪
B.胆矾晶体表面有白斑
C.小试管内有晶体析出
D.pH试纸变红
D
记忆技巧:
吸水性——有H2O才吸(有现成的水分子)
脱水性——无H2O才脱(没有水分子,只含有
氢元素和氧元素)
(3)强氧化性
①与金属Cu反应
实验现象:
a.试管中铜丝表面__________________________
b.试管中的溶液__________________________
c.试管中的________________________________
将a试管里的溶液慢慢倒入水中,_____________
逐渐变为无色
有气泡产生
紫色石蕊溶液逐渐变为红色
溶液显蓝色
实验结论:
说明:
a.Cu与浓H2SO4 反应时,浓H2SO4 显示酸性和强氧化性
b.足量的Cu与50ml 18mol·L-1的浓H2SO4充分反应生成的SO2的物质的量 0.45mol
小于
其原因为:随着反应的进行,浓H2SO4的浓度逐渐
变小,当成为稀H2SO4时,反应不再发生。
c.足量的Cu与浓H2SO4充分反应后应得到CuSO4和
H2SO4(未反应)的混合液,再加入H2O2溶液,可以
继续反应。
思考:足量的金属锌与浓硫酸反应时,所得气体产物有哪些?
刚开始时反应产生气体SO2,发生的反应为:
随着反应的进行,硫酸浓度变小成稀硫酸后,则继续反应产生气体H2
最后得到的还原产物为SO2和 H2的混合气体
②Fe、Al的钝化
常温下,当Fe、Al遇到浓HNO3、浓H2SO4会钝化
钝化:Fe、Al会与浓HNO3、浓H2SO4发生反应,在金属表面生成一层致密氧化物薄膜,可阻止内层金属继续反应
为化学变化
思考:在常温下能否用铁罐、铝罐盛装浓H2SO4、浓HNO3?
说明:在加热时, Fe、Al与浓H2SO4会反应但不产生H2,浓H2SO4产物为SO2气体
③与非金属反应
思考:如何设计实验检验碳C与浓H2SO4反应的产物?
检验是否H2O有生成:
1.选择合适的检验试剂
无水CuSO4粉末
检验是否有SO2生成:
品红溶液
检验是否有CO2气体生成:
澄清石灰水
2.考虑检验的顺序问题
(1)无水CuSO4粉末
目的:检验是否H2O有生成
(2)品红溶液
目的:检验是否有SO2生成
(3)酸性KMnO4溶液或溴水
目的:除去气体中的SO2
(4)品红溶液
目的:检验SO2气体是否除尽
(5)澄清石灰水
目的:检验是否有CO2气体生成
证明有CO2气体的现象:
(4)中品红溶液不褪色,澄清石灰水变浑浊
硫酸与金属或非金属反应情况分析
a.稀硫酸与位于金属活动性顺序中H之前的金属反
应生成H2,与位于金属活动性顺序中H之后的金属
不反应。
b.热的浓硫酸能与大多数金属(金、铂除外)反应
生成SO2气体,但分两种情况:
①浓硫酸与足量活泼金属如Zn、Mg等反应时,刚开
始时反应产生气体SO2,随着反应的进行,硫酸浓度
变小成稀硫酸后,则继续反应产生气体H2,最后得
到的还原产物为SO2和 H2的混合气体。
②浓硫酸与足量不活泼金属如Cu、Ag等反应时,刚
开始时反应产生气体SO2,硫酸溶度变小后,稀硫
酸不再反应,最后只得到SO2气体。
c.浓硫酸与金属反应时会表现强氧化性和酸性;与
非金属反应时只表现强氧化性。
1.下列关于硫酸性质的描述中,正确的是 ( )
A.浓硫酸有氧化性,稀硫酸无氧化性
B.由于浓硫酸具有吸水性,故可用来与蔗糖反应做“黑面
包”实验
C.稀硫酸与铁、铝反应,浓硫酸在常温下不与铁、铝反应
D.浓硫酸与Cu的反应中有少量黑色固体生成,可能是CuO
【相关习题】
2.向5mL 18mol L-1的硫酸中加入足量铜片并加热
使其充分反应。下列说法正确的是( )
A.有0.09mol的硫酸被还原
B.有0.045mol的硫酸被还原
C.充分反应后体系无硫酸剩余
D.消耗的铜的质量一定小于2.88g
④与还原性物质反应如H2S、HBr、HI
D
浓H2SO4不可干燥H2S、HBr、HI,但可干燥HCl、SO2
⑤难挥发性
浓硫酸为高沸点、难挥发性的酸,可用于制
取低沸点、易挥发性的酸如HCl、HNO3
向盐酸中加入浓硫酸时,会有白雾生成。下列
叙述不属于产生该现象的原因的是( )
A.浓硫酸具有脱水性
B.浓硫酸具有吸水性
C.盐酸具有挥发性
D.气态溶质的溶解度随温度升高而降低
【相关习题】
A
5.用途
(1)重要的化工原料,也是化学实验室中必备的
重要试剂。
(2)工业上用于制化肥、农药、炸药和燃料等。
(3)用于石油精炼、金属加工前的酸洗及制取各种
挥发性酸等。
【思考】浓硫酸与稀硫酸的鉴别方法
①稀释法:取少量蒸馏水,沿烧杯内壁慢慢加入少
量样品,稀释时放出大量热的是浓硫酸,反之则为
稀硫酸。
②密度法:分别称量相同体积的两种酸,质量大的
是浓硫酸。
③钝化法:分别取少许试液于试管中,加入铁丝或铝片,无明显现象的是浓硫酸,有气泡冒出的是稀硫酸。
④脱水法:分别用玻璃棒蘸取两种酸涂在纸上,变
黑者是浓硫酸。
⑤吸水法:分别取两支试管,加入胆矾
(CuSO4·5H2O)小许,再分别加入少许酸,蓝色晶
体变白者是浓硫酸。
⑥氧化法:分别取两支试管,加入铜片或木炭后,再分别加入酸,加热,溶液变蓝,有刺激性气味气体产生的是浓硫酸。
六、SO42-的检验及粗盐的提纯
1.检验 SO42―的操作方法
语言叙述:取少量溶液于试管中,先加入足量稀盐
酸,再加入适量BaCl2溶液,若有白色沉淀生成,
则证明原溶液中含有SO42- ,反之则证明原溶液中
无SO42-。
思考:如何设计实验检验Na2SO3溶液是否已被氧化?
取少量溶液置于洁净的试管中,向其中滴加稀
盐酸至不再产生气体,再向其中滴加BaCl2溶液,
若产生白色沉淀,则证明Na2SO3已被氧化。
若为Na2SO3固体如何检验是否已被氧化?
2.粗盐的提纯
(1)提纯步骤:溶解 过滤 蒸发
说明:固体溶解时玻璃棒的作用为搅拌,加速溶
解。只能除去粗盐中不溶性杂质。
(2)基本操作
过滤
a.条件:用于分离不溶性固体
和液体(H2O)的混合物
b.仪器:铁架台(带铁圈)、
烧杯、(普通)漏斗、玻璃棒
c.操作注意事项
漏斗下端尖嘴应紧靠烧杯内壁
说明:若溶液B经操作Ⅰ后得到固体物质和液体,则操作I一般为过滤
记忆口诀:斗架烧杯玻璃棒,滤纸漏斗角一样;
过滤之前要静置,三靠两低不要忘。
蒸发
a.条件:用于分离可溶性固体和液体的混合物。
b.仪器:铁架台(或三脚架)、
酒精灯、蒸发皿、玻璃棒
c.注意事项:
①加热过程中,用玻璃棒不断搅拌溶液,防止局部
温度过高,造成液体飞溅。
故玻璃棒的作用:搅拌,防止局部温度过高,造成
液体飞溅
②当蒸发皿中出现较多固体时,停止加热,利用余
热蒸干。
③取下未冷却的蒸发皿时,要放在石棉网上。
记忆口诀:皿架玻棒酒精灯,加热搅拌不放松;
析出固体不蒸干,熄灯以后余热干。
沉淀的洗涤、检验及判断的方法
以BaCl2溶液沉淀Na2SO4 溶液为例
a.判断SO42-离子是否已经完全沉淀或沉淀完全及
沉淀剂BaCl2是否过量的方法
①取少量静置后的上层清液于洁净的试管中,向其
中滴加BaCl2溶液,若有白色沉淀生成,说明SO42-
未沉淀完全(或沉淀剂BaCl2不足);反之,则SO42-
已沉淀完全(或BaCl2已过量)
②静置,向上层清液中继续滴加少量BaCl2溶液,
若有白色沉淀生成,说明SO42-未沉淀完全(或
BaCl2不足),反之,则SO42-已沉淀完全(或
BaCl2已过量)
说明:若需称量沉淀的质量而进行有关定量计算时
则只能选用法②
某校化学研究性学习小组设计如下实验方案,
测定放置已久的小苏打样品中纯碱的质量分数。称
取一定量样品,置于小烧杯中,加适量水溶解,向
小烧杯中加入足量氯化钡溶液,过滤洗涤,干燥沉
淀,称量固体质量,计算,实验中判断沉淀是否完
全的方法是 。
【相关习题】
b.沉淀洗涤的目的
除去沉淀表面吸附的可溶性杂质(NaCl)
c.沉淀洗涤的方法
沿玻璃棒向漏斗中加蒸馏水至浸没沉淀,等水自然流尽后,再重复操作2~~~~3次
d.判断沉淀是否已洗涤干净的方法(NaCl)
取最后一次洗涤液少许于试管中,加入适量
用稀HNO3酸化的AgNO3溶液,若有白色沉淀生成,
说明沉淀未洗涤干净,反之,则已洗涤干净。
(3)除去粗盐中可溶性杂质
【思考】如何除去NaCl溶液中含有的Na2SO4、MgCl2、CaCl2等杂质?
a.除杂的原则:不增:不能引入新杂质
不减:尽量不减少被提纯和分离的物质
易分:使被提纯或分离的物质与其他物质易分离
复原:被提纯物质要易被复原
b.除杂剂的选择原则:遵循易分的原则,将杂质转
化为易分离的物质,即沉淀、气体、H2O及物质本身。
c.多步除杂的原则:为了将杂质除净,先加入的除
杂剂通常都是过量的,这时又会引入新的杂质,但
必须保证后加入的除杂剂能把先前过量的除杂剂除
去,最后加酸或碱调节溶液的酸碱性。
常采用流程图来解
故加入试剂的先后顺序为:① BaCl2、Na2CO3、
NaOH(过滤)、HCl
②BaCl2、NaOH、Na2CO3(过滤)、HCl
③NaOH、BaCl2、Na2CO3(过滤)、HCl
七、不同价态含硫物质的转化
1.不同价态硫元素之间的相互转化主要是通过氧化
还原反应实现。当硫元素的化合价(-2 0 +4
+6)升高或降低时,一般遵循转化律(就近生成原
则),相邻价态的微粒之间不反应氧化还原反应,
如S和SO2、SO2和浓H2SO4之间不反应。
利用氧化剂,可将硫元素从低价态转化到高价
态;利用还原剂,可将硫元素从高价态转化到低
价态。
常见的氧化剂和还原剂
(1)常见的氧化剂:酸性高锰酸钾溶液、氯水、硝
酸、浓硫酸、氧气等。
(2)常见的还原剂:硫化氢、碘化钾、金属单质、
氢气等。
2.选择合适的试剂,设计合理的实验方案,实现不同含硫化合物之间的转化
(1) +4价至+6价,如SO2到H2SO4
选择试剂:SO2、氯水、BaCl2溶液
实验现象:SO2通入氯水中,氯水褪色;再滴入BaCl2溶液,生成白色沉淀
实验结论:SO2能被氯水氧化为H2SO4
(2) +6价至+4价,如H2SO4到SO2
选择试剂:浓H2SO4、Cu
实验现象:加热Cu与浓H2SO4的混合物,放出具有
刺激性气味的气体,反应后的溶液与水混合变蓝色
实验结论:
(3) +4价至0价 -2价至0价
选择试剂:SO2、H2S、H2O
实验现象:将SO2、H2S同时通入H2O中,生成淡黄色
沉淀
实验结论:
4. 实验方案的设计与评价
设计实验方案或对多种实验方案进行对比评
价或选择最佳实验方案时首先从绿色化学的角度考
虑是否产生污染物;其次是否节省原料;再次操作
是否简单,现象是否明显,原料是否易得,安全,
步骤是否较少;最后看产物是否纯净,在具体分析
问题时往往只需考虑以上的某一方面或某几方面。
某兴趣小组在实验室用铜和硫酸为原料采用多种方法制取硫酸铜,方案甲:铜与浓硫酸加热
【相关习题】
方案乙:
对比方案甲,则方案乙的优点是:
①不产生污染物SO2
②产生等量的CuSO4,乙消耗的硫酸更少
某课外活动小组的同学,在实验室做锌与浓硫酸反
应的实验时,有同学认为产生的气体除SO2外,还可
能产生氢气。该同学为了检验他的判断是否正确,
设计了如图所示的实验装置,其中,装置B中盛有
浓硫酸,装置C中放置黑色CuO粉末,装置D中放置的
是无水硫酸铜粉末(锌与浓硫酸共热时产生的气体
为X,且该装置略去)。试回答:
【典型例题】
(1)在安装好装置后,必须首先进行的一步操作
是 。
(2)A中加入的试剂可能是 ,作用是 ;
B 中试剂的作用是 ;
E中加入的试剂可能是 ,作用是
;
装置A、B之间的酸性高锰酸钾溶液的作用是
。
(3) 上述反应中生成二氧化硫的化学方程式为
(4)有同学认为还可能产生氢气的理由是 。
(5)如果去掉装置B,还能否根据D中的现象判断气
体X中有氢气? (填“能”或“不能”)
原因是 。
(6)可以证明气体X中含有氢气的实验现象是:
C中 ,
D中 。
作业布置:
1.对照知识点复习材料或课堂笔记认真复习记忆基础知识,特别要记忆涉及到的有关化学方程式。
3.预习必修2第五章第二节第1课时内容。
4.根据老师要求默写化学方程式,上传到班级群里。
2.认真完成本节课课时训练试题。(与课件同时传到钉钉群)
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
