高中化学必修第二册第五章《硫酸》PPT课件(共17张PPT)
文档属性
| 名称 | 高中化学必修第二册第五章《硫酸》PPT课件(共17张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 620.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-18 10:48:47 | ||
图片预览




文档简介
(共17张PPT)
硫酸
人教版必修第 二 册第 五 章
高中
化学
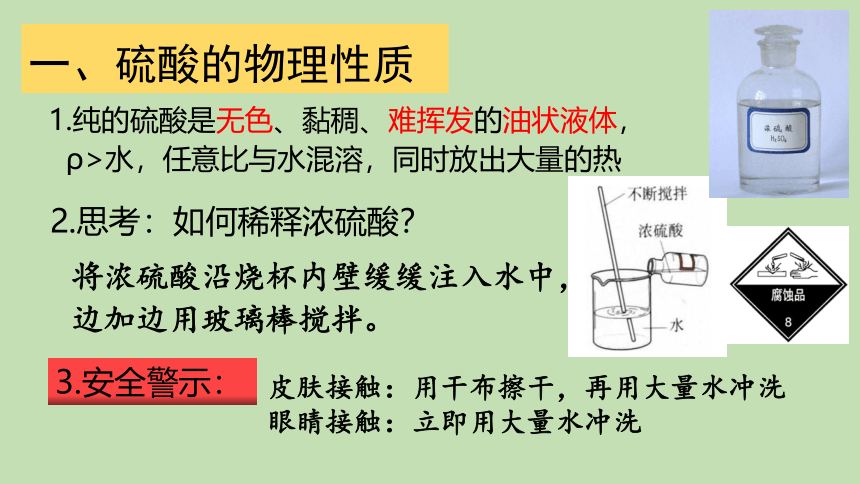
1.纯的硫酸是无色、黏稠、难挥发的油状液体,
ρ>水,任意比与水混溶,同时放出大量的热
一、硫酸的物理性质
2.思考:如何稀释浓硫酸?
将浓硫酸沿烧杯内壁缓缓注入水中,
边加边用玻璃棒搅拌。
皮肤接触:用干布擦干,再用大量水冲洗
眼睛接触:立即用大量水冲洗
3.安全警示:
①与指示剂反应:
使紫色石蕊变红,无色酚酞不变色
②与H前的金属反应置换出氢气:
Fe+H2SO4=FeSO4+H2↑
③与金属氧化物反应生成盐和水:
Fe2O3+3H2SO4=Fe2(SO4)3+3H2O
④与碱反应生成盐和水:
2Fe(OH)3+3H2SO4=Fe2(SO4)3+6H2O
⑤与盐反应生成新的盐和新的酸:
Na2CO3+H2SO4=Na2SO4+H2O +CO2 ↑
二、稀硫酸:酸的通性
三、浓硫酸的三大特性
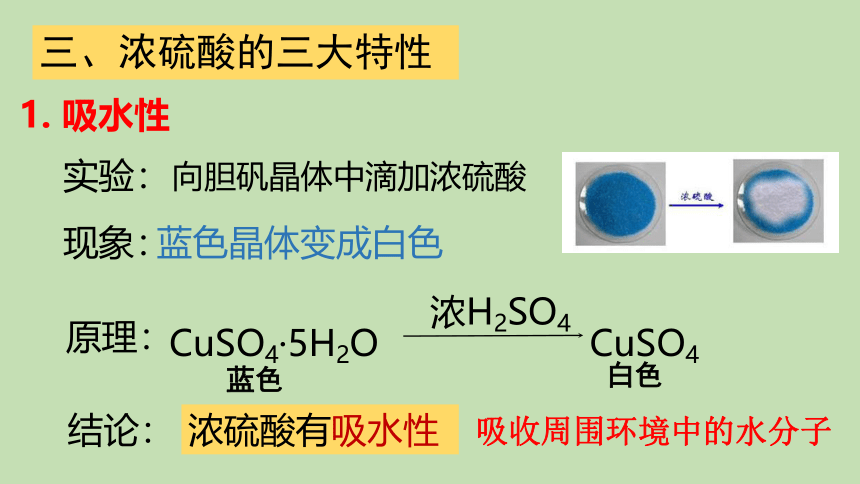
1. 吸水性
吸收周围环境中的水分子
向胆矾晶体中滴加浓硫酸
蓝色晶体变成白色
浓H2SO4
CuSO4 5H2O
CuSO4
蓝色
白色
现象:
原理:
结论:
浓硫酸有吸水性
实验:
干燥:H2、O2、N2、 Cl2、CO、CO2、SO2、CH4、HCl等
碱性气体:NH3
还原性气体: H2S 、HBr 、HI
{
不能干燥
吸水性应用:
注意:
2NH3+H2SO4=(NH4)2SO4
作干燥剂
2.脱水性
实验: 向蔗糖中滴加浓硫酸
将蔗糖、纸张、棉布、木材等有机物中的氢、 氧元素按2:1脱去,生成黑色的炭。(炭化)
蔗糖变黑,体积膨胀,形成疏松多孔的海绵状固体,产生刺激性气味气体,放出大量的热。
C12H22O11
蔗糖
浓硫酸
12C + 11H2O
原理:
结论:
浓硫酸有脱水性
现象:
浓硫酸
木炭
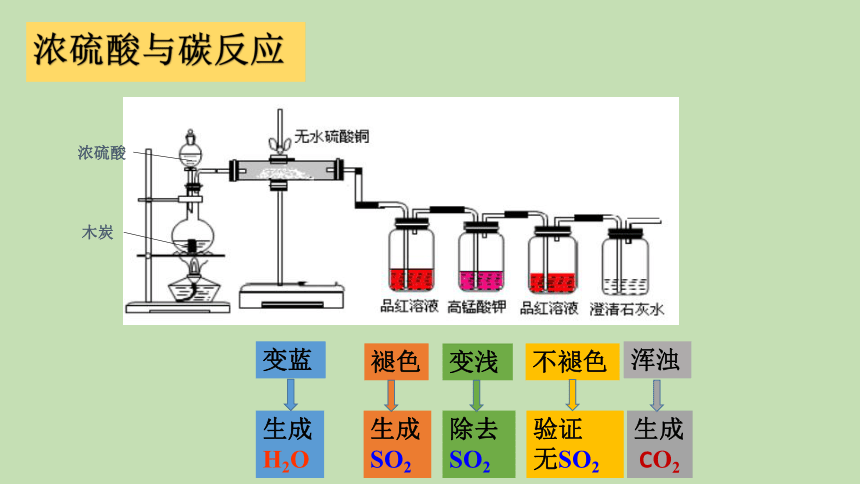
浓硫酸与碳反应
变蓝
褪色
变浅
不褪色
浑浊
生成
H2O
生成
SO2
除去SO2
验证
无SO2
生成
CO2
浓硫酸表现氧化性
还原剂
氧化产物
氧化剂
还原产物
+6
+4
+4
0
浓硫酸与碳反应
C + 2H2SO4(浓)
CO2↑+ 2SO2↑+ 2H2O
△
浓硫酸使蔗糖脱水炭化过程中表现脱水性和强氧化性
得到2×2e-
失去4e-
3.强氧化性
H2SO4
(1)与非金属反应
+6
+4
SO2
C + 2H2SO4(浓)
△
CO2↑+ 2SO2↑+2H2O
非金属+浓硫酸
△
最高价氧化物或含氧酸 + SO2↑+ H2O
(C、S、P等)
S + 2H2SO4(浓)
△
3SO2↑+2H2O
2P + 5H2SO4(浓)
△
2H3PO4+ 5SO2↑+2H2O
还原产物
加热铜丝与浓硫酸,产生了使品红褪色的气体,将反应后试管里的物质慢慢倒入盛有水的烧杯中,溶液呈蓝色。
+6
可抽动的铜丝
浓硫酸
Cu + 2H2SO4(浓)= CuSO4+ SO2 +2H2O
+6
+4
得到2e-
+2
0
失去2e-
还原剂
氧化产物
氧化剂
浓硫酸表现氧化性和酸性
浓硫酸与铜反应
(2)与金属反应
浓硫酸表现氧化性和酸性
金属+浓硫酸
最高价金属硫酸盐 + SO2↑+ H2O
△
① 加热 : 与除Au、Pt外的金属反应
② 常温:冷的浓硫酸遇Fe、Al钝化
Cu + 2H2SO4(浓)= CuSO4+ SO2 +2H2O
可用Fe、Al制容器盛装浓硫酸
H2SO4(浓)+ H2S = SO2↑+S↓ + 2H2O
(3)与某些还原性物质反应
H2SO4(浓)+ 2HBr = SO2↑+Br2+ 2H2O
H2SO4(浓)+ 2H I = SO2↑+ I2+ 2H2O
不能干燥还原性气体: H2S 、HBr 、H I
—2
—1
—1
-2
0
+6
+4
失去2e-
得到2e-
如何鉴别浓硫酸与稀硫酸?
方法一:
方法七:
方法二:
方法三:
方法四:
方法五:
方法六:
观察,油状为浓
体积相同时质量大的为浓
稀释,放热为浓
加入胆矾,变白为浓
加铜片并加热,铜片溶解为浓
加铁片或铝片,钝化为浓
使滤纸或木条变黑为浓
硫酸生产反应式
第三步:
四、硫酸的工业制法
反应原理
H2SO4
98.3%的浓硫酸吸收
SO2
硫磺
或黄铁矿
空气
燃烧
SO3
400~500℃
V2O5催化剂
SO3 + H2O H2SO4
第二步:
2SO2 + O2 2SO3
催化剂
△
第一步:
4FeS2 +11 O2 2Fe2O3 + 8SO2
高 温
S + O2 SO2
点燃
{
或者
五、硫酸根离子的检验
取少量待测溶液,先加稀HCL酸化,再加BaCL2溶液,
若有白色沉淀,证明有SO42-。
1.方法:
2.注意:
③不能用稀HNO3代替稀HCL
①加稀HCL的目的是排除CO32-、SO32-和A g+的干扰
④不能用Ba(NO3)2代替BaCL2
避免SO32-的干扰
避免SO32-的干扰
②不能用先加BaCL2再加稀HCL
避免A g+的干扰
本节要点
浓硫酸的三大特性
吸水性:
脱水性:
强氧化性
还原性物质
非金属单质
金属单质
吸收物质中现成的水分子
物质中没有现成水分子,氢、氧元素按2:1生成水
硫酸
人教版必修第 二 册第 五 章
高中
化学
1.纯的硫酸是无色、黏稠、难挥发的油状液体,
ρ>水,任意比与水混溶,同时放出大量的热
一、硫酸的物理性质
2.思考:如何稀释浓硫酸?
将浓硫酸沿烧杯内壁缓缓注入水中,
边加边用玻璃棒搅拌。
皮肤接触:用干布擦干,再用大量水冲洗
眼睛接触:立即用大量水冲洗
3.安全警示:
①与指示剂反应:
使紫色石蕊变红,无色酚酞不变色
②与H前的金属反应置换出氢气:
Fe+H2SO4=FeSO4+H2↑
③与金属氧化物反应生成盐和水:
Fe2O3+3H2SO4=Fe2(SO4)3+3H2O
④与碱反应生成盐和水:
2Fe(OH)3+3H2SO4=Fe2(SO4)3+6H2O
⑤与盐反应生成新的盐和新的酸:
Na2CO3+H2SO4=Na2SO4+H2O +CO2 ↑
二、稀硫酸:酸的通性
三、浓硫酸的三大特性
1. 吸水性
吸收周围环境中的水分子
向胆矾晶体中滴加浓硫酸
蓝色晶体变成白色
浓H2SO4
CuSO4 5H2O
CuSO4
蓝色
白色
现象:
原理:
结论:
浓硫酸有吸水性
实验:
干燥:H2、O2、N2、 Cl2、CO、CO2、SO2、CH4、HCl等
碱性气体:NH3
还原性气体: H2S 、HBr 、HI
{
不能干燥
吸水性应用:
注意:
2NH3+H2SO4=(NH4)2SO4
作干燥剂
2.脱水性
实验: 向蔗糖中滴加浓硫酸
将蔗糖、纸张、棉布、木材等有机物中的氢、 氧元素按2:1脱去,生成黑色的炭。(炭化)
蔗糖变黑,体积膨胀,形成疏松多孔的海绵状固体,产生刺激性气味气体,放出大量的热。
C12H22O11
蔗糖
浓硫酸
12C + 11H2O
原理:
结论:
浓硫酸有脱水性
现象:
浓硫酸
木炭
浓硫酸与碳反应
变蓝
褪色
变浅
不褪色
浑浊
生成
H2O
生成
SO2
除去SO2
验证
无SO2
生成
CO2
浓硫酸表现氧化性
还原剂
氧化产物
氧化剂
还原产物
+6
+4
+4
0
浓硫酸与碳反应
C + 2H2SO4(浓)
CO2↑+ 2SO2↑+ 2H2O
△
浓硫酸使蔗糖脱水炭化过程中表现脱水性和强氧化性
得到2×2e-
失去4e-
3.强氧化性
H2SO4
(1)与非金属反应
+6
+4
SO2
C + 2H2SO4(浓)
△
CO2↑+ 2SO2↑+2H2O
非金属+浓硫酸
△
最高价氧化物或含氧酸 + SO2↑+ H2O
(C、S、P等)
S + 2H2SO4(浓)
△
3SO2↑+2H2O
2P + 5H2SO4(浓)
△
2H3PO4+ 5SO2↑+2H2O
还原产物
加热铜丝与浓硫酸,产生了使品红褪色的气体,将反应后试管里的物质慢慢倒入盛有水的烧杯中,溶液呈蓝色。
+6
可抽动的铜丝
浓硫酸
Cu + 2H2SO4(浓)= CuSO4+ SO2 +2H2O
+6
+4
得到2e-
+2
0
失去2e-
还原剂
氧化产物
氧化剂
浓硫酸表现氧化性和酸性
浓硫酸与铜反应
(2)与金属反应
浓硫酸表现氧化性和酸性
金属+浓硫酸
最高价金属硫酸盐 + SO2↑+ H2O
△
① 加热 : 与除Au、Pt外的金属反应
② 常温:冷的浓硫酸遇Fe、Al钝化
Cu + 2H2SO4(浓)= CuSO4+ SO2 +2H2O
可用Fe、Al制容器盛装浓硫酸
H2SO4(浓)+ H2S = SO2↑+S↓ + 2H2O
(3)与某些还原性物质反应
H2SO4(浓)+ 2HBr = SO2↑+Br2+ 2H2O
H2SO4(浓)+ 2H I = SO2↑+ I2+ 2H2O
不能干燥还原性气体: H2S 、HBr 、H I
—2
—1
—1
-2
0
+6
+4
失去2e-
得到2e-
如何鉴别浓硫酸与稀硫酸?
方法一:
方法七:
方法二:
方法三:
方法四:
方法五:
方法六:
观察,油状为浓
体积相同时质量大的为浓
稀释,放热为浓
加入胆矾,变白为浓
加铜片并加热,铜片溶解为浓
加铁片或铝片,钝化为浓
使滤纸或木条变黑为浓
硫酸生产反应式
第三步:
四、硫酸的工业制法
反应原理
H2SO4
98.3%的浓硫酸吸收
SO2
硫磺
或黄铁矿
空气
燃烧
SO3
400~500℃
V2O5催化剂
SO3 + H2O H2SO4
第二步:
2SO2 + O2 2SO3
催化剂
△
第一步:
4FeS2 +11 O2 2Fe2O3 + 8SO2
高 温
S + O2 SO2
点燃
{
或者
五、硫酸根离子的检验
取少量待测溶液,先加稀HCL酸化,再加BaCL2溶液,
若有白色沉淀,证明有SO42-。
1.方法:
2.注意:
③不能用稀HNO3代替稀HCL
①加稀HCL的目的是排除CO32-、SO32-和A g+的干扰
④不能用Ba(NO3)2代替BaCL2
避免SO32-的干扰
避免SO32-的干扰
②不能用先加BaCL2再加稀HCL
避免A g+的干扰
本节要点
浓硫酸的三大特性
吸水性:
脱水性:
强氧化性
还原性物质
非金属单质
金属单质
吸收物质中现成的水分子
物质中没有现成水分子,氢、氧元素按2:1生成水
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
