2024届高三化学二轮复习专题突破练7:电化学(含解析)
文档属性
| 名称 | 2024届高三化学二轮复习专题突破练7:电化学(含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 741.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-18 13:45:16 | ||
图片预览



文档简介
专题突破练7 电化学
一、基础练
1.(2023·深圳模拟)我国有着丰富的海风资源,在海水中建立风电设备,防腐蚀是一个突出问题。下列说法正确的是( )
A.钢铁构件表面的镀铜破损后依然会保护内部钢铁不被腐蚀
B.可将钢铁构件与电源负极连接可减缓腐蚀发生
C.钢铁发生吸氧腐蚀时负极发生的反应为Fe-3e-===Fe3+
D.海水中发生化学腐蚀的速率大于电化学腐蚀速率
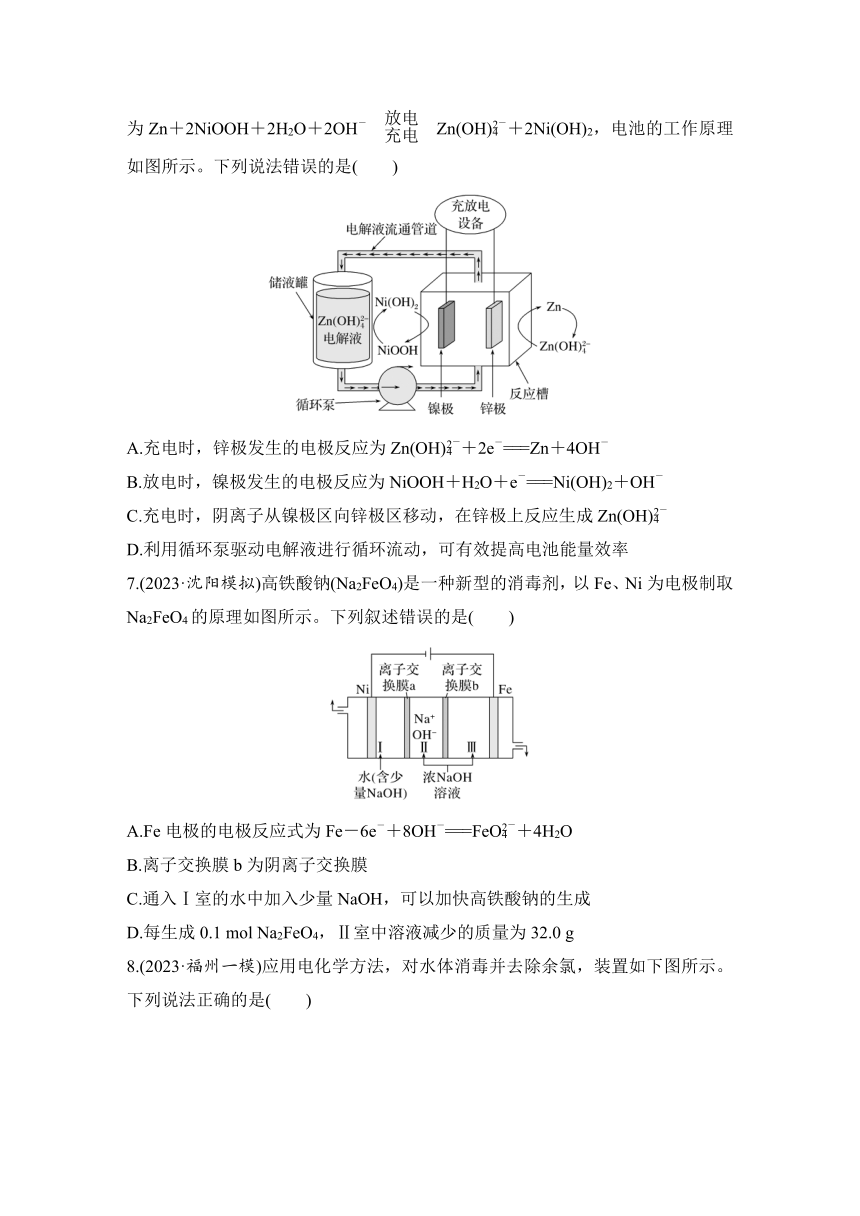
2.(2023·北京西城区高三统考)盐酸酸洗钢材的废液中含有大量的盐酸、FeCl2。研究人员利用如图装置可将部分铁元素在a极区转化为沉淀,实现资源和能源的再利用。下列说法不正确的是( )
A.电子由b极流向a极
B.离子交换膜为阴离子交换膜
C.该装置实现了化学能向电能转化
D.a极可发生电极反应:O2+4e-+2H2O===4OH-
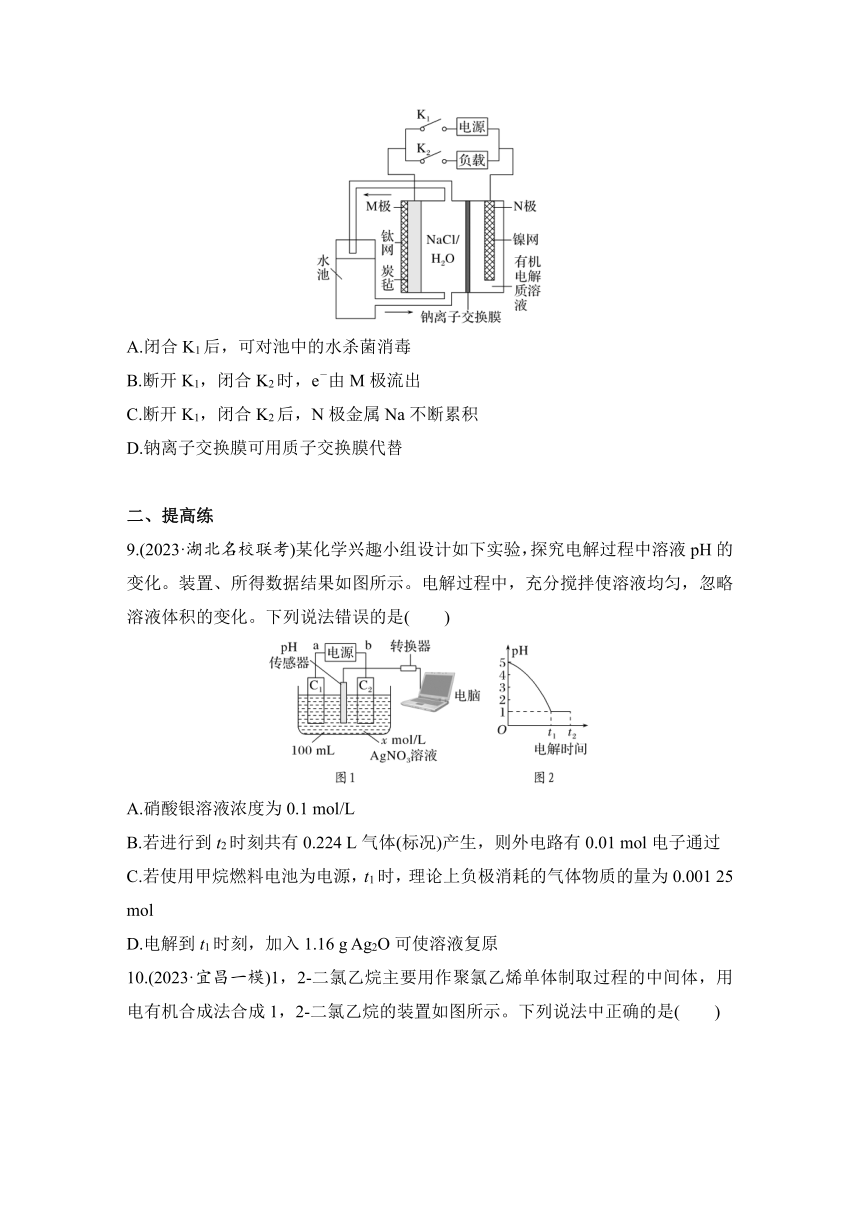
3.(2023·河北九师联盟联考)利用电化学方法可将CO2同时转化为甲烷、乙烯等产物,实验装置如图所示,下列说法错误的是( )
A.一段时间后,Cu极区溶液质量增大
B.若Pt极区产生8 mol H+,则产生CH4与C2H4共2 mol
C.生成乙烯的电极反应式为2CO2+12H++12e-===C2H4+4H2O
D.若生成0.15 mol CH4和0.30 mol C2H4则外电路中转移4.8 mol电子
4.(2023·沈阳高三联考)电化学制氢是实现氢经济的重要途径。中国科学院近来提出了一种新型的可充电锌—肼(Zn-N2H4)电池,采用双功能电催化剂实现了独立的析氢反应,原理如图,下列说法不正确的是( )
A.放电时,左侧电极反应式:Zn-2e-+4OH-===Zn(OH)
B.充电时,右侧电极反应式:N2H4-4e-+4OH-===N2↑+4H2O
C.电池工作时,N2与H2可同时在右侧生成
D.放电时,每转移2 mol e-,可产生标况下22.4 L气体
5.(2023·重庆三次联诊)工业上用双极膜电解槽电解糠醛溶液同时制备糠醇和糠酸盐,电解过程如图所示。下列说法不正确的是( )
A.电解时,阴极反应为+2e-+2H+===
B.理论上外电路中迁移2 mol电子,消耗1 mol糠醛
C.电解时,MnO2和MnOOH在电极与糠醛之间传递电子
D.生成糠酸盐的离子反应方程式为+2MnO2+OH-―→+2MnOOH
6.(2023·河北示范校三模)单液流锌镍电池以其成本低、效率高、寿命长等优势表现出较高的应用价值,电解液为ZnO溶解于碱性物质的产物Zn(OH),总反应为Zn+2NiOOH+2H2O+2OH-Zn(OH)+2Ni(OH)2,电池的工作原理如图所示。下列说法错误的是( )
A.充电时,锌极发生的电极反应为Zn(OH)+2e-===Zn+4OH-
B.放电时,镍极发生的电极反应为NiOOH+H2O+e-===Ni(OH)2+OH-
C.充电时,阴离子从镍极区向锌极区移动,在锌极上反应生成Zn(OH)
D.利用循环泵驱动电解液进行循环流动,可有效提高电池能量效率
7.(2023·沈阳模拟)高铁酸钠(Na2FeO4)是一种新型的消毒剂,以Fe、Ni为电极制取Na2FeO4的原理如图所示。下列叙述错误的是( )
A.Fe电极的电极反应式为Fe-6e-+8OH-===FeO+4H2O
B.离子交换膜b为阴离子交换膜
C.通入Ⅰ室的水中加入少量NaOH,可以加快高铁酸钠的生成
D.每生成0.1 mol Na2FeO4,Ⅱ室中溶液减少的质量为32.0 g
8.(2023·福州一模)应用电化学方法,对水体消毒并去除余氯,装置如下图所示。下列说法正确的是( )
A.闭合K1后,可对池中的水杀菌消毒
B.断开K1,闭合K2时,e-由M极流出
C.断开K1,闭合K2后,N极金属Na不断累积
D.钠离子交换膜可用质子交换膜代替
二、提高练
9.(2023·湖北名校联考)某化学兴趣小组设计如下实验,探究电解过程中溶液pH的变化。装置、所得数据结果如图所示。电解过程中,充分搅拌使溶液均匀,忽略溶液体积的变化。下列说法错误的是( )
A.硝酸银溶液浓度为0.1 mol/L
B.若进行到t2时刻共有0.224 L气体(标况)产生,则外电路有0.01 mol电子通过
C.若使用甲烷燃料电池为电源,t1时,理论上负极消耗的气体物质的量为0.001 25 mol
D.电解到t1时刻,加入1.16 g Ag2O可使溶液复原
10.(2023·宜昌一模)1,2 二氯乙烷主要用作聚氯乙烯单体制取过程的中间体,用电有机合成法合成1,2 二氯乙烷的装置如图所示。下列说法中正确的是( )
A.直流电源电极a为负极
B.X为阳离子交换膜,Y为阴离子交换膜
C.液相反应中,C2H4被氧化为1,2 二氯乙烷
D.该装置总反应为2Cl-+2H2O2OH-+H2↑+Cl2↑
11.(2023·全国乙卷)室温钠 硫电池被认为是一种成本低、比能量高的能源存储系统。一种室温钠 硫电池的结构如图所示。将钠箔置于聚苯并咪唑膜上作为一个电极,表面喷涂有硫黄粉末的炭化纤维素纸作为另一电极。工作时,在硫电极发生反应:S8+e-―→S,S+e-―→S,2Na++S+2e-―→Na2Sx
下列叙述错误的是( )
A.充电时Na+从钠电极向硫电极迁移
B.放电时外电路电子流动的方向是a→b
C.放电时正极反应为:2Na++S8+2e-―→Na2Sx
D.炭化纤维素纸的作用是增强硫电极导电性能
12.(2023·浙江选考仿真模拟)Zn-BiOI电池以ZnI2水溶液作为锌离子电池的氧化还原介质,可实现快速可逆的协同转化反应,具有超高的可逆容量和超长循环寿命。下列说法不正确的是( )
A.ZnI2能加快电极反应速率
B.放电时,正极反应为3BiOI+3e-===Bi+Bi2O3+3I-
C.充电时,Bi与外接电源正极相连
D.充电时,若转移2 mol e-,两电极总质量增加65 g
13.(2023·苏锡常镇四市调研)双极膜电渗析法固碳技术是将捕集的CO2转化为CaCO3而矿化封存,其工作原理如图所示。双极膜中间层中的H2O解离成H+和OH-,并在直流电场作用下分别向两极迁移。下列说法不正确的是( )
A.两个双极膜中间层中的H+均向左侧迁移
B.若碱室中比值增大,则有利于CO2的矿化封存
C.电解一段时间后,酸室中盐酸的浓度增大
D.该技术中电解固碳总反应的离子方程式为2Ca2++2CO2+4H2O2CaCO3↓+2H2↑+O2↑+4H+
14.(2023·绵阳二模)pH计的工作原理(如图所示)是通过测定电池电动势E(即玻璃电极和参比电极的电势差)而确定待测溶液的pH。电池电动势E与待测溶液pH关系为:E=0.059 pH+K(E的单位为V,K为常数)。下列说法错误的是( )
A.pH计工作时,化学能转化为电能
B.玻璃电极玻璃膜内外c(H+)的差异会引起电池电动势的变化
C.若玻璃电极电势比参比电极低,玻璃电极反应:AgCl(s)+e-===Ag(s)+Cl-
D.若测得pH=3的标准溶液电池电动势E为0.377 V,可标定常数K=0.2
15.(2023·山东卷改编)利用热再生氨电池可实现CuSO4 电镀废液的浓缩再生。电池装置如图所示,甲、乙两室均预加相同的CuSO4电镀废液,向甲室加入足量氨水后电池开始工作。下列说法错误的是( )
A.甲室Cu电极为负极
B.隔膜为阳离子膜
C.电池总反应为:Cu2++4NH3===[Cu(NH3)4]2+
D.NH3扩散到乙室将对电池电动势产生影响
16.(2023·永州高三适应性考试)双膜碱性多硫化物空气液流二次电池可用于再生能源储能和智能电网的备用电源等,电极Ⅰ为掺杂Na2S2的电极,电极Ⅱ为碳电极。电池工作原理如下图所示。下列说法错误的是( )
A.离子交换膜a为阳离子交换膜,离子交换膜b为阴离子交换膜
B.放电时,中间储液器中NaOH的浓度不断变大
C.充电时,电极Ⅰ的电极反应式为:2S-2e-===S
D.充电时,电路中每通过1 mol电子,阳极室溶液质量理论上增加9 g
参考答案
1.B [铜镀层破损后,Cu、Fe和海水构成原电池,Fe失电子作负极,Fe加速被腐蚀,A项错误;将钢铁部件与电源负极连接减缓腐蚀是外加电流法,可以减缓腐蚀发生,B项正确;钢铁发生吸氧腐蚀时负极发生的反应为Fe-2e-===Fe2+,C项错误;发生电化学腐蚀的速率大于化学腐蚀速率,D项错误。]
2.B [由图可知,该装置为原电池,通入空气的电极a为正极,电极反应为:O2+4e-+2H2O===4OH-,电极b是负极,负极区盐酸酸洗的废液含有大量的盐酸、FeCl2,负极的电极反应为Fe2+-e-===Fe3+,负极区反应生成的Fe3+向a极移动,与OH-生成Fe(OH)3沉淀,据此分析解答。A.电池中电子由负极经外电路流向正极,即电子由b极流向a极,故A正确;B.a极的电极反应为:O2+4e-+2H2O===4OH-,为维持电荷守恒,且在a极区产生含铁沉淀,则离子交换膜为阳离子交换膜,故B错误;C.该装置为原电池,实现了化学能向电能转化,故C正确;D.a极为原电池正极,该极通入空气,氧气得电子,电极反应为:O2+4e-+2H2O===4OH-,故D正确。]
3.B [根据装置图,CO2生成CH4、C2H4,以CO2转化为C2H4为例,每2 mol CO2转化为1 mol C2H4,质量变化为44×2 g+12×1 g-28×1 g>0,所以对应电极区溶液的质量增大,同理,生成甲烷,溶液质量也会增大,A项正确;Pt极区产生8 mol H+,移向Cu极区,因为生成CH4和C2H4的比不确定外,且氢离子还有一部分转化生成了H2O,所以无法根据迁移的氢离子具体计算有多少甲烷和乙烯生成,B项错误;铜电极为阴极,CO2参与反应,溶液呈酸性,因此产生乙烯的电极反应式为2CO2+12H++12e-===C2H4+4H2O,C项正确;生成0.15 mol CH4和0.30 mol C2H4,转移电子的物质的量为0.15 mol×8+0.30 mol×6×2=4.8 mol,D项正确。]
4.C [A.放电时为原电池,左侧是负极,电极反应式:Zn-2e-+4OH-===Zn(OH),A正确;B.充电时,右侧与电源正极相连为阳极,电极反应式:N2H4-4e-+4OH-===N2↑+4H2O,B正确;C.放电时右侧发生的反应是2H2O+2e-===H2↑+2OH-,充电时 N2H4-4e-+4OH-===N2↑+4H2O,所以N2与H2没有同时在右侧生成,C错误;D.放电时,每转移2 mole-,由2H2O+2e-===H2↑+2OH-可知产生标况下22.4 L气体,D正确。]
5.B [根据图示,阳极室中,MnOOH失电子变为MnO2;阴极室中,糠醛得电子生成糠醇。双极膜将水解离为H+和OH-,并实现其定向通过。据图可知电解时,阴极反应为+2e-+2H+===,A正确;理论上外电路中迁移2 mol电子,阳极室和阴极室各需要消耗1 mol糠醛,共需要消耗2 mol糠醛,B错误;电解时,MnO2和MnOOH在电极与糠醛之间传递电子,C正确;据图可知在阳极室糠醛生成糠酸盐的离子反应方程式为+2MnO2+OH-―→+2MnOOH,D正确。]
6.C [充电时,锌极为阴极,电极反应为Zn(OH)+2e-===Zn+4OH-,A正确;放电时,镍极为正极,电极反应为NiOOH+H2O+e-===Ni(OH)2+OH-,B正确;充电时,镍极为阳极,阴离子从锌极区向镍极区移动,Zn(OH)在锌极上得电子生成金属锌,C错误;利用循环泵驱动电解液使其通过输送管道在电池反应槽与储液罐之间循环流动,可有效抑制电池内部电解液的浓度差造成的影响,从而提高电池能量效率,D正确。]
7.D [该装置以Fe、Ni为电极制取Na2FeO4,为电解池装置,Fe电极为阳极,Ni电极为阴极,阳极电极反应式为Fe-6e-+8OH-===FeO+4H2O,OH-移动向Ⅲ室,阴极电极反应式为2H2O+2e-===H2↑+2OH-,Na+应移动向Ⅰ室。A项,Fe电极为阳极,Fe失电子生成FeO,电极反应式为Fe-6e-+8OH-===FeO+4H2O,故A正确;B项,Fe电极为阳极,Ni电极为阴极,Ⅱ室中的Na+移动向Ⅰ室,OH-移动向Ⅲ室,故离子交换膜a、b分别为阳离子交换膜、阴离子交换膜,故B正确;C项,通入Ⅰ室的水中加入少量NaOH,可以增强溶液的导电性,可以加快高铁酸钠的生成,故C正确;D项,每生成0.1 mol Na2FeO4,外电路中通过0.6 mol电子,则Ⅱ室溶液中减少的NaOH的物质的量为0.6 mol,质量为24.0 g,故D错误;故选D。]
8.A [A.闭合K1后,构成电解池装置,M极为阳极,电极反应式:2Cl--2e-===Cl2↑,氯气进入水池消毒,A正确;B.断开K1,闭合K2时,构成原电池装置,M极为正极,N极为负极,e-由N极流出,B错误;C.断开K1,闭合K2后,构成原电池装置,N极为负极,电极反应式:Na-e-===Na+,N极金属Na不断减少,C错误;D.钠离子交换膜换成质子交换膜后H+会穿过膜与N极的Na反应,故不可换为质子交换膜,D错误。]
9.B [A.根据图2中pH的变化与电解过程的关系:开始时发生:4AgNO3+2H2O4Ag+O2↑+4HNO3,溶质从AgNO3→HNO3,pH变化快,当Ag+完全放电,接着发生:2H2O2H2↑+O2↑,pH变化小,因此t1时刻Ag+恰好完全耗尽,pH=1,c(H+)=0.1 mol/L,推出c(HNO3)=0.1 mol/L,c(AgNO3)=0.1 mol/L,故A说法正确;B.t1时刻时产生O2为:0.002 5 mol,t1~t2时,发生2H2O2H2↑+O2↑,生成的氧气为:(-0.002 5)×=0.002 5 mol,故0~t2时,共产生0.005 mol O2,外电路有0.02 mol电子通过,故B说法错误;C.t1时刻,电路通过电子为:0.1×0.1 mol,甲烷燃料电池中甲烷与转移电子关系:CH4~8e-,燃料电池负极消耗的甲烷的物质的量为:0.01×mol=0.001 25 mol,故C说法正确;D.电解到t1时刻析出0.01 mol Ag和0.002 5 mol O2,应加入0.005 mol Ag2O可恰好恢复至电解前状态,即加入1.16 g Ag2O则能恢复至电解前状态,故D说法正确。]
10.C [由电解池装置图可知,左侧亚铜离子失去电子生成二价铜离子,为电解池的阳极,则a为电源正极,溶液中的氯离子经过阴离子交换膜X移向阳极,右侧氢离子得到电子生成氢气,为阴极,则b为电源的负极,溶液中的钠离子经过阳离子交换膜Y移向阴极,同时生成氢氧化钠。液相反应中氯化铜与乙烯反应生成1,2 二氯乙烷和氯化亚铜,据此解答。A.根据分析,直流电源a极为正极,A错误;B.由分析可知,X为阴离子交换膜,Y为阳离子交换膜,B错误;C.液相反应中,C2H4与CuCl2反应生成1,2 二氯乙烷时碳元素化合价升高,发生氧化反应,C2H4被CuCl2氧化为1,2 二氯乙烷,C正确;D.以NaCl溶液和乙烯为原料合成1,2 二氯乙烷中, CuCl循环使用,其实质是NaCl、H2O与 CH2===CH2反应,所以总反应为CH2===CH2+2H2O+2NaClH2↑+2NaOH+ClCH2CH2Cl,D错误。]
11.A [由题意可知放电时硫电极得电子,硫电极为原电池正极,钠电极为原电池负极。A.充电时为电解池装置,阳离子移向阴极,即钠电极,故充电时,Na+由硫电极迁移至钠电极,A错误;B.放电时Na在a电极失去电子,失去的电子经外电路流向b电极,硫黄粉在b电极上得电子与a电极释放出的Na+结合得到Na2Sx,电子在外电路的流向为a→b,B正确;C.由题给的一系列方程式相加可以得到放电时正极的反应式为2Na++S8+2e-―→Na2Sx,C正确;D.炭化纤维素纸中含有大量的炭,炭具有良好的导电性,可以增强硫电极的导电性能,D正确。]
12.D [Zn-BiOI电池中,放电时,Zn作负极,BiOI作正极,充电时,Bi作阳极,连接电源正极,Bi2O3连接电源负极。A项,由图可知,ZnI2水溶液作为锌离子电池的氧化还原介质,在Zn-BiOI电池中转移电子,充当催化剂,可以加快电极反应速率,A正确;B项,放电时,BiOI作正极,正极反应为3BiOI+3e-===Bi+Bi2O3+3I-,B正确;C项,充电时,Bi作阳极,Bi与外接电源正极相连,C正确;D项,充电时,总反应式为:3ZnI2+2Bi+2Bi2O3===6BiOI+3Zn,由B选项可知,该反应转移6个电子,若反应转移2 mol e-,两电极总质量增加1 mol ZnI2,即增加319 g,D错误。]
13.B [左侧双极膜中氢氧根离子向碱室中迁移,氢离子向左室迁移,氯离子透过阴离子交换膜进入酸室,右侧双极膜中氢离子左侧迁移进入酸室,故A正确;碱室中碳酸根离子透过阴离子交换膜,与钙离子结合生成碳酸钙,若碱室中比值增大,HCO可能进入酸室不利于CO2的矿化封存,故B错误;碱室中碳酸根离子透过阴离子交换膜,与钙离子结合生成碳酸钙,氯离子透过阴离子交换膜进入酸室,右侧双极膜中氢离子进入酸室,酸室中盐酸的浓度增大,故C正确;由两极反应和分析可知,电解固碳总反应的离子方程式为:2Ca2++2CO2+4H2O2CaCO3↓+2H2↑+O2↑+4H+,故D正确。]
14.C [A.原电池是把化学能转化为电能,pH计是以玻璃电极(在特制玻璃薄膜球内放置已知浓度的HCl溶液,并插入Ag-AgCl电极)和另一Ag-AgCl电极插入待测溶液中组成电池,pH计工作时,化学能转化为电能,A正确;B.pH与电池的电动势E存在关系:E=0.059 pH+K,则pH=,利用玻璃膜内外氢离子浓度的差异引起电动势的变化达到测量溶液的pH目的,B正确;C.若玻璃电极电势比参比电极低,为原电池负极,负极上是银失电子生成氯化银,电极反应为:Ag-e-+Cl-===AgCl,C错误; D.pH与电池的电动势E存在关系:E=0.059 pH+K,若测得pH=3的标准溶液电池电动势E为0.377 V,可标定常数K=E-0.059 pH=0.377-0.059×3=0.2,D正确。]
15.B [A.向甲室加入足量氨水后电池开始工作,则甲室Cu电极溶解,变为铜离子与氨气形成[Cu(NH3)4]2+,因此甲室Cu电极为负极,A正确;B.在原电池内电路中阳离子向正极移动,若隔膜为阳离子膜,电极溶解生成的铜离子要向右侧移动,通入氨气要消耗铜离子,显然左侧阳离子不断减小,明显不利于电池反应正常进行,B错误;C.左侧负极是Cu-2e-+4NH3===[Cu(NH3)4]2+,正极是Cu2++2e-===Cu,则电池总反应为:Cu2++4NH3===[Cu(NH3)4]2+,C正确;D.NH3扩散到乙室会与铜离子反应生成[Cu(NH3)4]2+,铜离子浓度降低,铜离子得电子能力减弱,因此将对电池电动势产生影响,D正确。]
16.C [由图分析可知,电极Ⅱ为碳电极,放电时,氧气发生还原反应生成氢氧根离子,为正极,则电极Ⅰ为负极。放电时,正极发生还原反应,反应为O2+2H2O+4e-===4OH-;负极发生氧化反应,反应为2S-2e-===S;正极区氢氧根离子向左侧移动,离子交换膜b为阴离子交换膜;负极区钠离子向右侧移动,离子交换膜a为阳离子交换膜,中间储液器中NaOH的浓度不断变大,A正确,B正确;充电时,电极Ⅰ为阴极,得到电子发生还原反应,C错误;充电时,电极Ⅱ为阳极区,反应为4OH--4e-===O2+2H2O,电路中每通过1 mol 电子,阳极室从中间储液器进入1 mol氢氧根离子、同时生成0.25 mol氧气,溶液质量理论上增加17 g-8 g=9 g,D正确
一、基础练
1.(2023·深圳模拟)我国有着丰富的海风资源,在海水中建立风电设备,防腐蚀是一个突出问题。下列说法正确的是( )
A.钢铁构件表面的镀铜破损后依然会保护内部钢铁不被腐蚀
B.可将钢铁构件与电源负极连接可减缓腐蚀发生
C.钢铁发生吸氧腐蚀时负极发生的反应为Fe-3e-===Fe3+
D.海水中发生化学腐蚀的速率大于电化学腐蚀速率
2.(2023·北京西城区高三统考)盐酸酸洗钢材的废液中含有大量的盐酸、FeCl2。研究人员利用如图装置可将部分铁元素在a极区转化为沉淀,实现资源和能源的再利用。下列说法不正确的是( )
A.电子由b极流向a极
B.离子交换膜为阴离子交换膜
C.该装置实现了化学能向电能转化
D.a极可发生电极反应:O2+4e-+2H2O===4OH-
3.(2023·河北九师联盟联考)利用电化学方法可将CO2同时转化为甲烷、乙烯等产物,实验装置如图所示,下列说法错误的是( )
A.一段时间后,Cu极区溶液质量增大
B.若Pt极区产生8 mol H+,则产生CH4与C2H4共2 mol
C.生成乙烯的电极反应式为2CO2+12H++12e-===C2H4+4H2O
D.若生成0.15 mol CH4和0.30 mol C2H4则外电路中转移4.8 mol电子
4.(2023·沈阳高三联考)电化学制氢是实现氢经济的重要途径。中国科学院近来提出了一种新型的可充电锌—肼(Zn-N2H4)电池,采用双功能电催化剂实现了独立的析氢反应,原理如图,下列说法不正确的是( )
A.放电时,左侧电极反应式:Zn-2e-+4OH-===Zn(OH)
B.充电时,右侧电极反应式:N2H4-4e-+4OH-===N2↑+4H2O
C.电池工作时,N2与H2可同时在右侧生成
D.放电时,每转移2 mol e-,可产生标况下22.4 L气体
5.(2023·重庆三次联诊)工业上用双极膜电解槽电解糠醛溶液同时制备糠醇和糠酸盐,电解过程如图所示。下列说法不正确的是( )
A.电解时,阴极反应为+2e-+2H+===
B.理论上外电路中迁移2 mol电子,消耗1 mol糠醛
C.电解时,MnO2和MnOOH在电极与糠醛之间传递电子
D.生成糠酸盐的离子反应方程式为+2MnO2+OH-―→+2MnOOH
6.(2023·河北示范校三模)单液流锌镍电池以其成本低、效率高、寿命长等优势表现出较高的应用价值,电解液为ZnO溶解于碱性物质的产物Zn(OH),总反应为Zn+2NiOOH+2H2O+2OH-Zn(OH)+2Ni(OH)2,电池的工作原理如图所示。下列说法错误的是( )
A.充电时,锌极发生的电极反应为Zn(OH)+2e-===Zn+4OH-
B.放电时,镍极发生的电极反应为NiOOH+H2O+e-===Ni(OH)2+OH-
C.充电时,阴离子从镍极区向锌极区移动,在锌极上反应生成Zn(OH)
D.利用循环泵驱动电解液进行循环流动,可有效提高电池能量效率
7.(2023·沈阳模拟)高铁酸钠(Na2FeO4)是一种新型的消毒剂,以Fe、Ni为电极制取Na2FeO4的原理如图所示。下列叙述错误的是( )
A.Fe电极的电极反应式为Fe-6e-+8OH-===FeO+4H2O
B.离子交换膜b为阴离子交换膜
C.通入Ⅰ室的水中加入少量NaOH,可以加快高铁酸钠的生成
D.每生成0.1 mol Na2FeO4,Ⅱ室中溶液减少的质量为32.0 g
8.(2023·福州一模)应用电化学方法,对水体消毒并去除余氯,装置如下图所示。下列说法正确的是( )
A.闭合K1后,可对池中的水杀菌消毒
B.断开K1,闭合K2时,e-由M极流出
C.断开K1,闭合K2后,N极金属Na不断累积
D.钠离子交换膜可用质子交换膜代替
二、提高练
9.(2023·湖北名校联考)某化学兴趣小组设计如下实验,探究电解过程中溶液pH的变化。装置、所得数据结果如图所示。电解过程中,充分搅拌使溶液均匀,忽略溶液体积的变化。下列说法错误的是( )
A.硝酸银溶液浓度为0.1 mol/L
B.若进行到t2时刻共有0.224 L气体(标况)产生,则外电路有0.01 mol电子通过
C.若使用甲烷燃料电池为电源,t1时,理论上负极消耗的气体物质的量为0.001 25 mol
D.电解到t1时刻,加入1.16 g Ag2O可使溶液复原
10.(2023·宜昌一模)1,2 二氯乙烷主要用作聚氯乙烯单体制取过程的中间体,用电有机合成法合成1,2 二氯乙烷的装置如图所示。下列说法中正确的是( )
A.直流电源电极a为负极
B.X为阳离子交换膜,Y为阴离子交换膜
C.液相反应中,C2H4被氧化为1,2 二氯乙烷
D.该装置总反应为2Cl-+2H2O2OH-+H2↑+Cl2↑
11.(2023·全国乙卷)室温钠 硫电池被认为是一种成本低、比能量高的能源存储系统。一种室温钠 硫电池的结构如图所示。将钠箔置于聚苯并咪唑膜上作为一个电极,表面喷涂有硫黄粉末的炭化纤维素纸作为另一电极。工作时,在硫电极发生反应:S8+e-―→S,S+e-―→S,2Na++S+2e-―→Na2Sx
下列叙述错误的是( )
A.充电时Na+从钠电极向硫电极迁移
B.放电时外电路电子流动的方向是a→b
C.放电时正极反应为:2Na++S8+2e-―→Na2Sx
D.炭化纤维素纸的作用是增强硫电极导电性能
12.(2023·浙江选考仿真模拟)Zn-BiOI电池以ZnI2水溶液作为锌离子电池的氧化还原介质,可实现快速可逆的协同转化反应,具有超高的可逆容量和超长循环寿命。下列说法不正确的是( )
A.ZnI2能加快电极反应速率
B.放电时,正极反应为3BiOI+3e-===Bi+Bi2O3+3I-
C.充电时,Bi与外接电源正极相连
D.充电时,若转移2 mol e-,两电极总质量增加65 g
13.(2023·苏锡常镇四市调研)双极膜电渗析法固碳技术是将捕集的CO2转化为CaCO3而矿化封存,其工作原理如图所示。双极膜中间层中的H2O解离成H+和OH-,并在直流电场作用下分别向两极迁移。下列说法不正确的是( )
A.两个双极膜中间层中的H+均向左侧迁移
B.若碱室中比值增大,则有利于CO2的矿化封存
C.电解一段时间后,酸室中盐酸的浓度增大
D.该技术中电解固碳总反应的离子方程式为2Ca2++2CO2+4H2O2CaCO3↓+2H2↑+O2↑+4H+
14.(2023·绵阳二模)pH计的工作原理(如图所示)是通过测定电池电动势E(即玻璃电极和参比电极的电势差)而确定待测溶液的pH。电池电动势E与待测溶液pH关系为:E=0.059 pH+K(E的单位为V,K为常数)。下列说法错误的是( )
A.pH计工作时,化学能转化为电能
B.玻璃电极玻璃膜内外c(H+)的差异会引起电池电动势的变化
C.若玻璃电极电势比参比电极低,玻璃电极反应:AgCl(s)+e-===Ag(s)+Cl-
D.若测得pH=3的标准溶液电池电动势E为0.377 V,可标定常数K=0.2
15.(2023·山东卷改编)利用热再生氨电池可实现CuSO4 电镀废液的浓缩再生。电池装置如图所示,甲、乙两室均预加相同的CuSO4电镀废液,向甲室加入足量氨水后电池开始工作。下列说法错误的是( )
A.甲室Cu电极为负极
B.隔膜为阳离子膜
C.电池总反应为:Cu2++4NH3===[Cu(NH3)4]2+
D.NH3扩散到乙室将对电池电动势产生影响
16.(2023·永州高三适应性考试)双膜碱性多硫化物空气液流二次电池可用于再生能源储能和智能电网的备用电源等,电极Ⅰ为掺杂Na2S2的电极,电极Ⅱ为碳电极。电池工作原理如下图所示。下列说法错误的是( )
A.离子交换膜a为阳离子交换膜,离子交换膜b为阴离子交换膜
B.放电时,中间储液器中NaOH的浓度不断变大
C.充电时,电极Ⅰ的电极反应式为:2S-2e-===S
D.充电时,电路中每通过1 mol电子,阳极室溶液质量理论上增加9 g
参考答案
1.B [铜镀层破损后,Cu、Fe和海水构成原电池,Fe失电子作负极,Fe加速被腐蚀,A项错误;将钢铁部件与电源负极连接减缓腐蚀是外加电流法,可以减缓腐蚀发生,B项正确;钢铁发生吸氧腐蚀时负极发生的反应为Fe-2e-===Fe2+,C项错误;发生电化学腐蚀的速率大于化学腐蚀速率,D项错误。]
2.B [由图可知,该装置为原电池,通入空气的电极a为正极,电极反应为:O2+4e-+2H2O===4OH-,电极b是负极,负极区盐酸酸洗的废液含有大量的盐酸、FeCl2,负极的电极反应为Fe2+-e-===Fe3+,负极区反应生成的Fe3+向a极移动,与OH-生成Fe(OH)3沉淀,据此分析解答。A.电池中电子由负极经外电路流向正极,即电子由b极流向a极,故A正确;B.a极的电极反应为:O2+4e-+2H2O===4OH-,为维持电荷守恒,且在a极区产生含铁沉淀,则离子交换膜为阳离子交换膜,故B错误;C.该装置为原电池,实现了化学能向电能转化,故C正确;D.a极为原电池正极,该极通入空气,氧气得电子,电极反应为:O2+4e-+2H2O===4OH-,故D正确。]
3.B [根据装置图,CO2生成CH4、C2H4,以CO2转化为C2H4为例,每2 mol CO2转化为1 mol C2H4,质量变化为44×2 g+12×1 g-28×1 g>0,所以对应电极区溶液的质量增大,同理,生成甲烷,溶液质量也会增大,A项正确;Pt极区产生8 mol H+,移向Cu极区,因为生成CH4和C2H4的比不确定外,且氢离子还有一部分转化生成了H2O,所以无法根据迁移的氢离子具体计算有多少甲烷和乙烯生成,B项错误;铜电极为阴极,CO2参与反应,溶液呈酸性,因此产生乙烯的电极反应式为2CO2+12H++12e-===C2H4+4H2O,C项正确;生成0.15 mol CH4和0.30 mol C2H4,转移电子的物质的量为0.15 mol×8+0.30 mol×6×2=4.8 mol,D项正确。]
4.C [A.放电时为原电池,左侧是负极,电极反应式:Zn-2e-+4OH-===Zn(OH),A正确;B.充电时,右侧与电源正极相连为阳极,电极反应式:N2H4-4e-+4OH-===N2↑+4H2O,B正确;C.放电时右侧发生的反应是2H2O+2e-===H2↑+2OH-,充电时 N2H4-4e-+4OH-===N2↑+4H2O,所以N2与H2没有同时在右侧生成,C错误;D.放电时,每转移2 mole-,由2H2O+2e-===H2↑+2OH-可知产生标况下22.4 L气体,D正确。]
5.B [根据图示,阳极室中,MnOOH失电子变为MnO2;阴极室中,糠醛得电子生成糠醇。双极膜将水解离为H+和OH-,并实现其定向通过。据图可知电解时,阴极反应为+2e-+2H+===,A正确;理论上外电路中迁移2 mol电子,阳极室和阴极室各需要消耗1 mol糠醛,共需要消耗2 mol糠醛,B错误;电解时,MnO2和MnOOH在电极与糠醛之间传递电子,C正确;据图可知在阳极室糠醛生成糠酸盐的离子反应方程式为+2MnO2+OH-―→+2MnOOH,D正确。]
6.C [充电时,锌极为阴极,电极反应为Zn(OH)+2e-===Zn+4OH-,A正确;放电时,镍极为正极,电极反应为NiOOH+H2O+e-===Ni(OH)2+OH-,B正确;充电时,镍极为阳极,阴离子从锌极区向镍极区移动,Zn(OH)在锌极上得电子生成金属锌,C错误;利用循环泵驱动电解液使其通过输送管道在电池反应槽与储液罐之间循环流动,可有效抑制电池内部电解液的浓度差造成的影响,从而提高电池能量效率,D正确。]
7.D [该装置以Fe、Ni为电极制取Na2FeO4,为电解池装置,Fe电极为阳极,Ni电极为阴极,阳极电极反应式为Fe-6e-+8OH-===FeO+4H2O,OH-移动向Ⅲ室,阴极电极反应式为2H2O+2e-===H2↑+2OH-,Na+应移动向Ⅰ室。A项,Fe电极为阳极,Fe失电子生成FeO,电极反应式为Fe-6e-+8OH-===FeO+4H2O,故A正确;B项,Fe电极为阳极,Ni电极为阴极,Ⅱ室中的Na+移动向Ⅰ室,OH-移动向Ⅲ室,故离子交换膜a、b分别为阳离子交换膜、阴离子交换膜,故B正确;C项,通入Ⅰ室的水中加入少量NaOH,可以增强溶液的导电性,可以加快高铁酸钠的生成,故C正确;D项,每生成0.1 mol Na2FeO4,外电路中通过0.6 mol电子,则Ⅱ室溶液中减少的NaOH的物质的量为0.6 mol,质量为24.0 g,故D错误;故选D。]
8.A [A.闭合K1后,构成电解池装置,M极为阳极,电极反应式:2Cl--2e-===Cl2↑,氯气进入水池消毒,A正确;B.断开K1,闭合K2时,构成原电池装置,M极为正极,N极为负极,e-由N极流出,B错误;C.断开K1,闭合K2后,构成原电池装置,N极为负极,电极反应式:Na-e-===Na+,N极金属Na不断减少,C错误;D.钠离子交换膜换成质子交换膜后H+会穿过膜与N极的Na反应,故不可换为质子交换膜,D错误。]
9.B [A.根据图2中pH的变化与电解过程的关系:开始时发生:4AgNO3+2H2O4Ag+O2↑+4HNO3,溶质从AgNO3→HNO3,pH变化快,当Ag+完全放电,接着发生:2H2O2H2↑+O2↑,pH变化小,因此t1时刻Ag+恰好完全耗尽,pH=1,c(H+)=0.1 mol/L,推出c(HNO3)=0.1 mol/L,c(AgNO3)=0.1 mol/L,故A说法正确;B.t1时刻时产生O2为:0.002 5 mol,t1~t2时,发生2H2O2H2↑+O2↑,生成的氧气为:(-0.002 5)×=0.002 5 mol,故0~t2时,共产生0.005 mol O2,外电路有0.02 mol电子通过,故B说法错误;C.t1时刻,电路通过电子为:0.1×0.1 mol,甲烷燃料电池中甲烷与转移电子关系:CH4~8e-,燃料电池负极消耗的甲烷的物质的量为:0.01×mol=0.001 25 mol,故C说法正确;D.电解到t1时刻析出0.01 mol Ag和0.002 5 mol O2,应加入0.005 mol Ag2O可恰好恢复至电解前状态,即加入1.16 g Ag2O则能恢复至电解前状态,故D说法正确。]
10.C [由电解池装置图可知,左侧亚铜离子失去电子生成二价铜离子,为电解池的阳极,则a为电源正极,溶液中的氯离子经过阴离子交换膜X移向阳极,右侧氢离子得到电子生成氢气,为阴极,则b为电源的负极,溶液中的钠离子经过阳离子交换膜Y移向阴极,同时生成氢氧化钠。液相反应中氯化铜与乙烯反应生成1,2 二氯乙烷和氯化亚铜,据此解答。A.根据分析,直流电源a极为正极,A错误;B.由分析可知,X为阴离子交换膜,Y为阳离子交换膜,B错误;C.液相反应中,C2H4与CuCl2反应生成1,2 二氯乙烷时碳元素化合价升高,发生氧化反应,C2H4被CuCl2氧化为1,2 二氯乙烷,C正确;D.以NaCl溶液和乙烯为原料合成1,2 二氯乙烷中, CuCl循环使用,其实质是NaCl、H2O与 CH2===CH2反应,所以总反应为CH2===CH2+2H2O+2NaClH2↑+2NaOH+ClCH2CH2Cl,D错误。]
11.A [由题意可知放电时硫电极得电子,硫电极为原电池正极,钠电极为原电池负极。A.充电时为电解池装置,阳离子移向阴极,即钠电极,故充电时,Na+由硫电极迁移至钠电极,A错误;B.放电时Na在a电极失去电子,失去的电子经外电路流向b电极,硫黄粉在b电极上得电子与a电极释放出的Na+结合得到Na2Sx,电子在外电路的流向为a→b,B正确;C.由题给的一系列方程式相加可以得到放电时正极的反应式为2Na++S8+2e-―→Na2Sx,C正确;D.炭化纤维素纸中含有大量的炭,炭具有良好的导电性,可以增强硫电极的导电性能,D正确。]
12.D [Zn-BiOI电池中,放电时,Zn作负极,BiOI作正极,充电时,Bi作阳极,连接电源正极,Bi2O3连接电源负极。A项,由图可知,ZnI2水溶液作为锌离子电池的氧化还原介质,在Zn-BiOI电池中转移电子,充当催化剂,可以加快电极反应速率,A正确;B项,放电时,BiOI作正极,正极反应为3BiOI+3e-===Bi+Bi2O3+3I-,B正确;C项,充电时,Bi作阳极,Bi与外接电源正极相连,C正确;D项,充电时,总反应式为:3ZnI2+2Bi+2Bi2O3===6BiOI+3Zn,由B选项可知,该反应转移6个电子,若反应转移2 mol e-,两电极总质量增加1 mol ZnI2,即增加319 g,D错误。]
13.B [左侧双极膜中氢氧根离子向碱室中迁移,氢离子向左室迁移,氯离子透过阴离子交换膜进入酸室,右侧双极膜中氢离子左侧迁移进入酸室,故A正确;碱室中碳酸根离子透过阴离子交换膜,与钙离子结合生成碳酸钙,若碱室中比值增大,HCO可能进入酸室不利于CO2的矿化封存,故B错误;碱室中碳酸根离子透过阴离子交换膜,与钙离子结合生成碳酸钙,氯离子透过阴离子交换膜进入酸室,右侧双极膜中氢离子进入酸室,酸室中盐酸的浓度增大,故C正确;由两极反应和分析可知,电解固碳总反应的离子方程式为:2Ca2++2CO2+4H2O2CaCO3↓+2H2↑+O2↑+4H+,故D正确。]
14.C [A.原电池是把化学能转化为电能,pH计是以玻璃电极(在特制玻璃薄膜球内放置已知浓度的HCl溶液,并插入Ag-AgCl电极)和另一Ag-AgCl电极插入待测溶液中组成电池,pH计工作时,化学能转化为电能,A正确;B.pH与电池的电动势E存在关系:E=0.059 pH+K,则pH=,利用玻璃膜内外氢离子浓度的差异引起电动势的变化达到测量溶液的pH目的,B正确;C.若玻璃电极电势比参比电极低,为原电池负极,负极上是银失电子生成氯化银,电极反应为:Ag-e-+Cl-===AgCl,C错误; D.pH与电池的电动势E存在关系:E=0.059 pH+K,若测得pH=3的标准溶液电池电动势E为0.377 V,可标定常数K=E-0.059 pH=0.377-0.059×3=0.2,D正确。]
15.B [A.向甲室加入足量氨水后电池开始工作,则甲室Cu电极溶解,变为铜离子与氨气形成[Cu(NH3)4]2+,因此甲室Cu电极为负极,A正确;B.在原电池内电路中阳离子向正极移动,若隔膜为阳离子膜,电极溶解生成的铜离子要向右侧移动,通入氨气要消耗铜离子,显然左侧阳离子不断减小,明显不利于电池反应正常进行,B错误;C.左侧负极是Cu-2e-+4NH3===[Cu(NH3)4]2+,正极是Cu2++2e-===Cu,则电池总反应为:Cu2++4NH3===[Cu(NH3)4]2+,C正确;D.NH3扩散到乙室会与铜离子反应生成[Cu(NH3)4]2+,铜离子浓度降低,铜离子得电子能力减弱,因此将对电池电动势产生影响,D正确。]
16.C [由图分析可知,电极Ⅱ为碳电极,放电时,氧气发生还原反应生成氢氧根离子,为正极,则电极Ⅰ为负极。放电时,正极发生还原反应,反应为O2+2H2O+4e-===4OH-;负极发生氧化反应,反应为2S-2e-===S;正极区氢氧根离子向左侧移动,离子交换膜b为阴离子交换膜;负极区钠离子向右侧移动,离子交换膜a为阳离子交换膜,中间储液器中NaOH的浓度不断变大,A正确,B正确;充电时,电极Ⅰ为阴极,得到电子发生还原反应,C错误;充电时,电极Ⅱ为阳极区,反应为4OH--4e-===O2+2H2O,电路中每通过1 mol 电子,阳极室从中间储液器进入1 mol氢氧根离子、同时生成0.25 mol氧气,溶液质量理论上增加17 g-8 g=9 g,D正确
同课章节目录
