第四章 物质结构元素周期律(含解析) 单元同步测试题 2023-2024学年高一上学期化学人教版(2019)必修第一册
文档属性
| 名称 | 第四章 物质结构元素周期律(含解析) 单元同步测试题 2023-2024学年高一上学期化学人教版(2019)必修第一册 |  | |
| 格式 | docx | ||
| 文件大小 | 627.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-18 13:46:05 | ||
图片预览




文档简介
第四章 物质结构 元素周期律 单元同步测试题
一、单选题
1.美国科学家用某有机分子和球形笼状分子C60制成了“纳米车”(如图所示),每辆“纳米车”是由一个有机分子和4个C60分子构成,直径约6到9纳米。“纳米车”可以用来运输单个的有机分子。下列说法正确的是
A.人们用肉眼可以清晰看到“纳米车”的运动
B.C60是一种新型的化合物
C.C60与石墨不是同素异形体
D.该“纳米车”分散到蒸馏水中可以形成胶体
2.W、X、Y、Z、Q是核电荷数依次增大的五种短周期元素。的半径在所有离子中最小,X、Y、Z同周期且相邻,Z、Q位于同一主族且Z的核电荷数是Q的一半。下列说法正确的是
A.Z、Q元素的最高正价相同
B.W、X、Y、Z四种元素不能形成离子化合物
C.X、Q的最高价氧化物对应水化物的酸性:
D.X、Y、Z分别与W形成的简单化合物的沸点:
3.短周期主族元素X、Y、Z、W的原子序数依次增大,X、Y同周期并相邻,Y是组成水的元素之一,Z在短周期主族元素中金属性最强,W原子在同周期主族元素中原子半径最小,下列判断正确的是
A.W位于第3周期第Ⅶ族
B.简单氢化物稳定性:X>Y
C.Z与W形成的化合物是离子化合物
D.X、Y、Z三种元素组成的化合物水溶液呈酸性
4.下列关于如图所示转化关系(X代表卤素)的说法不正确的是
A.
B.
C.途径Ⅰ生成HCl放出热量比生成HBr的多,说明HCl比HBr稳定
D.按照Cl、Br、I的顺序,依次增大
5.元素在周期表中的位置,反映了元素的原子结构和元素的性质,下列说法正确的是
A.第三周期主族元素的最高正化合价等于它所处的主族序数
B.元素周期表中左下方区域的金属元素多用于制造半导体材料
C.短周期元素形成离子后,最外层都达到8电子稳定结构
D.同一主族元素的原子,最外层电子数相同,化学性质完全相同
6.如图是部分短周期元素的原子序数与某种常见化价的关系图,若用原子序数代表所对应的元素,则下列说法中正确的是
A.e元素在淡水中含量过高会出现水华现象
B.气态氢化物的稳定性:
C.c元素的氧化物可溶于b元素最高价氧化物对应水化物的水溶液
D.a和b形成的化合物不可能含共价键
7.下列说法中正确的是
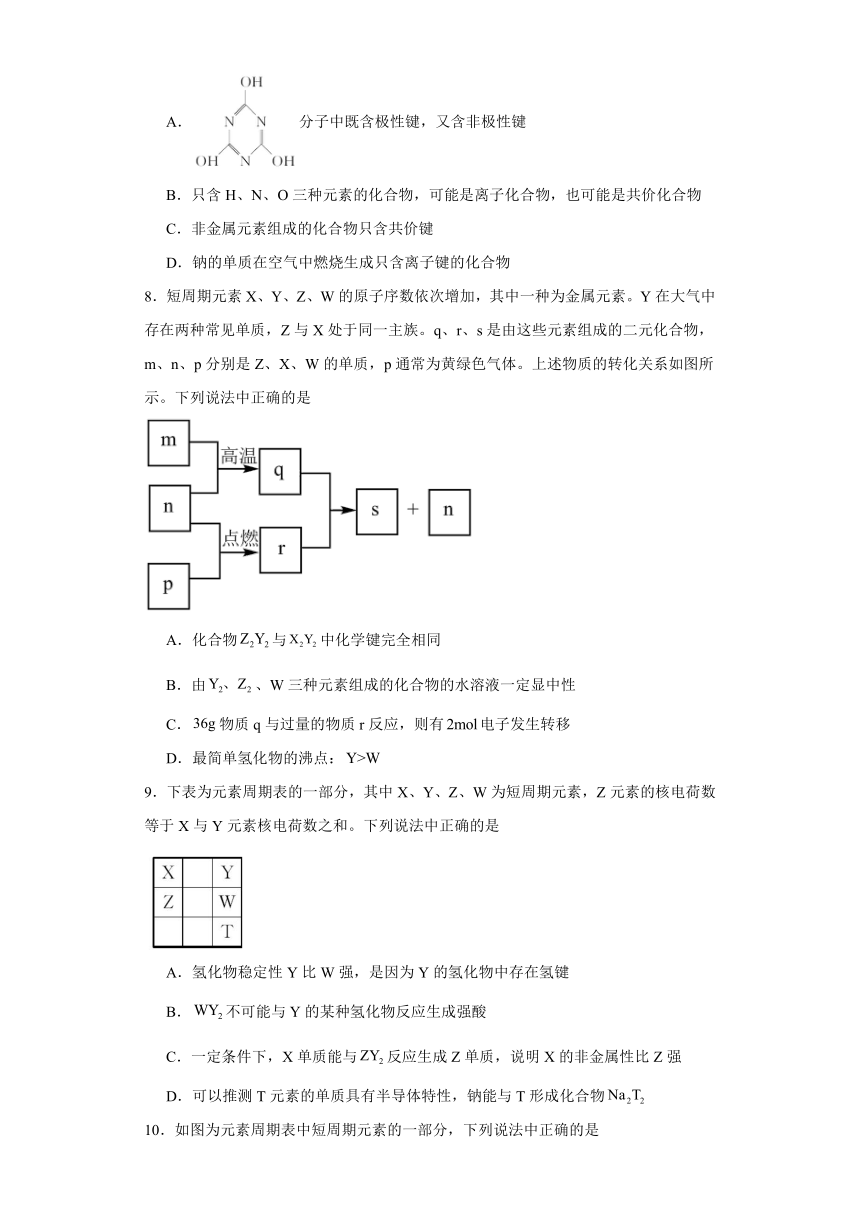
A.分子中既含极性键,又含非极性键
B.只含H、N、O三种元素的化合物,可能是离子化合物,也可能是共价化合物
C.非金属元素组成的化合物只含共价键
D.钠的单质在空气中燃烧生成只含离子键的化合物
8.短周期元素X、Y、Z、W的原子序数依次增加,其中一种为金属元素。Y在大气中存在两种常见单质,Z与X处于同一主族。q、r、s是由这些元素组成的二元化合物,m、n、p分别是Z、X、W的单质,p通常为黄绿色气体。上述物质的转化关系如图所示。下列说法中正确的是
A.化合物与中化学键完全相同
B.由、W三种元素组成的化合物的水溶液一定显中性
C.物质q与过量的物质r反应,则有电子发生转移
D.最简单氢化物的沸点:
9.下表为元素周期表的一部分,其中X、Y、Z、W为短周期元素,Z元素的核电荷数等于X与Y元素核电荷数之和。下列说法中正确的是
A.氢化物稳定性Y比W强,是因为Y的氢化物中存在氢键
B.不可能与Y的某种氢化物反应生成强酸
C.一定条件下,X单质能与反应生成Z单质,说明X的非金属性比Z强
D.可以推测T元素的单质具有半导体特性,钠能与T形成化合物
10.如图为元素周期表中短周期元素的一部分,下列说法中正确的是
A.不可能出现金属元素
B.气态氢化物的热稳定性:
C.六种元素中,③的最高价氧化物对应的水化物的酸性一定最强
D.六种元素,相互结合形成的二元化合物一定都是共价化合物
11.取一定体积的两种试剂进行反应,改变两种试剂的滴加顺序(试剂浓度均为0.1mol/L),反应现象没有明显差别的是
试剂① ②
A Na2CO3溶液 盐酸
B ACl3溶液 NaOH溶液
C AgNO3溶液 氨水
D Na2S2O3溶液 H2SO4溶液
A.A B.B C.C D.D
12.2016年11月国际纯粹与应用化学联合会(IUPAC)公布了人工合成的第113、115、117和118号元素。其中118号元素是由美国与俄罗斯科学家合作合成的,其质量数为294。下列关于该元素的说法中,正确的是
A.其原子核内中子数和质子数都是118 B.其原子核内中子数为176
C.其原子核外电子数为176 D.其原子最外层电子数为18
13.已知A、B、C、D为原子序数依次增大的短周期主族元素,B、C、D为同周期元素且与A均不同族,B、D原子的最外层电子数之和等于A的最外层电子数的2倍,B的氧化物是一种耐火材料,D的多种化合物是生活中常见的漂白剂。下列有关说法不正确的是
A.C的氧化物的水化物的酸性可能强于碳酸
B.简单离子半径的大小顺序为D>A>B
C.A与C可能形成共价化合物C3A4
D.电解B与D形成的化合物的水溶液可以制取单质B
14.镓()与铝同主族,曾被称为“类铝”,其氧化物、氢氧化物均为两性化合物。工业制备镓的流程如图所示,下列判断错误的是
A.一定条件下,、可溶于盐酸和溶液
B.可与溶液反应生成
C.酸性:
D.可由受热分解得到
二、非选择题
15.按要求完成下列填空:
(1)100mL的溶液中取出10mL该溶液,其中 。
(2)8.5g氢氧根离子含有的电子数目为 。
(3)在无土栽培中,需配制500mL含有、、、的植物培养液.且要求该培养液中,则 。
(4)含个中子的的质量是 。
(5)4g和20g的单质化合时最多能生成 g。
16.为纪念元素周期表诞生150周年,IUPAC等向世界介绍118位优秀青年化学家,并形成一张“青年化学家元素周期表”。中国学者雷晓光、姜雪峰、刘庄分别成为“N、S、Hg”元素的代言人。回答下列问题:
(1)请补全汞的原子结构示意图 。
(2)自然界的水银内含7种核素:、、、、、和,其中,和的中子数之比为 。
(3)硫磺可用于制作黑火药,爆炸时的反应为:。
①用电子式表示的形成过程 ;
②烟花爆竹的成分中除了加火药,常加入一些金属元素,若燃放烟花的火焰呈现黄色,则烟花中可能含有 元素(填名称)。
(4)氮、磷、砷都是第VA族元素,下列说法正确的是 (填字母)。
a.非金属性,所以氮气最活泼
b.与性质相似,能与溶液反应
c.As的最高价氧化物对应的水化物是强酸
d.形成的简单氢化物的还原性随着原子序数递增而增强
17.人们为了揭示原子结构的奥秘,经历了漫长的探究过程。以下是英国科学家卢瑟福进行的探究。1911 年英国科学家卢瑟福进行了著名的α粒子(即氦原子核)轰击金属箔实验。结果发现:发现绝大多数的α粒子都照直穿过薄金箔,偏转很小,但有少数α粒子发生角度比汤姆森模型所预言的大得多的偏转,大约有极少数的阿尔法粒子偏转角大于 90°,甚至观察到偏转角等于 150°的散射,称大角散射,无法用汤姆森模型说明。1911 年卢瑟福提出原子的有核模型(又称原子的核式结构模型),与正电荷联系的质量集中在中心形成原子核,电子绕着核在核外运动,由此导出α粒子散射公式,说明了 α粒子的大角散射。人类对原子结构的认识永无止境。
(1)根据上文中的表达。绝大多数α粒子是按照上图中类似 (填写路径编号)路径穿越金箔的;
(2)上图中所示的线条中,不可能是α粒子在该实验中的运动轨迹的是 (填写路径编号);
(3)正电子、负质子都属于反粒子,它们与普通的电子、质子的质量与电量均相等,而电性相反,科学家设想在宇宙的某些部分可能存在完全由反粒子构成的反物质。请你推测反氢原子的结构:
①反氢原子中含有一个带 电荷的质子和一个带 电荷的电子;
②反氢原子失去一个电子后所形成的离子符号 。(元素符号不变)
18.元素周期表反映元素之间的内在联系,是研究物质性质的重要工具。如表是元素周期表的一部分,请回答下列问题:
周期 IA 0
1 IIA … IIIA IVA VA VIA VIIA
2 ① ②
3 ③ ④ ⑤ ⑥
(1)元素②、③、⑥的简单离子半径由大到小的排序为 (填离子符号)。
(2)②和④组成的物质中含有 键,可以证明该化合物含有此类型化学键的实验事实为 。
(3)⑤的氧化物和⑥的最高价氧化物对应的水化物反应的离子方程式为 。
(4)已知④的单质与①的最高价氧化物A在点燃条件下能反应生成黑色单质,推测③的单质 (填“能”或“不能”)与A反应,说明推测的理由 。
试卷第1页,共3页
参考答案:
1.D
【详解】A.“纳米车”直径约6到9纳米,人们用肉眼看不到,故A错误;
B.C60是一种单质,故B错误;
C. C60与石墨是同种元素形成的不同种单质,互为同素异形体,故C错误;
D.“纳米车”直径约6到9纳米,该物质分散在蒸馏水中形成的分散系是胶体,故D正确;
故选D。
2.C
【分析】W、X、Y、Z、Q是核电荷数依次增大的五种短周期元素。的半径在所有离子中最小,则W为H,Z、Q位于同一主族且Z的核电荷数是Q的一半,则Z为O,Q为S,X、Y、Z同周期且相邻,故X为C,Y为N;
【详解】A.Z为O,Q为S,Z一般没有正价,Q元素的最高正价为+6价,选项A错误;
B.W、X、Y、Z四种元素能形成离子化合物NH4HCO3或(NH4)2CO3,选项B错误;
C.元素非金属性S>C,故X、Q的最高价氧化物对应水化物的酸性:,选项C正确;
D.X、Y、Z分别与W形成的简单化合物中H2O、NH3存在氢键,沸点:,选项D错误;
答案选C。
3.C
【分析】X、Y、Z、W为原子序数依次增大的短周期主族元素,X、Y同周期并相邻,且Y是组成水的元素之一,则Y为O元素,X为C元素,Z在同周期主族元素中金属性最强,则Z为Na元素,W原子在同周期主族元素中原子半径最小,则W为Cl元素。
【详解】A.W为Cl元素,位于第3周期第ⅦA族,故A错误;
B.Y为O元素,X为C元素,非金属性越大,简单氢化物越稳定,故XC.Z为Na元素,W为Cl元素,Z与W形成的化合物NaCl是离子化合物,故C正确;
D.X、Y、Z三种元素组成的化合物为碳酸钠,碳酸钠水溶液呈碱性,故D错误;
故答案为C。
4.D
【详解】A.形成新的化学键放热,,A正确;
B.反应热与反应途径无关,,B正确;
C.反应热等于旧键断裂吸收的能量之和与新键形成放出的能力之和的差,途径Ⅰ生成HCl放出热量比生成HBr的多,说明HCl的能量低于HBr,能量越低越稳定,C正确;
D.键、键、键的键能依次减小,断裂化学键需要吸收的能量依次减小,所以途径Ⅱ吸收的热量依次减小,依次减小,D错误;
故选D。
5.A
【详解】A.第三周期主族元素最高正化合价等于其所处的主族序数,A正确;
B.元素周期表中左下方区域的金属元素都比较活泼,不能用于制造半导体材料,制造半导体材料的元素位于金属和非金属交界处,B错误;
C.短周期元素形成离子后,最外层不是都能达到8电子稳定结构,如Li+最外层只有2个电子,C错误;
D.ⅠA族中氢元素和碱金属元素的化学性质差别较大,D错误;
故答案选A。
6.C
【详解】a常显价,即a为O,b常显价,原子序数增大,则b为,c常显价,c为常显价,d为P,e是S。P元素在淡水中含量过高会出现水华现象,A错误;氢化物的稳定性与非金属性有关,非金属性越强,氢化物越稳定,非金属性,氢化物的稳定性,B错误;氧化铝为两性氧化物,可与氢氧化钠溶液反应,C正确;a和b形成的化合物是和只含离子键,既有离子键又有共价键,D错误。
7.B
【详解】A项,没有同种元素之间的共价键,因而不含非极性键,错误;B项,为离子化合物,为共价化合物,正确;C项,非金属元素组成的化合物可能含有共价键,也可能含有离子键,如,错误;D项,中存在共价键,错误。
8.D
【详解】[短周期元素X、Y、Z、W的原子序数依次增加,Y在大气中存在两种常见单质,空气中含氧气和臭氧,Y为氧元素。卫通常为黄绿色气体,则W为。再结合Z与X处于同一主族,且X、Y、Z、W中一种为金属元素,知X为H,Z为。中含有离子键和共价键,中只含共价键,与中化学键不完全相同,A错误;可形成化合物,故形成的溶液可能显中性,也可显碱性,B错误;物质q与过量的物质r反应,则有电子发生转移,C错误;常温下,为液体,为气体,沸点:,D正确。]
9.D
【详解】[设X的原子序数为a,则Z的原子序数为,Y的原子序数为,又Z元素的核电荷数等于X与Y元素核电荷数之和,则,所以X为碳元素、Y为氧元素、Z为硅元素、W为硫元素、T为硒元素。氢化物的稳定性与氢键无关,A错误;二氧化硫与反应生成硫酸,B错误;一定条件下,碳单质能与二氧化硅反应生成硅单质,碳表现还原性,不能说明碳的非金属性比硅强,C错误;硒元素在金属与非金属的分界线附近,可以推测硒元素的单质具有半导体特性,硒与氧元素同族,钠能与硒形成化合物,D正确。]
10.D
【详解】[④可能是,A错误;同周期元素从左到右、同主族元素从下到上非金属性逐渐增强,气态氢化物的热稳定性也逐渐增强,因此气态氢化物的热稳定性:,B错误;③有可能是氧或氟元素,没有最高价氧化物对应的水化物,C错误。]
11.D
【详解】A.将盐酸滴入碳酸钠溶液中,两者反应生成碳酸氢钠,开始无明显现象,随着盐酸的不断加入,碳酸钠全部转化为碳酸氢钠,此时再滴加盐酸,生成二氧化碳气体,将碳酸钠滴入盐酸中,两者反应生成二氧化碳,立即就有气体生成,A不符合题意;
B.向AlCl3中加NaOH,先产生白色沉淀,NaOH过量,沉淀溶解;将AlCl3滴加入NaOH溶液中,反应生成Na[Al(OH)4],开始时无沉淀生成,随着AlCl3的不断滴加,铝离子与[Al(OH)4]-反应生成氢氧化铝白色沉淀,B不符合题意;
C.将氨水逐滴加入到硝酸银溶液发生的反应为硝酸银溶液先与氨水反应生成硝酸铵和氢氧化银沉淀,后氢氧化银与过量的氨水反应生成氢氧化二氨合银和水,实验现象为先有沉淀生成后消失,将硝酸银溶液加入到氨水中发生的反应为硝酸银溶液与过量的氨水反应生成硝酸二氨合银和水,实验中无明显现象,则两种试剂进行相互滴定时,实验现象有明显差别,C不符合题意;
D.Na2S2O3与硫酸反应生成二氧化硫气体,与滴加顺序无关,D符合题意;
故答案为:D。
12.B
【详解】A.其原子核内质子数是118,中子数为294-118=176,故A错误;
B.其原子核内中子数为294-118=176,故B正确;
C.其原子核外电子数=质子数=118,故C错误;
D.其原子最外层电子数为8,故D错误;
选B。
13.D
【详解】B的氧化物是耐火材料,推知是Al2O3,B是Al元素,可得C、D也是第三周期元素,D的化合物是一种常见消毒剂,B、C、D原子序数逐渐增大,推测消毒剂是HClO,D是Cl,B、D的最外层电子数之和是A的2倍,B最外层电子数是3,D是7,故A最外层电子数是5,是N元素,与B、C、D不同主族,推测是C是Si元素或者S元素。据此分析解题。
【分析】A.C若是S元素,氧化物对应水化物可能是硫酸,酸性比碳酸强,A正确;
B.简单离子A、B、D分别是N3-、Al3+、Cl-,N3-、Al3+是2个电子层,Cl-是3个电子层最外层电子数均是8,电子层数多,半径相对大,同样电子层,原子序数大,半径小,故半径大小是Cl-> N3-> Al3+,B正确;
C.若C是Si,与N形成Si3N4,是共价化合物,C正确;
D.B和D形成化合物是AlCl3,电解AlCl3溶液,得不到铝单质,D错误;
故答案为:D。
14.C
【分析】向铝土矿中加入氢氧化钠溶液,氧化铝和氧化镓转化为偏铝酸钠和偏镓酸钠,向反应得到的溶液中通入适量二氧化碳,偏铝酸钠转化为氢氧化铝沉淀,过滤得到氢氧化铝和偏镓酸钠溶液,偏镓酸钠溶液经多步反应制得镓。
【详解】A.铝、氧化铝能与盐酸和氢氧化钠溶液反应,由镓与铝同主族,曾被称为“类铝”可知,镓、氧化镓也能与盐酸和氢氧化钠溶液反应,故A正确;
B.由分析可知,氧化镓能与氢氧化钠溶液反应生成偏镓酸钠和水,故B正确;
C.由分析可知,偏铝酸钠溶液能与二氧化碳反应生成氢氧化铝沉淀,而偏镓酸钠溶液不能与二氧化碳反应,由强酸制弱酸的原理可知,碳酸的酸性强于氢氧化铝,弱于氢氧化镓,所以氢氧化铝的酸性弱于氢氧化镓,故C错误;
D.氢氧化铝受热分解生成氧化铝和水,由镓与铝同主族,曾被称为“类铝”可知,氢氧化镓受热也能分解生成氧化镓和水,故D正确;
故选C。
15.(1)
(2)
(3)
(4)
(5)
【详解】(1)100mL的溶液中取出10mL该溶液,其中;
(2)8.5g氢氧根离子的物质的量,则8.5g氢氧根离子含有的电子数目为;
(3)根据溶液呈电中性,,则;
(4)个中子的物质的量为1mol,因为含有4个中子,所以该微粒的物质的量为0.25mol,质量为;
(5)4g的物质的量为1mol,20g的物质的量为,则过量,以为准计算可生成1mol,其质量为。
16.(1)
(2)
(3) 钠
(4)bd
【详解】(1)汞的原子结构示意图为 。
(2)的中子数为199-80=119,的中子数为204-80=124,故和的中子数之比为。
(3)①为离子化合物,故形成过程为 ;
②钠的焰色试验为黄色,故烟花中可能含有钠元素。
(4)a.虽然非金属性,但是氮气中为氮氮三键,所以氮气不活泼,错误;
b.与反应生成氯化钠和氨水,也能与溶液反应,正确;
c.非金属性,对应最高价氧化物的水化物的酸性减弱,故As的最高价氧化物对应的水化物是弱酸,错误;
d.非金属性,形成的简单氢化物的还原性随着原子序数递增而增强,正确;
故选bd。
17.(1)b
(2)a
(3) 负 正 H-
【详解】(1)发现绝大多数的α粒子都照直穿过薄金箔,故绝大多数α粒子是按照上图中类似b路径穿越金箔的;
(2)α粒子(即氦原子核)带正电荷,原子核带正电荷,故会相互排斥而不是吸引,故不可能是α粒子在该实验中的运动轨迹的是a;
(3)①氢原子中含有一个带正电荷的质子和一个带负电荷的电子,则反氢原子中含有一个带负电荷的质子和一个带正电荷的电子;
②反氢原子失去一个电子后形成带负电荷的离子,H-。
18.(1)
(2) 离子 氧化镁在熔融状态下可以导电
(3)
(4) 能 因为钠的金属性比镁强
【分析】由元素在周期表中的位置可知,①是C,②是O,③是Na,④是Mg,⑤是Al,⑥是Cl。
【详解】(1)电子层越多,离子半径越大,电子层结构相同的离子,核电荷数越大,半径越小,则离子半径:,故答案为:;
(2)O和Mg组成的物质为MgO,是由活泼金属与活泼非金属形成的化合物,属于离子化合物,含有离子键,可以证明该化合物含有此类型化学键的实验事实为氧化镁在熔融状态下可以导电,故答案为:离子;氧化镁在熔融状态下可以导电;
(3)Al的氧化物为Al2O3,Cl的最高价氧化物对应的水化物为HClO4,Al2O3和HClO4反应生成高氯酸铝和水,反应的离子方程式为,故答案为:;
(4)由题干部分周期表信息可知,由于Mg、MgO均为白色固体,已知④的单质即Mg与①的最高价氧化物A即CO2在点燃条件下能反应生成黑色单质,即Mg与CO2发生置换反应生成MgO和碳,而钠的还原性比Mg强,推测钠能与CO2反应,故答案为:能;因为钠的金属性比镁强
一、单选题
1.美国科学家用某有机分子和球形笼状分子C60制成了“纳米车”(如图所示),每辆“纳米车”是由一个有机分子和4个C60分子构成,直径约6到9纳米。“纳米车”可以用来运输单个的有机分子。下列说法正确的是
A.人们用肉眼可以清晰看到“纳米车”的运动
B.C60是一种新型的化合物
C.C60与石墨不是同素异形体
D.该“纳米车”分散到蒸馏水中可以形成胶体
2.W、X、Y、Z、Q是核电荷数依次增大的五种短周期元素。的半径在所有离子中最小,X、Y、Z同周期且相邻,Z、Q位于同一主族且Z的核电荷数是Q的一半。下列说法正确的是
A.Z、Q元素的最高正价相同
B.W、X、Y、Z四种元素不能形成离子化合物
C.X、Q的最高价氧化物对应水化物的酸性:
D.X、Y、Z分别与W形成的简单化合物的沸点:
3.短周期主族元素X、Y、Z、W的原子序数依次增大,X、Y同周期并相邻,Y是组成水的元素之一,Z在短周期主族元素中金属性最强,W原子在同周期主族元素中原子半径最小,下列判断正确的是
A.W位于第3周期第Ⅶ族
B.简单氢化物稳定性:X>Y
C.Z与W形成的化合物是离子化合物
D.X、Y、Z三种元素组成的化合物水溶液呈酸性
4.下列关于如图所示转化关系(X代表卤素)的说法不正确的是
A.
B.
C.途径Ⅰ生成HCl放出热量比生成HBr的多,说明HCl比HBr稳定
D.按照Cl、Br、I的顺序,依次增大
5.元素在周期表中的位置,反映了元素的原子结构和元素的性质,下列说法正确的是
A.第三周期主族元素的最高正化合价等于它所处的主族序数
B.元素周期表中左下方区域的金属元素多用于制造半导体材料
C.短周期元素形成离子后,最外层都达到8电子稳定结构
D.同一主族元素的原子,最外层电子数相同,化学性质完全相同
6.如图是部分短周期元素的原子序数与某种常见化价的关系图,若用原子序数代表所对应的元素,则下列说法中正确的是
A.e元素在淡水中含量过高会出现水华现象
B.气态氢化物的稳定性:
C.c元素的氧化物可溶于b元素最高价氧化物对应水化物的水溶液
D.a和b形成的化合物不可能含共价键
7.下列说法中正确的是
A.分子中既含极性键,又含非极性键
B.只含H、N、O三种元素的化合物,可能是离子化合物,也可能是共价化合物
C.非金属元素组成的化合物只含共价键
D.钠的单质在空气中燃烧生成只含离子键的化合物
8.短周期元素X、Y、Z、W的原子序数依次增加,其中一种为金属元素。Y在大气中存在两种常见单质,Z与X处于同一主族。q、r、s是由这些元素组成的二元化合物,m、n、p分别是Z、X、W的单质,p通常为黄绿色气体。上述物质的转化关系如图所示。下列说法中正确的是
A.化合物与中化学键完全相同
B.由、W三种元素组成的化合物的水溶液一定显中性
C.物质q与过量的物质r反应,则有电子发生转移
D.最简单氢化物的沸点:
9.下表为元素周期表的一部分,其中X、Y、Z、W为短周期元素,Z元素的核电荷数等于X与Y元素核电荷数之和。下列说法中正确的是
A.氢化物稳定性Y比W强,是因为Y的氢化物中存在氢键
B.不可能与Y的某种氢化物反应生成强酸
C.一定条件下,X单质能与反应生成Z单质,说明X的非金属性比Z强
D.可以推测T元素的单质具有半导体特性,钠能与T形成化合物
10.如图为元素周期表中短周期元素的一部分,下列说法中正确的是
A.不可能出现金属元素
B.气态氢化物的热稳定性:
C.六种元素中,③的最高价氧化物对应的水化物的酸性一定最强
D.六种元素,相互结合形成的二元化合物一定都是共价化合物
11.取一定体积的两种试剂进行反应,改变两种试剂的滴加顺序(试剂浓度均为0.1mol/L),反应现象没有明显差别的是
试剂① ②
A Na2CO3溶液 盐酸
B ACl3溶液 NaOH溶液
C AgNO3溶液 氨水
D Na2S2O3溶液 H2SO4溶液
A.A B.B C.C D.D
12.2016年11月国际纯粹与应用化学联合会(IUPAC)公布了人工合成的第113、115、117和118号元素。其中118号元素是由美国与俄罗斯科学家合作合成的,其质量数为294。下列关于该元素的说法中,正确的是
A.其原子核内中子数和质子数都是118 B.其原子核内中子数为176
C.其原子核外电子数为176 D.其原子最外层电子数为18
13.已知A、B、C、D为原子序数依次增大的短周期主族元素,B、C、D为同周期元素且与A均不同族,B、D原子的最外层电子数之和等于A的最外层电子数的2倍,B的氧化物是一种耐火材料,D的多种化合物是生活中常见的漂白剂。下列有关说法不正确的是
A.C的氧化物的水化物的酸性可能强于碳酸
B.简单离子半径的大小顺序为D>A>B
C.A与C可能形成共价化合物C3A4
D.电解B与D形成的化合物的水溶液可以制取单质B
14.镓()与铝同主族,曾被称为“类铝”,其氧化物、氢氧化物均为两性化合物。工业制备镓的流程如图所示,下列判断错误的是
A.一定条件下,、可溶于盐酸和溶液
B.可与溶液反应生成
C.酸性:
D.可由受热分解得到
二、非选择题
15.按要求完成下列填空:
(1)100mL的溶液中取出10mL该溶液,其中 。
(2)8.5g氢氧根离子含有的电子数目为 。
(3)在无土栽培中,需配制500mL含有、、、的植物培养液.且要求该培养液中,则 。
(4)含个中子的的质量是 。
(5)4g和20g的单质化合时最多能生成 g。
16.为纪念元素周期表诞生150周年,IUPAC等向世界介绍118位优秀青年化学家,并形成一张“青年化学家元素周期表”。中国学者雷晓光、姜雪峰、刘庄分别成为“N、S、Hg”元素的代言人。回答下列问题:
(1)请补全汞的原子结构示意图 。
(2)自然界的水银内含7种核素:、、、、、和,其中,和的中子数之比为 。
(3)硫磺可用于制作黑火药,爆炸时的反应为:。
①用电子式表示的形成过程 ;
②烟花爆竹的成分中除了加火药,常加入一些金属元素,若燃放烟花的火焰呈现黄色,则烟花中可能含有 元素(填名称)。
(4)氮、磷、砷都是第VA族元素,下列说法正确的是 (填字母)。
a.非金属性,所以氮气最活泼
b.与性质相似,能与溶液反应
c.As的最高价氧化物对应的水化物是强酸
d.形成的简单氢化物的还原性随着原子序数递增而增强
17.人们为了揭示原子结构的奥秘,经历了漫长的探究过程。以下是英国科学家卢瑟福进行的探究。1911 年英国科学家卢瑟福进行了著名的α粒子(即氦原子核)轰击金属箔实验。结果发现:发现绝大多数的α粒子都照直穿过薄金箔,偏转很小,但有少数α粒子发生角度比汤姆森模型所预言的大得多的偏转,大约有极少数的阿尔法粒子偏转角大于 90°,甚至观察到偏转角等于 150°的散射,称大角散射,无法用汤姆森模型说明。1911 年卢瑟福提出原子的有核模型(又称原子的核式结构模型),与正电荷联系的质量集中在中心形成原子核,电子绕着核在核外运动,由此导出α粒子散射公式,说明了 α粒子的大角散射。人类对原子结构的认识永无止境。
(1)根据上文中的表达。绝大多数α粒子是按照上图中类似 (填写路径编号)路径穿越金箔的;
(2)上图中所示的线条中,不可能是α粒子在该实验中的运动轨迹的是 (填写路径编号);
(3)正电子、负质子都属于反粒子,它们与普通的电子、质子的质量与电量均相等,而电性相反,科学家设想在宇宙的某些部分可能存在完全由反粒子构成的反物质。请你推测反氢原子的结构:
①反氢原子中含有一个带 电荷的质子和一个带 电荷的电子;
②反氢原子失去一个电子后所形成的离子符号 。(元素符号不变)
18.元素周期表反映元素之间的内在联系,是研究物质性质的重要工具。如表是元素周期表的一部分,请回答下列问题:
周期 IA 0
1 IIA … IIIA IVA VA VIA VIIA
2 ① ②
3 ③ ④ ⑤ ⑥
(1)元素②、③、⑥的简单离子半径由大到小的排序为 (填离子符号)。
(2)②和④组成的物质中含有 键,可以证明该化合物含有此类型化学键的实验事实为 。
(3)⑤的氧化物和⑥的最高价氧化物对应的水化物反应的离子方程式为 。
(4)已知④的单质与①的最高价氧化物A在点燃条件下能反应生成黑色单质,推测③的单质 (填“能”或“不能”)与A反应,说明推测的理由 。
试卷第1页,共3页
参考答案:
1.D
【详解】A.“纳米车”直径约6到9纳米,人们用肉眼看不到,故A错误;
B.C60是一种单质,故B错误;
C. C60与石墨是同种元素形成的不同种单质,互为同素异形体,故C错误;
D.“纳米车”直径约6到9纳米,该物质分散在蒸馏水中形成的分散系是胶体,故D正确;
故选D。
2.C
【分析】W、X、Y、Z、Q是核电荷数依次增大的五种短周期元素。的半径在所有离子中最小,则W为H,Z、Q位于同一主族且Z的核电荷数是Q的一半,则Z为O,Q为S,X、Y、Z同周期且相邻,故X为C,Y为N;
【详解】A.Z为O,Q为S,Z一般没有正价,Q元素的最高正价为+6价,选项A错误;
B.W、X、Y、Z四种元素能形成离子化合物NH4HCO3或(NH4)2CO3,选项B错误;
C.元素非金属性S>C,故X、Q的最高价氧化物对应水化物的酸性:,选项C正确;
D.X、Y、Z分别与W形成的简单化合物中H2O、NH3存在氢键,沸点:,选项D错误;
答案选C。
3.C
【分析】X、Y、Z、W为原子序数依次增大的短周期主族元素,X、Y同周期并相邻,且Y是组成水的元素之一,则Y为O元素,X为C元素,Z在同周期主族元素中金属性最强,则Z为Na元素,W原子在同周期主族元素中原子半径最小,则W为Cl元素。
【详解】A.W为Cl元素,位于第3周期第ⅦA族,故A错误;
B.Y为O元素,X为C元素,非金属性越大,简单氢化物越稳定,故X
D.X、Y、Z三种元素组成的化合物为碳酸钠,碳酸钠水溶液呈碱性,故D错误;
故答案为C。
4.D
【详解】A.形成新的化学键放热,,A正确;
B.反应热与反应途径无关,,B正确;
C.反应热等于旧键断裂吸收的能量之和与新键形成放出的能力之和的差,途径Ⅰ生成HCl放出热量比生成HBr的多,说明HCl的能量低于HBr,能量越低越稳定,C正确;
D.键、键、键的键能依次减小,断裂化学键需要吸收的能量依次减小,所以途径Ⅱ吸收的热量依次减小,依次减小,D错误;
故选D。
5.A
【详解】A.第三周期主族元素最高正化合价等于其所处的主族序数,A正确;
B.元素周期表中左下方区域的金属元素都比较活泼,不能用于制造半导体材料,制造半导体材料的元素位于金属和非金属交界处,B错误;
C.短周期元素形成离子后,最外层不是都能达到8电子稳定结构,如Li+最外层只有2个电子,C错误;
D.ⅠA族中氢元素和碱金属元素的化学性质差别较大,D错误;
故答案选A。
6.C
【详解】a常显价,即a为O,b常显价,原子序数增大,则b为,c常显价,c为常显价,d为P,e是S。P元素在淡水中含量过高会出现水华现象,A错误;氢化物的稳定性与非金属性有关,非金属性越强,氢化物越稳定,非金属性,氢化物的稳定性,B错误;氧化铝为两性氧化物,可与氢氧化钠溶液反应,C正确;a和b形成的化合物是和只含离子键,既有离子键又有共价键,D错误。
7.B
【详解】A项,没有同种元素之间的共价键,因而不含非极性键,错误;B项,为离子化合物,为共价化合物,正确;C项,非金属元素组成的化合物可能含有共价键,也可能含有离子键,如,错误;D项,中存在共价键,错误。
8.D
【详解】[短周期元素X、Y、Z、W的原子序数依次增加,Y在大气中存在两种常见单质,空气中含氧气和臭氧,Y为氧元素。卫通常为黄绿色气体,则W为。再结合Z与X处于同一主族,且X、Y、Z、W中一种为金属元素,知X为H,Z为。中含有离子键和共价键,中只含共价键,与中化学键不完全相同,A错误;可形成化合物,故形成的溶液可能显中性,也可显碱性,B错误;物质q与过量的物质r反应,则有电子发生转移,C错误;常温下,为液体,为气体,沸点:,D正确。]
9.D
【详解】[设X的原子序数为a,则Z的原子序数为,Y的原子序数为,又Z元素的核电荷数等于X与Y元素核电荷数之和,则,所以X为碳元素、Y为氧元素、Z为硅元素、W为硫元素、T为硒元素。氢化物的稳定性与氢键无关,A错误;二氧化硫与反应生成硫酸,B错误;一定条件下,碳单质能与二氧化硅反应生成硅单质,碳表现还原性,不能说明碳的非金属性比硅强,C错误;硒元素在金属与非金属的分界线附近,可以推测硒元素的单质具有半导体特性,硒与氧元素同族,钠能与硒形成化合物,D正确。]
10.D
【详解】[④可能是,A错误;同周期元素从左到右、同主族元素从下到上非金属性逐渐增强,气态氢化物的热稳定性也逐渐增强,因此气态氢化物的热稳定性:,B错误;③有可能是氧或氟元素,没有最高价氧化物对应的水化物,C错误。]
11.D
【详解】A.将盐酸滴入碳酸钠溶液中,两者反应生成碳酸氢钠,开始无明显现象,随着盐酸的不断加入,碳酸钠全部转化为碳酸氢钠,此时再滴加盐酸,生成二氧化碳气体,将碳酸钠滴入盐酸中,两者反应生成二氧化碳,立即就有气体生成,A不符合题意;
B.向AlCl3中加NaOH,先产生白色沉淀,NaOH过量,沉淀溶解;将AlCl3滴加入NaOH溶液中,反应生成Na[Al(OH)4],开始时无沉淀生成,随着AlCl3的不断滴加,铝离子与[Al(OH)4]-反应生成氢氧化铝白色沉淀,B不符合题意;
C.将氨水逐滴加入到硝酸银溶液发生的反应为硝酸银溶液先与氨水反应生成硝酸铵和氢氧化银沉淀,后氢氧化银与过量的氨水反应生成氢氧化二氨合银和水,实验现象为先有沉淀生成后消失,将硝酸银溶液加入到氨水中发生的反应为硝酸银溶液与过量的氨水反应生成硝酸二氨合银和水,实验中无明显现象,则两种试剂进行相互滴定时,实验现象有明显差别,C不符合题意;
D.Na2S2O3与硫酸反应生成二氧化硫气体,与滴加顺序无关,D符合题意;
故答案为:D。
12.B
【详解】A.其原子核内质子数是118,中子数为294-118=176,故A错误;
B.其原子核内中子数为294-118=176,故B正确;
C.其原子核外电子数=质子数=118,故C错误;
D.其原子最外层电子数为8,故D错误;
选B。
13.D
【详解】B的氧化物是耐火材料,推知是Al2O3,B是Al元素,可得C、D也是第三周期元素,D的化合物是一种常见消毒剂,B、C、D原子序数逐渐增大,推测消毒剂是HClO,D是Cl,B、D的最外层电子数之和是A的2倍,B最外层电子数是3,D是7,故A最外层电子数是5,是N元素,与B、C、D不同主族,推测是C是Si元素或者S元素。据此分析解题。
【分析】A.C若是S元素,氧化物对应水化物可能是硫酸,酸性比碳酸强,A正确;
B.简单离子A、B、D分别是N3-、Al3+、Cl-,N3-、Al3+是2个电子层,Cl-是3个电子层最外层电子数均是8,电子层数多,半径相对大,同样电子层,原子序数大,半径小,故半径大小是Cl-> N3-> Al3+,B正确;
C.若C是Si,与N形成Si3N4,是共价化合物,C正确;
D.B和D形成化合物是AlCl3,电解AlCl3溶液,得不到铝单质,D错误;
故答案为:D。
14.C
【分析】向铝土矿中加入氢氧化钠溶液,氧化铝和氧化镓转化为偏铝酸钠和偏镓酸钠,向反应得到的溶液中通入适量二氧化碳,偏铝酸钠转化为氢氧化铝沉淀,过滤得到氢氧化铝和偏镓酸钠溶液,偏镓酸钠溶液经多步反应制得镓。
【详解】A.铝、氧化铝能与盐酸和氢氧化钠溶液反应,由镓与铝同主族,曾被称为“类铝”可知,镓、氧化镓也能与盐酸和氢氧化钠溶液反应,故A正确;
B.由分析可知,氧化镓能与氢氧化钠溶液反应生成偏镓酸钠和水,故B正确;
C.由分析可知,偏铝酸钠溶液能与二氧化碳反应生成氢氧化铝沉淀,而偏镓酸钠溶液不能与二氧化碳反应,由强酸制弱酸的原理可知,碳酸的酸性强于氢氧化铝,弱于氢氧化镓,所以氢氧化铝的酸性弱于氢氧化镓,故C错误;
D.氢氧化铝受热分解生成氧化铝和水,由镓与铝同主族,曾被称为“类铝”可知,氢氧化镓受热也能分解生成氧化镓和水,故D正确;
故选C。
15.(1)
(2)
(3)
(4)
(5)
【详解】(1)100mL的溶液中取出10mL该溶液,其中;
(2)8.5g氢氧根离子的物质的量,则8.5g氢氧根离子含有的电子数目为;
(3)根据溶液呈电中性,,则;
(4)个中子的物质的量为1mol,因为含有4个中子,所以该微粒的物质的量为0.25mol,质量为;
(5)4g的物质的量为1mol,20g的物质的量为,则过量,以为准计算可生成1mol,其质量为。
16.(1)
(2)
(3) 钠
(4)bd
【详解】(1)汞的原子结构示意图为 。
(2)的中子数为199-80=119,的中子数为204-80=124,故和的中子数之比为。
(3)①为离子化合物,故形成过程为 ;
②钠的焰色试验为黄色,故烟花中可能含有钠元素。
(4)a.虽然非金属性,但是氮气中为氮氮三键,所以氮气不活泼,错误;
b.与反应生成氯化钠和氨水,也能与溶液反应,正确;
c.非金属性,对应最高价氧化物的水化物的酸性减弱,故As的最高价氧化物对应的水化物是弱酸,错误;
d.非金属性,形成的简单氢化物的还原性随着原子序数递增而增强,正确;
故选bd。
17.(1)b
(2)a
(3) 负 正 H-
【详解】(1)发现绝大多数的α粒子都照直穿过薄金箔,故绝大多数α粒子是按照上图中类似b路径穿越金箔的;
(2)α粒子(即氦原子核)带正电荷,原子核带正电荷,故会相互排斥而不是吸引,故不可能是α粒子在该实验中的运动轨迹的是a;
(3)①氢原子中含有一个带正电荷的质子和一个带负电荷的电子,则反氢原子中含有一个带负电荷的质子和一个带正电荷的电子;
②反氢原子失去一个电子后形成带负电荷的离子,H-。
18.(1)
(2) 离子 氧化镁在熔融状态下可以导电
(3)
(4) 能 因为钠的金属性比镁强
【分析】由元素在周期表中的位置可知,①是C,②是O,③是Na,④是Mg,⑤是Al,⑥是Cl。
【详解】(1)电子层越多,离子半径越大,电子层结构相同的离子,核电荷数越大,半径越小,则离子半径:,故答案为:;
(2)O和Mg组成的物质为MgO,是由活泼金属与活泼非金属形成的化合物,属于离子化合物,含有离子键,可以证明该化合物含有此类型化学键的实验事实为氧化镁在熔融状态下可以导电,故答案为:离子;氧化镁在熔融状态下可以导电;
(3)Al的氧化物为Al2O3,Cl的最高价氧化物对应的水化物为HClO4,Al2O3和HClO4反应生成高氯酸铝和水,反应的离子方程式为,故答案为:;
(4)由题干部分周期表信息可知,由于Mg、MgO均为白色固体,已知④的单质即Mg与①的最高价氧化物A即CO2在点燃条件下能反应生成黑色单质,即Mg与CO2发生置换反应生成MgO和碳,而钠的还原性比Mg强,推测钠能与CO2反应,故答案为:能;因为钠的金属性比镁强
