3.3沉淀溶解平衡(含解析)同步练习题2023-2024学年高二上学期鲁科版(2019)化学选择性必修1
文档属性
| 名称 | 3.3沉淀溶解平衡(含解析)同步练习题2023-2024学年高二上学期鲁科版(2019)化学选择性必修1 |  | |
| 格式 | docx | ||
| 文件大小 | 348.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-18 14:46:12 | ||
图片预览




文档简介
3.3 沉淀溶解平衡 同步练习题
一、选择题
1.下列实验能达到预期目的是
编号 实验内容 实验目的
A 等体积pH=2的HX和HY两种酸分别与足量的铁反应,排水法收集气体,HX放出的氢气多且反应速率快 证明HX酸性比HY强
B 室温下,用pH试纸测定浓度为0.1mo/LNaClO和0.1mol/LCH3COONa溶液的pH 比较HClO和CHCOOH酸性强弱
C 向含有酚酞的Na2CO3溶液中加入少量BaCl2固体,溶液红色变浅 证明Na2CO3溶液中存在水解平衡
D 向10mL0.2mo/LNaOH溶液中滴2滴0.1mol/LMgCl2溶液,产生白色沉淀后再滴加2滴0.1mol/LFeCl3又生成红褐色沉淀 证明相同温度下Ksp:Mg(OH)2>Fe(OH)3
A.A B.B C.C D.D
2.下列说法正确的是
A.将溶液蒸干灼烧至恒重,最终剩余固体是FeO
B.将铁闸与锌片连接防止铁腐蚀,是利用外加电流法
C.锅炉中沉积的可用饱和碳酸钠溶液浸泡,再用盐酸溶解而除去
D.在合成氨工业中,将液化并及时分离可增大正反应速率,提高原料转化率
3.室温下,下列实验探究方案能达到探究目的的是
选项 实验探究方案 探究目的
A 向盛有Fe(NO3)2溶液的试管中滴加几滴稀硫酸,振荡,观察溶液颜色变化 具有氧化性
B 向溶液X中加入稀硫酸,并将产生的无色气体通入澄清石灰水中,观察是否有沉淀生成 溶液X中含有或
C 用pH试纸分别测定浓度均为0.1mol/L的NaCN和NaClO溶液的pH
D 常温下,向10mL0.1mol/LNaCl溶液中滴加5滴0.1mol/LAgNO3溶液,充分反应后,再滴加5滴0.1mol/LKI溶液,观察沉淀颜色变化
A.A B.B C.C D.D
4.在1L0.01mol·L-1MgCl2溶液中,加入1mL0.01mol·L-1的Na2CO3溶液,下列说法正确的是(已知MgCO3的Ksp=6.8×10-6mol2·L-2)
A.有MgCO3沉淀析出 B.无MgCO3沉淀析出
C.无法确定 D.有沉淀但不是MgCO3
5.下列有关化学与生产、生活的说法不正确的是
A.氢气燃烧过程中主要是将化学能转化为热能和光能
B.自来水厂可用氯气或明矾进行自来水的消毒、净化,以改善水质
C.处理锅炉水垢中的硫酸钙,先用饱和碳酸钠溶液浸泡,再用酸除去
D.Sb2O3可用作白色颜料和阻燃剂等,在实验室中用SbCl3的水解反应制取
6.根据下列实验操作和现象所得到的结论正确的是
选项 实验操作 实验现象 实验结论
A 将少量醋酸滴入溶液中 未产生明显气泡 酸性:
B 向盛有相同体积、浓度的溶液的两支试管中分别滴加和HI溶液,观察出现棕黄色现象的时间 后者出现棕黄色时间短 其他条件不变时,一般浓度越大,该反应化学反应速率越快
C 将装有相同质量和的混合气的两支烧瓶分别置于热水、冰水中 浸泡在热水中的烧瓶红棕色更深
D 向盛有溶液滴加2滴等浓度溶液,悬浊液静置,取上层清液,滴入少量稀NaI溶液 出现黄色沉淀
A.A B.B C.C D.D
7.下列说法正确的是
A.溶度积就是溶解平衡时难溶电解质在溶液中的各离子浓度的乘积
B.溶度积常数是不受任何条件影响的常数,简称溶度积
C.可用离子积Qc与溶度积Ksp的比较来判断沉淀溶解平衡进行的方向
D.所有物质的溶度积都是随温度的升高而增大的
8.有人说“五颜六色”形象地说出了化学实验中的颜色变化。下列颜色变化中是由发生氧化还原反应导致的是
A.向溶液中加入,溶液变为红色
B.将乙醇加入酸性重铬酸钾溶液中,溶液从橙色变成墨绿色
C.向氯化银悬浊液中滴加碘化钠,出现黄色浑浊
D.黑色溶解在稀硫酸中可以得到蓝色的溶液
9.夏天,鸡没有汗腺只能依赖“喘息”调节体温,鸡过度的呼出CO2,使下列平衡向左移动,导致蛋壳变薄,使农场主和超市经营者蒙受经济损失(aq表示稀溶液),CO2(g)CO2(aq),CO2(aq)+H2OH2CO3(aq),H2CO3(aq)H+(aq)+HCO(aq),HCO(aq)H+(aq)+CO(aq),Ca2+(aq)+CO(aq)CaCO3(s)(蛋壳),澳大利亚学者研究发现,夏季给鸡喂食下列某种饮料会使蛋壳变厚。这种饮料是
A.淡盐水 B.碳酸水 C.蔗糖水 D.澄清石灰水
10.下列离子方程式与所给事实不相符的是
A.用惰性电极电解AgNO3溶液:4Ag++2H2O4Ag+4H++O2↑
B.钢铁制品在潮湿空气中的电化学腐蚀:Fe 3e-=Fe3+
C.泡沫灭火器的灭火原理:Al3++3HCO=Al(OH)3↓+3CO2↑
D.KI溶液将AgCl转化为AgI:I-(aq)+AgCl(s) AgI(s)+Cl-(aq)
二、填空题
11.一种磁性材料的磨削废料的主要成分是铁镍合金(含镍质量分数约21%),还含有铜、钙、镁、硅的氧化物。由该废料制备氢氧化镍,工艺流程如下:
已知常温下Ksp[Ni(OH)2]=2.0×10-15,该流程在“沉镍”过程中,需调节溶液pH约为 时,Ni2+才刚好沉淀完全。(离子沉淀完全的浓度≤1.0×10-5mol/L;lg2=0.30)
12.I.根据表中数据(常温下),完成下列填空。
物质 CH3COOH NH3 H2O HCN HClO H2CO3 H2SO3
电离常数(Ka) 1.7×10 5 1.7×10 5 4.9×10 10 3×10 8 Ka1=4.3×10 7 Ka2=5.6×10 11 Ka1=1.5×10 2 Ka2=1.0×10 7
(1)常温下,NaCN溶液呈 (填“酸”、“碱”或“中”)性,其原因是 (用离子方程式表示)。
(2)常温下,浓度均为0.1 mol L 1的下列4种溶液:①CH3COONa溶液,②NaCN溶液,③NaHCO3溶液,④NaClO溶液;这4种溶液pH由大到小的顺序是 (填序号)。
(3)常温下,向NaClO溶液中通入少量CO2,发生反应的离子方程式为 。
(4)常温下,Na2SO3溶液中c(OH-) c(H+)=c(HSO)+ 。
II.我国《生活饮用水卫生标准》中规定生活用水中镉的排放量不超过0.005mg L 1。处理含镉废水可采用化学沉淀法。Ksp(CdCO3)=4.0×10 12,Ksp(CdS)=8.0×10 27;回答下列问题:
(5)向某含镉废水中加入Na2S,当S2 浓度达到8.0×10 8 mol L 1时,废水中Cd2+的浓度为 mol L 1,此时是否符合生活饮用水卫生标准 (填“是”或“否”)。
(6)室温下,反应CdCO3(s)+S2 (aq)CdS(s)+CO(aq)达到平衡,该反应的平衡常数K= (结果保留两位有效数字)
13.平衡常数是分析平衡问题的重要依据。回答下列问题:
(1)已知:时,的,则时,的溶液的 。
(2)在温度为时,某研究人员测定的电离常数为,的水解常数为,则该温度下水的离子积常数为 ,请判断 (填“>”“<”或“=”)。
(3)化工生产中常用作沉淀剂除去工业废水中的:。该反应的平衡常数为 (和的分别为、)。
(4)时,将的氨水与的盐酸等体积混合,所得溶液中,则溶液显 (填“酸”“碱”或“中”)性;用含a的代数式表示的电离常数 。
14.含Al(OH)溶液中的铝元素完全沉淀的pH为 。通常认为溶液中离子浓度小于10-5 mol·L-1为沉淀完全:Al(OH)3+OH—Al(OH)K=100.63;Kw=10-14,Ksp[Al(OH)3]=10-33}
15.短周期元素 X、Y、Z 可组成化学式均为 XYZ3的四种化合物甲、乙、丙、丁。
(l)若甲中 X 的原子只有一个质子,Y 、Z均是第二周期元素,则 Y 元素原子的电子排布式为 ; X、Y 原子间可形成与烷烃结构类似的化合物,则该系列化合物的通式为 。
(2)若乙是一种微溶于水的物质,其 Ksp 约为 6.8×10ˉ6,且 X、Y、Z 三种元素的原子序数之和为 26 , Y、Z 同周期,则乙的溶解平衡可表示为 ,其饱和溶液中X的离子的物质的量浓度约为 mol/ L。
(3)若丙中X元素的焰色反应为黄色,Y与X同周期,Y 是同周期中原子半径最小的元素,丙与浓盐酸反应生成 Y 单质的化学方程式为 。
(4)若丁中 X、Y、Z 处于不同周期,且 X 原子最外层电子数为其次外层电子数的二倍,Z原子最外层电子数是其电子层数的二倍多1,则丁的结构式为 。
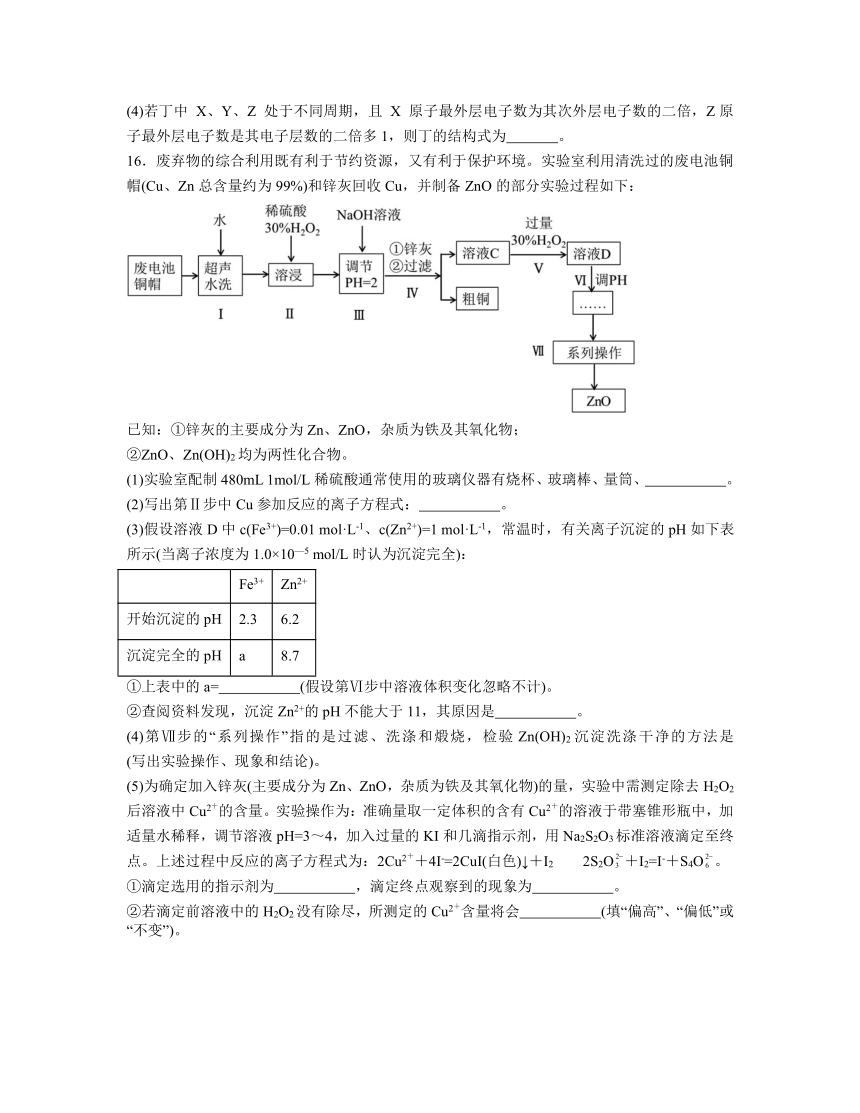
16.废弃物的综合利用既有利于节约资源,又有利于保护环境。实验室利用清洗过的废电池铜帽(Cu、Zn总含量约为99%)和锌灰回收Cu,并制备ZnO的部分实验过程如下:
已知:①锌灰的主要成分为Zn、ZnO,杂质为铁及其氧化物;
②ZnO、Zn(OH)2均为两性化合物。
(1)实验室配制480mL 1mol/L稀硫酸通常使用的玻璃仪器有烧杯、玻璃棒、量筒、 。
(2)写出第Ⅱ步中Cu参加反应的离子方程式: 。
(3)假设溶液D中c(Fe3+)=0.01 mol·L-1、c(Zn2+)=1 mol·L-1,常温时,有关离子沉淀的pH如下表所示(当离子浓度为1.0×10—5 mol/L时认为沉淀完全):
Fe3+ Zn2+
开始沉淀的pH 2.3 6.2
沉淀完全的pH a 8.7
①上表中的a= (假设第Ⅵ步中溶液体积变化忽略不计)。
②查阅资料发现,沉淀Zn2+的pH不能大于11,其原因是 。
(4)第Ⅶ步的“系列操作”指的是过滤、洗涤和煅烧,检验Zn(OH)2沉淀洗涤干净的方法是 (写出实验操作、现象和结论)。
(5)为确定加入锌灰(主要成分为Zn、ZnO,杂质为铁及其氧化物)的量,实验中需测定除去H2O2后溶液中Cu2+的含量。实验操作为:准确量取一定体积的含有Cu2+的溶液于带塞锥形瓶中,加适量水稀释,调节溶液pH=3~4,加入过量的KI和几滴指示剂,用Na2S2O3标准溶液滴定至终点。上述过程中反应的离子方程式为:2Cu2++4I-=2CuI(白色)↓+I2 2S2O+I2=I-+S4O。
①滴定选用的指示剂为 ,滴定终点观察到的现象为 。
②若滴定前溶液中的H2O2没有除尽,所测定的Cu2+含量将会 (填“偏高”、“偏低”或“不变”)。
【参考答案】
一、选择题
1.C
解析:A.等pH时HX放出的氢气多且反应速率快,说明HX的浓度比HY的大,可知HX的酸性更弱,则证明HX酸性比HY弱,故A错误;
B.NaClO溶液可使pH试纸褪色,不能测定盐溶液的pH来比较酸性,故B错误;
C.钡离子与碳酸根离子反应生成沉淀,使碳酸根离子水解平衡逆向移动,溶液红色变浅,故C正确;
D.向10mL0.2mo/LNaOH溶液中滴2滴0.1mol/LMgCl2溶液,NaOH溶液过量,产生Mg(OH)2白色沉淀后再滴加2滴0.1mol/LFeCl3,Fe3+和OH-直接结合生成红褐色的Fe(OH)3沉淀,不能证明Fe(OH)3是Mg(OH)2转化而来的,不能证明相同温度下Ksp:Mg(OH)2>Fe(OH)3,故D错误;
故选C。
2.C
解析:A.溶液加热过程中,水解生成和HCl,加热HCl挥发促进水解,被空气中氧气氧化为,蒸干灼烧至恒重,最终剩余固体是,A错误;
B.铁闸与锌片连接防止铁腐蚀,其原理是牺牲阳极的阴极保护法,B错误;
C.锅炉中沉积的可用饱和碳酸钠溶液浸泡,转化为难溶的,易溶于盐酸而除去,C正确;
D.合成氨反应中,将液化并及时分离,降低产物浓度,正、逆反应速率均降低,D错误;
故选C。
3.D
解析:A.向盛有Fe(NO3)2溶液的试管中滴加几滴稀硫酸,振荡,由于发生:3Fe2+++4H+=3Fe3++NO+2H2O,可观察到溶液颜色由浅绿色变为橙黄色,体现的氧化性而不是具有氧化性,A不合题意;
B.已知SO2和CO2通入到澄清石灰水中均能生成白色沉淀,故向溶液X中加入稀硫酸,并将产生的无色气体通入澄清石灰水中,即使生成白色沉淀,也不能确定溶液X中含有或,还可能是或者,B不合题意;
C.由于NaClO具有强氧化性,能够漂白pH试纸,则不能用pH试纸测量NaClO溶液的pH值,C不合题意;
D.常温下,向10mL0.1mol/LNaCl溶液中滴加5滴0.1mol/LAgNO3溶液,充分反应后可以观察到白色沉淀产生,且AgNO3不足,再滴加5滴0.1mol/LKI溶液,产生黄色沉淀,说明存在AgCl(s)+I-(aq)AgI(s)+Cl-(aq),故能得出,D符合题意;
故答案为:D。
4.B
解析:在1L 0.01mol·L-1 MgCl2溶液中,加入1mL 0.01mol·L-1的Na2CO3溶液,混合溶液体积可近似为1L,所得溶液中c(Mg2+)=0.01 mol·L-1,c(CO)==1×10-5 mol·L-1,c(Mg2+) c(CO)=0.01 mol·L-1×1×10-5 mol·L-1=1×10-7 mol2·L-2<Ksp[Mg(OH)2],所以无沉淀析出,故选B。
5.B
解析:A.氢气燃烧发光发热,将化学能转化为热能和光能,A正确;
B.氯气和水反应生成HCl和有强氧化性的HClO,HClO能杀菌消毒,但不能净水,明矾中铝离子水解生成氢氧化铝胶体,能吸附水中的悬浮物,净化水质,但不能杀菌消毒,B错误;
C.用饱和碳酸钠溶液浸泡硫酸钙,硫酸钙转化为更难溶的碳酸钙,碳酸钙易溶于酸而除去,C正确;
D.SbCl3,水解生成Sb2O3,,制备时加大量水,同时加热,使水解趋于完全,D正确;
故答案选B。
6.B
解析:A.将少量醋酸滴入溶液中,反应生成醋酸钠和碳酸氢钠,不能得出酸性:,故A错误;
B.向盛有相同体积、浓度的溶液的两支试管中分别滴加和HI溶液,观察出现棕黄色现象的时间,后者出现棕黄色时间短,说明后者反应速率快,因此得出结论:其他条件不变时,一般浓度越大,该反应化学反应速率越快,故B正确;
C.将装有相同质量和的混合气的两支烧瓶分别置于热水、冰水中,浸泡在热水中的烧瓶红棕色更深,说明升高温度,平衡向生成二氧化氮方向移动,则 ,故C错误;
D.向盛有溶液滴加2滴等浓度溶液,氯离子过量,悬浊液静置,取上层清液,滴入少量稀NaI溶液,得到黄色沉淀,说明,故D错误。
综上所述,答案为。
7.C
解析:A.溶度积是沉淀溶解平衡时难溶电解质在溶液中各离子浓度幂的乘积,A项错误;
B.溶度积与温度有关,B项错误;
C.可用离子积Qc与溶度积Ksp的比较来判断沉淀溶解平衡进行的方向,若Qc>Ksp,则平衡向生成沉淀的方向移动;若Qc<Ksp,则平衡向沉淀溶解的方向移动;若Qc=Ksp,则平衡不移动,C项正确;
D.Ca(OH)2的Ksp随温度升高而减小,D项错误;
故选C。
8.B
解析:A.向FeCl3溶液中加入KSCN,溶液变为红色,反应原理为:FeCl3+3KSCN=Fe(SCN)3+3KCl,该反应未有元素化合价发生改变,属于非氧化还原反应,A不合题意;
B.将乙醇加入酸性重铬酸钾溶液中,溶液从橙色变成墨绿色,反应原理是:3CH3CH2OH+2K2Cr2O7+8H2SO4=2Cr2(SO4)3+3CH3COOH+11H2O+2K2SO4,该反应有元素化合价发生改变,属于氧化还原反应,B符合题意;
C.向氯化银悬浊液中滴加碘化钠,出现黄色浑浊,反应原理为:AgCl(s)+I-(aq) AgI(s)+Cl-(aq),该反应未有元素化合价发生改变,属于非氧化还原反应,C不合题意;
D.黑色溶解在稀硫酸中可以得到蓝色的溶液,反应原理为:CuO+H2SO4=CuSO4+H2O,该反应未有元素化合价发生改变,属于非氧化还原反应,D不合题意;
故答案为:B。
9.B
【分析】要使鸡蛋壳变厚,使平衡向生成碳酸钙方向进行,利用勒夏特列原理进行分析;
解析:A.淡盐水中各种微粒不参加反应,对平衡无影响,故A不符合题意;
B.加碳酸水,能够增大二氧化碳浓度,平衡向正反应方向移动,使得碳酸根离子浓度增大,生成碳酸钙增多,使蛋壳变厚,故B符合题意;
C.加蔗糖水,蔗糖水不参加反应,对平衡无影响,故C不符合题意;
D.澄清石灰水碱性强,有腐蚀性,故D不符合题意;
答案为B。
10.B
解析:A.用惰性电极电解AgNO3溶液,阳极有氧气生成,阴极生成银:4Ag++2H2O4Ag+4H++O2↑,故A正确;
B.钢铁制品在潮湿空气中的电化学腐蚀:Fe 2e-=Fe2+,故B错误;
C.泡沫灭火器的灭火原理是碳酸氢钠和硫酸铝反应生成硫酸钠、氢氧化铝和二氧化碳:Al3++3HCO=Al(OH)3↓+3CO2↑,故C正确;
D.AgI的溶度积比AgCl的溶度积小,则KI溶液将AgCl转化为AgI:I-(aq)+AgCl(s) AgI(s)+Cl-(aq),故D正确。
综上所述,答案为B。
二、填空题
11.15
【分析】磁性材料的磨削废料(含镍质量分数约21%)主要成分是铁镍合金,还含有铜、钙、镁、硅的氧化物,加入 H2SO4和 HNO3酸溶,合金中的Ni难溶于稀H2SO4,“酸溶"时除了加入稀H2SO4,还要边搅拌边缓慢加入稀 HNO3,溶解Ni反应有N2生成,过滤除去废渣,滤液中加入H2O2氧化Fe2+离子为Fe3+,加入 Na2CO3调节溶液pH除去Fe3+,过滤得到滤渣和滤液,滤液中加入H2S沉淀Cu2+离子,过滤得到滤液中加入NaF用来除去Mg和Ca2+,过滤得到滤液中主要是Ni离子,加入 NaOH 溶液沉淀Ni2+离子生成Ni(OH)2固体。
解析:Ksp[Ni(OH)2]=c(Ni2+)·c2(OH-)=2.0×10-15,则c(OH-)=(×10-5)mol·L-1,c(H+)=(×10-9)mol·L-1,pH=-lg c(H+)≈9.15,故该流程在“沉镍”过程中,需调节溶液pH约为9.15时,Ni2+才刚好沉淀完全。
12.(1) 碱 CN-+H2OHCN+OH-
(2)②>④>③>①
(3)CO2+ClO-=H2O=HClO+HCO
(4)2c(H2SO3)
(5)1×10 19 是
(6)5.0×1014
解析:(1)常温下,NaCN溶液中CN-水解,溶液呈碱性,其原因是CN-+H2OHCN+OH-;故答案为:碱;CN-+H2OHCN+OH-。
(2)常温下,浓度均为0.1 mol L 1的下列4种溶液:①CH3COONa溶液,②NaCN溶液,③NaHCO3溶液,④NaClO溶液;根据对应酸越弱,离子水解程度越大,其碱性越强,根据电离常数得到酸的强弱是CH3COOH>H2CO3>HClO>HCN,则盐溶液碱性强弱顺序 NaCN>NaClO>NaHCO3>CH3COONa,则这4种溶液pH由大到小的顺序是②>④>③>①;故答案为:②>④>③>①。
(3)常温下,向NaClO溶液中通入少量CO2,根据酸的强弱H2CO3>HCN>HCO,则少量二氧化碳通入只能生成碳酸氢钠,发生反应的离子方程式为CO2+ClO-=H2O=HClO+HCO;故答案为:CO2+ClO-=H2O=HClO+HCO。
(4)常温下,Na2SO3的质子守恒是c(OH-)= c(H+)+ c(HSO)+2c(H2SO3),从而得到c(OH-) c(H+)= c(HSO)+2c(H2SO3);故答案为:2c(H2SO3)。
(5)向某含镉废水中加入Na2S,当S2 浓度达到8.0×10 8 mol L 1时,则废水中Cd2+的浓度为Ksp(CdS)=8.0×10 27= c(S2 ) c(Cd2+)=8.0×10 8×c(Cd2+),解得c(Cd2+)=1.0×10 19mol L 1,镉的排放量为,小于规定生活用水中镉的排放量不超过0.005mg L 1,是否符合生活饮用水卫生标准;故答案为:1×10 19;是。
(6)室温下,反应CdCO3(s)+S2 (aq)CdS(s)+CO(aq)达到平衡,该反应的平衡常数;故答案为:。
13.(1)3
(2)
(3)
(4)中
解析:(1)由可得:,因此;
(2)Kw = Kb×Kh =2×10-5×1.5×10-8 = 3×10-13>10-14,因此T应高于25℃;
(3)该反应的平衡常数K==3.3×1025;
(4)根据电荷守恒有,由于,则,因此溶液呈中性;溶液中c(OH-)=10-7mol/L,=0.005mol/L,因此混合后溶液中c(NH3·H2O) = (0.5a-0.005)mol/L,因此NH3·H2O的电离平衡常数Kb= = 。
14.37
解析:由方程式可知,反应Al(OH)3+OH—Al(OH)的平衡常数K==100.63,则Al(OH)溶液中的铝元素完全沉淀时,溶液的氢氧根离子浓度为=10-5.63 mol/L,则溶液的pH为8.37,故答案为:8.37。
15. 1s22s22p3 NnHn+2 MgCO3(s) Mg2+(aq)+ (aq) 2.61×10-3 NaClO3+6HCl(浓)=3Cl2↑+NaCl+3H2O
【分析】(1)X的原子只有一个质子,X为H元素,短周期元素X、Y、Z可组成化学式为XYZ3的化合物,在化合物中H显+1价, YZ3为-1价原子团,Y、Z均是第二周期元素,则Y是N元素,Z是O元素;
(2)Y、Z同周期,结合X、Y、Z的原子序数为26推测Y、Z应为第二周期,则X为第三周期元素,又知丙微溶于水,符合要求的是MgCO3,则乙是碳酸镁,X是镁,Y是C 元素,Z是O元素;
(3)若丙中X元素的焰色反应为黄色,则X是钠元素,Y与X同周期,Y是同周期中原子半径最小的元素,则Y是Cl元素,短周期元素X、Y、Z可组成化学式为XYZ3的盐,所以丙是氯酸钠;
(4)若丁中X、Y、Z处于不同周期,X原子最外层电子数为其次外层电子数的二倍,则X原子有2个电子层,最外层电子数为4,则X为碳元素,Z原子最外层电子数是其电子层数的二倍多1,Z处于第三周期,Z原子最外层电子数为7,则Z为Cl元素,故X为氢元素。
解析:(1)X的原子只有一个质子,X为H元素,短周期元素 X、Y、Z 可组成化学式为XYZ3的化合物,在化合物中H显+1价, YZ3为-1价原子团,Y、Z均是第二周期元素,则Y是N元素,Z是O元素,Y原子核外有7个电子,其核外电子排布式为1s22s22p3,H、N原子间可形成与烷烃结构类似的化合物,氮原子成3个共价键,设N原子数目为n,每形成1个N-N键减少2个H原子,则H原子数目为3n-2(n-1)=n+2,故则该系列化合物的通式为NnHn+2;
因此,本题正确答案是: 1s22s22p3, NnHn+2;
(2)Y、Z同周期,结合X、Y、Z的原子序数为26推测Y、Z应为第二周期,则X为第三周期元素,又知丙微溶于水,符合要求的是MgCO3,X是镁,Y是C 元素,Z是O元素,则乙是碳酸镁,碳酸镁的溶解平衡可表示为MgCO3(s) Mg2+(aq)+ (aq),其饱和溶液中Mg2+离子与离子浓度相等,故饱和溶液中Mg2+离子的物质的量浓度约为=2.61×10-3mol/L;
因此,本题正确答案是: MgCO3(s) Mg2+(aq)+ (aq),2.61×10-3;
(3)若丙中X元素的焰色反应为黄色,则X是钠元素,Y与X同周期,Y是同周期中原子半径最小的元素,则Y是Cl元素,短周期元素 X、Y、Z可组成化学式为XYZ3的盐,则Z是O元素,所以丙是氯酸钠,氯酸钠和浓盐酸反应生成氯化钠、氯气和水,反应方程式为: NaClO3+6HCl(浓)=3Cl2↑+NaCl+3H2O;
因此,本题正确答案是: NaClO3+6HCl(浓)=3Cl2↑+NaCl+3H2O;
(4)若丁中X、Y、Z处于不同周期,X原子最外层电子数为其次外层电子数的二倍,则X原子有2个电子层,最外层电子数为4,则X为碳元素,Z原子最外层电子数是其电子层数的二倍多1,Z处于第三周期,Z原子最外层电子数为7,则Z为Cl元素,故X为氢元素,丁是三氯甲烷,三氯甲烷是四面体结构,其结构式为,
因此,本题正确答案是:。
16.(1)胶头滴管、500mL容量瓶
(2)Cu+H2O2+2H+=Cu2++2H2O
(3)3.3 Zn(OH)2为两性化合物,pH过大,Zn(OH)2会反应溶解(合理即可)
(4)取少量最后一次洗涤液于试管中,先加盐酸,再加氯化钡,若无明显现象,则说明沉淀已经洗涤干净(合理即可)
(5)淀粉溶液 溶液蓝色褪去,且半分钟内不变化 偏高
解析:本题考查从废电池铜帽制备氧化锌的过程,首先用超声水洗原材料,再在稀硫酸存在的情况下用氧化氢来氧化铜,调节pH,之后用锌置换出铜离子,得到溶液C主要成分为硫酸锌,也含有硫酸亚铁,再用过氧化氢将二价铁氧化为三价铁,调节pH出去三价铁,再经过一系列操作得到产品,以此解题。
(1)配置480ml1mol/L稀硫酸需要500ml的容量瓶还需要烧杯、玻璃棒、量筒、胶头滴管,故答案为:胶头滴管、500mL容量瓶;
(2)在酸性条件下铜被过氧化氢氧化为铜离子,离子方程式为:Cu+H2O2+2H+=Cu2++2H2O;
(3)①溶液中c(Fe3+)=0.01 mol·L-1,pH = 2.3时铁离子开始沉淀,即,所以,当时,铁离子沉淀完全,代入.上述公式可以求得此时溶液中,即pH为3.3时,Fe3+完全沉淀,即a=3.3;
②查阅资料发现,沉淀Zn2+的pH不能大于11,其原因Zn(OH)2是两性氢氧化物,碱性很强时,容易发生反应溶解,故答案为:Zn(OH)2为两性化合物,pH过大,Zn(OH)2会反应溶解(合理即可);
(4)生成的氢氧化锌沉淀可能附着有硫酸盐,所以检验是否含有硫酸根离子即可确定沉淀是否洗涤干净,具体操作为:取少量最后一次洗涤液于试管中,先加盐酸,再加氯化钡,若无明显现象,则说明沉淀已经洗涤干净(合理即可);
(5)①碘遇淀粉变蓝色,用淀粉溶液作指示剂;滴定终点观察到的现象为:最后一滴滴标准溶液滴入后溶液蓝色褪去,且半分钟内不变化;
②)若滴定前溶液中的H2O2没有除尽,会发生反应,与Na2S2O3反应的碘增多,所测定的Cu2+含量将会偏高。
一、选择题
1.下列实验能达到预期目的是
编号 实验内容 实验目的
A 等体积pH=2的HX和HY两种酸分别与足量的铁反应,排水法收集气体,HX放出的氢气多且反应速率快 证明HX酸性比HY强
B 室温下,用pH试纸测定浓度为0.1mo/LNaClO和0.1mol/LCH3COONa溶液的pH 比较HClO和CHCOOH酸性强弱
C 向含有酚酞的Na2CO3溶液中加入少量BaCl2固体,溶液红色变浅 证明Na2CO3溶液中存在水解平衡
D 向10mL0.2mo/LNaOH溶液中滴2滴0.1mol/LMgCl2溶液,产生白色沉淀后再滴加2滴0.1mol/LFeCl3又生成红褐色沉淀 证明相同温度下Ksp:Mg(OH)2>Fe(OH)3
A.A B.B C.C D.D
2.下列说法正确的是
A.将溶液蒸干灼烧至恒重,最终剩余固体是FeO
B.将铁闸与锌片连接防止铁腐蚀,是利用外加电流法
C.锅炉中沉积的可用饱和碳酸钠溶液浸泡,再用盐酸溶解而除去
D.在合成氨工业中,将液化并及时分离可增大正反应速率,提高原料转化率
3.室温下,下列实验探究方案能达到探究目的的是
选项 实验探究方案 探究目的
A 向盛有Fe(NO3)2溶液的试管中滴加几滴稀硫酸,振荡,观察溶液颜色变化 具有氧化性
B 向溶液X中加入稀硫酸,并将产生的无色气体通入澄清石灰水中,观察是否有沉淀生成 溶液X中含有或
C 用pH试纸分别测定浓度均为0.1mol/L的NaCN和NaClO溶液的pH
D 常温下,向10mL0.1mol/LNaCl溶液中滴加5滴0.1mol/LAgNO3溶液,充分反应后,再滴加5滴0.1mol/LKI溶液,观察沉淀颜色变化
A.A B.B C.C D.D
4.在1L0.01mol·L-1MgCl2溶液中,加入1mL0.01mol·L-1的Na2CO3溶液,下列说法正确的是(已知MgCO3的Ksp=6.8×10-6mol2·L-2)
A.有MgCO3沉淀析出 B.无MgCO3沉淀析出
C.无法确定 D.有沉淀但不是MgCO3
5.下列有关化学与生产、生活的说法不正确的是
A.氢气燃烧过程中主要是将化学能转化为热能和光能
B.自来水厂可用氯气或明矾进行自来水的消毒、净化,以改善水质
C.处理锅炉水垢中的硫酸钙,先用饱和碳酸钠溶液浸泡,再用酸除去
D.Sb2O3可用作白色颜料和阻燃剂等,在实验室中用SbCl3的水解反应制取
6.根据下列实验操作和现象所得到的结论正确的是
选项 实验操作 实验现象 实验结论
A 将少量醋酸滴入溶液中 未产生明显气泡 酸性:
B 向盛有相同体积、浓度的溶液的两支试管中分别滴加和HI溶液,观察出现棕黄色现象的时间 后者出现棕黄色时间短 其他条件不变时,一般浓度越大,该反应化学反应速率越快
C 将装有相同质量和的混合气的两支烧瓶分别置于热水、冰水中 浸泡在热水中的烧瓶红棕色更深
D 向盛有溶液滴加2滴等浓度溶液,悬浊液静置,取上层清液,滴入少量稀NaI溶液 出现黄色沉淀
A.A B.B C.C D.D
7.下列说法正确的是
A.溶度积就是溶解平衡时难溶电解质在溶液中的各离子浓度的乘积
B.溶度积常数是不受任何条件影响的常数,简称溶度积
C.可用离子积Qc与溶度积Ksp的比较来判断沉淀溶解平衡进行的方向
D.所有物质的溶度积都是随温度的升高而增大的
8.有人说“五颜六色”形象地说出了化学实验中的颜色变化。下列颜色变化中是由发生氧化还原反应导致的是
A.向溶液中加入,溶液变为红色
B.将乙醇加入酸性重铬酸钾溶液中,溶液从橙色变成墨绿色
C.向氯化银悬浊液中滴加碘化钠,出现黄色浑浊
D.黑色溶解在稀硫酸中可以得到蓝色的溶液
9.夏天,鸡没有汗腺只能依赖“喘息”调节体温,鸡过度的呼出CO2,使下列平衡向左移动,导致蛋壳变薄,使农场主和超市经营者蒙受经济损失(aq表示稀溶液),CO2(g)CO2(aq),CO2(aq)+H2OH2CO3(aq),H2CO3(aq)H+(aq)+HCO(aq),HCO(aq)H+(aq)+CO(aq),Ca2+(aq)+CO(aq)CaCO3(s)(蛋壳),澳大利亚学者研究发现,夏季给鸡喂食下列某种饮料会使蛋壳变厚。这种饮料是
A.淡盐水 B.碳酸水 C.蔗糖水 D.澄清石灰水
10.下列离子方程式与所给事实不相符的是
A.用惰性电极电解AgNO3溶液:4Ag++2H2O4Ag+4H++O2↑
B.钢铁制品在潮湿空气中的电化学腐蚀:Fe 3e-=Fe3+
C.泡沫灭火器的灭火原理:Al3++3HCO=Al(OH)3↓+3CO2↑
D.KI溶液将AgCl转化为AgI:I-(aq)+AgCl(s) AgI(s)+Cl-(aq)
二、填空题
11.一种磁性材料的磨削废料的主要成分是铁镍合金(含镍质量分数约21%),还含有铜、钙、镁、硅的氧化物。由该废料制备氢氧化镍,工艺流程如下:
已知常温下Ksp[Ni(OH)2]=2.0×10-15,该流程在“沉镍”过程中,需调节溶液pH约为 时,Ni2+才刚好沉淀完全。(离子沉淀完全的浓度≤1.0×10-5mol/L;lg2=0.30)
12.I.根据表中数据(常温下),完成下列填空。
物质 CH3COOH NH3 H2O HCN HClO H2CO3 H2SO3
电离常数(Ka) 1.7×10 5 1.7×10 5 4.9×10 10 3×10 8 Ka1=4.3×10 7 Ka2=5.6×10 11 Ka1=1.5×10 2 Ka2=1.0×10 7
(1)常温下,NaCN溶液呈 (填“酸”、“碱”或“中”)性,其原因是 (用离子方程式表示)。
(2)常温下,浓度均为0.1 mol L 1的下列4种溶液:①CH3COONa溶液,②NaCN溶液,③NaHCO3溶液,④NaClO溶液;这4种溶液pH由大到小的顺序是 (填序号)。
(3)常温下,向NaClO溶液中通入少量CO2,发生反应的离子方程式为 。
(4)常温下,Na2SO3溶液中c(OH-) c(H+)=c(HSO)+ 。
II.我国《生活饮用水卫生标准》中规定生活用水中镉的排放量不超过0.005mg L 1。处理含镉废水可采用化学沉淀法。Ksp(CdCO3)=4.0×10 12,Ksp(CdS)=8.0×10 27;回答下列问题:
(5)向某含镉废水中加入Na2S,当S2 浓度达到8.0×10 8 mol L 1时,废水中Cd2+的浓度为 mol L 1,此时是否符合生活饮用水卫生标准 (填“是”或“否”)。
(6)室温下,反应CdCO3(s)+S2 (aq)CdS(s)+CO(aq)达到平衡,该反应的平衡常数K= (结果保留两位有效数字)
13.平衡常数是分析平衡问题的重要依据。回答下列问题:
(1)已知:时,的,则时,的溶液的 。
(2)在温度为时,某研究人员测定的电离常数为,的水解常数为,则该温度下水的离子积常数为 ,请判断 (填“>”“<”或“=”)。
(3)化工生产中常用作沉淀剂除去工业废水中的:。该反应的平衡常数为 (和的分别为、)。
(4)时,将的氨水与的盐酸等体积混合,所得溶液中,则溶液显 (填“酸”“碱”或“中”)性;用含a的代数式表示的电离常数 。
14.含Al(OH)溶液中的铝元素完全沉淀的pH为 。通常认为溶液中离子浓度小于10-5 mol·L-1为沉淀完全:Al(OH)3+OH—Al(OH)K=100.63;Kw=10-14,Ksp[Al(OH)3]=10-33}
15.短周期元素 X、Y、Z 可组成化学式均为 XYZ3的四种化合物甲、乙、丙、丁。
(l)若甲中 X 的原子只有一个质子,Y 、Z均是第二周期元素,则 Y 元素原子的电子排布式为 ; X、Y 原子间可形成与烷烃结构类似的化合物,则该系列化合物的通式为 。
(2)若乙是一种微溶于水的物质,其 Ksp 约为 6.8×10ˉ6,且 X、Y、Z 三种元素的原子序数之和为 26 , Y、Z 同周期,则乙的溶解平衡可表示为 ,其饱和溶液中X的离子的物质的量浓度约为 mol/ L。
(3)若丙中X元素的焰色反应为黄色,Y与X同周期,Y 是同周期中原子半径最小的元素,丙与浓盐酸反应生成 Y 单质的化学方程式为 。
(4)若丁中 X、Y、Z 处于不同周期,且 X 原子最外层电子数为其次外层电子数的二倍,Z原子最外层电子数是其电子层数的二倍多1,则丁的结构式为 。
16.废弃物的综合利用既有利于节约资源,又有利于保护环境。实验室利用清洗过的废电池铜帽(Cu、Zn总含量约为99%)和锌灰回收Cu,并制备ZnO的部分实验过程如下:
已知:①锌灰的主要成分为Zn、ZnO,杂质为铁及其氧化物;
②ZnO、Zn(OH)2均为两性化合物。
(1)实验室配制480mL 1mol/L稀硫酸通常使用的玻璃仪器有烧杯、玻璃棒、量筒、 。
(2)写出第Ⅱ步中Cu参加反应的离子方程式: 。
(3)假设溶液D中c(Fe3+)=0.01 mol·L-1、c(Zn2+)=1 mol·L-1,常温时,有关离子沉淀的pH如下表所示(当离子浓度为1.0×10—5 mol/L时认为沉淀完全):
Fe3+ Zn2+
开始沉淀的pH 2.3 6.2
沉淀完全的pH a 8.7
①上表中的a= (假设第Ⅵ步中溶液体积变化忽略不计)。
②查阅资料发现,沉淀Zn2+的pH不能大于11,其原因是 。
(4)第Ⅶ步的“系列操作”指的是过滤、洗涤和煅烧,检验Zn(OH)2沉淀洗涤干净的方法是 (写出实验操作、现象和结论)。
(5)为确定加入锌灰(主要成分为Zn、ZnO,杂质为铁及其氧化物)的量,实验中需测定除去H2O2后溶液中Cu2+的含量。实验操作为:准确量取一定体积的含有Cu2+的溶液于带塞锥形瓶中,加适量水稀释,调节溶液pH=3~4,加入过量的KI和几滴指示剂,用Na2S2O3标准溶液滴定至终点。上述过程中反应的离子方程式为:2Cu2++4I-=2CuI(白色)↓+I2 2S2O+I2=I-+S4O。
①滴定选用的指示剂为 ,滴定终点观察到的现象为 。
②若滴定前溶液中的H2O2没有除尽,所测定的Cu2+含量将会 (填“偏高”、“偏低”或“不变”)。
【参考答案】
一、选择题
1.C
解析:A.等pH时HX放出的氢气多且反应速率快,说明HX的浓度比HY的大,可知HX的酸性更弱,则证明HX酸性比HY弱,故A错误;
B.NaClO溶液可使pH试纸褪色,不能测定盐溶液的pH来比较酸性,故B错误;
C.钡离子与碳酸根离子反应生成沉淀,使碳酸根离子水解平衡逆向移动,溶液红色变浅,故C正确;
D.向10mL0.2mo/LNaOH溶液中滴2滴0.1mol/LMgCl2溶液,NaOH溶液过量,产生Mg(OH)2白色沉淀后再滴加2滴0.1mol/LFeCl3,Fe3+和OH-直接结合生成红褐色的Fe(OH)3沉淀,不能证明Fe(OH)3是Mg(OH)2转化而来的,不能证明相同温度下Ksp:Mg(OH)2>Fe(OH)3,故D错误;
故选C。
2.C
解析:A.溶液加热过程中,水解生成和HCl,加热HCl挥发促进水解,被空气中氧气氧化为,蒸干灼烧至恒重,最终剩余固体是,A错误;
B.铁闸与锌片连接防止铁腐蚀,其原理是牺牲阳极的阴极保护法,B错误;
C.锅炉中沉积的可用饱和碳酸钠溶液浸泡,转化为难溶的,易溶于盐酸而除去,C正确;
D.合成氨反应中,将液化并及时分离,降低产物浓度,正、逆反应速率均降低,D错误;
故选C。
3.D
解析:A.向盛有Fe(NO3)2溶液的试管中滴加几滴稀硫酸,振荡,由于发生:3Fe2+++4H+=3Fe3++NO+2H2O,可观察到溶液颜色由浅绿色变为橙黄色,体现的氧化性而不是具有氧化性,A不合题意;
B.已知SO2和CO2通入到澄清石灰水中均能生成白色沉淀,故向溶液X中加入稀硫酸,并将产生的无色气体通入澄清石灰水中,即使生成白色沉淀,也不能确定溶液X中含有或,还可能是或者,B不合题意;
C.由于NaClO具有强氧化性,能够漂白pH试纸,则不能用pH试纸测量NaClO溶液的pH值,C不合题意;
D.常温下,向10mL0.1mol/LNaCl溶液中滴加5滴0.1mol/LAgNO3溶液,充分反应后可以观察到白色沉淀产生,且AgNO3不足,再滴加5滴0.1mol/LKI溶液,产生黄色沉淀,说明存在AgCl(s)+I-(aq)AgI(s)+Cl-(aq),故能得出,D符合题意;
故答案为:D。
4.B
解析:在1L 0.01mol·L-1 MgCl2溶液中,加入1mL 0.01mol·L-1的Na2CO3溶液,混合溶液体积可近似为1L,所得溶液中c(Mg2+)=0.01 mol·L-1,c(CO)==1×10-5 mol·L-1,c(Mg2+) c(CO)=0.01 mol·L-1×1×10-5 mol·L-1=1×10-7 mol2·L-2<Ksp[Mg(OH)2],所以无沉淀析出,故选B。
5.B
解析:A.氢气燃烧发光发热,将化学能转化为热能和光能,A正确;
B.氯气和水反应生成HCl和有强氧化性的HClO,HClO能杀菌消毒,但不能净水,明矾中铝离子水解生成氢氧化铝胶体,能吸附水中的悬浮物,净化水质,但不能杀菌消毒,B错误;
C.用饱和碳酸钠溶液浸泡硫酸钙,硫酸钙转化为更难溶的碳酸钙,碳酸钙易溶于酸而除去,C正确;
D.SbCl3,水解生成Sb2O3,,制备时加大量水,同时加热,使水解趋于完全,D正确;
故答案选B。
6.B
解析:A.将少量醋酸滴入溶液中,反应生成醋酸钠和碳酸氢钠,不能得出酸性:,故A错误;
B.向盛有相同体积、浓度的溶液的两支试管中分别滴加和HI溶液,观察出现棕黄色现象的时间,后者出现棕黄色时间短,说明后者反应速率快,因此得出结论:其他条件不变时,一般浓度越大,该反应化学反应速率越快,故B正确;
C.将装有相同质量和的混合气的两支烧瓶分别置于热水、冰水中,浸泡在热水中的烧瓶红棕色更深,说明升高温度,平衡向生成二氧化氮方向移动,则 ,故C错误;
D.向盛有溶液滴加2滴等浓度溶液,氯离子过量,悬浊液静置,取上层清液,滴入少量稀NaI溶液,得到黄色沉淀,说明,故D错误。
综上所述,答案为。
7.C
解析:A.溶度积是沉淀溶解平衡时难溶电解质在溶液中各离子浓度幂的乘积,A项错误;
B.溶度积与温度有关,B项错误;
C.可用离子积Qc与溶度积Ksp的比较来判断沉淀溶解平衡进行的方向,若Qc>Ksp,则平衡向生成沉淀的方向移动;若Qc<Ksp,则平衡向沉淀溶解的方向移动;若Qc=Ksp,则平衡不移动,C项正确;
D.Ca(OH)2的Ksp随温度升高而减小,D项错误;
故选C。
8.B
解析:A.向FeCl3溶液中加入KSCN,溶液变为红色,反应原理为:FeCl3+3KSCN=Fe(SCN)3+3KCl,该反应未有元素化合价发生改变,属于非氧化还原反应,A不合题意;
B.将乙醇加入酸性重铬酸钾溶液中,溶液从橙色变成墨绿色,反应原理是:3CH3CH2OH+2K2Cr2O7+8H2SO4=2Cr2(SO4)3+3CH3COOH+11H2O+2K2SO4,该反应有元素化合价发生改变,属于氧化还原反应,B符合题意;
C.向氯化银悬浊液中滴加碘化钠,出现黄色浑浊,反应原理为:AgCl(s)+I-(aq) AgI(s)+Cl-(aq),该反应未有元素化合价发生改变,属于非氧化还原反应,C不合题意;
D.黑色溶解在稀硫酸中可以得到蓝色的溶液,反应原理为:CuO+H2SO4=CuSO4+H2O,该反应未有元素化合价发生改变,属于非氧化还原反应,D不合题意;
故答案为:B。
9.B
【分析】要使鸡蛋壳变厚,使平衡向生成碳酸钙方向进行,利用勒夏特列原理进行分析;
解析:A.淡盐水中各种微粒不参加反应,对平衡无影响,故A不符合题意;
B.加碳酸水,能够增大二氧化碳浓度,平衡向正反应方向移动,使得碳酸根离子浓度增大,生成碳酸钙增多,使蛋壳变厚,故B符合题意;
C.加蔗糖水,蔗糖水不参加反应,对平衡无影响,故C不符合题意;
D.澄清石灰水碱性强,有腐蚀性,故D不符合题意;
答案为B。
10.B
解析:A.用惰性电极电解AgNO3溶液,阳极有氧气生成,阴极生成银:4Ag++2H2O4Ag+4H++O2↑,故A正确;
B.钢铁制品在潮湿空气中的电化学腐蚀:Fe 2e-=Fe2+,故B错误;
C.泡沫灭火器的灭火原理是碳酸氢钠和硫酸铝反应生成硫酸钠、氢氧化铝和二氧化碳:Al3++3HCO=Al(OH)3↓+3CO2↑,故C正确;
D.AgI的溶度积比AgCl的溶度积小,则KI溶液将AgCl转化为AgI:I-(aq)+AgCl(s) AgI(s)+Cl-(aq),故D正确。
综上所述,答案为B。
二、填空题
11.15
【分析】磁性材料的磨削废料(含镍质量分数约21%)主要成分是铁镍合金,还含有铜、钙、镁、硅的氧化物,加入 H2SO4和 HNO3酸溶,合金中的Ni难溶于稀H2SO4,“酸溶"时除了加入稀H2SO4,还要边搅拌边缓慢加入稀 HNO3,溶解Ni反应有N2生成,过滤除去废渣,滤液中加入H2O2氧化Fe2+离子为Fe3+,加入 Na2CO3调节溶液pH除去Fe3+,过滤得到滤渣和滤液,滤液中加入H2S沉淀Cu2+离子,过滤得到滤液中加入NaF用来除去Mg和Ca2+,过滤得到滤液中主要是Ni离子,加入 NaOH 溶液沉淀Ni2+离子生成Ni(OH)2固体。
解析:Ksp[Ni(OH)2]=c(Ni2+)·c2(OH-)=2.0×10-15,则c(OH-)=(×10-5)mol·L-1,c(H+)=(×10-9)mol·L-1,pH=-lg c(H+)≈9.15,故该流程在“沉镍”过程中,需调节溶液pH约为9.15时,Ni2+才刚好沉淀完全。
12.(1) 碱 CN-+H2OHCN+OH-
(2)②>④>③>①
(3)CO2+ClO-=H2O=HClO+HCO
(4)2c(H2SO3)
(5)1×10 19 是
(6)5.0×1014
解析:(1)常温下,NaCN溶液中CN-水解,溶液呈碱性,其原因是CN-+H2OHCN+OH-;故答案为:碱;CN-+H2OHCN+OH-。
(2)常温下,浓度均为0.1 mol L 1的下列4种溶液:①CH3COONa溶液,②NaCN溶液,③NaHCO3溶液,④NaClO溶液;根据对应酸越弱,离子水解程度越大,其碱性越强,根据电离常数得到酸的强弱是CH3COOH>H2CO3>HClO>HCN,则盐溶液碱性强弱顺序 NaCN>NaClO>NaHCO3>CH3COONa,则这4种溶液pH由大到小的顺序是②>④>③>①;故答案为:②>④>③>①。
(3)常温下,向NaClO溶液中通入少量CO2,根据酸的强弱H2CO3>HCN>HCO,则少量二氧化碳通入只能生成碳酸氢钠,发生反应的离子方程式为CO2+ClO-=H2O=HClO+HCO;故答案为:CO2+ClO-=H2O=HClO+HCO。
(4)常温下,Na2SO3的质子守恒是c(OH-)= c(H+)+ c(HSO)+2c(H2SO3),从而得到c(OH-) c(H+)= c(HSO)+2c(H2SO3);故答案为:2c(H2SO3)。
(5)向某含镉废水中加入Na2S,当S2 浓度达到8.0×10 8 mol L 1时,则废水中Cd2+的浓度为Ksp(CdS)=8.0×10 27= c(S2 ) c(Cd2+)=8.0×10 8×c(Cd2+),解得c(Cd2+)=1.0×10 19mol L 1,镉的排放量为,小于规定生活用水中镉的排放量不超过0.005mg L 1,是否符合生活饮用水卫生标准;故答案为:1×10 19;是。
(6)室温下,反应CdCO3(s)+S2 (aq)CdS(s)+CO(aq)达到平衡,该反应的平衡常数;故答案为:。
13.(1)3
(2)
(3)
(4)中
解析:(1)由可得:,因此;
(2)Kw = Kb×Kh =2×10-5×1.5×10-8 = 3×10-13>10-14,因此T应高于25℃;
(3)该反应的平衡常数K==3.3×1025;
(4)根据电荷守恒有,由于,则,因此溶液呈中性;溶液中c(OH-)=10-7mol/L,=0.005mol/L,因此混合后溶液中c(NH3·H2O) = (0.5a-0.005)mol/L,因此NH3·H2O的电离平衡常数Kb= = 。
14.37
解析:由方程式可知,反应Al(OH)3+OH—Al(OH)的平衡常数K==100.63,则Al(OH)溶液中的铝元素完全沉淀时,溶液的氢氧根离子浓度为=10-5.63 mol/L,则溶液的pH为8.37,故答案为:8.37。
15. 1s22s22p3 NnHn+2 MgCO3(s) Mg2+(aq)+ (aq) 2.61×10-3 NaClO3+6HCl(浓)=3Cl2↑+NaCl+3H2O
【分析】(1)X的原子只有一个质子,X为H元素,短周期元素X、Y、Z可组成化学式为XYZ3的化合物,在化合物中H显+1价, YZ3为-1价原子团,Y、Z均是第二周期元素,则Y是N元素,Z是O元素;
(2)Y、Z同周期,结合X、Y、Z的原子序数为26推测Y、Z应为第二周期,则X为第三周期元素,又知丙微溶于水,符合要求的是MgCO3,则乙是碳酸镁,X是镁,Y是C 元素,Z是O元素;
(3)若丙中X元素的焰色反应为黄色,则X是钠元素,Y与X同周期,Y是同周期中原子半径最小的元素,则Y是Cl元素,短周期元素X、Y、Z可组成化学式为XYZ3的盐,所以丙是氯酸钠;
(4)若丁中X、Y、Z处于不同周期,X原子最外层电子数为其次外层电子数的二倍,则X原子有2个电子层,最外层电子数为4,则X为碳元素,Z原子最外层电子数是其电子层数的二倍多1,Z处于第三周期,Z原子最外层电子数为7,则Z为Cl元素,故X为氢元素。
解析:(1)X的原子只有一个质子,X为H元素,短周期元素 X、Y、Z 可组成化学式为XYZ3的化合物,在化合物中H显+1价, YZ3为-1价原子团,Y、Z均是第二周期元素,则Y是N元素,Z是O元素,Y原子核外有7个电子,其核外电子排布式为1s22s22p3,H、N原子间可形成与烷烃结构类似的化合物,氮原子成3个共价键,设N原子数目为n,每形成1个N-N键减少2个H原子,则H原子数目为3n-2(n-1)=n+2,故则该系列化合物的通式为NnHn+2;
因此,本题正确答案是: 1s22s22p3, NnHn+2;
(2)Y、Z同周期,结合X、Y、Z的原子序数为26推测Y、Z应为第二周期,则X为第三周期元素,又知丙微溶于水,符合要求的是MgCO3,X是镁,Y是C 元素,Z是O元素,则乙是碳酸镁,碳酸镁的溶解平衡可表示为MgCO3(s) Mg2+(aq)+ (aq),其饱和溶液中Mg2+离子与离子浓度相等,故饱和溶液中Mg2+离子的物质的量浓度约为=2.61×10-3mol/L;
因此,本题正确答案是: MgCO3(s) Mg2+(aq)+ (aq),2.61×10-3;
(3)若丙中X元素的焰色反应为黄色,则X是钠元素,Y与X同周期,Y是同周期中原子半径最小的元素,则Y是Cl元素,短周期元素 X、Y、Z可组成化学式为XYZ3的盐,则Z是O元素,所以丙是氯酸钠,氯酸钠和浓盐酸反应生成氯化钠、氯气和水,反应方程式为: NaClO3+6HCl(浓)=3Cl2↑+NaCl+3H2O;
因此,本题正确答案是: NaClO3+6HCl(浓)=3Cl2↑+NaCl+3H2O;
(4)若丁中X、Y、Z处于不同周期,X原子最外层电子数为其次外层电子数的二倍,则X原子有2个电子层,最外层电子数为4,则X为碳元素,Z原子最外层电子数是其电子层数的二倍多1,Z处于第三周期,Z原子最外层电子数为7,则Z为Cl元素,故X为氢元素,丁是三氯甲烷,三氯甲烷是四面体结构,其结构式为,
因此,本题正确答案是:。
16.(1)胶头滴管、500mL容量瓶
(2)Cu+H2O2+2H+=Cu2++2H2O
(3)3.3 Zn(OH)2为两性化合物,pH过大,Zn(OH)2会反应溶解(合理即可)
(4)取少量最后一次洗涤液于试管中,先加盐酸,再加氯化钡,若无明显现象,则说明沉淀已经洗涤干净(合理即可)
(5)淀粉溶液 溶液蓝色褪去,且半分钟内不变化 偏高
解析:本题考查从废电池铜帽制备氧化锌的过程,首先用超声水洗原材料,再在稀硫酸存在的情况下用氧化氢来氧化铜,调节pH,之后用锌置换出铜离子,得到溶液C主要成分为硫酸锌,也含有硫酸亚铁,再用过氧化氢将二价铁氧化为三价铁,调节pH出去三价铁,再经过一系列操作得到产品,以此解题。
(1)配置480ml1mol/L稀硫酸需要500ml的容量瓶还需要烧杯、玻璃棒、量筒、胶头滴管,故答案为:胶头滴管、500mL容量瓶;
(2)在酸性条件下铜被过氧化氢氧化为铜离子,离子方程式为:Cu+H2O2+2H+=Cu2++2H2O;
(3)①溶液中c(Fe3+)=0.01 mol·L-1,pH = 2.3时铁离子开始沉淀,即,所以,当时,铁离子沉淀完全,代入.上述公式可以求得此时溶液中,即pH为3.3时,Fe3+完全沉淀,即a=3.3;
②查阅资料发现,沉淀Zn2+的pH不能大于11,其原因Zn(OH)2是两性氢氧化物,碱性很强时,容易发生反应溶解,故答案为:Zn(OH)2为两性化合物,pH过大,Zn(OH)2会反应溶解(合理即可);
(4)生成的氢氧化锌沉淀可能附着有硫酸盐,所以检验是否含有硫酸根离子即可确定沉淀是否洗涤干净,具体操作为:取少量最后一次洗涤液于试管中,先加盐酸,再加氯化钡,若无明显现象,则说明沉淀已经洗涤干净(合理即可);
(5)①碘遇淀粉变蓝色,用淀粉溶液作指示剂;滴定终点观察到的现象为:最后一滴滴标准溶液滴入后溶液蓝色褪去,且半分钟内不变化;
②)若滴定前溶液中的H2O2没有除尽,会发生反应,与Na2S2O3反应的碘增多,所测定的Cu2+含量将会偏高。
同课章节目录
- 第1章 化学反应与能量转化
- 第1节 化学反应的热效应
- 第2节 化学能转化为电能——电池
- 第3节 电能转化为化学能——电解
- 第4节 金属的腐蚀与防护
- 微项目 设计载人航天器用化学电池与氧气再生方案——化学反应中能量及物质的转化利用
- 第2章 化学反应的方向、 限度与速率
- 第1节 化学反应的方向
- 第2节 化学反应的限度
- 第3节 化学反应的速率
- 第4节 化学反应条件的优化——工业合成氨
- 微项目 探讨如何利用工业废气中的二氧化碳合成甲醇——化学反应选择与反应条件优化
- 第3章 物质在水溶液中的行为
- 第1节 水与水溶液
- 第2节 弱电解质的电离 盐类的水解
- 第3节 沉淀溶解平衡
- 第4节 离子反应
- 微项目 揭秘索尔维制碱法和侯氏制碱法——化学平衡思想的创造性应用
